2017-2 —- Full Articles
Treatment modalities for renal angiomyolipomas associated with tuberous sclerosis
DOI: 10.22591/magyurol.2017.2.szendroia.69
Authors:
Szendrői Attila dr. (Semmelweis Egyetem, Urológiai Klinika, Budapest (igazgató: Nyirády Péter dr.))
Summary
Sclerosis Tuberosa (TSC) is an autosomal dominantly inherited, various organs such as kidney in 80%, brain in 75%, skin in 70%, and heart in 50% affecting disease. In the patient’s kidney next to multiple cysts angiomyolipomas (AML) also appear, both tend to ruin the renal function on long-term. In case of sclerosis tuberose the clinical appearance of the angiomyolipomas differ from the sporadic AML: they appear in younger age, show progressive growing, with several centre and both kidneys are involved. Treatment of AML in urology is performed due to the high risk of heavy bleeding or blood shock and means in most of the cases kidney resection or nephrectomy. On the other hand surgery is not ideal on TS based AML, because we have to count on further manifestations of the illness and repeated surgeries cause damage to the renal parenchyma and even without surgery complications this increases the development of renal insufficiency. This enhances the importance of the minimal invasive radiological interventions, such as the selective embolization and radiofrequency ablation the importance of the medical treatment. Per os applying the mTOR inhibitor everolimus on regular basis, the size of the AML’s decrease, preventing the shock of bleeding. On the systematic therapy the other organ’s lesions react also well, there will be less epileptic attacks; cognitive functions will be better, etc. The treatment of TS patients is a multidisciplinary task, where the patient’s quality of life and the expected lifetime can be supported by the efficient cooperation of the different professions.
LAPSZÁM: MAGYAR UROLÓGIA | 2017 | 29. ÉVFOLYAM, 2. SZÁM
Összefoglalás
A Sclerosis Tuberosa (TSC) autoszomális dominánsan öröklődő, sok szervet érintő megbetegedés, amelyben a vese 80%-ban, az agy 75%-ban, a bőr 70%-ban, a szív 50%-ban érintett. A betegek veséiben többszörös ciszták mellett angiomyolipomák (AML) is jelentkeznek, hosszú távon mindkettő hajlamosít a vesefunkció romlására. A sclerosis tuberosás betegek angiomyolipomái klinikai viselkedésükben eltérnek a sporadikus AML-től: fiatalabb korban jelentkeznek, progresszív növekedést mutatnak, többgócúak és mindkét vesét érintik. Az urológiában az AML kezelése elsősorban fenyegető vérzésveszély vagy ruptúra következtében kialakuló heveny vérzéses sokk miatt történik, és az esetek döntő többségében vesereszekciót vagy nephrectomiát végzünk. A sebészi beavatkozások azonban a TSC talaján kialakult AML kezelésére nem ideálisak, ezekben az esetekben számolnunk kell a betegség további manifesztációjával, és az ismételt sebészi feltárások a működő veseállomány károsítása révén még sebészi szövődmények nélkül is gyorsítják a veseelégtelenség kialakulását. Mindez kiemeli a minimálisan invazív intervenciós radiológiai eljárások, a szelektív embolizáció és a radiofrekvenciás abláció mellett a gyógyszeres kezelés jelentőségét. A per os alkalmazható mTOR-gátló everolimus tartós használatával az AML-k mérete csökken, megelőzve ezáltal a ruptúra következtében kialakuló vérzéses sokk kialakulását. A szisztémás terápia alkalmazására a többi szervrendszert érintő elváltozások is jótékonyan reagálnak, ritkulnak az epilepsziás rohamok, javulnak a kognitív funkciók stb. A TS-betegek élethosszig tartó kezelése multidiszciplináris feladat, amelyben a betegek életminőségét és várható élethosszát az egyes társszakmák hatékony együttműködése segítheti elő.
Az angiomyolipoma (AML) a vesében kialakuló, jóindulatú daganat, hamartoma, amely szövettanilag túlburjánzott atípusos erekből, simaizomból és zsírszövetből épül fel. Tünetet általában nem okoz, nagyra megnőve hasi fájdalom, vérvizelés hívhatja fel rá a figyelmet, hirtelen megrepedéskor pedig vérzéses sokk klinikai képét mutatja (1). Ultrahang-(UH) vizsgálat során jellemzően hiperdenz, hangárnyékot nem adó, jól körülírt, kerek képlet ábrázolódik a vese kéregállományában, és ez az esetek többségében elegendő a diagnózishoz (2). Az AML klinikai jelentőségét az adja, hogy bizonyos esetekben (pl. zsírszegény AML) képalkotó módszerekkel (UH, MR), nehéz lehet elkülöníteni egyéb, a vesén belül elhelyezkedő rosszindulatú daganatoktól (liposarcoma, vesesejtes rák stb.), illetve az, hogy spontán megrepedhet, ezzel életet veszélyeztető retroperitonealis vérzést okozva. Ruptúrára hajlamosít, ha a daganat eléri a 4 cm-es átmérőt, illetve ha a patológiás erek (ér aneurizmák) átmérője meghaladja az 5 mm-t. Az AML felismerését követően az esetek többségében további kezelést nem igényel, elegendő a beteg rendszeres követése UH-val. Az AML beavatkozást igényel, amennyiben a képalkotó vizsgálatok alapján (lásd előzőekben leírtak) a vérzés fokozott veszélye áll fenn, ha panaszokat okoz, ha a beteg életmódja, együttműködése stb. miatt az utánkövetés vagy az akut ellátás nem oldható meg, illetve ha a képalkotó vizsgálatok alapján a malignitás gyanúja nem zárható ki teljes biztonsággal (3). A terápia az urológiai gyakorlatban leginkább a sebészi kezelést, nyílt vagy laparoszkópos technikával történő vesereszekciót, esetleg veseeltávolítást jelent.
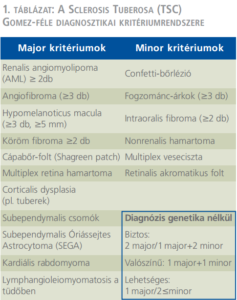
A Sclerosis Tuberosa (TSC) autoszomális dominánsan, inkomplett penetranciával öröklődő rendellenesség, amely sokszervi károsodás képében jelentkezik, incidenciája 1/10 000. A betegek genetikai vizsgálata során két gént, a TSC1-et és a TSC2-t írtak le, az első a hamartin, a második a tuberin nevű fehérje kialakulásáért felel. A két fehérje által alkotott komplex gátolja a sejteken belül az mTOR jelátviteli mechanizmust. A fenti gének károsodása tehát az mTOR kontrollálatlan túlműködésével jár, amely a sejtek kóros irányban történő differenciálódását és túlburjánzását okozza. Az mTOR-rendszer gyógyszeres gátlásán alapul a betegek szisztémás kezelése (4). A kórképet először Bourneville és Pringle írták le mentális retardációval, görcsökkel és a bőrön jelentkező angiofibromákkal jellemezték, azonban a kórképre jellemző hamartomák minden szervben, így a vesében is előfordulhatnak. TS esetén a vese 80%-ban, az agy 75%-ban, a bőr 70%-ban, a szív 50%-ban érintett (5). Kórisméjét a klinikumban leggyakrabban a Gomez-féle kritériumok alapján állapíthatjuk meg (1. táblázat), de bizonyos esetekben a képalkotó (koponya, szív és vese MR vagy UH) és a klinikai vizsgálatok (szemészet, bőrgyógyászat, neurológia) mellett genetikai és szövettani vizsgálat is szükségessé válhat (6).
Extrarenális manifesztációk közül a központi idegrendszer érintettsége epilepsziás görcsök és mentális retardáció képében jelentkezik (7). Szemfenéki vizsgálattal a retina idegrostjai mentén kialakuló burjánzások a látást nem befolyásoló sárga foltok képében mutathatók ki. A bőrön születéskor hipopigmentált foltok jelentkeznek, a későbbiekben alakul ki az adenoma sebaceum és a periungualis fibromatosis. A tüdőben lymphangio-leiomyomatosis alakul ki, amely spontán pneumothoraxhoz és fokozódó dyspnoehoz vezet. A szívben, csecsemőkorban kialakuló rhabdomyomák lehetnek tünetmentesek, de hajlamosíthatnak ritmuszavar, dekompenzáció és hirtelen szívhalál kialakulására, a későbbiekben spontán regressziót mutathatnak.
A renális manifesztációk közé tartoznak az AML-k és a ciszták. A ciszták jellemzően a kéregállományban szaporodnak fel, klinikai megjelenésük gyakran nem különbözik az autoszómális domináns öröklésmenetet mutató policisztás vesebetegségétől, és ahhoz hasonlóan szintén magas vérnyomást és a vesefunkció progresszív romlását okozhatják.
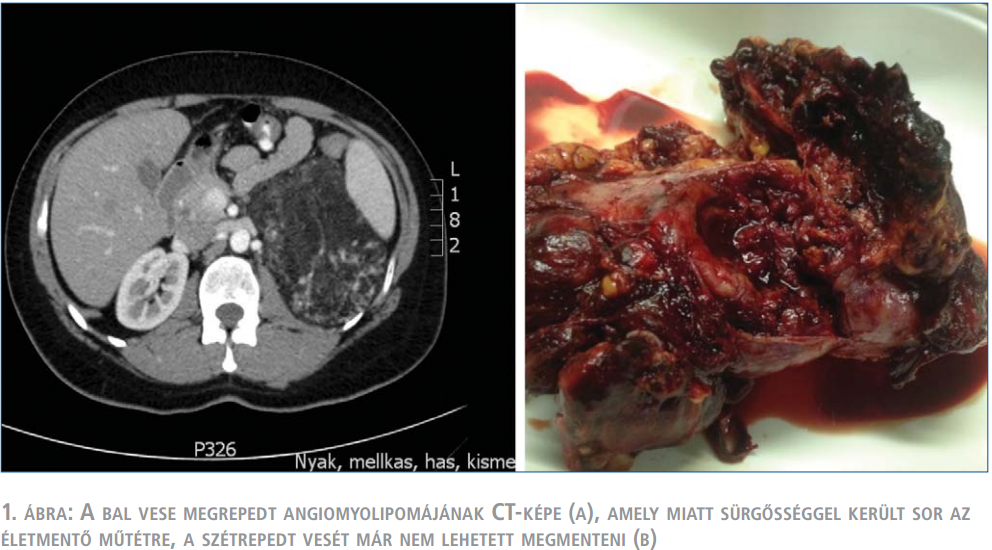
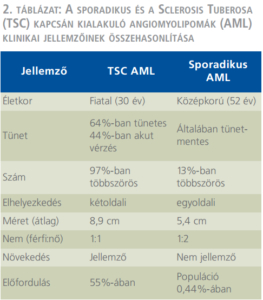
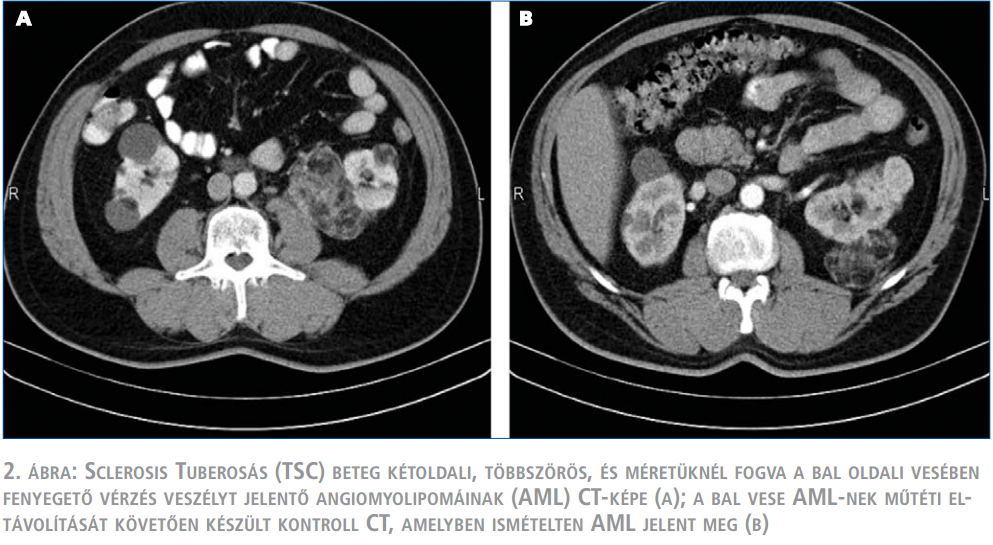
A TSC-vel szövődött AML klinikai viselkedésében eltér a gyakoribb, sporadikus betegségtől: fiatalabb korban jelentkezik, gyakran többszörös és mindkét vesét érinti, gyorsabban növekszik, és ezáltal nagyobb a spontán ruptúra következtében kialakuló vérzés veszélye is (2. táblázat). A vérzés az esetek negyedében keringési sokkot okoz. Az ekkor végzett azonnali műtét során gyakrabban kényszerülünk csonkolásra, nephrectomiára, ez a másik vese érintettségét is figyelembe véve sietteti a végstádiumú veseelégtelenség kialakulását (1. ábra). Ezért kívánatos a vérzés kialakulásának megelőzése. A hazai klinikai gyakorlatban a TSC részjelenségeként kialakult AML kezelése általában nem tér el a sporadikus esetekétől, elsősorban sebészi kezelést alkalmaznak (8) (2. ábra). Azonban a genetikai károsodás következtében ezekben a betegekben fiatalabb korban, gyakran többszörös, kétoldali műtétekre van szükség, amelyek a vesereszekció általános veszélyei mellett, a visszamaradó parenchyma-állomány hegesedésével, működésének csökkenésével is járnak. A fentiek kiemelik a minimál invazív intervenciós radiológiai módszer és a gyógyszeres kezelés jelentőségét, amelyek hozzájárulhatnak a parenchyma megőrzésével a jobb vesefunkció biztosításához, ezáltal a TSC-ben szenvedő betegek életminőségének és életkilátásainak javításához.
Az intervenciós radiológiai módszerek közül az embolizáció, mind a vérzésveszélyt jelentő AML-ek kezelésében, mind a ruptúra miatt bekövetkező heveny vérzést okozó AML sürgősségi ellátásában eredményesen alkalmazható. Megelőzésként a 4 cm-nél nagyobb, vagy 5 mm-nél vastagabb eret tartalmazó AML-t ellátó ér embolizációjával a daganat mérete megkisebbedik, későbbi növekedése lelassul, és kisebb lesz a spontán repedés valószínűsége is. Az embolizációt, a sebészi kezeléssel ellentétben, a későbbiekben gyakrabban kell ismételni. A radiofrekvenciás abláció (RFA) alkalmazásával a vesén belüli daganatok szövetei elpusztulnak, így AML esetében csökken a ruptúra és ezáltal a vérzés veszélye is. Mindkét fenti módszerre jellemző, hogy biztonsággal alkalmazható, kevesebb szövődménnyel jár és kisebb megterhelést jelentenek a betegnek, mint a „hagyományos” sebészeti eljárás. Ugyanakkor az AML gyakrabban recidivál intervenciós radiológiai eljárást követően, ezért a szoros, élethosszig tartó UH-kontroll elengedhetetlen.
A gyógyszeres kezelés során a TS hátterében lévő genetikai okok talaján kialakuló szövetburjánzást célzottan, a sejten belüli jelátvitel szintjén gátoljuk az urológiában a magas rizikójú, áttétet adó világossejtes vesedaganatok kezeléséből már ismert mTOR-gátló everolimus alkalmazásával. A szisztémás kezelés a TSC által érintett szervek mindegyikén kifejti hatását. Így eredményesen csökkenthető pl. az epilepsziás rohamok valószínűsége, javulnak a kognitív funkciók, csökken a kardiológiai eltérések kockázata stb. (9). A vesén belül az AML-ek megkisebbednek, és csökken az általuk jelentett vérzésveszély is (10). A gyógyszeres kezelést, amennyiben az eredményesnek bizonyul, hosszú távon, akár élethosszig kell alkalmazni a transzplantált betegek kezeléséhez hasonlóan. Mellékhatásai általában jól tolerálhatóak (11). Nemzetközi kettős vak placebokontrollált vizsgálatok (pl. EXIST2) több mint 3 éves utánkövetési idővel megállapították, hogy a naponta 1×10 mg per os alkalmazott everolimus kezelés a betegek 89,4%-ában gátolta az AML-ek progresszióját, sőt 64%-ában a tumorok több mint 50%-os méretcsökkenését tapasztalták (12). Ezen vizsgálatok alapján megfogalmazott nemzetközi ajánlások (FDA, EMA) szerint az everolimus kezelés első vonalban alkalmazandó:
- a 3 cm-nél nagyobb, tünetmentes, növekedést mutató AML-k;
- a növekvő, tünetmentes subependimális óriássejtes astrocytomák (SEGA) esetén.
A TSC-ben szenvedő betegek gyógyszeres kezelése kiemelt (általában transzplantált betegekkel foglalkozó) centrumokban, nefrológusok irányításával működő multidiszciplináris szakemberek összefogásával történik világszerte (13)
Következtetések
A fentiekben ismertettük az AML kezelési lehetőségeit, különös tekintettel a konzervatív (intervenciós radiológiai és gyógyszeres) gyógymódokra. Ezeket a kezeléseket Magyarországon ritkán alkalmazzák, és a hazai urológusok nem ismerik eléggé. A konzervatív terápiás lehetőségek bővülésével a társszakmák (nefrológus, intervenciós radiológus stb.) együttműködése kiemelt szerephez jut azon közös cél érdekében, hogy betegeink a számukra legkisebb megterhelést jelentő, legjobb eredménnyel, legkevesebb szövődménnyel járó gyógymódban részesülhessenek.
Támogatások
A közlemény a Novartis felkérésére készült, a cikkben leírtak a szerző saját véleményét tükrözik, amelyek eltérhetnek a cég álláspontjától.
Irodalomjegyzék:
1. Szendrői A, Hamvas A, Székely E, et al. Jóindulatú daganat-e a vese angiomyolipoma? Uroonkológia 2005; 2(3): 76–80.
2. Fittschen A, Wendlik I, Oeztuerk S, et al. Prevalence of sporadic renal angiomyolipoma: a retrospective analysis of 61,389 in- and out-patients. Abdom Imaging 2014; 39(5): 1009–1013. https://doi.org/10.1007/s00261-014-0129-6
3. Ljunberg B, Bensalah K, Bex A, et al. EAU Guidelines on renal cell carcinoma 2016. http://uroweb.org/guideline/renal-cell-carcinoma/
4. Reusz Gy, Deák-Pál Á, Remport Á. A sclerosis tuberosa terápiájának és gondozásának újabb aspektusai. Hypertonia és Nephrologia 2016; 20(3): 97–144.
5. Wataya-Taneda M, Tanaka M, Hamasaki T, et al. Trends in the Prevalence of Tuberous Sclerosis Complex Manifestations: An Epidemiological Study of 166 Japanese Patients. Plos One 2013; 8(5): e63910 https://doi.org/10.1371/journal.pone.0063910
6. Krueger DA, Northrup H, et al. Tuberous Sclerosis Complex Diagnostic Criteria Update: Recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference. Peadiatr Neurol 2013; 49: 243–254.
7. Franz DN, Agricola K, Mays M, et al. Everolimus for subependymal giant cell astrocytoma: 5-year final analysis. Ann Neurol 2015; 78(6): 929–38. https://doi.org/10.1002/ana.24523
8. Nelson CP, Sanda MG. Contemporary diagnosis and management of renal angiomyolipoma. J Urol 2002; 168(4): 1315–25. https://doi.org/10.1016/S0022-5347(05)64440-0
9. Krueger DA, Care MM, Agricola K, et al. Everolimus long-term safety and efficacy in subependymal giant cell astrocytoma. Neurology 2013; 80(6):574–80. https://doi.org/10.1212/WNL.0b013e3182815428
10. Bissler JJ, Kingswood JC, Radzikowska E, et al. Everolimus for renal angiomyolipoma in patients with tuberous sclerosis complex or sporadic lymphangioleiomyomatosis: extension of a randomized controlled trial. Nephrol Dilal Transplant 2016; 31(1): 111–119. https://doi.org/10.1093/ndt/gfv249
11. Eijkemans MJC, van der Wal W, Rejinders LJ, et al. Long term follow up assassing renal angiomyolipoma treatment patterns, morbidity and mortality: an observational study in tuberous sclerosis complex patients in the Netherlands. Am J Kidney Dis 2015; 66: 638–645. https://doi.org/10.1053/j.ajkd.2015.05.016
12. Bissler JJ, Kingswood JC, Radzikowska E, et al. Everolimus for angiomyolipoma associated with tuberous sclerosis complex or sporadic lymphangioleiomyomatosis (EXIST2): a multicentre, randomised, double blind, placebo-controlled trial. Lancet 2013; 381: 817–824. https://doi.org/10.1016/S0140-6736(12)61767-X
13. Coombs E. Role of mTOR inhibition in the treatment of patients with renal angiomyolipomas. J Am Assoc Nurse Pract 2013; 25(11): 588–596. https://doi.org/10.1002/2327-6924.1208
Promising imaging technique for diagnosing non-muscle invasive bladder tumour: NBI (narrow band imaging) in urology
DOI: 10.22591/magyurol.2017.2.kubika.52
Authors:
Mosonyi Péter dr., Szepesváry Zsolt dr., Kerényi Gábor dr., Lacó László dr. (Petz Aladár Megyei Oktató Kórház, Urológiai Osztály, Győr (osztályvezető: Szepesváry Zsolt dr.))
Summary
Objective: A high percentage of recurrent tumours can be obtained during the follow up of non-muscle invasive bladder tumours (NMIBT). In order to reduce this number, a lot of newly developed procedures have been introduced in the clinical practice. These are either biomarkers, and have a role in the follow up, or make the visualisation of bladder tumors more accurate. In the following article we discuss the most common methods and emphasize more importance to Narrow Band Imaging (NBI).
Patients and method: A total of 26 patients were retrospectively examined (female: 10 – male: 16). The light source of Olympus’s Visera Elite (C-190) type with special filters was used for endoscopic examinations. Conventional cystoscopy white light was performed, followed by NBI technique procedure.
Results: Atipical malformations were detected in two cases during NBI examination that was not detectable with white light cystoscopy.
Conclusion: The authors also highlight that the results can be improved by combining these new procedures.
LAPSZÁM: MAGYAR UROLÓGIA | 2017 | 29. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Célkitűzés: A nem izominvazív hólyagdaganatok (non-muscle invasive bladder tumor – NMIBT) utánkövetése során viszonylag magas számban észlelhető recidíva. Ennek csökkentése céljából az utóbbi években számos eljárás került kidolgozásra vagy bevezetésre a klinikai gyakorlatban. Ezek részben biomarkerek és az utánkövetésben van szerepük, részben pedig a tumor vizualizációját javítják. A közleményünkben az utóbbi technikák közül a legelterjedtebbeket tárgyaljuk, kiemelve a szűkített hullámhosszú képalkotás (narrow band imaging – NBI) jelentőségét.
Bevezetés
A hólyagdaganat a húgyutakban leggyakrabban előforduló rosszindulatú tumor. Az idősebb generáció betegsége, mivel diagnóziskor az átlagéletkor 70 év. Ugyanakkor a fiatalabb korban felfedezett tumorok általában jobban differenciáltak, alacsonyabb grádusúak és ezáltal jobb prognózissal bírnak. Férfiak esetében négyszer gyakrabban figyelhető meg, mint nőknél, afroamerikaiaknál feleannyira gyakori (1). Az újonnan diagnosztizált betegek 75%-ánál a daganat felszínes (non-muscle invasive bladder tumor, NMIBT), vagyis a mucosat és submucosus területeket érinti (Ta, T1 és CIS). Szövettani típus szerint 90%-ban tranziciocelluláris tumor (TCC) kerül diagnosztizálásra, 5%-ban laphám, 3%-ban adenokarcinóma, valamint 1%-ban neuroendokrin tumor (2).
A nem izominvazív hólyagtumoros esetek 15-61%-ában a tumor transurethralis reszekcióját (TUR) követően a daganat ismételten megjelenik a hólyagban egy éven belül (2, 22). A rekurrenciát és emellett a progressziót több tényező befolyásolja: a tumorok száma, mérete, megelőző kiújulási gyakoriság, jelen lévő karcinóma in situ (CIS), a daganat kiterjedése (Ta, T1) és a szövettani malignitás foka (grading). Mindezeket az EORTC – GUCG (European Organization for Research and Treatment of Cancer – Genito-Urinary Cancer Group) objektív pontrendszer formájában foglalta össze (2). Ugyanakkor a fentiek mellett egy további, szubjektív tényező befolyásolja a daganatok kiújulási gyakoriságát: a műtét (TUR) minősége. Ez utóbbi tényező javítása igencsak fontos és kívánatos (3). Az orvosi kezelés első és el nem hanyagolható lépcsőjének tökéletesítésére két lehetőségünk adódik: a vizualizáció javítása és a reszekciós technika fejlesztése. Ennek fényében a műtét során a lehető legnagyobb gondossággal és precizitással kell eljárni. Ebben lehet segítségünkre néhány, az utóbbi időben kifejlesztett, vagy újra felfedezett reszekciós technika („en block” reszekció, „HybridKnife” hidrodisszekció). Nem szabad elhanyagolni a beteg kezelése során elvégzett korai intravesicalis kemoinstillációt sem, mivel alkalmazásával 11,7%-13%-os csökkenést tudunk elérni a nem izominvazív hólyagtumorok kiújulási gyakoriságában (2).
A betegek utánkövetése szintén fontos lépés a gyógyuláshoz vezető úton. Kiemelt jelentőségű, hogy a daganat esetleges kiújulása minél előbb felfedezésre kerüljön. Korai recidíva alatt az első műtéttől számított három hónap múlva elvégzett első cisztoszkópia során felfedezett daganat értendő, amely az esetek 3-45%-ában figyelhető meg (5). Ezen esetek egy része valós tumorrecidíva, amely a daganat agresszív viselkedéséből származtatható, vagy a reszekciót követően implantálódott tumorsejtek hozzák létre. Ezeken túl el nem hanyagolható hányadot képeznek a műtét során észre nem vett apró daganatok is. Amellett, hogy újabb műtét szükséges ahhoz, hogy a beteg daganatmentessé váljon, nem kerülhető el az a tény sem, hogy a beavatkozások ismétlése jelentős terhet ró az amúgy is minimális tartalékokkal rendelkező egészségügyi rendszerünkre, nem beszélve a beteg szociális, pszichés és általános egészségi állapotáról (8, 9, 10).
Az utánkövetés során a képalkotó eljárások mellett alapvető fontosságú a vizeletcitológia (G3 tumor esetén) és a cisztoszkópia. A vizeletcitológia a G1, G2 esetekben erősen korlátozott értékű, hátránya, hogy vizsgálófüggő, low-grade tumorok esetén a szenzitivitás lecsökken, valamint zavarja az értékelést egyidejű gyulladás, húgyúti kövesség vagy intravesicalis instilláció is. Az eddig alkalmazott, fehér fénnyel (white light cystoscopy – WLC) történő cisztoszkópiának is megvannak a gyenge pontjai: az apró recidívát vagy CIS-t nehéz észrevenni, amelynek előfordulási gyakoriságát 10-20%-ra becsülik (3, 15). Mindezekre tekintettel az utóbbi időben jelentős erőfeszítések történtek annak érdekében, hogy a nem izominvazív hólyagtumorok detektálási hatékonyságát növelni lehessen mind az első műtét során, mind pedig az utánkövetés alatt. Erre szolgál több, az utóbbi években kifejlesztett eljárás: a biomarkerek és a vizualizációt javító technikák.
Továbbra sincs meg az ideális biomarker, azonban a jelenleg használatban lévők mindegyike igyekszik túlszárnyalni az ezidáig „gold standardnak” számító vizeletcitológiát. Az ImmunoCyt/uCyt immunohisztokémiai megoldást kínál a fenti problémára, míg az UroVysion fluoreszcens in situ hibridizációt alkalmaz. Az NMP22 (BladderCheck) a nuclear matrix protein 22 kimutatására szolgál vizeletből, könnyű a használata és 30 perc alatt eredményt ad. BTA stat (bladder tumor antigen) és BTA TRAK a hólyagtumor antigén jelenlétét igazolja vizeletből, ugyancsak fél óra alatt kész. Közös jellemzőjük, hogy nem helyettesíthetik a cisztoszkópiát és általában kiegészítésként használják citológia mellett. A továbbra sem tökéletes szenzitivitás miatt egyelőre csak az utánkövetés során van értelme a használatuknak (2, 23) (1. táblázat).
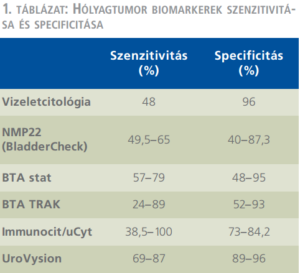
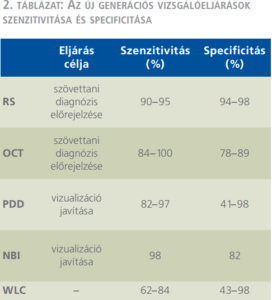
A nem izominvazív hólyagdaganatok felismerését elősegítő, jelenleg jóval nagyobb jelentőséggel bíró eljárások a vizualizációt segítik: a Raman-spektroszkópia (RS), az optikai koherencia-tomográfia (optical cocherence tomography, OCT), a fotodinámiás diagnózis (PDD), és a szűkített hullámhosszú képalkotás (narrow band imaging, NBI), továbbá néhány kezdeti stádiumban lévő módszer.
Új generációs vizsgálóeljárások
1. Raman-spektroszkópia (RS)
Az ún. Raman-effektusra alapozott eljárás lényege, hogy monokromatikus fénnyel megvilágított anyag részecskéinek vibrációs energiaállapota megváltozik és az ebből a helyzetből az alapenergia-állapotba történő visszatéréskor fotont sugároz ki, ami jól regisztrálható és az adott részecskékből álló anyagra jellemző. Minden anyagnak – így a normál mucosanak és tumoros szövetnek is – megvan a jellemző Raman-spektruma, amit fel lehet használni a normál és kóros szövetek elkülönítésére. Ezzel az RS alkalmas a patológiai diagnózis megelőlegezésére, hátránya, azonban hogy a hólyagnak csak kis területe vizsgálható és az eljárás kidolgozása még folyamatban van (3, 4, 6).
2. Optikai koherencia-tomográfia (optical coherence tomography, OCT
Ahogyan a neve is mutatja, ez is egy optikai eljárás, amelynek segítségével nagy felbontású, 2- vagy 3-dimenziós képeket tudunk előállítani szövetekről. A szemészetben már széles körben elterjedt eljárás, alapja az ultrahang analógiájára képzelhető el, annyi különbséggel, hogy fényt használnak hang helyett. Míg az ultrahang esetén a mélységi információt a hang visszaverődésének késleltetési idejéből származtatják, az OCT esetén interferometrikus módszert alkalmaznak. A szórt fény amplitúdója jellemző a szöveti típusra és szöveti mélységre, ami jól vizualizálható, penetrációja 2-3 mm. A hólyag három anatómiai rétege (urothelium, lamina propria, muscularis propria) így jól elkülöníthető, de tumoros invázió esetén ezek a rétegek eltűnnek. Előnye, hogy valós idejű eljárás, nem igényel speciális előkészítést és segítségével a tumor mélységi terjedésére lehet következtetni. Hátránya viszont az, hogy a hólyagnak csak kis területét lehet vizsgálni és az eredmények értékelése nagy gyakorlatot igényel (3, 4, 6).
3. Fotodinámiás diagnózis (photodynamic diagnosis, PDD
A fotodinámiás diagnózis, más néven fluoreszcens cisztoszkópia a fluoreszcencia jelenségét használja ki arra, hogy a patológiás és normális nyálkahártyafelszín között különbséget tegyen. Az eljárás során eltérő koncentrációban halmozódnak fel fluoreszcens molekulák normális és kóros szövetekben, majd a megfelelő hullámhosszú fény hatására más és más színben jelennek meg. A következő anyagokkal történtek beavatkozások: hypericin, 5-amino levulinsav (5-ALA) és észtere, hexa-amino levulinsav (HAL). Instillációt követően átlagosan két órával lehet a cisztoszkópiát elvégezni, speciális fényforrással és filterekkel felszerelt eszközökkel, amelyeken egyszerű gombnyomással lehet váltani a fehér fényű és a fluoreszcens mód között. A daganatos szövet intenzív rózsaszínes-vöröses fényben jelenik meg kékes (egészséges) háttér előtt. Számos klinikai tanulmány igazolta a detekciós ráta javulását PDD használata során a hagyományos fehér fényű cisztoszkópiával szemben. További előnye, hogy a tumoros szövet reszekciójának pontosságát is javítja. 5-ALA mellett jobb eredmények születtek, mint HAL alkalmazásával, mivel a vizsgálatok szerint az 5-ALA mélyebbre penetrál a szövetekbe és jobb dúsulást ér el neoplasztikus sejtekben (17, 18). A legnyomósabb ellenérv PDD-vel szemben a relatíve alacsony specificitása. Fals pozitív eseteket eredményezhet gyulladás, megelőző TUR vagy intravesicalis kemoterápia, valamint a nyálkahártya tangencionális megvilágítása. Mindezeken túl sajnos nem elhanyagolható tény az eljárás költséges volta, ami elterjedésének egyik fő akadályát képezi. A legújabb tanulmányok már az RS-sel és az OCT-vel történő kombinációját vizsgálják, amelynek köszönhetően a specificitás jelentősen javítható. További felhasználási lehetőség a fluoreszcens citológiai vizsgálat, amely mind a PDD, mind pedig a vizeletcitológiai vizsgálat előnyét egyesíti (19).
4. Szűkített hullámhosszú képalkotás (narrow band imaging, NBI
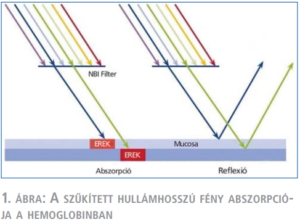
Az eljárásnak magyar elnevezése még nincs, leginkább „a látható fény spektrumát beszűkítő technikának”, vagy „szűkített hullámhosszú képalkotásnak” lehetne nevezni. A módszer maga egyszerű, ötletes és hatékony. Gasztrointesztinális endoszkópos vizsgálatokra fejlesztették ki, célja, hogy festék nélkül, optikai úton segítsen felerősíteni a kontrasztot ép és kóros mikrovaszkulatúrával rendelkező területek között (20). Azon a jelenségen alapul, hogy a fény szöveti penetrációjának mélysége az adott fény hullámhosszának függvénye. Ennek megfelelően, amikor a vizsgálófény hullámhosszát kék (415 nm) és zöld (540 nm) színekre szűkítjük, az a hemoglobin abszorpciós sávjába kerül és elnyelődik benne (1. ábra).
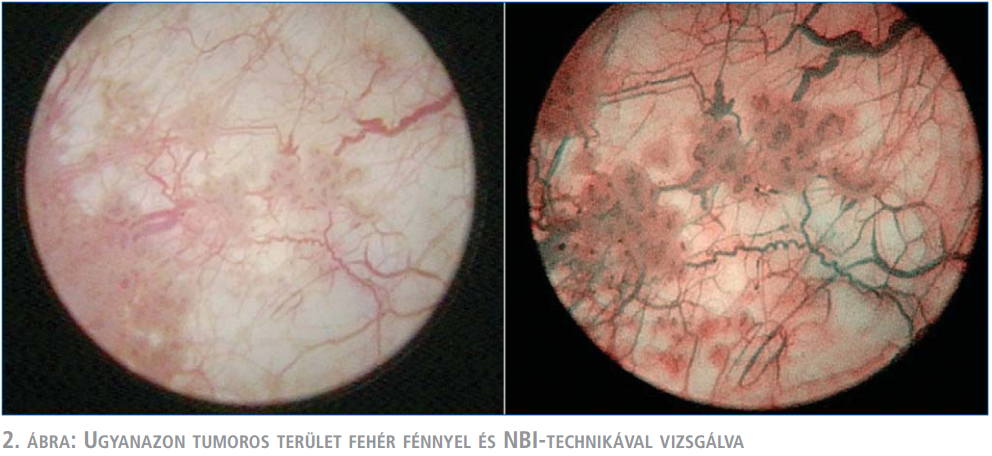
Következésképpen az érstruktúrák sötétzöld – fekete színben jelennek meg, míg a nyálkahártya rózsaszínes marad. A tumoros szövetekre jellemző dús érhálózat ezáltal könnyebben felismerhető, éles kontrasztot képez a normális vaszkulatúrával rendelkező nyálkahártya előtt (2. ábra) (9,10,12).
A vizsgálat során xenon fényforrást alkalmaznak, ami speciális színszűrővel van ellátva, 415 nm és 514 nm hullámhosszra optimalizálva. A készülék nem más, mint egy átlagos fényforrás, egyetlen plusz gombbal, ami a szűrőket aktiválja. Egyszerűségében rejlenek az előnyei: valós idejű, reprodukálható, jól dokumentálható (fénykép, videó), egyszeri beruházást igényel, amortizációja átlagos, speciális betegelőkészítés nincs, ambuláns formában is kivitelezhető (flexibilis cisztoszkópia), használatát könnyű elsajátítani, gyulladás vagy előzetes instillácó, kismértékű vérzés az értékelést nem zavarja. Fontos megemlíteni, hogy optikai eljárásról van szó, így nem hasonlítható egyéb valós idejű digitális képminőség – és kontrasztjavító technikához.
Hátránya a speciális szűrőkkel ellátott fényforrás viszonylag magas ára. További hátrányként szokták megemlíteni a fals pozitív minták számának emelkedését, ami azonban az eddigi vizsgálatok alapján nem jár a szövődmények gyakoriságának növekedésével (15, 16).
A gasztroenterológiában kiterjedten alkalmazzák azért, mert kolonoszkópia során hatékonyan segít a hiperplasztikus (nem neoplasztikus) és adenomatosus (neoplasztikus) polipusok in vivo elkülönítésében. Ugyancsak hasznos segítség gasztroszkópia során a nyelőcső Barrett-metaplázia kimutatásában. A bőrgyógyászatban is egyre szélesebb körben használják a fej-nyak régió laphámsejtes daganatainak diagnosztizálásában (2. táblázat) (7, 20).
A fentieken túl számos további vizsgálat indult a hólyagtumorok vizualizációjának elősegítésére. Ezek többsége még kísérleti stádiumban van. Kisebb részük ugyan már kipróbált és bevált eljárás, azonban nem terjedt el a mindennapi gyakorlatban, mivel egyes tulajdonságaikban a gyakorlati használhatóságuk korlátozott. A következőket lehet megemlíteni a teljesség igénye nélkül (hivatalos magyar elnevezés hiányában): confocal laser endomicroscopy, virtual cystoscopy, multimodal imaging, ultraviolet autofluorescence, multiphoton microscopy, scanning fiber endoscopy, telerobotic cystoscopy (4).
Betegek és módszer
Összesen 26 beteget vizsgáltunk retrospektíve (nő: 10 – férfi: 16), minden betegnél a beavatkozást megelőzően standard kivizsgálási protokollt alkalmaztunk. Ez magában foglalta az anamnézist, általános fizikális, laboratóriumi (vér és vizelet), és hasi ultrahangvizsgálatot. Az endoszkópos vizsgálatokat az Olympus cég Visera Elite (C-190) típusú speciális szűrőkkel ellátott fényforrásával végeztük.
A műtét során minden betegnél először fehér fénnyel, hagyományos cisztoszkópiát végeztünk. Ezt követően a készülék átállítása után az NBI-technikát alkalmaztuk és az eredményeket a műtéti leírásban rögzítettük (3. ábra). Amennyiben a két diagnosztikus eljárás során különbséget észleltünk, az adott területről vett szövettani mintákat szeparáltan küldtük vizsgálatra.
A műtét után sem tértünk el az eddig megszokott protokolltól.
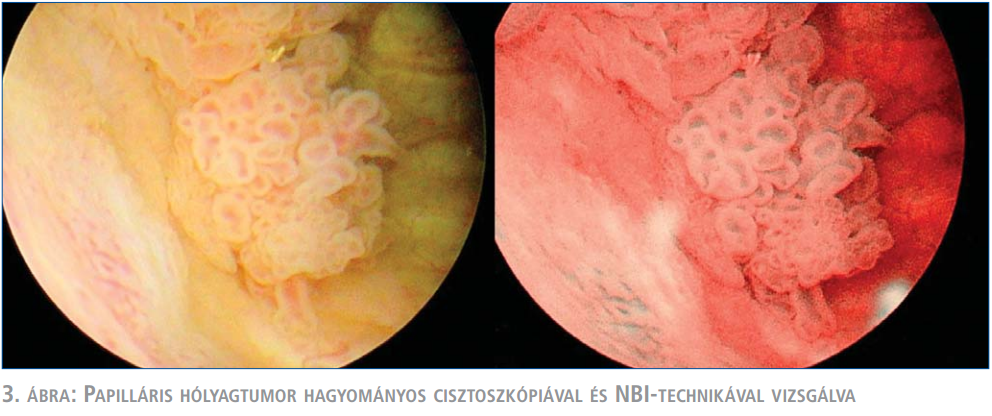
Eredmények
Gyógytartamot befolyásoló szövődmény nem volt, amiből a kis esetszám miatt nem vonhatunk le messzemenő következtetéseket, azonban joggal feltételezhetjük, hogy NBI használata nem növeli a szövődmények előfordulási gyakoriságát. NBI-vel történő vizsgálat során két betegnél észleltünk olyan eltérést, amely fehér fénnyel nem volt detektálható. Az e területekről vett minták szövettani vizsgálata az első esetben pozitívnak bizonyult (pTa, low grade urothelialis karcinóma). A második esetben a hisztológiai diagnózis krónikus urocistitist mutatott (ál-pozitív).
Utánkövetés kapcsán három hónap múlva elvégzett cisztoszkópia során két betegnél találtunk rekurráló tumort. Egy beteg nem jelent meg kontrollvizsgálaton.
Megbeszélés
Az Európai Unióban a hólyagtumorok előfordulási gyakorisága férfiak esetében 27/100 000 személy/év, míg nők esetében 4/100 000 személy/év. 2012-es adatok alapján férfiak esetében a prosztata, tüdő és colorectalis tumorokat követő a negyedik leggyakoribb daganat, míg nőknél a gyakorisági lista 15. helyén találjuk. Magyarországon a Nemzeti Rákregiszter adatai alapján a hólyagdaganat a hetedik leggyakoribb daganatféleség. 2013-ban 2262 férfi és 1049 női esetet regisztráltak, számuk 2009 óta 14%-kal nőtt. Érdekesség, hogy nők esetében az incidencia meglepően magas, az Európai Uniós országok közül csak Dániában magasabb (1).
Az újonnan diagnosztizált esetek 75%-a nem izominvazív hólyagtumor (Ta, T1 vagy CIS), amelyek 15-61%-a recidivál egy éven belül, 31-78%-a pedig öt éven belül a transurethralis reszekciót követően (2, 22). Ebből 3-45% a műtétet követő harmadik hónapban elvégzett cisztoszkópiás kontroll kapcsán kerül felfedezésre. A fentiekben ismertetett vizualizációt javító eljárások is elsősorban azért kerültek kifejlesztésre, hogy a kezdeti stádiumban lévő tumorszövet minél nagyobb arányban felfedezésre, és lehetőleg már az első műtét alkalmával eltávolításra kerüljön. Természetesen az utánkövetés során is jól kihasználhatóak az előnyei cisztoszkópia kapcsán. Míg az optikai koherencia-tomográfia (OCT) és a Raman-spektroszkópia (RS) a hólyagnyálkahártyának csak kis részét képes vizsgálni, addig a fotodinámiás diagnózis (PDD) és a szűkített hullámhosszú képalkotás (NBI) során a teljes nyálkahártya-felületet ellenőrizni lehet. A PDD-technika hasznosságára már az 1990-es évek elején felhívták a figyelmet, 2006 óta az Európai Urológus Társaság ajánlásában (EAU Guideline) is szerepel (21). Számos előnye ellenére a mindennapos gyakorlatban a mai napig nem terjedt el. Az NBI-technika első klinikai alkalmazását japán kutatók 2004-ben kolonoszkópia kapcsán végezték (7). Első urológiai alkalmazásáról Bryan és munkatársai számoltak be 2007-ben, majd a következő években a PDD konkurrensévé vált (12). Egy 2015-ben közreadott metaanalízis alapján nem találtak szignifikáns különbséget a hólyagdaganat kiújulási gyakoriságában PDD és NBI alkalmazásával elvégzett TUR-t követően. A vizsgálat egyértelműen az NBI alkalmazását javasolja, mert a PDD-vel ellentétben nem szükséges előzetes instilláció, és egyebek mellett egyidejű gyulladás sem rontja a specificitást (17).
Számos további vizsgálat igazolta az NBI előnyeit hagyományos cisztoszkópiával szemben, ezek közül kiemelendőek az alábbiak:
1. lényegesen jobb szenzitivitás (NBI: 98,8% – WLC: 75,4%) (11);
2. reziduális tumorok arányának csökkenése (NBI: 15% – WLC: 30,5%) (9, 13).
3. az egyéves kontroll kapcsán észlelt átlagos 10%-os csökkenés a kiújulási gyakoriságban (13).
Az NBI legnagyobb hátrányaként a fals pozitív esetek számának 8-13%-os emelkedését említik, azonban a vizsgálatok kimutatták, hogy ezen emelkedés nem jár sem a morbiditás, sem pedig a költségek szignifikáns növekedésével (9, 10, 15, 16).
Az előzetesen diagnosztizált felületes hólyagtumorok 4-25%-ban progresszió figyelhető meg (2). Arra még nem kaptunk választ, hogy a fenti vizsgálóeljárások alkalmazásával a progresszió gyakorisága milyen mértékben csökkenthető. A Nemzetközi Endourológiai Társaság koordinálásával 2013-ban indult egy nemzetközi, multicentrikus, randomizált, kontrollált vizsgálat, amelynek eredményei feltehetőleg választ adnak többek között a progressziós ráta alakulására is (14). A már említett 2015-ös metaanalízis következtetései alapján valószínűsíthető, hogy az NBI önmagában a progressziós rátát nem javítja (15). Mindezek miatt az egyes technikák kombinálásával lehetséges az eredményeken javítani. Már eddig is bíztató eredmények születtek (PDD+OCT, NBI+OCT), de további vizsgálatok szükségesek a megfelelő szintű evidencia felállításához.
A klinikus számára azonban a legfontosabb kérdés továbbra is az, hogy a mindennapi munkában hol jelent leginkább előnyt az NBI alkalmazása? Erre keres választ többek között egy, még le nem zárult dán vizsgálat (Da-Bla-Ca study), amelyben a PDD-vel és NBI-vel végzett hólyagtükrözés eredményeit hasonlítják össze a hagyományos cisztoszkópiával. A 2016-os EAU kongresszuson részeredményeket is közöltek, amelyben arra a következtetésre jutottak, hogy mindkét vizualizációt javító (PDD és NBI) vizsgálóeljárás a standard módszert mind specificitásban, mind szenzitivitásban megelőzi. Ezen túl úgy véleményezték, hogy egyszerűsége miatt az NBI a legalkalmasabb arra, hogy az ambuláns hólyagtükrözés során a szenzitivitást javítsa. Így a járóbeteg-ellátásban lehet számítani leginkább az elterjedésére, méghozzá a nem izominvazív hólyagtumoros betegek utánkövetése során végzett vizsgálatok esetében.
Következtetések
A fentiekben tárgyalt technikák közül – amennyiben rendelkezésre áll – a két, vizualizációt javító eljárás valamelyikét javasolt a mindennapi munkában is alkalmazni.
Az Európai Urológus Társaság legfrissebb ajánlása szerint amennyiben a vizeletcitológia pozitív és a hagyományos cisztoszkópia negatív eredményű – akár kivizsgálás, akár utánkövetés során – a felső húgyúti tumor kizárását követően PDD-, vagy pedig az NBI-technika alkalmazása előnyben részesítendő a random biopsziával szemben. Előzetes CIS szövettani eredmény mellett a három- és hathónapos kontrollvizsgálat során PDD vagy NBI által vezérelt biopszia elvégzése javasolt tumorrecidíva gyanúja esetén (2).
Tekintettel arra, hogy a PDD, de különösen az NBI a kiújulási gyakoriságot, ezáltal az ismételt transurethralis reszekciók számát lecsökkenti, költséghatékonynak tekinthető.
Annak ellenére, hogy a cikkben ismertetett NBI-technika számos előnnyel rendelkezik, hangsúlyozni szükséges, hogy ez az új képalkotó eljárás nem helyettesítheti, és nem nélkülözheti a tapasztalt urológus szakember jelenlétét és közreműködését.
Irodalomjegyzék:
1. Cancer incidence IARC, Ferlay J, Bray F, Forman D, et al. GLOBOCAN 2008 v1.2, Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 10 2010, International Agency for Research on Cancer: Lyon, France. https://doi.org/10.1002/ijc.29210
2. Babjuk M, Böhle A, Burger M, et al. EAU Guidelines on Non–Muscle-invasive Urothelial Carcinoma of the Bladder: Update 2016 http://doi.org/10.1016/j.eururo.2016.05.041
3. Cauberg ECC, de Bruin DM, Faber DJ, van Leeuwen TG, de la Rosette JJMCH, de Reijke TM. A new generation of optical diagnostics for bladder cancer: technology, diagnostic accuracy and future applications. Eur Urol 2009; 56: 287–97. https://doi.org/10.1016/j.eururo.2009.02.033
4. Lopez A, Liao JC. Emerging endoscopic imaging technologies for bladder cancer detection. Curr Urol Rep 2014; 15: 406. https://doi.org/10.1007/s11934–014–0406–5
5. Brausi M, Colette L, Kurt K, et al. Variability in the recurrence rate at firs follow-up cystoscopy after TUR in stage Ta T1 transitional cell carcinoma of the bladder: a combined analysis of seven EORTC studies. Eur Urol 2002; 41: 523–531. https://doi.org/10.1016/s0302-2838(02)00068–4
6. Patel P, Bryan RT, Wallace DM. Emerging endoscopic and photodynamic techniques for bladder cancer detection and surveillance. Scientific WorldJournal 2011; 11: 2550–2558. https://doi.org/10.1100/2011/412739
7. Muguruma N, Takayama T. Narrow band imaging as an efficient and economical tool in diagnosing colorectal polyps. Clin Endosc 2015; 48: 461–463. https://doi.org/10.5946/ce.2015.48.6.461
8. Naselli A, Introini C, Timossi L, et al. A Randomized Prospective Trial to Assess the Impact of Transurethral Resection in Narrow Band Imaging Modality on Non–Muscle-Invasive Bladder Cancer Recurrence. Eur Urol 2012; 61: 908–913. https://doi.org/10.1016/j.eururo.2012.01.018
9. Herr HW, Donat SM. A comparison of white-light cystoscopy and narrow-band imaging cystoscopy to detect bladder tumour recurrences. BJU Int 2008; 102: 1111–1114. https://doi.org/10.1111/j.1464–410x.2008.07846.x
10. Naselli A, Introini C, Bertolotto F. Narrow band imaging for detecting residual/recurrent cancerous tissue during second transurethral resection of newly diagnosed non-muscle-invasive high-grade bladder cancer. BJU Int 2009; 105: 208–211. https://doi.org/10.1111/j.1464–410x.2009.08701.x
11. Ye Z, Hu J, Song X, et al. A comparison of NBI and WLI cystoscopy in detecting non-muscle-invasive bladder cancer: a prospective, randomized and multi-center study. Sci Rep 2015; 5: 10905. https://doi.org/10.1038/srep10905
12. Bryan RT, Billingham LJ, Wallace DMA. Narrow-band imaging flexible cystoscopy in the detection of recurrent urothelial cancer of the bladder. BJU Int 2007; 101: 702–706. https://doi.org/10.1111/j.1464–410x.2007.07317.x
13. Cauberg ECC, Mamoulakis C, de la Rosette JJ. Narrow band imaging-assisted transurethral resection for non-muscle invasive bladder cancer significantly reduces residual tumour rate. World J Urol 2011; 29: 503–509. https://doi.org/10.1007/s00345–011–0659–2
14. Naito S, de la Rosette JJ, Algaba F, et al. The Global Randomized NBI Bladder Cancer study. 2010. http://www.croesoffice.org/ OngoingProjects/NBIStudy.aspx
15. Li K, Lin T, Fan X, et al. Diagnosis of narrow-band imaging in non-muscle-invasive bladder cancer: a systematic review and meta-analysis. Int J Urol 2013; 20: 602–609. https://doi.org/10.1111/j.1442–2042.2012.03211.x
16. Song PH, Cho S, Ko YH. Decision based on narrow band imaging cystoscopy without a referential normal standard rather increases unnecessary biopsy in detection of recurrent bladder urothelial carcinoma early after intravesical instillation. Cancer Res Treat 2016; 48: 273–280. https://doi.org/10.4143/crt.2014.190
17. Lee JY, Cho KS, Kang DH, et al. A network meta-analysis of therapeutic outcomes after new image technology-assisted transurethral resection for non-muscle invasive bladder cancer: 5-aminolaevulinic acid fluorescence vs hexylaminolevulinate fluorescence vs narrow band imaging. BMC Cancer 2015; 15: 566. https://doi.org/10.1186/s12885–015–1571–8
18. Járomi P, PintérZ, Lukács N, et al. A differenciált szövetmintavétel, illetve a fluorescens cystoscopia – mint prognózist befolyásoló tényező – szerepe a hólyagdaganat diagnosztikájában. Uroonkológia 2011; 8(2): 29–31.
19. Pytel A, Schmeller N. New aspect of photodynamic diagnosis of bladder tumors: fluorescence cytology. Urology 2002; 59: 216–219. https://doi.org/10.1016/s0090–4295(01)01528–x
20. Herszényi L, Mihály E, Tulassay Zs. Az NBI endoszkópos technika. Magy Belorv Arch 2014; 67: 5–10.
21. Pajor L, Bajory Z. A magyar urológia irányelvei. Útmutató. Klinikai Irányelvek Kézikönyve. 2009.dec. Urológia p. 75–82.
22. van der Heijden AG, Witjes JA. Recurrence, progression, and follow-up in non–muscle-invasive bladder cancer. Eur Urol Suppl 2009; 8: 556–562. https://doi.org/10.1016/j.eursup.2009.06.010
23. Vrooman OPJ, Witjes JA. Urinary Markers in Bladder Cancer. Eur Urol 2008; 53: 909–916. http://doi.org/10.1016/j.eururo.2007.12.006.
Management of urothelial carcinoma of the upper urinary tract – similarities and differences with urothelial bladder cancer
DOI: 10.22591/magyurol.2017.2.kubika.52
Authors:
Kubik András dr., Szarvas Tibor dr., Módos Orsolya dr., Keresztes Dávid dr., Horváth András dr., Nyirády Péter dr. (Semmelweis Egyetem, Urológiai Klinika, Budapest (igazgató: Nyirády Péter dr.))
Summary
The upper tract urothelial carcinoma (UTUC) and urothelial bladder carcinoma (UBC) were considered as one tumour entity with different anatomical locations. The aim of this review was to discuss current progress in UTUC research and to highlight the molecular, histopathological and clinical differences and similarities between UTUC and UBC. UBC and UTUC sharing common risk factors including smoking and aromatic amines, while aristolochic acid exposure or familiar Lynch syndrome are rather specific for UTUC. The grading of UBC and UTUC are identical, but inherent from their different anatomical locations, there are some differences between their stage classifications.
The primary treatment for both UBC and UTUC is surgery. Because of the inaccurate preoperative or transurethral staging of UTUC, many patients are overtreated by nephroureterectomy. Therefore, combined predictive tools including molecular, pathological and imaging parameters are needed in order to improve the prediction of tumor stage. Currently, the clinical benfit of lymph node dissection (LND) as well as the optimal number and sequence of lymph node removal is unclear. Systemic neoadjuvant and adjuvant chemotherapies may be considered, however their benefit has to be confirmed by large prospective studies.
LAPSZÁM: MAGYAR UROLÓGIA | 2017 | 29. ÉVFOLYAM, 2. SZÁM
Összefoglalás
A felső húgyúti urothel sejtes tumorokat (FeHUT) valamint az alsó húgyúti urothel sejtes tumorokat (AHUT) számos klinikai és patológiai hasonlóságuk alapján sokáig ugyanazon tumorentitás különbözö lokalizációjaként tartották számon. Az elmúlt évek kutatásai azonban egyre több, a két tumor különbözőségét feltáró eredményt szolgáltattak. A jelen összefoglaló tanulmány célja, hogy a FeHUT vizsgálata során nyert kutatási eredményeket ismertetve, rámutasson a két tumortípus közötti epidemiológiai, etiológiai, stádium- és rizikómeghatározási, illetve a sebészi és más onkológiai kezelést érintő hasonlóságokra és különbségekre.
Bevezetés
Az urothel sejtes daganatok a leggyakoribb rosszindulatú húgyúti elváltozások, amelyek az esetek nagy részében a húgyhólyagot érintik, azonban 5%-ban a felső húgyutakban (húgyvezeték, vesemedence) jelentkezik a daganat (1), így a felső húgyúti urothel sejtes tumorokat (FeHUT) sokáig csak egy gyakori tumortípus ritka elhelyezkedésű változataként tartották számon. Az azonos szöveti eredetű felső húgyúti traktust érintő daganatok (FeHUT) és az urothel sejtes alsó húgyúti tumorok (AHUT) számos hasonlóságot mutatnak, ezért kezelésük is a gyakrabban előforduló AHUT terápiás tapasztalatain alapul. Az utóbbi évek kutatásai feltárták e két tumortípus kórszövettani, etiológiai és molekuláris különbözőségeit, így egyre inkább teret kap az a nézet, amely szerint ez a két hasonló, azonban jól megkülönböztethető tumortípus különböző diagnosztikus és terápiás eszközöket igényel (2).
Epidemiológiai és kockázati tényezők
Diagnosztikai módszerek
Műtéti lehetőségek
Endoszkópos sebészeti megoldás
Nyílt, szervmegtartó sebészeti megoldás
Nyílt radikális sebészeti megoldás
Laparoszkópos sebészeti megoldás
Onkoterápiás lehetőségek
Következtetések
Irodalomjegyzék:
1. Munoz JJ, Ellison LM. Upper tract urothelial neoplasms: incidence and survival during the last 2 decades. J Urol 2000; 164(5): 1523–5. https://doi.org/10.1016/S0022-5347(05)67019-X
2. Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013.CA Cancer J Clin 2013 Jan; 63(1): 11–30. https://doi.org/10.3322/caac.21166
3. Roupret M, et al. European Association. Of Urology Guidelines on Upper Urinary Tract Urothelial Cell Carcinoma: 2015 Update. Eur Urol 2015; 68(5): 868–79. https://doi.org/10.1016/j.eururo.2015.06.044
4. Balogh, et al. Pyelum- és uréterdaganatok klinikai és epidemiológiai vizsgálata. Orvosi hetilap 1983; .124(1): 1003–1007.
5. Nortier JL, et al. Urothelial carcinoma associated with the use of a Chinese herb (Aristolochia fangchi). N Engl J Med 2000; 342(23): 1686–92. https://doi.org/10.1056/NEJM200006083422301
6. Moriya M, et al. TP53 Mutational signature for aristolochic acid: an environmental carcinogen. Int J Cancer 2011; 129(6): 1532–6. https://doi.org/10.1002/ijc.26077
7. Yang MH, et al. Unusually high incidence of upper urinary tract urothelial carcinoma in Taiwan. Urology 2002; 59(5): 681–7. https://doi.org/10.1016/S0090–4295(02)01529–7
8. Watson P, Lynch HT. The tumor spectrum in HNPCC. Anticancer Res 1994; 14(4B): 1635–9.
9. Fink DS, Aebi, Howell SB. The role of DNA mismatch repair in drug resistance. Clin Cancer Res 1998; 4(1): 1–6.
10. Scosyrev E, et al. Sex and racial differences in bladder cancer presentation and mortality in the US. Cancer 2009; 115(1): 68–74. https://doi.org/10.1002/cncr.23986
11. Green DA, et al. Urothelial carcinoma of the bladder and the upper tract: disparate twins. J Urol 2013; 189(4): 1214–21. https://doi.org/10.1016/j.juro.2012.05.079
12. Shariat SF, et al. Gender differences in radical nephroureterectomy for upper tract urothelial carcinoma. World J Urol 2011; 29(4): 481–6. https://doi.org/10.1007/s00345–010–0594–7
13. Novara G, et al. Independent predictors of contralateral metachronous upper urinary tract transitional cell carcinoma after nephroureterectomy: multi-institutional dataset from three European centers. Int J Urol 2009; 16(2): 187–91. https://doi.org/10.1111/j.1442–2042.2008.02201.x
14. Wilson RT, et al. Shared occupational risks for transitional cell cancer of the bladder and renal pelvis among men and women in Sweden. Am J Ind Med 2008; 51(2): 83–99. https://doi.org/10.1002/ajim.20522
15. Lughezzani G, Burger M, Margulis V, et al. Prognosticfactors in upper urinary tract urothelial carcinomas: a comprehensive review of the current literature. Eur Urol 2012; 62: 100–14. https://doi.org/10.1016/j.eururo.2012.02.030
16. Fritz GA, et al. Multiphasic multidetector-row CT (MDCT) in detection and staging of transitional cell carcinomas of the upper urinary tract. Eur Radiol 2006; 16(6): 1244–52. https://doi.org/10.1007/s00330–005–0078–0
17. Chung PH, et al. Degree of hydronephrosis predicts adverse pathological features and worse oncologic outcomes in patients with high-grade urothelial carcinoma of the upper urinary tract. Urol Oncol 2014; 32(7): 981–8. https://doi.org/0.1016/j.urolonc.2014.02.018
18. Bus MT, et al. Optical diagnostics for upper urinary tract urothelial cancer: technology, thresholds, and clinical applications. J Endourol 2015; 29(2): 113–23. https://doi.org/10.1089/end.2014.0551
19. Matin SF, Kamat AM, Grossman HB. High-frequency endoluminal ultrasonography as an aid to the staging of upper tract urothelial carcinoma: imaging findings and pathologic correlation. J Ultrasound Med 2010; 29(9): 1277–84. https://doi.org/10.7863/jum.2010.29.9.1277
20. Bui D, et al. A Pilot Study of In Vivo Confocal Laser Endomicroscopy of Upper Tract Urothelial Carcinoma. J Endourol 2015. https://doi.org/10.1089/end.2015.0523
21. Cutress ML, et al. Ureteroscopic and percutaneous management of upper tract urothelial carcinoma (FEHUT): systematic review. BJU Int 2012; 110(5): 614–28. https://doi.org/10.1111/j.1464–410X.2012.11068.x
22. Iborra I, et al. Conservative elective treatment of upper urinary tract tumors: a multivariate analysis of prognostic factors for recurrence and progression. J Urol 2003; 169(1): 82–5. https://doi.org/10.1016/S0022–5347(05)64041–4
23. Pruthi RS, et al. Conservative management of low risk superficial bladder tumors. J Urol 2008; 179(1): 87–90; discussion 90. https://doi.org/10.1016/j.juro.2007.08.171
24. Grasso M, et al. Ureteroscopic and extirpative treatment of upper urinary tract urothelial carcinoma: a 15-year comprehensive review of 160 consecutive patients. BJU Int 2012; 110(11): 1618–26. https://doi.org/10.1111/j.1464–410X.2012.11066.x
25. Romain Mathieu KB, Ilaria Lucca, Aurélie Mbeutcha, Morgan Rouprêt, Shahrokh F. Shariat. Upper urinary tract disease: what we know today and unmet needs. Transl Androl Urol 2015; 4(3): 261–272.
26. Cai G, Liu X, Wu B. Treatment of upper urinary tract urothelial carcinoma. Surg Oncol, 2011; 20(1): 43–55. https://doi.org/10.1016/j.suronc.2009.10.001
27. Kondo T, et al. Impact of the extent of regional lymphadenectomy on the survival of patients with urothelial carcinoma of the upper urinary tract. J Urol 2007; 178(4 Pt 1): 1212–7; discussion 1217. https://doi.org/10.1016/j.juro.2007.05.158
28. Kondo T, et al., Template-based lymphadenectomy in urothelial carcinoma of the upper urinary tract: impact on patient survival. Int J Urol 2010; 17(10): 848–54. https://doi.org/10.1111/j.1442–2042.2010.02610.x
29. Raman JD, Scherr DS. Management of patients with upper urinary tract transitional cell carcinoma. Nat Clin Pract Urol 2007; 4(8): 432–43. https://doi.org/10.1038/ncpuro0875
30. Yakoubi R, et al. Radical nephroureterectomy versus endoscopic procedures for the treatment of localised upper tract urothelial carcinoma: a meta-analysis and a systematic review of current evidence from comparative studies. Eur J Surg Oncol 2014; 40(12): 1629–34. https://doi.org/10.1016/j.ejso.2014.06.00
31. Irie A, et al. Intravesical instillation of bacille Calmette-Guerin for carcinoma in situ of the urothelium involving the upper urinary tract using vesicoureteral reflux created by a double-pigtail catheter. Urology 2002; 59(1): 53–7. https://doi.org/10.1016/S0090–4295(01)01488–1
32. Martinez-Pineiro JA, Garcia Matres MJ, Martinez-Pineiro L. Endourological treatment of upper tract urothelial carcinomas: analysis of a series of 59 tumors. J Urol 1996; 156(2 Pt 1): p. 377–85. https://doi.org/10.1097/00005392–199608000–0001
33. Kojima Y, et al. Long-term outcome of upper urinary tract carcinoma in situ: effectiveness of nephroureterectomy versus bacillus Calmette-Guerin therapy. Int J Urol 2006; 13(4): 340–4. https://doi.org/10.1111/j.1442–2042.2006.01312.
34. Witjes JA, et al. EAU guidelines on muscle-invasive and metastatic bladder cancer: summary of the 2013 guidelines. Eur Urol 2014; 65(4): 778–92. https://doi.org/10.1016/j.eururo.2013.11.04
35. Igawa M, et al. Neoadjuvant chemotherapy for locally advanced urothelial cancer of the upper urinary tract. Urol Int 1995; 55(2): 74–7. https://doi.org/10.1159/00028275
36. Porten S, et al. Neoadjuvant chemotherapy improves survival of patients with upper tract urothelial carcinoma. Cancer 2014; 120(12): 1794–9. https://doi.org/10.1002/cncr.2865
37. Lee SE, et al. Adjuvant chemotherapy in the management of pT3N0M0 transitional cell carcinoma of the upper urinary tract. Urol Int 2006; 77(1): 22–6. https://doi.org/10.1159/000092930
Results of penile rehabilitation with avanafil after laparoscopic radical prostatectomy
DOI: 10.22591/magyurol.2017.2.kerenyig.64
Authors:
Kerényi Gábor dr., Szepesváry Zsolt dr., Mosonyi Péter dr., Törzsök Ferenc dr. (Petz Aladár Megyei Oktató Kórház, Urológiai Osztály, Győr (osztályvezető: Szepesváry Zsolt dr.))
Summary
Objective: Investigation of erectile function of penis by administration of avanafil in patients operated with laparoscopic nervesparing radical prostatectomy, its impact on quality of life, furthermore compare the same parameters of data with a group of patients not received medication.
Patients and methods: Authors investigated patients operated with laparoscopic radical prostatectomy on Urology Department of Petz Aladár County Teaching Hospital between 2012 and 2016. Preoperative erectile function was appointed by score of „Questionnaire on quality of erection” (MMM) – a shortened form of IIEF used in Hungary. 26 patients met criteria (MMM score 17 at least) in group of penile rehabilitation (2015– 2016) and 25 men was included in control group (2012–2015). In „patients with medicine” group next catheter removal 100 mg avanafil was administered once daily for 60 days, and 200 mg casually after that. For measuring efficacy (satisfying erection for sexual intercourse) “MMM” questionnaire was also used in addition a specially compiled list of questions. Postoperatively quality of life score was determined by EQ-5D and VAS questionnaire 6-9 months after the operation.
Results: Differences in all of the endpoints of this survey (satisfying erection for vaginal insertion, successful sexual intercourse, increase in postoperative MMM score, improvement in Quality of Life parameters) was proven statistically significant in favour of avanafil medication group.
Authors remark that data processed during this study were neither prospective nor randomized, but was a comparison of parameters between metachronous groups.
Conclusion: There are several studies for penile rehabilitation with PDE-5 inhibitors attainable in international literature. Pharmaceutical agent in most studies is sildenafil, as well as tadalafil and vardenafil. On the score of present survey the newest phosphodiesterase type-5 inhibitor, avanafil seems to have its place among methods of early correction of circulation of penis after nervesparing radical prostatectomy.
LAPSZÁM: MAGYAR UROLÓGIA | 2017 | 29. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Célkitűzés: Idegkímélő laparoszkópos radikális prostatectomián átesett betegeknél a pénisz merevedési funkciójának vizsgálata avanafil adása mellett, ennek hatása az életminőségre, továbbá az adatok összehasonlítása a fenti hatóanyagot nem kapott betegek hasonló paramétereivel.
Betegek és módszerek: A szerzők intézményük urológiai osztályán a 2012–2016 közötti időszakban laparoszkópos radikális prostatectomián átesett betegeket vizsgálták. A műtétre kerülő betegeknél a Merevedés Minőségi Mutatója (MMM) kérdőív pontszáma alapján határozták meg a preoperatív merevedési funkciót. A pénisz-rehabilitációs vizsgálati csoport (2015–2016 között) kritériumainak (MMM ≥17) 26 beteg felelt meg. A kontrollcsoportot (2012–2015 között) 25 beteg alkotta. A gyógyszeres csoportba beválasztott betegek katétereltávolítás után naponta 100 mg avanafil-t szedtek 60 napig, majd ezt követően 200 mg-ot alkalomszerűen. A hatékonyság – közösüléshez elegendő merevedés – felmérését szintén MMM-kérdőívvel, illetve speciálisan összeállított célzott kérdéssorral végezték. A posztoperatív életminőséget EQ-5D és VAS-kérdőívekkel mérték fel a műtét után 6-9 hónappal.
Eredmények: A vizsgált végpontok (közösüléshez szükséges erekció létrejötte, sikeres közösülés, műtét utáni MMM-pontszám növekedése, életminőségi mutatók javulása) mindegyikénél szignifikáns különbség mutatkozott az avanafil gyógyszeres csoport javára.
A szerzők kiemelik, hogy nem prospektív, randomizált tanulmány adatai kerültek kiértékelésre, hanem metakron csoportok paramétereit vetették össze.
Következtetés: A nemzetközi irodalomban több tanulmány foglalkozik PDE-5-gátló gyógyszerek segítségével kivitelezett pénisz-rehabilitációval. A vizsgálatokban szereplő hatóanyag főként szildenafil, illetve tadalafil vagy vardenafil. Jelen felmérés eredményei alapján az idegkímélő radikális prostatectomiák után a hímvessző korai keringésjavító módszerei között a legújabb foszfodiészteráz-5-gátlónak, az avanafilnak is helye van.
Bevezetés
A radikális prostatectomián átesett betegek leggyakoribb késői szövődménye az erektilis diszfunkció (ED) (1, 2). Az idegkímélő technika bevezetése forradalmasította a műtéti eljárást, megteremtette a merevedés megmaradásának, illetve visszatérésének a lehetőségét (3, 4). A nemzetközi irodalmi adatokban az ED előfordulása gondos műtéttechnika mellett is nagy szóródást mutat (14-87%) (5, 6, 7).
A műtét után létrejövő merevedési zavar multifaktoriális eredetű. Az operáció során létrejött ideg-, ér- és izomkárosodások egy része irreverzibilis (eltávolításra kerül, elektromosan vagy mechanikusan sérül). Műtét után a spontán erekció elmaradásának következtében állandósul a relatív hypoxia, emiatt kedvezőtlen változások történnek a cavernosus szövetek állományában, illetve funkciójában. A csökkent oxigenizáció miatti kötőszövet-felszaporodás (egyfajta „hegesedés”) az erektilis szövetek csökkent tágulékonyságához, majd a veno-okkluzív működés károsodásához, a vénás elfolyás növekedéséhez vezet (8, 9, 10, 11).
A szexuális vágy és erekciós képesség fontossága csökken az életkorral. A 40–50 év közötti férfiak 75-84%-a, míg a 6. évtizedben 48-59% vallja szükségesnek. Azonban ezen betegeknél az erekció elmaradása rontja a beteg életminőségét és feszültséghez vezethet a párkapcsolatban (12, 13). Szintén megállapítást nyert, hogy a műtét előtt jobb merevedési mutatókkal rendelkezők motiváltabb csoportot képeznek a posztoperatív kielégítő erekció és szexuális funkció eléréséhez (14). A műtét után a maximális szexuális funkció visszatérése 6-24 hónap alatt várható (15). A kiterjesztett nyirokcsomó-eltávolítás nincs hatással a műtét utáni merevedésre (16).
A pénisz-rehabilitáció célja a műtét után a hímvessző véráramlásának elősegítése, a barlangos szövetek oxigenizációjának támogatása a lehető legjobb szexuális funkció elérése céljából. A nemzetközi irodalomban többféle gyógyszerrel és eljárással történtek klinikai vizsgálatok: PDE-5-gátlók, intraurethralis alprostadil (Muse), prostaglandin-E1 injekció, vákuum-készülék. A foszfodiészteráz-5-inhibitorok csoportjából valamennyi forgalomban lévő hatóanyagot vizsgálták (sildenafil, tadalafil, vardenafil és avanafil), illetve több összehasonlító elemzés is történt. Összességében a PDE-5-gátlók a leggyakrabban vizsgált hatóanyagok a pénisz-rehabilitáció tárgykörében (17, 18).
Ezen tanulmány célja a laparoszkópos, kétoldali idegkímélő technikával végzett radikális prostatectomián átesett betegeknél a hímvessző rehabilitációs lehetőségeinek vizsgálata a műtét után szedett avanafil mellett, továbbá ezen betegek életminőségi mutatóinak felmérése, illetve az adatok összehasonlítása egy kontrollcsoport hasonló paramétereivel, akik nem kapták a fenti hatóanyagot.
Beteg és módszer
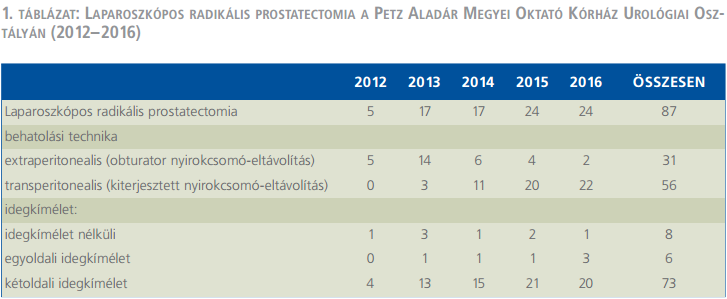
A Petz Aladár Megyei Oktató Kórház urológiai osztályán 2012. szeptember 1. és 2016. november 30. között 87 laparoszkópos radikális prostatectomiát végeztek (1. táblázat).
Kétoldali idegkímélő műtéten átesett betegeket vontak be a vizsgálatba. A betegeknél a műtéthez szükséges vizsgálatokon (általános fizikális vizsgálat, rutin labor, mellkasröntgen/CT, has+medence CT, csontizotóp) túlmenően szérum tesztoszteron-meghatározás és a Merevedés Minőségi Mutatója (MMM) kérdőív kitöltése történt meg, ez utóbbi adat alapján következtettek a preoperatív merevedési funkcióra (17). A preoperatív MMM-pontszám alapján a megtartott erektilis funkciójú betegeket (MMM 17–25 között) választották be a tanulmányba. A pénisz-rehabilitációs csoportba a 2015–2016-os időszakból 26 beteg került beválasztásra (az ebben az időszakban operált betegek 60,5%-a). A 2012–2015-ös időszakból kiválasztott kontrollcsoportban 25 beteg adatát dolgozták fel (az időtartam összes operált betegének 56,8%-a). A beválasztott betegek életkora a rehabilitációs csoportban 52–70 év (átlagéletkor: 62,2 év), míg a kontrollcsoport esetén 51–73 év (átlagéletkor: 62,3 év) volt. Az első csoportban a katéterkivétel után kezdett avanafil szedését 24 beteg folytatta 60 napig, 2 beteg sikertelenség, illetve a nemi élet szükségessége megítélésének változása miatt megszakította a kezelést.
A műtét utáni 7-11. napon a katéter eltávolításra került, ezt követően a páciensek 24 óránként 100 mg avanafilt szedtek 60 napig. Ettől – indokolt esetben – alkalmanként legfeljebb 12 órával eltérhettek. Ebben az időszakban az elérendő célok között szerepelt, hogy a betegeknek hetente 2-4 alkalommal legyen – bármilyen minőségű – erekciója. A betegek megfelelő tájékoztatást kaptak arról, hogy a merev állapot segíti a szöveteket egészségesen tartani, továbbá a gyógyszer hatásmechanizmusáról, kiemelve, hogy a PDE-5-gátlók szexuális stimulusra fejtik ki hatásukat. Ennek megfelelően vizuális és/vagy taktilis ingerek igénybevétele javasolt volt. A merevedés eléréséhez a gyógyszert az ajánlás szerint a szexuális tevékenység indítása előtt 15-60 perccel vették be. Étkezési, illetve alkoholfogyasztási korlátozások nem kerültek meghatározásra.
A célok (merevedés, közösülés) elérésének méréséhez a már említett MMM-kérdőívet, valamint – az adatok egyértelműsítése és a könnyebb feldolgozhatóság kedvéért – egy speciális, erre a célra összeállított kérdéssort használtak. Ez utóbbi eldöntendő kérdésként tartalmazta a vizsgálat végpontjait is: közösülés megkezdéséhez elegendő merevedés, sikeres közösülés. Az avanafil csoportban a gyógyszer állandó szedése utáni időszakra két további kérdés vonatkozott (1. táblázat). A műtét utáni életminőség mérése EQ-5D és vizuális analóg skála (VAS 0-100%) alkalmazásával történt. A betegek a posztoperatív 6-9. hónapban töltötték ki a kérdőíveket. A szerzők az információhoz személyes kontrollvizsgálatok során, illetve esetenként telefonos interjúk által jutottak hozzá.
Eredmények
A betegek jól tolerálták a kezelést. Gyógyszerrel kapcsolatos súlyos nemkívánatos esemény nem fordult elő. Gyógyszer-mellékhatás miatt nem volt szükség terápia beszüntetésre. Nem farmakológiai okok miatt a betegek kis hányada (7,7%) szakította meg a gyógyszerszedést.

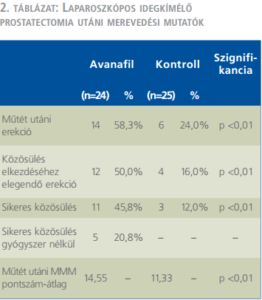
A vizsgálat eredményeinek erekcióval kapcsolatos részét a 2. táblázat foglalja össze.
Az egyik végpont – a közösüléshez szükséges merevedés elérése – az avanafilt szedő betegek 50%-ában valósult meg (n=12), szemben a kontrollcsoport 16%-ával (n=4).
Másik végpontként a sikeres közösülés létrejötte szerepelt. 11 beteg (45,8%) volt képes coitusra gyógyszer szedése mellett, a gyógyszermentes csoportban regisztrált 3 beteggel (12%) szemben.
A közösülést kivitelezni képes betegek műtét utáni MMM-pontszám átlaga az avanafil hatóanyagcsoportban 14,5 volt, míg a kontrollcsoportban 11,3. Az eltérés statisztikailag szignifikáns (p<0,01).
Az avanafilt kapott betegcsoportból 5 beteg (20,8%) nyilatkozott úgy, hogy képes a közösülésre a gyógyszer elhagyását követően, további gyógyszer szedése nélkül.
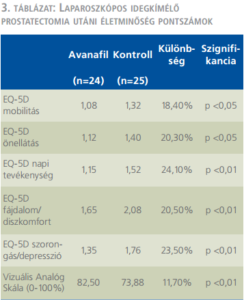
Az életminőségi mutatók eredményeinek összefoglalását szemlélteti a 3. táblázat. Az EQ-5D-5L kérdőív valamennyi dimenziója, továbbá a Vizuális Analóg Skála (0-100%) értékei is szignifikáns különbséget mutatnak az avanafil csoport javára.
Az adatok jelenleg nem elegendőek további analízishez: pl. korcsoportok szerinti bontás, preoperatív MMM-pontszám szerinti csoportosítás stb. Egy multicentrikus felmérés segíthetné a további adatgyűjtést és feldolgozást.
A szerzők kiemelik, hogy az adatok nem prospektív, randomizált tanulány keretein belül kerültek kiértékelésre, az avanafil hatóanyagot kapott betegcsoport és a gyógyszert nem kapott betegek adatainak metakron feldolgozása történt. Ezt a tényt azért fontos hangsúlyozni, mert a 4,5 éves időszakban némiképpen változtak a műtéti technika finom részletei, javult az idegkímélet metodikája. Ezek a paraméterek szintén közrejátszhattak az eredmények javulásában.
Megbeszélés
A poszt-prostatectomiás merevedési zavar a leggondosabb idegkímélő technika mellett is gyakori szövődmény. A pénisz-rehabilitáció pontos programja jelenleg még nem meghatározott, de a legtöbb leírás elsőként választandó módszerként javasolja a PDE-5-gátló gyógyszereket, amelyek egyszerű használhatóságuknál fogva áttörést jelentettek a barlangos szövetek keringésének, oxigenizációjának műtét utáni javításában (18, 19). A korai stimulálás akár a katétereltávolítást követően megkezdhető. Ebben az időszakban kívánatos, hogy hetente kb. 3-szor létrejöjjön erekció (20, 21).
Bannowsky és munkatársai 2008-ban napi 25 mg sildenafillel végeztek vizsgálatot, a gyógyszerszedést közvetlenül a katéterkivétel után indítva. A 43 beteg 95%-ának volt erekciója már az első éjszaka. A vizsgálat első évében az IIEF-pontszám 3,6-ról 14,1-re nőtt, míg a kontrollcsoportban 2,4-ről 9,3-ra. A különbséget p<0,001 szinten szignifikánsnak találták (15).
Raina és munkatársai szintén 2008-ban közölték felmérésük eredményeit: 12 hétig adagolt napi 50 mg sildenafil szedését követően az utánkövetés 11. hónapjában a betegek 27%-a volt képes spontán erekcióra, amely szignifikánsan jobb volt a kontrollcsoport 4%-os eredményénél (20).
Riesz és munkatársai 2009-es cikkükben 64 radikális prostatectomián átesett beteg visszajelzéséről számolnak be, amelyek közül 18 beteg (28%) PDE-5-gátlóval, 10 beteg (16%) intracavernosus injekcióval, 1 beteg (1,8%) vákuumos eszközzel, 8 beteg (13%) pedig kezelés nélkül is képes az erekcióra (22).
Avanafil hatóanyaggal Mulhall és munkatársai 298 beteg bevonásával végeztek kettős vak, placebokontrollált vizsgálatot 2013-ban. Eredményeik megmutatták, hogy 12 hetes avanafil kezelés után az erektilis funkció jelentős javulása volt megfigyelhető. A 100 és 200 mg-os avanafil adagok statisztikailag szignifikánsan hatásosabbak voltak a placebónál mindhárom együttesen előforduló elsődleges végpontot illetően (vaginális bevezetés, sikeres közösülés, IIEF-pontszám változása)
(p <0,01). Az avanafil a bevétel után gyorsan, 15 percen belül kifejtette a hatását, és egyes betegeknél 6 órán túl is hatásos maradt, ami arra utal, hogy megfelelő lehet az enyhe-súlyos ED-k szükség szerinti kezelésére (23, 24).
A 100 mg avanafil hatóanyaggal végzett pénisz-rehabilitáció jelen felmérés eredményei alapján minden vizsgálati végponton (közösüléshez szükséges erekció létrejötte, sikeres közösülés, műtét utáni MMM-pontszám növekedése, életminőségi mutatók javulása) szignifikáns különbség volt kimutatható a gyógyszeres csoport javára. A fenti eredmények alapján az idegkímélő technikával kivitelezett radikális prostatectomiák után a hímvessző korai keringésjavító módszerei között a legújabb foszfodiészteráz-5-gátlónak, az avanafilnak is helye van.
A rehabilitáció jelenleg elérhető és ajánlott formái a betegek részéről jól tolerálhatóak, és hatékonyságukat illetően is biztatóak az eredmények. A pénisz-rehabilitáció programjára azonban egyelőre nincs egyetlen, minden szempontból ajánlható terápiás algoritmus. A standardizált menetrend kidolgozása valószínűleg további klinikai vizsgálatok alapján fog megtörténni (22, 25).
Irodalomjegyzék:
1. Penson DF, Litwin MS. Quality of life after treatment for prostate cancer. Curr Urol Rep 2003 Jun; 4(3): 185–95. DOI: https://doi.org/10.1007/s11934–003–0068–1
2. Litwin MS, Gore JL, Kwan L, et al. Quality of life after surgery, external beam irradiation, or brachytherapy for early-stage prostate cancer. Cancer 2007 Jun 1; 109(11): 2239–47. DOI: https://doi.org/10.1002/cncr.22676
3. Walsh PC, Donker PJ. Impotence following radical prostatectomy: insight into etiology and prevention. J Urol 1982 Sep; 128(3): 492–7. DOI: https://doi.org/10.1016/j.juro.2016.10.105
4. Walsh PC, Lepor H, Eggleston JC. Radical prostatectomy with preservation of sexual function: anatomical and pathological considerations. Prostate 1983; 4: 473–485. DOI: https://doi.org/10.1002/pros.2990040506
5. Dubbelman YD, Dohle GR, Schröder FH. Sexual function before and after radical retropubic prostatectomy: a systematic review of prognostic indicators for successful outcome. Eur Urol 2006; 50: 711–720. DOI: https://doi.org/10.1016/j.eururo.2006.06.009
6. Kundu SD, Roehl KA, Eggener SE, et al. Potency, continence and complications in 3,477 consecutive radical retropubic prostatectomies. J Urol 2004 Dec; 172(6 Pt 1): 2227–31. DOI: https://doi.org/10.1097/01.ju.0000145222.94455.73
7. Rabbani F, Stapleton AM, Kattan MW, et al. Factors predicting recovery of erections after radical prostatectomy. J Urol 2000 Dec; 164(6): 1929–34. DOI: https://doi.org/10.1016/S0022-5347(05)66921–2.
8. Nandipati KC, Raina R, Agarwal A, et al. Erectile dysfunction following radical retropubicprostatectomy: epidemiology, pathophysiology and pharmacological management. Drugs Aging 2006; 23: 101–117. DOI: https://doi.org/10.2165/00002512–200623020–00002
9. Mulhall JP, Slovick R, Hotaling J, et al. Erectile dysfunction after radical prostatectomy: hemodynamic profiles and their correlation with the recovery of erectile function. J Urol 2002 Mar; 167(3): 1371–5. DOI: https://doi.org/10.1016/S0022–5347(05)65303–7.
10. Ferrini MG, Davila HH, Kovanecz I, et al. Vardenafil prevents fibrosis and loss of corporal smooth muscle that occurs after bilateral cavernosal nerve resection in the rat. Urology 2006 Aug; 68(2): 429–35. DOI: https://doi.org/10.1016/j.urology.2006.05.011
11. Schwartz EJ, Wong P, Graydon RJ. Sildenafil preserves intracorporeal smooth muscle after radical retropubic prostatectomy. J Urol 2004 Feb; 171(2 Pt 1): 771–4. DOI: https://doi.org/10.1097/01.ju.0000106970.97082.61
12. Kirschner-Hermanns R, Jakse G. Quality of life following radical prostatectomy. Crit Rev Oncol Hematol 2002 Aug; 43(2): 141–51. DOI: https://doi.org/10.1016/S1040–8428(02)00026–4
13. Meyer JP, Gillatt DA, Lockyer R, et al. The effect of erectile dysfunction on the quality of life of men after radical prostatectomy. BJU Int 2003; 92: 929–931. DOI: https://doi.org/10.1046/j.1464–410X.2003.04530.x
14. Gandaglia G, Gallina A, Suardi N, et al. Preoperative erectile function is the only predictor of the use of a high number of phosphodiesterase type-5 inhibitors after bilateral nerve-sparing radical prostatectomy. Int J Impot Res 2014; 26: 201–4. DOI: 10.3978/j.issn.2223–4683.2015.02.01
15. Bannowsky A, Schulze H, van der Horst C, et al. Recovery of erectile function after nerve-sparing radical prostatectomy: improvement with nightly low-dose sildenafil. BJU Int 2008; 101: 1279–1283. DOI: https://doi.org/10.3978/j.issn.2223–4683.2015.02.01
16. Gandaglia G, Suardi N, Gallina A, et al. Extended pelvic lymph node dissection does not affect erectile function recovery in patients treated with bilateral nerve-sparing radical prostatectomy. J Sex Med 2012; 9: 2187–94. DOI: https://doi.org/10.1111/j.1743–6109.2012.02812.x
17. Papp Gy. Az erectilis funkció nemzetközi mutatója (EFNM) és a merevedés minőségi mutatója (MMM) kérdőívei. Magy Androl 1999; 2: 34–38.
18. Teloken P, Mesquita G, Montorsi F, et al. Post-radical prostatectomy pharmacological penile rehabilitation: practice patterns among the international society for sexual medicine practitioners. J Sex Med 2009; 6: 2032–8. DOI: https://doi.org/10.1111/j.1743–6109.2009.01269.x
19. Tal R, Teloken P, Mulhall JP. Erectile function rehabilitation after radical prostatectomy: practice patterns among AUA members. J Sex Med 2011; 8: 2370–6. DOI: https://doi.org/10.1111/j.1743–6109.2011.02355.x
20. Raina R, Pahlajani G, Agarwal A, et al. Early penile rehabilitation following radical prostatectomy: Cleveland clinic experience. Int J Impot Res 2008; 20: 121–126. DOI: https://doi.org/10.1038/sj.ijir.3901573
21. Rusz A. A foszfodiészteráz-bénítók alkalmazása a merevedési zavarok korszerű gyógyszeres kezelésére. Urol Szemle 2003; 1: 5–10.
22. Riesz P, Rusz A, Szűcs M, et al. A merevedési zavar megelőzése és kezelésének lehetőségei radikális prostatectomia után. Orv Hetil 2009; 18: 831–837. DOI: https://doi.org/10.1556/OH.2009.28569
23. Mulhall JP, Burnett AL, Wang R, et al. A phase 3, placebo-controlled study of the safety and efficacy of avanafil for the treatment of erectile dysfunction after nerve-sparing radical prostatectomy. J Urol 2013; 189: 2229–36. DOI: https://doi.org/10.1016/j.juro.2012.11.177
24. Mulhall JP, Moul JW, Wang R, et al. A randomized, double-blind, placebo-controlled, parallel-group, multicenter study of the safety and efficacy of avanafil in the treatment of erectile dysfunction following bilateral, nerve-sparing radical prostatectomy. Cancer Survivalship and Sexual Health Symposium 2011.
25. Clavell-Hernandez J, Wang R. Penile rehabilitation following prostate cancer treatment: review of current literature. Asian J Androl 2015; 17: 916–22. DOI: https://doi.org/10.4103/1008-682X.150838.