2018-1 —- Full Articles
Surgical treatment of a huge scrotal elephantiasis
DOI: 10.22591/magyurol.2018.1.magyara.17
Authors:
Magyar András dr., Póth Sándor dr., Köves Béla dr., Tenke Péter dr.
Jahn Ferenc Dél-pesti Kórház és Rendelőintézet, Urológiai Osztály, Budapest (osztályvezető: Tenke Péter dr.)
Summary
Objective: While in subtropical areas elephantiasis of the scrotum, or scrotal lymphedema is a common disease, caused by endemic filariasis, in Hungary, this condition is rarely seen. In Europe the most common cause of scrotal elephantiasis is the occlusion of lymphatic vessels secondary to other medical disorders. We wish to demonstrate the proper diagnostic workup and the surgical management of a giant scrotal lymphedema.
Case report: Our patient is 66 years old, has not been abroad recently and has already undergone an abdominal reconstruction due to lymphedema before. Following laboratory testing and ultrasound examination, a biopsy of the scrotum was performed, which did not prove the presence of any malignancy or inflammation. After counselling with a plastic surgeon, the enormous scrotal mass was surgically removed, followed by plastic reconstructive surgery of the scrotum. The wound healed without any complication and the patient has reported a significant improvement in his quality of life.
Conclusion: The physician should find out if the patient has travelled to an area where filariasis is endemic. To exclude malignancy, biopsy of the scrotum might be necessary. The reconstruction of the scrotum requires plastic surgical expertise.
LAPSZÁM: MAGYAR UROLÓGIA | 2018 | 30. ÉVFOLYAM, 1. SZÁM
Összefoglalás
Bevezetés: A szubtrópusi övezetben endémiás filariasis okozta scrotalis elephantiasis, avagy scrotalis lymphoedema hazánkban elvétve fordul elő. Európában a leggyakrabban a scrotum egyéb okból adódó nyirokelvezetési zavara áll a betegség hátterében. Egy rendkívül nagyméretű scrotalis lymphoedema szakszerű kivizsgálását és sebészeti ellátását kívánjuk bemutatni.
Esetismertetés: 66 éves páciensünk nem járt külföldön, lymphoedema miatt korábban már átesett hasi rekonstrukción. A labor- és ultrahangvizsgálatokon kívül szövettani mintavétel is történt, amely scrotalis lymphoedemát igazolt, gyulladás és daganat jelei nélkül. Plasztikai sebészeti konzíliumot követően a nagyméretű elváltozás sebészeti reszekcióját és a scrotum plasztikai rekonstrukcióját végeztük. A páciens sebe szövődménymentesen gyógyult, a műtéti kezeléssel a páciens jelentős életminőségbeli javulását értük el.
Következtetések: A kivizsgálás fontos eleme az alapos anamnézisfelvétel, illetve a páciens esetleges, endémiás területre történő külföldi utazásának kiderítése. Ezen kívül fontos a malignitás kizárása, amelynek érdekében szükségessé válhat a szöveti mintavétel. A műtéti megoldás során plasztikai sebészeti ismeretek szükségesek.
Bevezetés
A scrotalis lymphoedema, másnéven scrotalis elephantiasis hazánkban ritkán előforduló krónikus állapot, amely a herezacskó masszív megnagyobbodásával jár. A betegség leggyakrabban a trópusi és szubtrópusi övezetben fordul elő, ahol hátterében endémiás filariasis okozta nyirokút-obstrukció áll, amely a scrotum kötőszöveteinek jelentős hipertrófiáját, hiperpláziáját és folyadék-felhalmozását okozza (1). Nyirokúti filariasis 120 millió embert érint világszerte, 40 millió betegnél okozva torzulást, vagy rokkantságot (2). Endémiás területeken a férfiak 50%-ában eredményezhet scrotalis elváltozást (3).
Az elephantiasist Európában és más fejlettebb országokban általában egyéb eredetű nyirokút-elzáródás következtében kialakult nyirokkeringési zavar okozhatja, úgymint sebészeti nyirokcsomó-eltávolítás, sérülés, trauma, sugárkezelés, tumor, vagy infekció (lymphogranuloma venereum) (4–7). Hazánkban a scrotalis lymphedema incidenciája nehezen felbecsülhető, hiszen Európában rendkívül ritkán fordul elő. Tanulmányozására korlátozott mennyiségű esettanulmány áll rendelkezésre.
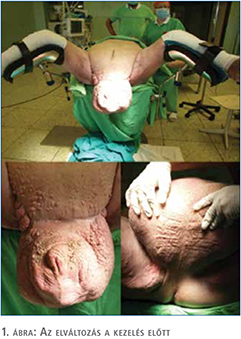
Esettanulmányunk során hatalmas méretű, térdig érő elephantiasis sikeres műtéti megoldását, posztoperatív sebkezelési stratégiáját kívánjuk szemléltetni. Páciensünk scrotuma 10 kg tömegűre növekedett, ami életminőségét jelentősen rontotta, járását, önellátását csaknem ellehetetlenítette.
Esetismertetés
Anamnézis
Hatvanhat éves, 135 kg-os páciensünk anamnézisében nem inzulin dependens diabetes mellitus (NIDDM), pitvarfibrilláció, 14 éve fennálló lymphoedema szerepel. Két évvel ezelőtt hasplasztikán esett át kötényhas miatt, ekkor 26 kg szövetet reszekáltak. A hasplasztikát követő két év alatt hatalmas méretű, térdig érő scrotalis lymphoedema fejlődött ki. A páciens nem járt külföldön, nem találtak nála infekciót, daganatos elváltozást, illetve onkológiai kezelésben sem részesült.
Panaszok, tünetek és a megoldandó probléma
Páciensünk masszív scrotalis megnagyobbodással jelentkezett ambulanciánkon. Az elváltozás jelentősen rontotta a páciens mobilitását, életminőségét, vizelési készségét és higiéniás önellátását, szociális életét, mindezek mellett nagy pszichés terhet jelentett számára. A műtét előtt készült fénykép az elváltozásról az 1. ábrán látható. A betegnek a műtétet megelőzően nem volt merevedési funkciója (Merevedés Minőségi Mutatója: 0 pont). A pácienst tájékoztattuk, hogy a műtét során a herék eltávolításra kerülhetnek, amit tudomásul vett és nem ragaszkodott a herék megtartásához.
Diagnosztikai vizsgálatok eredményei
Fizikális vizsgálata során nagymértékű obezitás és a térdig érő scrotális terime volt tapasztalható, ezeken kívül egyéb számottevő kóros eltérés nem igazolódott.
A herék nem voltak tapinthatók és a hímvessző sem volt látható. A húgycsőnyílás mélyen a scrotumba volt ágyazódva, ennek ellenére katéter nélkül tudott vizelni, gyenge sugárban, a scrotum bőre és a fitymabőr által képződött csatornán keresztül. Laborvizsgálata, hasi-kismedencei ultrahang és hereultrahang vizsgálata daganatra, vagy infekcióra utaló kóros eltérést nem igazolt.
Differenciáldiagnosztikai lépések, megfontolások, társszakmai konzíliumok
A műtéti megoldást megelőzően elsősorban malignus daganat kizárása céljából a herezacskó biopsziáját végeztük (Bart biopty gun segítségével). A kórszövettani vizsgálat heges kötőszöveti átalakulást igazolt, ezen kívül egyéb kóros elváltozást nem mutatott. A műtéti megoldás plasztikai sebészeti vonatkozásainak megbeszélésére plasztikai sebészeti konzíliumot kértünk.
Javasolt terápia, műtéti megoldás leírása
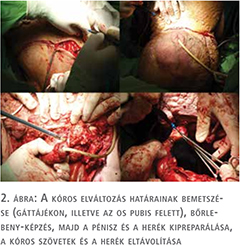
A scrotalis elephantiasis legoptimálisabb kezelése az elváltozás sebészi eltávolítása (8). A terime reszekcióját és a scrotum rekonstrukcióját, konzíliumot követően, plasztikai sebész jelenlétében végeztük. A beavatkozás során 10 kg szövetet reszekáltunk. A műtét során a heges környezetbe beágyazott atrofizált herék eltávolítása mellett döntöttünk. A péniszt bőrlebenyen keresztül a gátra ültettük ki. A sebet feszülésmentesen zártuk.
A plasztikai sebész javaslatára a műtéti seb alsó sebzugában körülbelül 5 cm-es nyílást hagytunk, amelyre speciális vákuum-szívó drén rendszert csatlakoztattunk.
Az eszköz egy a sebbe helyezett szivacsból és egy hozzá csatlakoztatott elektronikus szívóberendezésből áll.
A vákuum asszisztált sebkezelés közismert és népszerű plasztikai sebészeti eljárás, amely égési sebek és többek között lymphoedemás bőrelváltozások rekonstrukciója során alkalmaznak (9). Az elektronikus rendszer által generált vákuum jelentősen felgyorsítja a sebgyógyulást, mivel a váladékok folyamatos eltávolítását biztosítja, emellett javítja a szövetek regenerációs képességét.
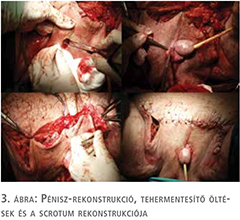
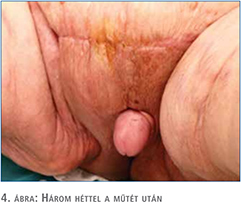
A posztoperatív szak eseménytelenül zajlott, a sebváladékozás fokozatosan megszűnt, a vákuum-szívó drén rendszert 4 nap után eltávolítottuk, sebe fokozatosan begyógyult. A végleges kórszövettani vizsgálat malignitást nem igazolt. A műtéti megoldás lépéseit a 2–4. ábrákon szemléltetjük. A páciens később az életminőségében tapasztalt jelentős javulásról számolt be és lehetővé vált számára a rendszeres testmozgás. A 4. ábrán szemléltetjük a gyógyult állapotot, a műtét után három héttel. Urológiai sebészeti ambulanciánkon három héten keresztül történt a nyomonkövetés, amely során sebe maratéktalanul begyógyult, további rekonstrukcióra nem volt szükség. Három héten túl történő kontrollja, további gondozása, tesztoszteronszint beállítása a lakhelyén illetékes urológiai szakrendelésen zajlott.
Megbeszélés
A scrotalis lymphoedemának számos oka ismert, amelyek közül a leggyakoribb a trópusi-szubtrópusi övezetben honos filariasis, míg a fejlettebb országokban legtöbbször sebészeti nyirokcsomó-eltávolítás, sérülés, trauma, sugárkezelés, tumor, vagy infekció okozta másodlagos nyirokút-elzáródás áll a betegség hátterében. Európában a scrotalis elephantiasist igen ritka betegségként tartják számon. Előfordulása az Amerikai Egyesült Államokban növekvő tendenciát mutat (9). A műtéti megoldásnak két alapvető módja ismert:
- a nyirokutak helyreállítása,
- a nyirokutak, illetve nyirokszövet eltávolítása.
A nyirokutak helyreállítási módjának kidolgozására a történelem során többféle próbálkozás történt, ezüst, fém, vagy műanyagcsövek beültetésével (10). A nyirokutak helyreállítását ma a nyirokutak anasztomózisa, vagy nyirokér-véna anasztomózis képzése útján végzik. Kisfokú, kimutatható nyirokút-elzáródás esetén alkalmazható ez az eljárás még a hegesedés megjelenése előtt (8).
Az 1950-es években történtek próbálkozások a scrotum combhoz történő rögzítésével, ami nem jelentett definitív megoldást. Később a kóros többletszövetek eltávolítására és a scrotum rekonstrukciójára számos technikai megoldás született (1). A legjobb eredményeket, a scrotalis lebenyekkel történő plasztikai rekonstrukcióval érhetjük el (11). Mediális comblebenyek szintén sikeresen alkalmazhatók, amennyiben nincs elegendő ép scrotumbőr. A mesh graft plasztika pedig széles körben elfogadott eljárás a péniszbőr-defektusok fedéséhez. Az egyik legnagyobb vizsgálat egy 350 esetet bemutató esettanulmány, amely filariasis okozta scrotalis elephantiasis sebészi eltávolításának eredményességét vizsgálja. A péniszbőr rekonstrukcióját félvastag bőrgraftok segítségével végezték.
A scrotumot elcsúsztatott bőrlebenyek segítségével állították helyre (1). Általános szövődményarányuk 19,4% volt. Fertőzés 10,2%-ban, haematoma 8,2%-ban, míg recidíva 7,3%-os arányban jelentkezett, amelyet a szerzők a filariasis elleni gyógyszerek elhagyásával magyaráztak.
Egy másik vizsgálat 70 páciens esetét mutatja be, ahol scrotumbőr rekonstrukcióját félvastag bőrgraft segítségével végezték. A nyomonkövetés 0,5–6 évig történt. A scrotum eltávolítását követően a határos bőrterületeket használták a rekonstrukcióhoz. A hímvessző bőrének rekonstrukcióját félvastag bőrgraftok segítségével oldották meg, amellyel véleményük szerint jobb taktilis és erekciós eredmények érhetők el, mint lebenyképzéssel. A műtéttel az életminőség, penetrációképesség és a szexuális elégedettség javulását érték el a betegeknél, és csupán egy esetben volt szükség ismételt műtétre, 2 év után jelentkező recidíva miatt (6).
Páciensünk kivizsgálása során a betegségének egyértelmű, bizonyítható oka nem igazolódott. Extrém túlsúlya szerepet játszhatott a lymphoedema kialakulásában. Ismert, hogy a túlsúlyos betegek bőr alatti szöveteiben nagyobb mennyiségben található intersticiális folyadék és nagyobb a szövetek nyirokutakra gyakorolt nyomása. A kialakult nyirokpangást fokozza a testmozgás hiánya. A nyirokkeringés zavara kifejezettebben érvényesül a lógó testtájakon (12, 13). Elképzelhető, hogy az anamnézisében szereplő kötényhasat is részben nyirokkeringési zavar okozhatta, amelynek sebészeti megoldását követően fejlődött ki a lymphoedema a scrotumban.
A scrotalis elephantiasis műtéti rekonstrukciója során törekednünk kell a herék megóvására, amikor elegendő bőrmennyiség áll rendelkezésre a scrotum-rekonstrukcióhoz. Betegünknél a kiterjedt heges környezetben lévő herék atrófiás jellege miatt a herék eltávolítása mellett döntöttünk. Extrém méretű elephantiasis műtéti megoldása komoly kihívást jelenthet, kiemelten fontos a plasztikai műtétekben, bőrlebenyképzésben való jártasság. Megfelelő technikával és posztoperatív sebkezeléssel jó eredmények érhetők el.
References
1. Dandapat MC, Mohapatro SK, Patro SK. Elephantiasis of the penis and scrotum. A review of 350 cases. American journal of surgery. 1985; 149(5): 686–90. https://doi.org/10.1016/S0002-9610(85)80156-2
2. http://www.who.int/mediacentre/factsheets/fs102/en/. WHO website. 2018.01.26.
3. https://www.cartercenter.org. The Carter Center “Lymphatic Filariasis Elimination Program”. 2008–07–20.
4. McDougal WS. Lymphedema of the external genitalia. The Journal of urology. 2003; 170(3): 711–6. https://doi.org/10.1097/01.ju.0000067625.45000.9e
5. Gurinder Singh ASS. Giant Peno-scrotal elephantiasis. International Journal of Clinical Cases and Investigations 2011; 3(1): 16–20.
6. Modolin M, Mitre AI, da Silva JC, Cintra W, Quagliano AP, Arap S, et al. Surgical treatment of lymphedema of the penis and scrotum. Clinics 2006; 61(4): 289–94. https://doi.org/10.1590/S1807-59322006000400003
7. Sauer PF, Bueschen AJ, Vasconez LO. Lymphedema of the penis and scrotum. Clinics in plastic surgery. 1988; 15(3): 507–11.
8. Brotherhood HL, Metcalfe M, Goldenberg L, Pommerville P, Bowman C, Naysmith D. A surgical challenge: Idiopathic scrotal elephantiasis. Canadian Urological Association journal = Journal de l’Association des urologues du Canada 2014; 8(7–8): E500–7. https://doi.org/10.5489/cuaj.1739
9. Stokes THMF, Keith E. BA‡; Silverstein, Ari D. MD†; Weizer, Alon Z. MD†; Donatucci, Craig F. MD†; Anderson, Everett E. MD†; Erdmann, Detlev MD, PhD*. Use of Negative-Pressure Dressings and Split-Thickness Skin Grafts Following Penile Shaft Reduction and Reduction Scrotoplasty in the Management of Penoscrotal Elephantiasis. Annals of Plastic Surgery 2006; 56(6): 649–653. https://doi.org/10.1097/01.sap.0000202826.61782.c9
10. C K. Lymphoedema of penis and scrotum. Br J Plast Surg 1968; 21: 38t–6.
11. Denzinger S, Watzlawek E, Burger M, Wieland WF, Otto W. Giant scrotal elephantiasis of inflammatory etiology: a case report. Journal of medical case reports 2007; 1: 23. https://doi.org/10.1186/1752-1947-1-23
12. Cintra Junior W, Modolin ML, Rocha RI, Fernandes TR, Nogueira AB, Gemperli R. Results of surgical treatment of massive localized lymphedema in severely obese patients. Revista do Colegio Brasileiro de Cirurgioes 2014; 41(1): 18–22. https://doi.org/10.1590/S0100-69912014000100005
13. Yosipovitch G, DeVore A, Dawn A. Obesity and the skin: skin physiology and skin manifestations of obesity. Journal of the American Academy of Dermatology. 2007; 56(6): 901–16; quiz 17–20.
https://doi.org/10.1016/j.jaad.2006.12.004
Bladder augmentation: a treatment for neurogenic bladder dysfunction
DOI: 10.22591/magyurol.2018.1.kubika.12
Authors:
Kubik András dr., Keszthelyi Attila dr., Nyirády Péter dr., Majoros Attila dr.
Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum, Budapest (igazgató: Nyirády Péter dr.)
Summary
Objective: Treatment of neurogenic bladder dysfunction is staggered, based on intermittent self-catheterization (CIC) in many cases. Unfortunately, over time either primarily or during progression in such cases urinary bladder becomes high pressured, reduced capacitated and expanded. If other minimal invasive treatments (such as clean intermittent catheterisation, anticholinergics, botulinum toxin, sphincterotomy) fail to reduce urinary bladder pressure and increase its capacity, compliance, then augmentation of bladder with excluded ileum section may result a good solution in high pressure reflux, renal impairment and recurrent urinary tract infections causing permanent disease.
Patients and methods: At our clinic, a 23-year-old and a 28-year-old female patient had open bladder augmentation due to neurogenic bladder dysfunction. In both cases, congenital spinal cord disorders (congenital sacrum agenesia or meningomyelocele) formed the basis for neurogenic bladder dysfunction. Conservative (anticholinergicum + CIC) and minimal invasive (botox intradetrusor injection) therapy was ineffective; bladder augmentations with excluded ileum sections were performed in both patients.
Results: Following the operation, the patients’ continence was improved, the numbers of urinary tract infections were decreased and their urinary bladder was still emptied by intermittent catheterization. The control urodynamic study demonstrated a significant increase in bladder capacity and compliance.
Conclusion: The first-line therapy, in many cases the base therapy for neurogenic bladder dysfunction is intermittent self-catheterization. If the conservative treatment does not manage to maintain low pressure, good compliance and capacity of the bladder, then augmentation of the urinary bladder is recommended with bowel application.
LAPSZÁM: MAGYAR UROLÓGIA | 2018 | 30. ÉVFOLYAM, 1. SZÁM
Összefoglalás
Bevezetés: A neurogén húgyhólyag-diszfunkció kezelése lépcsőzetes, elsővonalbeli kezelésében jelentős szerep jut az intermittáló önkatéterezésnek. Sajnos sok betegnél a húgyhólyag primeren, vagy az állapot progressziója következtében idővel magasnyomásúvá és/vagy csökkent kapacitásúvá, tágulékonyságúvá válik. Amennyiben egyéb kevéssé invazív kezelésekkel (intermittáló katéterezés – CIC), anticholinergicum, botulinum toxin, sphincterotomia) nem sikerül a húgyhólyag nyomását csökkenteni, illetve kapacitását, tágulékonyságát (compliance) növelni, akkor a hólyag kirekesztett bélszakaszszal történő megnagyobbítása (augmentáció) végezhető. A magasnyomású és/vagy kis kapacitású, rossz tágulékonyságú hólyagműködés okozta reflux, következményes vesekárosodás és recidív húgyúti fertőzés ezzel végleg megszüntethető.
Betegek és módszerek: Klinikánkon egy 23 éves és egy 28 éves nőbetegnél végeztünk neurogén húgyhólyag-diszfunkció miatt nyílt húgyhólyag-augmentációt. Mindkét esetben veleszületett gerincfejlődési rendellenességek (kongenitális sacrum agenesia, illetve meningomyelocele) képezték a neurogén eredetű húgyhólyag működési zavar alapját. Konzervatív (anticholinergicum + CIC) és minimál invazív (botox intradetrusor injekció) terápia hatástalansága miatt mindkét betegnél kirekesztett ileum szakasszal történő húgyhólyag-augmentáció végzésére kényszerültünk.
Eredmények: A műtéteket követően mindkét beteg kontinenciája javult, a húgyúti fertőzések száma csökkent, húgyhólyagjukat továbbra is intermittáló katéterezéssel ürítik. A kontroll urodinamikai vizsgálat a hólyagkapacitás és compliance szignifikáns növekedését igazolta.
Következtetések: A neurogén húgyhólyag-diszfunkció elsővonalbeli kezelési lehetőségét, sok esetben annak bázisterápiáját az intermittáló önkatéterezés jelenti. Amennyiben konzervatív kezelés segítségével nem sikerül az alacsony nyomású, jó tágulékonyságú és kapacitású hólyagműködés megtartása, akkor a húgyhólyag bélszakasszal történő augmentációját javasolt elvégezni.
Bevezetés
A neurogén hólyagdiszfunkció magyar szakirodalomban is megtalálható rövidítése (NLUTD) az angol megfelelőjéből (neurogenic lower urinary tract dysfunction) ered (1). Leginkább veleszületett, vagy szerzett ideggyógyászati betegségek, sérülések következtében alakulnak ki a neurogén eredetű vizelettartási vagy ürítési zavarok, amelyek gyakran kombinálódnak. A vizelettartás és -ürítés normális szabályozásához az ép húgyhólyag és záróizom-apparátus mellett, a sacralis 2–4-es gerincvelői szegmentumokban elhelyezkedő intakt vizelési központra, a vizelési inger tudatosulásához szükséges, sértetlen agyi centrumra, illetve a húgyutak és a szabályozó idegi központok közötti érintetlen afferens és efferens idegpálya kapcsolatokra van szükség. Amennyiben ebben a bonyolult és kifinomult rendszerben bárhol hiba keletkezik, az a vizelettartás és -ürítés funkcionális panaszával járhat (2).
A neurogén hólyagfunkció-zavarok felosztása történhet a kiváltó ok szerint, amelyek között megkülönböztetünk veleszületett betegségeket (pl. meningomyelocele), illetve szerzett elváltozásokat (sérülés, tumor, gyulladás, sclerosis multiplex stb). A károsodás elhelyezkedése alapján elkülönítünk felső és alsó motoneuron léziót (FMNL, AMNL), előbbi a sacralis vizelési központ (S2-4) szintje felett elhelyezkedő spinalis vagy suprapontin károsodás esetén keletkezik és többnyire spasztikus jellegű hólyag és záróizom működési zavarokkal járhat. Az alsó motoneuron lézió esetén a sacralis vizelési központban, vagy annak szintje alatt helyezkedik el az idegrendszeri károsodás és petyhüdt, funkciózavarok észlelhetők. A spasztikus alsó húgyúti funkciózavarra jellemző a detrusor-túlműködés és a következményes vizeletinkontinencia, amely gyakran detrusor sphincter disszinergiával együttesen jelentkezik. Ebben az esetben az akaratlan vizeletvesztés mellett vizeletretenció is jelentkezik. A spasztikus típusú hólyagfunkció-zavar legveszélyesebb formáiban magasnyomású (detrusor nyomás a tárolási szakaszban 40 vízcm fölé emelkedik) vagy csökkent tágulékonyságú (compliance 20 ml/vízcm alatti) és kapacitású hólyagműködés alakul ki, amely a következményes vesicoureteralis reflux megjelenése miatt a felső húgyutak károsodásához és visszatérő húgyúti infekciók fellépéséhez vezethet. A károsodás lehet részleges vagy teljes, érintheti a szenzoros, vegetatív és a motoros beidegzést is. A felső és az alsó motoneuron lézió tünetei ugyancsak kombinálódhatnak. A fentiek alapján nagyon változatos klinikai kép jöhet létre. Az egyik legtípusosabb esetben, pl. teljes gerincvelői harántsérülés esetén, automata reflexhólyag alakul ki. Ennek lényege, hogy a hólyag bizonyos térfogat elérésekor, automatikusan összehúzódik, a vizelet pedig akadálytalanul kiürül, anélkül, hogy a beteg a hólyagtelődés és a vizeletürítés érzetéről tudatosulna. A petyhüdt típusú funkciózavar általában detrusor areflexiához és petyhüdt medencefenék kialakulásához vezet, amely vizeletretenció és neurogén eredetű stresszinkontinencia képében jelenik meg (3).

A funkcionális alapon történő felosztásra legjobban alkalmazható a Madersbacher-féle funkcionális beosztás (1. ábra). Ennek lényege, hogy a hólyag, illetve az urethralis sphincter működését jellemezzük normális funkció, túlműködés és alulműködés szerint, amelyek kombinációkban is előfordulhatnak (4). Pontos statisztikai adatok nem állnak rendelkezésünkre a hazai esetszámokat illetően, azonban a neurológiai kórképekben előforduló alsó húgyúti funkciózavarok gyakoriságával kapcsolatban ismeretesek útmutató adatok (5). Az agyi daganatok esetében 24%-ban észleltek neurogén hólyagműködést. Az idősebb kor is hajlamosít hólyagfunkció zavarra, a demencia súlyossági fokától függően 30-100%-ban állapítottak meg NLUTD-t. Agyi érbetegségek 20-50%-ában, sclerosis multiplexben 52-97%-ban (vizeletürítési zavar: 37-72%, inkontinencia: 33-52%) találtak neurogén hólyagműködésre utaló eltérést. Meningomyelocele esetén szinte minden esetben kialakul funkciózavar (90-97%), amely az esetek felében detrusor sphincter disszinergiával (DSD) társul. A cukorbetegek felében fejlődik ki perifériás neuropathia és e betegek több mint háromnegyedében vizelettartás és ürítési problémák is jelentkeznek (5). A kismedencei műtétek közül az abdominoperinealis rectum exstirpációt követően az esetek felében, radikális hysterectomia után 8-57%-ában alakul ki NLUTD. A gerincsérülés gyakorisága külföldi adatok alapján 40/1 000 000 fő, akiknél 80%-ban alakul ki következményes húgyhólyagfunkció-zavar (6). A fenti számokból jól kitűnik, hogy relatív gyakori problémáról van szó, amelyet sajnos sokszor nem, vagy nem kellő időben észlelünk.
A NLUTD-s betegek kezelésének, gondozásának elsődleges célja a vesefunkció megőrzése az alacsony tárolási és ürítési húgyhólyagnyomás biztosításával. Ez érthető, hiszen a gerincvelősérültek vezető haláloka sokáig a veseelégtelenség volt (7). A diagnosztikai és az ezzel együtt járó terápiás késlekedés súlyos szövődmények kialakulásával jár. Az antibiotikumok bevezetésével, illetve az intermittáló önkatéterezés technikájának elterjedésével drámaian csökkent az ezen betegeknél regisztrált életveszélyes (UTI, veseelégtelenség) szövődmények száma (8). Jelenleg a detrusor izomzat relexációjához vezető anticholinerg gyógyszerek és az intermittáló önkatéterezés (CIC) jelentik a neurogén detrusor túlműködés elsővonalbeli kezelésének alapjait. A neurogén eredetű detrusor areflexia elsővonalbeli kezelésében jelentős szerep jut az intermittáló önkatéterezésnek (9). A konzervatív kezelés sikertelensége esetén másodvonalban, a hólyagnyomás csökkentésére, a tágulékonyság és a kapacitás növelésére botulinum toxin intradetrusor injekciót alkalmazhatunk. Eredménytelenség esetén sebészi ellátás válhat szükségessé, amely során a húgyhólyag augmentációját végezzük, ezzel biztosítva a megfelelő tároló kapacitást, illetve az alacsony hólyagnyomást (10, 11). A leggyakrabban vékonybél (ileum) szakasszal történik a hólyagfal augmentációja. A posztoperatív időszakban tapasztalt magas kontinencia arány, megnövekedett húgyhólyag-kapacitás és csökkent maximális detrusor tárolási nyomás mind a sikeres műtéttechnika és a magas betegelégedettség mellett szólnak (12).
Betegek és módszer
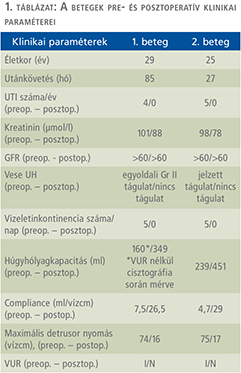
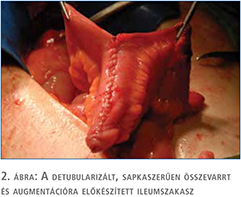
Klinikánkon egy 23 éves (2011. október) és egy 28 éves (2015. szeptember) nőbetegnél végeztünk terápiarezisztens neurogén húgyhólyag-diszfunkció miatt nyílt húgyhólyag-augmentációt. A betegeinknél vizeletvizsgálatot, ultrahangvizsgálatot, cystometria és nyomás-áramlás vizsgálatokat, refluxvizsgálatot végeztünk a preoperatív és posztoperatív időszakban. Mindkét esetben veleszületett gerincfejlődési rendellenességek (kongenitális sacrum agenesia, illetve meningomyelocele) képezték a neurogén húgyhólyag-diszfunkció alapját. Bár a betegek intermittáló önkatéterezést végeztek akontratkilis hólyagjuk miatt, a neurogén hólyagfunkció-zavar progressziója a húgyhólyag compliance csökkenéséhez, következményes zsugorhólyag, vesico-ureteralis reflux és veseüregrendszeri tágulat kialakulásához, illetve recidív húgyúti infekciók megjelenéséhez vezetett. Egy esetben vesicoureterális reflux (VUR) talaján kialakult hydronephrosis és afunkciós veseműködés miatt korábban bal oldali nephrectomia történt. Mindkét betegnél előfordult vizeletinkontinencia a katéterezések között, a kis hólyagkapacitás miatt. A műtéti indikációt mindkét esetben a kifejezetten beszűkült compliance (2,6, illetve 4,7 ml/vízcm, illetve 7 ml/ vízcm) és az alacsony húgyhólyag-kapacitás (160, illetve 220 ml) értékek jelentették. A betegek preoperatív és posztoperatív státuszát az 1. táblázatban foglaltuk össze. A konzervatív (anticholinergicum + CIC) és minimál invazív (botox intradetrusor injekció) terápia hatástalansága miatt mindkét betegnél húgyhólyag-augmentáció történt kirekesztett, detubularizált ileumszakasz felhasználásával. A műtét során a terminális ileum 40-50 cm-es szakaszát hosszában felvágtuk és U-alakban összehajtottuk majd összevarrtuk, mintegy sapkát képezve. A hólyagfal-reszekciót mindig a trigonum szintje felett végeztük, tehát az eredeti hólyag nagyobbik felét eltávolítottuk, majd az így kapott béleredetű „félhólyagot” a cranialis feléhez anasztomizáltuk (2–3. ábra). Ügyeltünk arra, hogy megfelelő hosszúságú bélszakasz maradjon, amely elegendő a B12-vitamin felszívódásához (13). A betegek preoperatív klinikai paramétereit az 1. táblázat tartalmazza.
Eredmények
A posztoperatív időszakban jelentős komplikációt nem észleltünk. Az állandó katéter eltávolítása után a betegek visszatértek intermittáló önkatéterezési technikájukhoz. Szövettani vizsgálattal a hólyagfal fibrotikus átalakulása igazolódott mindkét esetben. A betegeknél műtét után megszűntek a húgyúti fertőzések, a katéterezések közötti akaratlan vizeletvesztések, és az anticholinerg kezelést elhagyhattuk. Jelenleg 85 és 27 hónapos utánkövetés során mindkét beteg kontinens és intermittáló önkatéterezéssel (napi 5×CIC) ürítik vizeletét. Mindkét esetben szignifikánsan nőtt a húgyhólyag-kapacitás (1. beteg:160 ml [VUR nélkül!] vs. 349 ml; 2. beteg: 221 ml vs. 451 ml), a compliance (1. beteg: 7,5 ml/vízcm vs. 26,5 ml/vízcm; 2. beteg: 2,6–4,7 ml/vízcm vs. 29 ml/vízcm) és csökkent a maximum detrusor nyomás a preoperatív értékekhez képest (1. beteg: 74 vízcm vs. 16 vízcm; 2. beteg: 75 vízcm vs. 17 vízcm) (4–6. ábra). A növekvő hólyagkapacitás és tágulékonyság mellett javuló vesefunkciót és csökkenő veseüregrendszeri tágulatot tapasztaltunk. A metabolikus eltéréseket jelen dolgozatunk nem vizsgálta, azonban a betegeinknél is történt posztoperatív rendszeres Astrup és ionkontroll, illetve lelettől függően sav-bázis egyensúly korrigálása. A betegek posztoperatív klinikai paramétereit az 1. táblázat mutatja.


Megbeszélés
Mikulicz volt az első 1899-ben, aki vékonybélpótlással próbálkozott a húgyhólyag nagyobbítására, majd Yeates detubularizált vékonybélszakaszt használt fel, amely a bélhólyag rezervoárok kialakításának azóta is bevált módszere (14). A fordulópontot az intermittáló önkatéterezés (CIC) elterjedése jelentette (15), ezt követően számos augmentációs technika került bevezetésre, különböző bélrendszeri pótlásokkal. A gyermekurológiában gyomor, vastagbél és vékonybél felhasználásával is végeznek húgyhólyag-augmentációt, amelyről számos hazai közlemény is született (16, 17). Az általunk detubularizált ileumszakasszal végzett augmentációs cisztoplasztikákat követően nőtt a hólyagkapacitás és a compliance, illetve csökkent a tárolási nyomás. A műtéteket követően mindkét beteg kontinenciája javult, a húgyúti fertőzések száma csökkent, a húgyhólyagjukat továbbra is intermittáló katéterezéssel ürítik. A saját tapasztalataink megfelelnek a nemzetközi irodalomban található adatoknak, amelyek szerint az átlagos hólyagkapacitás növekedés eléri a 300–450 ml-t, illetve az átlagos maximális detrusor nyomás csökkenés a 20 vízcm-t (10). A hólyagkapacitás növelésének legfontosabb feltétele a megfelelő hoszszúságú ileumszakasz reszekciója. Általánosságban augmentáció céljára 50-60 cm-t javasolnak (11, 12). A túlságosan nagy reszekció a bél felszívó funkciójának csökkenéséhez és így hasmenés kialakulásához vezethet. A kontinencia javulása összefüggést mutat a NLUTD súlyosságával (12). Betegeinknél a kontinencia javítása érdekében további sebészi beavatkozásra nem volt szükségünk, azonban az irodalomban gyakran említenek a primer műtétet követő műsphincter vagy TOT-szalag beültetéseket. A nemzetközi irodalomban szövődményként leggyakrabban a bélműködési zavarok, hasmenés, ileus és hólyagkövesség szerepelnek (13). Esetünkben az egyik beteg panaszol hasmenést, amely javuló tendenciát mutat. A folyamatos bakteriuria és mucus termelés kedvez a húgyúti kövek kialakulásának, azonban a rendszeresen végzett intermittáló önkatéterezéssel ez többnyire megelőzhető. Az augmentált húgyhólyag cisztoszkópos ellenőrzése csak 10 év után javasolt. A műtétet követően a reziduális hólyagfal mennyiségétől és az augmentációra használt bélszakasz hosszától függően szükség lehet a további detrusor relaxációs kezelésre (orális anticholinergikumok, intravesicalis botulinum toxin injekció). Esetünkben műtét után mindkét beteg elhagyta a korábbi anticholinerg kezelést (13). Fontos, hogy az augmentációt idejében, még a tartós vesekárosodás bekövetkezése előtt elvégezzük. Ugyanakkor gyermekeknél a növekedést figyelembe véve az a legszerencsésebb, ha 16 éves életkorig el tudjuk halasztani a műtét időpontját (16, 17).
Következtetés
A neurogén hólyagműködési zavar súlyos, életet veszélyeztető következménye lehet a VUR okozta recidív húgyúti infekció és veseelégtelenség. Amennyiben konzervatív kezelés segítségével nem sikerül a húgyhólyag nyomását, compliance-jét, kapacitását a normáltartományban tartani, akkor a húgyhólyag bélszakasszal történő augmentációját javasolt elvégezni, mert ez megőrizheti és/vagy javíthatja a beteg vesefunkcióját, csökkentheti a visszatérő lázas húgyúti fertőzések számát és így megóvhatja a beteg életét. Ezen kívül a beteg életminőségét is javítja, hiszen a katéterezések közötti kontinencia is javul.
References
1. Stöhrer M, Castro-Diaz D, Chartier-Kastler E, et al. EAU Guidelines on Neurogenic Lower Urinary Tract Dysfunction. European Urology 2009; 56: 81–88. https://doi.org/10.1016/j.eururo.2009.04.028
2. Biers SM, Venn SN, Greenwell TJ. The past, present and future of
augmentation cystoplasty. BJU Int 2012; 109: 1280–93. https://doi.org/10.1111/j.1464-410X.2011.10650.x
3. Wyndaele J-J. The management of neurogenic lower urinary tract dysfunction after spinal cord injury. Nature Reviews Urology 2016; 13: 705–714. https://doi.org/10.1038/nrurol.2016.206
4. Madersbacher H. The various types of neurogenic bladder dysfunction: an update of current therapeutic concepts. Paraplegia 1990; 28: 217–29. https://doi.org/10.1038/sc.1990.28
5. Majoros A, Hamvas A, Romics I. Neurogén eredetű hólyagműködési zavarok. Magyar Urológia Irányelvei 2009; 15–23.
6. Randy A. Vince, Adam P. Klausner. Surveillance Strategies for Neurogenic Lower Urinary Tract Dysfunction. Urologic Clinics of North America 2017; 44(3): 367–375.
7. Majoros A. Az inkontinencia konzervatív kezelése. Orvosi Hetilap 2005; 146(49): 2509–11.
8. Perovic SV, Vukadinovic VM, Djordjevic ML. Augmentation ureterocystoplasty could be performed more frequently. J Urol 2000; 164: 924–7. https://doi.org/10.1097/00005392-200009020-00003 https://doi.org/10.1016/S0022-5347(05)67219–9
9. Krebs J, Bartel P, Pannek J. Functional outcome of supratrigonal cystectomy and augmentation ileocystoplasty in adult patients with refractory neurogenic lower urinary tract dysfunction. Neurourol Urodyn 2016; 35: 260–266. https://doi.org/10.1002/nau.22709
10. Majoros A. A vizeletelvezetés lehetőségei neurogén eredetű hólyagműködési zavarok esetén. Rehabilitáció 2012; 22: 35–39.
11. Gobeaux N, Yates DR, Denys P, et al. Supratrigonal cystectomy with Hautmann pouch as treatment for neurogenic bladder in spinal cord injury patients: long-term functional results. Neurourol Urodyn 2012; 31: 672–6. https://doi.org/10.1002/nau.21239
12. Gurung PM, Attar KH, Abdul-Rahman A, et al. Long-term outcomes of augmentation ileocystoplasty in patients with spinal cord injury: A minimum of 10 years of follow-up. BJU Int 2012; 109: 1236–42. https://doi.org/10.1111/j.1464-410X.2011.10509.x
13. Pannek J, Haupt G, Schulze H, et al. Influence of continent ileal urinary diversion on vitamin B12 absorption. J Urol 1996; 155: 1206–8. https://doi.org/10.1097/00005392-199604000-00014 https://doi.org/10.1016/S0022-5347(01)66217-7
14. Yeates WK. A technique of ileocystoplasty. Br J Urol 1956; 28: 410.
15. Lapides J, Diokono AC, Silber SJ, et al. Clean intermittent self-catheterization in the treatment of urinary tract disease. J Urol 1972; 107: 458–61. https://doi.org/10.1016/S0022-5347(17)61055–3
16. Kispal Z, Balogh D, Erdei O, et al. Complications after bladder augmentation or substitution in children: a prospective study of 86 patients. BJU Int. 2011; 108(2): 282–9. https://doi.org/10.1111/j.1464-410X.2010.09862.x
17. Juhasz Z, Somogyi R, Vajda P, et al. Does the type of bladder augmentation influence the resolution of pre-existing vesicoureteral reflux? Urodynamic studies. Neurourol Urodyn. 2008; 27(5): 412–6. https://doi.org/10.1002/nau.20529
Development of a laparoscopic partial nephrectomy training model
DOI: 10.22591/magyurol.2018.1.sarlosd.8
Authors:
Sarlós Donát Péter dr., Czétány Péter med.
PTE KK, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.
Summary
Objective: Urologists seek opportunities for the development of surgical skills. Our objective was the development of a laparoscopic partial nephrectomy (PN) training model.
Methods: The base of the PN model is polyurethane foam, in which a silicone artificial tumour is implanted. Latex Foley catheter and examination glove fingers are used to simulate vessels and collecting system. Sixteen medical students, who were novice in laparoscopy tested the model, performing a total of 160 PNs. CAE LapVR laparoscopic virtual-reality surgical simulator was used to test laparoscopic dexterity before and after the training.
Results: The model’s mechanic properties show good similarity with the normal human kidney. The steps of the PN operation can be trained, bleeding and urine leakage can be simulated. The price of the materials for one model is under 1 Euro and can be self-produced in less than 10 minutes. During the testing candidates showed a significant progression in resection time (746±338 s vs. 244±123 s, p<0.01), number of stitches placed (1 [0–2] vs. 4.5 [2–5.5], p<0.05) and post-operative bleeding (19.1±2.6 ml vs. 15.7±4.9 ml, p<0.05). Laparoscopic peg transfer, cutting and stitching dexterity has improved, along with significant reduction of unnecessary movements.
Conclusions: We created a widely available and low cost model for PN training that has been proven to better laparoscopic surgical skills. We hope it will help advance skill training in urology and flatten PN learning curves.
LAPSZÁM: MAGYAR UROLÓGIA | 2018 | 30. ÉVFOLYAM, 1. SZÁM
Összefoglalás
Célkitűzés: A vesedaganatok laparoszkópos reszekciójának gyakorlására szolgáló eszközök nem állnak rendelkezésre széles körben. Munkánk célja egy bárki számára elérhető parciális nephrectomia (PN) gyakorlómodell kifejlesztése volt.
Anyagok és módszer: A modell alapja közepes sűrűségű, nyílt pórusszerkezetű poliuretán hab, amire szilikon tömítőanyagból egy tumort készítünk. A daganat vérellátását végző ereket latex katéterrel, a vese üregrendszerét latex gumikesztyű ujjával szimuláltuk. A pelvitrainerbe helyezett modell hasznosságát orvostanhallgatók bevonásával teszteltük, akik összesen 160 szimulált PN-t végeztek el. A beavatkozások pontos dokumentációja mellett a hallgatók laparoszkópos ügyességének fejlődését virtuális valóság szimulátor segítségével vizsgáltuk.
Eredmények: A modellen élethűen gyakorolhatók a PN egyes lépései, mint a tumor kimetszése, a tumoralap képleteinek ellátása és a veseparenchyma zárása, mindeközben műtéti terület vérzése és vizeletes ázása is szimulálható. Több modell egyidejű elkészítése esetén egy modell anyagára átlagos minőségű alapanyagokból körülbelül 200 Ft, és körülbelül 7,5 perc alatt elkészíthető. A modell tesztelése során szignifikáns javulást észleltünk a reszekciós időben, (746±338 s vs. 244±123 s, p<0,01), a behelyezett öltések számában (1 [0–2] vs. 4,5 [2–5,5], p<0,05) és a vérveszteségben (19,1±2,6 ml vs. 15,7±4,9 ml, p<0,05). A hallgatók fogási, vágási és öltési ügyessége javult, a felesleges mozgásaik csökkentek.
Következtetések: Az általunk készített modell hasznosságát kísérleteink során igazoltuk. Reményeink szerint a jövőben az urológiai készségfejlesztésben kollégáink sikerrel használják majd.
Bevezetés
A radikális és a parciális nephrectomia (PN) onkológiai eredményessége hasonló. A mai európai irányelvek szerint a vesedaganatok eltávolításakor az olykor nagyobb kihívást jelentő nephron-kímélő sebészetre kell törekedni (1). A sebészeti szimulációs oktatás jelentősen javítja a gyakorolt beavatkozások tanulási görbéjét (2). A laparoszkópos PN gyakorlására több modellt kifejlesztettek korábban, azonban egyik sem elérhető széles körben. Munkánk célja egy mindenki számára rendelkezésre álló modell kifejlesztése volt.
Anyagok és módszer
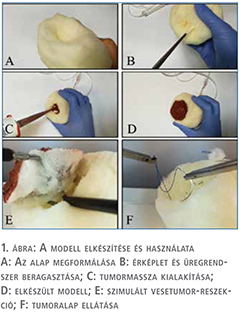
A modell elkészítéséhez közepes sűrűségű poliuretán habmatracot, 12 Ch-es latex Foley-katétert, latex gumikesztyűt, és polisziloxán (szilikon) tömítőanyagot használtunk fel. A poliuretán alapot veseformájúra munkáltuk meg úgy, hogy az 13±0,5 cm hosszú és 7±0,5 cm széles legyen. Az alsó részt meghagytuk laposnak, annak érdekében, hogy a gyakorló doboz aljához könnyebb legyen hozzárögzíteni. Standardizált predilekciós helyeken a vese pólusától 1,5 cm-re, a ventralis felszínen 2,5 cm-es félgömb formájú részt vágtunk ki a modellből, ez jelképezte a tumor alapját. Két előre meghatározott pontban a tumoralap középpontjától 0,5 cm távolságban járatokat alakítottunk ki.
Ezekbe egy körülbelül 7 cm-es katéterdarabot és egy gumikesztyű levágott ujját ragasztottuk be a járatba előre beadagolt
átlátszó szilikonnal. Előbbi egy érképletet, utóbbi a műtét során
megnyíló veseüregrendszert modellezi. A katéteren és a gumikesztyűujjon keresztül vérzés és vizeletes ázás szimulálása céljából, infúziós szerelék segítségével folyadék áramoltatható át.
Ezt követően a tumoralapot púposan feltöltöttük színes szilikonnal, amit körülbelül 50%-ban endophytikus gömb formájúra formáztunk, ez jelképezte a daganatot (R.E.N.A.L. score 6a, PADUA score 7) (3, 4). A szilikon tömítőanyagnak az optimális kötöttség eléréséhez körülbelül 48 órára van szüksége. A modell alapjára erős kétoldalú szivacsos szigetelőszalagot helyeztünk, amit a modellhez két külön öltéssel is hozzárögzítettünk.
Ennek segítségével a modell a pelvitrainer aljához rögzíthető. A modell tesztelését tizenhat önként jelentkező orvostanhallgató bevonásával végeztük. Mindnyájan tantervük részeként a sebészeti műtéttant alapszinten elsajátították, ahol a laparoszkópia alapjait megismerték. További laparoszkópos tapasztalattal nem rendelkeztek. A kísérlet során öt nap alatt fejenként összesen tíz szimulált laparoszkópos parciális nephrectomiát kellett elvégezniük, amikre egyenként 20 perc időtartam állt rendelkezésükre.
Ezen idő alatt kellett végrehajtaniuk a daganat kimetszését, és behelyezni egy tovafutó mély öltéssort úgy, hogy az legalább öt öltésből álljon, ezek közül kettővel az érképletet, kettővel pedig az üregrendszert igyekezzenek zárni. A rendelkezésre álló laparoszkópos eszközök a Maryland-disszektor, Metzenbaum-olló és két tűfogó voltak. A varróanyag egy 26 mm ½-es vágó élű tűvel ellátott 3-0 polipropilén fonal volt, ami 19 cm hosszú volt, és a végére egy 1×1 cm-es összehajtogatott gézlapot csomóztunk, hasonlóan a korábban Klinikánk laparoszkópos munkacsoportja által bemutatott pécsi módszerhez (5) (1. ábra). A varratsor hatékonyságának vizsgálatához a modellen található katéterhez és kesztyűujjhoz infúziós szereléket csatlakoztattunk és 50 H2O cm-es nyomással folyadékot vezettünk bele. A szimulált vérzés és vizeletes ázás mennyiségének mérését 15 másodpercig folytattuk minden esetben. A laparoszkópos készségeket a kísérlet előtt és után CAE LapVR laparoszkópos virtuális valóság szimulátorban mértük fel.
Az adatokat Microsoft Excel táblázatokban összesítettük, elemzésükre IBM SPSS 22.0 programcsomagot használtunk. A változók összehasonlítására páros t-próbát, Mann–Whitney-próbát, vagy Wilcoxon-féle előjeles rangösszeg próbát használtunk.
Eredmények
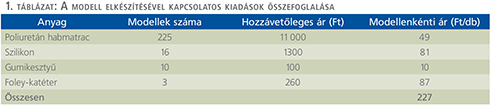
Több modell egyidejű elkészítésekor az egy darab elkészítéséhez szükséges idő körülbelül 7,5 perc, a költségek összesen körülbelül 200 Ft-ot tesznek ki. A felhasznált szivacs anyag kedvező mechanikai tulajdonságokkal bír, könnyedén vágható ollóval, megfelelően rögzül hozzá a szilikon ragasztó és jól tartja az öltéseket. A kiadások kalkulációját az 1. táblázatban foglaltuk össze.
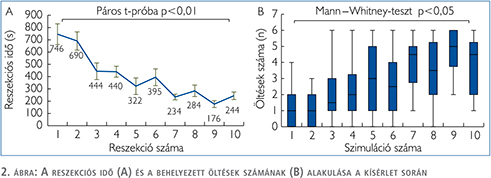
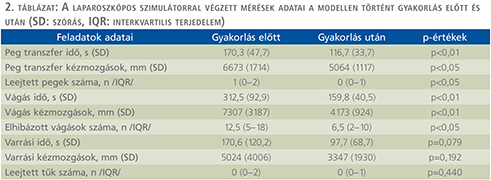
A modell tesztelése során az első és a tizedik beavatkozást öszszehasonlítva jelentősen csökkent a kimetszéshez szükséges idő (746±338 s vs. 244±123 s, p<0,01) (2. ábra). A kísérlet előrehaladtával jelentősen nőtt a behelyezett öltések száma (1 [0–2] vs. 4,5 [2–5,5] p<0,05). A kiértékelés során az első, és a tizedik mintát összehasonlítva jelentősen csökkent a szimulált vérzés mennyisége (19,1±2,6 ml vs. 15,7±4,9 ml, p<0,05), ám a vizeletes ázás változatlan maradt (19,6±4,9 ml vs. 20,9±5,6 ml, p=0,507).
A laparoszkópos szimulátoron végzett mérések szignifikáns javulást mutattak mind a peg transzfer és a vágási feladatok végrehajtásában, ahol nemcsak a feladatok végrehajtásához szükséges idő, hanem a felesleges kézmozgások és a feladat közbeni hibák is jelentősen csökkentek. A felmérés eredményeit a 2. táblázatban foglaltuk össze.
Megbeszélés
A vesedaganatok prevalenciája világszerte növekszik, eközben a modern képalkotó módszereket egyre szélesebb körben alkalmazzák. Az incidentálisan felfedezett kisméretű vesetérfoglalások száma évről évre magasabb, emiatt a minimálisan invazív technikával végzett parciális nephrectomiák száma megemelkedett. Az ilyen műtétek elvégzéséhez szükséges műtéttechnikai készségeket célszerű minél korábban és biztonságos környezetben elsajátítani. Több mint tíz éve léteznek modellek a parciális nephrectomia gyakorlásához. Az első készítmények sertés veséjét használták alapnak (6–10). Azon kívül, hogy a veseüregrendszer morfológiája különbözik, ez egy rendkívül valósághű szimulációt tesz lehetővé, akár in vivo is. A hátránya a disznóvesének az esetleges beszerzés, a romlandóság és annak a nehézsége, hogy a parenchymába egy arteficiális tumort stabilan rögzítsünk (11).
Több vesemodellt készítettek a háromdimenziós nyomtatás segítségével, ezek ma a legmodernebb készítmények. Ezek felhasználási területébe a gyakorláson kívül a műtéti tervezés, és a betegek pontosabb felvilágosítása is beletartozik (12–19). Egy részüknél a nyomtatóval a teljes modellt elkészítik, másoknál egy negatív öntőformát képeznek. A képalkotó szoftverekkel való fúzió technológiájával esetspecifikus modellek készíthetők.
A módszer hátránya, hogy napjainkban kevéssé elterjedt és nagyon költséges. A virtuális valóság trénerek fejlesztésével lehetőség nyílik olyan szoftverek kifejlesztésére, amiken a parciális nephrectomia is gyakorolható szcenárió lehet (20). Jelenleg ezek drágák és korlátozott a hozzáférhetőségük.
Munkacsoportunkkal egy olyan gyakorlómodellt mutatunk be, aminek a fő előnyei a könnyű és olcsó elkészíthetőség, és a jó eltarthatóság. A modell megfelelő élethűség mellett intraoperatív vagy posztoperatív vérzés és vizelet ázás szimulációjára is alkalmas.
A kutatásunkban részt vevő hallgatók jelentős fejlődést mutattak a tumor kimetszésének idejét (p<0,01), az öltések számát (p<0,05) és a posztoperatív vérzést illetően (p<0,05). A javuló varrási technika ellenére a szimulált vizeletes ázásban nem tapasztaltunk javulást. Ennek okát abban látjuk, hogy a modellbe ágyazott gumikesztyűujj víztartó bezárása az utasításaink szerint behelyezett két öltéssel csak kivételes esetekben sikerül.
Kísérleteink során az irodalomban elsőként használtunk mérőeszközként laparoszkópos virtuális valóság trénert. Ez a módszer a feladatok végrehajtását és a kísérleti egyének fejlődésének precíz dokumentációját teszi lehetővé.
Bízunk benne, hogy többen kedvet kapnak hasonló gyakorlóeszközök készítéséhez, és az urológus szakorvosképzésben a sebészeti szimulációs oktatás tárháza tovább bővülhet.
Köszönetnyilvánítás
A szerzők köszönetüket fejezik ki Dr. Pusztai Csabának, Dr. Bányai Dánielnek, Hargitainé Óbert Erzsébetnek és Pandúr Melindának a PTE KK Urológiai Klinikáról, Dr. Varga Tamásnak és Baranyainé Boskovics Gabriellának a PTE KK Szülészeti és Nőgyógyászati Klinikáról, Dr. Varga Péternek és Jakabovics Adriennek a PTE ÁOK Sebészeti Oktató és Kutató Intézetből, Dr. Maróti Péternek a PTE ÁOK Sebészeti Szimulációs Központból és valamennyi, a kísérletben részt vevő hallatónak a munkában nyújtott segítségükért.
References
1. Ljungberg B, Albiges L, Bensalah K, et al. EAU Guidelines on Renal Cell Carcinoma. EAU Guidelines. Edn. presented at the EAU Annual Congress London: 2017. p. 22–40.
2. Chow AK, Sherer BA, Yura E et al. Urology Residents’ Experience and Attitude Toward Surgical Simulation: Presenting our 4-Year Experience With a Multi-institutional, Multi-modality Simulation Model. Urology 2017; 109: 32–37. https://doi.org/10.1016/j.urology.2017.05.037
3. Kutikov A, Uzzo RG. The R.E.N.A.L. nephrometry score: a comprehensive standardized system for quantitating renal tumor size, location and depth. J Urol 2009; 182: 844–853. https://doi.org/10.1016/j.juro.2009.05.035
4. Ficarra V, Novara G, Secco S et al. Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron-sparing surgery. Eur Urol 2009; 56: 786–793. https://doi.org/10.1016/j.eururo.2009.07.040
5. Pusztai Cs, Bagheri F, Bányai D, et al. Laparoszkópos parciális nephrectomia – A pécsi módszer. Magyar Urológia 2013; 25 (1): 12–19
6. Hidalgo J, Belani J, Maxwell K et al. Development of exophytic tumor model for laparoscopic partial nephrectomy: technique and initial experience. Urology 2005; 65: 872–876. https://doi.org/10.1016/j.urology.2004.12.002
7. Yang B, Zeng Q, Yinghao S et al. A novel training model for laparoscopic partial nephrectomy using porcine kidney. J Endourol 2009; 23: 2029–2033. https://doi.org/10.1089/end.2009.0245
8. Ames CD, Vanlangendonck R, Morrissey K et al. Evaluation of surgical models for renal collecting system closure during laparoscopic partial nephrectomy. Urology 2005; 66: 451–454. https://doi.org/10.1016/j.urology.2005.03.033
9. Rouach Y, Timsit MO, Delongchamps NB et al. [Laparoscopic partial nephrectomy: urology resident learning curve on a porcine model]. Prog Urol 2008; 18: 344–350. https://doi.org/10.1016/j.purol.2008.03.009
10. Eun D, Bhandari A, Boris R et al. A novel technique for creating solid renal pseudotumors and renal vein-inferior vena caval pseudothrombus in a porcine and cadaveric model. J Urol 2008; 180: 1510–1514. https://doi.org/10.1016/j.juro.2008.06.005
11. Hung AJ, Ng CK, Patil MB et al. Validation of a novel robotic-assisted partial nephrectomy surgical training model. BJU Int 2012; 110: 870–874. https://doi.org/10.1111/j.1464-410X.2012.10953.x
12. Porpiglia F, Bertolo R, Checcucci E et al. Development and validation of 3D printed virtual models for robot-assisted radical prostatectomy and partial nephrectomy: urologists’ and patients’ perception. World J Urol 2018; 36(2): 201–207. https://doi.org/10.1007/s00345-017–2126-1
13. Fernandez A, Chen E, Moore J et al. A phantom model as a teaching modality for laparoscopic partial nephrectomy. J Endourol 2012; 26: 1–5. https://doi.org/10.1089/end.2011.0131
14. Abdelshehid CS, Quach S, Nelson C et al. High-fidelity simulation-based team training in urology: evaluation of technical and nontechnical skills of urology residents during laparoscopic partial nephrectomy. J Surg Educ 2013; 70: 588–595. https://doi.org/10.1016/j.jsurg.2013.04.009
15. Zhang Y, Ge HW, Li NC et al. Evaluation of three-dimensional printing for laparoscopic partial nephrectomy of renal tumors: a preliminary report. World J Urol 2016; 34: 533–537. https://doi.org/10.1007/s00345-015-1530-7
16. Bernhard JC, Isotani S, Matsugasumi T et al. Personalized 3D printed model of kidney and tumor anatomy: a useful tool for patient education. World J Urol 2016; 34: 337–345. https://doi.org/10.1007/s00345-015-1632-2
17. von Rundstedt FC, Scovell JM, Agrawal S et al. Utility of patient-specific silicone renal models for planning and rehearsal of complex tumour resections prior to robot-assisted laparoscopic partial nephrectomy. BJU Int 2017; 119: 598–604. https://doi.org/10.1111/bju.13712
18. Maddox MM, Feibus A, Liu J et al. 3D-printed soft-tissue physical models of renal malignancies for individualized surgical simulation: a feasibility study. J Robot Surg 2017. https://doi.org/10.1007/s11701-017-0680-6
19. Golab A, Smektala T, Kaczmarek K et al. Laparoscopic Partial Nephrectomy Supported by Training Involving Personalized Silicone Replica Poured in Three-Dimensional Printed Casting Mold. J Laparoendosc Adv Surg Tech A 2017; 27: 420–422. https://doi.org/10.1089/lap.2016.0596
20. Hung AJ, Shah SH, Dalag L et al. Development and Validation of a Novel Robotic Procedure Specific Simulation Platform: Partial Nephrectomy. J Urol 2015; 194: 520–526. https://doi.org/10.1016/j.juro.2015.02.2949
The role of neoadjuvant and adjuvant chemotherapy in urothelial cancer pati-ents suitable for cystectomy
DOI: 10.22591/magyurol.2018.1.maraza.2
Authors:
Maráz Anikó dr., Varga Linda dr.
Szegedi Tudományegyetem, Onkoterápiás Klinika, Szeged (igazgató: Kahán Zsuzsanna dr.)
Summary
SUMMARY
Introduction: Based on randomized studies and meta-analyses, survival data of metastatic bladder cancer patients are more favorable if they receive neoadjuvant or adjuvant cisplatin-based chemotherapy before or after cystectomy. Data of neoadjuvant therapy are more favorable, although in Hungary, it has only been administered in the recent years. In comparison with the Western European countries, in Hungary, cystectomy requires significant experience and caution of the surgeon due to the advanced stages and the co-morbidities of the patients. In case of these patients, neoadjuvant therapies could only be performed if multidisciplinary tumor boards would make the decision before cystectomy, and if the procedures for the patients would be adequately defined. Our article summarizes the evidence of different studies, international guidelines, and the results of pre- and postoperative chemotherapy in case of muscle-invasive urothelial cancer patients who underwent radical cystectomy.
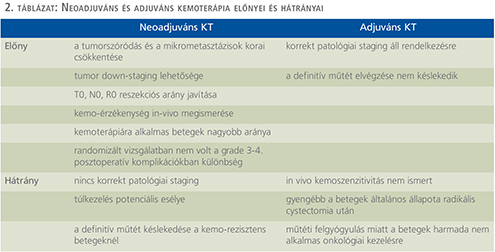
Patients, methods: Based on the ESMO and EAU guidelines, we interpret the different advantages of neoadjuvant chemotherapy, such as early decrease of tumor spreading, opportu-nity of tumor down-staging, improving the ratio of R0 resection, knowledge of chemosensitivity, and the well-known benefits of the adjuvant chemotherapy, such as appropriate pathological staging and earlier definitive operation. We analyzed the result of the most important phase III studies and meta-analyses of neo-adjuvant and adjuvant chemotherapy regarding the type of chemotherapy protocols, stage of the participants, and the effectivity.
Results: Based on the meta-analyses, in case of neoadjuvant cisplatin-based chemotherapy, the 5-year survival benefit is 5%. In a Norwegian phase III study, the benefit was 8%, in case of T3 patients, it was 11%, and according to the 8-year follow-up data, it was 16%. The outcome is even more favorable in case of patients who respond well to neoadjuvant chemotherapy (pCR 12–50% MVAC, 12–22% in case of GC protocol). More than 3 months delay of cystectomy does not significantly reduce the survival if chemotherapy is performed before the operation. Results of adjuvant phase III studies and meta-analyses are not so unambiguous as neoadjuvant data, but chemotherapy seems to influence favorably the survival, especially in case of pT3/4 and/or N+ (and high grade or margin positivity) cases. The outcome of adjuvant chemotherapy is more favorable than in case of deferred chemotherapy started after progression.
Conclusions: Based on the current knowledge, neoadjuvant cisplatin-based chemotherapy is recommended for patients with T2b-T4a tumors before radical cystectomy. If the patients cannot receive cisplatin, neoadjuvant chemotherapy does not have any advantage. In case of T2aN0 stage, the potential presence of micrometastases is lower due to the smaller tumor mass; thus, neoadjuvant chemotherapy can be administered individually in this stage. Adjuvant chemotherapy is recommended in case of all patients with pT3/4 and/or N+ tumor or positive resection margin who did not receive neoadjuvant chemotherapy.
LAPSZÁM: MAGYAR UROLÓGIA | 2018 | 30. ÉVFOLYAM, 1. SZÁM
Összefoglalás
Bevezetés: Randomizált vizsgálatok és metaanalízisek alapján a lokálisan előrehaladott hólyagtumoros betegek túlélési adatai kedvezőbbek, ha a cystectomiát neoadjuváns- vagy adjuváns cisplatin bázisú kemoterápia egészíti ki. A neoadjuváns kezelés eredményei biztatóbbak a posztoperatívnál, mégis a hazai gyakorlatban csak az utóbbi években kezdődött meg alkalmazásának elterjedése. A nyugati országok betegpopulációjához képest előrehaladottabb stádiumban és több társbetegséggel rendelkező hazai betegek esetén már a hólyageltávolító műtét kivitelezése is igen nagy gyakorlatot és körültekintést igényel. Ezeknél a betegeknél a neoadjuváns kezelések akkor végezhetőek rutinszerűen, ha jól működő multidiszciplináris onkoteamek hoznak körültekintő döntést a cystectomia elvégzése előtt, valamint adekvátan definiált betegutak állnak rendelkezésre. A közlemény célja az izominvazív urotheliális daganatos betegeknél indikált radikális sebészi beavatkozáshoz kapcsolódó pre- és posztoperatív kemoterápia eredményeinek –, a vizsgálatok evidenciáinak –, valamint a nemzetközi ajánlásoknak az összefoglalása.
Beteganyag, módszer: Az ESMO és EAU guideline-ok alapján kiindulva ismertetésre kerülnek a neoadjuváns kemoterápiával kapcsolatos általános előnyök, mint a tumorszóró-dás korai csökkentése, a tumor down-staging lehetősége, az R0 reszekciós arány javítása, a kemo-érzékenység megismerése, ahogyan az adjuváns kemoterápia mellett ismert benefit, mint a korrekt patológiai staging, valamint a definitív műtét koraibb időzítése. A neoadjuváns és adjuváns kemoterápia fontosabb 3. fázis vizsgálatait és metaanalízisek eredményeit értékeljük a kemoterápiás protokollok típusa –, a beválogatott betegek tumorstádiuma – és az eredményesség szempontjából.
Eredmények: A neoadjuváns cisplatin bázisú kemote-rápia hatására metaanalízisek alapján 5%-os 5 éves túlélési benefit érhető el. Norvég 3. fázis vizsgálatban 8%-os, T3-as betegeknél 11%-os benefit volt, amely a 8 éves követési adatok szerint 16%. A neoadjuváns kemoterápiára jól reagáló betegeknél (pCR 12-50% MVAC, 12-22% GC protokoll esetén) még kedvezőbb a kimenetel. A cystectomia 3 hónapon túli késlekedésének nincs egyértelműen szignifikáns kedvezőtlen hatása a túlélésre, ha a műtét előtt kemoterápia történik. Az adjuváns 3. fázis vizsgálatok, így a metaanalízisek eredményei is kevésbé egyértelműek, mint a neoadjuváns adatok, de ösz-szességükben kedvező trend észlelhető a kemoterápia hatására a túlélésben, különösen pT3/4 és/vagy N+ (valamint high grade vagy margin pozitív) esetekben. Az adjuvánsan indított kemoterápia utáni kimenetel kedvezőbb a késleltetett, prog-ressziókor indított kemoterápia eredményeinél.
Következtetés: Az eddig ismert adatok alapján neoadjuváns cisplatin bázisú kemoterápia javasolt T2b-T4a tumorstátuszú betegeknek radikális cystectomia előtt. Cisplatinra alkalmatlan betegeknél neoadjuváns kezelés nem jár igazolt előnnyel. A T2aN0 stádiumú betegek kisebb tumortömege miatt kevesebb a mikrometasztázis potenciális jelenléte, emiatt a neoadjuváns kemoterápia ebben a stádiumban egyedileg mérlegelendő. Adjuváns kemoterápia javasolt minden pT3/4 és/vagy N+, vagy reszekciós szél pozitív betegnek, akinél neoadjuváns kemoterápia nem történt.
Bevezetés
Az urotheliális húgyhólyag-karcinóma a kilencedik leggyakoribb rosszindulatú daganat (1). Az esetek közel 70%-ában 65 év feletti életkorban kerül diagnosztizálásra (2).
Felületes tumoroknak tekintjük a nem izominvazív daganatokat (non-muscle-invasive bladder cancer – NMIBC, Ta, Tis, T1), izominvazívnak (muscle-invasive bladder cancer – MIBC) azokat, amelyek a húgyhólyag falának izomrétegét beszűrik (T2), míg lokálisan előrehaladottnak a hólyagfalon túl a zsírszövetbe (T3), környező szervekre (T4) vagy a regionális nyirokcsomókba (szoliter-N1, többszörös medencei-N2, iliaca communis menti-N3) terjedő karcinómákat (3, 4). A diagnózis időpontjában a felületes, nem izominvazív hólyagtumorok előfordulási aránya 51-70%, az izominvazív tumoroké 25-42%, míg a primeren áttétes daganatoké 4-10% a különböző közlemények alapján (5–9). A felületes daganatok kiújulási aránya magas, 30-50% (5), de mortalitása alacsony, az összes eset kb. 50%-a (1). A lokalizált, izominvazív daganatok csaknem 50%-ban válnak áttétessé a betegség kórlefolyása során (5). Az izominvazivitást mutató, lokalizált betegség standard kezelése a radikális cystectomia (RC) (5 éves teljes túlélés kb. 50%), amelynek túlélési eredményei javíthatóak neoadjuváns (vagy adjuváns) kemoterápiával kiegészítve. A nyugati országok betegpopulációjához képest előrehaladottabb stádiumban és több társbetegséggel rendelkező hazai betegek esetén már a hólyageltávolító műtét kivitelezése is igen nagy gyakorlatot és körültekintést igényel. Ezeknél a betegeknél a neoadjuváns kezelések akkor végezhetőek rutinszerűen, ha jól működő multidiszciplináris onkoteamek hoznak körültekintő döntést a cystectomia elvégzése előtt, valamint adekvátan definiált betegutak állnak rendelkezésre.
Kuratív terápiás lehetőség az ún. trimodális módszer (hólyagmegtartó műtét, sugárkezelés és kemoterápia [KT] kombinációja), amelynek hatására a radikális műtétet közelítő túlélési eredmények érhetőek el a hólyag megtartása mellett (2, 4). Szerény eredményességűnek volt mondható az áttétes betegek kezelése az elmúlt évekig, amíg csaknem önmagában a platinabázisú kombinált kemoterápiára kellett hagyatkozni. Hólyagtumorok kezelésében a molekulárisan célzott készítmények többsége a target receptorok meghatározása ellenére egyelőre nem hozott érdemi hasznot (10). Az immunellenőrzési pont blokkolása által az immunterápia új készítményei kedvező eredményeket mutatnak az áttétes vagy lokálisan előrehaladott urotheliális daganatok kezelésében, amely készítmények a jövőben áttörést hozhatnak a betegek túlélésének jelentős javításával.
Kemoterápiás kombinációk – cisplatin vs. carboplatin
Az urotheliális tumorok leggyakrabban alkalmazott szisztémás kezelési lehetősége a kemoterápia. A kemoterápiás kombinációk bázis készítményei a platinaszármazékok. Cisplatin tartalmú protokollok között alkalmazhatóak az MVAC (methothrexat/vinblastin/doxorubicin/cisplatin), CMV (cisplatin/methothrexat/vinblastin + leucovorin), GC (gemcitabin/cisplatin) és PGC (paclitaxel/gemcitabin/cisplatin), míg carboplatint (CBP) tartalmazóak a G-CBP (gemcitabin/carboplatin), M-CAVI (methothrexat/carboplatin/vinblastin) sémák. Platinaszármazékot nem tartalmazó terápiás lehetőségek a vinflunin, a paclitaxel és a docetaxel, amelyek leginkább másodvonalban indikáltak (2, 5).
A cisplatinbázisú kombinációkkal kedvezőbb terápiás eredmény érhető el, mint CBP-vel. A teljes tumorválasz (overall remission rate – ORR) aránya 50-60%, az 1. vonalban elérhető medián teljes túlélés (overall survival – OS) 15 hónap, az 1 éves OS 60%, míg CBP-bázisú kombinációk esetén 36% ORR, medián OS 9 hónap, 1 éves OS 37% érhető el (2, 5), így lehetőség szerint a cis platin bázisú kombinációk alkalmazása javasolt. Cisplatin bázisú kemoterápiára azonban a betegek kb. fele nem alkalmas a gyenge általános állapot, csökkent vesefunkciós érték, halláscsökkenés, perifériás neuropátia vagy kardiális okok miatt (5, 11) (1. táblázat).
Kemoterápia időzítése – neoadjuváns (NA)/adjuváns/késleltetett
Neoadjuváns alkalmazás
A definitív műtétre dedikált betegek sebészi beavatkozást megelőző, azaz preoperatív kezelését nevezzük neoadjuváns terápiának, amennyiben a folyamat potenciálisan reszekábilisnek tekinthető. A lokálisan előrehaladott, technikailag irreszekábilis betegek esetleges műtét előtti kemoterápiás kezelését konverziós kemoterápiának nevezzük (12).
Előnyei a tumorszóródás és a mikrometasztázisok korai csökkentése, a tumor down-staging lehetősége, a T0, N0, R0 reszekciós arány javítása, a kemo-érzékenység in-vivo megismerése, a kemoterápiára alkalmas betegek nagyobb aránya a radikális cyst ectomia előtt, valamint hogy randomizált vizsgálatban nem volt a grade 3-4 posztoperatív komplikációkban különbség (skandináv vizsgálatban 71%-ban 3 ciklus KT történt) (4, 13). Hátrányai, hogy nincs korrekt patológiai staging (képalkotó staging 70%-ban korrekt), a túlkezelés potenciális esélye, továbbá a definitív műtét késlekedése a kemo-rezisztens betegeknél (bár nincs adat az RC késlekedésének negatív hatásáról, csak a kemo-naív betegeknél) (4) (2. táblázat).

Neoadjuváns KT eredményessége
A NA-kemoterápia valós hasznával kapcsolatosan éveken keresztül bizonytalan álláspontok láttak napvilágot annak ellenére, hogy az 1980-as évektől kezdődően több klinikai vizsgálatban bizonyították a cystectomiára alkalmas T2-T3 tumorstádiumú betegek NA-kezelést követő cystectomia utáni 26-33%-os halálozási rizikó csökkenését a csak cystectomiához képest (13–16). A NA cisplatinbázisú, 2-3 ciklus KT hatására a legújabb metaanalízisek alapján is (11 trial 3005 beteg) 5% 5 éves OS benefit, míg 9% 5 éves betegségmentes túlélési (disease free survival – DFS) előny detektálható (4, 15, 17).
Egy skandináv 3. fázis vizsgálatban 8%, a T3-as betegeknél 11% benefit volt elérhető a NA KT hatására a csak cystectomiához képest, amely 8 éves követés után 16%-ra emelkedett (18). Az elemzések alapján csak a cisplatinbázisú kombináció okoz előnyt, emiatt az NA-kezelés a cisplatin KT-ra fit betegeknek javasolt. A KT hatására kialakult patológiai komplett remisszió esetén (azaz pT0 N0 betegeknél) még jelentősebb OS javulás volt detektálható (4, 17).
Neoadjuváns KT kombinációi – GC vagy MVAC?
A két leggyakrabban használt kemoterápiás kombináció esetén felmerül a kérdés, hogy neoadjuváns kezelések során melyik séma az előnyösebb. Bár csak lokálisan előrehaladott vagy áttétes betegek elsővonalbeli terápiájával vannak direkt összehasonlító vizsgálatok a protokollokkal, az elemzések a két kombináció esetén azonos OS, 5 éves OS és progressziómentes túlélést (PFS) eredményeztek, a GC kombináció lényegesen kedvezőbb toxicitási arányával (19, 20). Indirekt összehasonlítások alapján neoadjuváns kezelés során a pT0/pT1 arány azonos volt az MVAC és GC sémákkal. Az NA KT-ra jól reagáló b-tegeknél (pCR 12-50% MVAC, 12-22% GC) mindkét protokoll mellett még kedvezőbb volt a kimenetel. 8 éves követés után 16%-os halálozási rizikójavulást és a 10 éves OS 30-ról 36%-ra emelkedését eredményezték. A távoli áttétek aránya is javult, a lokoregionális kontroll változatlan maradt (4, 17, 21).
Neoadjuváns KT kinél előnyös?
Jól ismert tény, hogy az izominvazív tumor diagnózisától a cystectomiáig eltelt idő 3 hónapon túli késlekedése rontja a túlélést (22, 23). Neoadjuváns kemoterápia esetén azonban a cystectomia késlekedésének nincs egyértelműen szignifikáns kedvezőtlen hatása a betegek túlélésére (4). A NA kemoterápia egyik célja a mikrometasztázisok arányának korai, gyors csökkentése. Mivel a kis kiterjedésű T2 (új klasszifikáció szerint T2a – izomréteg belső fele érintett) tumorok esetén ennek aránya alacsonyabb az előrehaladott tumorokéhoz képest, emiatt a NA KT alkalmazása a T2b-T3b (korábbi klasszifikáció szerint T3) tumorok esetén a túlélés javítása és a potenciális down-staging miatt kiemelten javasolt. További kérdést vet fel a T2 tumorok klinikai stádiumának pontossága, mivel a műtéti preparátumokban 43-73%-ban magasabb patológiai tumorstádiumot találtak, ami ugyancsak a NA KT javallatát erősíti (4, 24). A T4-es tumorok esetén a műtéti preparátumokban a makroszkópos nyirokcsomó-áttétek aránya magas, ebben a stádiumban a konverziós KT célja a reszekabilitás javítása és a downstaging (4, 18).
Neoadjuváns kemoterápia összefoglalva
Az eddig ismert eredmények alapján neoadjuváns cisplatinbázisú KT javasolt T2b-T4a N0 M0, esetleg N+ tumorstátuszú betegeknek radikális cystectomia előtt.
Cisplatinra alkalmatlan betegeknél neoadjuváns kezelés nem jár igazolt előnnyel.
A T2aN0 stádiumú betegek kisebb tumortömege miatt kevesebb a mikrometasztázis potenciális jelenléte, emiatt a neoadjuváns KT egyedileg mérlegelendő (4).
Adjuváns alkalmazás
Adjuváns kemoterápiának nevezzük a definitív műtétet követő posztoperatív kezelést (12).
Előnye, hogy korrekt patológiai staging áll rendelkezésre, valamint, a definitív műtét elvégzése nem késlekedik (4). Hátrányai, hogy az in vivo kemoszenzitivitás nem ismert, gyengébb a betegek általános állapota radikális műtétet követően, az esetlegesen elhúzódó műtéti felgyógyulás miatt a betegek harmada nem lesz alkalmas onkológiai kezelésre, emiatt kisebb arányú a kemoterápiára alkalmas betegcsoport (4) (2. táblázat).
Adjuváns KT eredményessége
Az adjuváns KT valós evidenciája pT3/4 és/vagy N+ M0 betegeknél kérdéses. A korábbi randomizált vizsgálatok adatai alapján nem volt egyértelmű adat arra vonatkozóan, hogy az adjuváns kemoterápia hatására túlélés-javulás jön létre. Az említett 6 vizsgálat (491 eset) felében az alacsony elemszám, a korai vizsgálatzárás, valamint az irreleváns végpontok miatt nem volt detektálható előny az adjuváns KT hatására. Ezekben a vizsgálatokban 4 ciklus CMV, CISCA, MVAC, MVEC, CM, C-monoterápia alkalmazása történt (25–27). Az újabb adjuváns 3. fázis vizsgálatokkal (9 trial, 945 beteg), amelyekből 3 vizsgálatban modern KT-s kombinációkat (GC, PGC) alkalmaztak (27–29), az OS javulásában 23%-os, a DFS-ben 34%, míg az N+ betegek DFS-ében 36% rizikócsökkenés volt detektálható (27). Összességében kedvező trend észlelhető az adjuváns KT hatására a túlélésben, különösen pT3-4 és/vagy N+ stádiumban, de az alacsony esetszámok miatt az alkalmazás evidenciája alacsony. Adjuváns KT-ból leginkább profitálhatnak a high risk betegek (pT3-4 és/vagy N+, pozitív sebészi szél, high grade tumor), ha neoadjuváns KT nem történt, amelynek lehetőségéről a betegeket informálni kell (4, 27).
Adjuváns vs. késleltetett KT
Az EORTC 30994-es fázis III-as trial-ében pT3/T4 és/vagy N+ betegek radikális cystectomia utáni azonnali 4 ciklus adjuváns kemoterápiás kezelésének az összehasonlítását végezték a relapszuskor alkalmazott 6 ciklus kemoterápia eredményével (GC, MVAC vagy high-dose MVAC-protokoll formájában). Az előzetesen tervezett betegszámot ebben a vizsgálatban sem tudták beválogatni az elemzésbe. A progressziómentes túlélésben a közvetlen műtét után alkalmazott KT hatására domináns előny mutatkozott a rizikó 48%-os csökkenésével, míg a teljes túlélésben szignifikáns előny nem volt detektálható, bár a halálozás rizikója 22%-kal csökkent (30).
Adjuváns KT összefoglalva
Az adjuváns 3. fázis vizsgálatok (9 trial) eredményei kevésbé erőteljesek (OS és DFS benefit), mint a neoadjuváns adatok. Összességében kedvező trend észlelhető az adjuváns KT hatására a túlélésben, különösen pT3-4 és/vagy N+ (és reszekciós szél pozitív vagy high grade) stádiumban, ha neoadjuváns KT nem történt. Az adjuváns KT utáni PFS és OS eredmények kedvezőbbek, mint a késleltetett, azaz progressziókor alkalmazott KT kimenetele.
A jövő lehetőségei
Jelenleg nem ismertek magas evidenciájú adatok a NA kemoterápia optimális betegszelekciójáról. A KT alkalmazása a kezelésre nem reagáló betegek esetén jelenthet hátrányt az eredménytelen terápia miatt késlekedő radikális cystectomia kedvezőtlenebb kimenetele miatt. A NA kezelések hatékonysága potenciálisan több módon javítható. Az egyik lehetőség az urotheliális daganatok genetikai profiljának megismerése, amely alapján lehetővé válhat a személyre szabott terápia és a potenciális non-responderek kiválasztása. Egyes közlemények alapján körvonalazódik a bazális, luminális és p53-like altípusok szerinti felosztás, amelyek között az utóbbi altípus kemo-rezisztensnek tűnik (31).
Egy másik lehetséges út az urotheliális daganatok kezelésében áttörést jelentő PD-1 / PD-L1 gátló immunellenőrzési pont gátlók neoadjuváns és adjuváns indikációkban történő alkalmazása, amellyel kapcsolatosan számos klinikai vizsgálat van folyamatban mind az öt, FDA által urotheliális daganat kezelésére befogadott készítménnyel (pembrolizumab, atezolizumab, nivolumab, durvalumab, and avelumab) (32).
Következtetések
- Az eddig ismert eredmények (11 trial, 5% 5éOS és 9% DFS előny vs. cystectomia) alapján neoadjuváns cisplatinbázisú KT javasolt T2b-T4a N0, esetleg N+ tumorstátuszú betegeknek radikális cystectomia előtt.
- Cisplatinra alkalmatlan betegeknél neoadjuváns kezelés nem jár igazolt előnnyel.
- T2aN0 stádiumú betegek kisebb tumortömege miatt kevesebb a mikrometasztázis potenciális jelenléte, emiatt a neoadjuváns KT ebben a stádiumban egyedileg mérlegelendő.
- Az adjuváns 3. fázis vizsgálatok (9 trial) eredményei kevésbé erőteljesek (OS és DFB benefit), mint a neoadjuváns metaanalízis adatok.
- Összességében kedvező eredmény észlelhető az adjuváns KT hatására a túlélésben, különösen pT3-4 és/vagy N+ stádiumban (high grade vagy rezekciós szél pozitív esetekben is), ha neoadjuváns KT nem történt.
- Az adjuváns kemoterápia adása kedvezőbb eredményességű, mint a késleltetett, progressziókor alkalmazott kezelés.
- Neoadjuváns KT > Adjuváns KT > Késleltetett KT.
References
1. Ratta R, Zappasodi R, Raggi D, et al. Immunotherapy advances in uro-genital malignancies. Critical Reviews in Oncology/Hematology 2016; 105: 52–64. https://doi.org/10.1016/j.critrevonc.2016.06.012
2. Bellmunt J, Orsola A, Leow JJ, et al. Bladder cancer: ESMO Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014; 25: iii40–8. https://doi.org/10.1093/annonc/mdu223
3. Babjuk M, Böhle A, Burger M, et al. EAU Guidelines on Non-Muscle-invasive Urothelial Carcinoma of the Bladder: Update Eur Urol 2017; 71(3): 447–461. https://doi.org/10.1016/j.eururo.2016.05.041
4. Witjes JA, Lebret T, Compérat EM, et al. Updated 2016 EAU Guidelines on Muscle-invasive and Metastatic Bladder Cancer. Eur Urol 2017; 71: 462–475. 2017.
5. NCCN Guidelines Version 2 2016. https://www.nccn.org/professionals/physician_gls/pdf/bladder.pdf
6. Howlader N, Noone AM, Krapcho M, et al. (eds). SEER Cancer Statistics Review, 1975–2011, National Cancer Institute. Bethesda, MD, http://seer.cancer.gov/csr/1975_2011/, based on November 2013 SEER data submission, posted to the SEER web site, April 2014.
7. Sharma S, Ksheersagar P and Sharma P. Diagnosis and treatment of bladder cancer. Am Fam Physician 2009; 80: 717–23.
8. Kaufman DS, Shipley WU and Feldman AS. Bladder cancer. Lancet 2009; 374: 234–49. https://doi.org/10.1016/S0140-6736(09)60491–8
9. American Cancer Society 2014: Bladder Cancer (http://www.cancer.org/acs/groups/cid/documents/webcontent/003085-pdf.pdf); last accessed June 2015
10. Kessel KE, Zuiverloon TC, Alberts AR, et al. Targeted therapies in bladder cancer: an overview of in vivo research. Nat Rev Urol 2015; 12: 681–94. https://doi.org/10.1038/nrurol.2015.231
11. Galsky MD, Hahn NM, Rosenberg JE, et al. Defining „cisplatin ineligible” patients with metastatic bladder cancer. J Clin Oncol 2011; 29: 7; abstr 238.
12. NCI Dictionary of Cancer Terms https://www.cancer.gov/publications/dictionaries/cancer-terms?cdrid=45587
13. Grossman HB1, Natale RB, Tangen CM, et al. Neoadjuvant chemother apy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N Engl J Med 2003; 28; 349(9): 859–66.
14. David KA, et al. Low incidence of perioperative chemotherapy for stage III bladder cancer 1998 to 2003: a report from the National Cancer Data Base. J Urol 2007; 178: 451. https://doi.org/10.1016/j.juro.2007.03.101
15. Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) meta-analysis collaboration. Eur Urol 2005; 48(2): 202–5. https://doi.org/10.1016/j.eururo.2005.04.006
16. International Collaboration of Trialists, on behalf of the Medical Research Council Advanced Bladder Cancer Working Party the European Organisation for Research and Treatment of Cancer Genito-Urinary Tract Cancer Group, the Australian Bladder Cancer Study Group, the National Cancer Institute of Canada Clinical Trials Group, et al. International Phase III Trial Assessing Neoadjuvant Cisplatin, Methotrexate, and Vinblastine Chemotherapy for Muscle-Invasive Bladder Cancer: Long-Term Results of the BA06 30894 Trial. J Clin Oncol 2011 Jun 1; 29(16): 2171–2177. https://doi.org/10.1200/JCO.2010.32.3139
17. Yin M, Joshi M, Meijer RP, et al. Neoadjuvant Chemotherapy for Muscle-Invasive Bladder Cancer: A Systematic Review and Two-Step Meta-Analysis Oncologist 2016; 21(6): 708–715.
18. Sherif A, et al. Neoadjuvant cisplatinum based combination chemotherapy in patients with invasive bladder cancer: a combined analysis of two Nordic studies. Eur Urol 2004; 45: 297. https://doi.org/10.1016/j.eururo.2003.09.019
19. De Santis M, Bellmunt J, Mead G, et al. Randomized phase II/III trial assessing gemcitabine/carboplatin and methotrexate/carboplatin/vinblastine in patients with advanced urothelial cancer “unfit” for cisplatin-based chemotherapy: phase II–results of EORTC study 30986. J Clin Oncol 2009; 27(33): 5634–9. https://doi.org/10.1200/JCO.2008.21.4924
20. Von der Maase H, Sengelov L, Roberts JT, et al. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol 2005; 23: 4602–4608. https://doi.org/10.1200/JCO.2005.07.757
21. Griffiths G, et al. International phase III trial assessing neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer: long-term results of the BA06 30894 trial. J Clin Oncol 2011; 29: 2171. https://doi.org/10.1200/JCO.2010.32.3139
22. Lee CT, Madii R, Daignault S, et al. Cystectomy delay more than 3 months from initial bladder cancer diagnosis results in decreased disease specific and overall survival. J Urol 2006; 175(4): 1262–1267. https://doi.org/10.1016/S0022-5347(05)00644-0
23. Sanchez-Ortiz RF, et al. An interval longer than 12 weeks between the diagnosis of muscle invasion and cystectomy is associated with worse outcome in bladder carcinoma. J Urol 2003; 169: 110. https://doi.org/10.1097/00005392-200301000-00027 https://doi.org/10.1016/S0022-5347(05)64047-5
24. Rosenblatt R, et al. Pathologic downstaging is a surrogate marker for efficacy and increased survival following neoadjuvant chemotherapy and radical cystectomy for muscle-invasive urothelial bladder cancer. Eur Urol 2012; 61: 1229. https://doi.org/10.1016/j.eururo.2011.12.010
25. Sylvester R, et al. The role of adjuvant combination chemotherapy after cystectomy in locally advanced bladder cancer: what we do not know and why. Ann Oncol 2000; 11: 851. https://doi.org/10.1023/A:1008399130226
26. ABC Meta-analysis Coll. Adjuvant chemotherapy in invasive bladder cancer: a systematic review and meta-analysis of individual patient data Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Eur Urol 2005; 48: 189. https://doi.org/10.1016/j.eururo.2005.04.005
27. Leow JJ, et al. Adjuvant chemotherapy for invasive bladder cancer: a 2013 updated systematic review and meta-analysis of randomized trials. Eur Urol 2014; 66: 42. https://doi.org/10.1016/j.eururo.2013.08.033
28. Cognetti F, et al. Adjuvant chemotherapy with cisplatin and gemcitabine versus chemotherapy at relapse in patients with muscle-invasive bladder cancer submitted to radical cystectomy: an Italian, multicenter, randomized phase III trial. Ann Oncol 2012; 23: 695. https://doi.org/10.1093/annonc/mdr354
29. Paz-Ares, L.G., et al. Randomized phase III trial comparing adjuvant paclitaxel/gemcitabine/cisplatin (PGC) to observation in patients with resected invasive bladder cancer: Results of the Spanish Oncology Genitourinary Group (SOGUG) 99/01 study. J Clin Oncol 2010; 28(18 Suppl). https://doi.org/10.1200/jco.2010.28.18_suppl.lba4518
30. Sternberg CN, et al. Immediate versus deferred chemotherapy after radical cystectomy in patients with pT3-pT4 or N+ M0 urothelial carcinoma of the bladder (EORTC 30994): an intergroup, open-label, randomised phase 3 trial. Lancet Oncol 2015; 16: 76. https://doi.org/10.1016/S1470-2045(14)71160-X
31. Choi W, Czerniak B, Ochoa A, et al. Intrinsic basal and luminal subtypes of muscle-invasive bladder cancer. Nat Rev Urol 2014; 11(7): 400–10. https://doi.org/10.1038/nrurol.2014.129
32. Maráz A, Géczi L. Immunterápia szerepe az urotheliális daganatok modern kezelésében. Magyar Onkológia 2017; 61: 139–146.
Beszámoló az urológiai fekvőbeteg-ellátásról a 2016-os adatok alapján
DOI: 10.22591/magyurol.2018.1.boszormenyig.21
Authors:
Böszörményi-Nagy Géza dr.
Bajcsy-Zsilinszky Kórház, Urológiai Osztály, Budapest (osztályvezető: Böszörményi-Nagy Géza dr.)
LAPSZÁM: MAGYAR UROLÓGIA | 2018 | 30. ÉVFOLYAM, 1. SZÁM
 A Kollégium, a Társaság és a Magyar Urológia folyóirat összefogásával végzett adatgyűjtést 2012-ben kezdtük újra, úgy hogy a mostani, 2016-os adatösszesítéssel már 5 év folyamatos adatszolgáltatásának eredményeit értékelhetjük. Maga az adatgyűjtés a korábban kidolgozott, egységes, elektronikus formában történik, így az értékelés gyorsabbá, könnyebbé vált. Az osztályok együttműködésének, az adatszolgáltató kollégák munkájának köszönhetően áll rendelkezésünkre tevékenységünk fontosabb mutatóinak és a műtéti statisztikánknak ezen fél évtizedes gyűjteménye. Köszönet érte valamennyi együttműködőnek, bár a határidők betartása, mint korábban is, most is nehézségekbe ütközött. A Magyar Urológia folyóirat éves első számában hagyományosan beszámolunk az éves műtéti statisztikai adatok összesítéséről.
A Kollégium, a Társaság és a Magyar Urológia folyóirat összefogásával végzett adatgyűjtést 2012-ben kezdtük újra, úgy hogy a mostani, 2016-os adatösszesítéssel már 5 év folyamatos adatszolgáltatásának eredményeit értékelhetjük. Maga az adatgyűjtés a korábban kidolgozott, egységes, elektronikus formában történik, így az értékelés gyorsabbá, könnyebbé vált. Az osztályok együttműködésének, az adatszolgáltató kollégák munkájának köszönhetően áll rendelkezésünkre tevékenységünk fontosabb mutatóinak és a műtéti statisztikánknak ezen fél évtizedes gyűjteménye. Köszönet érte valamennyi együttműködőnek, bár a határidők betartása, mint korábban is, most is nehézségekbe ütközött. A Magyar Urológia folyóirat éves első számában hagyományosan beszámolunk az éves műtéti statisztikai adatok összesítéséről.
2016-ban a 38 hazánkban működő urológiai osztály adatait értékeltük, összesíthettük.
Az ellátott betegek száma, a műtétek száma kevesebb, mint 2015-ben volt (1. táblázat).

Ez évben az – eddigi évek folyamán egyébként folyamatosan növekvő – antibiotikum-költség megoszlását értékelve igen nagy szórást találunk az egy betegre jutó költség vonatkozásában az egyes osztályok között (1. ábra).
A felső húgyúti kövesség miatt végzett beavatkozások száma is kevesebb a múlt évinél, amelynek hátterében az ESWL-ek számának csökkenése áll (2. ábra). A percutan kőeltávolítások aránya csökkenő, az ureteroszkópiáké viszont – évről évre – növekvő tendenciát mutat az évek során.
Növekedett a nephrectomiák és a vesereszekciók száma, valamint a vesemegtartó műtétek nephrectomiához viszonyított aránya is (3. ábra). Folytatódik tehát a tendencia, egyre több vesét tudunk megtartani.
A laparoszkópos vesereszekciók és cystectomiák kivételével kissé megtorpant viszont a laparoszkópos műtétek száma is. Bár 2016-ban összességében nem növekedett a radikális prostatectomiák száma, a laparoszkópos prostatectomia aránya változatlanul emelkedik és az összműtéti szám a lélektani 1000-es határ feletti.
Növekedést mutat a cystectomiák száma, 327 radikális cystectomia történt (4. ábra).
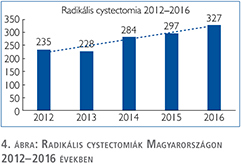
A vizeletelvezetések közül továbbra is szívesebben választottuk a Bricker-műtétet, mint az orthotop hólyagpótlást (5. ábra).
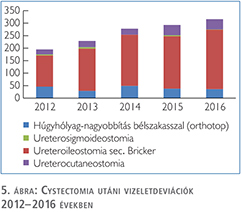
A statisztikai adatok értéke óriási. Lehetőséget nyújtanak saját tevékenységünk értékelésére, megerősíthetik, vagy megkérdőjelezhetik mindennapos gyakorlatunkat. A Magyar Urológia ez évi első számában közöljük részletesen a statisztikát. Ha a példaként felhozott antibiotikum-felhasználásunkat, vagy akár egyes műtéteink számát vizsgáljuk, az adatok segítségével tükröt tarthatunk magunk elé. Hazai és nemzetközi adatok összevetése válik lehetővé, előadásainkban végre hazai adatokra is hivatkozhatunk, nem csak külföldi epidemiológiai grafikonokra.
Remélhetőleg a munka folytatódik, és további adalékul szolgál urológiai tevékenységünk minél korszerűbb és hatékonyabb végzéséhez.