2019-2 —- Full Articles
Platinum-based chemotherapy in urinary bladder cancer – 10 years clinical experiences
DOI: 10.22591/magyurol.2019.2.modoso.58
Authors:
Módos Orsolya dr.1, Bozsaki Ákos1, Nagy Cintia1, Nagy Nikolett1, Csizmarik Anita1, Keresztes Dávid1, Oláh Csilla1, Váradi Melinda1, Horváth András dr.1, Szendrői Attila dr.1, Szűcs Miklós dr.1, Keszthelyi Attila dr.1, Nyirády Péter dr.1, Szarvas Tibor dr.1,2
1Semmelweis Egyetem ÁOK, Urológiai Klinika és Uroonkológiai Centrum, Budapest (igazgató: Nyirády Péter dr.);
2Duisburg-Esseni Egyetem, Urológiai Klinika, Essen
Summary
Objective: Cisplatin-based chemotherapy is the first-line treatment for locally advanced and metastatic bladder cancer. Novel checkpoint inhibitor therapies are approaching and are currently approved for second-line treatment. In this retrospective study, we report our 10-years single institution experiences with cisplatin-based chemotherapy.
Patients and methods: We collected clinicopathological and follow-up data of bladder cancer patients treated with platinum-based chemotherapy in our clinic between 2007 and 2017. Correlations between clinicopathological and follow-up data have been evaluated and compared to those published in the literature.
Results: Our internal database search identified 135 bladder cancer patients with sufficient data who received cisplatin-based chemotherapy. Of these patients 97 were men (72%) and 38 were women (28%). At the time of diagnosis, the median age was 63 years (40-82 years). We grouped patients based on the indication of chemotherapy: 1) Adjuvant chemotherapy was performed in patients with locally advanced (pT3/T4, N0; n=42/135; 31.1%) and/or with lymph node metastatic cases (pT1/T2, N+, n=19/135; 14.1% or pT3/pT4 and N+, n=28/135; 20,7%). 2) Induction chemotherapy was performed in those patients who had tumor progression after surgical treatment (local recurrence n=5/135; 3.7%, distant organ metastases n=7/135; 5.2% and distant lymph node metastases n=1/135; 0.8%). 3) Patients who were unfit for radical cystectomy received palliative chemotherapy (n=33/135; 24.4%).
Patients who received induction chemotherapy had the most unfavourable survival (p<0.001). In the induction chemotherapy group patients with lymph node metastasis had a significant better prognosis compared to those with local recurrence or distant metastasis (p=0.036). Diabetes mellitus proved to be a significant risk factor for patients’ survival (p=0.027). Patients who showed a radiographic response to chemotherapy had a significant better survival (p=0.047).
Conclusions: Our analysis demonstrated that the indication of chemotherapy, the progression site and diabetes mellitus have a significant impact on survival of platinum-treated bladder cancer patients. Therapy predictive models for cisplatin-based chemotherapy implementing molecular features of bladder cancer are needed to improve therapeutic decision making.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Bevezetés: Az invazív húgyhólyagdaganat disszeminációjának megállítására első vonalban a platinaalapú kemoterápia áll rendelkezésünkre. Ez a kezelés azonban csupán a betegek körülbelül felében bizonyul hatékonynak. Jelen vizsgálataink célja az volt, hogy Intézetünkben a kemoterápiával kezelt hólyagrákos betegek klinikopatológiai adatait feltérképezve információt nyerjünk arról, hogy azok hatással vannak-e a platinaalapú kezelés hatékonyságára, illetve a betegség kimenetelére.
Betegek és módszerek: A Semmelweis Egyetem Urológiai Klinikáján 2007 és 2017 között platinaalapú kemoterápiával kezelt hólyagrákos betegek adatait gyűjtöttük össze. Összefüggéseket kerestünk a klinikai paraméterek és a betegek progressziómentes és teljes túlélése között.
Eredmények: Összesen 135 beteg adatait dolgoztuk fel, akik között 97 férfi (72%) és 38 nő (28%) szerepelt. A medián életkor a kezelés megkezdésekor 63 év volt (40–82). A kemoterápia indikációja szerint három csoportot különböztettünk meg: 1) Adjuváns kezelésben részesültek azok a betegek, akik a cystectomia szövettani eredménye szerint lokálisan előrehaladott lelettel (n=42/135; 31,1%) és/vagy nyirokcsomó-áttéttel (n=19/135; 14,1%) vagy mindkettővel (n=28/135; 20,7%) rendelkeztek. 2) Induktív kezelésben részesültek, akiknek a tumora a cystectomia után progrediált (lokális recidíva n=5/135; 3,7%, távoli szervi metasztázis n=7/135; 5,2%, és nyirokcsomóáttét n=1/135; 0,8%). 3) Palliatív kezelésben részesültek azok a betegek, akiknél radikális sebészi kezelésre nem volt lehetőség (n=33/135; 24,4%).
Az induktív kezelésben részesülők tumora a cystectomia után progrediált (lokális recidíva n=5/135; 3,7%, távoli szervi metasztázis n=7/135; 5,2%, és nyirokcsomóáttét n=1/135; 0,8%). Palliatív kezelés esetén radikális sebészi kezelésre nem volt lehetőség (n=33/135; 24,4%). Eredményeink alapján az induktív terápiában részesülők túlélése volt a legkedvezőtlenebb (p<0,001). A nyirokcsomóáttét megléte szignifikánsan jobb prognózissal járt együtt (p=0,036). A cukorbetegség szignifikáns rizikófaktornak bizonyult a túlélés tekintetében (p=0,027). A kezelés alatt radiológiai progressziót nem mutató páciensek szignifikánsan tovább éltek (p=0,047).
Következtetések: Eredményeink alapján a kemoterápia indikációja, a progresszió típusa, valamint a cukorbetegség lényegesen befolyásolhatja a platinaalapú kezelésnek alávetett betegek túlélését. E klinikai paraméterek mellett a tumorok molekuláris sajátságait is figyelembe vevő predikciós módszerekre lenne szükség a terápiás döntések hatékonyságának javítása érdekében.
Bevezetés
A húgyhólyag rosszindulatú daganatát – elkülönítve a prosztatadaganattól – először a 19. században diagnosztizálták külön entitásként (1). A húgyhólyagdaganatok körülbelül negyede már a diagnózis pillanatában izominvazív, vagy a betegség progressziója következtében válik azzá (2). Az izominvazív hólyagdaganatok gyakran multimodális kezelést igényelnek, amelynek részét képezi a lokális kezelésen túl a szisztémás kezelés is. Az első kemoterápiás szerek felfedezéséhez a történelem egyik legmegrázóbb eseménye, a II. világháború vezetett, amely alatt a Yale Egyetem Professzorai, Alfred Gilman és Louis Goodman felfedezte a vegyi fegyverként használt nitrogén-mustár daganatellenes hatását (1946). Nem sokkal később Faber már az MVAC (metotrexát, vinblasztin, doxorubicin, ciszplatin) kombinált kezelés egyik alkotóeleméről, a folsav-antagonista metotrexátról tett közzé ígéretes eredményeket (1948). Közel 10 évvel később, 1960-ban az MVAC egy másik alkotó eleme, a vinca-alkaloidok közé tartozó doxorubicin daganatellenes hatását írta le Eli Lilly (3). Az első kemoterápiás szereket elsősorban hematológiai betegségek kezelésére alkalmazták, az MVAC-kezelés csupán 1985 után terjedt el a hólyagrák adjuváns kezelésében. A hólyagrák szisztémás kezelésében igazi áttörésnek számított a ciszplatin megjelenése. A ciszplatint először M. Peyrone szintetizálta 1844-ben, a tudományos érdeklődés fókuszába azonban csak 1960-ban került, amelynek eredményeképpen 1978-ban az FDA jóváhagyta alkalmazását a daganatellenes terápiában (4). A következő újdonságot már a 2000-es évek hozták, amikor az MVAC-kezeléssel azonos eredményességű, kedvezőbb toxicitású gemcitabin-ciszplatin (GC) kombinált kemoterápia alkalmazása terjedt el az előrehaladott vagy áttétes betegek kezelésében.
Az izominvazív hólyagdaganatok neoadjuváns kezelése szintén a 2000-es években került előtérbe. A neoadjuváns kezelés a következő előnyöket hozhatja magával: a kezelés következtében a daganat stádiuma csökkenhet (downstaging) – amely a műtét elvégzését teheti lehetővé –, lehetőséget ad különböző kemoterápiás szerekre való in vivo érzékenységének megítélésére, továbbá a neoadjuváns kezelésre való érzékenység egy fontos prognosztikai faktor (5). Ellene szól azonban, hogy alkalmazása a radikális műtét elvégzését körülbelül három hónappal tolja el, ami olyan betegeknél, akik nem reagálnak a neoadjuváns kemoterápiára, jelentős időveszteséget jelent. A ciszplatinalapú neoadjuváns kezelés az Európai Urológus Társaság irányelveinek ajánlása ellenére még mindig csak alacsony arányban választott kezelési forma hazánkban.
Az MVAC neoadjuváns kezelés előnyeit és toxicitását az INT-0800 tanulmány foglalta össze, amely 307, pT2-pT4 stádiumú hólyagrákos beteget osztott véletlenszerűen 2 csoportba. Az egyik csoportban a páciensek 3 ciklus MVAC, majd sebészi kezelésben részesültek, a másik csoport betegein kizárólag radikális cystectomiát végeztek. A tanulmány szignifikánsan nagyobb teljes patológiai választ és kedvezőbb túlélést talált az MVAC-cal kezelt betegcsoportban a csak sebészileg kezelt csoporthoz képest. A kezeléssel összefüggésben azonban magas arányban észleltek súlyos hematológiai (57%) és gasztrointesztinális (16%) mellékhatásokat (6). Egy másik tanulmány, az EORT 30894 közel 1000 lokálisan előrehaladott hólyagrákos beteget vizsgált, akik egy része 3 ciklus CMV (ciszplatin, metotrexat, vinblastin) neoadjuváns kezelésben, míg másik része sebészi vagy teljes dózisú sugárterápiában részesült. Nyolc év betegkövetés után statisztikailag szignifikáns haszon mutatkozott a teljes túlélésben a neoadjuváns kezelés javára (5). Egy további tanulmány az MVAC- és a GC-kezelés hatékonyságát 405 beteg bevonásával hasonlította össze. A vizsgálat során a kétféle kombinált kezelés közel azonos hatékonysága igazolódott: a teljes túlélés 14,0 és 15,2 hónap (GC vs. MVAC), a progressziómentes túlélés pedig 7,7, illetve 8,3 hónap volt a vizsgált betegcsoportokban (7). Bár a tanulmányok azt mutatják, hogy a két kezelés megegyező hatékonysággal rendelkezik, a GC-kezelést mégis előszeretettel alkalmazzuk az MVAC-kezeléssel szemben a kedvezőbb mellékhatásprofilja miatt.
A hólyagrák ellátásában a hagyományos sebészi és kemoterápiás kezelések mellett az utóbbi időben az immunterápia is teret nyert. A modern immunterápiák leginkább az immun-checkpoint fehérjék gátlására fókuszálnak. A számos molekuláris célpont közül a hólyagrák kezelésében a PD-1 (programmed cell death protein-1), a PD-L1 (programmed death ligand-1) és a CTLA4 (citotoxyc T-lymphocyte associated protein 4) kiemelten fontos. A nagyobb mennyiségben PD-L1-et kifejező hólyagdaganatok magasabb grade-del rendelkeznek, gyakoribb a tumorrecidíva és a betegek túlélése is kedvezőtlenebb (8). Az atezolizumab volt az első PD-L1-gátló monoklonális antitest, amelyet a hólyagrák kezelésében engedélyeztek. Jelenleg az atezolizumab és a pembrolizumab alkalmazható lokálisan előrehaladott vagy áttétet adó hólyagdaganat kezelésére abban az esetben, ha a daganat a ciszplatinkezelés alatt progrediált, illetve olyan betegeknél, akiknél nem alkalmazható platinaalapú kezelés. Jelenleg számos PD-1/PD-L1-gátló I/II. fázis vizsgálat alatt áll, amelyek közül a nivolumab, valamint a durvalumab is ígéretesnek tűnik (9). Az immun-checkpoint-inhibitorok szerepe a jövőben nagy valószínűséggel előtérbe fog kerülni. Számos vizsgálat eredménye azt sugallja, hogy idővel alkalmazásuk teret fog nyerni a nem-izominvazív hólyagdaganatok kezelésében is, valamint az izominvazív daganatok esetén a neoadjuváns kezelésben.
A Semmelweis Egyetem Urológiai Klinikájának Uroonkológiai Centrumában először 2002-ben végeztek adjuváns MVAC-kezelést, amelyet 2008 nyarán az adjuváns GC-kezelés váltott fel. 2018 tavasza óta a platinaalapú kemoterápiás kezelés alatt progressziót mutató, illetve platinára alkalmatlan hólyagrákos betegek pedig checkpoint-inhibitor kezelésben részesülnek. Intézetünkben a kemoterápiás kezelések száma is növekvő tendenciát mutat, amely napjainkra már elérte a 20 beteg/év feletti számot. Jelen vizsgálatunk célja az volt, hogy az elmúlt évek eredményeit összegezve áttekintést nyújtsunk a kemoterápiával kezelt hólyagrákos betegeinkkel kapcsolatos tapasztalatainkról.
Anyag és módszer
2007. augusztus és 2017. november között a Semmelweis Egyetem Urológiai Klinikáján platinaalapú kemoterápiával kezelt hólyagrákos betegek adatait gyűjtöttük össze. Az adott időszakban 146 beteget vizsgáltunk, közülük elemzésünkbe 135 beteget válogattunk be. A kizárások okai között a neoadjuváns, illetve a külső intézetben történő kezelések, valamint a hiányos dokumentációk szerepeltek. A vizsgálat kezdetén kigyűjtöttük a betegek legfontosabb klinikopatológiai adatait valamint a kemoterápiával kapcsolatos adatokat, majd statisztikai elemzéseket végeztünk. Vizsgáltuk a kemoterápia indikációjának, a kemoterápia utáni progresszió típusának, a betegek társbetegségeinek, valamint a radiológiai progresszió túlélésre gyakorolt hatását.
Az egyes klinikai és patológiai paraméterek valamint a betegek túlélése közötti összefüggéseket részletes statisztikai vizsgálatnak vetettük alá, amelyhez az IBM SPSS Software 20.0. verziót használtuk.
Eredmények
A betegcsoport általános jellemzése
A 135 vizsgált betegünk között 38 nő és 97 férfi szerepelt (nő:férfi ≈ 1:2,6). A kezelés időpontjában a betegek átlagéletkora 63 év volt (40–82). A betegek közül 83 fő (61%) 65 éves vagy annál fiatalabb, míg 52 beteg 65 évnél idősebb volt (39%). A vizsgálatba bevont 135 beteg közül 38 fő dohányzott és ugyancsak 38 fő nem dohányzott, míg 59 beteg dohányzási szokásairól nem álltak rendelkezésünkre adatok. A korábban a dohányzásról leszokott betegeket a dohányzó csoport tagjai közé soroltuk. A daganat 5 beteg esetén pT1 (3,9%), 43 betegnél pT2 (33,9%), 47 betegnél pT3 (37%) és 32 betegnél pT4 (25,2%) stádiumot ért el. Leggyakrabban a GC-alapú kemoterápiás kezelést alkalmaztuk (109/135; 81%); ennél ritkábban fordultak elő a gemcitabin-carboplatin (17/135; 13%), valamint az MVAC (9/135; 6%) kezelések. A betegek klinikopatológiai adatait az 1. táblázat mutatja be.
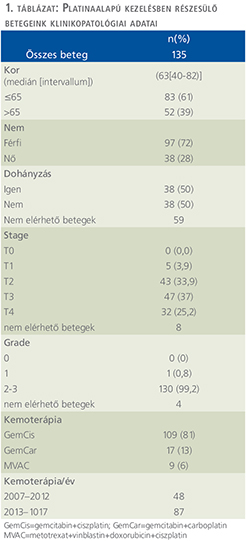
A 135 beteg közül 102-nek volt nem rosszindulatú társbetegsége (76%). Magasvérnyomás-betegség 79 betegnél (59%) fordult elő, diabetes mellitus 22 fő (16%) esetén került leírásra. Szív-ér rendszeri betegség 20 betegnél (15%), míg tüdőbetegség 23 betegnél (17%) volt megfigyelhető. Egyéb urológiai betegség (pl.: benignus prosztata hiperplázia, a funkciós vese, vesekövesség) 4 beteg (3%) anamnézisében szerepelt. További társbetegség (glaukóma, psoriasis, osteoporosis, colitis ulcerosa, krónikus fertőzések) 24 betegnél (18%) fordultak elő (1. ábra).
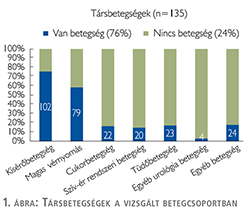
A kemoterápia indikációja szerint három csoportot különböztettünk meg: adjuváns kezelésben részesültek azok, akik a radikális cystectomia szövettani eredménye szerint lokálisan előrehaladott lelettel (pT3/pT4, N0; n=42/135; 31,1%), nyirokcsomóáttéttel (pT1/pT2, N+, n=19/135; 14,1%) vagy mindkettővel (pT3/pT4 és N+, n=28/135; 20,7%) rendelkeztek. Induktív kezelésben részesültek, akiknek a tumora a cystectomia után progrediált (lokális recidíva n=5/135; 3,7%, távoli szervi metasztázis n=7/135; 5,2%, és nyirokcsomóáttét n=1/135; 0,8%). Palliatív kezelésben részesültek azok a betegek, akiknél radikális sebészi kezelésre nem volt lehetőség (n=33/135; 24,4%) (2. ábra).
Intézetünkben a kemoterápiában részesülő betegeink száma 2007–2012 között 48 volt, míg az azt követő 5 évben majdnem duplájára nőtt; 2013–2017 között 87 beteg részesült kemoterápiás kezelésben (1. táblázat).
A platinaalapú kemoterápia indikációjának és a túlélés viszonyának vizsgálata
A kemoterápia indikációja szerint három csoportot különböztethetünk meg:
- adjuváns,
- induktív és
- palliatív.
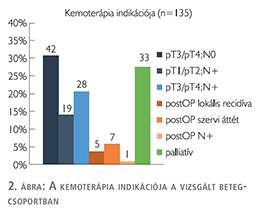
A három csoport közül az induktív terápiában részesülők túlélése volt a legkedvezőtlenebb, ezt követte a palliatív kezelésben részesülők csoportja, míg az adjuváns kezelést kapó betegeknél szignifikánsan jobb túlélés igazolódott (p<0,001). Az adjuváns kezelésben részesülők három csoportja (pT3/pT4, N+, pT3/pT4 és N+) között a túlélés tekintetében nem találtunk különbséget (3. ábra).
A platinaalapú kemoterápia utáni progresszió és a túlélés viszonyának vizsgálata
A kemoterápia után kialakuló progresszió típusa szerint a lokális recidíva és a távoli áttét megjelenése hasonlóan rossz prognózist jelentett, míg a nyirokcsomóáttét megjelenése szignifikánsan jobb prognózissal járt együtt (p=0,036) (4. ábra).

A betegcsoport klinikopatológiai és a túlélés viszonyának vizsgálata
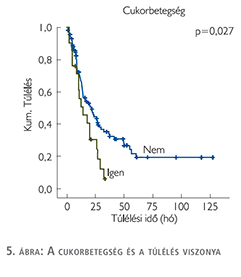
A vizsgált klinikopatológiai paraméterek közül a betegek életkora, neme, dohányzási szokásai, a magas vérnyomás és az obstruktív tüdőbetegség, valamint a kemoterápia típusa (gemcitabin-ciszplatin/carboplatin) nem mutatott összefüggést a túléléssel. Ezzel szemben a cukorbetegség szignifikáns rizikófaktornak bizonyult (p=0,027) (5. ábra).
A radiológiai progresszió és a túlélés viszonyának vizsgálata
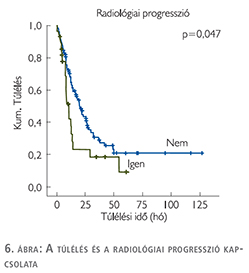
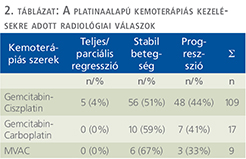
A radiológiai válasz szerint három csoportot hoztunk létre: teljes vagy parciális regressziót mutató, a stabil betegséggel bíró és a progressziót mutató betegek csoportjait. A vizsgált 135 főből 5 betegnél volt megfigyelhető teljes vagy részleges radiológiai válasz, 72 betegnél stabil volt a betegség, míg 58 betegnél progressziót véleményezett a radiológus (2. táblázat). Az adatok további analízise után kiderült, hogy a kemoterápia alatt radiológiai progressziót nem mutató páciensek szignifikánsan hosszabb ideig éltek (p=0,047), mint a képalkotóval igazolt, progressziót mutató betegek (6. ábra).
Megbeszélés
Az izominvazív hólyagdaganatos betegeknél a metasztázisok megjelenése jelenti a legnagyobb veszélyt, amely az esetek körülbelül negyedében fordul elő. A tumor szisztémás terjedésének megelőzésére, illetve megállítására első vonalban a platinaalapú kemoterápia áll rendelkezésünkre. Klinikánkon a mai napig első vonalban a GC kombinációs kezelést alkalmazzuk a progressziót mutató, izominvazív hólyagdaganatos betegeknél, és bár a kemoterápiában részesülő betegek száma – ha csak apró léptékben is – évről évre növekszik, a kezelés sajnos csak a betegek körülbelül felében bizonyul hatékonynak. Amennyiben a daganat a kemoterápia alatt progressziót mutat, úgy másodvonalban a checkpoint-inhibitor terápiára esik a választásunk. A GC-kezelés neoadjuváns alkalmazása egyelőre kevésbé terjedt el, aminek az a fő oka, hogy az 5 éves túlélést a betegek mindössze 5%-ában, míg a 10 éves túlélést 7,5%-ában hosszabbítja meg (10). A legújabb kutatások arra utalnak, hogy azok a betegek, akik nem adnak radiológiai választ a neoadjuváns kezelésre, rövidebb ideig élnek, mint azok, akik azonnali sebészi terápiában részesültek (neoadjuváns kemoterápia nélkül) (10). Mindezek alapján belátható, hogy nagy szükség lenne a ciszplatinkezelés hatékonyságának előrejelzésére. A radikális cystectomiára váró betegek Klinikánkon 2018 tavasza óta részesülnek neoadjuváns kemoterápiában, ám az eddigi alacsony betegszám miatt a neoadjuváns kezeléssel kapcsolatos tapasztalataink egyelőre korlátozottak.
A klinikai gyakorlatban az adjuváns kezelés jobban elterjedt a neoadjuváns kezelésnél. Egy 269 előrehaladott hólyagrákos beteg adatait feldolgozó multicentrikus tanulmány, amely az MVAC és az egykomponensű ciszplatinkezelés hatékonyágát hasonlította össze, egyértelműen az MVAC-kezelést ítélte meg hatékonyabbnak a radiológiai teljes válasz (39% vs. 12%), a progressziómentes túlélés (10 vs. 4 hónap) és a teljes túlélés tekintetében (13 vs. 8 hónap). A legfőbb akadályt azonban MVAC-kombináció kezelés alkalmazásában a gyakran jelentkező és akár igen súlyos mellékhatások jelentették. Mieloszuppresszió, neutropeniás láz, szepszis, mucositis és hányás miatt a betegek 54%-a igényelt hospitalizációt (11). A GC kettős kombináció az egyik leggyakrabban választott elsővonalbeli kemoterápiás kezelés izominvazív hólyagdaganatoknál, amely több tanulmány alapján az MVAC-kezeléssel összehasonlítva megegyező hatékonysággal, ellenben sokkal kevesebb toxikus mellékhatással bír. Egy randomizált, 405 beteget magába foglaló tanulmány alapján az MVAC- és GC-kezelés esetén a teljes válaszarány 49% vs. 47%, a teljes túlélés 14 vs. 15 hónap, az 5 éves túlélés pedig 13% vs. 15% volt. Súlyos mellékhatások azonban ritkábban jelentkeztek GC-kezelés esetén: neutropenia GC-kezeléskor 71%-ban alakult ki, míg MVAC-kezelés esetén a betegek 82%-át érintette. Neutropeniás szepszis 2% vs. 14%-ban, míg mucositis 1% vs. 22%-ban volt megfigyelhető (11). A GC tehát hasonló onkológiai hatás mellett kedvezőbb mellékhatásprofilt mutatott az MVAC-kezeléshez képest, ami a GC alkalmazásának előtérbe kerülését eredményezte.
Az általunk vizsgált betegpopulációban a magasvérnyomás-betegség a betegek 59%-át, míg a cukorbetegség 16%-át érintette. Mindkét idült betegség vesefunkció-csökkenéshez vezethet. Hólyagdaganatos betegeknél maga a malignus betegség is okozhat vesefunkció-csökkenést az obstrukció miatt kialakult hydronephrosis révén. Mivel a ciszplatinalapú kemoterápia csökkent vesefunkcióval rendelkező betegeknek nem adható, így mind az alapbetegség, mind a társbetegségek miatt kiemelten fontos a betegek eGFR-értékének rendszeres ellenőrzése.
A vizsgálatba bevont betegek 81%-a GC-kezelésben, míg gemcitabin-carboplatin és MVAC-kezelésben kevesebb, mint 20% részesült.
Vizsgálataink szerint az induktív terápiában részesülők túlélése kedvezőtlenebb, mint a palliatív kezelésben részesülőké, míg az adjuváns kezelést kapó betegeknek szignifikánsan kedvezőbb a túlélése (p<0,001). Érdekes, hogy az induktív kezelésben részesülők túlélési eredményeit még a palliatív kemoterápiával kezelt betegek túlélése is felülmúlta. Ez azért meglepő, mert a palliatív csoport tagjainál nem került sor radikális cystectomiára, így nagy mennyiségű tumor maradt a betegek szervezetében. Véleményünk szerint talán a palliatív kezelésben részesült betegcsoportban a korábban elkezdett kemoterápia hatott kedvezően a túlélésre. Az irodalomban az induktív, az adjuváns és a palliatív kemoterápiában részesülő hólyagrákos betegek túlélési adatait összehasonlító publikáció idáig nem jelent meg. Az adjuváns kezelésben részesülők három csoportja (pT3/pT4 és N0, pT1/pT2 és N+, pT3/pT4 és N+) között a túlélés tekintetében nem találtunk különbséget.
A kemoterápia után kialakuló progresszió típusa úgy, mint a lokális recidíva és a távoli áttét megjelenése hasonlóan rossz prognózist jelentett, míg a nyirokcsomóáttét megjelenése e két csoporthoz képest szignifikánsan jobb prognózissal járt együtt (p=0,036). Ez az eredményünk egybevág az irodalmi adatokkal: az EAU 2016-ban kiadott irányelve szerint a lokális recidívával rendelkező betegek túlélése 4-8 hónap körül alakul, míg a nyirokcsomó-érintettséggel rendelkező betegcsoport túlélése platinaalapú kemoterápiás kezelés mellett jellemzően 9-26 hónap között mozog (12).
A vizsgált klinikopatológiai paraméterek közül a betegek életkora, neme, dohányzási szokásai, a magasvérnyomás- és az obstruktív tüdőbetegség valamint a kemoterápia típusa (gemcitabin-ciszplatin/carboplatin) nem mutatott összefüggést a túléléssel. Ezzel szemben a cukorbetegség szignifikáns rizikófaktornak bizonyult (p=0,027).
A GC kombinációs kezelésre adott radiológiai választ vizsgálva a betegek 4%-ában mutattak teljes, vagy részleges daganat-regressziót, 51%-ban stabil maradt a betegség, illetve a daganatmentes állapot, míg 44%-ban a radiológiai progresszió alakult ki. Az MVAC kezelésben részesültek 67%-a mutatott terápiás választ (teljes remisszió, parciális remisszió, stabil betegség), míg 33%-ban a daganat progrediált. A GC-kezelésre adott radiológiai válasz irodalmi adatok szerint 49%, amely közelíti saját vizsgálati eredményeinket, az MVAC-kezelés esetén azonban mindössze egy 46%-os válaszarányt említ (13). Ez a csekély eltérés véleményünk szerint a vizsgálatunkban szereplő MVAC-kezelt betegek viszonylag kis száma miatt lehetséges. A radiológiai progressziót mutató betegek túlélése szignifikánsan rosszabb volt szemben azokkal, akik stabil betegséggel rendelkeztek vagy radiológiai választ adtak a platinaalapú kezelésre (p=0,047).
Megemlítendő, hogy a betegek túlélését sok tényező befolyásolja, amelyeket nem tudtunk mind vizsgálni, illetve a beteganyag, bár hazai viszonylatban kiemelkedően nagy elemszámú, ugyanakkor nem elég nagy ahhoz, hogy a betegeket további alcsoportokba soroljuk és részletesebben vizsgáljuk. Ezért is javasolt a jelen vizsgálat folytatása valamint a vizsgált összefüggések megerősítése nagyobb beteganyagon.
A klinikai tapasztalatok és a rendelkezésre álló molekuláris adatok egymástól függetlenül alátámasztják azt az elméletet, miszerint a hólyagdaganatok kialakulásának legalább két egymástól jól elkülönülő útvonala létezik: a papilláris és a nem papilláris út. A felületes hólyagdaganatok nagyrészt a papilláris útvonalon keresztül alakulnak ki, amelyre a fibroblast növekedési faktor receptor 3-as (FGFR3) típusának aktiváló mutációja, a RAS-útvonal aktivációja, vad típusú p53 fehérje és stabil genom a jellemző. A nem papilláris útvonalon kialakult hólyagdaganatok (amely elsősorban az izominvazív hólyagdaganatokat jelenti) jellemzője a p53 és a retinoblastoma-1 fehérjék funkcióvesztéses mutációja, valamint a genetikai instabilitás (14). Az izominvazív daganatok kisebb hányadában megtalálhatók a papilláris útra jellemző molekuláris elváltozások is, ami arra utal, hogy e tumorok a felületes, papilláris daganatokból történő progresszió útján alakulnak ki. Egy friss közlemény szerzői arra a megállapításra jutottak, hogy azok az izominvazív hólyagdaganatok, amelyek papilláris eredetűek (a közleményben „szekunder” tumorok), kevésbé reagálnak a ciszplatin-alapú kezelésre, mint azok a húgyhólyagdaganatok, amelyek már az első diagnózis idején izominfiltráló növekedést mutattak (a közleményben „primer” daganatok) (10). Ez a különbség a kétféle patomechanizmus szerint kialakuló hólyagdaganatok molekuláris hátterére vezethető vissza (15).
Az izominvazív húgyhólyagrákok génexpressziós profil alapján történő molekuláris alcsoportbeosztása két nagy csoportra, az úgynevezett luminális és bazális csoportokra osztotta e daganatokat (16). Az újabb vizsgálatok a luminális alcsoporton belül három további csoportot (luminális papilláris, luminális infiltrált és luminális) írtak le, valamint elkülönítettek egy neuroendokrin-szerű csoportot is (17). Ez utóbbi az izominvazív daganatok csupán 5%-át teszik ki, hisztológiai megjelenését tekintve a többi altípushoz hasonló urotheliális daganat, de molekuláris mintázata alapján neuroendokrin sajátságokat mutat. Az e csoportba tartozó betegek túlélési kilátásai a legrosszabbak az összes alcsoporthoz viszonyítva. A különböző molekuláris altípusokhoz sorolható tumorok egyik fontos klinikai jelentősége abban áll, hogy eltérően reagálnak a különböző kezelésekre. Seiler és munkatársai egy nagy retrospektív vizsgálatban azt találták, hogy a húgyhólyagrák bazális alcsoportja reagál leginkább a neoadjuváns kemoterápiára (18). A luminális infiltrált alcsoport esetében pedig a checkpoint-inhibitor kezelések hatékonyságát valószínűsítik (17).
A húgyhólyagtumoros betegek molekuláris altípusainak meghatározása, és az ez alapján történő személyre szabott kezelés, valamint a klinikai gyakorlatban is megjelenő újabb immunterápiás kezelési lehetőségek növekedése hozzásegíthet egy árnyaltabb, és ez által hatékonyabb terápiás algoritmus kidolgozásához. Ehhez azonban szükség van a hólyagtumorok molekuláris sajátságait is figyelembe vevő predikciós módszerek tökéletesítésére.
Támogatás
E munka a Magyar Urológus Társaság, az NKFIH/FK 12443, NVKP 16-1-2016-004 és az Emberi Erőforrások Minisztériuma ÚNKP-18-4-SE-66 Kódszámú Új Nemzeti Kiválóság Programjának Támogatásával készült. Dr. Szarvas Tibor a Magyar Tudományos Akadémia Bolyai János ösztöndíjában részesült.
References
1. Alsudani MMA. Historical development of diagnosis and treatment of bladder cancer. Eur Urol Suppl 2013; 12: e39.
2. Chang SS, Bochner BH, Chou R, Dreicer R, et al. Treatment of Non-Metastatic Muscle-Invasive Bladder Cancer: AUA/ASCO/ASTRO/SUO Guideline. J Urol 2017; 198(3): 552–559. https://doi.org/10.1016/j.juro.2017.04.086
3. Mandal A. History of Chemotherapy. 2018; Available from: https://www.news-medical.net/health/History-of-Chemotherapy.aspx
4. Dasari S, Tchounwou PB. Cisplatin in cancer therapy: molecular mechanisms of action. Eur J Pharmacol 2014; 740: 364–78. https://doi.org/10.1016/j.ejphar.2014.07.025
5. Trenta P, Calabro F, Cerbone L, Sternberg CN. Chemotherapy for Muscle-Invasive Bladder Cancer. Curr Treat Options Oncol 2016; 17(1): 6.
6. Derek Raghavan M. Neoadjuvant treatment options for muscle-invasive urothelial bladder cancer. https://www.uptodate.com, 2018.
7. von der Maase H, Sengelov L, Roberts JT, Ricci S, Dogliotti L, Oliver T, Moore MJ, Zimmermann A, Arning M. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol 2005; 23(21): 4602–8.
8. Bellmunt J, Powles T, Vogelzang NJ. A review on the evolution of PD-1/PD-L1 immunotherapy for bladder cancer: The future is now. Cancer Treat Rev 2017; 54: 58–67. https://doi.org/10.1016/j.ctrv.2017.01.007
9. Rouanne M, Roumiguie M, Houede N, Masson-Lecomte A, et al. Development of immunotherapy in bladder cancer: present and future on targeting PD(L)1 and CTLA-4 pathways. World J Urol 2018. 36(11): 1727–1740. https://doi.org/10.1007/s00345-018-2332-5
10. Pietzak EJ, Zabor EC, Bagrodia A Armenia J, et al. Genomic Differences Between “Primary” and “Secondary” Muscle-invasive Bladder Cancer as a Basis for Disparate Outcomes to Cisplatin-based Neoadjuvant Chemotherapy. Eur Urol 2018.
11. Joaquim Bellmunt M. Treatment of metastatic urothelial cancer of the bladder and urinary tract. https://www.uptodate.com, 2018.
12. Bokarica P, Hrkac A, Gilja I. Re: J. Alfred Witjes, Thierry Lebret, Eva M. Comperat, et al. Updated 2016 EAU Guidelines on Muscle-invasive and Metastatic Bladder Cancer. Eur Urol 2017; 71: 462–75. Eur Urol 2017; 72(2): e45.
13. Alfred Witjes J, Lebret T, Comperat EM, Cowan NC, et al. Updated 2016 EAU Guidelines on Muscle-invasive and Metastatic Bladder Cancer. Eur Urol 2017; 71(3): 462–475. https://doi.org/10.1016/j.eururo.2016.06.020
14. Choi W, Ochoa A, McConkey DJ, et al. Genetic Alterations in the Molecular Subtypes of Bladder Cancer: Illustration in the Cancer Genome Atlas Dataset. Eur Urol 2017; 72(3): 354–365. https://doi.org/10.1016/j.eururo.2017.03.010
15. Tibor Szarvas CO, Henning Reis. Neoadjuvant cisplatin-based chemotherapy in “primary” and “secondary” muscle-invasive bladder cancer – is it a surrogate for molecular subtypes? Translational Cancer Research, 2019.
16. Damrauer JS, Hoadley KA, Chism DD, Fan C, et al. Intrinsic subtypes of high-grade bladder cancer reflect the hallmarks of breast cancer biology. Proc Natl Acad Sci U S A 2014; 111(8): 3110–5. https://doi.org/10.1073/pnas.1318376111
17. Robertson AG, Kim J, Al-Ahmadie H, Bellmunt J, et al. Comprehensive Molecular Characterization of Muscle-Invasive Bladder Cancer. Cell 2018; 174(4): 1033.
18. Seiler R, Gibb EA, Wang NQ, Oo HZ, et al. Black, Divergent Biological Response to Neoadjuvant Chemotherapy in Muscle-invasive Bladder Cancer. Clin Cancer Res 2018.
Epidemiology and susceptibility patters of Staphylococcus aureus isolates from STI samples of male patients (2008–2017)
DOI: 10.22591/magyurol.2019.2.gajdacsm.66
Authors:
Gajdács Márió dr.1,2
1Szegedi Tudományegyetem Gyógyszerésztudományi Kar, Gyógyszerhatástani és Biofarmáciai Intézet, Szeged (intézetvezető: Zupkó István dr.);
2Szegedi Tudományegyetem Általános Orvostudományi Kar, Klinikai Mikrobiológiai Diagnosztikai Intézet, Szeged (igazgató: Burián Katalin dr.)
Summary
Introduction: Bacterial infections of reproductive organs are a major factor of morbidity, and one of the most common causes of infertility in men. More and more studies report the growing importance of Staphylococcus aureus in urological diseases, but little data is available on the sensitivity of the isolates.
Materials and methods: During this study, the retrospective characterization of S. aureus isolates from STI samples of male patients was performed regarding a 10-year (01. 01. 2008. – 31. 12. 2017.) study period.
Results: 85 S. aureus isolates were detected during the study period; the average age of the affected patents was 37±14 years (range 17–90). During the 10-year period, 2 MRSA isolates were detected. The sensitivity of the isolates was close to 100% for most tested antibiotics, except for fluoroquinolones (90%) and macrolides (~75-80%).
Conclusions: S. aureus is a relatively rare isolate in male STI samples; however its significance must not be neglected, due to its high pathogenicity.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Bevezetés: A reproduktív szervek bakteriális fertőzései jelentős morbiditási tényezőnek és a meddőség egyik leggyakoribb okának számítanak férfiakban. Egyre több tanulmány számol be a Staphylococcus aureus egyre növekvő jelentőségéről urológiai kórképekben, azonban kevés adattal rendelkezünk az izolátumok érzékenységéről.
Anyag és módszer: A kutatás során SZTE Klinikai Mikrobiológiai Diagnosztikai Intézet STD laboratóriumába 2008. 01. 01. és 2017. 12. 31. között, férfi betegektől érkezett mintákból kitenyészett S. aureus izolátumok retrospektív mikrobiológiai elemzése történt.
Eredmények: A vizsgálati periódus alatt 85 S. aureus izolátum került kitenyésztésre, az érintett betegek átlagéletkora 37±14 év (tartomány: 17–90) volt. A 10 éves periódus alatt 2 MRSA-izolátumot detektáltunk. Az izolátumok érzékenysége közel 100%-os volt a vizsgált antibiotikumokra, kivéve a fluorokinolonokat (~90%) és a makrolidokat (~75-80%).
Következtetés: A S. aureus viszonylag ritkán előforduló izolátum férfi betegek STD-mintáiban, azonban magas fokú patogenitása miatt jelentősége nem elhanyagolható.
Bevezetés
A reproduktív szervek bakteriális fertőzései világszerte jelentős tényező a morbiditás és az életminőség-romlás szempontjából, és a meddőség egyik leggyakoribb okai mind a férfi, mind a női betegeknél. A különféle klasszikus és sejtfal nélküli (pl. Chlamydia, Mycoplasma) kórokozókkal történő fertőzések jelentőségét számos urológiai jellegű kórképben leírták (1). A bakteriális kórokozókkal történő fertőzés az emberi reproduktív rendszerben számos különböző klinikai képhez vezethetnek, és hosszú távon befolyásolhatják a férfiak reproduktív funkcióit (2). A Staphylococcus fajok Gram-pozitív, kataláz-pozitív és bacitracin-rezisztens coccusok. A S. aureus (a koaguláz-negatív Staphylococcus fajokkal egyetemben) egy kommerzális baktérium, azonban számos virulencia faktorának köszönhetően vezető oka bőr- és lágyszöveti fertőzéseknek és életveszélyes szisztémás fertőzéseknek egyaránt (3). Ezen felül, számos tanulmány számol be egyre növekvő jelentőségéről urológiai kórképekben, férfi meddőségben, ha nem is az egyik leggyakoribb, de lehetséges okként szerepel. In vitro tanulmányok igazolják a baktérium spemagglutináló hatását, és epidemiológiai vizsgálatokban a meddő férfiaktól származó ondóváladékok 10-60%-ban jelentős csíraszámban kitenyészthető volt (4–6). A methicillin-rezisztens
S. aureus (MRSA) – amely (a ceftarolin és ceftobiprol kivételével) rezisztens a béta-laktám antibiotikumokra – továbbra is napjaink egyik legnagyobb gondot jelentő multidrog-rezisztens (MDR) kórokozója (3, 7). Kevés tanulmány foglalkozik a S. aureus izolátumok antibiotikum-érzékenységével, az infekciók terápiája döntően empirikus. Jelen kutatás célja a Szent-Györgyi Albert Klinikai Központ helyi epidemiológiai viszonyainak feltárása.
Anyag és módszer
A kutatás során SZTE Klinikai Mikrobiológiai Diagnosztikai Intézet bakteriális STD laboratóriumába 2008. 01. 01 és 2017. 12. 31. között, férfi betegektől érkezett mintákból kitenyészett S. aureus izolátumok retrospektív mikrobiológiai elemzése történt. A minták mikrobiológiai feldolgozását a rutin bakteriológiai eljárásoknak megfelelően végeztük. A minták kioltása véres agar, csokoládé agar, eozin-metilénkék agar és Sabouraud agar táptalajokra történt, amelyeket 24-48 órán át inkubáltunk 37 °C-on. Egy további véres agar táptalaj anaerob körülmények között került inkubálásra (Baker–Ruskinn anaerob kamra) 5 napig, a vegyes anaerob flóra detektálása érdekében. A S. aureus izolátumok identifikálása preszumptív biokémiai módszerekkel, VITEK 2 ID automatával (bioMérieux, Marcy-l’Étoile, Franciaország), illetve 2013-tól mátrix-asszisztált lézer deszorpciós/ionizációs repülési időn alapuló tömegspektrométer (MALDI-TOF MS; Bruker Daltonics, Bréma, Németország) készülékkel történt, az előzőleg ismertetett protokoll alapján (8). Az észlelt izolátumok antibiotikum érzékenységét (AST) korongdiffúziós módszerrel határoztuk meg (kivéve a vankomycin esetén, ahol E-teszttel), a módszer kivitelezését és az eredmények értékelését az EUCAST ajánlásainak megfelelően (http://www.eucast.org). Érzékenységvizsgálat az alábbi antibiotikumokra vonatkozóan történt: cefoxitin (FOX), vancomycin (VAN), erythromycin (ERI), azitrhomycin (AZI), clindamycin (CL), norfloxacin (NOR), gentamycin (GEN), rifampicin (RIF), szulfamethoxazol/trimethoprim (SMX/TMP) és doxycyclin (DOX). Az AST-vizsgálatok során S. aureus ATCC 29213, S. aureus ATCC 44330 (MRSA), Enterococcus faecalis ATCC 29212, Proteus mirabilis ATCC 35659, Escherichia coli ATCC 25922 és Pseudomonas aeruginosa ATCC 27853 törzsek kontrolltörzsekként szerepeltek.
Eredmények
A vizsgálati periódus alatt 85 S. aureus izolátum került kitenyésztésre (8,50±2,59/év; tartomány: 5–14), az alábbi mintatípusokból: ejakulátum (25,88%) (22), glans-törlés (21,18%) (18) és húgycsőváladék (52,94%) (45). Az érintett betegek átlagéletkora 37±14 év (tartomány: 17–90) volt, a (25,88%), a mintavétel pillanatában 35,29% 30 évnél fiatalabb, 9,41% 60 évnél idősebb volt. A mintákhoz kapcsolódó beküldő diagnózisok eloszlása az alábbi volt: balanitis, illetve balanoposthitis (25,88%), urethritis (14,12%), bakteriális infekció (8,23%), krónikus prostatitis (7,06%), cystitis acuta (7,06%), férfi meddőség (5,88%), hímvessző rendellenessége vagy fekélye (3,53%) vagy egyéb (24,71%).
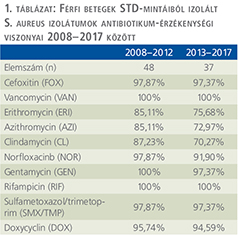
Az izolátumok antibiotikum érzékenysége nem változott jelentősen a vizsgálati periódus alatt: az SMX/TMP, DOX, GEN- és RIF-érzékenység tartósan 100% közeli, míg a NOR-érzékenység csökkent, ám továbbra is 90% felett mozog. A makrolidok (ERI, AZI) és CLI-érzékenység azonban 85-87%-ról 70-75%-ra csökkent. A 10 éves periódus alatt 2 MRSA-izolátumot detektáltunk, de VAN-ra ezek is érzékenynek bizonyultak (1. táblázat).
Megbeszélés
A S. aureus viszonylag ritkán előforduló izolátum férfi betegek STD-mintáiban, azonban magas fokú patogenitása miatt jelentősége nem elhanyagolható. A mikrobiológiai lelet pozitivitása S. aureus-ra önmagában még nem indokolja az antibiotikum-terápia szükségességét; szükséges további vizsgálatok elvégzése (pl. ondó peroxidáz teszt, PMN elasztáz teszt) és a klinikus terápiás döntése a beteg tünettanának értékelésével együtt kell, hogy történjen. A helyi epidemiológiai adatok ismerete fontos a célzott, hatékony antibiotikum-terápia kiválasztásában. Ha a terápia valóban indokolt, a beteg anamnézisében található adatokat (pl. penicillin-allergia, előzetes Clostridium difficile enterocolitis) is figyelembe kell venni az antibiotikum kiválasztásakor. A vizsgált antibiotikumok közül a fluorokinolonok, az SMX/TMP, doxycyclin, clindamycin és azithromycin az orálisan elérhető szerek, a cefoxitin, gentamycin és a vancomycin parenterálisan alkalmazandók, míg a rifampicint csak kombinációban alkalmazzák, mivel monoterápiában gyorsan kialakul ellene a rezisztencia. A jelen betegségcsoport szempontjából a legnagyobb jelentősége a fluorokinoloknak, az SMX/TMP-nek, doxycyclinnek és a clindamycinnek van; különösen igaz ez krónikus prostatitis esetén, ahol hosszan tartó (több hetes-hónapos) terápiára van szükség. Vizsgálatunkban a S. aureus izolátumok döntő többsége érzékeny a releváns antibiotikumra és az MRSA-prevalencia is alacsony (0,2 izolátum/év), azonban a makrolidok és clindamycin esetén az antibiogram ismerete nélkül a klinikusnak óvatosnak kell lennie az empirikus terápia kiválasztásában (9).
Köszönetnyilvánítás
A közlemény létrejöttét az ESCMID Mentorprogram és az NTP-NFTÖ-18-C-0225 „Nemzet Fiatal Tehetségeiért Ösztöndíj” támogatta.
References
1. Schuppe HC, Pilatz A, Hossain H, Diemer T, Wagenlehner F, Weidner W. Urogenital Infection as a Risk Factor for Male Infertility. Dtsch Arztebl Int 2017; 114(19): 339–346.
2. Shi L, Wang H, Zhe L. Chapter 10: Staphylococcal infection and infertility. In: Atef M. Darwish (ed.): Genital Infections and Infertility. InTech Open; London, UK: 2017. http://dx.doi.org/10.5772/62663
3. Gajdács M. The Continuing Threat of Methicillin-Resistant Staphylococcus aureus. Antibiotics 2019; 8(2): 52. http://dx.doi.org/10.3390/antibiotics8020052
4. Kaur S, Prabha V. Infertility as a Consequence of Spermagglutinating Staphylococcus aureus Colonization in Genital Tract of Female Mice. Plos One 2012; 7(12): e52325. http://dx.doi.org/10.1371/journal.pone.0052325.t002
5. Esmailkhani A, Akhi TM, Sadeghi J, Niknafs B, Bialvaei AZ, Farzadi L, Safadel N. Assessing the prevalence of Staphylococcus aureus in infertile male patients in Tabriz, northwest Iran. Int J Reprod BioMed 2018; 16(7): 469–474.
6. Nwadoiha SI, Odimayo MS, Jombo GTA, Nwokedi Prince EO, Abba PO, Agaje I, Akor JO. Microbiologic Review of Seminal Fluids in a Nigerian Tertiary Health Centre. Ach Clin Microbiol 2016; 7(4): 23.
7. Gajdács M. Pánrezisztens kórokozók által okozott többlethalálozás: mi áll valójában a szakirodalomban? Egészségfejlesztés 2019; 60(2): 29–35. http://dx.doi.org/10.24365/ef.v60i2.397
8. Gajdács M, Spengler G, Urbán E. Identification and Antimicrobial Susceptibility Testing of Anaerobic Bacteria: Rubik’s Cube of Clinical Microbiology? Antibiotics 2017; 6(4): 25. http://dx.doi.org/10.3390/antibiotics6040025
9. Gajdács M, Komáry K, Burián K, Hajdú E, Paulik E, Szabó A. Assessment of knowledge level among medical students and residents related to infectious diseases and antimicrobial therapy: a single-centre study In: 28th European Congress of Clinical Microbiology and Infectious Diseases (28th ECCMID). P1710: 2018.
Primary renal solitary fibrous tumour: case report and literature review
DOI: 10.22591/magyurol.2019.2.vrecenarl.69
Authors:
Vrecenár László dr.1, Galambos Csilla dr.2, Diczházi János Csaba dr.2, Buzogány István dr.1
1Péterfy Kórház-Rendelőintézet és Manninger Jenő Országos Traumatológiai Intézet, Urológiai osztály, Budapest (osztályvezető: Buzogány István dr.);
2Péterfy Kórház-Rendelőintézet és Manninger Jenő Országos Traumatológiai Intézet, Patológiai osztály, Budapest (osztályvezető: Diczházi János Csaba dr.)
Summary
Objective: The authors present a rare case of fibrotic tumour originating from the kidney and provide the literature review background.
Case report: The solitary fibrous tumour (SFT) is a rare mesenchymal neoplasm most frequently originating from the pleura. Renal occurrence is very uncommon. We report a 21-year-old male patient presenting with recurrent episodes of hypoglycaemia causing altered level of consciousness. Subsequent investigations revealed a tumour in the right kidney. The initial results of the core biopsy caused a diagnostic dilemma, but the immunohistochemical analysis of the radical nephrectomy specimen confirmed the primary renal solitary fibrous tumour. Our patient was doing well at the 3-month follow-up with no evidence of recurrence or metastasis.
Conclusion: The basis of its treatment is primarily surgical, which includes metastasectomy in metastatic cases. Considering the possibility of recurrence and distant metastasis formation, careful follow-up is recommended.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Célkitűzés: A szerzők ritka, veseeredetű fibrózus tumor esetét mutatják be áttekintve az irodalmi hátteret is.
Esetismertetés: A szoliter fibrózus tumor (SFT) egy ritka mesenchymalis daganat, amely elsősorban a pleurában fordul elő. Primeren a veséből kiindulva extrém ritkán kerül felfedezésre. Az esettanulmányunkban szereplő 21 éves férfi páciens kivizsgálása ismétlődő, tudatzavarokkal is járó hypoglykaemiás epizódok miatt indult, amely során felfedezésre került jobb oldali vesetumora. A kezdeti core biopszás mintavétel diagnosztikus dilemmát okozott, de a későbbi radikális nephrectomiából származó specimen immunhisztokémiai vizsgálata igazolta a vese primer szoliter fibrózus tumorát. Betegünk műtétet követő háromhónapos utánkövetése alkalmával ezidáig sem recidíva, sem metasztázis nem igazolódott.
Megbeszélés: A kezelésének alapja elsődlegesen sebészi, amely áttétes esetben magában foglalja a metastasectomiát is. Tekintettel a recidíva és a távoli áttétképzés lehetőségére, gondos utánkövetés ajánlott.
Bevezetés
A szoliter fibrózus tumor – korábbi nevén hemangiopericytoma – egy ritka mesenchymalis daganat, amely a szervezetben számos lokalizációban előfordulhat (1). Elsőként a pleurában írta le Klemperer és Rabin 1931-ben, de szinte bárhonnan kiindulhat (2). Változatos előfordulási helyei között említendő a peritoneum, pericardium, agyhártya, gerincvelő, hasnyálmirigy (3), máj (4), de leírták szublingvális nyálmirigyben (5), vagy intraocularisan (6) is.
Az immunhisztokémia és a molekuláris diagnosztika fejlődésével a CD34 vált a szoliter fibrózus tumor leginkább jellemző markerévé, habár ez sem bizonyult teljesen specifikusnak a tumortípus pontos identifikációjában. Napjainkra a NAB2-STAT6 fúziós gén felfedezése az SFT még pontosabb diagnosztikáját teszi lehetővé (2).
A szoliter fibrózus tumorok nagy része benignus, kevesebb, mint 20%-ban azonban malignus daganatként viselkedve lokálisan invazív és metasztázist képez (7).
Az SFT elsődleges kezelése a negatív sebészi széllel történő kimetszés, de még radikális excízió mellett is szoros utánkövetés javasolt a lokális recidíva lehetősége miatt (8). A sugár- és kemoterápia nem kellően hatékony, így a standard kezelésnek nem része, ám szelektált esetekben – multidiszciplináris döntést követően – egyénre szabott terápiás stratégiák is megfontolhatóak (2).
Esetismertetés
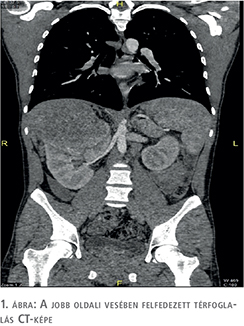
21 éves férfi páciensünk távolabbi kórelőzményében mindössze egy gyermekkori lágyéksérvműtét szerepel. Egy könnyűzenei fesztiválról alkoholos intoxikáció gyanújával a Siófoki Kórház Intenzív Osztályára került felvételre, ahol észlelése során többször vált hypoglykaemiássá, agresszív viselkedése miatt szedatívumokra szorult. Belgyógyászati kivizsgálása alkalmával felfedezésre került jobb oldali vesedaganata (1. ábra).
A térfoglalásból core biopsziás mintavétel történt, amely alapján low grade mesenchymalis daganat (fibromyxoid sarcoma variáns) lehetősége merült fel, így radikális nephrectomiát végeztünk.
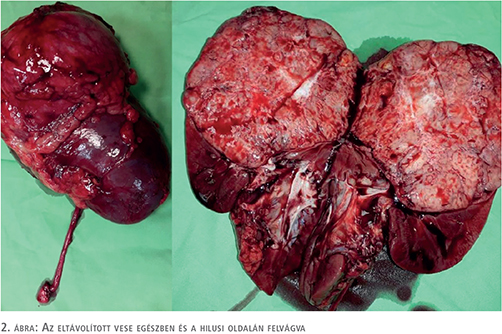
Makroszkóposan az eltávolított és hilusi oldalán felvágott vese felső és középső harmadát tejesen és az alsó harmadát részben kitöltő 11,5 cm × 10 cm × 8 cm nagyságú, jól körülírt, dominánsan szürkésfehér, néhol sárgásfehér tumort láttunk, amely centrumában pókhálószerű rajzolatot mutatott. Szabad szemmel vizsgálva a daganat a vese pyelonját és hilusát deformálta, de sem az üregrendszerbe, sem pedig a rostos tokba való betörés nem látszott (2. ábra).
Mikroszkóposan a mesenchymalis jellegű tumorsejtek mellett myxoid és fibrotikus gócok és kisebb-nagyobb nekrotikus területek is megfigyelhetőek voltak.
A veseállományra lokalizált tumor szélén többnyire tokszerű kötőszövet húzódott, de helyenként ez hiányzott, főleg a pyelon felé eső területeken. Nagy nagyítással elszórtan megfigyelhető volt ezen tokszerű struktúra infiltrációja. A hilusi képleteknek megfelelően tumorterjedés nem volt látható, egyetlen apró reaktív nyirokcsomó ábrázolódott.
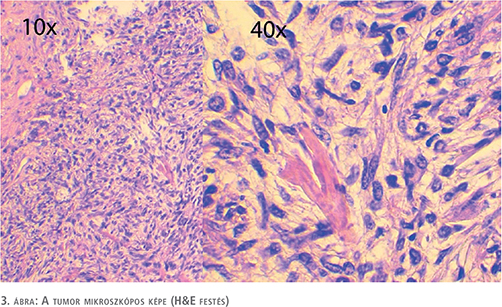
Az elvégzett immunhisztokémiai vizsgálatok során bár az SFT-re jellemző CD34-immunreakció negatív volt, de a STAT5-reakció pozitivitása szoliter fibrózus tumort igazolt és a low grade fibromyxoid sarcoma kizárásra került (3. ábra).
Bár a látott szöveti kép a malignitás kritériumait teljes egészében nem elégítette ki, tekintettel a tumor nagy méretére, a fokálisan emelkedett mitotikus aktivitásra, a daganat határán néhol megfigyelhető infiltratív növekedési jellegre, a szokatlan CD34-negativitásra és a fokális p53-pozitivitásra a patológiai lelet onkológiai követést javasolt.
Megbeszélés
Az angol nyelvű irodalomban 2019. februárig a PubMed adatbázisában (https://www.ncbi.nlm.nih.gov/pubmed/) a „solitary fibrous tumor”, a „kidney” és a „renal” keresőszavak kombinációit használva 78 darab primeren a veséből kiinduló szoliter fibrózus tumoros esetet azonosítottunk. Szinte kivétel nélkül első terápiás lépésként sebészeti beavatkozás történt, amely többnyire radikális nephrectomia volt, de több tumorreszekció és egy nephro-ureterectomia is közlésre került (9).
10 esetben szoliter vagy multiplex metasztázist is dokumentáltak (az összes eset 13%-a). A metasztázisok leggyakrabban a májban (6 esetben) és a tüdőben (5 esetben) kerültek leírásra, de előfordult nyirokcsomó (2 eset), csont (2 eset), peritoneum (10) (1 eset), pleura (11) (1 eset), pancreas (12)
(1 eset), és ellenoldali veseáttét is (13) (1 eset), amely radikális nephrectomiát követően 8 évvel később alakult ki kontralaterálisan.
Számos közleményben a metasztázisok a primer vesetumorral szimultán kerültek sebészi eltávolításra, összesen négy májreszekció, egy tüdőreszekció (14), egy pancreas-reszekció, egy ellenoldali vesereszekció és egy peritonealis metastasectomia került leírásra.
Az SFT kezelésében a világon elsőként egy kolumbiai esettanulmány adjuváns interferon-alfa-2b használatát dokumentálta egy tüdő- és pleurális áttétekkel rendelkező páciens kezelésénél és a betegséget progressziómentesnek írta le 23 hónappal későbbi utánkövetés alkalmával (11).
Egy esetben a sebészi eltávolítás helyett a vesedaganat obszervációját végezték, amely egyéves utánkövetés alkalmával progressziót nem mutatott (15).
Két közleményben került bemutatásra lokálrecidíva a veseágyban nephrectomiát követően (16, 17), mindkét alkalommal a recidíva ismételt sebészi eltávolítására került sor.
Egy esetben kétoldali vese SFT került közlésre (18), egyszer egy mindössze 3 éves gyermekben írták le (19), egy alkalommal pedig – közleményünkhöz hasonlóan – hypoglykaemia, mint paraneopláziás tünet vezetett a vese szoliter fibrózus tumorának felismeréséhez (20). E közleményben a visszatérő alacsony vércukorszintek hátterében a daganat által képzett, az inzulinnal nagyfokú strukturális és biokémiai homológiát mutató IGF-2 (insulin-like growth factor-2) állt, amelynek emelkedett szérumszintje a tumor reszekcióját követően normalizálódott és a hypoglykaemiás epizódok megszűntek.
Következtetések
A vese szoliter fibrózus tumora ritkán fordul elő és bár többnyire benignus viselkedésű, nem extrém ritka a metasztázisok, illetve a lokálrecidíva kialakulása sem. Kezelésének alapja elsődlegesen sebészi, amely áttétes esetben magában foglalja a metastasectomiát is. Tekintettel a recidíva és a távoli áttétképzés lehetőségére – akár évekkel később is – gondos utánkövetés ajánlott.
References
1. Salas S, Resseguier N, Blay JY, et al. Prediction of local and metastatic recurrence in solitary fibrous tumor: Construction of a risk calculator in a multicenter cohort from the French Sarcoma Group (FSG) database. Ann Oncol 28: 1979–1987, 2017. DOI: https://doi.org/10.1093/annonc/mdx250
2. Brian Davanzo, Robert E. Emerson, Megan Lisy. Solitary fibrous tumor. Transl Gastroenterol Hepatol. 2018 Nov 21; 3: 94. DOI: https://doi.org/10.21037/tgh.2018.11.02
3. D’Amico FE, Ruffolo C, Romano M et al. Rare neoplasm mimicking neuoroendocrine pancreatic tumor: A case report of solitary fibrous tumor with review of the literature. Anticancer Res 2017; 37: 3093–3097. DOI: https://doi.org/10.21873/anticanres.11665
4. Sun Z, Ding Y, Jiang Y, et al. Ex situ hepatectomy and liver autotransplantation for a treating giant solitary fibrous tumor: A case report ONCOLOGY LETTERS 2019; 17: 1042–1052. DOI: https://doi.org/10.3892/ol.2018.9693
5. Iorio B, Ronchi A, Montella M, et al. Malignant extrapleural solitary fibrous tumor arising in the sublingual gland: A case report and review of literature. Oral Oncol 2019 Jan 9. pii: S1368–8375(18)30476–7. DOI: https://doi.org/10.1016/j.oraloncology.2018.12.013
6. Rinaldo L, Xu SCY, Eggers SD, et al. Rare Occurrence of an Intraocular Choroidal Solitary Fibrous Tumor/Hemangiopericytoma. Ocul Oncol Pathol 2018 Jun; 4(4): 213–219. DOI: https://doi.org/10.1159/000481947
7. Robinson LA. Solitary fibrous tumor of the pleura. Cancer Control 2006; 13: 264–269. DOI: https://doi.org/10.1177/107327480601300403
8. Thway K, Ng W, Noujaim J, et al. The current status of solitary fibrous tumor: diagnostic features, variants, and genetics. Int J Surg Pathol 2016; 24(4): 281–92. DOI: https://doi.org/10.1177/1066896915627485
9. Guo G, Zhang X, Zhou ZH, et al. Clinical characteristics of malignant solitary fibrous tumors of the kidney with thoracic vertebral metastasis. Int J Urol 2012 Feb; 19(2): 177–8. DOI: https://doi.org/10.1111/j.1442–2042.2011.02921.x
10. Rodríguez Cruz, Hernández Sánchez, Blázquez, et al. Malignant solitary fibrous kidney tumor with peritoneal disease: a case report. Case Rep Nephrol Urol 2014 Apr 11; 4(1): 70–4. DOI: https://doi.org/10.1159/000362539
11. Cuello J, Brugés R. Malignant solitary fibrous tumor of the kidney: report of the first case managed with interferon. Case Rep Oncol Med 2013; 2013: 564980. DOI: https://doi.org/10.1155/2013/564980
12. Patel YA, Dhalla S, Olson MT, et al. Pancreatic metastasis from a solitary fibrous tumor of the kidney: a rare cause of acute recurrent pancreatitis. Pancreatology 2013 Nov-Dec; 13(6): 631–3. DOI: https://doi.org/10.1016/j.pan.2013.06.004
13. Cheung, Talanki, Liu, et al. Metachronous Malignant Solitary Fibrous Tumor of Kidney: Case Report and Review of Literature. Urol Case Rep 2015 Oct 17; 4: 45–7. DOI: https://doi.org/10.1016/j.eucr.2015.09.004
14. Sasaki, Kurihara T, Katsuoka Y, et al. Distant metastasis from benign solitary fibrous tumor of the kidney. Case Rep Nephrol Urol 2013 Jan; 3(1): 1–8. DOI: https://doi.org/10.1159/000346850
15. Petrella F, Monfardini L, Musi G, et al. Synchronous pleuro – renal solitary fibrous tumors: a new clinical-pathological finding. Minerva Chir 2009 Dec; 64(6): 669–71.
16. Usuba W, Sasaki H, Yoshie H, et al. Solitary Fibrous Tumor of the Kidney Developing Local Recurrence. Case Rep Urol 2016; 2016: 2426874. DOI: https://doi.org/10.1155/2016/2426874
17. Sfoungaristos S, Papatheodorou M, Kavouras A et al. Solitary fibrous tumor of the kidney with massive retroperitoneal recurrence. A case presentation. Prague Med Rep 2012; 113(3): 246–50. DOI: https://doi.org/10.14712/23362936.2015.23
18. Llarena Ibarguren, Eizaguirre Zarzai B, Lecumberri Castaños D, et al. Bilateral renal solitary fibrous tumor Arch Esp Urol 2003 Sep; 56(7): 835–40.
19. Wu WW, Chu JT, Romansky SG, et al. Pediatric renal solitary fibrous tumor: report of a rare case and review of the literature. Int J Surg Pathol 2015 Feb; 23(1): 34–47. DOI: https://doi.org/10.1177/1066896913492847
20. Khowaja A, Johnson-Rabbett B, Bantle J, et al. Hypoglycemia mediated by paraneoplastic production of Insulin like growth factor-2 from a malignant renal solitary fibrous tumor – clinical case and literature review. BMC Endocr Disord 2014 Jun 17; 14: 49. DOI: https://doi.org/10.1186/1472–6823–14–49
Glans reconstruction with split-thickness skin graft
DOI: 10.22591/magyurol.2019.2.muranyim.73
Authors:
Murányi Mihály dr.1, Juhász István dr.2, Drabik Gyula dr.1, Kiss Zoltán dr.1, Flaskó Tibor dr.1
1Debreceni Egyetem Általános Orvostudományi Kar, Urológiai Tanszék, Debrecen (tanszékvezető: Flaskó Tibor dr.);
2Debreceni Egyetem Általános Orvostudományi Kar, Bőrgyógyászati Tanszék, Debrecen (tanszékvezető: Remenyik Éva dr.)
Summary
Objective: A patient with penile cancer located on the glans penis is reported. The authors performed glansectomy and glans reconstruction with meshed split-thickness skin graft. To our knowledge, this is the first report of glans reconstruction with split-thickness skin graft in Hungarian literature.
Case report: The 73-year-old patient had a biopsy-proven verrucous carcinoma of the penis. Glansectomy and glans reconstruction was performed. A subcoronal incision was carried out and then the glans and prepuce was removed en block. The penile skin was fixed to the corporal bodies 3 cm from the tip of the corpora, creating the neosulcus. Urethra was sutured to the corporal tips. Area between the neosulcus and meatus was covered by meshed unexpanded split thickness skin graft. Postoperative period was uneventful. 14 months after surgery follow up examination did not revealed local recurrence or metastasis.
Conclusion: Besides complete primary tumour removal, organ preservation is major issue in penile cancer treatment. Small T1/T2 localised glandular and preputial tumours are ideal for penile-sparing surgery. The aims of organ preservation are ability of voiding in standing position, preserving sexual health and better cosmetic result.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Bevezetés: A szerzők hímvesszőrák miatti glansectomia és glans rekonstrukció esetét mutatják be. A műtét során alkalmazott hálósított félvastag bőrrel történő neoglans képzésről a hazai irodalomban korábban nem számoltak be.
Esetismertetés: A 73 éves férfi makkján elhelyezkedő tumorgyanús elváltozás biopsziája verrucosus karcinómát igazolt. A szerzők glansectomiát végeztek glans rekonstrukcióval. Subcoronalis metszés után a fitymát és a makkot egyben távolították el a barlangos testek csúcsának megőrzésével. A megmaradt hímvesszőbőrt a corpus cavernosumok csúcsától 3 cm-re kijelölt neosulcushoz rögzítették, a húgycsőcsonkot körkörösen a tunica albugineához szegték. A neosulcus és húgycsőnyílás közötti területet a comb elülső felszínéről eltávolított hálósított, nem expandált félvastag bőrgrafttal fedték. A graft teljes felülete megtapadt, a műtét utáni időszakban szövődményt nem észleltek. A műtét után 14 hónappal a beteg panaszmentes volt, lokális recidíva, áttét nem igazolódott.
Következtetések: Hímvesszőtumor esetén a primer daganat maradéktalan eltávolításán túl a hímvessző funkciójának megőrzése is lényeges szempont. Hímvesszőmegőrző műtét a makkot vagy fitymát érintő kisméretű T1-2 stádiumú daganat esetén lehetséges. Célja az állva vizelés képességének megtartása, a szexuális funkció megőrzése és kedvezőbb kozmetikai eredmény elérése.
Bevezetés
A hímvesszőrák kezelésének alapja a primer daganat maradéktalan eltávolítása. Ennek hagyományos módszere a péniszamputáció. Kisebb elváltozások esetén azonban lehetőség van annak széles tumormentes széllel történő eltávolítására. Csak a fitymát érintő folyamat esetén circumcisiót, a makkra lokalizálódó tumor esetén pedig glansreszekciót vagy glansectomiát végezhetünk. A műtéti kezelés kiválasztásakor figyelembe kell vennünk azt, hogy a hímvesszőmegőrző műtétek után a helyi kiújulás esélye magasabb a péniszamputációval összevetve, a teljes túlélésben azonban nincs különbség (1). Ez lehetőséget teremt arra, hogy a hímvessző funkcióját megőrző műtétek teret nyerjenek. Több hazai közlemény is bizonyítja e műtétek létjogosultságát (2, 3).
Egy makkon elhelyezkedő pénisztumoros férfi esetét ismertetjük, akin a makk eltávolítása után glans helyreállító műtétet végeztünk félvastag bőrátültetéssel. Az eset különlegessége, hogy ismereteink szerint a magyar szakirodalomban elsőként számolunk be félvastag bőr átültetésével végzett hímvessző-rekonstrukcióról.
Esetismertetés
A 73 éves férfi kórelőzményében Parkinson-kór, hypothyreosis és coeliakia szerepel. A makkon elhelyezkedő egyenetlen felszínű, vörhenyes, helyi kezelésre nem gyógyuló elváltozás miatt pénisz-biopsziát végeztünk. A szövettani vizsgálat malignitást nem igazolt, emiatt ismételt mintavételre került sor, amely verrucosus karcinómát mutatott ki. Fizikális vizsgálattal inguinalis nyirokcsomó-megnagyobbodás nem igazolódott. A hímvessző verrucosus karcinómája a kevésbé agresszív, jó prognózisú tumorok közé tartozik áttétképző hajlam nélkül, ezért hímvesszőmegőrző műtét mellett döntöttünk. Általános anesztéziában glansectomiát és glans rekonstrukciót végeztünk.
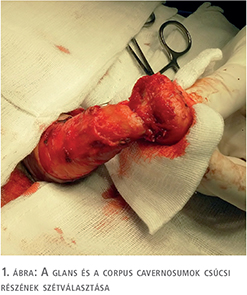
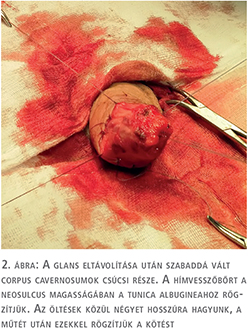
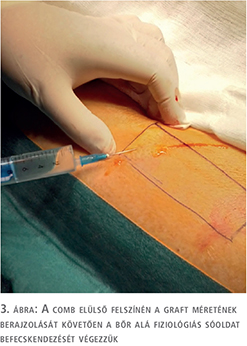
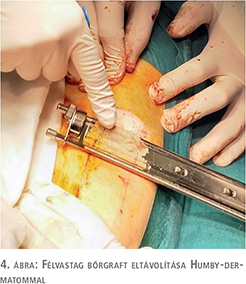
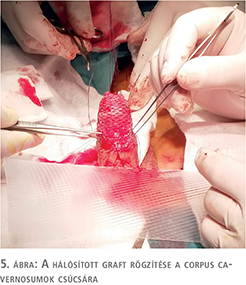
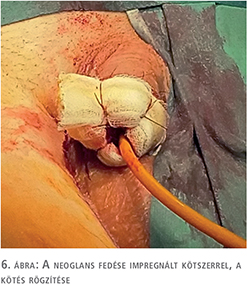
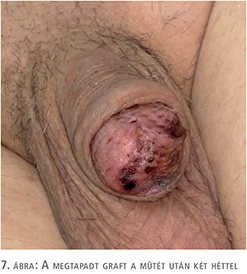
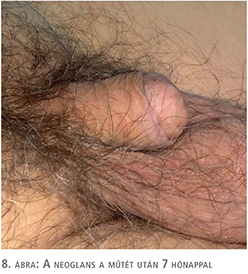
A fityma alatt vezetett subcoronalis metszés után a hímvessző dorsalis oldalától kezdve ventralis irányba haladva a glans penist élesen elválasztottuk a corpus cavernosum csúcsaitól (1. ábra). A preparálást addig folytattuk, amíg a húgycsövet el nem értük, ezt követően a húgycsövet átvágtuk. Az egyben eltávolított fitymát és makkot szövettani vizsgálatra küldtük. A makk csúcsából és a húgycsőcsonkból intraoperatív gyorsfagyasztott szövettani vizsgálatra kimetszést végeztünk. Ezek vizsgálata malignitást nem igazolt. A corpus cavernosumok csúcsától proximálisan 3 cm-re jelöltük ki a neosulcus magasságát. A hímvesszőbőr disztális szélét ebben a körkörös vonalban rögzítettük a tunica albugineához 4/0-ás polyglactin fonállal (2. ábra), majd a húgycsőcsonkot kiszegtük a corpus cavernosumok csúcsához. A neosulcus és húgycsőnyílás közötti terület fedését a jobb comb elülső felszínéről eltávolított hálósított félvastag bőrgrafttal végeztük, annak expanziója nélkül. A graft méretének meghatározásához lemértük a neosulcus kerületét, ez jelentette a graft hosszabb oldalát. Megmértük a neosulcus – húgycsőnyílás távolságát, ez képezte a graft rövidebb oldalát (3. ábra). A félvastag bőrgraft kimetszését Humby-dermatommal végeztük (4. ábra). A graftot hálósítottuk, ezzel megelőzve az alatta felgyülemlő haematomát, amely a megtapadást veszélyeztetné. A graftot a neosulcushoz, a húgycsőnyíláshoz és a sebalaphoz is rögzítettük 5/0-ás poly-p-dioxanon fonállal (5. ábra). Katéterbehelyezést követően a neoglansot impregnált kötszerrel fedtük, amelyet a neosulcus és húgycsőnyílás hosszúra hagyott fonalaival rögzítettünk (6. ábra). A graft teljes felületén megtapadt (7. ábra), a műtét utáni időszakban szövődményt nem észleltünk, a beteget a műtét után hét nappal bocsátottuk haza. A végleges szövettani vizsgálat pT1a, G1 laphámrákot igazolt ép sebészi széllel. A műtét után 7 és 14 hónappal történt ellenőrző vizsgálaton a beteg panaszmentes volt, lokális recidíva, inguinalis nyirokcsomó-megnagyobbodás vagy áttét jeleit nem észleltük (8. ábra).
Megbeszélés
A hímvessző tumorainak többsége laphámrák, amely a makkból vagy a fityma bellemezéből indul ki. A kezelés alapvető eleme a primer daganat eltávolítása. Hímvesszőmegőrző műtét (a tumor széles kimetszése, circumcisio, a glans epithelium eltávolítása, glansreszekció, glansectomia) után a helyi kiújulás rizikója magasabb, mint péniszamputáció után. Djajadiningrat és munkatársai 1000 beteg adatainak elemzése után arról számoltak be, hogy a hímvesszőmegőrző műtétek esetén a helyi kiújulás 27%, péniszamputáció után pedig 3,8%. A két csoport túlélésben azonban nem találtak szignifikáns eltérést (1). A beteg életkilátásait tehát nem a primer tumor határozza meg elsősorban. A nyirokcsomóáttétek megléte, ezek eltávolítása, illetve a nyirokcsomóáttétek kiújulása ebből a szempontból lényegesen nagyobb szerepet játszik. Leijte és munkatársai 700 beteg retrospektív vizsgálata során azt találták, hogy amíg a pénisztumor helyi kiújulása esetén az 5 éves túlélés 92%, a nyirokcsomó-régiókban kialakuló kiújulás esetén 32,7% (4).
A korábban általánosan alkalmazott elv, miszerint a pénisztumort 2 cm-es ép széllel szükséges eltávolítani, nem érvényes minden esetben. Az európai irányelv jelenleg a makkra lokalizálódó kisméretű T1 és T2 tumorok esetén hímvesszőmegőrző műtétet javasol. A tumormentes sebészi szél vastagságát 3-5 mm-ben határozza meg. Az ennél lokálisan kiterjedtebb tumorok esetén és a funkciómegőrző műtétre alkalmatlan betegek esetén a péniszamputáció továbbra is indikált (5). Fontos hangsúlyozni, hogy onkológiai szempontból a hímvesszőmegőrző műtéteknél is kritérium a tumormentes sebészi szél, amelyet a műtét során a reszekátum alapjából, széleiről vett minta intraoperatív szövettani vizsgálatával kell ellenőrizni.
A péniszamputáció a beteg életminőségét több szempontból is rontja. A hímvessző rövidsége az állva vizelést megnehezíti, vagy teljesen lehetetlenné is teheti. A műtét után a közösülési készség értelemszerűen károsodik a hímvessző rövidsége és a makk hiánya miatt. Végül nem szabad megfeledkeznünk a lelkileg nehezen feldolgozható kozmetikai eredményről sem.
A hímvessző megőrzésére számos lehetőségünk van a tumor helyi stádiumától és elhelyezkedésétől függően. Csak a fitymát érintő folyamat esetén a körülmetélés, egy kisméretű, nem invazív tumor esetén a széles kimetszés is végleges kezelés jelenthet. A makkon elhelyezkedő nem invazív laphámrák kezelhető a makk epiheliumának teljes vagy részleges eltávolításával és bőr- vagy nyálkahártyafolttal történő pótlással (6). A makkot érintő T1-2 stádiumú tumorok esetén glansreszekció vagy glansectomia után a makk rekonstrukciója történhet bőrgrafttal (7), szájnyálkahártya-grafttal (2) vagy tunica vaginalisből képzett grafttal (8). Magyarországon elsőként Pajor és munkatársai számoltak be esztétikus neoglans képzésről szájnyálkahártya felhasználásával négy eset kapcsán (2). A nemzetközi irodalomban, legnagyobb számban a félvastag nem hálósított bőrgrafttal történő neoglans képzéssel találkozhatunk (7).
Jelen dolgozatunkban glansectomia után a combról eltávolított hálósított félvastag bőrrel történő hímvessző-rekonstrukciról számolunk be. A hálósítás célja esetünkben nem a graft méretének növelése, hanem a graft alatt kialakuló haematoma, exsudatum felhalmozódásának megelőzése, ezzel a graft megtapadásának elősegítése. A Pajor és munkatársai által bemutatott szájnyálkahártyafolt felhasználásával kialakított neoglansszal (2) szemben a félvastag bőr alkalmazásának több előnye van: nagyobb méretű graft nyerhető, a műtét után a makk hidratáló krémes kezelése nem szükséges, a zsugorodás esélye kisebb. A módszer hátránya, hogy a neoglans színe kevésbé hasonlít a makk eredeti színéhez, a donorterület pedig kozmetikai szempontból kedvezőtlenebb helyen van.
Következtetések
Jelenlegi ismereteink szerint a hímvesszőtumorban szenvedő betegek túlélését nem befolyásolja az, hogy a primer tumort hímvesszőmegőrző műtéttel vagy péniszamputációval kezeljük. Ebből következik az az elv, hogy hímvesszőtumor esetén amellett, hogy a primer daganatot maradéktalanul eltávolítjuk, törekednünk kell a hímvessző funkciójának megőrzésére. Ezzel lehetővé tesszük az állva vizelés képességének megtartását, javítjuk a szexuális funkciót és kedvezőbb kozmetikai eredményt érünk el.
References
1. Djajadiningrat RS, van Werkhoven E, Meinhardt W, et al. Penile sparing surgery for penile cancer-does it affect survival? J Urol 2014 Jul; 192(1): 120–5. DOI: https://doi.org/10.1016/j.juro.2013.12.038
2. Pajor L, Király I, Sükösd F. Esztétikus neoglans képzés szájnyálkahártyából. Magy Urol 2011; 4: 184–188.
3. Bajory Z, Pajor L. A glans reszekciójának rekonstrukciós lehetőségei. Magy Urol 2012; 24(3): 211.
4. Leijte JA, Kirrander P, Antonini N, et al. Recurrence patterns of squamous cell carcinoma of the penis: recommendations for follow-up based on a two-centre analysis of 700 patients. Eur Urol. 2008 Jul; 54(1): 161–8. DOI: https://doi.org/10.1016/j.eururo.2008.04.016
5. Hakenberg OW, Compérat E, Minhas SA, et al. EAU Guidelines on Penile Cancer. Arnhem: EAU Guidelines Office 2018. p. 15–8.
6. Palminteri E, Berdondini E, Lazzeri M, et al. Resurfacing and reconstruction of the glans penis. Eur Urol 2007 Sep; 52(3): 893–8. DOI: https://doi.org/10.1016/j.eururo.2007.01.047
7. Parnham AS, Albersen M, Sahdev V, et al. Glansectomy and Split-thickness Skin Graft for Penile Cancer. Eur Urol 2018 Feb; 73(2): 284–289. DOI: https://doi.org/10.1016/j.eururo.2016.09.048
8. Weibl P, et al. Neo-glans reconstruction for penile cancer: Description of the primary technique using autologous testicular tunica vaginalis graft. Arab J Urol 2018 Mar 21; 16(2): 218–223. DOI: https://doi.org/10.1016/j.aju.2018.02.002
The role of Uro-Vaxom in the treatment and prevention of acute cystitis
DOI: 10.22591/magyurol.2019.2.magyara.78
Authors:
Magyar András dr., Tenke Péter dr.
Jahn Ferenc Dél-pesti Kórház és Rendelőintézet, Urológiai Osztály, Budapest (osztályvezető: Tenke Péter dr.)
Summary
Introduction: Non-antibiotic approaches are of high priority in the prevention of recurrent cystitis, due to the global emergence of bacterial resistance to antibiotics. Uro-vaxom (OM-89), a lyophilized extract of Escherichia coli, is one of the most important drugs for non-antibiotic prophylaxis of recurrent cystitis. Its efficacy for reducing recurrent cystitis episodes has been investigated in several studies. Our objective was to review available publications on this immunoprophylactic drug.
Methods: A PubMed search was performed and references from available systematic reviews were summarised. The main outcomes of interest were: 1) the effects of the drug, 2) its efficacy in the prevention of recurrent cystitis episodes, 3) development of immunity versus several pathogens, 4) time of the initiation of the treatment 5) drug administration schemes and scheduling. Results: prophylaxis with Uro-Vaxom decreases the episodes of recurrent cystitis by 36% for at least 6 months therefore the administration of antibiotics may be reduced. Its efficiency is not influenced by the causative pathogen.
Conclusions: Out of all agents for non-antibiotic prophylaxis of acute cystitis Uro-Vaxom has the strongest evidence of its efficiency, which may be further amplified by its intermittent use.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Bevezetés: A növekvő bakteriális rezisztencia miatt a visszatérő cystitis megelőzésében a nem antibiotikum-alapú módszerek alkalmazása rendkívül fontos. Ezek közé tartozik az Uro-Vaxom liofilizált Escherichia coli baktérium lizátumot tartalmazó készítménnyel (OM-89) történő immunoaktív profilaxis. Visszatérő cystitis megelőzésében hatékonyságát több tanulmány elemezte. Célunk ezen vizsgálatok eredményeinek összefoglalása.
Módszerek: A rendelkezésre álló közleményeket PubMed-en történő kereséssel és a témában leközölt összefoglaló közlemények alapján gyűjtöttük össze a következő szempontok szerint: 1) a kezelés hatásainak vizsgálata, 2) alkalmazása visszatérő hólyaghurut megelőzésében 3) kialakuló immunitás több kórokozóval szemben, 4) adagolás időzítése, 5) kezelési, immunizálási sémák.
Eredmények: Az Uro-Vaxom profilaxis, kórokozótól függetlenül, 6 hónap alatt 36%-kal csökkenti a visszatérő heveny hólyaghurutos fellángolások arányát, ezáltal mérsékelhető az antibiotikum-felírások száma.
Következtetések: A visszatérő hólyaghurut nem antibiotikum-alapú megelőzésében alkalmazható készítmények közül az Uro-Vaxom rendelkezik a legerősebb tudományos alapokkal. Intermittáló alkalmazásával hatékonysága tovább növelhető.
Bevezetés
A világszerte egyre növekvő bakteriális antibiotikum-rezisztencia megakadályozása érdekében fontos szemléletváltozás szükséges az infekciók kezelése terén. A rendkívül gyakori húgyhólyaghurut miatt felírt antibiotikumok jelentősen hozzájárulnak a rezisztencia növekedéséhez. A legjobb eredmény a nem antibiotikum-alapú megelőzési technikák bevezetésével és az egyéb hajlamosító tényezők kiiktatásával érhető el. Visszatérő hólyaghurut esetén a betegek oktatása, tájékoztatása a kezelés szerves részét kell, hogy képezze, hiszen ezzel segíthető elő a kockázati tényezők elkerülésére irányuló jobb együttműködés, mindazonáltal a kezeléssel szemben reálisabb betegelvárások érhetők el. A nem antibiotikum-alapú megelőzési módszerek közé tartozik az Uro-Vaxom liofilizált Escherichia coli baktérium lizátumot tartalmazó készítménnyel (OM-89) történő immunoaktív profilaxis. Jó minőségű, randomizált vizsgálatok támasztják alá előnyeit nők visszatérő húgyúti fertőzéseinek megelőzésében a placebóval szemben (1). Célunk ezen tanulmányok eredményeinek összefoglalása és elemzése.
Módszerek
Szisztematikus irodalomkutatást végeztünk a PubMed rendszerben időre és nyelvre való korlátozások nélkül a következő kulcsszavakkal: „Uro-Vaxom”, „OM-89” és/vagy „recurrent cystitis”. Ezen kívül az így azonosításra került, a témában korábban leközölt összefoglaló közlemények irodalomjegyzékeit is felhasználtuk a tanulmányok azonosításához. A publikációk eredményeit a következő szempontok szerint értékeltük:
- a kezelés hatásainak vizsgálata,
- alkalmazása visszatérő hólyaghurut megelőzésében,
- kialakuló immunitás több kórokozóval szemben,
- adagolás időzítése,
- kezelési, immunizálási sémák.
Eredmények
Az irodalomkutatás során az Európai Urológus Társaság legfrissebb, 2019-ben megjelent ajánlásain kívül 6, az Uro-Vaxom hatékonyságát, továbbá a kezelés időzítését, javasolható kezelési sémákat elemző, jelentős tudományos értékű eredeti klinikai vizsgálat eredményeit foglaltuk össze (1–7).
Hatékonyságot alátámasztó klinikai vizsgálatok, tudományos publikációk
Az Európai Urológus Társaság legújabb, 2019-ben megjelent ajánlásai szerint a visszatérő hólyaghurut ellátásában a növekvő bakteriális antibiotikum-rezisztencia miatt a nem antibiotikum-alapú megelőzésre kell fektetni a hangsúlyt.
Az Európai Urológus Társaság, figyelembe véve több jól dokumentált, randomizált vizsgálat eredményeit kihangsúlyozta, hogy a számos rendelkezésre álló nem antibiotikum-alapú profilaktikus készítmény közül a legerősebb evidenciaszinttel (1a) és a legerősebb ajánlással (Strong) az OM-89 immunprofilaxis rendelkezik. A lokális ösztrogénkészítmények gyenge ajánlási (Weak) és evidenciaszintet (1b) képviselnek, míg a probiotikumok, a tőzegáfonya-kivonatok, D-mannóz és a hólyag-instillációs megelőzési módok hatékonyságának tudományos megítéléséhez további vizsgálatok elvégzése szükséges (2). 2009-ben Naber és munkatársai által végzett metaanalízis kimutatta, hogy egyszeri, három hónapos Uro-Vaxom kezelés 6 hónap alatt 36%-kal, szignifikánsan csökkenti a heveny hólyaghurutos fellángolások arányát, ezáltal mérsékelheti az antibiotikum-kezelések számát, mindemellett igen kedvező mellékhatásprofillal rendelkezik. Megállapították továbbá, hogy a kezelési időszak alatt is felléphet heveny hólyaghurut-fellángolás, azonban a kezelt csoportban ötből három betegnél nem jelentkezett ez idő alatt hólyaghurut, és azok a betegek, akiknél mégis előfordult, 35%-kal kevesebb visszatérést fognak tapasztalni a placebocsoporthoz képest (7). 1999-ben Huber és munkatársai kimutatták, hogy a kezelés hatására nemcsak E. coli, hanem számos más uropatogén kórokozóval szemben is megemelkedett ellenanyagszint érhető el (5). Krebs és munkatársai által 2018-ban publikált vizsgálat eredményei pedig arra utalnak, hogy sem a kitenyészett kórokozó, sem egyéb vizsgált tényezők nem befolyásolják szignifikánsan az Uro-Vaxom hatékonyságát, ami szintén igazolja, hogy a készítmény több kórokozóval szemben is hatékony védelmet biztosít (6).
A kezelés megfelelő időzítését és ütemezését elemző vizsgálatok
Uro-Vaxom adagolással kapcsolatban az érvényes alkalmazási előiratban nincs hivatalos álláspont a kúra ismétlésével kapcsolatban. Feltételezések szerint a legmegfelelőbb immunitás eléréséhez, a kezdeti immunizálást követően megerősítő, úgynevezett „boost” immunaktív profilaxis alkalmazása szükséges. Azonban az immunrendszer hosszú távú stimulálása kedvezőtlen hatással bír, a kezelés hatékonyságának csökkenéséhez vezethet. Ezért a hagyományos német, úgynevezett intermittáló séma szerint három hónapig tartó Uro-Vaxom kezelést követően a kezelés három hónapig tartó szüneteltetése javasolt, majd ismételt három hónapos, úgynevezett „booster” kezelés indokolt, amely napi 1 kapszula adását jelenti mindhárom hónapban 10 napon keresztül. Bauer és munkatársai (2005) kimutatták, hogy ezzel a módszerrel tovább csökkenthető a húgyúti fertőzések visszatérésének aránya (3, 4), amelyet a Krebs és munkatársai által 2018-ban közzétett vizsgálat is megerősített (6).
Megbeszélés
A baktériumok antibiotikum-rezisztenciájának világméretű növekedése miatt a visszatérő hólyaghurut nem antibiotikum-alapú profilaxisa egyre nagyobb jelentőségű. A nem antibiotikum-alapú megelőzési módszerek közül a 18 különböző E. coli baktériumtörzs lizátumot tartalmazó Uro-Vaxom a legerősebb tudományos bizonyítékokkal bíró, az Európai Urológus Társaság irányelveiben megfogalmazott legmagasabb ajánlási szintet képviselő készítmény. A 3 hónapos, antibiotikummal együtt indított Uro-Vaxom profilaxis azáltal, hogy aktiválja a szervezet saját védekező mechanizmusát, 6 hónap alatt 36%-kal csökkenti a heveny hólyaghurutos fellángolások arányát, ezáltal csökkentve az antibiotikum-felírásokat is (7). Mivel bizonyított, hogy az Uro-Vaxom számos uropatogén kórokozóval szemben hatékony (6), nem szükséges a tenyésztés eredményét megvárni, a 3 hónapos kúrát az antibiotikum-kezeléssel egy időben érdemes indítani. Uro-Vaxom adagolással kapcsolatban jelenleg nincs hivatalos álláspont a kúra ismétlésével kapcsolatban. A hagyományos német séma szerint azonban a három hónapos, napi egyszeri Uro-Vaxom kúra után három hónapig tartó szüneteltetés szükséges, majd ezt követően újabb három hónapos, havi 10 napon át tartó megerősítő kezeléssel fokozható tovább a megelőzés hatékonysága (3).
Következtetések
Az Európai Urológus Társaság irányelveiben a visszatérő cystitis megelőzésében magas prioritással bír a nem antibiotikum-alapú módszerek alkalmazása. E tekintetben az Uro-Vaxom készítmény hatékonysága rendelkezik a legerősebb tudományos alapokkal. Kúraszerű, intermittáló alkalmazása jelentősen csökkenti a visszatérő húgyúti fertőzések számát. Ugyanakkor a legjobb terápiás eredményhez elengedhetetlen a betegoktatás, a hajlamosító tényezők azonosítása és kiiktatása, valamint a nem antibiotikum-alapú megelőzési módszerek kombinálása.
Támogatás
A cikk megírását és megjelenését a Phytotec Hungária (1026 Budapest, Szilágyi Erzsébet fasor 61.) szponzorálta.
References
1. Beerepoot MA, Geerlings SE, van Haarst EP, van Charante NM, ter Riet G. Nonantibiotic prophylaxis for recurrent urinary tract infections: a systematic review and meta-analysis of randomized controlled trials. The Journal of urology 2013; 190(6): 1981–9. DOI: 10.1016/j.juro.2013.04.142.
2. Bonkat G BR, Bruyére F, Cai T, Geerlings SE, Köves B. EAU Guidelines on Urological Infections. https://uroweb.org/. 2019.
3. Bauer HW, Alloussi S, Egger G, Blumlein HM, Cozma G, Schulman CC, et al. A long-term, multicenter, double-blind study of an Escherichia coli extract (OM-89) in female patients with recurrent urinary tract infections. Eur Urol 2005; 47(4): 542–8; discussion 8. DOI: https://doi.org/10.1016/j.eururo.2004.12.009
4. EW R. Immunological therapy of recurrent urinary tract infections with immunoactive E. coli fractions in women. Int Urogynecol J 1992; 3: 179–184. DOI: https://doi.org/10.1007/BF00454997
5. Huber M, Baier W, Serr A, Bessler WG. Immunogenicity of an E. coli extract after oral or intraperitoneal administration: induction of antibodies against pathogenic bacterial strains. International journal of immunopharmacology 2000; 22(1): 57–68. DOI: https://doi.org/10.1016/S0192-0561(99)00064-8
6. Krebs J, Fleischli S, Stoyanov J, Pannek J. Effects of oral immunomodulation therapy on urinary tract infections in individuals with chronic spinal cord injury-A retrospective cohort study. Neurourology and urodynamics 2019; 38(1): 346–52. DOI: https://doi.org/10.1002/nau.23859
7. Naber KG, Cho YH, Matsumoto T, Schaeffer AJ. Immunoactive prophylaxis of recurrent urinary tract infections: a meta-analysis. International journal of antimicrobial agents 2009; 33(2): 111–9. DOI: https://doi.org/10.1016/j.ijantimicag.2008.08.011