— 2019-3 —- Full Articles
Prevention for recurrent lower urinary tract infections
DOI: 10.22591/magyurol.2019.3.ganyeczm.106
Authors:
Ganyecz Máté dr., Köves Béla dr., Tenke Péter dr.
Jahn Ferenc Dél-pesti Kórház, Urológia osztály, Budapest (osztályvezető: Tenke Péter dr.)
Summary
Half of women suffer from acute lower urinary tract infection at least once in their lifetime and 20% of cases develop recurrent urinary tract infection. The disease has a detrimental impact on patient’s quality of life; and 60% of patients have some degree of depression that can be reduced by up to 30-40% with appropriate preventive treatment. In developed countries, this disease represents a significant financial burden on the health care system and on the other hand result in a high number of days off work. In the case of recurrent cystitis, it is not sufficient to treat the current infection a greater emphasis should be placed on the appropriate prophylaxis. From the options of the preventive methods, non-antibiotic-based methods should always be preferred, and antibiotic prophylaxis is only recommended in case of failure.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 3. SZÁM
Összefoglalás
A nők felénél alakul ki akut hólyaghurut élete folyamán legalább egy alkalommal és az esetek 20%-ában alakul ki visszatérő hólyaghurut. A betegségnek komoly negatív hatása van az életminőségre; a betegek 60%-ánál kimutatható valamilyen fokú depresszió, amely megfelelő kezelés alkalmazásával akár 30-40%-kal csökkenthető. A fejlett országokban ez nagy anyagi terhet jelent az egészségügyi ellátórendszer leterhelése, illetve az emiatt a munkából kiesett napok magas száma miatt. Visszatérő hólyaghurutnál nem elégséges az aktuális fertőzést kezelni, nagyobb hangsúlyt kell fektetni a megfelelő profilaxis alkalmazására. A megelőzési lehetőségek közül mindig a nem antibiotikumon alapuló módszereket szükséges előnyben részesíteni, antibiotikum-profilaxis csak ezek sikertelensége esetén javasolt.
Bevezetés
Visszatérő hólyaghurutról akkor beszélünk, ha a páciensnek az elmúlt 6 hónapban legalább kettő, vagy az elmúlt évben legalább 3 alkalommal volt húgyúti fertőzése. Visszatérő húgyúti fertőzésre anatómiailag és funkcionálisan ép húgyutakkal bíró, egyébként egészséges fiatal nők is hajlamosak lehetnek (1). A kezelést követő 6 hónapon belül az esetek 25%-ában, 1 éven belül pedig az esetek 44%-ában visszaesés következik be (2). Amennyiben 2 héten belül térnek vissza a tünetek relapszusról, ha ennél hosszabb idő múlva, akkor reinfekcióról beszélhetünk.
A visszatérő hólyaghurut nagyon gyakori betegség, minden második nőnél jelentkezik akut hólyaghurut élete folyamán legalább egy alkalommal, és ezen esetek 20%-ában alakul ki visszatérő hólyaghurut (3). A betegségnek komoly negatív hatása van az életminőségre, egy felmérés szerint a recidív cystitisben szenvedő nők több mint felénél lehetett valamilyen fokú depressziót kimutatni. Ezek a betegek gyakran szoronganak betegségük miatt, és megoldást keresve sokszor több orvost is felkeresnek, de nem mindig kapják meg a megfelelő kezelést ezért bizalmukat vesztik, pedig megfelelő kezeléssel az esetek jó része megelőzhető lenne. A visszatérő hólyaghurut az urológus számára is egy frusztráló betegség, amely nagy türelmet igényel, mivel ezek a betegek gyakran visszatérnek, és sokszor csak újabb és újabb antibiotikumot kapnak, amely csak erősíti a betegségérzetüket és fokozza az egyre rezisztensebb kórokozók kialakulásának veszélyét.
Az összefoglaló közlemény ajánlásai az EAU irányelvei alapján készültek.
Rizikófaktorok
A menopauza előtti korcsoportban a visszatérő hólyaghurut legfontosabb rizikófaktorai a gyakori közösülés, a különböző fogamzásgátló módszerek alkalmazása (elsősorban a spermicid gél használata), saját és anyai anamnézisben szereplő húgyúti infekció, a 15 éves kor előtt jelentkező első húgyúti infekció, egy éven belül új szexuális partner, menstruáció utáni időszak, illetve a hüvelyflóra károsodása (4, 5). A viselkedéssel (folyadékfogyasztási szokások, vizeletürítési szokások, székelés utáni higiéné, tamponhasználat, szűk műszálas ruhák viselése) kapcsolatos korreláció nem volt egyértelműen bizonyítható. Egy vizsgálat szerint a szexuális együttlét volt a legfontosabb rizikófaktor, amely a közösülések számával mutatott összefüggést, havi 4-8 szexuális együttlét közel 6×-os, 9-nél több együttlét már több mint 10×-es rizikót jelentett (6).
Genetikai okok is feltételezhetően szerepet játszanak a visszatérő hólyaghurut kialakulásában, tekintettel arra, hogy akinél első fokú rokonnál fordult elő a betegség az 3,1×-es, ha már két női rokonnál az már 5,1×-es rizikót jelentett (7).
Menopauzát követően további fontos rizikófaktorok a csökkent ösztrogénszint és következményesen megváltozott hüvelyflóra, vizeletinkontinencia, korábbi katéterviselés és a kórelőzményben szereplő húgyúti fertőzések.
Kórokozók
Nemzetközi felmérések (pl. ARESC – Antimicrobial Resistance Epidemiological Survey on Cystitis) szerint Echerichia coli törzsek felelősek az egyszerű hólyaghurut mintegy 75%-áért. Mintegy 4%-ban fordul elő Enterococcus faecalis, 4%-ban Staphylococcus saprophyticus, 3,5%-ban, Klebsiella pneumoniae és P. mirabilis 3,4%-ban (8). A tünetes betegek 10-15%-ánál nem igazolható kórokozó hagyományos módszerekkel (9, 10).
A kórokozók fokozódó antibiotikum-rezisztenciája egyre aggasztóbb világméretű egészségügyi probléma. Az antibiotikum-rezisztencia fokozódó mértéke sajnos fordított arányban van az újonnan forgalomba kerülő antibiotikumok számával (11). A hatékony kezeléshez emiatt nagyon fontos az adott ország húgyúti infekciókért felelős leggyakoribb kórokozóinak, illetve azok helyi rezisztenciaviszonyainak ismerete. Általánosságban nem ajánlott empirikusan olyan antibiotikum használata, amivel szemben a várható kórokozó rezisztenciája az adott területen a 20%-ot meghaladja. Emiatt például hazánkban a korábban széles körben alkalmazott trimethropim-sulphametoxazol (TMP-SMX) kezelés alsó húgyúti fertőzésekben empirikusan már nem ajánlott (12). Az ARESC-vizsgálat igazolta a kórokozók ciprofloxacinnal szemben fokozódó rezisztenciáját, amely Magyarországon már a 10%-ot is meghaladja. Mindazonáltal Európában és hazánkban továbbra is viszonylag alacsony a rezisztencia nitrofurantoinnal (4,8%) és fosfomycinnel (<2%) szemben (8).
Menopauza után kialakuló nem-komplikált akut húgyúti fertőzéseket ritkábban okozzák E. coli törzsek (kb. 50%-ban), mint azt a menopauza előtt, ugyanakkor két-háromszor gyakrabban izolálhatók a vizeletből más Gram-negatív baktériumok, főleg Klebsiella pneumoniae, illetve Enterococcusok törzsek is nagyobb arányban fodulnak elő.
Diagnosztika
Az alsó húgyúti fertőzések biztos diagnózisát a beteg panaszai mellett fennálló szignifikáns bakteriuria jelenti. A hólyaghurut panaszai nagyon típusosak: gyakori, fájdalmas vizelés, állandó vizelési inger, alhasi fájdalom, esetenként véres vizelet. Egyéb panaszok hiányában jelentkező vérvizelés (néma haematuria) hólyaghurutra nem típusos, ilyenkor további kivizsgálás szükséges. Szignifikáns bakteriuriáról cystitis esetén akkor beszélünk, ha a spontán ürített középsugaras vizeletéből legalább 103 cfu/ml kórokozó tenyészik ki (13) (panaszmentes nők esetén 105 cfu/ml csíraszámot tekintjük szignifikánsnak). Egyszerű, nem ismétlődő heveny hólyaghurut esetén vizelettenyésztés elvégzése nem kötelező, azonban visszatérő esetekben a vizelettenyésztés nélkülözhetetlen.
A nem komplikált fertőzések monobakteriálisak, tehát általában egy baktériumtörzs okozza. Ha egynél több kórokozó tenyészik ki, vagy komplikáló tényezőre (kő, divertikulum, idegentest, anatómiai rendellenesség), vagy kontaminációra kell gondolnunk.
Ha az üledékben szignifikáns bakteriuria van, és a tenyésztés negatív, akkor a kapott eredmény valószínűleg álnegatív, ilyenkor nem szűnő panaszok, vagy korai relapszus esetén a vizelettenyésztés ismétlése javasolt.
A felső húgyutak ellenőrzésére ultrahangvizsgálat elegendő, amennyiben ez eltérést nem igazol további képalkotó vizsgálatok (pl. pyelográfia, cisztográfia, cisztoszkópia) alkalmazása nem javasolt (14).
Kezelés
Visszatérő hólyaghurut esetén az akut epizód kezelése megegyezik az egyszeri hólyaghurut kezelési ajánlásaival. A guideline ajánlása szerint ilyenkor antibiotikum-kezelés szükséges, figyelembe véve a kórokozók régió szerinti rezisztenciaviszonyait, az ökológiai hatásokat, a gyógyszer mellékhatásait, költségeket, hozzáférhetőséget, gyógyszerérzékenységet stb. (12), Hazánkban fosfomycin trometamol 3 g egy dózisban, nitrofurantoin 3×100 mg 5 napig, esetleg béta-laktám antibiotikumok javasolhatóak. Fluorokinolonok alkalmazása első vonalban akut hólyaghurutban nem javasolt!
Megelőzés
Visszatérő hólyaghurut esetén az akut epizódok kezelésén túl a hangsúlyt a fertőzés megelőzésére kell helyezni. Először természetesen mindig zárjuk ki valamely esetlegesen fennálló komplikáló tényező (fertőzött vesekő, húgyhólyagkő, fejlődési rendellenesség, maradékvizelet, cystokele stb.) lehetőségét. Elengedhetetlen továbbá, hogy a beteg megértse a saját állapotát, nem lehet ezért eléggé hangsúlyozni a betegedukáció fontosságát.
Ezután a megelőzési stratégiánkat mindig lépcsőzetesen építsük fel. Első lépésben az életmódbeli tanácsok következnek: megfelelő folyadékfogyasztás, spermicid szerek kerülése, hólyag kiürítése aktust követően, szűk műszálas ruhák viselésének kerülése.
Az aktív megelőzési lehetőségek közül mindig a nem antibiotikummal végzett módszerek részesítendők előnyben, antibiotikum-profilaxist csakis ezek hatástalansága esetén alkalmazzunk.
Nem antibiotikummal végzett profilaxis
Számos különböző nem antibiotikum-alapú megelőzési módszer áll rendelkezésre, szükség esetén ezek együttesen, kombinációban is alkalmazhatóak.
Immunoaktív profilaxis (OM-89)
A nem antibiotikummal végzett profilaxis egyik formája az orálisan alkalmazott immunaktív profilaxis. Az OM-89 készítmény 18 különböző szerotípusú liofilizált uropatogén E. coli törzset tartalmaz, ami az immunrendszert stimulálva növeli a keringő T-limfociták számát, elősegíti a kórokozók elpusztításáért felelős ellenanyagok termelését, illetve lokálisan is növeli az ellenanyagszintet a húgyhólyagban. Több randomizált, kontrollált vizsgálat is igazolta, hogy az orális immunoaktív profilaxis hatékonyan csökkenti a recidívák számát és a szükséges antibiotikum-kezeléseket. Az ezen vizsgálatokból készült metaanalízis eredményei szerint a készítmény 6 hónap után 36%-kal csökkentette az alsó húgyuti fertőzéses epizódok számát, jó biztonsági profil mellett (15).
Tőzegáfonya
A nem antibiotikummal végzett másik sokat vizsgált profilaktikus módszer a tőzegáfonya fogyasztása. Legfontosabb hatóanyagai a proantocianidinek (PAC), amelyek kísérletek alapján az E. coli törzsek megtapadását gátolják az uroepitheliumhoz. Különböző formában fogyasztható; profilaxisként az urológiai irányelvek minimum napi 36 mg proantocianidin bevitelét javasolják, ez kb. 300 ml áfonyalének felel meg. Számos randomizált kontrollált vizsgálatot végeztek a tőzegáfonya hatékonyságának bizonyítására, azonban az ezekből készített metaanalízis eredményei alapján hatásossága jelenleg nem egyértelmű (16). Ebben azonban valószínűleg annak is szerepe van, hogy az elvégzett vizsgálatok között sok alacsony tudományos értékkel bír, illetve bizonytalan PAC-tartalmú készítménnyel történt. Így jelenleg egyértelmű ajánlás nem adható a tőzegáfonya használatát illetően, mindenképpen szükség van további, jól megtervezett vizsgálatokra a pontos hatékonyság megállapításához. Ugyanakkor mivel alkalmazása nem jár érdemi mellékhatásokkal, adása megkísérelhető visszatérő húgyúti fertőzésben szenvedő betegek esetén.
Hüvelyflóra helyreállítására Lactobacillus készítmények
Az ép hüvelyflóra nélkülözhetetlen a húgyúti fertőzések kiújulásának megelőzésében. Antibiotikum-kezelések, főleg hosszú, vagy ismételt alkalmazás esetén jelentősen károsítják a hüvelyflórát, menopauza után pedig a csökkenő ösztrogénszint okozhatja a Lactobacillus flóra gyengülését. Károsodott hüvelyflóra esetén a bélflóra részét képező Gram-negatív kórokozók könnyen kolonizálják a hüvelynyálkahártyát, ahonnan folyamatos forrást képeznek a fertőzés kiújulásához. A normális Lactobacillus flóra továbbá az általa termelt hidrogénperoxidáz pH savanyító hatása miatt is protektív a kórokozókkal szemben.
Hüvelyi Lactobacillus probiotikus készítmények
Alkalmazásuk segít a károsodott hüvelyflóra regenerálásában. Ugyan több vizsgálat eredménye azt mutatta, hogy alkalmazásukkal csökkenthető a kiújulások száma (17), azonban a tanulmányok metaanalízise alapján nem egyértelmű, hogy mely készítmények, mely betegcsoportban javasolhatók. A szerzők véleménye szerint hosszú vagy ismételt antibiotikum-kezelést követően a hüvelyflóra helyreállítása elengedhetetlen. Fontos, hogy a betegek saját maguk ellenőrizzék a hüvely pH-ját (normális esetben 4-4,5 között) hüvelyi pH tesztcsík segítségével és ennek megfelelően folytassák a kezelést a normális értékek eléréséig.
Ösztrogénkészítmények
A menopauzát követően a csökkent lokális ösztrogénkoncentráció a hüvely glikogéntartalmának, ezáltal a glikogénfüggő lactobacillusok számának csökkenéséhez vezet. Emellett a húgycső és a hüvely kötőszövetének vérellátása is zavart szenved, amely rontja a helyi immunválasz hatékonyságát. Menopauzát követően a vaginálisan, vagy per os alkalmazott ösztrogénkészítmények szignifikánsan csökkentették a cystitises epizódok számát (18, 19, 20). Fontos hangsúlyozni azonban, hogy az orálisan adott ösztrogénkészítmények használata ismert veszélyeik miatt (fokozott trombózis hajlam, endmetrium cc. fokozott kockázata stb.) az újabb ajánlások alapján nem javasolt (12, 21, 22). A lokálisan alkalmazható hüvelykúpok heti 1-2×-i alkalmazása azonban javasolható a páciensek számára, főleg egyértelmű atrófiás vaginitis esetében. Használatuk során mellékhatások előfordulhatnak, lokális alkalmazás mellett 6-20%-ban számoltak be a nők hüvelyi irritációs panaszokról.
Jelenleg vizsgálat alatt lévő módszerek
A nem antibiotikumalapú megelőzés alábbi lehetséges módszereinek hatékonysága egyelőre kivizsgálás alatt van, azonban kísérleti módszerként már említik az irányelvek, ezért ismeretük hasznos lehet az olvasó számára.
D-mannóz
A D-mannóz egy cukormolekula, amelynek feltételezett hatása, hogy kompetitív antagonista módon meggátolja a baktériumok kitapadását a húgyhólyag nyálkahártyájához. Ugyan a D-mannózt tartalmazó termékek már hosszú ideje forgalomban vannak, hatékonyságával kapcsolatban egyelőre nagyon korlátozottan állnak rendelkezésre tudományos közlemények. Egy 2014-ben publikált randomizált kontrollált vizsgálat azt mutatta, hogy napi 2 g D-mannóz szignifikánsan hatékonyabb volt, mint a placebo, és ugyanolyan hatékonynak bizonyult a visszatérő hólyaghurut megelőzésében, mint napi 50 mg nitrofurantoin szedése (23). Ezen eredmények ellenére azonban a D-mannóz pontos szerepének, illetve hatékonyságának a meghatározásához további vizsgálatok szükségesek.
Húgyhólyag-instilláció
Hialuronsav és chondroitin-szulfát húgyhólyagba való instillációja bizonyított és széleskörben alkalmazott módszer a hólyag glükóz-aminoglikán (GAG) rétegének helyreállítására interstitialis cystitis esetén. Mivel a sérült GAG-réteg oki szerepe felmerült visszatérő hólyaghurut esetén, alkalmazásának vizsgálata megkezdődött ebben a betegségcsoportban is. Jelenleg még nem adható ajánlás ezzel a módszerrel kapcsolatban visszatérő hólyaghurut esetében, további randomizált vizsgálatok szükségesek a pontos hatás megítélésére (24).
Antibiotikummal végzett profilaxis
Antibiotikum-profilaxis alkalmazása csak akkor javasolt, ha a nem antibiotikumon alapuló megelőzési lehetőségek kudarcot vallottak. Általában 3-6 hónapos profilaxis alkalmazása javasolható kis dózisú antibiotikummal (12). A profilaxis hatékonysága nem kérdéses, azonban leállítását követően a nők mintegy 50%-ában a tünetek ismét kialakulnak. Az antibiotikum-profilaxis alkalmazása történhet minden nap folyamatosan vagy szexuális aktust követően, attól függően, hogy a beteg panaszai aktussal összefüggést mutatnak-e.
Az alkalmazandó antibiotikumot a korábban kimutatott kórokozó érzékenysége és a beteg esetleges gyógyszer-allergiájának függvényében választhatjuk ki. Az irányelvek ajánlásai alapján a következő antibiotikumok javasolhatók: fosfomycin 3 g 10 naponta ismételve, cefalexin 250 mg napi egy alkalommal/aktust követően, trimethoprim/sulfamethoxazol 40/200 mg, nitrofurantoin 50 vagy 100 mg. Terhességben alkalmazható cefaclor 250 mg, illetve cefalexin 250 vagy 125 mg napi egy alkalommal (25, 12).
Magyarországi adatok szerint az E. coli rezisztenciája TMP+SMX-szel szemben meghaladja a 20%-ot (26), ezért alkalmazása országunkban empirikusan nem ajánlott, csak tenyésztés eredményétől függően. Habár a fluorokinolonok igen hatékonyak, használatuk az antibiotikum-rezisztencia kialakulása miatt elsővonalbeli kezelésként nem javasolt. A nitrofurantoin jó hatásfokú készítmény és annak ellenére, hogy régóta és széles körben alkalmazzák alacsony a rezisztencia vele szemben.
Alkalmazhatóságát sajnos korlátozza, hogy a betegeknél gyakran hasi panaszok (hányinger, hányás, puffadás, hasmenés) jelentkeznek. Vizsgálatok alapján használatuk csak >60 ml/perc feletti kreatinin clearence esetén javasolt, mivel ennél rosszabb vesefunkció esetén nem választódnak ki kellő szinten a húgyutakban (27). Krónikus használata során ritkán előforduló súlyos tüdőfibrózisról, illetve májkárosodásról számoltak be, amelyek miatt egyes szakmai társaságok nem javasolják használatát hosszú távú megelőzésre (1. táblázat).

Amennyiben a betegcomplience megfelelő és a visszatérések gyakorisága alacsony, a visszatérő cystitis öndiagnózisa és rövid önkezelése is hatékony és javasolható módszer lehet (28).
Következtetések
A visszatérő hólyaghurut kezelése türelmet igényel a betegtől és kezelőorvosától egyaránt. Nagyon fontos a beteg bizalmának elnyerése, a megfelelő orvos–beteg-kapcsolat kialakítása és a betegek megfelelő edukációja betegségükkel kapcsolatban. A megelőzés során először mindig a rendelkezésre álló nem antibiotikum-alapú módszereket használjuk, és csak ennek hatástalansága esetén javasolható a folyamatos, vagy aktust követően végzett intermittáló antibiotikum-profilaxis.
References
1. Renard J, Ballarini S, Mascarenhas T, et al. Recurrent Lower Urinary Tract Infections Have a Detrimental Effect on Patient Quality of Life: a Prospective, Observational Study. Infect Dis Ther 2015 Mar; 4(1): 125–135. https://doi.org/10.1007/s40121-014-0054-6
2. Hooton TM. Recurrent urinary tract infection in women. Int J Antimicrob Agents 2001 Apr; 17(4): 259–68. https://doi.org/10.1016/S0924-8579(00)00350-2
3. Foxman B, et al. Urinary tract infection: self-reported incidence and associated costs. Ann Epidemiol 2000; 10(8): 509–15. https://doi.org/10.1016/S1047-2797(00)00072-7
4. Hooton TM, Scholes D, Hughes JP, Winter C, Roberts PL, Stapleton AE, Stergachis A, Stamm WE. A prospective study of risk factors for symptomatic urinary tract infection in young women. N Engl J Med 1996; 335: 468–474. https://doi.org/10.1056/NEJM199608153350703
5. Scholes D, Hooton TM, Roberts PL, Stapleton AE, Gupta K, Stamm WE. Risk factors for recurrent urinary tract infection in young women. J Infect Dis 2000; 182: 1177–1182. https://doi.org/10.1086/315827
6. Delia Scholes1,2, Thomas M. Hooton3, Pacita L. Roberts3, Ann E. Stapleton3, Kalpana Gupta3 and Walter E. Stamm3 Risk Factors for Recurrent Urinary Tract Infection in Young Women. J Infect Dis 2000; 182(4): 1177–1182. https://doi.org/10.1086/315827
7. S. D1, Hawn TR, Roberts PL, Li SS, Stapleton AE, Zhao LP, Stamm WE, Hooton TM. Family history and risk of recurrent cystitis and pyelonephritis in women. J Urol 2010 Aug; 184(2): 564–9. https://doi.org/10.1016/j.juro.2010.03.139
8. Naber KG, et al. Surveillance study in Europe and Brazil on clinical aspects and Antimicrobial Resistance Epidemiology in Females with Cystitis (ARESC): implications for empiric therapy. Eur Urol 2008; 54(5): 1164–75. https://doi.org/10.1016/j.eururo.2008.05.010
9. Hooton TM, Stamm WE. Diagnosis and treatment of uncomplicated urinary tract infection. Infect Dis Clin North Am 1997; 11: 551–581. https://doi.org/10.1016/S0891-5520(05)70373-1
10. Kahlmeter G. ECO.SENS. An international survey of the antimicrobial susceptibility of pathogens from uncomplicated urinary tract infections: the ECO.SENS Project. J An timicrob Chemother 2003; 51: 69–76. https://doi.org/10.1093/jac/dkg028
11. Infectious Diseases Society of America (IDSA). Combating antimicrobial resistance: policy recommendations to save lives. Clin Infect Dis 2011; 52(Suppl 5): S397–428. https://doi.org/10.1093/cid/cir153
12. Grabe M, et al. EAU Guidelines on Urological Infections. 2015. www.uroweb.org.
13. Kunin C. Urinary tract infections. In: Detection, prevention and management. 5th edition. Philadelphia: Lea & Febiger; 1997.
14. Fowler JE Jr, Pulaski ET. Excretory urography, cystography, and cystoscopy in the evaluation of women with urinary-tract infection: a prospective study. N Engl J Med 1981 Feb; 304(8): 462–5. https://doi.org/10.1056/NEJM198102193040805
15. Naber KG, Cho YH, Matsumoto T, Schaeffer A. Immunoactive prophylaxis of recurrent urinary tract infections: a meta-analysis. Int J Antimicrob Agents 2009; 33(2): 111–119. https://doi.org/10.1016/j.ijantimicag.2008.08.011
16. Jepson RG, et al. Cranberries for preventing urinary tract infections. Cochrane Database Syst Rev 2012. 10: p. Cd001321. https://doi.org/10.1002/14651858.CD001321.pub5
17. Anukam KC, et al. Clinical study comparing probiotic Lactobacillus GR-1 and RC-14 with metronidazole vaginal gel to treat symptomatic bacterial vaginosis. Microbes Infect, 2006; 8(12–13): 2772–6. https://doi.org/10.1016/j.micinf.2006.08.008
18. Raz R, Stamm WE. A controlled trial of intravaginal estriol in postmenopauzal women with recurrent urinary tract infections. N Engl J Med 1993; 329: 753–756. https://doi.org/10.1056/NEJM199309093291102
19. Kirkengen AL, Andersen P, Gjersoe E, Johannessen GR, Johnsen N, Bodd E. Oestriol in the prophylactic treatment of recurrent urinary tract infections in postmenopauzal women. Scand J Prim Health Care 1992; 10: 139–142. https://doi.org/10.3109/02813439209014051
20. Pfau A, Sacks T. The bacterial flora of the vaginal vestibule, urethra and vagina in the normal premenopauzal woman. J Urol 1977; 118: 292–295. https://doi.org/10.1016/S0022-5347(17)57976-8
21. Beerepoot MA1, Geerlings SE, van Haarst EP, van Charante NM, ter Riet G. Nonantibiotic prophylaxis for recurrent urinary tract infections: a systematic review and meta-analysis of randomized controlled trials. J Urol 2013 Dec; 190(6): 1981–9. https://doi.org/10.1016/j.juro.2013.04.142
22. Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women’s Health Initiative randomized controlled trial. JAMA 2004; 291: 1701. https://doi.org/10.1001/jama.291.14.1701
23. Kranjcec B, et al. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: a randomized clinical trial. World J Urol 2014. 32(1): 79–84. https://doi.org/10.1007/s00345-013-1091-6
24. Madersbacher H, et al. GAG layer replenishment therapy for chronic forms of cystitis with intravesical glycosaminoglycans – a review. Neurourol Urodyn 2013. 32(1): 9–18. https://doi.org/10.1002/nau.22256
25. Albert X, Huertas I, Pereiro II, Sanfelix J, Gosalbes V, Perrota C. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev 2004:CD001209. https://doi.org/10.1002/14651858.CD001209.pub2
26. Országos Epidemiológiai Központ: A hazai mikrobiológiai surveillance antibiotikum rezisztencia eredményei. Available from: http://www.oek.hu/oek.web?nid=666&pid=3
27. Michelle L. Ingalsbe, Amy L. Wojciechowski, Kelly A. Smith, Kari A. Mergenhagen. Effectiveness and safety of nitrofurantoin in outpatient male veterans. Ther Adv Urol 2015 Aug; 7(4): 186–193. https://doi.org/10.1177/1756287215581556
28. Schaeffer AJ, BA Stuppy. Efficacy and safety of self-start therapy in women with recurrent urinary tract infections. J Urol 1999 Jan; 161(1): 207–11. https://doi.org/10.1016/S0022-5347(01)62099-8
Laparoscopic renal dissection and left side nephroureterectomy for ureteral tumour in a horseshoe kidney – Case report
DOI: 10.22591/magyurol.2019.3.csicsenkovp.103
Authors:
Csicsenkov Péter dr., Domján Zsolt dr.
Szent János Kórház és Észak-budai Egyesített Kórházak, Urológiai osztály, Budapest (osztályvezető: Domján Zsolt dr.))
Summary
Introduction: Horseshoe kidney is the most common renal fusion anomaly. The incidence of horseshoe kidney is approximately 1 in 500 in the normal population with a male preponderance of 2:1. Upper urinary tract urothelial carcinoma is relatively uncommon, accounting for less than 5% of all urothelial carcinomas. It is associated with high mortality and morbidity.
Case report: The authors would like to present a single case of a laparoscopic dissection and left side nephroureterectomy in a patient who was investigated for painless haematuria and later on diagnosed for left side ureteral cancer.
The case was considered worth of presentation because a full thickness renal parenchyma was successfully dissected with minimal invasive way, but the authors had to work out a special safe technique.
Conclusion: There are only a few publications about laparoscopic horseshoe kidney dissections due to cancer, and this article can be considered as the first case reported in Hungary.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Bevezetés: A patkóvese a vese leggyakoribb fúziós fejlődési rendellenessége. Incidenciája körülbelül 1:500 normálpopulációban, férfiaknál mintegy kétszer gyakrabban fordul elő, mint nőknél. A felső húgyutakat érintő urotheliális karcinóma viszonylag ritkán fordul elő, kevesebb, mint 5%-ot teszi ki az összes urotheliális karcinómák közül. Magas mortalitással és morbiditással jár.
Esetismertetés: A szerzők egy olyan esetet ismertetnek, ahol laparoszkópos patkóvese-szétválasztást és bal oldali ureteronephrectomiát végeztek uréterdaganat miatt. Az esetet azért tartották bemutatásra érdemesnek, mert teljes vastagságú parenchymahíddal rendelkező patkóvesét sikerült minimálisan invazív módon szétválasztani, és ehhez egy biztonságos megoldást kellett kidolgozniuk.
Megbeszélés: Az irodalomban tumor miatt végzett laparoszkópos patkóvese-szétválasztás néhány eset kivételével alig található, hazánkban pedig ez tekinthető az első publikációnak a témában.
Bevezetés
A patkóvese a vese leggyakoribb fúziós fejlődési rendellenessége. Incidenciája körülbelül 1:500 normálpopulációban, férfiaknál mintegy kétszer gyakrabban fordul elő, mint nőknél. Bizonyos veleszületett fejlődési rendellenségekben gyakrabban alakul ki patkóvese (pl. Turner-szindróma 14%-20%, Edward-szindróma 67%, Down-szindróma 1%).
Patkóvesében urothelialis daganat viszonylag ritkán fordul elő. Laparoszkópos megoldása kihívást jelent az anatómiai malformáció miatt. Esetünkben uréterdaganat miatt végzett patkóvese-szétválasztást, bal oldali ureteronephrectomia laparoszkópos megoldását mutatjuk be.
Esetismertetés
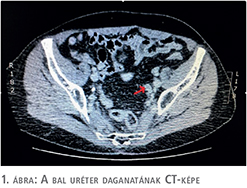
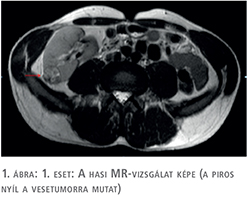
A páciens kivizsgálása fájdalmatlan vérvizelés miatt kezdődött és a meglévő patkóvese mellett bal oldali alsó szakasz urétertumort igazoltunk. A kórelőzményben szereplő spontán kőtávozás miatt első lépésben natív hasi, kismedencei CT történt, azonban sem vese-, sem uréterkövesség nem igazolódott. Ugyanakkor a bal oldali uréter disztális szakaszán kóros, közel 3 cm hosszú szövetszaporulat ábrázolódott, amely felvetette az urétertumor gyanúját, ezért a kivizsgálás kontrasztanyagos CT-vel (1. ábra), illetve diagnosztikus ureteroszkópiával folytatódott. Az urétertumor jelenlétét alátámasztotta a beavatkozás során végzett szövettani mintavétel, amely magas grádusú urotheliális karcinómát (grade III) igazolt.
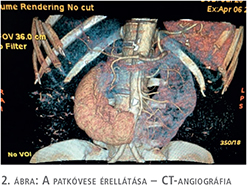
A patkóvese érrendszeri ellátása számtalan variációt mutathat. A kivizsgálást CT-angiográfiával folytattuk a további sebészi terv felállítása végett (2. ábra). A megfelelő képalkotó diagnosztikai vizsgálatok preoperatív elvégzése alapvető, hiszen a műtét alatt a szokatlan anatómiai szituáció miatt az ellátó erek felismerése nehéz feladat. A mi esetünkben is a bal oldali vese részhez 4 artéria csatlakozott, 2 közvetlenül az aortából és 2 az alsó mezenteriális artériából.
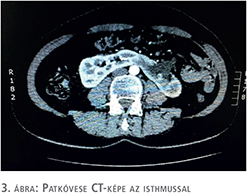
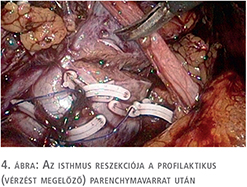
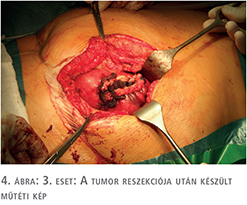
A beteg megfelelő felvilágosítása és tájékoztatása után a patkóvese laparoszkópos szétválasztását és baloldali ureteronephrectomiát végeztünk, 3 port behelyezésével. A bal oldali „veserész”, illetve az isthmus teljes mobilizálását követően, fokozatos preparálást követően láthatóvá váltak a veséhez futó nagyerek, majd a 4 ellátó artéria leklippelése után egy demarkációs vonal vált láthatóvá, amely jelentősen segített minket a megfelelő szétválasztási határ meghatározásában. Ez a vonal közvetlenül az aorta felett helyezkedett el. Tekintettel arra, hogy a patkóvese legvékonyabb része ezen a szakaszon 26 mm volt (3. ábra), nem tűnt biztonságosnak kizárólag vágóeszközök használata a szétválasztásban, még a manapság használt modern lehetőségek birtokában sem (ultrahangos, bipolar, vagy kombinált energiaforrást használó eszközök), ezért sajátos szétválasztó technikát kellett kidolgoznunk. Nehezítő tényezőnek tekintjük azt is, hogy a szétválasztást egyenesen az aorta felett kellett végeznünk. 2-0-ás felszívódó, monofil fonalat használtunk egyenes tűvel, Hem-o-Lok klipekkel és csúsztatott csomóval kombinálva (4. ábra). A demarkációs vonal mentén végzett átöltő „matrac“ öltéseket „U“ alakban helyeztük fel, majd Hem-O-Lock klippel rögzítettük. Ezt követően élesen, ollóval végeztük a disszekciót és az átöltő fonalakat fokozatosan feszesebbre húztuk, és másodlagos, biztonsági „lezáró“ Hem-O-Lock klippeket helyeztünk fel. Ezt a technikát vesetumor-reszekcióknál szoktuk használni. Jelentősebb vérzés a disszekció során nem lépett fel. A szétválasztás befejezését követően lehetőségünk volt egy második, biztonságos varratsort is végezni 2-0-ás Vicryl fonállal, 5/8-as tűvel kombinálva (5. ábra). A varratsorra vérzéscsillapítás céljából Surgicel Nu-Knit cellulózt helyeztünk fel. Értelemszerűen az ellenoldali hílus leszorítása nem volt szükséges (nehezen is lett volna kivitelezhető), így a meleg iszkémiával nem kellett számolni a reszekció során.
Az érintett uréterszájadék kimetszését transzvezikálisan végeztük, alsó medián laparotómiát alkalmazva, illetve ipszilaterális kismedencei lymphadenectomia is történt.
A műtéti idő összesen 260 perc volt, transzfúzióra nem került sor, a páciens korai mobilizációját követően az 5. posztoperatív napon hagyta el az osztályt. Egy év elteltével, az elvégzett kontrollvizsgálatok során recidív folyamatra utaló jel nem igazolódott.
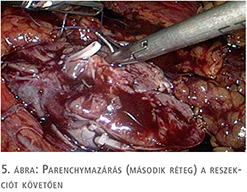
Megbeszélés
A patkóvese, mint a vese leggyakoribb fúziós fejlődési rendellenessége, a teljes populáció 0,25%-át érinti. A felső húgyutakat érintő urotheliális karcinóma viszonylag ritkán fordul elő, az összes urotheliális karcinómák kevesebb, mint 5%-át teszi ki. Magas mortalitással és morbiditással jár, az 5 éves túlélés 30-60% között számlálható (1, 2).
A kezelést alapvetően a daganat mérete, kiterjedése, grádusa és a fokalitása határozza meg. Tekintettel a magas recidívaarányra a radikális ureteronephrectomia az uréterszáj kimetszésével ma is a goldstandartnak tekintendő. Válogatott esetekben a szervmegtartó műtét is elfogadott terápiás eljárás lehet, figyelembe véve, hogy a későbbiekben akár dialízist igénylő veseelégtelenség, illetve az ellenoldalon is daganatos folyamat alakulhat ki (3–5).
Az áttekintett külföldi irodalomban leggyakrabban esetismertetések leírásával találkoztunk. Egy-egy cikk számol csak be nagyobb esetszámról. Legtöbb esetben kézzel asszisztált nephtrectomiáról vagy vesetumor-reszekcióról számoltak be vesedaganat esetén. Urétertumor miatt végzett laparoszkópos patkóvese-szétválasztás és ureteronephrectomia nem szerepelt a közleményekben. A legtöbb esetben alternatív vágóeszközök alkalmazását említik, mint mikrohullámú koagulátor, bipoláris vágó, ultrahangos vágókés, vagy endoszkópos tűzőgép (6–8).
A mi esetünkben a daganat elhelyezkedése (az uréterszájadéktól 5-6 cm-re) és a szövettani típus (magas grádusú elváltozás) miatt endoszkópos (endoluminalis) megoldás nem jött szóba.
A vesereszekciók során kialakult laparoszkópos tapasztalat tette lehetővé, hogy a patkóvese szétválasztását minimálisan invazív módon kíséreljük meg, a beteg biztonságának kockázata nélkül. Ehhez elengedhetetlen volt a megfelelő preoperatív kivizsgálás, valamint a szétválasztás módjának előzetes, részletes megtervezése.
A CT-angiográfia kiemelt jelentőségű a patkóvese műtétei esetén, mivel a patkóvese érrendszeri ellátása számtalan variációt mutathat. Csak az esetek 30 százalékában létezik egy-egy fő artéria, amely mindkét oldali veserészt látja el, de az érellátás rendkívül atípusos is lehet, akár nyolc artériával is számolhatunk, amely a vese egyik vagy mindkét részét látja el. Az isthmushoz külön is futhatnak elágazó ágak a vesét ellátó fő artériákból, vagy egyenesen az aortából (65%-ban). Az isthmus területe gyakran kap érellátást az alsó mezenteriális artériából, vagy az arteria iliaca communis/externa, vagy akár a sacralis artériákból (9).
A parenchyma vastagsága miatt alternatív vágóeszköz alkalmazása önmagában nem lett volna elegendő a visszavérzés veszélye miatt, ezért mi egy olyan megoldást dolgoztunk ki, ami biztonságos, minimalizálja a vérzés lehetőségét a laparoszkópia nyújtotta előnyök mellett.
Következtetések
Összefoglalásként elmondhatjuk, hogy mind a beteg kivizsgálásában, mind a beteg sebészeti ellátásában korszerű elveknek és szemléletnek megfelelően jártunk el. Az esetet azért tartottuk bemutatásra érdemesnek, mert teljes vastagságú parenchymahíddal rendelkező patkóvesén sikerült minimálisan invazív módon szétválasztást és ureteronephrectomiát végezni. Bár a módszer a laparoszkópos technika térhódítása ellenére ma sem tekinthető rutin beavatkozásnak, mégis biztonsággal kivitelezhető volt az általunk megtervezett technikával.
References
1. Chen GL, Bagley DH. Ureteroscopic management of upper tract transitional cell carcinoma in patients with normal contralateral kidneys. J Urol 2000; 164: 1173–1176. https://doi.org/10.1016/S0022-5347(05)67135-2
2. Milner JE, Voelzke BB, Flanigan RC, et al. Urothelial-cell carcinoma and solitary kidney: outcomes with renalsparing management. J Endourol 2006; 20: 800–807. https://doi.org/10.1089/end.2006.20.800
3. Palou J, Piovesan LF, Huguet J, et al. Percutaneous nephroscopic management of upper urinary tract transitional cell carcinoma: recurrence and long-term follow-up. J Urol 2004; 172: 66–69. https://doi.org/10.1097/01.ju.0000132128.79974.db
4. Van der Poel HG, Antonini N, Van Tinteren H, Horenblas S. Upper urinary tract cancer: location is correlated with prognosis. Eur Urol 2005; 48: 438v444. https://doi.org/10.1016/j.eururo.2005.03.009
5. Giannarini G, Schumacher MC, Thalmann GN, et al. Elective management of transitional cell carcinoma of the distal ureter: can kidney-sparing surgery be advised? BJU Int. 2007; 100: 264–268. https://doi.org/10.1111/j.1464-410X.2007.06993.x
6. Nouri-Mahdavi K, Izadpanahi MH. Laparoscopic heminephrectomy in horseshoe kidney using bipolar energy: report of three cases. J Endourol 2008; 22: 667–670. https://doi.org/10.1089/end.2007.0109
7. Zumsteg J, Roberts WW, Wolf JS. Laparoscopic heminephrectomy for benign renal anomalies. J Endourol 2010; 24: 41–47. https://doi.org/10.1089/end.2009.0346
8. Blaze V, Ceuterick M, Hauzeur C, Wespes E. Laparoscopic radical nephrectomy for a tumor in a horseshoe kidney. Prog Urol 2007; 17(1): 99–100. https://doi.org/10.1016/S1166-7087(07)92234-4
9. Boatman DL, Cornell SH, Kölln CP. The arterial supply of horseshoe kidneys. Am J Roentgenol Radium Ther Nucl Med 1971 Nov; 113(3): 447–51. https://doi.org/10.2214/ajr.113.3.447
Tumour in the renal graft after transplantation
DOI: 10.22591/magyurol.2019.3.kissz.98
Authors:
Kiss Zoltán dr., Berczi Csaba dr., Berczi Adrienne, Flaskó Tibor dr.
Debreceni Egyetem Általános Orvostudományi Kar, Urológiai Tanszék, Debrecen (igazgató: Flaskó Tibor dr.)
Summary
Introduction: The administered immunosuppressive treatment increases the incidence of malignant tumours after organ transplantation. Occurrence of renal cancers is higher after kidney transplantation than in normal population. These tumours mainly occur in the own kidney of the recipients, while in 10% they developed in the graft. The authors report their experience with treatment of tumour in renal graft in their three cases.
Case presentation: Case 1: Kidney transplantation was performed 20 years ago in a 46-year-old male patient. The routine ultrasound examination showed a 2 cm tumour in the graft which was confirmed by the abdominal MR scan. The patient underwent partial nephrectomy. Histology proved pT1a, renocellular carcinoma. The dose of immunosuppressive drugs was reduced after surgery. No recurrence was observed in the 2-year follow-up period.
Case 2: Renal transplantation was done 13 years ago in a 65-year-old female patient. Ultrasound and CT scan of the graft described a 35 mm tumour at the upper pole of the kidney. Partial nephrectomy was performed. Histological examination showed pT1a, renocellular carcinoma. Following surgery, the dose of immunosuppressive drugs was reduced. There was no tumour recurrence during the 17 months’ follow-up.
Case 3: In the 62-year-old male patient, kidney transplantation was carried out 10 years earlier. During the follow-up, the ultrasound showed a 2.5 cm tumour in the graft, which was confirmed by CT. Partial resection was performed and a multifocal tumour was removed. The histology proved papillary carcinoma. Following surgery, everolimus treatment was started instead of tacrolimus. There was no tumor recurrence during the 2 months follow-up.
Discussion: After kidney transplantation, in case with tumour in the renal graft organ sparing surgery is recommended. In the described cases, tumour resection was also performed. The organ sparing surgery provides adequate oncological efficacy with preservation the function of the transplanted kidney.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Bevezetés: A szervtranszplantációt követően alkalmazott immunszuppresszív kezelés növeli a malignus daganatok incidenciáját. Vesetranszplantációt követően a vesetumor előfordulása magasabb, mint a normálpopulációban. Ezen daganatok többsége a beteg saját veséjében alakul ki, azonban 10%-uk a graftban jelentkezik. Szerzők tanulmányukban három eset kapcsán ismertetik a transzplantált vesében jelentkező vesedaganat kezelésével szerzett tapasztalataikat.
Esetismertetés: 1. eset: a 46 éves férfi betegnél 20 évvel korábban történt vesetranszplantáció. A gondozás során rutinszerűen végzett ultrahangvizsgálat egy 2 cm-es tumort észlelt a graftban, amelyet az elvégzett hasi MR-vizsgálat megerősített. A betegnél parciális nephrectomiát végeztek. A szövettani vizsgálat pT1a, renocelluláris karcinómát igazolt. A műtétet követően az immunszuppresszív gyógyszerek dózisát csökkentették. A 2 éves utánkövetés során recidív tumort nem észleltek.
2. eset: a 65 éves nőbetegnél 13 évvel ezelőtt végeztek vesetranszplantációt. Ultrahang- és CT-vizsgálat a transzplantált vese felső pólusában egy 35 mm-es daganatot írt le, amely miatt vesereszekció történt. A szövettani vizsgálat pT1a, renocelluláris karcinómát mutatott. A műtétet követően az immunszuppresszív gyógyszerek dózisát csökkentették. A17 hónapos utánkövetés alatt recidíva nem alakult ki.
3. eset: a 62 éves férfi betegben 10 évvel korábban vesetranszplantáció történt. Az utánkövetés során az ultrahangvizsgálat a graftban 2,5 cm-es tumort mutatott, amelyet a CT is igazolt. Tumorreszekció történt, amelynek során multifokális daganat került eltávolításra. A szövettan papilláris karcinómát véleményezett. A műtétet követően a tacrolimus helyett everolimus kezelés indult. A 2 hónapos utánkövetés alatt recidíva nem jelentkezett.
Megbeszélés: A vesetranszplantációt követően a graftban kialakult vesetumorok esetében szervmegtartó műtétet ajánlott végezni. Az ismertetésre került esetekben is tumorreszekció történt. A szervmegtartó műtét megfelelő onkológiai eredményességet biztosított az átültetett vese funkciójának megtartása mellett.
Bevezetés
A vesesejtes karcinóma a malignus daganatok 2-3%-át alkotja. Világszerte évente kb. 209 000 új esetet regisztrálnak, míg a daganat okozta mortalitás mértéke 102 000/év. Az elmúlt két évtized során 2%-kal nőtt tovább az incidenciája világszerte. A férfiakban a vesesejtes karcinóma a hetedik, míg a nőkben a kilencedik leggyakoribb daganatos megbetegedés (1, 2).
A vesedaganat pontos oka nem ismert. Az etiológiai faktorok közé tartozik a dohányzás, az elhízás és a magasvérnyomás-betegség. Az irodalmi adatok alapján a vesetumor előfordulása gyakoribb végstádiumú veseelégtelenségben szenvedőknél és a szerzett vesecisztás betegeknél mint az átlagos populációban. A világos sejtes vesedaganatok körübelül 5%-ban örökletes és genetikai rendellenességekkel társulnak (1, 3).
A végstádiumú krónikus vesebetegek kezelésére alkalmazott veseátültetést követően a betegek immunszuppresszív kezelést kapnak, aminek célja az átültetett szerv rejekciójának megelőzése és kezelése. Az immunszuppresszió következtében az immunrendszer ellenállóképessége csökken, ezért a szervezet fogékonyabb fertőzésekkel szemben, és ugyanakkor az immunszuppresszív kezelés mellett megnő a daganatos megbetegedések aránya, különösen a lymphomák előfordulása (4, 5).
Tanulmányunkban a vesetransplantációt követőn a graftban kialakult daganat kezelésével szerzett tapasztalatainkat mutatjuk be.
Esetismertetés
1. eset
A beteg korábbi anamnézisében ismeretlen okból fennálló krónikus veseelégtelenség szerepel, mely miatt 1995-ben, az akkor 25 éves férfibetegben hemodialízis kezelést indítottak.
1996. szeptemberben a beteg – 26 éves korában – kadáver vesetranszplantációban részesült. A transzplantációt követően immunszuppresszív kezelést kapott, amely szteroidot, tacrolimust és mikofenolát-mofetilt tartalmazott.
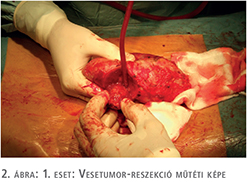
2016. júniusban a rutinszerűen végzett kontroll UH-vizsgálat a graftban kis daganatot írt le. Az ezt követően elvégzett MRI-vizsgálat a transzplantált vesében 2 cm-es tumort igazolt (1. ábra). Távoli áttét, illetve nyirokcsomó-metasztázis nem volt kimutatható.
2016 szeptemberében – a beteg 46 éves korában, 20 évvel a vesetranszplantációt követően – a graftból tumorreszekció történt (2. ábra). A műtét során a hilus lefogási idő 10 perc volt, a reszekciós alap zárásához 2/0-ás Safil varróanyagot és Bloodcare hálót alkalmaztunk. A szövettani vizsgálat világossejtes karcinómát igazolt (pT1a) negatív sebészi széllel. A daganat szövettani differenciáltsága Fuhrman grade 3 volt.
A tumoreltávolítást követően a az immunszuppresszív kezelés dózisát csökkentették. A beteg ezt követően 5 mg/nap tacrolimust kapott.
A beteg csaknem 2 éves utánkövetése során tumorkiújulás nem jelentkezett.
2. eset
Távolabbi anamnézisében magas vérnyomás szerepel. Ismeretlen okból fennálló krónikus veseelégtelensége miatt az akkor 48 éves nőbeteg 1999-ben krónikus hemodialízis programba került.
A betegben 2003-ban – 65 éves korában – kadáver vese allotranszplantációját végezték. Ezt követően szteroidot, tacrolimust és mikofenolát-mofetilt tartalmazó immunszuppresszív kezelést kapott.
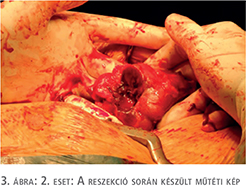
2016. szeptemberben az utánkövetés a beteg gondozása során végzett UH-vizsgálat az átültetett vesében 3 cm-es tumorgyanús képletet talált. Ezt követően CT-vizsgálat történt, amely a graft felső pólusában 3,5 cm-es daganatot igazolt.
2016. decemberben a graftban elhelyezkedő vesetumora miatt tumorreszekció történt (3. ábra). A műtét során a hiluslefogási idő 12 perc volt, a reszekciós alap zárásához 2/0-ás Safil varróanyagot és Bloodcare hálót alkalmaztunk. A hisztológiai vizsgálat világossejtes vesekarcinómát mutatott (pT1a), amelynek szövettani diffrenciáltsága Fuhrman grade 2 volt. A sebészi szél negatív volt. A műtétet követően az immunszuppresszív kezelés dózisát csökkentették, s így a továbbiakban 1 mg/nap tacrolimust kapott.
A 17 hónapos utánkövetés alatt recidíva nem alakult ki.
3. eset
Korábbi anamnézisében hasfali sérvműtét és appendectomia szerepel. 2003 óta ismert fokális segmentalis glomerulosclerosisa, amelynek progressziója miatt 2006-tól hemodialízis kezelés alatt állt. Az akkor 52 éves férfi betegben, 2009. januárban kadáver vesetranszplantációja történt. Ezt követően tacrolimus, szteroid és mikofenolát-mofetil tartalmú immunszuppresszív kezelést kapott. 2018. novemberben a kontroll UH-vizsgálat a graftban tumorgyanús képletet észlelt, amely miatt CT-vizsgálat történt, s ez 2,5 cm-es daganatot véleményezett. Vesebiopsziát végeztünk s ennek szövettana renocelluláris karcinómát igazolt. Ezt követően 2019. 03-ban a graftból tumorreszekciót végeztünk (4. ábra). A műtét során multifokális tumort találtunk, amelyet reszekáltunk. A műtét során a hiluslefogási idő 14 perc volt, a reszekciós alap zárásához 2/0-ás Safil varróanyagot és Bloodcare hálót alkalmaztunk. A szövettan multifokális papilláris vesekarcinómákat (grade 2) mutatott negatív sebészi széllel. A műtétet követően a tacrolimus helyett everolimus kezelés indult. Ezen betegnél egyelőre 2 hónapos utánkövetésről tudunk beszámolni.
Megbeszélés
A végstádiumú krónikus vesebetegségek kezelésére az elsődlegesen javasolt eljárás a vesetranszplantáció, mert ezáltal a betegek élettartama meghosszabbodik és életminőségük javul a dialízis kezelésekhez viszonyítva (6, 7). A transzplantáció során a betegbe „idegen” szerv kerül beültetésre, s ilyenkor a beteg saját immunrendszere aktiválódik a beültetett szerv ellen. A szervtranszplantáció során az immunszuppresszív kezelés csökkenti az akut rejekció gyakoriságát és növeli a graft túlélését, azonban több lényeges szövődményt okozhat. Így emelkedik a kardiovaszkuláris betegségek, a különböző fertőzések, valamint a malignus betegségek előfordulási gyakorisága (8).
A transzplantációt követően kialakuló malignus daganatokkal kapcsolatban elsősorban az alkalmazott immunszuppresszív kezelést tekintik rizikótényezőnek (9, 10). Több adat arra utal, hogy egyes immunszuppresszív készítményeknek direkt onkogenetikus hatása lehet. Ezt a lehetőséget az azathioprinnal, a cyclosporinnal és a tacrolimussal kapcsolatban vetették fel. Míg napjainkban az azathioprint ritkán, addig a cyclosporint és a tacrolimust elterjedten használják a veseátültetést követőn alkalmazott kezelés során, így ezek jelentősége nagyobb. A cyclosporin és a tacrolimus calcineurin-inhibitorok és az eddigi adatok szerint azáltal idézhetik elő a daganatnövekedést, hogy növelik a bTGF (transforming growth factor) és VEGF (vascularis endothelialis growth factor) szintet (9, 11, 12). Ugyanakkor vannak olyan adatok is, amely szerint sem az alkalmazott immunszuppresszív kezelés típusának, sem annak időtartamának nincs szignifikáns hatása az urológiai daganatok kialakulására (13). Megemlítendő azonban, hogy mTOR-receptor-gátló készítményeket alkalmazhatnak a transzplantáció után az immunszuppresszív kezelés részeként is, valamint a metasztatikus vesedaganatok terápiája alkalmával is.
Nem szabad figyelmen kívül hagyni, hogy egyéb tényezők is szerepet játszhatnak a daganat kialakulásában. Az eddigi adatok alapján a vesetranszplantációt követően kialakuló tumorok multifaktoriális eredetűek. Az immunszuppresszív kezelés mellett egyéb okok is jelen lehetnek, így bizonyos környezeti tényezők, elhízás, dohányzás, fájdalomcsillapítók hosszantartó használata, genetikai tényezők és szerzett cisztás betegségek szintén rizikótényezőknek tekinthetőek ebben a populációban (14).
Már régóta ismert, hogy a hemodialízis kezelésben részesülő krónikus veseelégtelenségben szenvedő betegekben lényegesen gyakoribb a vesetumor, mint a normális populációban (13,15,16).
Az irodalmi adatok alapján a vesetranszplantáció után az újonnan kialakuló rosszindulatú daganatok 7-11%-ban fordulnak elő (17, 18). Ez négy-ötszöröse a normális populációban észlelt incidenciához képest (7, 18). A vesetranszplantáció után kialakult tumorok 0,4-5,5%-a urológiai daganat. Ezek közül leggyakoribb a vesedaganat, amelynek előfordulása 15× gyakoribb, mint az átlagpopulációban (13, 19–22).
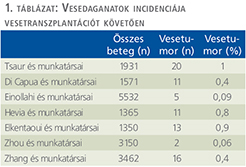
A vesedagatok incidencája a vesetranszplantáció után kevesebb, mint 1% (1. táblázat) (18, 19–24).
Figyelembe véve, hogy a transzplantációt követően a malignus betegségek előfordulása gyakoribb, ezért a veseátültetett betegek utánkövetése, gondozása során vizsgálatokat kell végezni az esetlegesen kialakuló daganatok szűrése irányában is (25–27). Ez a vesedaganatok szempontjából elsődlegesen a kontroll UH-vizsgálatokat jelenti. A rutinszerűen végzett UH-vizsgálatoknak köszönhetően a vesedaganat még korai stádiumban kerülhet felismerésre, amely kuratív kezelést tesz lehetővé és ezáltal a beteg életkilátásait javítja.
A vesetranszplantációt követően kialakuló vesedaganatok döntő többsége a beteg eredeti, saját veséjében fordul elő, s csak az esetek kb. 10%-ában jelentkezik a graftban (22, 28). Ploussard és munkatársai a közleményükben úgy találták, hogy a 2396 transzplantált betegükből 12 esetben találtak a graftban daganatot. A transzplantációtól a tumor kialakulásáig átlagosan 13 év telt el, így annak lehetősége, hogy a daganat a donorból került átvitelre, kizárható volt.
Amennyiben a vesedaganat a beteg eredeti, saját veséjében van, úgy radikális nephrectomia végzése javasolt, a daganat nagyságától függetlenül, hiszen itt már nem funkcionáló veséről van szó.
Azokban az esetekben viszont, amikor a daganat a graftban alakul ki, lehetőség szerint szervmegtartó műtét végzésére kell törekedni. Természetesen ennek kapcsán figyelembe kell venni a tumor nagyságát és a grafton belüli elhelyezkedését is (26, 28, 29). Amennyiben a parciális nephrectomia nem megvalósítható, úgy a graftot el kell távolítani és ezt követően a beteg majd dialízis kezelésre kerül. A graftban elhelyezkedő tumor esetén ritkán radiofrekvenciás vagy krioteraterápia elvégzésére is sor kerülhet. Ez akkor jöhet szóba, ha a betegnek súlyos társult betegségei vannak vagy az anaesztézia kockázata magas, illetve a beteg visszautasítja a műtétet.
Antunes és munkatársai 2897 vesetranszplantációt követően 58 esetben észleltek urológiai daganatot a betegek gondozása során. Az urológiai tumorok közül a leggyakoribb a prosztatadaganat, míg a második leggyakoribb a vesekarcinóma, amelynek incidenciája 0,8% volt. Anyagukban 23 recipiensben összesen 25 tumort észleltek. Egy betegnek szinkron, míg egy másik recipiensnek metakron vesedaganata volt. A vesekarcinóma 22 alkalommal a beteg saját veséjében, míg 3 esetben (12%) a graftban alakult ki. A daganatokat a recipiensek követése során végzett rutin UH-vizsgálatok során diagnosztizálták. A vesedaganatok 76%-a volt kisméretű vesedaganat („small renal mass”). A vesetranszplantációtól a vesetumor diagnózisáig eltelt idő átlagosan 54 hónap volt. A beteg saját, nem működő veséjében kialakult daganatoknál valamennyi esetben radikális nephrectomiát, míg a graftban levő tumorok esetében vesetumor-reszekciót végeztek. A szerzők nem közölték, hogy az immunszuppresszív kezelést csökkentették-e a daganat diagnosztizálását követően. Az 5 és 10 éves általános túlélés 81,3% és 87% volt. Vesedaganat okozta mortalitás egy betegben fordult elő (13).
Saját eseteinkben a graftban kialakult vesedaganat incidenciája 0,23% volt. Mindhárom betegben a gondozás, utánkövetés során végzett UH-vizsgálalat diagnosztizálta a tumor jelenlétét. Tekintettel arra, hogy a daganatok korai stádiumban lettek kimutatva, mindegyik betegben tumorreszekció történt a graftból. A szervmegtartó műtét megfelelő onkológiai eredményességet biztosított a graft működésének megőrzése mellett. Ugyanakkor a rövid utánkövetési idő miatt a bemutatott betegeknél a hosszú távú túlélést még nem tudjuk megítélni.
References
1. Brian I Rini, Steven C Campbell, Bernard Escudier, Renal cell carcinoma. Lancet 2009; 373: 1119–32.
2. Lindblad, P. Epidemiology of renal cell carcinoma. Scand J Surg 2004; 93: 88.
3. Bergström A, Hsieh CC, Lindblad P, Lu CM, Cook NR, Wolk A. Obesity and renal cell cancer – a quantitative review. Br J Cancer 2001; 85: 984.
4. Bamoulid J, Staeck O, Halleck F, Khadzhynov D, Paliege A, Brakemeier S, et al. Immunosuppression and Results in Renal Transplantation. Eur Urol Suppl 2016; 15: 415.
5. Leas BF, Uhl S, Sawinski DL, Trofe-Clark J, Tuteja S, Kaczmarek JL, et al. Calcineurin Inhibitors for Renal Transplant 2016. Rockville (MD).
6. Tsaur I, Obermu¨ller N, Jonas D, et al. De novo renal cell carcinoma of native and graft kidneys in renal transplant recipients. BJUI 2010; 108: 229–234.
7. Au E, Wong G, Chapman JR. Cancer in kidney transplant recipients Nat Rev Nephrol 2018; 14(8): 508–520.
8. Veroux M, Puliatti C, Fiamingo P et al. Early de novo malignancies after kidney transplantation. Transplant Proc 2004; 36: 718–720.
9. Hall EC, Pfeiffer RM, Segev DL, Engels EA. Cumulative incidence of cancer after solid organ transplantation. Cancer 2013; 119: 2300–82.
10. Morath C, Mueller M, Goldschmidt H, Schwenger V, Opelz G, Zeier M. Malignancy in renal transplantation. J Am Soc Nephrol 2004; 15: 1582e8
11. Elkentaoui H, Robert G, Pasticier G, Bernhard JC, Couzi L, Merville P, et al. Therapeutic management of de novo urological malignancy in renal transplant recipients: the experience of the French Department of Urology and Kidney Transplantationfrom Bordeaux. Urology 2010; 75: 126–32.39.
12. Hojo M, Morimoto T, Maluccio M, et al. Cyclosporine induces cancer progression by a cell-autonomous mechanism. Nature1999; 397:
13. Antunes H, Tavares-da-Silva E, Oliveira R, Carvalho J, Parada B, Bastos C, et al. De Novo Urologic Malignancies in Renal Transplant Recipients. Transplant Proc 2018; 50(5): 1348–1354.
14. Alexander MP, Farag YM, Mittal BV, Rennke HG, Tullius SG, Singh AK. De novo multifocal renal cell carcinoma in the renal allo-graft. Kidney Int 2009; 75: 111–4.6.
15. Neuzillet Y, Tillou X, Mathieu R, et al. Renal cell carcinoma (RCC) in patients with end-stage renal disease exhibits many favourable clinical, pathologic, and outcome features compared with RCC in the general population. Eur Urol 2011; 60: 366e73.
16. Breda A, Luccarelli G, Rodriguez-Faba O, et al. Clinical and pathological outcomes of renal cell carcinoma (RCC) in native kidneys of patients with end-stage renal disease: a long-term comparative retrospective study with RCC diagnosed in the general population. World J Urol 2015; 33: 1e7.
17. Vajdic CM, McDonald SP, McCredie MRE, et al. Cancer incidence before and after kidney transplantation. JAMA 2006; 296: 2823e31
18. Elkentaoui H, Robert G, Pasticier G, et al. Therapeutic management of de novo urological malignancy in renal transplant recipients: the experience of the French Department of Urology and Kidney Transplantation from Bordeaux. Urology 2010; 75: 126e32
19. di Capua Sacoto C, Luján Marco S, Bahilo Mateu P, Budía Alba A, Pontones Moreno JL, Jiménez Cruz JF. [De novo urological neoplasms in kidney transplant patients: experience in 1,751 patients]. Actas Urol españolas 2010; 34: 88e94.
20. Einollahi B, Simforoosh N, Lessan-Pezeshki M, et al. Genitourinary tumor following kidney transplantation: a multicenter study. Transplant Proc 2009; 41: 2848e9.
21. Zhou M, Zhu Y, Wang L, Wang Y, Fu S, Min Z. Urological malignancy as a complication of renal transplantation: a report of twelve clinical cases. Clin Transpl 2006; 395e8
22. Tsaur I, Karalis A, Probst M, Blaheta RA, Scheuermann EH, Gossmann J, et al. Development of urological cancers in renal transplant recipients: 30-year experience at the Frankfurt Transplant Center. Cancer Sci 2010; 101: 2430–5.3.
23. Zhang J, Ma L, Xie Z, Guo Y, Sun W, Zhang L. Epidemiology of post-transplant malignancy in Chinese renal transplant recipients: a single-center experience and literature review. Med Oncol 2014; 31(7): 32.
24. Hevia V, Gomez V, Diez Nicolas V, Alvarez S, Gomez del CanizoC, Galeano C et al. Development of urologic de novo malig-nancies after renal transplantation. Transplant Proc 2014; 46: 170–5.10.
25. Bennett WM, Simonicha EL, Garrea AM, McEvoya KM, Farinolab MA, Batiuk TD. Renal Cell Carcinoma in Renal Transplantation: The Case for Surveillance. Transplant Proc 2017; 49(8): 1779–1782.
26. Wong G, Chapman JR, Craig JC. Cancer screening in renal transplant recipients: what is the evidence? Clin J Am Soc Nephrol 2008; 3: S87e100.
27. Chiang TJ, Chu SH, Liu KL, Lai WJ, Wang HH, Chen HW, et al. Kidney ultrasound is useful tool in post-transplant follow-up. Transplant Proc 2006; 38: 2018e9.
28. Frascà GM, Sandrini S, Cosmai L, Porta C, Asch W, Santoni M, et al. Renal cancer in kidney transplanted patients. J Nephrol 2015; 28(6): 659–68.
29. Ribal MJ, Rodriguez F, Musquera M, Segarra J, Guirado L, Villa-vicencio H et al. Nephron-sparing surgery for renal tumor: a choice of treatment in an allograft kidney. Transplant Proc 2006; 38: 1359–62.19
Life with prostate cancer – the patient’s perspective
DOI: 10.22591/magyurol.2019.3.birok.91
Authors:
Biró Krisztina dr.1, Kun Eszter2, Dobi Etelka3
1Országos Onkológiai Intézet, Budapest (főigazgató főorvos: Polgár Csaba dr.)
2Szinapszis Kft., Budapest (ügyvezető: Szabó András dr.)
3Janssen-Cilag Kft., Magyarország
Summary
Prostate cancer continues to be one of the most common cancers diagnosed in men. Due to early detection, radical interventions and the emerging modern treatments, life expectancy has significantly improved in recent years. In light of the excellent survival rates for prostate cancer, quality of life became a primary concern, and several studies addressed long-term physical, psychosocial, and economic effects of cancer treatment. We measured patient-reported outcome by asking 61 prostate cancer patients online, about their own experience during and following their treatment. Although most of them reported that they received adequate information about the diagnosis and the treatment options, some of them missed a more detailed discussion about possible complications, side effects and available clinical trials. Only 28% heard about the beneficial effect of exercise and lifestyle changes. and only 8% was briefed, that his case was assessed by a multidisciplinary team, although the positive impact of the multidisciplinary discussion is well documented.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 3. SZÁM
Összefoglalás
A prosztatarák férfiaknál az egyik leggyakrabban diagnosztizált rosszindulatú betegség. A korai felismerésnek, az időben elvégzett radikális kezeléseknek és a sorra megjelenő modern gyógyszereknek köszönhetően ezen betegek várható túlélése folyamatosan javul. A megnövekedett túlélés miatt az életminőség szerepe is felértékelődik, emiatt világszerte egyre több publikáció vizsgálja, szubjektíven miként élik meg a betegek a betegség során megtett útjukat, a diagnózistól, a kivizsgáláson és kezelésen keresztül egészen a palliatív ellátásig.
Vizsgálatunkban online kérdőívek segítségével 61 prosztatadaganatos férfit kérdeztünk meg arról, hogy szubjektíven miként élték meg a kezelések során általuk megtett betegutat.
Bár a betegek többsége úgy érezte, hogy a diagnózis hátteréről, illetve a kezelési lehetőségekről részletes tájékoztatást kapott, viszont sokan hiányolták a kezelések esetleges szövődményeiről, a mellékhatásokról, illetve a klinikai vizsgálatokról történő részletesebb tájékoztatást. Mindössze 28%-ukkal ismertették a megfelelő életmód pozitív hatásait és csak 8% tudott arról, hogy esetét az onkológiai bizottság megtárgyalta volna, annak ellenére, hogy nemzetközi vizsgálatok már többszörösen igazolták, hogy az onkoteam bevonása a daganatos betegek kezelésébe javítja az eredményeket.
Bevezetés
Az onkológiai betegek rehabilitációja a kivizsgálástól kezdve a gondozáson át a beteg életének végéig tartó komplex folyamat, amely ideális esetben már a diagnózis közlésekor kezdődik. Lényege a fizikai, élettani és lelki károsodások megelőzése, illetve a lehetséges legnagyobb mértékű csökkentése (1). Habár a daganatos betegek kezelése során még mindig a hatékonyságot állítjuk legtöbbször előtérbe, egyre több publikáció vizsgálja, szubjektíven miként élik meg a betegek a betegség során megtett útjukat, a diagnózistól, a kivizsgáláson és kezelésen keresztül egészen a palliatív ellátásig.
Kutatásunk célja a szubjektív betegút feltérképezése volt a magyar prosztatarákkal élő betegek körében, különös tekintettel arra, hogyan élik meg a betegséget, milyen megválaszolt vagy megválaszolatlan igényeik vannak a betegségük kapcsán. A vizsgálatban 61 prosztatarákkal élő páciens vett részt. Az adatfelvétel online önkitöltős kérdőívek segítségével történt, amely a következő témaköröket fedte le: első találkozás a betegséggel, élet a betegséggel, a kezeléssel kapcsolatos elvárások, tapasztalatok, segítségek és szükségletek.
Betegek és módszer
A kérdőíves felmérésbe 61 prosztatarákkal élő beteget vontunk be. A betegeket a kezelőorvosokon, illetve az országos betegszervezeteken (Gyógyulj Velünk Egyesület, Magyar Rákellenes Liga) keresztül kértük fel a kutatásban való részvételre. Az adatfelvétel 2017. október – 2018. január között zajlott. A kutatásban való részvétel önkéntes volt, a kutatást végző cég a kutatás céljáról és módszeréről tájékoztatta a betegeket. A kérdőív kitöltése 20-25 percet vett igénybe és a következő témaköröket fedte le:
- első találkozás a betegséggel: diagnózis, milyen érzésekkel küzdöttek és milyen tájékoztatást kaptak, ezt mennyire értették meg.
- Élet a betegséggel: nehézségek, igények és szükségletek, tájékozódás a betegségről és jelenlegi érzések.
- Kezeléssel kapcsolatos remények, szükségletek, tapasztalatok, segítségek és hiányosságok.
A kutatás fókusza a beteg perspektívájának megismerése volt.
Eredmények
Demográfia
A betegek 100%-a férfi volt, az átlagéletkoruk 72 év. Lakóhely szerint 31% származott Budapestről, 42% vidéki városokból és 25% községekből. Felsőfokú végzettséggel 41%, érettségivel 33% rendelkezett, 26% végzett csak általános és szakiskolát. Mindössze 10% dolgozott teljes vagy részmunkaidőben, 85% nyugdíjas volt. 85% párkapcsolatban, 11% egyedül élt. Az általánosan elfogadott egészségügyi rizikófaktorokat figyelembe véve: a betegek 51%-a volt túlsúlyos, 23% elhízott, 8% dohányzott és 10% fogyasztott napi rendszerességgel alkoholt.
Első találkozás a betegséggel és diagnózis
A kutatásba bevont betegek közel felének (44%) nem voltak panaszai, véletlenül derült ki betegségük. A diagnózis közlésekor betegek többnyire negatív érzelmekről számoltak be: döbbenet, megsemmisülés, elkeseredettség, kilátástalanság (41%), a félelem, rémület, ijedtség, aggódás (34%) és a hitetlenség, bizonytalanság (28%). Reménykedésről vagy határozott pozitív hozzáállásról a betegek 21%-a számolt be.
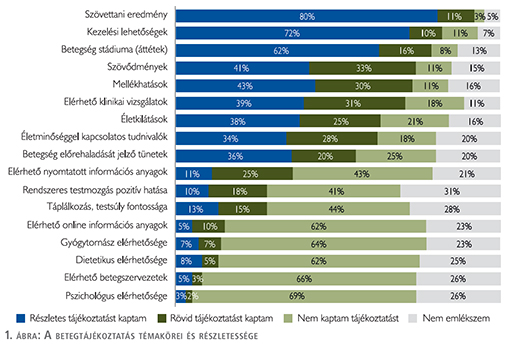
A betegek többsége úgy érzi, hogy a diagnózis hátteréről, azaz a szövettani eredményekről, a betegség stádiumáról, illetve a kezelési lehetőségekről részletes tájékoztatást kapott. A betegek kevesebb, mint fele kapott részletes tájékoztatást a kezelés esetleges szövődményeiről (41%), a lehetséges mellékhatásokról (43%), elérhető klinikai vizsgálatokról (39%) és az életkilátásokról (38%). Egyharmadukat tájékoztatták részletesen a betegség előrehaladását jelző tünetekről és az életminőséggel kapcsolatos tudnivalókról. 28% kapott részletes vagy rövid tájékoztatást a rendszeres testmozgás pozitív hatásairól és a táplálkozás, testsúly fontosságáról (1. ábra).
A kapott tájékoztatást a válaszadók többsége (84%) úgy érzi, hogy teljes mértékben megértette.
Kezelőorvosok, kezelések, információforrás és életmód
A válaszadók 93%-át urológus kezdte el kezelni a betegség felfedezésekor, és többségüket továbbra is kezeli urológus (85%). A betegek 38%-át kezeli jelenleg onkológus, 8% említette az onkoteamet. Mindössze a válaszadók 2%-a jár pszichológushoz.
A válaszadók 84%-a úgy ítélte meg, hogy kezelőorvosuk részletesen ismertette a különböző kezelési lehetőségeket, 16% viszont úgy nyilatkozott, hogy kezelőorvos nem ismertette azokat. 87% érezte úgy, hogy a kezelőorvos bevonta a kezeléssel kapcsolatos döntésekbe.
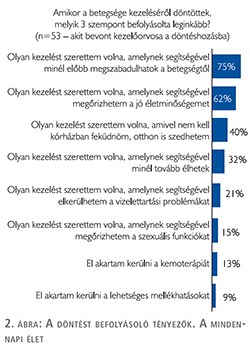
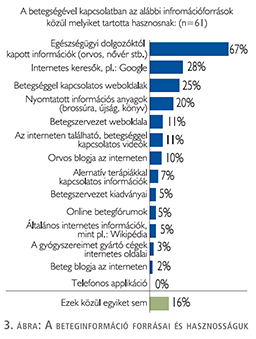
A döntést befolyásoló szempontok között a betegségtől való megszabadulást (75%), a jó életminőség megőrzését (62%) és az otthon alkalmazható terápiát (40%) jelölték meg a válaszadók a leggyakrabban (2. ábra). A válaszadók 67%-a említette, mint hasznos információforrást, az egészségügyi dolgozókat, 41%-uk az internetes felületeket, 20% a nyomtatott információs anyagokat (3. ábra).
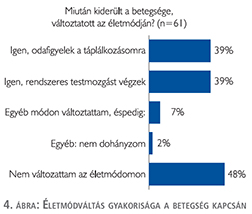
A betegek 48%-a nem változtatott az életmódján mióta kiderült betegségük (4. ábra).
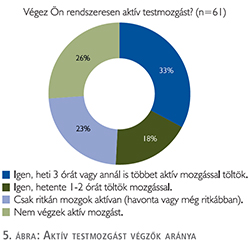
A kutatásban részt vevők egyharmada heti 3 órát vagy annál is többet tölt aktív mozgással, 23% csak ritkán, míg 26% egyáltalán nem végez aktív testmozgást (5. ábra).
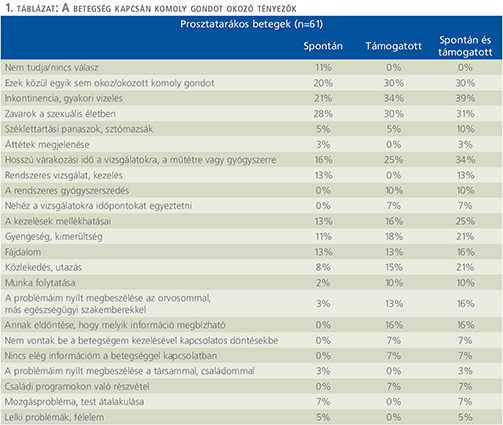
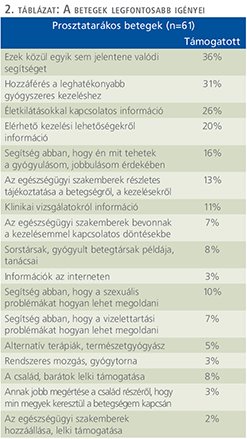
A betegség kapcsán komoly gondot okozó tényezőket az 1. táblázat, a betegek legfontosabb igényeit, szükségleteit a 2. táblázat tünteti fel.
Megbeszélés
A kasztrációrezisztens (akkor még hormonrezisztens) prosztatarák kezelésére az FDA 2004-ben engedélyezte a docetaxel alkalmazását. 6 év szünetet követően 2010-től sorra regisztrálták az újabb és újabb gyógyszereket, amelyek III. fázis vizsgálatokban igazoltan javították a prosztatarákos betegek túlélését. Ezek az engedélyezés sorrendjében a cabazitaxel, az abirateron, az enzalutamid, a radium-223 és az apalutamid. A korai felismerés, az időben elvégzett radikális műtét vagy sugárterápia, illetve az újabb modernebb terápiás lehetőségeknek köszönhetően a prosztatarákos betegek túlélése folyamatosan javul. A betegségével hosszú évekig együtt élő páciens számára a túlélés mellett az életminőség jelentősége is megnő.
A szubjektív betegút feltérképezésének legfőbb célja a betegellátás és a betegelégedettség javítása. Megtudhatjuk belőle, betegeink hogyan élik meg a betegséget, a kezelést és milyennek látják az ellátásuk és az orvos–beteg-kommunikáció minőségét. Olyan információkat tudhatunk meg segítségükkel, amelyek a szokásos orvos–beteg-találkozókon nyilvánvalóan nem derülnek ki. A betegek igényeit az irodalomban általában információs, szupportációs és terápiás igényekre osztják (2). A 61 beteggel végzett felmérésnek vannak korlátai, azonban a válaszok alkalmasak lehetnek arra, hogy néhány jelenségre felhívják a figyelmet.
Betegtájékoztatás
A betegtájékoztatással kapcsolatos válaszokat az 1. ábrában foglaltuk össze. A lokalizált prosztatadaganat mortalitása viszonylag alacsony, a betegséggel történő megküzdés a különböző terápiák okozta várható mellékhatások miatt (impotencia és inkontinencia) a betegek számára kifejezetten megterhelő (3, 4), ennek ellenére vizsgálatunkban az életminőséggel kapcsolatos tudnivalókról mindössze a betegek 28%-a kapott részletes vagy rövid tájékoztatást. A mi eredményeinkhez hasonló eredményre jutott egy az Egyesült Államokban végzett vizsgálat, ahol a prosztatadaganatos férfiak elsősorban a betegség kiújulásának jeleiről és a kezelés mellékhatásairól történő részletesebb információt hiányolták (5). Más vizsgálatokban a szexualitással és a pszichoszociális problémákkal kapcsolatos felvilágosítást nem találták elég részletesnek (6, 7). Magyar adatokat nem ismerünk, viszont nemzetközi vizsgálatok szerint a prosztatadaganatos betegek negyede, elsősorban a fiatalabbak igényelnék pszichológus segítségét (7, 8).
Amikor a betegekkel a daganatos diagnózist közlik, általában nincsenek abban az állapotban, hogy egy részletes tájékoztatást felfogjanak, vizsgálatunkban is főként negatív érzelmekről számoltak be a betegek. Ráadásul a túlterhelt magyar egészségügyben legtöbbször nincsenek is meg a feltételei a beteggel történő hosszas beszélgetésnek. Ennek ellenére az, hogy a prosztatarákos férfiaknál a hormonkezelés megkezdésekor a hormonkezelés mellékhatásainak ismertetése elmarad, minimum szuboptimális. A daganatos betegek amennyiben kemoterápiás kezelést kapnak, általában tisztában vannak a terápia mellékhatásaival. Mivel ezek a kezelések akár életet veszélyeztető mellékhatásokkal bírhatnak, a betegek részletes szóbeli felvilágosítást követően aláírásukkal is igazolják, hogy megértették a veszélyeket. Ezzel szemben a hormonkezelés mellékhatásai kevésbé ismertek, és mivel hosszabb távon alakulnak ki, a beteg életét nem veszélyeztetik, „csak” az életminőségét rontják, az orvosok is kevésbé érzik elengedhetetlennek a nem kívánt következmények részletes ismertetését. A hormonterápia toxicitása eltér az egyéb onkológiai kezelésekétől, de könnyen, érthetően elmagyarázható a betegnek. Ebben egy-egy jól kialakított brossúra, a szakma által lektorált, felvilágosítással foglalkozó honlap, jól képzett nővérek vagy a betegszervezetek is sokat segíthetnek. A másik jelentős különbség, hogy a hormonkezelést hosszabban (évekig, akár élethosszig) alkalmazzuk, mint a kemoterápiát. Amennyiben azt szeretnénk, hogy betegünk hű maradjon az előírt kezeléshez, elengedhetetlen a kezelés céljának és mellékhatásainak részletes ismertetése, lehetőleg a kezelés megkezdése előtt. Jól ismert tény, hogy a krónikus kezelések (magas vérnyomás, cukorbetegség) esetén a betegek complianc-e folyamatosan romlik, ezt a jelenséget emlőrákos nők hosszú távú hormonkezelése esetén is kimutatták (Wheeler, 2016; 10:). Egy prosztatarákos betegeken végzett vizsgálat is azt igazolta, hogy az alkalmazott gyógyszerek mellékhatásprofilja befolyásolja a betegek terápiahűségét (9). Az orvos sokféle segítséget nyújthat betegének a mellékhatások kivédésében, ehhez a betegnek lehetőséget kell nyújtania, hogy az életminőségét rontó mellékhatásokról őszintén beszélhessen. Anélkül, hogy a mellékhatások kivédésének részleteibe itt belemennénk (hőhullámok, erekitilis diszfunkció, libidó csökkenése, csontritkulás, kognitív hanyatlás, metabolikus szindróma, kardiovaszkuláris kockázat) fontos megjegyezni, hogy a mellékhatások nagy része csökkenthető megfelelő életmóddal, rendszeres testmozgással és megfelelő diétával.
Az onkoteam szerepe
Az onkoteam szerepét az 1/2012. (V. 31.) EMMI rendelet szabályozza. A rendelet szerint „A daganatos betegek ellátása komplex feladat, így a betegek optimális ellátásának meghatározása több szakterület orvosainak együttes feladata.” Ez ad garanciát arra, hogy a – nemzetközi ajánlások figyelembevételével – a betegek kivizsgálása és kezelése egységes legyen a daganatos betegek többszakmás ellátását végző onkológiai centrumokat működtető intézményeken belül, illetve országosan (10). Ennek alapján, Magyarországon minden daganatos beteg klinikai adatait, a diagnózis felállítását követően minél hamarabb, de legfeljebb 21 napon belül az onkoteam elé kell vinni. Ez az idő legfeljebb 30 napra meghosszabbítható. A fentiek ellenére a vizsgálatban a betegek mindössze 8%-a tudott arról, hogy esetét a bizottság megbeszélte volna. Ez még akkor is alacsony számnak tűnik, ha figyelembe vesszük, hogy a megkérdezettek jelentős hányadánál a betegség lokalizált, illetve nem minden beteg volt tisztában azzal, hogy esetét az onkológiai bizottság megtárgyalta-e vagy sem.
Életmód
Releváns kérdésnek tartottuk, hogy a megjelenő igények mellett a betegek mit tesznek saját meglátásuk szerint egészségük érdekében, milyen életmódot folytatnak. Különösen aktuálissá teszi kutatásunk ezen részét az életminőség kiemelt fontossága a válaszadók számára. A válaszadók BMI-indexe alapján 23% tekinthető elhízottnak (BMI³30), 51% túlsúlyosnak (BMI=25–29,9), ennek ellenére 23% csak ritkán mozog aktívan, és 26% egyáltalán nem végez aktív mozgást. Az aktív mozgást egyáltalán nem végzők között magasabb volt az áttéttel rendelkező betegek aránya (55%). A rendszeres mozgásnak pedig pont ebben a csoportban (hormonkezelést kapó áttétes betegek) volna a legfontosabb szerepe, mivel csökkenti a csont és izomvesztést, illetve a fáradékonyságot. Egy longitudinális vizsgálatban 144 áttéttel nem rendelkező prosztatarákos beteg életminőségét vizsgálták kérdőív segítségével. A hormonkezelést kapó betegek súlyosabb fáradtságról (p=0,001) és rosszabb életminőségről számoltak be, mint a hormonkezelésben nem, csak lokális kezelésben (EBRT, műtét) vagy szoros követésben részesülő betegek (p=0,001) (11). Két különböző randomizált vizsgálat is igazolta, hogy a rendszeres mozgás szignifikánsan képes csökkenteni a hormonkezeléssel összefüggő fáradtságot. Galvão és munkatársai 57 hormonkezelésben részesülő beteget randomizáltak 2 csoportba: egy rendszeresen edző és egy kontrollcsoportot hoztak létre. Az a csoport, amelyik egy 12 hetes aerobik és rezisztenciaedzésen vett részt, szignifikánsan kevésbé volt fáradékony. A fáradékonyságon kívül a 12 hetes edzés a hormonkezelés egyéb mellékhatásait, is mint az izom- és csontvesztést, szignifikánsan csökkentette (12). Segal és munkatársai egy hasonló randomizált vizsgálatban mutatták ki 155 prosztatarákos betegnél a fáradékonyság csökkenését (p=0,002) a felső (p=0,009) és az alsó test (p<0,001) izomerő növekedését egy 12 hetes rezisztenciaedzést követően (13). Egy kérdőíves felmérés alapján, azok a betegek, akik rendszeresen mozogtak, jobb életminőségről (QoL) számoltak be (14). Ugyanebben a vizsgálatban a betegek 29%-a az ajánlásoknak megfelelően hetente legalább ötször 30 percet aktívan mozgott, 27,4% viszont semmilyen rendszeres fizikai aktivitást nem végzett (14). A magyar prosztatarákos betegek rendszeres mozgásának elősegítésére indult el a 10 Ezer Lépés Program, amely a kezelőorvosok bevonásával, betegszervezetek által szervezett rendezvények, brossúrák és interneten elérhető videók segítségével edukálja a betegeket a rendszeres testmozgás előnyeiről. A program sikerét jelzi, hogy a hazánkban készült edukációs anyagok a környező országok betegei számára is elérhetővé váltak.
Következtetés
A szubjektív betegutat vizsgáló kérdőívek fontos információkat adhatnak mind az egészségügyben dolgozóknak, mind az egészségügyi stratégiát kialakító szakértőknek, azonban nem szabad megfeledkezni a módszer korlátairól és az értelmezés nehézségeiről. Az adatok használhatósága függ a megkérdezett populáció nagyságától és karakterisztikájától. Jelen vizsgálat mintája a prosztatarák prevalenciája alapján reprezentatívnak tekinthető, azonban a betegek további jellemzői szempontjából (lakhely, kor, végzettség, betegség stádiuma stb.) nem volt reprezentatív, ezért ebben a tekintetben vizsgálatunk használhatósága mindenképpen limitált.
A limitációk figyelembe vételével is úgy érezzük, hogy néhány, feltehetőleg valós jelenségre sikerült vizsgálatunkkal felhívni a figyelmet, így többek között arra, hogy a betegek körében milyen komoly az információk, a kommunikáció iránti igény. Az orvosok leterheltségét is figyelembe véve fontos lenne annak alapos átgondolása, hogy a szakmailag hiteles betegedukáció hogyan, milyen eszközökkel, együttműködésekkel valósítható meg a leghatékonyabban. A szakma és a prosztatarákos betegekért dolgozó betegszervezetek közötti hosszú távú együttműködés kiépítése fontos előrelépés lehetne az orvosszakmát is segítő, részben tehermentesítő, hiteles betegedukáció irányában.
A prosztatadaganatos betegek kezelése multidiszciplináris feladat. A csapat része az urológuson kívül a patológus, a radiológus, a sugárterápiás szakorvos, az onkológus, a gyógytornász és szükség szerint a pszichológus és a dietetikus is. Ideális esetben a beteg kezelésében résztvevő „team” a betegség felfedezését követően az onkológiai bizottsági ülésen beszéli át a kezelési lehetőségeket. A betegek túlélésének emelése és az életminőségük javulásának érdekében kiemelten fontos, hogy összhangban az előírásokkal, az onkoteamek minden beteg esetében összehívásra kerüljenek.
Nagy potenciál rejlik mindezen felül abban is, hogy a betegeket sikerül-e aktív, elkötelezett részesévé tenni a kezelési folyamatnak. A prosztatarákkal élő beteg is sokat tehet saját gyógyulásáért, állapota javulásáért, ha változtat életmódján, ha érti a kezelés folyamatát és megfelelő az adherenciája. A betegellátásban dolgozók az egészségügy többi szereplőjével és a betegszervezetekkel együttműködve érhetik el azt, hogy a beteg tisztában legyen szerepével a saját gyógyulásában.
A publikáció alapjául szolgáló kérdőíves felmérést a Janssen-Cilag Kft. megbízásából a Szinapszis Piackutató és Tanácsadó Kft. végezte 2017. október és 2018. január között.
A közlemény megírásának alapjául szolgáló kutató munkát a Janssen-Cilag Kft. anyagilag támogatta.
References
1. Risko Á. Az onkológiai betegek lelki rehabilitációja. Rahabilitáció 2007; 17(3–4): 34–39.
2. Gustafson DH, Arora NK, Nelson EC, Boberg EW. Increasing understanding of patient needs during and after hospitalization. Jt Comm J Qual Improv 2001. doi: https://doi.org/10.1016/S1070-3241(01)27008-4
3. Middleton RG, Thompson IM, Austenfeld MS, et al. Prostate Cancer Clinical Guidelines Panel Summary report on the management of clinically localized prostate cancer. The American Urological Association. J Urol 1995; 154(6): 2144–2148. http://www.ncbi.nlm.nih.gov/pubmed/7500479. Accessed March 27, 2019.
4. Litwin MS, Hays RD, Fink A, et al. Quality-of-life outcomes in men treated for localized prostate cancer. JAMA 1995; 273(2): 129–135. http://www.ncbi.nlm.nih.gov/pubmed/7799493. Accessed March 27, 2019.
5. Boberg EW, Gustafson DH, Hawkins RP, et al. Assessing the unmet information, support and care delivery needs of men with prostate cancer. Patient Educ Couns 2003; 49(3): 233–242. http://www.ncbi.nlm.nih.gov/pubmed/12642195. Accessed March 27, 2019.
6. Steginga SK, Occhipinti S, Dunn J, Gardiner RA, Heathcote P, Yaxley J. The supportive care needs of men with prostate cancer. Psychooncology 2000; 10(1): 66–75. http://www.ncbi.nlm.nih.gov/pubmed/11180578. Accessed March 27, 2019.
7. Shapiro PJ, Coyne JC, Kruus LK, Palmer SC, Vaughn DJ, Malkowicz SB. Interest in services among prostate cancer patients receiving androgen deprivation therapy. Psychooncology. 2004; 13(8): 512–525. doi: https://doi.org/10.1002/pon.769
8. Voerman B, Visser A, Fischer M, Garssen B, van Andel G, Bensing J. Determinants of participation in social support groups for prostate cancer patients. Psychooncology. 2007; 16(12): 1092–1099. doi: https://doi.org/10.1002/pon.1160
9. Behl AS, Ellis LA, Pilon D, Xiao Y, Lefebvre P. Medication Adherence, Treatment Patterns, and Dose Reduction in Patients with Metastatic Castration-Resistant Prostate Cancer Receiving Abiraterone Acetate or Enzalutamide. Am Heal drug benefits 2017; 10(6): 296–303. http://www.ncbi.nlm.nih.gov/pubmed/28975013. Accessed March 27, 2019.
10. Magyar Közlöny 2012. 64. Szám; 2012.
11. Herr HW, O’Sullivan M. Quality of life of asymptomatic men with nonmetastatic prostate cancer on androgen deprivation therapy. J Urol 2000; 163(6): 1743–1746. http://www.ncbi.nlm.nih.gov/pubmed/10799173. Accessed March 27, 2019.
12. Galvão DA, Taaffe DR, Spry N, Joseph D, Newton RU. Combined Resistance and Aerobic Exercise Program Reverses Muscle Loss in Men Undergoing Androgen Suppression Therapy for Prostate Cancer Without Bone Metastases: A Randomized Controlled Trial. J Clin Oncol 2010; 28(2): 340–347. doi: https://doi.org/10.1200/JCO.2009.23.2488
13. Segal RJ, Reid RD, Courneya KS, et al. Resistance Exercise in Men Receiving Androgen Deprivation Therapy for Prostate Cancer. J Clin Oncol 2003; 21(9): 1653–1659. doi: https://doi.org/10.1200/JCO.2003.09.534
14. Glaser AW, Fraser LK, Corner J, et al. Patient-reported outcomes of cancer survivors in England 1-5 years after diagnosis: a cross-sectional survey. BMJ Open 2013; 3(4): e002317. doi: https://doi.org/10.1136/bmjopen-2012-002317