2020-2 —- Full Articles
Efficacy of neoadjuvant hormonal treatment before radical prostatectomy for high-risk clinically localised prostate carcinomas
DOI: 10.22591/magyurol.2020.2.berczics.53
Authors:
Berczi Csaba dr., Dócs János dr., Flaskó Tibor dr.
Debreceni Egyetem Általános Orvostudományi Kar, Urológiai Tanszék, Debrecen (igazgató: Flaskó Tibor dr.)
Summary
Aims: To measure the efficacy of neoadjuvant hormonal therapy before multimodal treatment of patients with clinically localized high-risk prostate carcinomas.
Methods: From January 1996 to January 2019, 394 patients underwent radical prostatectomy for clinically localized high-risk prostate cancer. In Group 1 the patients neoadjuvant hormonal treatment (n: 98) was administered, while in Group 2 the patients didn’t receive any neoadjuvant hormonal treatment (n: 296). In Group 1, the mean age of the patients was 64.6 ± 6.1 years and the mean PSA level was 32.9 ng/mL. In Group 2, the mean age of the patients was 63.8 ± 6.4 years, and the mean PSA concentration was 25.4 ng/mL. In all cases the preoperative imaging examinations showed clinically localized prostate tumor.
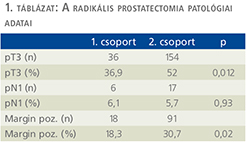
Results: Histology revealed locally advanced tumor (pT3) in 36 cases (36.9%) in Group 1, and in 154 patients (52.0%) in Group 2 (p = 0.012). Margin positivity was detected in 18 patients (18.3%) in Group 1, while it was proved in 91 cases (30.7%) in Group 2 (p = 0.02).
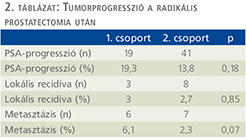
The median follow-up period was 56 months. In Group 1, biochemical progression developed in 19 patients (19.3%). Local recurrence and distant metastasis were diagnosed in 3 cases (3.0%) and in 6 occasions (6.1%) during this period. In Group 2, biochemical progression was diagnosed in 41 cases (13.8%), local recurrence in 8 patients (2.7%) and distant metastasis in 7 occasions (2.3%). There was no significant difference regarding to these parameters in the two groups. Tumor specific mortality was 3.0% in both groups (p = 0.991).
Conclusions: The results showed that the neoadjuvant hormonal therapy provided significantly better local tumor control in clinically localized high-risk prostate carcinomas. However, the neoadjuvant hormonal therapy didn’t prove any advantage according to tumor progression and tumor specific survival.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Célkitűzés: A neoadjuváns hormonkezelés hatékonyságának vizsgálata a klinikailag szervre lokalizált magas rizikójú prosztatatumorok esetében végzett multimodális kezelés során intézetükben.
Módszer: A tanulmányban az 1996.01.01 és 2019.01.01. között a klinikailag szervre lokalizált magas rizikójú prosztatadaganat miatt radikális prostatectomián átesett 394 beteg adatai kerültek feldolgozásra. Az 1. csoportba (n: 98) tartozó betegek a műtét előtt neoadjuváns hormonkezelést kaptak. A 2. csoportba sorolt betegek (n: 296) nem részesültek hormonkezelésben az operáció előtt. Az 1. csoportban az átlagos életkor 64,6 ± 6,1 év, míg az átlagos PSA-szint 32,9 ± 27,1 ng/ml. A 2. csoportban az átlagos életkor 63,8 ± 6,4 év, míg az átlagos PSA-szint 25,4 ± 19,6 ng/ml volt. Valamennyi esetben képalkotó vizsgálat történt, amely egyik esetben sem vetette fel lokálisan előrehaladott tumor gyanúját.
Eredmények: A szövettani vizsgálat 1. csoportban, 36 esetben (36,9%), míg a 2. csoportban 154 alkalommal (52,0%) igazolt lokálisan előrehaladott (pT3) daganatot (p = 0,012). Marginpozitivitás az 1. csoportban, 18 esetben (18,3%), míg a 2. csoportban, 91 betegben (30,7%) fordult elő (p = 0,02).
A medián 56 hónapos utánkövetés alatt az 1. csoportban biokémiai progressziót 19 (19,3%), lokális recidívát 3 (3,0%), míg távoli metasztázist 6 (6,1%) betegben diagnosztizáltak.
A 2. csoportban biokémiai progresszió 41 (13,8%), lokális recidíva 8 (2,7%), míg távoli metasztázis 7 (2,3%) esetben fordult elő. Ezen vizsgált mutatókban a két csoport között nem volt szignifikáns eltérés. A tumorspecifikus mortalitás mindkét csoportban 3% volt (p = 0,991).
Következtetések: Az eredmények alapján a magas rizikójú prosztatadaganatok esetében a neoadjuváns hormonkezelés szignifikánsan jobb lokális tumorkontrollt biztosított. A későbbi tumorprogresszió és tumorspecifikus túlélés szempontjából a neoadjuváns hormonkezelés nem nyújtott lényeges előnyt. A neoadjuváns hormonkezelést követően nem csökkent szignifikánsan az adjuváns és salvage kezelések száma sem.
Bevezetés
A D’Amico-beosztás szerint azokat a daganatokat, amelyeknél a PSA ≥20 ng/ml, vagy a Gleason-score ≥8 vagy a tumor cT3-stádiumú, magas rizikójú prosztatadaganatoknak nevezzük (1). Az a kérdés, hogy ezen prosztatatumoroknál mi az optimális kezelés, a radikális prostatectomia vagy a sugárkezelés, még nem egyértelmű. A magas rizikójú prosztatadaganatokban végzett radikális prostatectomiákat követően biokémia progresszió az esetek 55-70%-ában alakul ki. Esetükben távoli metasztázis 13%-ban míg tumor okozta mortalitás 6%-ban fordul elő (2–4).
A sugárkezelés viszonylatában már több randomizált klinikai vizsgálat igazolta, hogy a sugárkezelés mellett adott androgéndeprivációs hormonkezelés javítja a terápia onkológiai eredményességet (5–9). A magas rizikójú prosztatadaganatok miatt végzett radikális prostatectomia vonatkozásában viszont, az Európai Urológus Társaság módszertani levele alapján, a műtét előtt a neoadjuváns androgéndeprivációs hormonkezelés alkalmazása nem javasolt. Ugyanakkor nem hagyható figyelmen kívül, hogy sok klinikai tanulmány eredménye azt mutatta, hogy a neoadjuváns kezelések javítják a lokális tumorkontrollt. Több vizsgálat során a magas rizikójú daganatoknál a radikális prostatectomia előtt adott androgéndeprivációs hormonkezelés (ADT), ADT + kemoterápia vagy ADT + abirateron-acetát-kezelés mellett javult a tumor patológia stádiuma és a biokémiai progressziómentes túlélés (10–13).
Jelen tanulmányunkban vizsgáltuk a klinikailag szervre lokalizált, magas rizikójú prosztatadaganatos betegekben végzett radikális prostatectomiák előtt adott neoadjuváns androgéndeprivációs hormonkezelés eredményességet.
Módszerek
A DE Urológiai Klinikáján 1996.01.01. és 2019.01.01. között 394 betegben végeztünk radikális prostatectomiát klinikailag szervre lokalizált magas rizikójú prosztatadaganat miatt. A prosztatadaganatok magas rizikócsoportba való besorolása az Európai Urológus Társaság (EAU) erre vonatkozó beosztása szerinti történt (PSA >20 ng/ml vagy Glesaon-score >7 vagy cT ≥2c).
A prosztatabiopsziák szövettani vizsgálata során a 2014-es Gleason-rendszert alkalmaztuk retrospektíve.
A magas rizikójú daganatos betegekben valamennyi esetben képalkotó vizsgálatot végeztünk a tumor helyi kiterjedtségének meghatározása céljából. Korábban CT, majd a későbbiekben, amikor már volt lehetőségünk MRI-vizsgálatok elvégzésére, MRI-vizsgálatokat végeztünk. Az eltelt időtartam alatt különböző típusú és érzékenységű CT- és MRI-készüléket használtunk klinikánkon. Sok alkalommal azonban a beteg más kórházból hozta magával a CT vagy MRI eredményét. A klinikánkon végzett MRI-vizsgálatok 2015.09.01-ig 1 Teslás érzékenységű készülékkel, míg azt követően 3 Teslás készülékkel végezték. Az endorectalis MR-vizsgálatok 1 Teslás készülékkel történtek.
A klinikailag szervre lokalizált magas rizikójú tumoros betegeket két csoportba soroltuk.
Az 1. csoportba (n: 98) tartozó betegek a műtét előtt neoadjuváns androgéndeprivációs hormonkezelést kaptak. A 2. csoportba sorolt betegek (n: 296) nem részesültek hormonkezelésben az operáció előtt. Az 1. csoportban az átlagos életkor 64,6 ± 6,1 év, míg az átlagos PSA-szint 32,9 ± 27,1 ng/ml. A 2. csoportban az átlagos életkor 63,8 ± 6,4 év, míg az átlagos PSA-szint 25,4 ± 19,6 ng/ml volt. A neoadjuváns hormonkezelés időtartama 3 és 6 hónap között változott.
Valamennyi betegben a műtét előtt végzett képalkotó vizsgálat szervre lokalizált tumort véleményezett. Így a CT-vizsgálat 201 betegben, a kismedencei MRI 150 esetben, míg az endorectalis MRI 25 alkalommal mutatott cT2-stádiumú daganatot. Valamennyi betegben történt csontizotóp-vizsgálat, amely negatív volt. Az elvégzett képalkotó vizsgálatok távoli áttétet egyik betegben sem igazoltak.
A radikális prostatectomiát az 1. csoportban, 56 esetben laparoszkópos és 42 betegben nyílt műtéti feltárással végeztük. A 2. csoportban a beavatkozás 195 alkalommal laparoszkópos míg 101 esetben nyílt műtéti feltárással történt.
Az eltávolított prosztata patológiai stádiumának meghatározása a 2009. UICC TNM-rendszer szerint történt retrospektíve.
A műtétet követően az aktuális kezelési protokoll szerint obszervációt, adjuváns irradiációt, salvage irradiációt és hormonkezelést alkalmaztunk.
A betegek utánkövetése során PSA-vizsgálat az első 3 évben 3 havonta, azt követően 5 évig 6 havonta, majd ezután évente történt. Képalkotó vizsgálatot (CT-, MR-, csontizotóp-vizsgálat) PSA-emelkedés vagy a beteg panaszai miatt végeztünk. A biokémiai progressziót úgy definiáltuk, hogy olyan PSA-emelkedés, amely 0,2 ng/ml fölé történt (legalább 2 alkalommal).
Az átlagadatok mellett ± standard deviációt adtuk meg. A statisztikai analízist Student-féle t-próbával végeztük. A 0,05-nél kisebb p-értékeket tekintettük szignifikánsnak.
Eredmények
Az 1. csoportban a szövettani vizsgálat 36 esetben (32,7%) igazolt lokálisan előrehaladott (pT3) daganatot és 18 betegben (18,3%) marginpozitivitást mutatott (1. táblázat). A 2. csoportban pT3-stádiumú tumort 154 alkalommal (52%), míg a sebészi szél tumoros beszűrtségét 91 betegben (30,7%) észlelte a patológiai vizsgálat. A lokálisan előrehaladott prosztatakarcinóma és a marginpozitivitás szignifikánsan gyakrabban fordult elő a neoadjuváns hormonkezlést nem kapott csoportban (0,012 és 0,02). A nyirokcsomó-pozitivitás hasonló mértékben volt jelen mindkét csoportban (p = 0,93) (1. táblázat).
A betegek átlagos utánkövetése 56 hónap volt (7 és 234 hónap között változott).
Az átlagosan csaknem 5 éves utánkövetési idő alatt az 1. csoportban biokémiai progressziót 19 (19,3%), lokális recidívát 3 (3%), míg távoli metasztázist 6 (6,1%) betegben diagnosztizáltunk (2. táblázat). A 2. csoportban biokémiai progresszió 41 (13,8%), lokális recidíva 8 (2,7%), míg távoli metasztázis 7 (2,3%) esetben fordult elő. Ezen vizsgált mutatókban a két csoport között nem volt szignifikáns eltérés (2. táblázat).
A betegek utánkövetése alatt tumorspecifikus mortalitás mindkét csoportban 3% volt (p = 0,991).
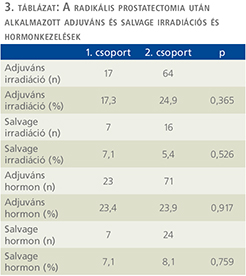
A magas rizikójú prosztatadaganatos betegek esetében az aktuális protokollnak megfelelően a betegcompliance és preferencia figyelembevételével obszervációt, adjuváns irradiációt salvage irradiációt és hormonkezelést alkalmaztunk (3. táblázat). Az 1. csoportban adjuváns és salvage sugárkezelés az esetek 17,3% és 7,1%-ában, míg a 2. csoportban a betegek 21,6% és 5,4%-ában történt (p = 0,365 és p = 0,526). A radikális prostatectomia után adjuváns és salvage hormonkezelést az 1. csoportban az esetek 23,4% és 7,1%-ában, míg a 2. csoportban a betegek 23,9% és 8,9%-ában alkalmaztunk (p = 0,917 és p = 0,759).
Megbeszélés
A férfiakban a leggyakrabban előforduló malignus betegség a prosztatatumor, amelynek 30%-a magas rizikójú daganat. Jelenleg a magas rizikójú prosztatadaganatok optimális kezelésének vonatkozásában a vélemények eltérők (14–17).
A tervezett operáció előtt alkalmazott neoadjuváns kezeléseknek alapvetően két célja van. Az egyik a lokális tumorkontroll biztosítása, míg a másik, a mikroszkópos metasztázisok szisztémás kontrollja. A lokális tumorkontroll javítása réven az eredetileg lokálisan előrehaladott daganat operálhatóvá válhat, és javul az épben eltávolítható daganatok aránya. Általában ha a neoadjuváns kezelésre lokálisan jól reagál a daganat, akkor az jól korrelál a hosszú távú onkológiai eredményességgel, így a tumormentes és a tumorspecifikus túléléssel. A neoadjuváns kezelés már több tumor vonatkozásában – emlő-, vastagbél-, nyelőcső-, hólyagdaganat – egyértelmű előnyöket mutatott (13).
A magas rizikójú prosztatatumorok esetében a radikális prostatectomia előtt alkalmazott neoadjuváns kezelés szintén előnyt nyújthat a jobb tumorkontroll biztosításában, a lokális vagy a lokálisan előrehaladott daganatok „downstagingjében”, a mikroszkopikus metasztázisok eradikálásában. Több tanulmány igazolta, hogy a neoadjuváns ADT-kezelés után végzett műtéteknél javul a marginpozitivitás aránya és jobb a tumor patológiai stádiuma. Azonban az ezzel kapcsolatban végzett klinikai vizsgálatok általában azt mutatták, hogy a biokémiai progresszióig eltelt idő és az általános túlélés nem javult (13, 18).
Saját vizsgálatunk során azt tapasztaltuk, hogy a neoadjuváns hormonkezelést kapott betegcsoportban a daganat patológiai stádiuma és a marginpozitivitás gyakorisága szignifikánsan jobb volt a kontrollcsoporthoz viszonyítva. Így elmondhatjuk, annak ellenére, hogy a lokális tumorkontroll biztosítása egyértelműen eredményesebbnek bizonyult, a biokémia progresszióig eltelt idő és a túlélés vonatkozásában nem volt szignifikáns különbség a két csoport között.
Tekintettel arra, hogy az eddigi vizsgálatok túlnyomó többsége azt mutatta, hogy a radikális prostatectomia előtt alkalmazott neoadjuváns androgéndeprivációs hormonkezelés nem nyújtott érdemi javulást a hosszú távú onkológiai kimenetel szempontjából, más készítményekkel történő neoadjuváns terápia került az érdeklődés előterébe. Neoadjuváns kezelésként LHRH-agonista és esztramusztin-foszfát alkalmazása mellett a patológiai stádium javulása mellett csökkent a biokémiai progresszió rizikója (11, 12). A CALGB 90203-vizsgálatban a neoadjuváns docetaxel +/- ADT-kezelés egyértelmű előnyét mutatták ki a túlélés vonatkozásában (19). Silbertstein és munkatársai paclitaxel + carboplatin + ADT-vel végzett neoadjuváns kemo-hormonális kezelés során a biokémiai progresszió előfordulásának csökkenését, valamint a metasztázismentes túlélés növekedését igazolták (20). Jelenleg több készítménnyel folynak klinikai vizsgálatok (tirozin-kináz-inhibitorok, mTOR-inhibitorok, PARP-inhibitorok, anti CTLA4-antitest) radikális prostatectomia előtti neoadjuváns kezelés céljából (19).
A prosztataműtét előtti neoadjuváns hormonkezelés hatékonysága szempontjából érdemes figyelembe venni, hogy ez mennyiben befolyásolja a későbbiekben alkalmazandó további terápia szükségességét. A radikális prostatectomia után esetlegesen végzendő adjuváns és salvage sugárkezelések és hormonterápia nemcsak a betegek daganatmentes túlélése szempontjából, hanem életminősége szempontjából is fontos. Saját vizsgálatunkban az adjuváns és salvage kezelések gyakorisága között nem volt szignifikáns különbség a két csoport között. Ugyanakkor az eredmények alapján látható, hogy az adjuváns sugárterápia kevesebbszer fordult elő a neoadjuváns hormonkezelést kapott csoportban, holott a preoperatív PSA-érték itt szignifikánsan magasabb volt.
Következtetések
Összefoglalva, a szervre lokalizált magas rizikójú prosztatadaganatok esetében a radikális prostatectomia előtt alkalmazott androgéndeprivációs terápia a lokális tumorkontroll szempontjából szignifikáns előnyt nyújt. Ugyanakkor a biokémiai progresszió, valamint a tumormentes túlélés szempontjából a neoadjuváns ADT-kezelés nem bizonyult eredményesebbnek.
References
1. D’Amico AV, Whittington R, Malkowicz SB, et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998; 280(11): 969–74. https://doi.org/10.1001/jama.280.11.969
2. Loeb S, Schaeffer EM, Trock BJ, Epstein JI, Humphreys EB, Walsh PC. What are the outcomes of radical prostatectomy for high-risk prostate cancer? Urology 2010 Sep; 76(3): 710–4. https://doi.org/10.1016/j.urology.2009.09.014
3. Yossepowitch O, Eggener SE, Serio AM, Carver BS, Bianco FJ Jr, Scardino PT, Eastham JA Secondary therapy, metastatic progression, and cancer-specific mortality in men with clinically high-risk prostate cancer treated with radical prostatectomy. Eur Urol 2008; 53(5): 950–9. https://doi.org/10.1016/j.eururo.2007.10.008
4. Yuh B, Artibani W, Heidenreich A, Kimm S, Menon M, Novara G, Tewari A, Touijer K, Wilson T, Zorn KC, Eggener SE. The role of robot-assisted radical prostatectomy and pelvic lymph node dissection in the management of high-risk prostate cancer: a systematic review. Eur Urol 2014; 65(5): 918–27. https://doi.org/10.1016/j.eururo.2013.05.026
5. Bolla M, de Reijke TM, Van Tienhoven G, et al. Duration of androgen suppression in the treatment of prostate cancer. N Engl J Med 2009; 360(24): 2516–27. https://doi.org/10.1056/NEJMoa0810095
6. Denham JW, Steigler A, Lamb DS, et al. Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 2011; 12(5): 451–9. https://doi.org/10.1016/S1470-2045(11)70063-8
7. Horwitz EM, Bae K, Hanks GE, et al. Ten-year follow-up of radiation therapy oncology group protocol 92-02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J Clin Oncol 2008; 26(15): 2497–504. https://doi.org/10.1200/JCO.2007.14.9021
8. Nguyen PL. Optimization of the Radiation Management of High-Risk Prostate Cancer. Semin Radiat Oncol 2017; 27(1): 43–49. https://doi.org/10.1016/j.semradonc.2016.08.009
9. Zapatero A, Guerrero A, Maldonado X, et al. High-dose radiotherapy with short-term or long-term androgen deprivation in localised prostate cancer (DART01/05 GICOR): a randomised, controlled, phase 3 trial. Lancet Oncol 2015; 16(3): 320–7. https://doi.org/10.1016/S1470-2045(15)70045-8
10. Cha EK, Eastham JA. Chemotherapy and novel therapeutics before radical prostatectomy for high-risk clinically localized prostate cancer. Urol Oncol 2015; 33(5): 217–25. https://doi.org/10.1016/j.urolonc.2014.11.020
11. Fujita N, Koie T, Ohyama C, Tanaka Y, Soma O, Matsumoto T, Yamamoto H, Imai A, Tobisawa Y, Yoneyama T, Hatakeyama S, Hashimoto Y. Overall survival of high-risk prostate cancer patients who received neoadjuvant chemohormonal therapy followed by radical prostatectomy at a single institution. Int J Clin Oncol 2017; 22(6): 1087–1093. https://doi.org/10.1007/s10147-017-1160-8
12. Hagiwara K, Koie T, Ohyama C, Yamamoto H, Imai A, Hatakeyama S, Yoneyama T, Hashimoto Y, Tobisawa Y, Yoneyama T. Efficacy of a neoadjuvant gonadotropin-releasing hormone antagonist plus low-dose estramustine phosphate in high-risk prostate cancer: a single-center study. Int Urol Nephrol 2017; 49(5): 811–816. https://doi.org/10.1007/s11255-017-1546-6
13. McKay RR, Choueiri TK, Taplin ME. Rationale for and review of neoadjuvant therapy prior to radical prostatectomy for patients with high-risk prostate cancer. Drugs 2013; 73(13): 1417–30. https://doi.org/10.1007/s40265-013-0107-2
14. Baker CB, McDonald AM, Yang ES, et al. Pelvic Radiotherapy versus Radical Prostatectomy with Limited Lymph Node Sampling for High-Grade Prostate Adenocarcinoma. Prostate Cancer 2016; 2016: 2674954. https://doi.org/10.1155/2016/2674954
15. Berczi Cs, Kiss Z, Flasko T. A radikális prostatectomia előtt alkalmazott neoadjuváns hormonkezelés hatékonysága lokálisan előrehaladott magas rizikójú prosztatadaganatoknál. Magyar Urológia 2019; 31: 3–7.
16. Kishan AU, Shaikh T, Wang PC, et al. Clinical Outcomes for Patients with Gleason Score 9-10 Prostate Adenocarcinoma Treated With Radiotherapy or Radical Prostatectomy: A Multi-institutional Comparative Analysis. Eur Urol 2017; 71(5): 766–773. https://doi.org/10.1016/j.eururo.2016.06.046
17. Matulay JT, DeCastro GJ. Radical Prostatectomy for High-risk Localized or Node-Positive Prostate Cancer: Removing the Primary. Curr Urol Rep 2017; 18(7): 53. https://doi.org/10.1007/s11934-017-0703-x
18. Gandaglia G, Sun M, Trinh QD, Becker A, Schiffmann J, Hu JC, Briganti A, Montorsi F, Perrotte P, Karakiewicz PI, Abdollah F. Survival benefit of definitive therapy in patients with clinically advanced prostate cancer: estimations of the number needed to treat based on competing-risks analysis. BJU Int 2014; 114(6b): E62–E69. https://doi.org/10.1111/bju.12645
19. Pietzak EJ, Eastham JA. Neoadjuvant Treatment of High-Risk, Clinically Localized Prostate Cancer Prior to Radical Prostatectomy. Curr Urol Rep 2016; 17(5): 37. https://doi.org/10.1007/s11934-016-0592-4
20. Silberstein JL, Poon SA, Sjoberg DD, Maschino AC, Vickers AJ, Bernie A, Konety BR, Kelly WK, Eastham JA. Long-term oncological outcomes of a phase II trial of neoadjuvant chemohormonal therapy followed by radical prostatectomy for patients with clinically localised, high-risk prostate cancer. BJU Int 2015; 116(1): 50–6. https://doi.org/10.1111/bju.12676
New treatment options for non-metastatic castration resistant (nmCRPC) prostate cancer
DOI: 10.22591/magyurol.2020.2.geczil.58
Authors:
Géczi Lajos dr.
Országos Onkológiai Intézet, Urogenitalis Tumorok és Klinikai Farmakológiai Osztály, Budapest (osztályvezető: Géczi Lajos dr.)
Summary
In this rewiev the author presents the results of SPARTAN, PROSPER and ARAMIS studies in nmCRPC. In the main clinical endponds (MFS, PFS, OS) apalutamid, enzalutamid and darolutamid in combination with androgen deprivation therapy (ADT) showed significant advantage compare to placebo and ADT. After these phase III clinical studies new standard treatment possibilities are available for clinicians in nmCRPC.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 2. SZÁM
Összefoglalás
A szerző a nmCRPC új kezelési lehetőségeit ismerteti a SPARTAN, PROSPER és ARAMIS vizsgálatok eredményei alapján. A legfőbb klinikai paraméterek (MFS, PFS, OS) tekintetében az apalutmid, enzalutmid, és darolutamid készítmények az androgén deprivációs hormonkezelés mellett (ADT) szignifikásan jobb hatékonyságot igazoltak a placebo plus ADT kezeléshez képest. A Fázis III klinikai vizsgálatok eredményei alapján a klinikusoknak új standard kezelési lehetőségek alkalmazására van lehetőségük nmCRPC kezelésében.
Bevezetés
A prosztatarák magas mortalitással és morbiditással járó betegség. Magyarországon a prosztatarák az évente jelentett 6. leggyakoribb rosszindulatú daganatos megbetegedés (kb. 3500-3600 eset), és a férfi daganatos halálozási statisztikában a 4. helyen szerepel (kb. 1100-1200 eset). Általában az idősebb korban észleljük, de fiatalabb korban is előfordult, a prognózis ezekben az esetekben általában rosszabb. Familiáris előfordulás is ismert.
A betegség felismerésében és prognózisának megítélésében segítségünkre van a prosztataspecifikusantigén- (PSA-) meghatározás, a végleges onkológiai diagnózist a prosztata-tűbiopszia, vagy a transurethralis műtét (vizeletelakadás esetén) szövettani vizsgálata adja. Normális PSA-érték mellett is lehet a betegnek prosztata-adenocarcinomája (3-5%), nem adenocarcinoma szövettani típusú malignus prosztatadaganatoknál a PSA normális.
A lokálisan kiterjedt, inoperábilis, vagy áttétes daganat nem gyógyítható, halálos betegség, jelenlegi lehetőségeinkkel a beteget tumormentessé tenni nem tudjuk. A kezelés általában palliatív, cél a beteg túlélésének javítása a legjobban biztosítható életminőség mellett.
Korai, lokalizált esetekben a kuratív célú radikális prostatectomia vagy sugárkezelés, vagy a kettő kombinálásával a betegség potenciálisan gyógyítható. A lokalizált, definitív kuratív kezelésen átesett betegekben életük folyamán kimutatható áttét nélkül biokémiai progresszió (PSA-emelkedés) alakulhat ki (27-53%), majd a betegség tovább progrediál, áttétek jelennek meg.
A biokémiai progresszió esetén a betegek – lehetőség szerint – lokális kiegészítő kezelést kapnak, és/vagy androgénmegvonásos kezelés (ADT) alkalmazása jön szóba. Az ADT alapja a gonadotropinfelszabadítóhormon- (GNRH-) agonista vagy -antagonista alkalmazása (biokémiai kasztráció), vagy a herék eltávolítása (sebészi kasztráció) a tesztoszteron kasztrációs szintre való csökkentése céljából. ADT hatására a PSA általában csökkent.
ADT alkalmazása mellett a betegekben hosszabb vagy rövidebb idő után kasztrációrezisztencia alakul ki (az első 5 évben 10-20%), ami azt jelenti, hogy a kasztrációs szinten levő tesztoszteronértékek ellenére a PSA ismét emelkedik, és/vagy áttétek alakulnak ki. Ez utóbbit kasztrációrezisztens áttétes prosztataráknak nevezik (mCRPC), ami halálos betegség, az átlagos túlélés kevesebb, mint 3 év. Azonban ha csak PSA-emelkedés észlelhető, kimutatható áttét nélkül, a meghatározás nmCRPC (vagy M0CRPC).
Az nmCRPC-meghatározás a Prostate Cancer Working Group (PCWG) 3 alapján:
- minimum PSA-szint 1,0 ng/ml, növekvő PSA legalább
2 ng/ml, a nadirnál 25%-kal legalább magasabb, - kasztrációs szérumtesztoszteron-szint (<50 ng/dl, vagy
1,7 mmol/l), - radiológiai progresszió hiánya (negatív mellkasi, hasi és kismedence-CT, negatív csontizotóp-vizsgálat).
Retrospektív vizsgálat során nmCRPC-ben az áttétek kialakulásának valószínűsége 5 éven belül 60%, a többség az első 3 évben jelentkezett. A betegek harmadánál két éven belül csontáttétek jelentek meg. A PSA kettőződési idő (PSADT) szoros összefüggést mutatott az áttétek kialakulásával (PSADT ≤10 hónap). A csontáttétek megjelenése a csonttal kapcsolatos események (SRE) révén (csonttörés, gerincvelői kompresszió, fájdalom) jelentősen csökkenti a betegek életminőségét és életkilátásait, valamint jelentősen megterheli az egészségügyi rendszert.
Korábban nmCRPC-ben az áttétek megjelenéséig a betegek követését javasolták. Az alkalmazott gyógyszeres kezelés 2018 előtt az első generációs antiandrogének (bicalutamid, flutamid, ösztrogén, ketakonazol) a betegek túlélését nem befolyásolta. A második generációs antiandrogének (enzalutamid, apalutamid, darolutamid) alkalmazása új lehetőséget jelent az nmCRPC kezelésében.
Az utóbbi két évben megjelent randomizált, III. fázisú vizsgálatok (Prosper, Spartan, Aramis) alapvetően megváltoztatták szemléletünket az nmCRPC kezelésében.
Prosper-vizsgálat
III. fázisú kettős vak, randomizált vizsgálatban az enzalutamid (160 mg per os/nap) és ADT kombinációt hasonlították össze ADT- plusz placebokezeléssel nmCRPC-ben szenvedő (N0 nyirokcsomó-stádiumú) betegekben. A PSDT ≤10 hónap és a PSA ≥2 ng/ml volt. A beválasztott 1401 beteget 2:1 arányban randomizálták enzalutamid- (n: 933) és placebo- (n: 468) kezelésre ADT mellett. Az átlagos kezelési idő 18,4 versus 11,1 hónap, az átlagos betegkövetés 22 hónap volt. Az elsődleges végpont a metasztázismentes túlélés (MFS), a másodlagos végpontok a PSA-progresszió, az új antineoplasztikus kezelésig eltelt idő, a túlélés (OS), a biztonságosság és az életminőség voltak. Az közölt adatok szerint a vizsgálati karon az MFS szignifikánsan jobbnak bizonyul (36,6 versus 14,7 hónap, HG: 0,29; p <0,0001) és az enzalutamid- plusz ADT-kezelés 71%-kal csökkentette a halálozás és az mCRPC kialakulásának valószínűségét az ADT plusz placebo adásával szemben. Az enzalutamid a közölt másodlagos végpont esetében, az új antineoplasztikus kezelésig eltelt idő (39,6 versus 17,1 hónap; HR: 0,21; p <0,0001) és a PSA-progresszióig eltelt idő (37,2 versus 3,9 hónap, HR: 0,07; p <0,0001) tekintetében is pozitív volt. Az enzalutamidkezelés a PSA-progresszió valószínűségét 93%-ban csökkentette. A túléléssel kapcsolatos új adatokat az ASCO 2020 kongresszusán ismertették. Az enzalutamid a placebohoz képest szignifikánsan megnövelte betegek túlélését. Az átlagos túlélés a vizsgálati karon 67,0, a placebo karon 56,3 hónap volt (HR 0,73, p = 0,0011). Az enzalutamid mellékhatásprofil a korábbi vizsgálatokban (AFFIRM, PREVAIL) észlelt mellékhatásokkal megegyezett. A leggyakoribb mellékhatás a gyengeség (33% versus 14%), a hőhullám (13% versus 8%), a magas vérnyomás (12% versus 5%) és az elesés (11% versus 4%) voltak a vizsgálati és placebokaron. A használt prosztataspecifikus életminőséget vizsgáló kérdőív (FACT-P) eredménye a két csoportban nem különbözött.
Spartan-vizsgálat
III. fázisú, randomizált, kettős vak vizsgálatban az apalutamid- (240 mg per os/nap) és ADT-kezelést ADT plusz placebo adásával hasonlították össze nmCRPC esetén. A randomizált 1207 beteget 2:1 arányban a vizsgálati karra (n: 806) és ADT- plusz placebokezelésre (n: 401) választottak be. A betegek N0 vagy N1 klinikai stádiumba tartoztak (N1=a bifurkáció alatti nyirokcsomó, a rövid átmérő <2 cm). Az elsőleges végpont szintén az MFS, a másodlagos végpontok az OS, progressziómentes túlélés (PFS), a tünetek megjelenéséig eltelt idő, a citosztatikus kezelésig eltelt idő, a biztonságosság és az életminőség voltak. A vizsgálati karon az MFS szignifikánsan jobb volt (40,5 hónap versus 16,2 hónap, HR: 0,28; p <0,0001), mint ADT plusz placebo adásakor. Az apalutamid hozzáadása az ADT-kezeléshez 72%-ban csökkentette a halálozás és a metasztázis kialakulásának valószínűségét. Az OS adatokat az ASCO legutóbbi kongresszusán ismertették. A átlagos túlélés az apalutamid karon 73,9, a placebo karon 59,9 hónap volt, a különbség statisztikailag jelentős (p=0,0161). Az apalutamid szignifikánsan jobb volt a PFS tekintetében is (40,5 hónap versus 14,7 hónap HR: 0,29, p <0,0001). Az apalutamid mellékhatása a korábban megismert mellékhatásokkal megegyező volt. Leggyakoribb mellékhatások a fáradékonyság (30,4% versus 21,1%), bőrkiütés (23,8% versus 5,5%), elesés (15,6% versus 9,0%), csonttörés (11,7% versus 6,5%), hypothyreosis (8,1% versus 2,0%) voltak az apalutamid- és placebokaron. Az életminőség vizsgálata során (FACT-P- és EQ-5D-RL-kérdőívek) a két csoport között különbséget nem észleltek.
Aramis-vizsgálat
III. fázis, randomizált, kettős vak vizsgálatban 1509 beteget randomizáltak ADT- és darolutamid- (n: 955) és ADT plusz placebo (n: 554) kezelésre. Az N1 bifurkáció alatti (rövid átmérő <2 cm) nyirokcsomó a beválasztáskor engedélyezett volt. A darolutamidot 600 mg per os napi dózisban alkalmazták. Az elsődleges végpont az MFS, a másodlagos végpont az OS, a csontáttéttel kapcsolatos tünetek, az első citosztatikus kezelés, a fájdalom megjelenéséig eltelt idő, és a biztonságosság volt. Az átlagos MFS 40,4 versus 18,4 hónap (HR: 0,41, p <0,0001) volt a darolutamidkezelés javára. Az MFS minden vizsgált alcsoportban és másodlagos végpontokban a vizsgálati készítménnyel volt szignifikánsan előnyösebb. Az átlagos túlélést a vizsgálti karokban még nem érték el, a darolutamid azonban statisztikailag jelentősen, 31%-al csökkentette a halálozás rizikóját (p=0,003). Darolutamid- és placebokezeléssel kapcsolatos leggyakoribb mellékhatások a fáradékonyság (12,1% versus 8,7%), a hasmenés (6,9% versus 5,8%), az ízületi fájdalom (8,1% versus 9,2%) és a szédülés (4,5% versus 4,0%) voltak. Az életminőség-vizsgálat során használt kérdőívek (FACT-P, BPI-SF, EORTC-QLQPR25) alapján a két csoportban különbséget nem találtak.
A készítmények alkalmazása
A három készítmény direkt összehasonlítása nmCRPC-ben nem történt meg. A mellékhatások, a betegek kísérőbetegségei, az egyéb alkalmazott gyógyszerek ismerete segítheti a klinikust a helyes gyógyszerválasztásban. A 3 vagy súlyosabb (Gr 3-4) mellékhatások előfordulási gyakorisága 45,1% versus 43,2%, 24,7% versus 19,5% és 31% versus 23% volt az apalutamid, a darolutamid, az enzalutamidkaron a placebóhoz képest. A leggyakoribb mellékhatások ezen második generációs antiandrogének alkalmazása során a fáradékonyság, magas vérnyomás, ízületi fájdalom, hányinger, hasmenés voltak. Az apalutamid adásával kapcsolatos speciális mellékhatásként csonttörést (11,7%), szédülést (8,1%), csökkent pajzsmirigyműködést (6,3%) figyeltek meg. Bőrkiütés apalutamid- és darolutamid- (23,5 és 2,9%) kezeléssel kapcsolatosan jelentkezett, enzalutamiddal kapcsolatosan nem közöltek. A darolutamid ellentétben az enzalutamiddal és az apalutamiddal kevésbé megy át a vér–agy gáton, ezért kevésbé okoz idegrendszeri mellékhatásokat. Mivel a prosztatarákos betegnek számos kísérőbetegség miatt többféle gyógyszert is szednie kell, a gyógyszerkölcsönhatások valószínűsége nagyobb. Az enzalutamid és apalutamid a CYP3A4-enzim szintjén számos gyógyszer metabolizációját befolyásolhatja, darolutamid esetében ezzel a módosítással kevésbé kell számolni.
Következtetések
Az új második generációs antiandrogén-készítmények új terápiás lehetőséget biztosítanak az nmCRPC kezelésében. Az indikációs kör azonos, hogy melyik készítményt alkalmazzuk melyik betegnél, gondos mérlegelést igényel. A készítmények direkt összehasonlítása nem történt meg. Fontos a betegek kiválasztása, figyelembe véve a várható mellékhatásokat, a beteg kísérőbetegségeit, a párhuzamosan alkalmazott gyógyszereit. A real-word klinikai adatok tovább gyarapíthatják ismereteinket a készítmények alkalmazáshatóságával kapcsolatosan. Addig a klinikust az a szemlélet vezérelje, hogy a betegnek a legkevesebb mellékhatással és a várható legnagyobb haszonnal járó kezelést igyekezzen kiválasztani.
References
1. Hussain M, Fizazi K, Saad F, et al. Enzalutamide in Men with Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 2018 Jun 28; 378 (26): 2465–2474.
2. Smith MR, Saad F, Chowdhury S, et al. Apalutamide Treatment and Metastasis-free Survival in Prostate Cancer N Engl J Med 2018 Apr 12; 378 (15): 1408–1418.
3. Fizazi K, Shore N, Tammela TL, et al. Darolutamide in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 2019 Mar 28; 380 (13): 1235–1246.
4. Heidegger I, Brandt MP, Heck MM. What is the best? Treatment of non-mestastatic castration resistant prostate cancer in 2020. Urol Oncol 2020 Apr; 38 (4): 129–136.
5. Esther J, Maughan BL, Anderson N, et al. Management of Nonmetastatic Castration-Resistant Prostate Cancer: Recent Advances and Future Direction. Curr Treat Options Oncol 2019 Feb 11; 20 (2): 14. Review
6. Hess-Busch Y, Hadaschik B, Hess J. M0CRPC overview of management options. World J Urol 2019 Nov 5. doi: https://doi.org/10.1007/s00345-019-02997-z. [Epub ahead of print] Review
7. Brave M, Weinstock C, Brewer JR, et al. An FDA Review of Drug Development in Non-Metastatic Castration-Resistant Prostate Cancer. Clin Cancer Res 2020 Apr 13. pii: clincanres.3835.2019. doi: https://doi.org/10.1158/1078-0432.CCR-19-3835. [Epub ahead of print]
8. Alpajaro SIR, Harris JAK, Evans CP. Non-metastatic castration resistant prostate cancer: a review of current and emerging medical therapies Prostate Cancer Prostatic Dis 2019 Mar; 22 (1): 16–23.
9. Overall survival (OS) results of phase III ARAMIS study of darolutamide (DARO) added to androgen deprivation therapy (ADT) for nonmetastatic castration-resistant prostate cancer (nmCRPC). Fizazi és mts-i. J Clin Oncol 38: 2020 (suppl; abstr 5514).
10. Final survival results from SPARTAN, a phase III study of apalutamide (APA) versus placebo (PBO) in patients (pts) with nonmetastatic castration-resistant prostate cancer (nmCRPC). Small E.J és mts-i. J Clin Oncol 38: 2020 (suppl; abstr 5516).
11. Final overall survival (OS) from PROSPER: A phase III, randomized, double-blind, placebo (PBO)-controlled study of enzalutamide (ENZA) in men with nonmetastatic castration-resistant prostate cancer (nmCRPC). Sternberg C.N. és mts.-i. J Clin Oncol 38: 2020 (suppl; abstr 5515)
Uro-oncologic aspects of Covid-19 research
DOI: 10.22591/magyurol.2020.2.fazekast.61
Authors:
Fazekas Tamás dr., Csizmarik Anita, Szarvas Tibor dr., Szűcs Miklós dr., Nyirády Péter dr.
Semmelweis Egyetem, Urológiai Klinika, Budapest (igazgató: Nyirády Péter dr.)
Summary
The SARS-2 Coronavirus and its related disease Covid-19 has dramatically changed our medical practice and daily lives in the last few months. During the fight against the epidemic, valuable scientific data have been obtained from the field of uro-oncology. Both the TMPRSS2 protein which enables viral cell entry, and Bacillus Calmette-Guérin (BCG) vaccination, which seems to have protective effect against the virus have important urologic aspects.
In this review we summarize the latest results on these topics and highlight unique opportunities for further research.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 2. SZÁM
Összefoglalás
A SARS-2-koronavírus és a Covid-19 betegség az utóbbi néhány hónapban eddig talán soha nem látott mértékben, egyik pillanatról a másikra változtatta meg orvosi gyakorlatunkat, életünket. A vírus megismerésében és a járvány elleni harcban váratlan helyről, az uroonkológia területéről érkeztek kiemelkedő kutatási eredmények. Mind a vírus bejutását biztosító TMPRSS2-fehérjével, mind a BCG-oltással és annak lehetséges protektív szerepével kapcsolatos vizsgálatoknak jelentős urológiai vonatkozásai vannak.
Az alábbiakban ismertetett tanulmányok és vizsgálati eredmények egyedi és kiemelkedő lehetőséget biztosítanak a további kutatások számára a témában.
Bevezetés
A SARS koronavírus-2 (Sars-CoV-2) és az általa okozott Covid-19 betegség terjedése eddig talán soha nem látott nyomás alá helyezte a világ egészségügyi ellátórendszereit. 2020. június 4-ig a Johns Hopkins Egyetem online adatbázisa szerint az igazolt fertőzöttek száma világszerte túllépte a 6,5 milliót (6 513 301), a halálozások száma pedig megközelíti a 400 ezret (386 111) (1, 2). Az utóbbi hónapok egészségügyi intézkedéseit a tömeges megbetegedésre való felkészülés jegyében a kórházi erőforrások felszabadítása jellemezte hazánkban is. Ennek eredményeképpen az egészségügyi szolgáltatók az elektív, nem életmentő urológiai beavatkozásokat és személyes orvos–beteg-találkozásokat elhalasztották, valamint korábban soha nem látott mértékben felértékelődött a telemedicina szerepe. Az életmentő, valamint azon műtétek, kezelések, amelyek elhalasztása potenciálisan súlyos egészségromlást von maga után – elsősorban az onkológiai beavatkozások, kemoterápia – továbbra is elvégezhetőek maradtak, ám ezen betegek alapbetegsége, gyengébb általános állapota, valamint számos kísérőbetegsége különösen fogékonnyá teszi őket Covid-19 betegségre.
A mindennapi urológiai betegellátásra gyakorolt hatásán kívül, a Sars-CoV-2 különösen jelentős kórokozó az urológusok számára, hiszen a vírus működésének megértésében az uroonkológiai kutatások szerepe kiemelkedő.
Androgénmegvonás és Covid-19
Az Sars-CoV-2 kórélettanának megértésében az utóbbi hónapok talán legjelentősebb felfedezése a vírus gazdasejtbe jutásának pontos leírása. A korábban már vizsgált Sars-CoV-hoz hasonlóan a Sars-CoV-2 is két sejtfelszíni fehérje együttes jelenléte esetén képes bejutni a sejtbe (3). A fertőzés első lépéseként a koronavírus kapcsolódik a gazdaszervezet megtámadott sejtjének sejtfelszíni receptorához, az angiotenzin-konvertáz-2 enzimhez (ACE2), majd az úgynevezett „priming” során a bizonyos emberi sejtek felszínén szintén jelen lévő transzmembrán szerin-proteáz-2 (TMPRSS2) fehérje elhasítja a vírus „spike” fehérjéjét, így képessé téve azt a sejtbe való bejutásra (3). A fent leírt vírusinternalizációs mechanizmus urológiai jelentőségét az adja, hogy TMPRSS2-fehérjét a prosztatarákkal kapcsolatban fedezték fel és a funkciója is jórészt a prosztatadaganattal kapcsolatos kutatások által vált ismertté (4–6). A TMPRSS2-t a prosztatát követően a hasnyálmirigy és a tüdő epitheliuma expresszálja a legnagyobb mértékben (4–6). A fehérje androgénszabályzás alatt áll, expressziója fokozott prosztatarákban, valamint fontos megemlíteni, hogy a daganatok több mint 50%-ában a TMPRSS2 génje onkogén szomatikus átrendeződést szenved az ETS-kapcsolt génnel (ERG), létrehozva a TMPRSS2: ERG fúziós gént (5–13). Az androgénmegvonás során, mind a TMPRSS2, mind a TMPRSS2: ERG-gén expressziója csökken, a daganat kasztrációrezisztenssé válásakor pedig ismét emelkedik (8). A rendelkezésre álló adatok alapján korábban felvetettük a kérdést, vajon az androgénmegvonás csökkenti-e a TMPRSS-2 kifejeződését a tüdőben és ezzel párhuzamosan a Sars-CoV-2-re való fogékonyságot, valamint vajon ezzel összhangban a fertőzés férfi predominanciája és súlyosabb lefolyása összefügg-e a TMPRSS2-gén androgénszabályzásával (14)?
Egy nemrég megjelent retrospektív tanulmány a koronavírus által egyik leginkább érintett olaszországi Veneto tartomány több mint 4500 igazoltan Sars-CoV-2-pozitív férfi betegét vizsgálta. Az adatok között szerepelt a kórházi felvétel és intenzív kezelés igénye, a halálozás, a betegnek volt-e tumora, volt-e prosztatadaganata, valamint kapott-e androgénmegvonásos kezelést (15). Eredményeik alapján a bármilyen daganatos beteg megfertőződésének rizikója magasabb volt a daganatos betegségben nem szenvedő populációhoz képest (esélyhányados: 1,79), ám érdekes módon az androgén megvonásban részesülő prosztatarákos betegek fogékonyságát alacsonyabbnak, a lefolyás súlyosságát pedig enyhébbnek találták mind a daganatos (esélyhányados: 5,17), mind az ADT-t nem kapó prosztatarákos betegekéhez képest (esélyhányados: 4,05) (15). Az adatok alapján az ADT protektív szerepe a kórokozóval szemben valószínűleg összefügg a TMPRSS2-fehérje expressziójával, amely a jövőben terápiás célpontként szolgálhat a gyógyszerfejlesztés számára.
A TMPRSS2 specifikus gátlószerét, a kamosztát-mezilátot Japánban már az 1980-as évek óta használják a hasnyálmirigy-gyulladás kezelésére. Erről a szerről korábban in vivo egérmodellen végzett kísérletek kimutatták, hogy csökkenti a Sars-CoV-fertőzés mortalitását ezért feltételezhető, hogy hatékony lehet a Sars-CoV-2-vel szemben is (3, 16, 17). Ezen eredményekre alapozva indult el az a randomizált, prospektív klinikai vizsgálat, amelyben igazolt Sars-CoV-2-fertőzött betegeken vizsgálják a kamosztát-mezilát a betegség súlyosságára gyakorolt hatását (NCT04321096).
A Bacillus Calmette Guérin (BCG) és Covid-19
További fontos urológiai vonatkozás a BCG-védőoltás lehetséges védő szerepe a Covid-19-cel szemben (18). Az oltás heterológ immunmoduláns hatását már korábban bizonyították, nemcsak a tuberkulózissal, hanem egyéb kórokozókkal, herpesz- és influenzavírusokkal szemben is bizonyos fokú védelmet nyújt (19–22). A Sars-CoV-2-vel kapcsolatban egy frissen megjelent tanulmány az egyes európai országok BCG-oltási szabályait vetette össze a vírus előfordulásával és mortalitásával (18). A közlemény BCG-oltás szempontjából három csoportba sorolja az országokat:
- soha nem volt kötelező,
- valaha kötelező volt,
- ma is kötelező.
A kapott eredmények jóval kedvezőbbek voltak a BCG-t jelenleg is kötelezően alkalmazó országokban mind az előfordulás, mind a halálozás tekintetében (18). Bár a WHO szerint az oltás védőhatása jelenleg nem kellően alátámasztott, ezért az elmúlt hónapokban több prospektív vizsgálatot indítottak a témában (23).
Az urológiai gyakorlatban a BCG kemoinstillációt 1976 óta használjuk, a jelenlegi irányelvek szerint a nem izominvazív hólyagdaganatok (T1, high grade) és az in situ karcinómák (CIS) kezelésében (24, 25). Bár a kezelés pontos mechanizmusa még a mai napig sem ismert minden részletében, a TH1 immunválasznak központi szerepet tulajdonítanak a daganatellenes reakció kifejlődésében (19, 26, 27). Bár a folyamat a fehérvérsejtek hólyagfalba való helyi infiltrációját eredményezi, korábban már felmerült a BCG-instilláció szisztémás immunmoduláns hatásának lehetősége (19, 28). Mindezen adatokat szem előtt tartva felmerül a kérdés, hogy a hólyagdaganatra alkalmazott BCG-instilláció védelmet nyújt-e a koronavírusfertőzéssel szemben, illetve csökkentheti-e a fatális kimenetel kockázatát.
Következtetések
Szerte a világon eddig soha nem látott méretű tudományos összefogás zajlik a Sars-CoV-2-járvány leküzdésének érdekében, amelyben mind az alap-, mind a klinikai kutatás egyaránt fontos szerepet játszik. Az uroonkológiával foglalkozó szakemberek nemcsak a betegek gondos és körültekintő kezelésével, hanem értékes klinikai adatok biztosításával is fontos szerepet játszanak a Sars-CoV-2 megismerésében és a járvány elleni küzdelemben.
References
1. Dong E, Du H, Gardner L. An interactive web-based dashboard to track COVID-19 in real time. Lancet Infect Dis 2020; 3099: 19–20.
2. COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU) (accessed: 10th of April). (2020). Available at: https://coronavirus.jhu.edu/map.html.
3. Hoffmann M, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 2020; 181: 271–280. https://doi.org/10.1016/j.cell.2020.02.052
4. Bertram S, et al. Influenza and SARS-Coronavirus Activating Proteases TMPRSS2 and HAT Are Expressed at Multiple Sites in Human Respiratory and Gastrointestinal Tracts. PLoS One 2012; 7: 1–8.
5. Lin B, et al. Prostate-localized and Androgen-regulated Expression of the Membrane bound Serine Protease TMPRSS2. Cancer Res 1999; 59: 4180–4184.
6. Lucas JM, et al. The androgen-regulated type II serine protease TMPRSS2 is differentially expressed and mislocalized in prostate adenocarcinoma. J Pathol 2008; 215: 118–125.
7. Afar DEH, et al. Catalytic Cleavage of the Androgen-regulated TMPRSS2 Protease Results in Its Secretion by Prostate and Prostate Cancer Epithelia. Cancer Res 2001; 61: 1686–1692.
8. Israel B, MD, Avenue B. Reactivation of Androgen Receptor Regulated TMPRSS2:ERG Gene Expression in Castration Resistant Prostate Cancer. Cancer Res 2009; 69: 6027–6032.
9. Stopsack KH, et al. TMPRSS2 and COVID-19 : Serendipity or opportunity for intervention? Cancer Discov CD-20-0451 (2020). https://doi.org/10.1158/2159-8290.CD-20-0451
10. Vaarala MH, Porvari K, Kyllönen A, Lukkarinen O, Vihko P. The TMPRSS2 gene encoding transmembrane serine protease is overexpressed in a majority of prostate cancer patients: Detection of mutated TMPRSS2 form in a case of aggressive disease. Int J Cancer 2001; 94: 705–710. https://doi.org/10.1002/ijc.1526
11. Szarvas T, Csizmarik A, Szűcs M, Nyirády P. Molecular subtypes and perspectives of targeted therapies in prostate cancer. Orv Hetil 2019; 160: 252–263.
12. Ács B, Szarvas T, Székely N, Nyirády P, Szász M. Current State of ERG as Biomarker in Prostatic Adenocarcinoma. Curr Cancer Drug Targets 2015; 15: 643–651.
13. Yoo S, et al. Androgen Receptor CAG Repeat Polymorphism and Risk of TMPRSS2:ERG–Positive Prostate Cancer. Cancer Epidemiol. Biomarkers Prev 2014. https://doi.org/10.1158/1055-9965.EPI-14-0020
14. Fazekas T, Szarvas T, Csizmarik A, Hadaschik Boris, Nyirády P. COVID-19 research: promising tracks leading to uro-oncology. Int Urol Nephrol 2020; 10–12. https://doi.org/10.1007/s11255-020-02490-2
15. Montopoli M, et al. Androgen-deprivation therapies for prostate cancer and risk of infection by SARS-CoV-2: a population-based study (n=4532). Ann Oncol 2020. https://doi.org/10.1016/j.annonc.2020.04.479
16. Zhou Y, et al. Protease inhibitors targeting coronavirus and filovirus entry. Antiviral Res 2015; 116: 76–84. https://doi.org/10.1016/j.ecolecon.2015.02.027
17. Uno Y. Camostat mesilate therapy for COVID-19. Intern Emerg Med 2020; 10–11. https://doi.org/10.1007/s11739-020-02345-9
18. Hegarty PK, Service NH, Kamat AM, Dinardo A. BCG vaccination may be protective against Covid-19. 2020. https://doi.org/10.13140/RG.2.2.35948.10880
19. Tanner R, Villarreal-ramos B, Vordermeier HM, Mcshane H. The Humoral Immune Response to BCG Vaccination. Front Immunol 2019; 10. https://doi.org/10.3389/fimmu.2019.01317
20. Butkeviciute E, Jones CE, Smith SG. Heterologous effects of infant BCG vaccination: potential mechanisms of immunity. Future Microbiol 2018; 13: 1193–1208.
21. Uthayakumar D, Paris S, Chapat L, Freyburger L. Non-specific Effects of Vaccines Illustrated Through the BCG Example : From Observations to Demonstrations 2018; 9: 1–13.
22. Moorlag SJCFM, Arts RJW, Crevel R. Van, Netea MG. Non-specific effects of BCG vaccine on viral infections. Clin Microbiol Infect 2019; 25: 1473–1478. https://doi.org/10.1016/j.cmi.2019.04.020
23. Bacille Calmette-Guérin (BCG) vaccination and COVID-19 (accessed: 12th of April). (2020). Available at: https://www.who.int/news-room/commentaries/detail/bacillecalmette-guérin-(bcg)-vaccination-and-covid-19.
24. Morales A, Eidiger D, Bruce AW. Intracavitary Bacillus Calmette-guerin in the Treatment of Superficial Bladder Tumors. J Urol 1976; 116: 180–182. https://doi.org/10.1016/S0022-5347(17)58737-6
25. Babjuk M, et al. EAU Guidelines on Bladder Cancer (TaT1 and CIS). 2020; 1–54.
26. Redelman-sidi G, Glickman MS, Bochner BH. The mechanism of action of BCG therapy for bladder cancer – a current perspective. Nat Rev Urol 2014; 11: 153–162.
27. Patard JJ, Saint F, Velotti F, Abbou CC, Chopin KD. Immune response following intravesical bacillus Calmette-Guerin instillations in superficial bladder cancer: a review. Urol Res 1998; 26: 155–159. https://doi.org/10.1080/03056249908704373
28. Taniguchi K, et al. Systemic immune response after intravesical instillation of bacille Calmette-Guérin (BCG) for superficial bladder cancer. Clin Exp Immunol 1999; 115: 131–135.
Difficulties in the distinguish between in situ carcinoma and interstitial cystitis of the bladder based on 5 cases
DOI: 10.22591/magyurol.2020.2.becsia.64
Authors:
Bécsi Áron dr.1, Nyirády Péter dr.1, Székely Eszter dr.2, Majoros Attila dr.1
1Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum, Budapest (igazgató: Nyirády Péter dr.)
2Semmelweis Egyetem, II. sz. Patológiai Intézet, Budapest (igazgató: Kiss András dr.)
Summary
Introduction: The clinical presentation of carcinoma in situ (CIS) and interstitial cystitis (IC) can be quite similar, but the two diseases require completely different treatment. Making the right diagnosis can be difficult ultimately the histopathologic sample from the suspicious lesion of the bladder can give us the correct answer. In this paper we present five cases in which the similarities and differences of these two diseases are pointed out. To assure safe and best possible treatment for the future patients with such symptoms we suggest some practical diagnostic recommendations.
Case reports (patients and method, results): Five cases are presented with the typical symptoms of IC, but the histopathological findings proved CIS. According to the histological diagnosis the patients received oncological treatment according the European Association Urological Guideline.
Conclusion: Although IC and CIS can present similar lower urinary symptoms, it is essential to distinguish the two diseases. The two diseases require completely different treatment. Treating CIS as if it was IC by mistake can lead to the progression of bladder cancer, therefore risking the lives of our patients. Taking histological sample is essential for the accurate diagnosis. In authors’ opinion before starting invasive treatment for IC suspect patients biopsy of the urinary bladder is necessary, for the exclusion of the CIS.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Bevezetés: A húgyhólyag in situ karcinóma (CIS) és az interstitialis cystitis (IC) gyakran hasonló megjelenésű lehet, azonban különböző kezelést igényelnek. A differenciáldiagnosztika sokszor nehéz feladat elé állítja a vizsgáló orvosokat. A szerzők esetbemutatások kapcsán próbálják bemutatni a két kórkép azonosságait, eltéréseit. A biztonságos kezelés érdekében javaslatot tesznek a gyakorlat számára alkalmazható elkülönítő kórismézésre.
Esetismertetések (betegek és módszer, eredmények): Öt beteg esetét ismertetik, akiknél a vizelési panaszok alapján felmerült IC lehetősége, ugyanakkor az elvégzett szövettani vizsgálat CIS-t igazolt. A hisztológia eredménye alapján az IC gyanús panaszokkal jelentkező betegeknél további onkológiai kezelés történt.
Következtetések: Bár az IC és CIS hasonló vizelési panaszokat okozhat, alapvető fontosságú a két kórkép biztonságos elkülönítése, mivel azok teljesen különböző kezelést igényelnek, továbbá az IC invazív kezelése CIS esetén a folyamat progressziójához vezethet. A biztos diagnózis csak szövettani mintavétel alapján lehetséges. Ezért a szerzők véleménye szerint IC gyanúja és emiatt tervezett invazív kezelés előtt, amennyiben esetleges malignitás lehetőségét klinikailag teljes biztonsággal nem tudjuk kizárni, feltétlenül szükséges a húgyhólyag-biopszia elvégzése CIS kiszűrése céljából.
Bevezetés
Az interstitialis cystitis (IC) és a húgyhólyag in situ karcinómájának (CIS) elkülönítése nehéz feladat elé állíthatja a gyakorlott urológust is. Mindkét betegség tüneteként jelentkezhetnek idült alsó húgyúti panaszok – gyakori vizelési ingerek, nehéz vizelés, éjszakai vizelés, alhasi fájdalom – és mikroszkópos vérvizelés (1, 2). A beteg további kilátásait (mind onkológiai, mind életminőség szempontjából) jelentősen meghatározza a helyes diagnózis felállítása. A két betegség kezelése teljesen eltérő. A fel nem ismert húgyhólyag CIS esetén a kezelés elmaradása, vagy késése, valamint a nem megfelelő terápia (pl. IC-re javasolt felületbevonó kezelés, vagy detrusor izomzatba adott botulinumtoxin-injekció) súlyos következményekhez, akár a daganat izominfiltratív terjedéséhez vezethet. Öt ismertetett betegünk példáján szeretnénk bemutatni milyen tünetek vihetik tévútra az urológust. Igyekszünk rávilágítani azokra a pontokra, amelyek meghatározók a korrekt kivizsgálás szempontjából. Fel kívánjuk hívni a figyelmet azokra a lehetőségekre, amelyek megkönnyítik a differenciáldiagnosztikát. Valamint javaslatot teszünk az interstitialis cystitis gyanúja esetén általunk elengedhetetlennek tartott vizsgálatokra.
Esetbemutatások (betegek és módszer, eredmények)
1. eset
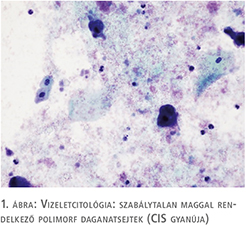
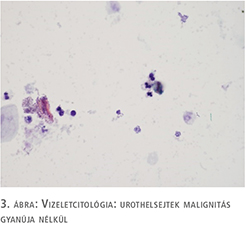
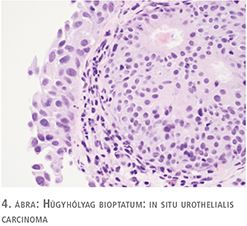
75 éves nőbeteg korábban húgyhólyag CIS miatt esett át transurethralis reszekción más intézetben, posztoperatív utókezelést nem kapott. Két év rendszeres cisztoszkópiás és vizeletcitológiai kontroll mellett recidívamentes volt. Újonnan jelentkező gyakori vizelési ingerei, urge inkontinenciás panaszai miatt jelentkezett kivizsgálásra, véres vizelete nem volt. Húgyúti fertőzés, mikro-, illetve makrohematúria kizárható volt. Urodinamikai vizsgálat detrusor túlműködést és csökkent hólyagkapacitást mutatott. Cisztoszkópia a hólyagban több helyen talált hyperaemiát, fokozott erezettséget és a hólyag telődése mellett IC-re jellemző típusos képet, egyértelmű tumoros folyamat nem volt látható. Bár a betegnek ismert volt hólyagtumoros anamnézise, a panaszok, az urodinámia és a hólyagtükri kép egymást erősítve elsősorban interstitialis cystitis gyanúját vetették fel, ám az elvégzett vizeletcitológiai vizsgálat malignus sejtek jelenlétét írta le (1. ábra). A húgyhólyag transurethralis térképbiopsziája mellett döntöttünk, amely in situ karcinómát igazolt (2. ábra). Hasi, kismedencei CT-vizsgálat a hólyag falában és környezetében reziduális daganatot, propagációt nem írt le. A beavatkozást követően a szövettani eredmény ismeretében a beteg BCG hólyaginstillációs kúrában részesült, amely a vizelési panaszait tovább rontotta, az anticholinerg kezelés nem hozott javulást. Sajnos az igazolt CIS miatt a vizelési panaszok célzott másodvonalbeli kezelése (felületbevonó terápiák, botulinumtoxin intradetrusor kezelés) nem volt lehetséges.

2. eset
74 éves nőbeteg korábban két alkalommal esett át felületes, alacsonyan differenciált (high grade) húgyhólyagdaganat, valamint párhuzamosan jelenlévő CIS miatt transurethralis reszekción. Rendszeres cisztoszkópos, valamint vizeletcitológiai vizsgálatok során recidíva nem merült fel. Kétéves tünetmentességet követően, bár véres vizelete nem volt, gyakori vizelési ingerek (nycturia 8-10 alkalommal), urge ingerek miatt jelentkezett. Ditropan-, Uroxal-kezelés mellett panaszai mérséklődtek, de nem szűntek meg teljesen. Cisztoszkópia 200 ml-es kapacitást mutatott, valamint a hólyagban telődésre a kis erekből „hóesésszerű” bevérzések jelentkeztek. Friss vizeletcitológiai vizsgálata nem mutatta malignitás gyanúját (3. ábra). Transurethralis húgyhólyag térképbiopsziát végeztünk. A szövettani vizsgálat in situ karcinóma jelenlétét igazolta (4. ábra). Hasi, kismedencei CT-vizsgálat eltérést nem igazolt, a szövettani vizsgálat eredménye alapján a betegnél BCG-instillációs kezelést javasoltunk, vezető vizelési panaszainak további másodvonalbeli kezelése a hisztológia eredménye miatt nem volt lehetséges.
3. eset
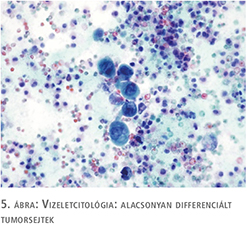
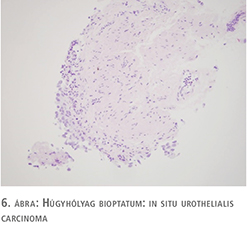
62 éves férfi beteg korábban felületes, jól differenciált (low grade) húgyhólyagdaganat miatt TUR-műtéten esett át. A beavatkozást követő kétéves időszakban egy alkalommal cisztoszkópiás vizsgálat során felmerült recidíva lehetősége, de hólyagbiopszia a malignitás jelenlétét kizárta. Alhasi fájdalmai, pollakisuriája és nycturiája, sürgető vizelési ingerei jelentkeztek, amely sem prosztatikus eredettel, sem húgyúti fertőzéssel nem voltak magyarázhatók. Véres vizelete nem volt. Kontroll cisztoszkópia során egyértelmű tumort nem láttunk, a fekélyes, vérzékeny elváltozás alapján leginkább interstitialis cystitis gyanúja merült fel. Vizeletcitológiai vizsgálat alacsonyan differenciált karcinómasejtek jelenlétét mutatta (5. ábra). Transurethralis húgyhólyag térképbiopsziát végeztünk. A szövettani vizsgálat in situ karcinóma jelenlétét mutatta (6. ábra). A beteg hasi, kismedencei CT-vizsgálata hólyagfal-vastagodáson kívül egyéb eltérést nem igazolt. Oki terápiaként BCG-kezelés indult.
4. eset
77 éves nőbeteg alsó húgyúti panaszai miatt jelentkezett kivizsgálásra. Gyakori, sürgető vizelési ingerei, valamint hólyagtáji fájdalmai voltak. Hólyagtükrözés során kis húgyhólyag-kapacitást mértek, valamint Hunner-ulcusnak megfelelő képletek voltak láthatók. A panaszok és a látott kép alapján került felállításra az interstitialis cystitis diagnózisa. A hólyag hidrodilatációja, elektrokoagulációja történt. A beavatkozásokat vizeletcitológiai vizsgálat nem előzte meg. Progrediáló panaszai miatt jelentkezett klinikánkon. Vizeletcitológiai vizsgálat felvetette rosszindulatú sejtek jelenlétét. A szövettani vizsgálat alacsonyan differenciált felületes húgyhólyagdaganatot igazolt. Utóreszekció alkalmával a daganat már nem volt igazolható. A beteg intravesicalis BCG-kezelésben részesült. Hasi, kismedencei CT-vizsgálat hólyagfali megvastagodást mutatott.
5. eset
81 éves nőbetegnél fájdalmas, gyakori vizelési ingerek, rövid ideig tartó makroszkópos hematúria miatt több alkalommal történt antibiotikumkezelés. Öt év alatt több alkalommal volt cisztoszkópos vizsgálata, amely tumort nem mutatott, de a látott kép alapján felmerült intestitialis cystitis gyanúja is, emiatt chondroitin-szulfát lokális hólyagkezeléseket kapott eredménytelenül. A lokálisan alkalmazott kombinált GAG-kezelés mellett panaszai csökkenését észlelte. Kontroll cisztoszkópos vizsgálat során észlelt daganat gyanúja miatt indított vizeletcitológiai vizsgálat tumorsejteket igazolt. Alacsonyan differenciált hólyagtumor gyanúja merült fel. A transurethralis reszekció valamint a 6 helyről vett hidegbiopszia in situ karcinóma jelenlétét igazolta. A beteg ezt követően BCG-kezelésben részesült. Hasi és kismedencei CT-vizsgálat kórosat nem mutatott, kontroll cisztoszkópia során daganat jelenléte nem merült fel, kontroll vizeletcitológia azonban malignus sejtek jelenlétét vetette fel. A beteg vizelési panaszait az első vonalban alkalmazható anticholinergikumokkal, béta-adrenoreceptor-agonistákkal érdemben nem tudtuk javítani. Alapbetegsége miatt az urge panaszok másodvonalbeli kezelése nem volt lehetséges, a beteg további kontrollra, oki terápiára nem jelentkezett.
Megbeszélés
Mind az interstitialis cystitis, mind a húgyhólyag in situ karcinómája jelentkezhet alsó húgyúti panaszok formájában. Legtöbbször ez gyakori sürgető vizelési ingereket, alhasi diszkomfortérzést, valamint alkalmanként idült fájdalmat is jelenthet. Makroszkópos, vagy mikroszkópos hematúria mindkét betegségben előfordulhat (1, 2).
Az in situ karcinóma gyakoriságával kapcsolatban több adat áll rendelkezésünkre. Különböző szerzők vizsgálata alapján a felületes húgyhólyagdaganatok 5-10%-a jelentkezik in situ karcinóma formájában (3, 4), de ennél magasabb 19%-os arányt is leírtak (5). Ennek a széles tartománynak a hátterében az in situ karcinóma egységes definíciójának és klasszifikációjának hiányát láthatjuk (6). Az IC előfordulásáról kevés adat áll rendelkezésre, irodalmi adat alapján évente 100 000 nő közül 21-nél, 100 000 férfi közül 4-nél alakul ki (7).
Bár az említett panaszok a beteg életminőségét jelentősen befolyásolhatják gyakran nem olyan fokúak és típusúak (a hematúria gyakran hiányozhat, vagy csak minimális mértékben, mikrohematúria formájában van jelen), hogy a kezelőorvos súlyos betegségre gondoljon. Ezek a betegek legtöbbször húgyúti fertőzés diagnózisával antibiotikumterápiában részesülnek, annak ellenére, hogy sokszor a vizeletvizsgálat eredménye fertőzés jelenlétét nem támasztja alá. Ilyen téves diagnózisok és szükségtelen antibiotikumkezelések mind az alapellátás, mind a szakellátás szintjén gyakran előfordulnak. A további differenciáldiagnosztika igénye sajnos sokszor csak számos sikertelen antibiotikumkúrát követően merül fel. Ez a betegnek szükségtelen antibiotikum-okozta mellékhatásokat, valamint jelentős időveszteséget jelenthet.
A Society for Urodynamics and Female Urology meghatározása alapján interstitialis cystitisnek/hólyagfájdalom-szindrómának a 6 hétnél hosszabb ideje fennálló, alsó húgyúti tünetekkel járó, hólyagtáji kellemetlen érzést (fájdalom, nyomás, diszkomfort) tekintjük, húgyúti fertőzés vagy egyéb kimutatható ok nélkül (8). Ezen definíció alapján az interstitialis cystitis kórisméje a tünetek alapján kimondható, amennyiben az elvégzett vizsgálatok egyértelmű kiváltó okot igazolni nem tudtak. A rendelkezésre álló irányelvek IC gyanúja esetén nem követelik meg szövettani vizsgálat elvégzését. Az Európai Urológus Társaság ajánlása szerint a diagnózis a fenti tünetek alapján megalapozott, ha nincs egyéb kiváltó ok (Gr: A). A panaszok időtartamával kapcsolatban feltételt nem állít az ajánlás (9). Az EAU-irányvonal idült kismedencei fájdalomszindróma miatt szövettani mintavételt csak indokolt, kivételes esetben javasol (10).
Interstitialis cystitis kimutatásában a cisztoszkópia szerepe ellentmondásos mivel az igen jellemző Hunner-fekélyek az esetek egy részében nincsenek jelen. Ez akár a betegek 30%-át is érintheti (11). A nyálkahártya glomerulációi, valamint a gyakorlatban jelentkező vörhenyes nyálkahártya-felületek pedig nem kellően specifikusak interstitialis cystitisre. A betegség lefolyásának kontrollja során azonban a cisztoszkópia hasznos eszköznek bizonyul.
A szövettani mintavétel hasznosságát többen kimutatták az interstitialis cystitis diagnózisának alátámasztásában illetve a lézió- (Hunner-ulcus) mentes elváltozások in situ karcinómától való elkülönítésében (9, 12).
Az interstitialis cystitis kimutatásában és követésében további segítséget nyújthatnak a vizelési napló vezetése, valamint validált, a betegség tüneteinek fokát felmérő kérdőívek (ICSI International Cystitis Symptoms Index, ICPI Interstitial Problem Index). A húgyhólyag in situ karcinómája: lapos, szövettanilag alacsonyan differenciált urothelialis carcinoma. Igen gyakran multifokálisan, a hólyag nyálkahártyáján fordul elő, de megjelenhet a felső húgyutakban, a prosztata ductusaiban valamint a prosztatikus húgycsőben is (13). A betegségre mikroszkópos, vagy makroszkópos vérvizelés hívhatja fel a figyelmet, de sokszor az IC-hez hasonlóan a makrohematúria nélkül jelentkező vizeléses panaszok dominálnak. Cisztoszkópos vizsgálat során lapos megjelenése miatt könnyen elkerülheti a vizsgáló figyelmét, vagy gyulladásos folyamattal téveszthető össze (6). Az endoszkópia szenzitivitása fluoreszcens cisztoszkópiás eljárás végzésével fokozható (14). Ez utóbbinak malignitás gyanúja esetén, illetve az esetleges szövettani mintavétel tervezése során van jelentősebb szerepe.
Az in situ karcinóma gyanúja esetén további vizsgáló módszer lehet, a high grade carcinomák jelenlétének kimutatásában igen érzékeny vizeletcitológia. A vizsgálat magas szenzitivitását az eljárásban gyakorlott uropatológus biztosíthatja. Szem előtt kell azonban tartanunk, hogy a daganatsejtek a vizeletelvezető-rendszer bármely részéről származhatnak.
Az in situ karcinóma gyanúja esetén a diagnózis felállításához pozitív citológiai vizsgálat mellett is kötelező a transurethralis szövettani mintavétellel (húgyhólyag-biopszia). IC gyanújakor azonban a szövettani vizsgálat nem kötelezően elvégzendő.
Az interstitialis cystitis ellenes terápiák hatását in situ karcinóma esetén részletesen nem vizsgálták. A leglényegesebb hatást a téves diagnózis és kezelések okozta késedelem okozza. A húgyhólyag in situ karcinómája igen agresszív elváltozás, amely magában hordozza a távoli áttétképzés lehetőségét, valamint az izominfiltratív terjedés valószínűségét. Ez utóbbinak a kockázata átlagosan 54% a diagnózis felállítását követő 5 évben (15).
Bár saját vizsgálatunk alacsony esetszáma, továbbá a három beteg hólyagtumoros anamnézise jelentősen csökkenti a levonható következtetéseket, az öt eset részletes megtárgyalása inkább az esetismertetések logikáját követve hívja fel a figyelmet a klinikai tünetek hasonlóságára CIS és IC esetében. Az orvosi köztudatban a hólyagtumor vezető tüneteként a néma hematúria szerepel. Sajnos urológusok közül is csak kevesen vannak tisztában vele, hogy az in situ karcinóma sokszor hematúria nélkül, csupán vizelési panaszok, fájdalmak tüneteivel jelentkezik. Ezért a vérvizelés nélküli „atípusos” panaszokat gyakran gyulladásos jelekként, sok esetben az IC tüneteként azonosítják. Nem ritkán feledésbe merül az anamnézis felvétele alkalmával, a beteg évekkel korábbi felületes hólyagtumor/CIS miatti kezelése. Így csupán a tünetekre koncentrálva, a kórelőzményt figyelmen kívül hagyva a gyanú könnyebben terelődik IC lehetőségére. Kétségtelen, hogy a vizeletcitológia, még az aspecifikus hólyagtükri eltérések esetén is az esetek nagy részében felhívhatja a figyelmet high grade hólyagtumor/CIS lehetőségére, sajnos gyakran ez is elfelejtődik. A véres vizelet és a cisztoszkópia során látott egyértelmű tumor jelenléte az a két meghatározó tényező, amely mellett minden urológus gondolata hólyagtumor lehetősége felé fordul. Saját rövid esetismertetéseink bemutatásával és összefoglalásával éppen az volt a célunk, hogy felhívjuk a figyelmet az IC és CIC hasonló klinikai megjelenésére és a diagnosztikai tévedések lehetőségeire. Mind az öt CIS-es beteg esetében a klinikai tünetek és a látott endoszkópos kép alapján merült fel interstitialis cystitis lehetősége is. Az első három betegnél a malignuselváltozás lehetőségére a betegek terhelt onkológiai előzménye is felhívta a figyelmet. A dolgozat egyik fő mondanivalója, hogy CIS-pozitív anamnézis egy életre szóló utánkövetést jelent és vizelési panaszok, hólyagfájdalmak esetén is elsősorban malignitásra gondoljunk ilyen betegnél. Csak a CIS/hólyagtumor biztos kizárása (hólyagbiopszia) után gondolkodhatunk a panaszok más kiváltó okában. Két beteg esetében megelőző uroonkológiai betegség nem volt. Mind az öt beteg esetében láthatók voltak speciális hólyagtükri elváltozások, a vizeletcitológiai vizsgálat csupán 3 esetben mutatta ki malignus sejtek jelenlétét, egy esetben negatív volt, egy esetben pedig nem történt ilyen vizsgálat az első észlelés alkalmával. A korábbi hólyagdaganat kezelésen átesett betegeknél az előzményekre való tekintettel a daganat kiújulásának lehetősége miatt, míg a két onkológiailag nem kezelt betegnél a primer malignitás kizárása céljából végeztünk szövettani mintavételt. A transurethralis térképbiopszia mind az öt betegünk esetében igazolta az in situ karcinómát. Ez azt jelenti, hogy egy betegnél az onkológiai szempontból negatív endoszkópos lelet és egy esetben malignitást nem igazoló vizeletcitológia ellenére volt igazolható a húgyhólyag in situ karcinómája. Ezek alapján úgy gondoljuk, hogy IC tüneteit mutató betegeknél alapvető fontosságú a korábbi esetleges CIS/hólyagtumor-előzmények feltérképezése, a legkisebb bizonytalanság (pozitív vagy atípusos sejteket mutató vizeletcitológia, malignitás esetleges gyanúját csupán legminimálisabban felvető cisztoszkópos eltérések) esetén a húgyhólyag szövettani mintavételével kell az állapotot pontosan tisztázni.
Következtetés
Az interstitialis cystitis és a húgyhólyag in situ karcinómájának differenciáldiagnózisa nehéz, komoly felkészültséget igénylő feladat. Körültekintő kivizsgálással elkerülhető a nem megfelelő diagnózisból következő haszontalan, káros kezelés, vagy a kezelés elmaradásából adódó betegségprogresszió. Az interstitialis cystitis nem szövettani, hanem klinikai diagnózis (amely kizárásos alapon kerül leírásra), ugyanakkor a kórképre jellemző panaszok alapján a vizsgáló orvos CIS-re is gondolhat, ezért véleményünk szerint IC gyanúja esetén elengedhetetlen a malignuselváltozás biztos kizárása. A hagyományos cisztoszkópia specificitása nem elégséges a két betegség közti elkülönítésre. A high grade daganatsejtek kimutatásában segítséget nyújthat a vizeletcitológia, azonban álnegatív és álpozitív eredmények előfordulásával is kell számolnunk. A malignus elváltozás jelenlétét biztosan csak szövettani mintavétellel tudjuk kimutatni. A kórelőzményben szereplő korábbi húgyhólyagdaganat, in situ karcinóma vagy a cisztoszkópia során látható, malignitásra legkisebb mértékben is gyanús nyálkahártya-elváltozás esetén a mintavétel elengedhetetlen.
References
1. Humphrey P.A. Urothelial Carcinoma In Situ of the Bladder. J Urol 2012; 187; 1057–1058. https://doi.org/10.1016/j.juro.2011.12.020
2. Warren JW, Meyer WA, Greenberg P, et al. Using the International Continence Society’s Definition of Painful Bladder Syndrome Urology. 2006 Jun; 67(6): 1138–1143. https://doi.org/10.1016/j.urology.2006.01.086
3. Lamm DL, Herr HW, Jakse G, et al. Updated concepts and treatment of in situ carcinoma. UrolOncol 1998; 4: 130–8. https://doi.org/10.1016/S1078-1439(99)00020-4
4. Kaasinen E, Wijkstrom H, Malmstrom PU, et al. Alternating mitomycin C and BCG instillations versus BCG alone in treatment carinoma in situ of the urinary bladder: a Nordic study. Eur Urol 2003; 43: 637–45. https://doi.org/10.1016/S0302-2838(03)00140-4
5. Palou J, Salvador J, Parada R, et al. Carcinoma in situ of the prostatic urethra: the role of intravesical BCG. Urol Integr Invest 2001; 6: 165–70.
6. Kirkali Z, Chan T, Manoharan M, et al. Bladder cancer: epidemiology, staging and grading, and diagnosis Urology. 2005 Dec; 66(6 Suppl 1): 4–34. https://doi.org/10.1016/j.urology.2005.07.062
7. Clemens J, Meenan R, Rosetti M, Gao S, Calhoun E. Prevalence and incidence of interstitial cystitis in a managed care population. J Urol 173(1): 98–102. https://doi.org/10.1097/01.ju.0000146114.53828.82
8. Hanno P, Dmochowski R. Status of international consensus on interstitial cystitis/bladder pain syndrome/painful bladder syndrome: 2008 snapshot. Neurourol Urodyn 2009; 28: 274–86. https://doi.org/10.1002/nau.20687
9. van de Merwe JP, Nordling J, et al. Diagnostic criteria, classification, and nomenclature for painful bladder syndrome/interstitial cystitis: an ESSIC proposal. Eur Urol 2008; 53(1): 60–7. https://doi.org/10.1016/j.eururo.2007.09.019
10. Engeler D, Baranowski AP, Borovicka J, et al. Guidelines on Chronic Pelvic Pain 2014 D
11. Johansson L, Fall M. Pathology of interstitial cystitis. Urol Clin North Am 1994 Feb; 21(1): 55–62.
12. Geurts N, Van Dyck J, Wyndaele JJ. Bladder pain syndrome: do the different morphological and cystoscopic features correlate? Scand J Urol Nephrol 2011; 45(1): 20–3. https://doi.org/10.3109/00365599.2010.519346
13. Sylvester R, van der Meijden A, Witjes JA, et al. High-grade Ta urothelial carcinoma and carcinoma in situ of the bladder. Urology 2005 Dec; 66(6 Suppl 1): 90–107. https://doi.org/10.1016/j.urology.2005.06.135
14. Kausch I, Sommerauer M, Montorsi F, et al. Photodynamic diagnosis in non-muscle-invasive bladder cancer: a systematic review and cumulative analysis of prospective studies. Eur Urol 2010 Apr; 57(4): 595–606. https://doi.org/10.1016/j.eururo.2009.11.041
15. Lamm D, Herr H, Jakse G, et al. Updated concepts and treatment of carcinoma in situ. Urol Oncol 1998; 4: 130–138. https://doi.org/10.1016/S1078-1439(99)00020-4
Rare scrotal manifestation of pancreatitis – The role of early differential diagnostics
DOI: 10.22591/magyurol.2020.2.juhaszd.69
Authors:
Juhász Dániel dr., Nyirády Péter dr., Majoros Attila dr.
Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum, Budapest (igazgató: Nyirády Péter dr.)
Summary
Introduction: Acute scrotum is an acute condition associated with swelling of the testicles and pain, which can be caused by inflammation, trauma and torsion of testicles and testicular appendices. As a complication of the inflammation of the pancreas an abscess can occur. Scrotal involvement is a literary rarity. This is a case report of a patient with chronic pancreatitis, scrotal swelling and pain causing problem in early differential diagnostics.
Case report: A 49-year-old male patient with progressive left side scrotal and lower abdominal pain, left side testicular swelling and penis edema attended the outpatient’s clinic. Physical examination and ultrasonography (US) of testicles arose the possibility of genital inflammation, but the intact male adnexal morphology raised the possibility of secondary process. The abdominal and pelvic CT-scan showed a large left-sided retroperitoneal multiregional abscess system with a propagation towards the back muscles presuming a pancreatic origin. After a surgical drainage the patient could be treated conservatively.
Discussion and conclusion: Scrotal swelling and pain can occur in case of acute retroperitoneal abscess, which is a rare complication of pancreatitis. In case of acute scrotum, if the etiology is unclear secondary origin shall be assumed. As a result of the correct differential diagnostics, the patient received targeted conservative therapy and no scrotal exploration was needed. In case of acute scrotum, prior to perform surgical exploration of the scrotum, correct differential diagnostics and treatment should be performed, additional tests can clarify the diagnosis.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Bevezetés: Az akut scrotum a herék duzzanatával, fájdalmával járó heveny kórállapot, ami gyulladás, trauma, a here és függelékeinek csavarodása következtében alakulhat ki. Bár irodalmi ritkaság, mégis a heveny hasnyálmirigy-gyulladás szövődményeként is kialakulhat scrotalis érintettség, tályog. Közleményünkben egy differenciáldiagnosztikai nehézséget okozó, herezacskó-duzzanattal és fájdalommal járó idült pancreatitises beteg esetét ismertetjük.
Esetismertetés: Egy 49 éves férfibeteg bal oldali heretáji, illetve alhasi fájdalom, bal oldali hereduzzanat és péniszödéma miatt kereste fel ügyeletünket. A fizikális vizsgálat és a here képalkotó vizsgálata felvetette az akut scrotalis gyulladás lehetőségét, azonban az ép here miatt szekunder eredet is szóba jött. Az elvégzett hasi-kismedencei CT a has bal oldalán a rekeszi felszíntől kiinduló, többrekeszes, a háti izmok felé propagációt mutató folyadékgyülemet mutatott, amely a pancreasból kiinduló tályognak bizonyult. Sebészeti drenázs után a beteg konzervatív kezelés mellett gyógyult.
Megbeszélés és következtetés: A retroperitonealis tályogot okozó pancreatitis ritka szövődménye lehet, a lecsorgó váladék okozta scrotalis duzzanat, fájdalom. Akut scrotum esetében, amikor az etiológia nem egyértelmű, mindig gondoljunk esetleges szekunder eredetre is. A helyes differenciáldiagnosztika eredményeképpen esetünkben a betegnél nem volt szükség a here műtéti feltárására, ehelyett oki kezelésre került. Akut scrotum esetén, exploráció elvégzése előtt az alapos differenciáldiagnosztika, illetve kiegészítő vizsgálatok pontosíthatják kórismézésünket.
Bevezetés
Az akut scrotum a herék duzzanatával, fájdalmával járó heveny kórállapot. Hátterében állhat gyulladás és fertőzés, amit leg-
gyakrabban húgyúti patogének, illetve STI (sexually transmitted infection – szexuálisan terjedő infekció) kórokozók (pl. Chlamydia trachomatis, Neisseria gonorrheae stb.) okozhatnak. Fiatal gyermekkorban 2 éves kor alatt, valamint 15–20 év között leggyakrabban heretorzió, herefüggelék-csavarodás, trauma, valamint Henoch–Schönlein-purpura okozhatja (1). Heretorzió során az ondózsinór megcsavarodása miatt az érintett oldali here heveny keringészavara alakul ki, ami sürgős beavatkozást igényel a here megőrzése érdekében (2).
A hasnyálmirigy heveny, szubakut vagy krónikus gyulladása és következményes tályogkialakulás ritkán scrotalis gyulladás kialakulásához vezethet. Az akut pancreatitis kétféle módon zajlik. Az esetek 85%-ában a benignusabb kimenetelű ödémás forma alakul ki, míg 15%-ban a fulmináns lefolyású nekrózissal járó típust látjuk, ami akár letális is lehet. Hátterében több faktor szerepelhet (pl. virális infekció, gyógyszer, epekő, alkoholfogyasztás stb.). Szövődményeként kialakulhat pseudocysta, tályog, ritkán többrekeszes tályogrendszer. Scrotalis érintettség irodalmi ritkaság. Egy differenciáldiagnosztikai nehézséget okozó herezacskó-duzzanattal és fájdalommal járó idült pancreatitises beteg esetét ismertetjük a következőkben.
Esetismertetés
Egy 49 éves férfibeteg pár napos, progrediáló bal oldali heretáji, illetve alhasi fájdalom, bal oldali hereduzzanat és péniszödéma miatt kereste fel ügyeletünket. Egyéb panasza nem volt, anamnéziséből krónikus alkoholizmus, korábban bal oldali lumbális tályog punkciója és akut pancreatitis miatt többszöri járó- és fekvőbeteg-kezelés volt kiemelhető. Fizikális vizsgálata során megnagyobbodott, bal oldalon hiperémiás, duzzadtabb, tömöttebb tapintatú, érzékeny, fájdalmas scrotumot találtunk. A hímvesszőn nagyfokú ödémát láttunk. A bal oldali here nem volt érzékeny, de felette a mellékherének megfelelően fájdalmas duzzanat volt tapintható. A bal oldali funiculus köteges tapintatú volt és az érzékenység a funiculus mentén az alhasban is tapintható volt. A has vizsgálata során kóros rezisztenciát, défense-t nem észleltünk.
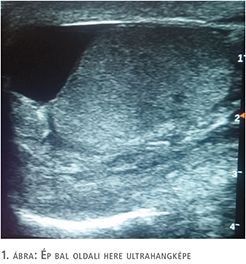
A herék, mellékherék Colour-Doppler-ultrahangvizsgálata ép szerkezetet igazolt jó keringéssel. A bal oldali here felett sűrű bennékű folyadékgyülem ábrázolódott a funiculus kiszélesedésével. Felmerült genitális gyulladás lehetősége, de a morfológiailag ép férfi adnexumok felvetették szekunder folyamat lehetőségét (1–3. ábra). Vizeletvizsgálat húgyúti infekcióra utaló eltérést nem igazolt. A beteg laborértékeiben súlyos alarmírozó eltéréseket nem láttunk, normál tartományban lévő fehérvérsejtszám mellett mérsékelten emelkedett C-reaktív proteinérték (39 mg/l) mutatkozott.
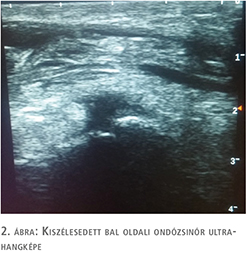
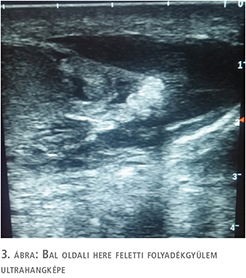
Radiológiai konzíliumot kértünk hasi ultrahangvizsgálat elvégzése céljából. A vizsgálat esetlegesen bizonytalan eredménye miatt hasi-kismedencei kontrasztanyagos CT-vizsgálat történt, amely felvetette a has bal oldalán a rekeszi felszíntől kiinduló, egy a legnagyobb axiális átmérőjében 87×30 mm-es, többrekeszes, a háti izmok felé propagációt mutató tályogrendszer lehetőségét, amely az inguinalis csatornán keresztül a scrotumig volt követhető. A pancreas morfológiája, Wirsung-vezeték tágulata és egyidejű kisméretű lépinfarktusok alapján kórokként hasnyálmirigy-eredet merült fel (4. ábra).
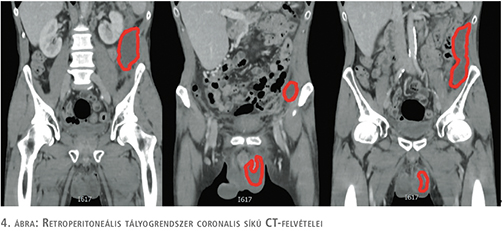
Sebészeti konzílium drenázst javasolt. Ultrahangvezérelt punkció során nyert minta amilázszintje 65 700 U/l értéket mutatott, ami megerősítette a pancreatogen eredetet. Bakteriológiai vizsgálat során aerob, illetve anaerob kórokozó nem tenyészett ki. Belgyógyászati áthelyezést követően konzervatív gyógyszeres terápia (intravénás ceftriaxon, majd piperacillin + tazobactam), laborkontroll (vérkép, máj-vesefunkció, gyulladásos paraméterek, vércukor, vérgáz) és a tályogrendszer szoros UH-obszervációja történt. A beteg néhány nap után otthonába bocsájtatott.
Megbeszélés
A nemzetközi szakirodalomban csupán néhány multidiszciplináris esetbemutatás (sebészeti, radiológiai, belgyógyászati és urológiai), illetve összefoglaló olvasható, amelyek a pancreas gyulladásos folyamatai és a herezacskó megnagyobbodásának kapcsolatáról szólnak. Az első esetet, amelyben egy hasnyálmirigytályog scrotalis érintettségét írták le, Steedman és munkatársai közölték 1967-ben (3). Mind az akut, a krónikus pancreatitis, illetve annak akut exacerbációja is járhat heretáji érintettséggel. Skouras és munkatársai által 2011-ben írt 25 esetet összefoglaló cikke alapján elmondható, hogy az érintett betegek túlnyomó többségénél a tartós alkoholfogyasztás szerepel a heveny hasnyálmirigy-gyulladás, vagy tályogos folyamat kiváltó okaként, de kialakult epekövesség miatt vagy pancreasműtétet követően is (4). Panaszként minden esetben szerepelt a hasi vagy többnyire a bal, ritkábban mindkét oldalon jelentkező heretáji fájdalom. Hányinger, hányás, hipotenzió, hímvessző-ödéma, az ondózsinór érzékenysége és scrotumerythema jelentkezhet még társuló tünetként. Az irodalomban találunk rossz prognózisú, az ondózsinór zsírnekrózisával járó nekrotizáló hasnyálmirigy-gyulladáshoz társuló, elülső hasfali tályogrendszerrel, phlegmonéval járó, hydrokelét okozó, illetve heretorziót utánzó eseteket is (5, 6, 7, 8, 9). A hasnyálmirigy anatómiai elhelyezkedéséből adódik, hogy a tályogképződéssel járó formáknál a retroperitoneumon keresztül lecsorgó váladék a herezacskó laza szöveteiben felszaporodhat és szekunder abscessus kialakulásához vezethet (10, 11, 12). Skouras beszámolt arról, hogy 10 betegnél exploratív laparotomia, herniotomia, illetve canalis inguinalis feltárás történt a primer heretáji tünetek alapján (4). Betegünknél a korábban kezelt és egyszer már retroperitonealis tályogképződés miatt operált krónikus hasnyálmirigy-gyulladás ismert anamnézise vetette fel a pancreatogen eredet gyanúját. Az akut scrotum egy urológiai sürgősségi állapot, aminek a hátterében állhat a here és függelékeinek csavarodása, trauma, orchido-epididymitis, heretályog, illetve kizáródott lágyéksérv is. A felsorolt esetek alapján elmondható, hogy a scrotalis duzzanat ritkán pancreatitis szövődményeként is kialakulhat, a retroperitoneumból induló, az inguinalis csatornán a herezacskót elérő gyulladásos eredetű tályog eredményeként (10, 13). Esetünkben a gondos preoperatív differenciáldiagnosztika tette lehetővé a szervkímélést, elkerülve a here feltárását, ami az elhúzódó sebgyógyulás miatt kedvezőtlenül befolyásolhatja a beteg életminőségét.
Következtetés
A retroperitonealis tályogot, tályogrendszert okozó pancreatitis ritka szövődménye lehet, a lecsorgó váladék okozta scrotalis duzzanat, fájdalom. Akut scrotum esetén, herefeltáró műtét elvégzése előtt az alapos differenciáldiagnosztika elengedhetetlen. Bizonytalanság esetén kiegészítő vizsgálatok (pl. hasi-kismedencei kontrasztanyagos CT-vizsgálat, scrotumpunkció során nyert minta laboratóriumi vizsgálata) pontosíthatják kórismézésünket. Esetünkben a korrekt diagnosztika herefeltáró műtét elvégzése nélkül tisztázta az állapot etiológiáját.
References
1. Rózsahegyi J, Szepesváry Zs, Sebestyén L, Laki A, Gyányi L. Akut scrotum. MEDICUS UNIVERSALIS 2007 DECEMBER; 40(5).
2. Günes¸, Mehmet Umul, Muammer Altok, Mehmet Akyüz, et al. Is it possible to distinguish testicular torsion from other causes of acute scrotum in patients who underwent scrotal exploration? A multi-center clinical trial Mustafa Cent European. J Urol 2015; 68: 252–256.
3. Steedman RA, Doering R, Carter R. Surgical aspects of pancreatic abscess. Surg Gynecol Obstet 1967; 125(4): 757–762.
4. Skouras C, Skouras T, Pai M, et al. Inguinoscrotal extension of a pancreatic collection: a rare complication of pancreatitis-case report and review of the literature. Updates Surg 2013; 65: 153. https://doi.org/10.1007/s13304-012-0138-3
5. Wolfson K, Sudakoff GS. Ultrasonography and color Doppler imaging of a scrotal phlegmon in acute necrotizingpancreatitis. J Ultrasound Med 1994 Jul; 13(7): 565–8. https://doi.org/10.7863/jum.1994.13.7.565
6. Kamble PM, Patil A, Jadhav S, Rao SA. Anterior abdominal wall abscess with epididymo-orchitis: an unusual presentation of acute pancreatitis. J Postgrad Med 2011 Oct-Dec; 57(4): 335–7. https://doi.org/10.4103/0022-3859.90088
7. Delamarre J, Descombes P, Grillot G, Deschepper B, Deramond H. Hydrocele of pancreatic origin. X-ray computed tomographic study of an intrascrotal collection in an acute outbreak of chronic pancreatitis. J Radiol 1988 Nov; 69(11): 689–90. https://doi.org/10.1175/1520-0477-69.6.689
8. Lin YL, Lin MT, Huang GT, Chang YL, Chang H, Wang SM, How SW. Acute pancreatitis masquerading as testicular torsion. Am J Emerg Med 1996 Nov; 14(7): 654–5. https://doi.org/10.1016/S0735-6757(96)90081-9
9. Chen W, Wang X, Zhang J. Left scrotal swelling caused by severe acute pancreatitis in a 38-year-old Chinese male. Int J Clin Exp Med 2015 May 15; 8(5): 8194–6.
10. Fukushi K, Tominaga K, Takenaka K, Takahashi F, Tsuchida K, Murohisa T, Iijima M, Irisawa A. Severe acute pancreatitis with inflammation extending to the scrotum Clin Case Rep 2019 Nov 6; 7(12): 2592–2593. https://doi.org/10.1002/ccr3.2529
11. Sutalo N, Dragisic V, Miskovic J, Soljic M. Scrotal abscess as the first symptom of fatal necrotizing pancreatitis. Saudi Med J 2019 Nov; 40(11): 1167–1170. https://doi.org/10.15537/smj.2019.11.24488
12. Moens L, Yengue Yengue P, Assenmacher C. Intrascrotal Collection in an Acute Pancreatitis: A Case Report and Review of the Literature. Case Rep Urol 2016; 2016: 7534781. Epub 2016 Nov 1. https://doi.org/10.1155/2016/7534781
13. Nikiforov I, Mansoora Q, Al-Khalisy H, Joseph S, Cheriyath P. Scrotal Swelling as a Complication of Hydrochlorothiazide Induced Acute Pancreatitis Case Rep. Gastrointest Med 2015; 2015: 265273. https://doi.org/10.1155/2015/265273