2020-3 —- Full Articles
Biofilm formation on the surfaces of ureter stents
DOI: 10.22591/magyurol.2020.3.szellt.91
Authors:
Széll Tamás dr.1, Köves Béla dr.2, Tenke Péter dr.2, Nyirády Péter dr.1
1Semmelweis Egyetem, Általános Orvostudományi Kar, Urológiai Klinika, Budapest (igazgató: Nyirády Péter dr.)
2Jahn Ferenc Dél-pesti Kórház, Urológiai Osztály, Budapest (osztályvezető: Tenke Péter dr.)
Summary
It belongs to the urological daily practice to insert ureter stent, in order to maintain the patency of the upper urinary tract. As every foreign body, which is inserted in the human organism, ureter stent is exposed to bacterial colonisation and thus biofilm formation as well. On the surface of ureter stent forming biofilm can induce sequence of complications which can cause the encrustation of stent at the end. The range of these complications can vary from irritative symptoms to life-threatening conditions which make necessary premature change of stent, causing risk and further health burden for the patients. For the purpose of preventing biofilm formation on the surface of ureter stent, extensive researches were conducted and were born some solutions which battle against biofilm with different efficiency. The fight against biofilm is not new-fangled but is timely nowadays as well. In our review we would like to present an overview about the biofilm formation on the surface of ureter stent and the possible treatment strategies against biofilm.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Az urológiai gyakorlatban mindennaposnak számít a felső húgyutak átjárhatóságának fenntartása érdekében felhelyezett húgyvezetékstent. Mint minden idegen test, amelyet emberi szervezetbe ültetünk, bakteriális kolonizációnak és ezáltal biofilmképződésnek van kitéve. A húgyvezetékstent felületén kialakuló biofilm további szövődmények lavináját indítja el, amely végső soron a stent elkövesedését okozza. Mindezen szövődmények skálája a kellemetlen tünetektől az egészen veszélyes állapotig terjedhet, amely a stent idő előtti cseréjét teszi szükségessé további kockázatot és megterhelést jelentve a páciensnek. A húgyvezetékstent felületén képződő biofilm megakadályozása végett kiterjedt vizsgálatok történtek és született számos megoldás, amelyek eltérő hatékonysággal veszik fel a küzdelmet. A biofilm elleni harc nem új keletű, azonban mind a mai napig időszerű. Összefoglaló közleményünkben a biofilmképződés folyamatáról és a húgyvezetékstent felületén végbemenő, biofilm elleni kezelés lehetséges stratégiájáról szeretnék áttekintést nyújtani.
Bevezetés
Felső húgyúti obstrukció esetén húgyvezetékstent felhelyezése áthidaló megoldásként szolgál a felső húgyút átjárhatóságának fenntartásában, ezáltal a vizelet akadálytalan elvezetésében. 1967 óta – mikor Zimskind és munkatársa közölték tapasztalataikat endoszkópos úton behelyezett tartós szilikon-húgyvezeték stenttel kapcsolatosan – az uréterstentek alkalmazása széleskörűen elterjedt a felső húgyutak átjárhatóságának minimál invazív módon való fenntartásában (1).
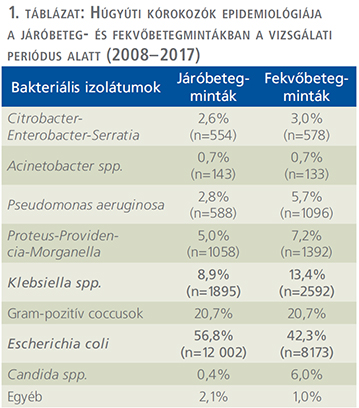
Jelentőségénél fogva a biofilmképződés intenzíven kutatott terület az urológiában (2). Húgyvezetékstent viselésekor biofilm képződik a stent belső és külső felületén egyaránt, amely végső esetben a stent részleges vagy teljes elzáródásához vezethet. Biofilm okozta szövődményként nemcsak a stent elzáródása és ennek következtében kialakuló ismételt felső húgyúti obstrukció róható fel, hanem alsó húgyúti tünetegyüttes (dysuria, késztetéses és sürgető vizelési inger, inkontinencia), véres vizelet, visszatérő húgyúti gyulladás is (3, 4). Biofilm által bevont stenttel összefüggésben jelentkező helyi tünetek gyógyszeresen ugyan csillapíthatóak (pl. fájdalomcsillapító, a1-receptor-gátló, antimuszkarin), de hatékonyságuk korlátozott (5, 6, 7, 8). Biofilmmel borított, elkövesedett és elzáródott uréterstent (1. ábra) idő előtti cseréjüket teszik szükségessé, amely a szövődményes esetek mellett az egészségügyi kiadások növekedését is maga után vonja (9). A stentek felületén végbemenő bakteriális kolonizációt, biofilmképződést szemünk előtt kell tartani, annak gyakorisága miatt. Egyes szerzők (Riedl és munkatársa) szoros összefüggést találtak a stent viselésének időtartama és a bakteriális kolonizáció között: tartós stentviselés esetén 100%-ban jelentkezik bakteriális kolonizáció (átlagos időtartam: 39,5 nap), míg átmeneti stentviselés esetén 69,3%-ban (átlagos időtartam: 11,2 nap) (10). Farsi és munkatársa által közölt adatok megerősítik az előző eredményeket: <1 hónap stentviselés esetén 58,6% a bakteriális kolonizáció aránya, >3 hónap stentviselés esetén ez az arány 75,1% (11).

A biofilmmel borított, elkövesedett uréterstentek kérdésével és annak megoldási lehetőségeivel számos vizsgálat foglalkozott már. Ígéretes koncepciók születtek, habár az urológiai gyakorlatban nem honosodtak meg széles körben. Nem tudnak minden tekintetben eleget tenni a velük szemben támasztott összes követelménynek, számottevő klinikai hatékonyságot nem tudtak felmutatni és előállítási költségük magas (7, 12, 13).
A biofilm vizsgálata, képződésének megakadályozása érdekében tett vizsgálatok és erőfeszítések nem újkeletűek, azonban mindezidáig nem sikerült egyetlen olyan megoldást találni, amely önmagában képes lenne az igen szerteágazó összetételű biofilmmel és kóroki tényezőkkel szemben hatékonyan fellépni.
Megbeszélés
Biofilm és képződésének folyamata
A biofilmképződés behatóan vizsgált terület az orvostudományban, mert jelentős szerepet játszik számos fertőzéssel járó kórállapotban. A biofilm nemcsak az urológiában játszik meghatározó szerepet, hanem más orvosi területen is, ahol idegen test emberi szövettel kerül kapcsolatba. Ezen okból adódóan fontos, hogy megértsük a biofilm hátterében álló okokat és kialakulásának folyamatát.
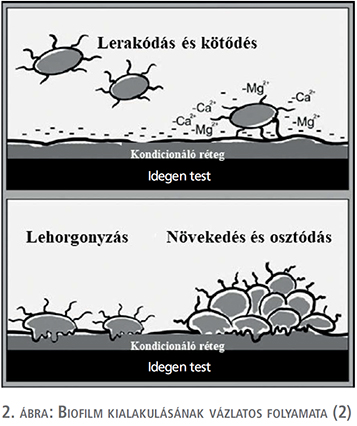
A biofilmet mikroorganizmusok és azok extracelluláris termékeinek felhalmozódásaként határozhatjuk meg, amelyek strukturált közösséget alkotnak valamely felületen (2, 14, 15). Korábbi vizsgálatok kimutatták, hogy néhány alapvető tényező meghatározza a baktériumok adhézióját az idegen testhez: idegen test felületének tulajdonságai, baktériumvirulencia faktorai és a mindenkori környezet, amely körülveszi az idegen testet és a baktériumokat (pl. vizelet-összetétel, pH, húgyúti kövesség) (2, 13, 15, 17). A teljes biofilmképződés egy lépésről lépésre zajló folyamat, amely során 3 fő állomást tudunk megjelölni (2. ábra). Az első lépés a kondicionáló vagy lehorgonyzó réteg kialakulása az idegen test felületén, amely a vizelet szervetlen alkotóelemeiből kerül ki: különböző glikoproteinek (pl. Tamm–Horsfall-fehérje/uromodulin), poliszacharidok, illetve a vizelet elektrolitjei. A kondicionáló réteget képző egyes alkotóelemek szerepe és jelentősége vitatott, ellentmondásos eredmények léteznek (13). A vizelet mellett a vér alkotóelemei is szerepet játszhatnak a kondicionáló film létrejöttében (albumin, hemoglobin, fibrinogén, hiszton, gyulladáshoz kapcsolódó fehérjék: a1-antitripszin, citokeratin, immunoglobulin láncok – Ig-kappa, Ig-nehézlánc G1). Húgyvezetékstent felhelyezése esetén is lehetséges, hogy a stent felülete vizelet mellett vérrel is kapcsolatba kerül az urothelium sérülése révén (13, 19, 20, 21). A kondicionáló rétegben részt vevő vizelet és vér elemei mellett az idegen test felületének tulajdonságai is meghatározóak (pl. elektromos töltöttség, hidrofób karakter) (13, 15, 17). A kondicionáló film képződése azonnal megindul amint az idegen test kapcsolatba kerül a vizelettel és a vérrel (13), baktériumok jelenléte nélkül is. Ezen lépcsőfok kiemelkedően fontos a biofilm keletkezésében, hiszen a baktériumok enélkül nem, illetve nem kellőképpen tudnak hozzákötődni közvetlenül az idegen test felületéhez (13, 15, 16). A kondicionáló film további jelentőségét az adja, hogy mivel szinte teljesen beborítja az idegen test felszínét, ezáltal megváltoztatja, elfedi annak eredeti felületi tulajdonságait. Ez a legfontosabb oka a különböző speciális bevonatú idegen testek alacsony hosszú távú klinikai hatékonyságának. A kondicionáló réteg elengedhetetlen a további biofilm-formálódáshoz, megteremti annak második lépcsőfokát, amely során a baktériumok lehorgonyoznak az idegen test felületéhez. A baktériumok kötődése a felülethez kezdetben visszafordítható folyamat, köszönhetően többek között elektrosztatikus erőknek, majd irreverzibilis kötés alakul ki a baktérium által termelt poliszacharidok révén, amelyek lehorgonyozzák őket a stent felszínéhez. Az utolsó, harmadik lépcsőfok a biofilm létrejöttében a baktériumok elszaporodása, amely strukturált hálózatot képez. Ezen folyamatok eredményeképpen alakul ki az a mikrokörnyezet (mikrokolónia), ahol az elszaporodó baktériumok és az általuk termelt molekulák változatos hálózatot képeznek, amelyet biofilmnek nevezünk. A mikrokolóniák adják a biofilm alapvető szerkezeti egységeit. A mikrokolóniát 10-15%-ban baktériumok alkotják, míg 85-90%-ban poliszacharidok építik fel, amely arány az adott baktérium függvénye (13, 15, 16, 17).
A biofilmbe ágyazott baktériumok eltérő tulajdonsággal bírnak azon baktériumoktól, amelyek szabadon sodródnak (planktonikus baktériumok). Különböző molekulákat termelnek, amelyekkel közvetlen környezetüket befolyásolják, illetve más baktériumok génexpresszióját módosítva távoli, illetve nem a biofilmbe ágyazott baktériumokra is kihatnak.
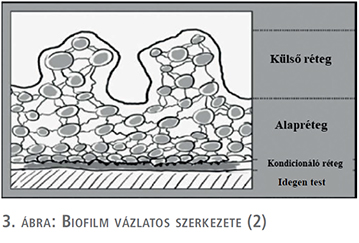
A biofilm jelenleg elfogadottnak tekinthető függőleges irányú rétegződése (3. ábra): közvetlenül az idegen test felületén helyezkedik a kondicionáló réteg, amelyet a lehorgonyzott baktériumokat tartalmazó alapréteg követi. Külső rétegben helyezkednek el azon baktériumok, amelyek elszakadva a biofilmtől szabadon sodródnak (2, 15, 16, 17).
A biofilm ellenállóképessége az antibiotikummal szemben
Annak érdekében, hogy jobban megértsük a biofilmmel szembeni antibakteriális küzdelem kihívásait, rá kell világítanunk a biofilm antibiotikummal szembeni fogékonyságára. Kézenfekvő megoldásnak kínálkozik az antibiotikum célzott alkalmazása, amelyet vizelettenyésztés alapján választunk meg. Az ellentmondás, illetve az antibiotikumkúra kudarca arra vezethető vissza, hogy a vizelettenyésztéssel a biofilmből kivált, szabadon sodródó baktériumokat lehetséges kimutatni. Mint tudjuk, ezen baktériumok eltérő tulajdonságokkal bírhatnak a biofilmbe lehorgonyzott társaikkal szemben. Kehinde és munkatársa vizsgálatára alapozva a vizelettenyésztés sok esetben negatív, ugyanakkor szövődményt okozó biofilmréteg helyezkedik el a húgyvezetékstent felületén (vizelettenyésztés szenzitivitása 40%-nak bizonyult) (22).
A vizelettenyésztés nem képes minden esetben a bakteriális kolonizációt, biofilmet képző baktériumot, és azok sokszínűségét kimutatni. Ezzel ellentétes megállapításra jutottak más kutatócsoportok a vizelettenyésztés szenzitivitását illetően: 93% (Al-Ghazo és munkatársa) (23) és 91% (Yeniyol és munkatársa) (24). Elfogadott álláspont, hogy az antibiotikumok nem tudják megakadályozni a biofilm képződését, legfeljebb lassítani tudja a folyamatot. A háttérben álló okokat az alábbiak szerint lehet összefoglalni (2, 15, 16, 17):
- „Extrinsic” ellenállóképesség: a biofilmet alkotó extracelluláris matrix megakadályozza az antibiotikumok bejutását, ezáltal védve a beágyazott baktériumot.
- „Intrinsic” ellenállóképesség: a biofilmbe horgonyzott baktériumok eltérő tulajdonsággal bírnak a szabadon keringő baktériumokhoz képest, amelyet génexpressziójuk módosításával érnek el. Ez az antibiotikumok célpontjainak megváltozását, így hatékonyságuk csökkenését eredményezi.
- A biofilmbe ágyazott baktériumok életciklusa, metabolikus folyamataik lassúbbak, ezáltal kevesebb támadáspontot kínálnak az antibiotikumoknak.
- Baktériumok közötti kommunikációs útvonalakon (pl. plazmid) keresztül a szabadon keringő és beágyazott baktériumok egymással akár antibiotikumrezisztenciát osztanak meg.
A fentebb felsorolt okok adhatnak magyarázatot azon figyelemre méltó adatra, miszerint a biofilmbe ágyazott baktériumok akár 1000-1500-szor magasabb antibiotikumkoncentrációt is képesek túlélni szemben a szabadon keringő baktériumokkal. Eddigi vizsgálatokra alapozva az antibiotikumok a szabadon keringő vagy nyálkahártya-felületen megtapadt baktériumok ellen hatékonyan képesek felvenni a küzdelmet, de idegen test felületén biofilmbe ágyazott baktériumokkal szemben hatástalanok (2, 15, 16, 17). Ezen okból adódóan antibiotikumok helyett más stratégiát kell választanunk, ha eredményesen szeretnénk a biofilmkézpződéssel szemben fellépni.
Biofilm elleni stratégia
Ezen stratégiák más megközelítéssel igyekeznek – a stent felületén kialakuló – a biofilm okozta szövődményeket csökkenteni, mint az antibiotikumok.
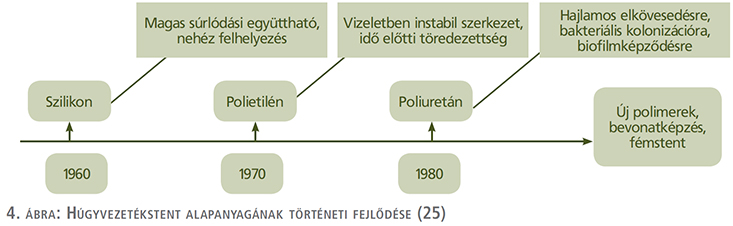
Történetileg elsőként a szilikon szolgált a húgyvezetékstent alapanyagául (4. ábra). Sok tekintetben a szilikon, mint első generációs stentösszetevő számít az aranyközépútnak. Felületének homogenitása révén bakteriális kolonizációnak és kőképződésnek kevésbé kitett összehasonlítva egyéb polimer anyaggal, illetve biokompatibilitása az urotheliummal szintén átlagon felüli, azonban magas súrlódási tényezője nem tette hosszútávon sikeressé húgyvezetékstent alapanyagaként (12, 25). A szilikont a polietilén váltotta a sorban, amely viszont tartósság tekintetében nem váltotta be a hozzá fűzött reményeket.
A szilikon és polietilén után a poliuretán mutatkozott be, mint a húgyvezetékstent alapanyaga és napjainkig is a legelterjedtebben alkalmazott összetevő (25).
Előnyei mellett – akárcsak más anyag esetén is – a poliuretán is rendelkezik néhány kedvezőtlen tulajdonsággal. A szilikonhoz képest nagyobb eséllyel nyújt kedvező felületet biofilmképződésre, ezáltal a stent elkövesedését okozva.
Minden bizonnyal utópikus elképzelés lenne azt gondolni, hogy létezik egy olyan anyag, amely minden tulajdonságával kielégíti a stentekkel kapcsolatos összes elvárásunkat (12, 17).
Tekintettel erre, alapvetően kettő megoldás kínálkozik, hogy a stent alapanyagaként legelterjedtebben felhasznált poliuretán tulajdonságain javítsunk.
Az egyik lehetséges megközelítés a poliuretán kémiai összetételének megváltoztatása különböző adalékanyag hozzáadásával. A másik megoldás a poliuretán stent felületén bevonat képzése. Az alábbiakban a bevonatképzést részletezzük.
Bevonatképzés
Ezen módszer a poliuretán kémiai összetételének megőrzése, viszont felületének különböző anyaggal való bevonása. Ezen módszert két csoportra oszthatjuk fel hatásmechanizmusok alapján: antimikrobiális anyagot bocsát ki a bevonat vagy önmagában antimikrobiális tulajdonsággal bír (12, 25). A bevonatképzés mind a múltban, mind a jelenben széles körben vizsgált terület. Számos tanulmány foglalkozott in vitro és in vivo kísérletek formájában a különböző bevonatot képző anyagokkal, úgymint (a teljesség igénye nélkül): heparin, hialuronsav, polivinilpirrolidon, ezüstion, nitrogén-oxid, kvaterner alumíniumsó, hidrogél, triclosan, nanoméretű gyémántszerkezetű szén, antibiotikumkibocsátó bevonat. A bíztató in vitro és in vivo eredmények ellenére ezen bevonattal rendelkező stentek nem terjedtek el a klinikai gyakorlatban széles körben, habár néhányuk elérhető a kereskedelmi forgalomban (12, 25, 26). A különböző antimikrobiális anyagot (pl. antibiotikum) kibocsátó stentbevonatok egy adott időintervallumon belül rendelkeznek előnnyel, viszont az adott időszakon kívül elveszítik antimikrobiális képességüket (az antibiotikumrezisztenciáról nem is szólva) (26). Ennek alapján hatékonyabb megoldásnak ígérkezik azon módszer, amikor a stentet bevonó anyag önmagában rendelkezik antimikrobiális aktivitással. Mint azt korábban említettük, a különböző bevonatok alacsony hosszú távú hatékonyságáért a kondicionáló réteg a felelős, amely elfedi a bevonatok felületmódosító tulajdonságait, továbbá a baktériumoknak az idegen test felszínéhez való hatékony kötődésében is elengedhetetlen.
A biofilm és szövődményei napjainkban is gondot okoznak, amely mozgatóerőként hat újabb vizsgálatok irányába. Számos – korábban már említett – in vitro és in vivo vizsgált bevonatképző anyag mellett akadnak újfent törekvések egy új, biofilmképződést mérséklő anyag fejlesztése érdekében.
Pandiyarajan és munkatársa, illetve Baghai és munkatársa bebizonyították, hogy bizonyos polimer anyagok (poli-N-alkil-akrilamid) képesek számottevő mértékben taszítani a humán fehérjék megtapadását a felületén. A szerzők szintén kimutatták, hogy ezen anyag nem csupán humán fehérjék, de humán sejtek felszínhez való kötődését is képes jelentős mértékben megakadályozni (27, 28). Ezen polimer anyagok közül a PDMAA (poli-N,N-dimetil-akrilamid) bizonyult a legígéretesebbnek. PDMAA vizes környezetben nagyfokú duzzadási képességgel bír, ezáltal nem mutat erős kölcsönhatást hidrofób kötések révén a fehérjékkel. A fehérjék, amelyek ezen a polimer anyagon igyekeznek megtapadni, taszító hatással szembesülnek molekulaméretük vagy termodinamikai hatás által (28). Pandiyarajan és munkatársa, illetve Baghai és munkatársa megvizsgálták a PDMAA taszító hatását különböző vérben megtalálható fehérjékkel (fibrinogén, fibronectin, von Willebrand-faktor) és a vér alakos elemeivel (humán és egér fibroblast, humán endothelsejt és vérlemezke) szemben. Az eredményeik előremutatóak, a PDMAA taszító hatását sikerült igazolniuk minden a vizsgálatban tesztelt fehérje és sejt ellen (27, 28). PDMAA ellenállóképességének vizsgálta során a leggyakoribb uropatogén baktériumokkal szemben történtek in vitro vizsgálatok, annak érdekében, hogy PDMAA biofilmképződés csökkentő hatása górcső alá kerüljön (29). Az eredmények megmutatták, hogy E. coli baktériumok szignifikáns mértékben kevesebb számban tudnak a PDMAA-val beborított felülethez kötődni. K. pneumonia és E. faecalis esetén nem mutatkozott szignifikáns különbség a PDMAA-val bevont felületeken, bár tendenciáját tekintve kevesebb baktérium kötődött a felületéhez. Ezen eredmények nincsenek teljes mértékben összhangban a korábbi munkacsoportok eredményeivel (27, 28). Magyarázatként szolgálhat, hogy az uropatogén baktériumok teljességgel eltérő mikroorganizmusok szemben a humán fiziológiás sejtekkel, amelyeket korábban vizsgáltak. A baktériumok számos virulenciafaktorral rendelkeznek, amelyek számottevően befolyásolják a viselkedésüket és kötődési képességüket idegen testek felületén (30–35).
Következtetés
A húgyvezetékstent felületén végbemenő biofilmképződés részletes folyamatának megismerése szükséges annak érdekében, hogy az általa okozott szövődmények megelőzésére hatékony támadáspontot találjunk. Keletkezésének az in vivo körülményekhez legjobban illeszkedő in vitro modell kidolgozása és egységes alkalmazásával juthatnánk mindehhez közelebb. Nem szabad megfeledkeznünk azonban az in vivo vizsgálatok jelentőségéről sem. Számos kísérlet és kezelési lehetőség áll jelenleg is rendelkezésünkre a stent felszínén lévő biofilmképződés csökkentésére, megakadályozására. Ezek közül sok kereskedelmi forgalomban is elérhető, azonban ezidáig egyik sem volt képes klinikai vizsgálatokban egyetemes sikert elérni. Ennek oka abban rejlik, hogy az adott körülmények (pl. vizelet összetétele, különböző baktériumok és azok különböző virulenciafaktorai) igen szerteágazóak. A biofilm kialakulásának megakadályozása érdekében a mikrobiológiai tényezők mellett a stent és környezetének (vizelet, felső húgyutak hámborítása, stentelt húgyvezetékben lévő áramlási viszonyok) kapcsolatát is figyelembe kell venni. Ezen sokszínűség nem teszi lehetővé, hogy csupán egy anyag, illetve egy kezelési stratégia önmagában sikeres legyen. Mint az orvostudomány sok területén, a biofilm elleni védekezésben is az egyénre szabott, az adott páciensnél fennálló kóroki tényezők figyelembevételével megválasztott stent adhatna legjobb eredményt.
References
1. Zimskind PD, Fetter TR, Wilkerson JL. Clinical use of long-term indwelling silicone rubber ureteral splints inserted cystoscopically. J Urol 1967 May; 97(5): 840–4.
2. Tenke P, Riedl CR, Jones GL, et al. Bacterial biofilm formation on urologic devices and heparin coating as preventive strategy. Int J Antimicrob Agents 2004 Mar; 23(Suppl 1): S67–74.
doi: https://doi.org/10.1016/j.ijantimicag.2003.12.007
3. Joshi HB, Stainthorpe A, Keeley FX Jr, et al. Indwelling ureteral stents: evaluation of quality of life to aid outcome analysis. J Endourol 2001 Mar; 15(2): 151–4 doi: https://doi.org/10.1089/089277901750134421
4. Leibovici D, Cooper A, Lindner A, et al. Ureteral stents: morbidity and impact on quality of life. Isr Med Assoc J 2005 Aug; 7(8): 491–4.
5. Lamb AD, Vowler SL, Johnston R, et al. Meta-analysis showing the beneficial effect of a-blockers on ureteric stent discomfort. BJU Int 2011 Dec; 108(11): 1894–902. doi: https://doi.org/10.1111/j.1464-410X.2011.10170.x
6. Park SC, Jung SW, Lee JW, et al. The effects of tolterodine extended release and alfuzosin for the treatment of double-j stent-related symptoms. J Endourol 2009 Nov; 23(11): 1913–7.
doi: https://doi.org/10.1089/end.2009.0173
7. Betschart P, Zumstein V, Piller A, et al. Prevention and treatment of symptoms associated with indwelling ureteral stents: A systematic review. Int J Urol 2017 Apr; 24(4): 250–259. doi: https://doi.org/10.1111/iju.13311
8. Beddingfield R, Pedro RN, Hinck B, et al. Alfuzosin to relieve ureteral stent discomfort: a prospective, randomized, placebo controlled study. J Urol 2009 Jan; 181(1): 170–6. doi: https://doi.org/10.1016/j.juro.2008.09.026
9. Staubli SE, Mordasini L, Engeler DS, et al. Economic Aspects of Morbidity Caused by Ureteral Stents. Urol Int 2016; 97(1): 91–7.
doi: https://doi.org/10.1159/000443379
10. Riedl CR, Plas E, Hübner WA, et al. Bacterial colonization of ureteral stents. Eur Urol 1999; 36(1): 53–9. doi: https://doi.org/10.1159/000019927
11. Farsi HM, Mosli HA, Al-Zemaity MF, et al. Bacteriuria and colonization of double-pigtail ureteral stents: long-term experience with 237 patients. J Endourol 1995 Dec; 9(6): 469–72. doi: https://doi.org/10.1089/end.1995.9.469
12. Liatsikos E, Kallidonis P, Stolzenburg JU, et al. Ureteral stents: past, present and future. Expert Rev Med Devices 2009 May; 6(3): 313–24.
doi: https://doi.org/10.1586/erd.09.5
13. Zumstein V, Betschart P, Albrich WC, et al. Biofilm formation on ureteral stents – Incidence, clinical impact, and prevention. Swiss Med Wkly 2017 Feb 6; 147: w14408. doi: https://doi.org/10.4414/smw.2017.14408
14. Costerton JW, Cheng KJ, Geesey GG, et al. Bacterial biofilms in nature and disease. Annu Rev Microbiol 1987; 41: 435–64.
doi: https://doi.org/10.1146/annurev.mi.41.100187.002251
15. Choong S, Whitfield H. Biofilms and their role in infections in urology. BJU Int 2000 Nov; 86(8): 935–41.
doi: https://doi.org/10.1046/j.1464-410x.2000.00949.x
16. Tenke P, Köves B, Nagy K, et al. Update on biofilm infections in the urinary tract. World J Urol 2012 Feb; 30(1): 51–7.
doi: https://doi.org/10.1007/s00345-011-0689-9
17. Tenke P, Kovacs B, Jäckel M, et al. The role of biofilm infection in urology. World J Urol 2006 Feb; 24(1): 13–20.
doi: https://doi.org/10.1007/s00345-005-0050-2
18. Rosman BM, Barbosa JA, Passerotti CP, et al. Evaluation of a novel gel-based ureteral stent with biofilm-resistant characteristics. Int Urol Nephrol 2014 Jun; 46(6): 1053–8. doi: https://doi.org/10.1007/s11255-013-0636-3
19. Elwood CN, Lo J, Chou E, et al. Understanding urinary conditioning film components on ureteral stents: profiling protein components and evaluating their role in bacterial colonization. Expert Rev Med Devices 2009 May; 6(3): 313–24. doi: https://doi.org/10.1080/08927014.2013.829049
20. Canales BK, Higgins L, Markowski T, et al. Presence of five conditioning film proteins are highly associated with early stent encrustation. J Endourol 2009 Sep; 23(9): 1437–42.
doi: https://doi.org/10.1089/end.2009.0389
21. Santin M, Motta A, Denyer SP, et al. Effect of the urine conditioning film on ureteral stent encrustation and characterization of its protein composition. Biomaterials 1999 Jul; 20(13): 1245–51.
doi: https://doi.org/10.1016/S0142-9612(99)00026-5
22. Kehinde EO, Rotimi VO, Al-Hunayan A, et al. Bacteriology of urinary tract infection associated with indwelling J ureteral stents. J Endourol 2004 Nov; 18(9): 891–6. doi: https://doi.org/10.1089/end.2004.18.891
23. Al-Ghazo MA, Ghalayini IF, Matani YS, et al. The risk of bacteriuria and ureteric stent colonization in immune-compromised patients with double J stent insertion. Int Urol Nephrol 2010 Jun; 42(2): 343–7.
doi: https://doi.org/10.1007/s11255-009-9607-0
24. Yeniyol CO, Tuna A, Yener H, et al. Bacterial colonization of double J stents and bacteriuria frequency. Int Urol Nephrol 2002; 34(2): 199–202. doi: https://doi.org/10.1023/A: 1023285422278
25. Venkatesan N, Shroff S, Jayachandran K, et al. Polymers as ureteral stents. J Endourol 2010 Feb; 24(2): 191–8.
doi: https://doi.org/10.1089/end.2009.0516
26. Gultekinoglu M, Tunc Sarisozen Y, Erdogdu C, et al. Designing of dynamic polyethyleneimine (PEI) brushes on polyurethane (PU) ureteral stents to prevent infections. Acta Biomater 2015 Jul; 21: 44–54.
doi: https://doi.org/10.1016/j.actbio.2015.03.037
27. Pandiyarajan CK, Prucker O, Zieger B, et al. Influence of the molecular structure of surface-attached poly(N-alkyl acrylamide) coatings on the interaction of surfaces with proteins, cells and blood platelets. Macromol Biosci 2013 Jul; 13(7): 873–84. doi: https://doi.org/10.1002/mabi.201200445
28. Baghai M, Tamura N, Beyersdorf F, et al. Platelet repellent properties of hydrogel coatings on polyurethane-coated glass surfaces. ASAIO J 2014 Sep-Oct; 60(5): 587–93.
doi: https://doi.org/10.1097/MAT.0000000000000118
29. Szell T, Dressler FF, Goelz H, et al. In Vitro Effects of a Novel Coating Agent on Bacterial Biofilm Development on Ureteral Stents. J Endourol 2019 Mar; 33(3): 225–231. doi: https://doi.org/10.1089/end.2018.0616
30. Ong CL, Ulett GC, Mabbett AN, et al. Identification of type 3 fimbriae in uropathogenic Escherichia coli reveals a role in biofilm formation. J Bacteriol 2008 Feb; 190(3): 1054–63.
doi: https://doi.org/10.1128/JB.01523-07
31. Kostakioti M, Hadjifrangiskou M, Hultgren SJ. Bacterial biofilms: development, dispersal, and therapeutic strategies in the dawn of the postantibiotic era. Cold Spring Harb Perspect Med 2013 Apr 1; 3(4): a010306. doi: https://doi.org/10.1101/cshperspect.a010306
32. Clegg S, Murphy CN. Epidemiology and Virulence of Klebsiella pneumoniae. Microbiol Spectr 2016 Feb; 4(1).
doi: https://doi.org/10.1128/microbiolspec.UTI-0005-2012
33. Stahlhut SG, Struve C, Krogfelt KA, et al. Biofilm formation of Klebsiella pneumoniae on urethral catheters requires either type 1 or type 3 fimbriae. FEMS Immunol Med Microbiol 2012 Jul; 65(2): 350–9.
doi: https://doi.org/10.1111/j.1574-695X.2012.00965.x
34. Guiton PS, Hung CS, Hancock LE, et al. Enterococcal biofilm formation and virulence in an optimized murine model of foreign body-associated urinary tract infections. Infect Immun 2010 Oct; 78(10): 4166–75. doi: https://doi.org/10.1128/IAI.00711-10
35. Mohamed JA, Huang DB. Biofilm formation by enterococci. J Med Microbiol 2007 Dec; 56(Pt 12): 1581–8.
doi: https://doi.org/10.1099/jmm.0.47331-0
Analysis of resistance trends in urinary Escherichia coli and Klebsiella spp. isolates using known and novel indicators of clinical relevance: a 10-year retrospective study
DOI: 10.22591/magyurol.2020.3.berczics
Authors:
Gajdács Márió dr.1, Ábrók Marianna2, Lázár Andrea dr.2, Burián Katalin dr.2,3
1Szegedi Tudományegyetem Gyógyszerésztudományi Kar, Gyógyszerhatástani és Biofarmáciai Intézet, Szeged (intézetvezető: Zupkó István dr.)
2Szegedi Tudományegyetem Általános Orvostudományi Kar, Klinikai Mikrobiológiai Diagnosztikai Intézet, Szeged (intézetvezető: Burián Katalin dr.)
3Szegedi Tudományegyetem Általános Orvostudományi Kar, Orvosi Mikrobiológiai és Immunbiológiai Intézet, Szeged (intézetvezető: Burián Katalin)
Summary
Introduction: The emergence and spread of antibiotic-resistant bacterial pathogens worldwide is one of the most important public health problems. A number of new bacterial resistance criteria have been published in recent years to improve the correlation between resistance data and clinical outcome.
Materials and methods: This study retrospectively collected microbiological and resistance data for the period of January 1, 2008-December 31, 2008 (10 years) at the Institute of Clinical Microbiology, University of Szeged. During data analysis, bacterial isolates were classified into various resistance categories (wild type, UDR, MDR, XDR, PDR, and DTR and mDTR). Results: Gram-negative bacteria were isolated from n=16,240 (76.8%) of outpatient samples and n=13,386 (69.3%) of inpatient samples during the 10-year study period (p=0.038). For E. coli isolates, 34.1–39.4% of the strains in total were wild-type, while for Klebsiella spp. strains, this ratio was 40.4–45.7%. The prevalence of UDR isolates for E. coli isolates was lowest in 2013 and highest in 2011, while for Klebsiella spp., this was the lowest in 2017 and the highest in 2011/2013.
Conclusions: In addition to its clinical-centered philosophy, the use of DTR (and its modifications as detailed in this study) in bedside and clinical practice may have significant benefits in terms of clinical data.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Bevezetés: Az antibiotikumokkal szemben rezisztens bakteriális kórokozók megjelenése és terjedése világszerte egyike a legfontosabb népegészségügyi problémáknak. Az utóbbi években számos új bakteriális rezisztenciakritérium került közzétételre, a rezisztenciaadatok és a klinikai kimenetel közötti korreláció javításának céljából.
Anyag és módszer: Jelen tanulmányban mikrobiológiai- és rezisztenciaadatok retrospektív gyűjtése történt, a 2008. 01. 01 – 2017. 12. 31. közötti (10 éves) periódusra vonatkozóan az SZTE ÁOK Klinikai Mikrobiológiai Diagnosztikai Intézetében. Az adatok elemzése során a bakteriális izolátumokat különféle rezisztenciakategóriákba soroltuk (vad típusú, UDR, MDR, XDR, PDR, illetve DTR és mDTR).
Eredmények: A tízéves vizsgálati periódus alatt n=16 240 (76,8%) járóbetegmintából és n=13 386 (69,3%) fekvőbetegmintából került izolálásra Gram-negatív baktérium (p=0,038). Az E. coli izolátumokra vonatkozóan a vad típusú törzsek 34,1-39,4%-át tették ki az összes izolátumnak, míg a
Klebsiella spp. törzsek esetén 40,4-45,7%-ot. Az UDR-izolátumok prevalenciája az E. coli izolátumokra vonatkozóan 2013-ban volt a legalacsonyabb és 2011-ben a legmagasabb, a Klebsiella spp. esetében 2017-ben volt a legalacsonyabb és 2011/2013-ban a legmagasabb.
Következtetés: A klinikumközpontú filozófiáján túlmenően, a DTR (és annak a jelen ebben a tanulmányban részletezett módosításai) a betegágy mellett és a klinikai gyakorlatban történő alkalmazása jelentős előnyökkel járhat a klinikai adatokkal összefüggésben.
Bevezetés
Az antibiotikumokkal szemben rezisztens bakteriális kórokozók megjelenése és terjedése világszerte egyike a legfontosabb népegészségügyi problémáknak (1, 2). Az antibiotikumrezisztens kórokozók által okozott fertőzések következtében az érintett betegek életminősége (QoL) csökken, az egészségügyi infrastruktúrát terhelő költségek megnövekednek, valamint drága és/vagy kedvezőtlen toxicitási profilú antibiotikumok használatát teszik szükségességé, amelyekkel összefüggésben megnövekedett halálozási arányt figyeltek meg (pl. kolisztin) (3, 4). A helyzetet tovább súlyosbítja, hogy az antibiotikumok felfedezésének és az új szerek kifejlesztésének területén a gyógyszerfejlesztő cégeknek nincsen megfelelő pénzügyi motivációjuk, mivel a beruházás megtérülése csak kevésszer valósul meg, szemben a krónikus, nem fertőző betegségek vagy daganatok kezelésére szolgáló új szerekkel (5). Bár az utóbbi években az ún. köz- és magánszféra partnerkapcsolatok (public-private partnerships; ideértve az Amerikai Gyógyszerügynökség 10×20 Initiative c. kezdeményezését, illetve az Európai Gyógyszerügynökség New Drugs for Bad Bugs [ND4BB] programját) igyekszenek fenntartani az antimikrobiális szerek fejlesztéséhez vonzó pénzügyi/beruházási területet, az újonnan forgalomba hozott antibiotikumok száma továbbra is messze van az antibiotikumok felfedezésének aranykorához (1960–1980) képest (6). Ha a halálozási mutatóikat és a gazdasági hatásaikat vesszük alapul, akkor az ún. „ESKAPE” kórokozók, nevezetesen E: Enterococcus faecium, S: Staphylococcus aureus vagy újonnan Stenotrophomonas maltophilia, K: Klebsiella pneumoniae vagy újabban C: Clostridioides difficile, A: Acinetobacter baumannii, P: Pseudomonas aeruginosa, E: Enterobacter spp., vagy nemrégiben Enterobacteriaceae) jelentik a legtöbb kihívást a klinikumban (7). Számos rezisztenciamechanizmust írtak le különféle baktériumfajokban. Ezeknek a rezisztenciamechanizmusoknak egy része plazmidközvetített, amely lehetővé teszi azok széles körű terjesztését és a kórházi járványok kialakulását (különösen a Gram-negatív baktériumok esetében; pl. a kiterjedt spektrumú b-laktamáz- vagy a karbapenemáz gének transzmissziója), míg néhány baktérium genetikailag („veleszületett”) rezisztenciával rendelkezik, amely a faj valamennyi tagjára jellemző (pl. a Proteus, Providencia és Morganella fajok tetraciklinekkel, a nitrofurantoinnal és a polymixin B-vel szembeni rezisztenciája) (8, 9). Az antibiotikumérzékenységi vizsgálatok kiválasztása és értelmezése, illetve a megfelelő terápia kiválasztása érdekében mind a klinikusoknak, mind a klinikai mikrobiológusoknak tisztában kell lenniük a különböző fajok genetikailag kódolt rezisztenciájával, illetve a szerzett rezisztencia helyi szintjével (10). Számos módszer került kifejlesztésre abból a célból, hogy a baktériumokat rezisztenciakategóriákba sorolják; ezekben a különbségek miatt osztályozások, azonban ezekben az osztályozásokban jelentős következetlenségek fordultak elő. Az első globális konszenzuskritériumokat az Egyesült Államok Járványvédelmi Központja (CDC) és az Európai Betegségmegelőzési és Járványvédelmi Központja (ECDC) határozta meg, nevezetesen a multidrog-rezisztencia (MDR), a kiterjedt gyógyszer-rezisztencia (XDR) és a pándrog-rezisztencia (PDR) definiálásával (11). Ezek a rezisztenciakategóriák hasznosak a járványügyi epidemiológiai adatok jelentésekor a rezisztenciahelyzetének egy adott földrajzi régióban történő értékeléséhez. Ez a kategorizálás azonban nem veszi figyelembe az egyes antibiotikumok klinikai hatékonyságát és a farmakológiai különbségeket; mindazonáltal, ezek a tulajdonságok jelentősen megváltoztathatják a fertőzések során a klinikai kimenetelt (12). Ezt számos publikáció igazolta már, amelyekben arra a következtetésre jutottak, hogy az MDR-kórokozók (a terápiához használt gyógyszerek jellemzőinek figyelembevétele nélkül) önmagában nem hozhatók összefüggésbe megnövekedett halálozási aránnyal, míg kifejezett toxicitással járó antibiotikumok használata (például a kolisztin-monoterápiában vagy kombinált terápiában) megemelkedett mortalitás kockázatát hordozza (13, 14). Az utóbbi években számos új baktériumrezisztencia-kritérium került közzétételre, a rezisztenciaadatok és a klinikai kimenetel közötti korreláció javításának céljából: ilyenek a multiple antibiotic resistance (MAR) index (15, 16), szokásos gyógyszer-rezisztencia (UDR; meghatározása McDonell és munkatársai nevéhez fűződik) (17) és a nehezen kezelhető rezisztencia (DTR; meghatározása Kadri és munkatársai nevéhez fűződik) (18).
A humán orvoslás szempontjából a húgyúti fertőzések (UTI) a második leggyakoribb infekciók a fejlett országokban, így fontos morbiditási tényezőknek tekinthetők mind a járóbetegek, mind a kórházban ápolt betegek tekintetében (19, 20). Az UTI-k ezen kívül jelentős gazdasági terhet jelentenek az egészségügyi intézmények számára, beleértve gyógyszeres terápiájuk és a kórházi ellátás költségeit és a kezelésük miatt elveszített munkanapokat; az UTI-k által okozott gazdasági veszteségbecslések szerint körülbelül három milliárd dollár csak az Egyesült Államokban (21). Az UTI leggyakoribb okai a mind a közösségben szerzett, mind a nozokomiális infekciókban az Enterobacterales rend tagjai (az E. colit tekintik a legfontosabb etiológiai ágensnek, azonban a rend többi tagjának relevanciáját nem szabad alábecsülni) (22). Az UTI-k epidemiológiáját lokálisan (Szent-Györgyi Albert Klinikai Központ; Szeged, Magyarország) korábban már széleskörűen jellemeztük (23). A jelen tanulmány célja az E. coli- és Klebsiella fajok rezisztenciaszintjeinek vizsgálata lokálisan, egy 10 éves vizsgálati periódus alatt (2008–2017), amelyben a baktériumok rezisztenciáját meglévő és új kritériumok alapján osztályozzuk (amelyeket korábban még nem alkalmaztak az UTI-ban).
Anyag és módszer
Jelen tanulmányban mikrobiológiai- és rezisztenciaadatok retrospektív gyűjtése történt, a 2008. 01. 01 – 2017. 12. 31. közötti (10 éves) periódusra vonatkozóan az SZTE ÁOK Klinikai Mikrobiológiai Diagnosztikai Intézetében. A felhasznált adatok gyűjtését az intézet laboratóriumi információs rendszerének nyilvántartásában (LIS) végeztük, a tanulmány szempontjából releváns, Gram-negatív kórokozókra pozitív vizeletmintákra vonatkozóan. Azok a minták, kerültek bevonásra az elemzésbe, amelyekben a bacteriuria klinikailag szignifikánsnak volt tekinthető (>105 CFU/ml) és amelyek pozitívak voltak nitrit- és leukocitaészteráz-tesztekre (24). Betegenként csak az első izolátumot vontuk be az elemzésbe; azonban, az izolátumok eltérő antibiotikumérzékenységi mintázatot mutató, ugyanabból a betegből származó baktériumtörzseket egyedi izolátumoknak tekintettük.
A centrifugálatlan vizeletmintákból tíz mikrolitert oltottunk ki UriSelect kromogén agar (Bio-Rad, Berkeley, CA, USA), véres agar (bioMérieux, Marcy-l’Étoile, Lyon, Franciaország) és eozin-metilénkék agar (EMB; Bio-Rad, Berkeley, CA, USA) táptalajokra kalibrált kaccsal, a gyártó utasításai szerint; a lemezeket 37 °C-on inkubáltuk 24–48 órán át, aerob módon (25). A vizsgálati időszak első felében (2008–2012) preszumptív, biokémiai reakciókon alapuló módszerek és a VITEK 2 Compact ID/AST (bioMérieux, Marcy-l’Étoile, Franciaország) került alkalmazásra a baktériumok identifikálásra. 2013-tól bevezetésre került a mátrix-asszisztált lézerdeszorpció/-ionizáció repülési idő mérésén alapuló tömegspektrometriás (MALDI-TOF MS) módszer az intézet bakteriológiai laboratóriumában. A tömegspektrometriás méréseket a microFlex LT MALDI Biotyper segítségével végeztük (Bruker Daltonics, Bréma, Németország), a MALDI Biotyper RTC 3.1 szoftver használatával.
A releváns Gram-negatív baktériumok antibiotikumérzékenységi vizsgálatát az európai módszertani ajánlásoknak és szabványoknak (EUCAST 9.0-ás verzióig) megfelelően végeztük korongdiffúziós módszerrel (Liofilchem, Abruzzo, Olaszország) és E-tesztekkel (fosfomycinérzékenységi vizsgálat; Liofilchem, Abruzzo, Olaszország) a Müller–Hinton-agar lemezeken, illetve mikroleves-hígításos módszerrel (kolisztin esetén érzékenységi vizsgálat; MERLIN Diagnostik) végeztük (24). Az ellentmondásos eredmények ellenőrzése érdekében a VITEK 2 Compact ID/AST (bioMérieux, Marcy-l’Étoile, Franciaország) automatát használtuk. Az érzékenységi vizsgálat tartalmazta az E. coli és Klebsiella spp. baktériumokra vonatkozó releváns antibiotikumot, hogy lehetővé tegyék azok osztályozását a rezisztenciakategóriák szerint; ha genetikailag kódolt rezisztencia állt fenn, akkor a szóban forgó antibiotikumot kizártuk az elemzésből. Az alábbi kontrolltörzseket használtuk (QC): S. aureus ATCC 29213, E. faecalis ATCC 29212, P. mirabilis ATCC 35659, E. coli ATCC 25922, P. aeruginosa ATCC 27853, A. baumannii ATCC 19606 és Stenotrophomonas maltophilia ATCC 13637.
Az adatok elemzése során a bakteriális izolátumokat különféle rezisztenciakategóriákba soroltuk. Az izolátumokat akkor tekintették vad típusúnak/érzékenynek, ha érzékenyek az összes vizsgált antibiotikumra. Az izolátumok a szokásos rezisztencia- (UDR; usual drug resistance, McDonell és munkatársai) (17) kategóriába kerültek, ha legalább egy vizsgált antibiotikumra rezisztensnek bizonyultak. Az izolátumok osztályozása az MDR (rezisztencia legalább 1 antibiotikummal szemben legalább 3 antibiotikumcsoportban), XDR (csak két antibiotikumcsoporttal szemben megtartott az érzékenység) és PDR (rezisztens az összes ágensre) a CDC/ECDC-ajánlásokon alapult (11). A nehezen kezelhető rezisztenciát (DTR; difficult-to-treat resistance) Kadri és munkatársai (18) meghatározása szerint alkalmaztuk: ha egy izolátum karbapenemekkel (imipenem, meropenem és ertapenem), kiterjesztett spektrumú cefalosporinokkal és fluorokinolonokkal (ciprofloxacin, levofloxacin és moxifloxacin) szemben mutatott rezisztenciát (18). A módosított nehezen kezelhető rezisztencia (mDTR) esetén egy izolátum rezisztens volt a kiterjesztett spektrumú cefalosporinokkal, fluorokinolonokkal, fosfomycinnel és sulfametoxazol-trimetoprimmel szemben. E. coli esetében csak egy további kategóriát (mcDTR; módosított nehezen kezelhető rezisztencia az E. coli-ban) is bevezettünk, amely magában foglalja a nitrofurantoin-érzékenységi adatait is.
A statisztikai elemzéseket, ideértve a deszkriptív elemzéseket és a statisztikai teszteket (Student-féle t-teszt és Mann–Whitney U teszt) az IBM SPSS Statistics for Windows 24.0 (IBM Corp., Armonk, NY, USA) programmal végeztük. A változók normalitását Shapiro–Wilk-teszttel vizsgáltuk. Korrelációs analízist végeztünk, hogy meghatározzuk az UDR-izolátumok arányának időbeli változását a vizsgálati időszak alatt időszak alatt, amelynek során a determinációs együttható (R2) kiszámításra került sor. Ezeket az elemzéseket a Past 3.16 statisztikai szoftver alkalmazásával végeztük (Paleontológiai Múzeum, Oslói Egyetem; Oslo, Norvégia). A p-értékeket <0,05 tekintettük statisztikailag szignifikánsak.
Eredmények
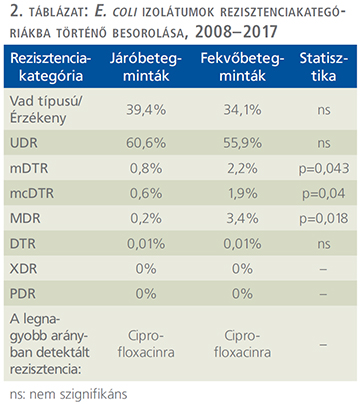
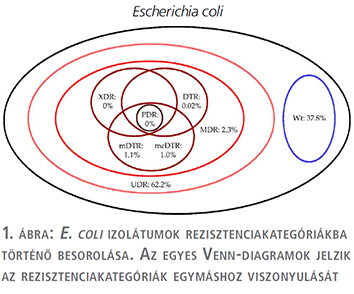
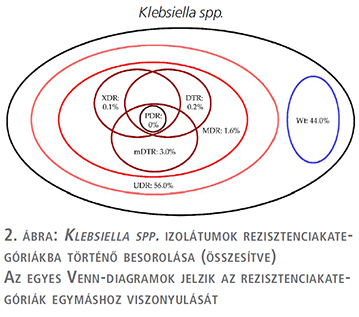
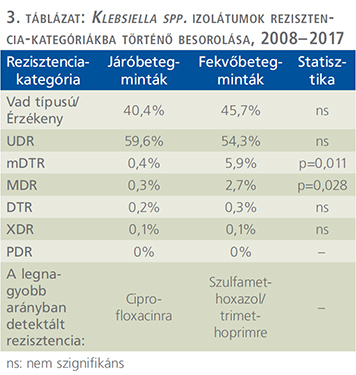
A tízéves vizsgálati periódus alatt (2008. január 1. és 2017. december 31. között) az Intézetbe 21 150 húgyúti kórokozóra pozitív vizeletminta érkezett járóbeteg-ambulanciákról és 19 325 pozitív minta járóbeteg-osztályoktól. Ezen minták közül n=16 240 (76,8%) járóbetegmintából és n=13 386 (69,3%) fekvőbetegmintából került izolálásra Gram-negatív baktérium (p=0,038). Az E. coli izolátumok száma a járó beteg mintákban (p=0,029), a Klebsiella spp. izolátumok száma a fekvőbetegmintákban (p=0,016) volt magasabb. Az izolátumok részletes eloszlását az 1. táblázat mutatja. Az E. coli izolátumok rezisztenciakategóriákba történő besorolását az 2. táblázat és az 1. ábra, a Klebsiella spp. izolátumok besorolását pedig a 3. táblázat és a 2. ábra tartalmazza.
Az UDR-izolátumok prevalenciája az E. coli izolátumokra vonatkozóan 2013-ban volt a legalacsonyabb és 2011-ben a legmagasabb (3. ábra), a Klebsiella spp. esetében 2017-ben volt a legalacsonyabb és 2011/2013-ban a legmagasabb (4. ábra); ugyanakkor az évek során statisztikailag szignifikáns összefüggést csak az E. coli fekvő beteg és a Klebsiella spp. járóbetegmintái esetén figyeltünk meg.
Az E. coli izolátumokra vonatkozóan a vad típusú törzsek 34,1-39,4%-át tették ki az összes izolátumnak, míg a Klebsiella spp. törzsek esetén 40,4-45,7%-ot (2. és 3. táblázat). Az UDR-státuszt leggyakrabban az E. coli törzsek ciprofloxacin-rezisztenciájának, a Klebsiella spp. törzsek esetén a ciprofloxacin vagy szumetrolim-rezisztenciájának tudható be. A járó- és fekvőbetegektől származó minták rezisztenciaviszonyait illetően az mDTR, mcDTR és MDR E. coli törzsek, illetve az mDTR és MDR Klebsiella spp. törzsek esetén volt megfigyelhető szignifikáns különbség (2. és 3. táblázat).
Megbeszélés
Jelen tanulmányban húgyúti patogének 10 éves periódusra vonatkozó rezisztenciaadatait elemeztünk ismert és újszerű indikátorok fényében. Az UTI-k etiológiájának és rezisztenciatrendjeinek vizsgálata lehetővé teszi azok célzott terápiáját a különböző egészségügyi intézményekben (26). Gram-negatív baktériumok antibiotikumokkal szembeni rezisztenciája a klinikumban fontos problémát jelent, a plazmidmediált karbapenem- és kolisztinrezisztencia esetén nagyon kevés terápiás lehetőség áll rendelkezésre (27). Az itt bemutatott adatok hasznosak lehetnek klinikai mikrobiológus, epidemiológus és közegészségügy szakembereknek. Az antibiotikumrezisztencia „klasszikus” osztályozásán kívül (MDR-XDR-PDR), a szakirodalomban leírtak új rezisztenciakategóriákat (nevezetesen UDR-t és DTR-t), amelyeket korábban nem alkalmaztak az UTI-kkal összefüggésben. Kiterjedt rezisztencia esetén a klinikusok kénytelenek olyan antibiotikumokat is alkalmazni a terápiában, amelyek hátrányos farmakológiai tulajdonságokkal rendelkeznek, mint például az aminoglikozidok (nefrotoxicitás, ototoxicitás, neurotoxicitás, rossz penetráció számos anatómiai régióba), tetraciklinek (különösen tigeciklin gyógyszerrezisztens fertőzések esetén; alacsony szérumszint és megnövekedett mortalitási ráta kezelt betegekben) és a kolisztin (nefrotoxicitás, neurotoxicitás, adagolási nehézségei, rossz penetráció számos anatómiai régióba) (28). A klasszikus rezisztenciaosztályozás (MDR-XDR-PDR) nagyon hasznos az epidemiológiai vizsgálatok során célokra; azonban nem feltétlenül korrelálnak jól a klinikai kimenetellel (29). A klinikumközpontú filozófiáján túlmenően, a DTR (és annak a jelen ebben a tanulmányban részletezett módosításai) a betegágy mellett és a klinikai gyakorlatban történő alkalmazása jelentős előnyökkel járhat a klinikai adatokkal összefüggésben (30).
Köszönetnyilvánítás
Gajdács Máriót a Magyar Tudományos Akadémia Bolyai János Kutatási Ösztöndíja (BO/00144/20/5), az Új Nemzeti Kiválóság Program (ÚNKP) Bolyai+ Ösztöndíja (ÚNKP-20-5-SZTE-330) és az ESCMID „30 under 30” Award támogatta.
References
1. Shallcross LJ, Howard SJ, Fowler T, Davies SC. Tackling the threat of antimicrobial resistance: From policy to sustainable action. Philos Trans R Soc Lond B Biol Sci 2015; 370: 20140082, doi: https://doi.org/10.1098/rstb2014.0082
2. Medina E, Pieper DH. Tackling Threats and Future Problems of Multidrug-Resistant Bacteria. Curr Top Microbiol Immunol 2016; 398: 3–33. doi: https://doi.org/10.1007/82_2016_492
3. Lyddiard D, Jones GL, Greatrex BW. Keeping it simple: Lessons from the golden era of antibiotic discovery. FEMS Microbiol Lett 2016; 363: fnw084. doi: https://doi.org/10.1093/femsle/fnw084
4. Hughes D, Karlén A. Discovery and preclinical development of new antibiotics. Ups J Med Sci 2014; 119: 162–169.
doi: https://doi.org/10.3109/03009734.2014.896437
5. Gajdács M. The concept of an ideal antibiotic: Implications for drug design. Molecules 2019; 24: e892.
doi: https://doi.org/10.3390/antibiotics8020052
6. Darrow JJ, Kesselheim AS. Drug development and FDA approval, 1938–2013. N Engl J Med 2014; 370: e39.
doi: https://doi.org/10.1056/NEJMp1402114
7. Santajit S, Indrawattana N. Mechanisms of Antimicrobial Resistance in ESKAPE Pathogens. Biomed Res Int 2016; 24: 75067.
doi: https://doi.org/10.1155/2016/2475067
8. Munita JM, Arias CA. Mechanisms of Antibiotic Resistance. Microbiol Spectr 2016; 4, 10.1128/microbiolspec.VMBF-0016-2015
doi: https://doi.org/10.1128/microbiolspec.VMBF-0016-2015
9. Rice LB. Federal funding for the study of antimicrobial resistance in nosocomial pathogens: No ESKAPE. J Infect Dis 2009; 197: 1079–1081.
doi: https://doi.org/10.1086/533452
10. Fridkin SK, Cleveland AA, See I, Lynfield R. Emerging infections program as surveillance for antimicrobial drug resistance. Emerg Infect Dis 2015; 21: 1578–1581. doi: https://doi.org/10.3201/eid2109.150512
11. Magiorakos AP, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect 2012; 18: 268–281. doi: https://doi.org/10.1111/j.1469-0691.2011.03570.x
12. Burnham JP, Lane MA, Kollef, MH. Impact of sepsis classification and multi-drug-resistance status on outcome among patients treated with appropriate ther-apy. Crit Care Med 2015; 43: 1580–6.
doi: https://doi.org/10.1097/CCM.0000000000001013
13. Zak-Doron Y, Benattar YD, Pfeffer I, Daikos DL, Skiada A, Antoniadou A, Durante-Mangoni E, et al. The Association Between Empirical Antibiotic Treatment and Mortality in Severe Infections Caused by Carbapenem-resistant Gram-negative Bacteria: A Prospective Study. Clin Infect Dis 2018; 67: 1815–1823. doi: https://doi.org/10.1093/cid/ciy371
14. Paul M, Daikos GL, Durante-Mangoti, E, Yahav D, Carmeli Y, Benattal DY, et al. Colistin alone versus colistin plus meropenem for treatment of severe infections caused by carbapenem-resistant Gram-negative bacteria: an open-label, randomised controlled trial. Lancet Infect Dis 2018; 18: 391–400. doi: https://doi.org/10.1016/S1473-3099(18)30099-9
15. Al-Dulaimi MMK, Mutalib SA, Ghani MA, Zaini NAM, Ariffin AA. Multiple Antibiotic Resistance (MAR), Plasmid Profiles, and DNA Polymorphisms among Vibrio vulnificus Isolates. Antibiotics 2019; 8: e68.
doi: https://doi.org/10.3390/antibiotics8020068
16. Gajdács M. Epidemiology and Resistance Levels of EnterobacteriaceaeIsolates from Urinary Tract Infections Expressed as Multiple Antibiotic Resistance (MAR) Indices. J Pharm Res Int 2019, 29: 1–7.
doi: https://doi.org/10.9734/jpri/2019/v29i330238
17. McDonnell A, Rex JH, Goosens H, Bonten M, Fowler VG, Dane A. Efficient Delivery of Investigational Antibacterial Agents via Sustainable Clinical Trial Networks. Clin Infect Dis 2016; 63: S57–S59.
doi: https://doi.org/10.1093/cid/ciw244
18. Kadri SS, Adjemian J, Lai YL, Spaulding AB, Ricotta E, Prevots DR, Palmore TN, et al. Difficult-to-Treat Resistance in Gram-negative Bacteremia at 173 US Hospitals: Retrospective Cohort Analysis of Prevalence, Predictors, and Outcome of Resistance to All First-line Agents. Clin Infect Dis 2018; 67: 1803–1814. doi: https://doi.org/10.1093/cid/ciy378
19. Wiedemann B, Heisig A, Heisig P. Uncomplicated urinary tract infections and antibiotic resistance-epidemiological and mechanistic aspects. Antibiotics 2014; 3: 341–352.
doi: https://doi.org/10.3390/antibiotics3030341
20. Calzi A, Grignolo S, Caviglia I, Calevo, MG, Losurdo G, Piaggio G, Bandettini R, Castagnola E. Resistance to oral antibiotics in 4569 Gram-negative rods isolated from urinary tract infection in children. Eur J Pediatr 2016; 175: 1219–1225. doi: https://doi.org/10.1007/s00431-016-2763-1
21. Simmering JE, Tang F, Cavanaugh JE, Polgreen LA, Polgreen PM. The Increase in Hospitalizations for Urinary Tract Infections and the Associated Costs in the United States, 1998–2011. Open Forum Infect Dis 2017; 4: ofw281. doi: https://doi.org/10.1093/ofid/ofw281
22. Gajdács M, Ábrók M, Lázár A, Burián K. Széles spektrumú béta-laktamáz-termelő (ESBL) húgyúti patogének kezelési lehetőségei: tapasztalatok a SZTE Szent-Györgyi Albert Klinikai Központban. Gyógyszerészet 2019; 63: 405–411.
23. Gajdács M, Bátori Z, Ábrók M, Lázár A, Burián K. Characterization of Resistance in Gram-Negative Urinary Isolates Using Existing and Novel Indicators of Clinical Relevance: A 10-Year Data Analysis. Life 2020; 10: e16.
doi: https://doi.org/10.3390/life10020016
24. Gajdács M, Burián K, Terhes G. Resistance Levels and Epidemiology of Non-Fermenting Gram-Negative Bacteria in Urinary Tract Infections of Inpatients and Outpatients (RENFUTI): A 10-Year Epidemiological Snapshot. Antibiotics 2019; 8: e143.
doi: https://doi.org/10.3390/antibiotics8030143
25. Gajdács M, Ábrók M, Lázár A, Burián K. Comparative Epidemiology and Resistance Trends of Common Urinary Pathogens in a Tertiary-Care Hospital: A 10-Year Surveillance Study. Medicina 2019; 55: e356.
doi: https://doi.org/10.3390/medicina55070356
26. Stefaniuk E, Suchocka U, Bosacka K, Hryniewicz W. Etiology and antibiotic susceptibility of bacterial pathogens responsible for community-acquired urinary tract infections in Poland. Eur J Clin Microbiol Infect Dis 2016; 35: 1363–1369.
doi: https://doi.org/10.1007/s10096-016-2673-1
27. Gajdács M. Pánrezisztens kórokozók által okozott többlethalálozás: mi áll valójában a szakirodalomban? Egészségfejlesztés 2019; 60: 29–35.
28. Nation RL, Garonzik SM, Thamlikitkul V, Giamarellos-Bourboulis EJ, Forrest A, Paterson DL, Li J, Silveira FP. Dosing Guidance for Intravenous Colistin in Critically Ill Patients. Clin Infect Dis 2017; 64: 565–571.
doi: https://doi.org/10.1093/cid/ciw839
29. Gajdács M, Ábrók M, Lázár A, Burián K. Microbiology of urine samples obtained through suprapubic bladder aspiration: A 10-year epidemiological snapshot. Dev Health Sci 2019; 2: 76–78.
doi: https://doi.org/10.1556/2066.2.2019.012
30. Abat C, Rolain JM, Dubourg G, et al. Evaluating the clinical burden and mortality attributable to antibiotic resistance: the disparity of empirical data and simple model estimations. Clin Infect Dis 2017; 65: S58–S63. doi: https://doi.org/10.1093/cid/cix346
Giant renal angiomyolipoma – Case report
DOI: 10.22591/magyurol.2020.3.fabiann.103
Authors:
Fábián Norbert dr.1, Szekeres Ibolya dr.2, Köves Béla dr.1, Tenke Péter dr.1
1Jahn Ferenc Dél-pesti Kórház és Rendelőintézet, Urológiai Osztály, Budapest (osztályvezető: Tenke Péter dr.)
2Jahn Ferenc Dél-pesti Kórház és Rendelőintézet, Patológia Osztály, Budapest (osztályvezető: Shönléber Julianna dr.)
Summary
Introduction: Renal angiomyolipoma (AML) is a benign tumour that contains abnormal blood vessels, smooth muscle and adipose cells. The main indications for active treatment are suspected malignancy on the imaging examination, high risk of bleeding or presence of symptoms.
Case report: We present a case of giant renal AML in a 47 year old female patient, who presented with left sided abdominal pain. Computed tomography (CT) examination revealed multiple AML’s (the largest AML was 12 cm) on the left kidney. The affected kidney was removed after arterial embolization, postoperative histopathological examination confirmed the lesion as a multifocal renal angiomyolipoma with infarction foci, associated with tumour embolization.
Conclusions: Nowadays, with the increased use of imaging studies most cases of AML’s are now discovered incidentally and therefore the giant renal AML’s is rare. In these patients early surgically treatment is the only possible option due to high risk of bleeding. Nowadays occurrence of giant renal AML’s occurrence is rare however there is a high risk of spontaneous rupture and life threating haemorrhage. We would like to emphasize the importance of regular follow-up by an urologist in case of patients with AML.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Bevezetés: Az angiomyolipoma (AML) a vesében kialakuló, benignus daganat, amely szövettanilag három komponensből épül fel: túlburjánzott atípusos erekből, simaizomból és érett zsírszövetből. Az AML aktív kezelést igényel, amennyiben a képalkotó vizsgálatok alapján fennáll a malignitás gyanúja, a vérzésveszély, illetve ha a beteg specifikus panaszokról számol be.
Esetismertetés: Egy 47 éves nőbeteg, bal oldali hasi fájdalmak és 2011 óta ismert, háziorvosa által kontrollált bal oldali nagyméretű AML véleményezése miatt jelentkezett az urológiai szakrendelésünkön. A hasi CT-vizsgálat a bal vese multiplex AML-t írt le (legnagyobb átmérőjű AML 12 cm-es volt). Az érintett vesét megelőző artériás embolizációt követően távolítottuk el, a kórszövettani vizsgálat multifokális AML-t írt le a bal vesében, a tumor embolizációhoz asszociált elhalt területekkel.
Következtetések: Napjainkban a klinikai képalkotó vizsgálatok dinamikus fejlődésének és egyre szélesebb körű alkalmazásának köszönhetően a vese nagyméretű AML igen ritka, viszont ezen betegeknél a nagyfokú vérzésveszély miatt a mihamarabbi, műtéti ellátás az egyetlen lehetséges alternatíva. Az eset bemutatását azért tartottuk fontosnak, mivel az extrém nagyméretű angiomyolipomák előfordulása ritka, viszont ruptura esetén akár a beteg életét veszélyeztető állapot jöhet létre, éppen ezért szeretnénk kiemelni az AML rendszeres, urológus által végzett kontrollvizsgálatának fontosságát.
Bevezetés
Az angiomyolipoma (AML) a vesében kialakuló, benignus mesenchymális tumor, amely változó arányban túlburjánzott zsírszövetből, simaizomból és atípusos erekből épül fel. Viszonylag ritka daganat, prevalencia tekintetében 0,2 és 0,6% között van (3). Az AML általában tünetet nem okoz, viszont nagyobb méretű AML bizonytalan hasi fájdalmat és vérvizelést okozhatnak. A tágult erek veszélyt jelenthetnek, mivel ezen alkotóelemei az AML-nek hajlamosak a spontán rupturára, ami retroperitoneális vérzéshez vezethet, majd vérzéses sokk alakulhat ki. A renalis AML-nek két formáját különböztetjük meg. Az egyik formában a sclerosis tuberosával szövődött angiomyolipoma, míg a másik sporadikus forma. A sclerosis tuberosa autoszomális dominánsan öröklődő, több szervet érintő kórkép, amely esetében az AML többszörös, kétoldali, szimptomatikus és a férfi-női predominancia nincs jelen (1, 7). A sporadikus AML a legtöbb esetben egyoldali, aszimptomatikus, női predominanciát és lassú növekedést mutat. Ezen daganatok átlagos mérete 2-8 cm, ritkán diagnosztizálható 10 cm feletti vese AML (3, 7).
Esetismertetés
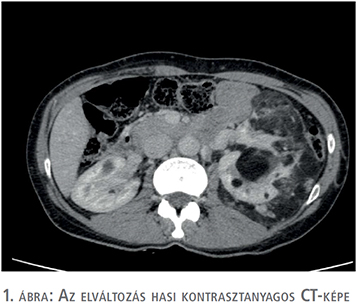
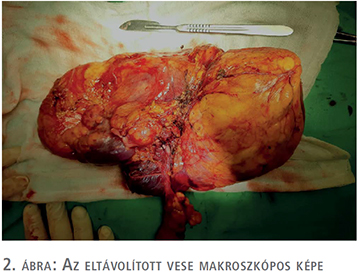
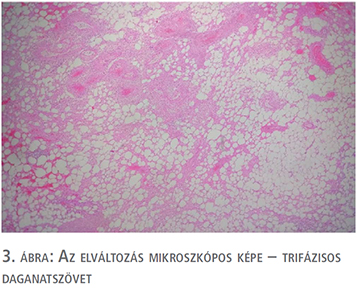
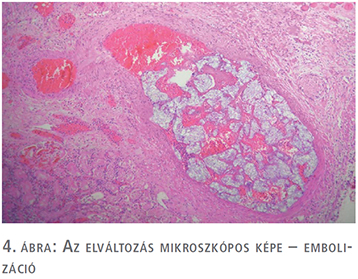
Egy 47 éves nőbeteg, akinél korábban urológiai vizsgálat nem történt, bal oldali felhasi panaszok miatt jelentkezett ambulanciánkon. Kórtörténetéből Raynaud-szindróma, Hashimoto-thyreoiditis és Crohn-betegség emelhető ki, emellett 2011-ben rutin ultrahangvizsgálat során a bal vesében több, körülhatárolt angiomyolipoma volt látható (legnagyobb átmérőjű angiomyolipoma ekkor 9 cm volt). A betegnél kétévente hasi UH-vizsgálat történt, amely során a multiplex angiomyolipomák folyamatos növekedése volt észlelhető. A beteg vesetumor-kontrollját 2019. 08. 06-ig háziorvosa végezte, amikor is fokozódó bal oldali felhasi fájdalmak és diszkomfortérzet miatt a páciens jelentkezett az urológiai szakrendelésen. Fizikális vizsgálat során a felső kvadránsban bal oldalon nagyméretű terime volt tapintható. CT-vizsgálat (1. ábra) során a bal vese felső pólusában egy 12 cm-es, alsó pólusban egy 6 cm-es és emellett a vesében több centrális angiomyolipomát írtak le a hilus kifejezett érintettségével. A képalkotó vizsgálatok során sclerosis tuberosa nem merült fel a beteg esetében. Az extrém nagyméretű AML-re való tekintettel bal oldali transperitonelialis radikális nephrectomia mellett döntöttünk, amelyet a beteg kérésére 2020 januárjában végeztünk el egy dózis antibiotikumprofilaxisban, a műtétet megelőzően a Semmelweis Egyetem Városmajori Szív- és Érgyógyászati Klinikáján a bal vese artériás embolizációja történt. A műtét során komplikáció nem történt, vérvesztés 250 ml volt. A bal oldali nephrectomiás preparátum (2. ábra) összsúlya 1427 gramm volt. A preparátumban a multinoduláris megjelenésű elváltozásnak megfelelően döntően kiérett zsírsejtekből, részben vaskosfalú diszmorf erekből, illetve kevés simaizomsejtből felépülő trifázisos dagantszövet volt megfigyelhető, fokálisan elhalt, bevérzett területekkel (3. és 4. ábra). A végső szövettani diagnózis multifokális AML a bal vesében, tumorembolizációhoz asszociált elhalt területekkel. A posztoperatív időszak második napján a betegnél Clostridium difficile-fertőzés igazolódott, amely terápia (Metronidazol) mellett megszűnt. Összességében a beteget a posztoperatív hatodik napon bocsájtottuk otthonába panaszmentesen, reakciómentes sebbel. Az utánkövetés során a beteg bal oldali felhasi panasza megszűnt, vesefunkciója mindvégig megfelelő volt.
Megbeszélés
Az AML klinikai jelentősége abban áll, hogy bizonyos esetekben (pl. monofázisos AML) képalkotó módszerekkel (UH, MRI, CT) nehéz elkülöníteni az egyéb vesén belül elhelyezkedő malignus daganatoktól (liposarcoma, vesesejtes rák stb.), illetve előfordulhat spontán rupturája a beteg életét veszélyeztető retroperitonealis vérzést okozva (2, 4). Az ebben a témában megjelent cikkeket összegezve Sergio Pello és munkatársai az aktív kezelés indikációit a legtöbb esetben a következőképpen határozták meg: vérzés (spontán ruptura/vérvizelés), nagy tumorméret (általában 4 cm küszöbérték), tünet jelenléte (pl. fájdalom) (8). Egyéb kritériumok lehetnek, ha a beteg nőnemű és szülőképes korban van, illetve amennyiben a tumor malignitásra gyanús elemeket tartalmaz a képalkotó vizsgálat során. Az aktív követés alkalmas eljárás az AML méretbeli és szerkezeti progressziójának nyomonkövetésére és az újabb tumorok korai felismerésére. Szoliter, kis (4 cm alatti méret) AML nyomonkövetése általában évente UH-vizsgálattal, míg többszörös és/vagy sclerosis tuberosával szövődött forma esetén célszerű a CT- vagy MRI-vizsgálat alkalmazása (5, 6). Jacob Ramon és munkatársai által megjelentetett tanulmányában látható volt, hogy transarterialis tumorembolizációt követően a vérzéses szövődmények elkerülhetők voltak, emellett csak minor komplikációk fordultak elő, és a vesefunkciós paraméterek nem romlottak (6, 9). Vese AML esetén gyakran a műtét marad az egyetlen alternatíva (radikális nephrectomia/parciális nephrectomia), de mindig érdemes törekedni a nephront megkímélő technikák alkalmazására. Nephrectomia indikált hatalmas méretű AML esetén, ha malignitás gyanúja fennáll, illetve néhány sürgősségi esetben (AML-ruptura – vérzéses sokk) (10, 11), az irodalmi adatok szerint az extrém nagyméretű AML esetén a minimálinvazív, illetve a konzervatív kezelési lehetőségek hatásossága kérdéses, ezért jelenleg a műtét (nephrectomia) a goldstandard kezelési lehetőség.
Következtetések
Esetünkben tekintettel az elváltozás extrém méretére és vérzési potenciájára, annak ellenére a vese eltávolítása mellett döntöttünk, hogy az angiomyolipoma jóindulatú daganat és a CT-vizsgálat során malignitás gyanú nem merült fel. Az esetet azért tartjuk bemutatásra érdemesnek, mivel napjainkban az extrém nagyméretű angiomyolipomák előfordulása ritka, emellett felhívja a figyelmet arra, hogy fontos ezen betegek rendszeres képalkotó (UH, CT, MRI), illetve urológiai vizsgálata.
References
1. Taneja R, Singh DV. Giant renal angiomyolipoma: unusual cause of huge abdominal mass. J Clin Imaging Sci 2013; 3: 56. Published 2013 Nov 28. doi: https://doi.org/10.4103/2156-7514.122326
2. Szendrői A. A sclerosis tuberosa-val szövődött angiomyolipoma kezelési lehetőségei, MAGYAR UROLÓGIA 2017; 29(2): 69–73.
doi: https://doi.org/10.22591/magyurol.2017.2.szendroia.69
3. Konrad Wron´ski, Zbigniew Masłowski, Giant renal angiomyolipoma – case report. New Med 2015: 19 (1): 6–8.
doi: https://doi.org/10.5604/14270994.1155325
4. Flum AS, Hamoui N, Said MA, et al. Update on the diagnosis and management of renal angiomyolipoma. J Urol 2017; 195(4): 834–846. doi: https://doi.org/10.1016/j.juro.2015.07.126
5. Kiefer, RM, Stavropoulos SW. The Role of Interventional Radiology Techniques in the Management of Renal Angiomyolipomas. Curr Urol Rep 2017; 18(5): 36.
doi: https://doi.org/10.1007/s11934-017-0687-6
6. Bhatt, JR, Richard, PO, Kim, NS, et al. Natural History of Renal Angiomyolipoma (AML): Most Patients with Large AMLs >4 cm Can Be Offered Active Surveillance as an Initial Management Strategy. Eur Urol 2016; 70(1): 85–90. doi: https://doi.org/10.1016/j.eururo.2016.01.048
7. Nicolas Vos and Raymond Oyen. Renal Angiomyolipoma: The Good, the Bad, and the Ugly. J Belg Soc Radiol 2018; 102(1): 41.
doi: https://doi.org/10.5334/jbsr.1536
8. Sergio Fernández-Pello, et al. Management of Sporadic Renal Angiomyolipomas: A SystematicReview of Available Evidence to Guide Recommendationsfrom the European Association of Urology Renal CellCarcinoma Guidelines Panel. European Urology Oncology 2020; 3: 57–72. doi: https://doi.org/10.1016/j.euo.2019.04.005
9. Ramon J, Rimon U, Garniek A, Golan G, Bensaid P, Kitrey ND, Nadu A, Dotan ZA. Renal Angiomyolipoma: Long-term Results Following Selective Arterial Embolization. European Urology 2008; 55(5): 1155–1162. doi: https://doi.org//10.1016/j.eururo.2008.04.025
10. Miguel Oliveira, Marta Sofia Costa, Tiago Barra, Andreia Silva, Tânia Sousa, Joana Rodrigues, Filipa Costa, Sérgio Lemos, Everolimus in the treatment of giant renal angiomyolipoma associated with tuberous sclerosis. Port J Nephrol Hypert 2016; 30(2): 11. 11. Szendrői A, Hamvas A, Székely E, Szűcs M, Romics I. Jóindulatú daganat-e az angiomyolipoma? Uroonkológia 2005; 2(3): 76–80.
Metastatic non-muscle-invasive bladder cancer – A case report
DOI: 10.22591/magyurol.2020.3.juhaszd.106
Authors:
Juhász Dániel dr.1, Szendrői Miklós dr.2, Nyirády Péter dr.1, Riesz Péter dr.1
1Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum, Budapest (igazgató: Nyirády Péter dr.)
2Semmelweis Egyetem, Ortopédiai Klinika, Budapest (igazgató: Szőke György dr.)
Summary
Introduction: Malignant neoplasm of the urinary bladder is the second most common malignancy in urological patients. Non-muscle-invasive bladder cancer causes distant metastasis in less than 10% of cases. In the literature available, very few metastases to non-muscle-invasive bladder cancer has been described in a variety of locations.
Case report: A 61-year-old female patient treated with type 2 diabetes mellitus visited our clinic in 2017. She had a history of 2008 with transurethral bladder tumour resection (TURTU). Histological examination resulted in pT1GrII low grade urothelial cell carcinoma. In 2013, X-ray and SPECT were performed due to lower left limb pain, which confirmed osteolytic lesion in the diaphysis of the left femur. The patient underwent left proximal femoral resection and tumor endoprosthesis implantation at the Department of Orthopaedics, Semmelweis University. Histological examination of the removed specimen confirmed the metastasis of urothelial cell carcinoma. Staging CT scan and cystoscopy did not confirm metastasis or relapse in the bladder. The patient did not submit to a control examination from 2014 for 3 years. In 2017, CT scan and cystoscopy confirmed recurrent bladder cancer. Transurethral resection of the bladder happened. Histologic examination confirmed T1GrII low grade transitional cell carcinoma. The patient underwent cystoscopy every 3 months and since then no recurrence was detected.
Discussion and conclusion: Non-muscle invasive bladder tumours cause metastases less than 10% of the cases. They can be recognised in variety of the locations. Type 2 diabetes mellitus is a predisposing factor for metastasis formation in patients treated by non-muscle invasive bladder cancer. National and international guidelines do not recommend additional staging imaging (eg. bone scintigraphy, x-rays) for low grade non-muscle invasive bladder carcinoma. In the present case, attention should be drawn to the possibility of metastasis when symptoms and abnormal imaging are observed.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Bevezetés: A húgyhólyag rosszindulatú daganata a második leggyakoribb malignitás az urológiai betegek körében. A nem izominvazív hólyagrák az esetek kevesebb, mint 10%-ában képez távoli áttétet. A fellelhető szakirodalomban kevés nem izominvazív hólyagrák által adott áttétet írtak le változatos elhelyezkedésben felismerve.
Esetismertetés: 61 éves 2-es típusú diabetes mellitus miatt kezelés alatt álló nőbeteg 2017-ben jelentkezett klinikánkon. Anamnézisében 2008-ban szerepel transurethralis hólyagtumor-reszekció. Szövettani vizsgálat eredménye pT1GrII low grade urothelsejtes karcinóma volt. 2013-ban bal oldali alsóvégtagi fájdalmak miatt röntgen és SPECT történt, ami a bal femur diafízisében igazolt osteolitikus léziót. A betegnél a Semmelweis Egyetem Ortopédiai Klinikán bal proximális femurreszekció és tumor endoprotézis-implantáció történt. Az eltávolított preparátum szövettani vizsgálata urothelsejtes karcinóma áttétjét igazolta. Staging CT-vizsgálat és cisztoszkópia a húgyhólyagban áttétet vagy recidívát nem igazolt. A beteg 2014-től 3 évig kontrollvizsgálatra nem jelentkezett. 2017-ben CT-vizsgálat és cisztoszkópia recidív hólyagtumort igazolt. TURTU történt, szövettani eredmény T1GrII low grade tranziciocelluláris karcinómát igazolt. A betegnél 3 havonta cisztoszkópia történt, azóta recidíva gyanúja nem merült fel.
Megbeszélés és következtetés: A nem izominvazív hólyagdaganatok az esetek kevesebb, mint 10%-ában képeznek metasztázist. Lokalizációt tekintve változatos elhelyezkedésben kerülhetnek felismerésre. A 2-es típusú diabetes mellitus hajlamosító tényező a nem izominvazív hólyagrák által gondozott betegeknél metasztázisképződésre. A hazai és nemzetközi szakmai irányelvek nem írnak elő kiegészítő staging képalkotó vizsgálatokat (pl. csontszcintigráfia, röntgen) low grade nem izominvazív hólyagkarcinómánál. A bemutatott esettel arra hívjuk fel a figyelmet, hogy tünetek és kóros eltérést mutató képalkotó eredmény észlelésekor áttét lehetőségére gondolni kell.
Bevezetés
A húgyhólyag rosszindulatú daganata a második leggyakoribb malignitás az urológiai betegek körében. Kialakulásában 90%-ban a dohányzás tehető felelőssé. Leggyakoribb tünete a makroszkópos vérvizelés. Kezelésében gold standard beavatkozás az endoszkópos transurethralis tumorreszekció (TURTU). Szövettani típusát tekintve urothelsejtes (átmeneti sejtes vagy tranziciocelluláris) karcinóma. Az összes húgyhólyagdaganat 75%-ban nem izominvazív (Ta, T1, CIS), 25%-ban izominvazív (T2≤). A nem izominvazív hólyagrák az esetek kevesebb, mint 10%-ában képez távoli áttétet, a diabetes mellitus kockázati tényezőként szerepel az áttétképződés szempontjából (1).
Esetismertetés
61 éves 2-es típusú diabetes mellitus miatt kezelés alatt álló nőbeteg 2017-ben jelentkezett klinikánkon. Anamnézisében 2008-ban szerepelt transurethralis hólyagtumor-reszekció (TURTU) és adjuváns mitomycin-C intravesicalis kemoinstilláció. Szövettani vizsgálat eredménye pT1GrII urothelsejtes karcinóma volt. Utóreszekció során daganat jelenléte nem igazolódott. A betegnél 2010-ben jobb oldali tüdőtumort fedeztek fel és alsólebenyi lobectomia történt. Szövettani vizsgálat primer planocelluláris karcinóma jelenlétét mutatta.
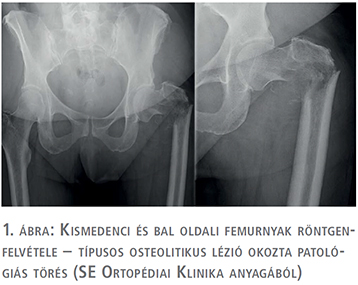
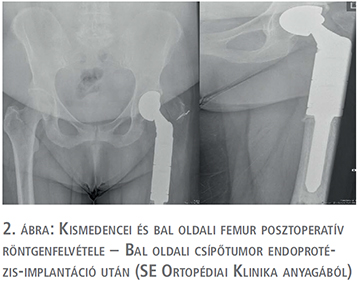
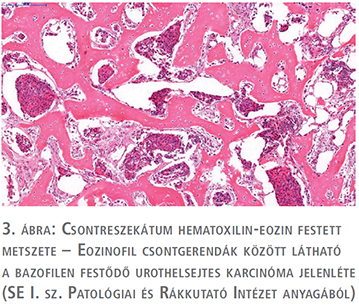
2013-ban bal oldali alsóvégtagi fájdalmak miatt röntgen és SPECT történt, ami a bal femur diafízisében igazolt osteolyticus léziót (1. ábra). A betegnél a Semmelweis Egyetem Ortopédiai Klinikán bal proximális femur reszekció és tumor endoprotézis-implantáció történt (2. ábra). Az eltávolított preparátum szövettani vizsgálata urothelsejtes karcinóma áttétjét igazolta.

Staging CT-vizsgálat és cisztoszkópia a húgyhólyagban áttétet vagy recidívát nem igazolt. A beteg 2014-től 3 évig kontrollvizsgálatra nem jelentkezett. 2017-ben CT-vizsgálat és cisztoszkópia recidív hólyagtumort igazolt. TURTU és korai posztoperatív intravesicalis epirubicin kemoinstilláció történt, szövettani eredmény T1GrII low grade tranziciocelluláris karcinómát igazolt. A betegnél 3 havonta cisztoszkópia történt, azóta recidíva gyanúja nem merült fel.
Megbeszélés és következtetés
A nem izominvazív hólyagdaganatok az esetek kevesebb, mint 10%-ában képeznek metasztázist, a 2-es típusú diabetes mellitus hajlamosító tényező metasztázis képződésre. A kevés fellelhető szakirodalomban lokalizációt tekintve változatos elhelyezkedésben kerültek felismerésre. Sasaki és munkatársai egy T1GII urothelialis karcinóma miatt TURTU-n átesett beteg esetét mutatták be, akinél a magas posztoperatív alkalikus foszfatáz- (ALP) szint hátterében csontszcintigráfia multiplex csontmetasztázist igazolt. Kombinált gemcitabin és denosumabkezelést indítottak (2). T1 high grade nem izominvazív húgyhólyag-karcinóma adott áttétet iliacalis nyirokcsomókba, csontba, mediastinumba, mellékvesébe és pajzsmirigybe egy török esetismertetésben (3). Egy japán betegnél ugyancsak pT1 high grade nem izominvazív húgyhólyag-karcinóma okozott mulitplex májmetasztázist (4). 2008-ban egy 63 éves férfi beteg TURTU-n esett át, szövettan T1 high grade urothelialis karcinóma volt. 3 évvel később akutan kialakult kettős látás, n. trochlearis paralízis és labialis hypaesthesia miatt készült koponya-MRI-vizsgálat, ami clivus infiltrációt és pachymeningitist igazolt, meningealis carcinomatosis mellett. A nem izominvazív húgyhólyag-tumorok által okozott metasztázisok ritkák, azonban előfordulásuk esetén is többnyire high grade daganat hozza létre azokat. Low grade tumorok esetében ez még ritkább. A hazai és nemzetközi szakmai irányelvek nem írnak elő kiegészítő staging képalkotó vizsgálatokat (pl. csontszcintigráfia, röntgen, MRI) nem izominvazív, így low grade hólyagkarcinómánál sem. A szerzők a bemutatott esettel arra kívánják felhívni a figyelmet, hogy tünetek esetén és kóros eltérést mutató képalkotó eredmény észlelésekor nem izominvazív húgyhólyagkarcinóma-áttét lehetőségére feltétlenül gondolni kell.
References
1. Ozer K, Horsanali MO, Gorgel SN, Ozbek E. Asian Pac J Cancer Prev 2016; 17(1): 105–8. doi: https://doi.org/10.7314/APJCP.2016.17.1.105
2. Sasaki Y, Oi H, Oyama T, Kagawa J, Komori M, Senzaki T, Fukawa T, Takahashi H, Takemura M, Yamaguchi K, Yamamoto Y. 2013 Oct; 59(10): 669–72. Japanese.
3. Tuncer M, Faydaci G, Altin G, Erdogan BA, Kibar S, Sanli A, Bilgici D. Korean J Urol 2014 Mar; 55(3): 222–5. doi: https://doi.org/10.4111/kju.2014.55.3.222. Epub 2014 Mar 13. doi: https://doi.org/10.4111/kju.2014.55.3.222
4. Kida K, Shimizu Y, Ogawa K, Kanamaru S, Ito N. Hinyokika Kiyo. 2018 Jun; 64(6): 271–275.
doi: https://doi.org/10.14989/ActaUrolJap_64_6_271. Japanese
5. Teyssonneau D, Daste A, Dousset V, Hoepffner JL, Ravaud A, Gross-Goupil M. BMC Cancer. 2017 May 11; 17(1): 323.
doi: https://doi.org/10.1186/s12885-017-3309-2
Az Orvosi Hetilap és a Gyógyászat 1921-es évfolyamában megjelent urológiai tárgyú dolgozatokró
DOI: 10.22591/magyurol.2020.3.romicsi.109
Authors:
Romics Imre dr.
Semmelweis Egyetem, Urológiai Klkinika, Budapest (igazgató: Nyirádi Péter dr.)
Summary
Az 1921-ben megjelent dolgozatok egy részét bizonyára még 1920-ban, tehát száz éve írták a szerzők. Nem érdektelen visszatekinteni mit tudtak már akkor is korábbi kollégáink, mi volt akkor aktuális téma és mi volt a véleményük, tapasztalatuk.
1920-ban az Orvosi Hetilap 65. évfolyamának számai jelentek meg. Az Orvosi Hetilap ez idő szerinti főszerkesztője Lenhossék Mihály, szerkesztője Székely Ágoston egyetemi tanárok voltak.
Mező Béla dr., egyetemi magántanár az „Új Szent István Kórház gyermekosztályainak sebészrendelő főorvosa” dolgozatának címe: A sebészeti csomó kötésének egyszerű és gyors módja. A dolgozat a csomózás fontosságát emeli ki, ami ma sem kevésbé fontos, mint száz éve. Asszony (!)-, hajós- és a sebészcsomót ismerteti. Az asszonycsomó a legrosszabb, mert az egyik szár egyenes marad, a másik szár ahhoz kötődik meg, tehát csúszik a csomó. A hajós már jobb (a részletes leírás ellenére egyiknél sem jöttem rá, hogyan kell csinálni), a sebészi csomó elnevezés ismerős. Mező egy újabb „fektetési pronációs csomóképzés”-nek nevezi saját ötletét és 4 fotóval illusztrálja is. Bizonyára felületes olvasásomnak tulajdonítható, hogy a leírás alapján a catgut-ot nem tudnám az ő újítása szerint megkötni…
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 3. SZÁM
Rihmer Béla dr., egyetemi magántanár, kórházi főorvos „A prostata sebészete” című dolgozatát három részletben közlik egymást követő lapszámokban.
A dolgozatot a prosztata gennyedésével kezdi. 19 betegéből hatnak volt gonorrhoeás eredete, de társultak a prosztatagennyedéshez (tályoghoz) prosztatatúltengés, húgycsőszűkület, krónikus pyelonephritis és szepszis is. 19 betegéből előzetesen 12-t katétereztek, ezután alakult ki a tályog. „Áttétes” prosztatatályogról is ír, amikor a távoli furunculus hematogén úton idézett elő prosztatagennyedést. A leírt tünetek ma is tankönyvi adatok. Káros kezelésnek tartja a masszázst, a „szondázást” (katéterezést?), cisztoszkópiát és a „heves-coitust”. A fentiek, valamint a lovaglás is „fellármázhatják” a prosztata „szunnyadó” baktériumait.
Öt napig javasol Arzberger-melegítést (!), ennek hatására kifakad a tályog és a húgycsövön kifolyik. A fenti terápiát tejinjekcióval javasolja kiegészíteni. Komplikáltabb, ha a tályog nem a húgycső, hanem a hólyag vagy a rectum felé tör ki. A nyirokutakon való továbbterjedés thrombophlebitist, peritonitist okozhat. Sebészi beavatkozások közül a gáti tályogmegnyitás a legeredményesebb. Tárgyalja a hólyag- és húgycsőkövek szerepét is a tályog kialakulásában.
A második fejezet a prosztatatúltengésról szól. (Megjegyzendő, hogy a dolgozat végén nincs irodalomjegyzék, azonban az írás folyamán a szerző idézi más, bel- és külföldi urológusok tapasztalatát az épp tárgyalt kérdésről csak a név említésével, a folyóirat, kötet-, oldalszám megnevezése nélkül. Ez minden dolgozatnál így szerepel a lapban.)
A prosztatatúltengés etiológiájáról Rihmer azt írja, hogy „homályos”. Bár számos teóriát és szerzőt idéz. Ma sem tudunk sokkal többet.
A terápiás lehetőségek közül elsőként a prosztata vagy a herék besugárzását ismerteti. Az eredmény szegényes. A „kathererismussal” kezelt betegek 30%-a szepszisben hunyt el! Sok az urémiás halálok is.
A cystostomia is egy lehetőség, nyílt műtéttel Pezzer-katétert helyeztek be (1. ábra). Szövődményei a hólyagkő, sebgyógyulási zavar, sebváladékozás.
A „radikális” műtét alatt a mai transvesicalis prostatectomiát értik. Úgy érzem, ez egy utolsó lehetőség volt. Gondoljunk bele: nem volt transzfúzió, nem volt antibiotikum, nem volt ballonos katéter, felszívódó fonal, spinális érzéstelenítés, jó műtőlámpa és műtőasztal. Ennek a fele a 70-es években sem volt, sok is volt a hólyagsipoly…
Rihmer kétszakaszos prosztataműtétről ír magyarázat nélkül, valószínűleg, ez akkor mindenki előtt ismert volt. A két szakasz nem az, ami az 50-es, 60-as években volt. Először volt a kisműtét, azaz a kétoldali vasectomia, majd egy újabb felvétel során a prosztataenukleáció lokálban. A hetvenes években ezt már egy ülésben csinálták/csináltuk. A két szakasz első része – így olvastam ki a sorok között – egy Pezzer-katéter behelyezése volt sectio alta útján. Ezzel azt érték el, amit ma a nagyvolumenű, totális retenció esetén a műtét előtt 3-4 héttel behelyezett katéter vagy epicystostomia, az esetleges urémia normalizálódása, a hólyag tónusának javítása céljából.
Fontosnak tartja Rihmer a műtét előtti labor-, vesefunkciós vizsgálatokat (vizeletfajsúly, hígításkoncentrálás, indigocarmin-kiválasztás, kryoscopia [vizelet fagyáspontcsökkenés?]), maradék nitrogénmeghatározás a szérumban. A műtéti technika, vérzéscsillapítás, öltés, tamponálás, folyamatos öblítés is szóba került.
Az Orvosi Hetilapban a Budapesti Királyi Orvosegyesület programjait is ismertetik, az előadások rövid összefoglalójával együtt. Egy alkalommal Mező Béla a vándorvese új műtéti technikáját ismerteti. A decapsulált felső pólust a „megkapart” rekeszhez négy öltéssel rögzíti.
Schnitzer Oszkár a húgycső és a hólyag idegen testjeiről beszélt. Az idegen testek: szilvamag, kácsatrachea (!), viaszdarab, illetve két háborús sérülés késői szövődménye. Egy srapnelrepesz az uréterbe, egy lövedék a hólyagba vándorolt.
A Magyar Orvosok Tuberkulózis Egyesületének ülésén Illyés Géza tartott referátumot az uro-tbc-ről. Vese-tbc esetén a nephrectomia a helyes beavatkozás.
A német L. Casper Lehrbuch der Urologie c. könyvét ismertetik röviden a lap hasábján (ára 100 márka). A hirdetések sem maradhatnak el. Röntgenkészülék, kvarclámpa, gyógyszerek, mint Valoral (sedativum) Robeferrin cum et sine arzen…
Szanatóriumok hirdetik magukat! Pl. a svábhegyi Liget Szanatórium, a valamikori, 1980-as, 90-es években a SOTE III. sz. Belklinika épülete, 1921-ben, 30 éve és ma is a címe Eötvös u. 10–12. Klinikaigazgató volt Gerő Sándor majd Romics László. A háború előtt bel- és idegbetegek valamint üdülők részére áll rendelkezésre. Horthy lánya, Paula is volt itt tbc-je miatt „kezelésen”, de tbc miatt meghalt fiatalon.
Az 1920-ban elcsatolt területek fürdőhelyei továbbra is hirdetik magukat, a még magyar tulajdonosok. Pöstyén, Igló, Újtátrafüred, Tátraháza. De a Szív utcai Dajka-Intézet Wassermannra (luesz) megvizsgált bőtejű dadák szolgálatait ajánlja.
Egy körzeti orvosi pályázatot is érdemes megtekinteni. Pilisvörösvárra várják a jelentkezőt, akinek Pilisszentivánt is el kell látni. Javadalmazás: 1600 korona + korpótlék, 800 korona lakbér, 432 korona úti átalány, háborús és drágasági segély. Valamint „szabályrendeletileg megállapított rendelési és látogatási díj”, azaz honorárium. Aláírás: főszolgabíró. Babics mondása jut eszembe: a tekintetes címre nem tart igényt, de a professzori 860 (!) pengő jó lenne…
1920-ban a Gyógyászat lap tulajdonosai Scháchter Miksa örökösei voltak, a főszerkesztő Molnár Mihály és Lévy Lajos.
A márc. 27-i számban Genersich Antal emlékezete címmel Entz Béla írt egy terjedelmes ötoldalas dolgozatot, aki patológusként az urológiához is közel állt. Kertész Géza és Perczel Aladár egy „Kreangol” nevű antigonorrheikus ezüstkészítmény kedvező hatásáról írnak rövid dolgozatukban, amelyet 1%-os hígításban használnak.
Pfeiffer Ernő, műtőorvos-urológus a „Homoszexualitás hereátültetéssel gyógyított esete” címmel közöl egy esetet. Az átültetett herét a rekesz izmai közé operálta – a betegnek sérvműtétet mondva. Hat hét után frenetikus hatása volt…Követője valószínűleg nem akadt.
Porosz Mór egy pseudofrenulum preputii esetét írja le (nem egészen tiszta, hogy lehet dorsalisan frenulum). A prosztatatúltengést Reininger-féle myomotorral (faradicus áram) kezeli…
Alapi Henrik dr., egyetemi c. rk. tanár (Izraelita Hitközség Kórházának Sebészeti Osztálya) dolgozatának lényege a prosztataműtét. 14 prostatectomiájából 4 meghalt („nem túl nagy halálozás”). Ami csak ma tűnik furcsának, mert ő is írja, hogy csak a „kétségbeesett esetek” kerülnek műtétre. Korábban már tárgyaltuk, miért is volt ez a műtét akkor valóban heroikus beavatkozás. Ő is a „kétszakaszos” műtétet végezte.
Irodalmi szemle itt is van az „URULÓGIA” (sic!) fejezet alatt, pl. a Berl. Kl. W.-ből ismertetnek egy írást, a gonorrhoeát autovakcinával és saját fehérjével ajánlják kezelni.
A hirdetések száma meghaladja, minősége alulmúlja az Orvosi Hetilapét.
Összefoglalva, sem a méltóságos cím, sem a sok ezer koronás fizetés nem csábít vissza száz évvel, ma sokkal többet tudunk tenni a betegért, sokkal sikeresebben dolgozunk mindnyájan. De tudni, hogy honnan jöttünk és hová jutottunk, az nem felesleges.
