Analysis of resistance trends in urinary Escherichia coli and Klebsiella spp. isolates using known and novel indicators of clinical relevance: a 10-year retrospective study
DOI: 10.22591/magyurol.2020.3.berczics
Authors:
Gajdács Márió dr.1, Ábrók Marianna2, Lázár Andrea dr.2, Burián Katalin dr.2,3
1Szegedi Tudományegyetem Gyógyszerésztudományi Kar, Gyógyszerhatástani és Biofarmáciai Intézet, Szeged (intézetvezető: Zupkó István dr.)
2Szegedi Tudományegyetem Általános Orvostudományi Kar, Klinikai Mikrobiológiai Diagnosztikai Intézet, Szeged (intézetvezető: Burián Katalin dr.)
3Szegedi Tudományegyetem Általános Orvostudományi Kar, Orvosi Mikrobiológiai és Immunbiológiai Intézet, Szeged (intézetvezető: Burián Katalin)
Summary
Introduction: The emergence and spread of antibiotic-resistant bacterial pathogens worldwide is one of the most important public health problems. A number of new bacterial resistance criteria have been published in recent years to improve the correlation between resistance data and clinical outcome.
Materials and methods: This study retrospectively collected microbiological and resistance data for the period of January 1, 2008-December 31, 2008 (10 years) at the Institute of Clinical Microbiology, University of Szeged. During data analysis, bacterial isolates were classified into various resistance categories (wild type, UDR, MDR, XDR, PDR, and DTR and mDTR). Results: Gram-negative bacteria were isolated from n=16,240 (76.8%) of outpatient samples and n=13,386 (69.3%) of inpatient samples during the 10-year study period (p=0.038). For E. coli isolates, 34.1–39.4% of the strains in total were wild-type, while for Klebsiella spp. strains, this ratio was 40.4–45.7%. The prevalence of UDR isolates for E. coli isolates was lowest in 2013 and highest in 2011, while for Klebsiella spp., this was the lowest in 2017 and the highest in 2011/2013.
Conclusions: In addition to its clinical-centered philosophy, the use of DTR (and its modifications as detailed in this study) in bedside and clinical practice may have significant benefits in terms of clinical data.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Bevezetés: Az antibiotikumokkal szemben rezisztens bakteriális kórokozók megjelenése és terjedése világszerte egyike a legfontosabb népegészségügyi problémáknak. Az utóbbi években számos új bakteriális rezisztenciakritérium került közzétételre, a rezisztenciaadatok és a klinikai kimenetel közötti korreláció javításának céljából.
Anyag és módszer: Jelen tanulmányban mikrobiológiai- és rezisztenciaadatok retrospektív gyűjtése történt, a 2008. 01. 01 – 2017. 12. 31. közötti (10 éves) periódusra vonatkozóan az SZTE ÁOK Klinikai Mikrobiológiai Diagnosztikai Intézetében. Az adatok elemzése során a bakteriális izolátumokat különféle rezisztenciakategóriákba soroltuk (vad típusú, UDR, MDR, XDR, PDR, illetve DTR és mDTR).
Eredmények: A tízéves vizsgálati periódus alatt n=16 240 (76,8%) járóbetegmintából és n=13 386 (69,3%) fekvőbetegmintából került izolálásra Gram-negatív baktérium (p=0,038). Az E. coli izolátumokra vonatkozóan a vad típusú törzsek 34,1-39,4%-át tették ki az összes izolátumnak, míg a
Klebsiella spp. törzsek esetén 40,4-45,7%-ot. Az UDR-izolátumok prevalenciája az E. coli izolátumokra vonatkozóan 2013-ban volt a legalacsonyabb és 2011-ben a legmagasabb, a Klebsiella spp. esetében 2017-ben volt a legalacsonyabb és 2011/2013-ban a legmagasabb.
Következtetés: A klinikumközpontú filozófiáján túlmenően, a DTR (és annak a jelen ebben a tanulmányban részletezett módosításai) a betegágy mellett és a klinikai gyakorlatban történő alkalmazása jelentős előnyökkel járhat a klinikai adatokkal összefüggésben.
Bevezetés
Az antibiotikumokkal szemben rezisztens bakteriális kórokozók megjelenése és terjedése világszerte egyike a legfontosabb népegészségügyi problémáknak (1, 2). Az antibiotikumrezisztens kórokozók által okozott fertőzések következtében az érintett betegek életminősége (QoL) csökken, az egészségügyi infrastruktúrát terhelő költségek megnövekednek, valamint drága és/vagy kedvezőtlen toxicitási profilú antibiotikumok használatát teszik szükségességé, amelyekkel összefüggésben megnövekedett halálozási arányt figyeltek meg (pl. kolisztin) (3, 4). A helyzetet tovább súlyosbítja, hogy az antibiotikumok felfedezésének és az új szerek kifejlesztésének területén a gyógyszerfejlesztő cégeknek nincsen megfelelő pénzügyi motivációjuk, mivel a beruházás megtérülése csak kevésszer valósul meg, szemben a krónikus, nem fertőző betegségek vagy daganatok kezelésére szolgáló új szerekkel (5). Bár az utóbbi években az ún. köz- és magánszféra partnerkapcsolatok (public-private partnerships; ideértve az Amerikai Gyógyszerügynökség 10×20 Initiative c. kezdeményezését, illetve az Európai Gyógyszerügynökség New Drugs for Bad Bugs [ND4BB] programját) igyekszenek fenntartani az antimikrobiális szerek fejlesztéséhez vonzó pénzügyi/beruházási területet, az újonnan forgalomba hozott antibiotikumok száma továbbra is messze van az antibiotikumok felfedezésének aranykorához (1960–1980) képest (6). Ha a halálozási mutatóikat és a gazdasági hatásaikat vesszük alapul, akkor az ún. „ESKAPE” kórokozók, nevezetesen E: Enterococcus faecium, S: Staphylococcus aureus vagy újonnan Stenotrophomonas maltophilia, K: Klebsiella pneumoniae vagy újabban C: Clostridioides difficile, A: Acinetobacter baumannii, P: Pseudomonas aeruginosa, E: Enterobacter spp., vagy nemrégiben Enterobacteriaceae) jelentik a legtöbb kihívást a klinikumban (7). Számos rezisztenciamechanizmust írtak le különféle baktériumfajokban. Ezeknek a rezisztenciamechanizmusoknak egy része plazmidközvetített, amely lehetővé teszi azok széles körű terjesztését és a kórházi járványok kialakulását (különösen a Gram-negatív baktériumok esetében; pl. a kiterjedt spektrumú b-laktamáz- vagy a karbapenemáz gének transzmissziója), míg néhány baktérium genetikailag („veleszületett”) rezisztenciával rendelkezik, amely a faj valamennyi tagjára jellemző (pl. a Proteus, Providencia és Morganella fajok tetraciklinekkel, a nitrofurantoinnal és a polymixin B-vel szembeni rezisztenciája) (8, 9). Az antibiotikumérzékenységi vizsgálatok kiválasztása és értelmezése, illetve a megfelelő terápia kiválasztása érdekében mind a klinikusoknak, mind a klinikai mikrobiológusoknak tisztában kell lenniük a különböző fajok genetikailag kódolt rezisztenciájával, illetve a szerzett rezisztencia helyi szintjével (10). Számos módszer került kifejlesztésre abból a célból, hogy a baktériumokat rezisztenciakategóriákba sorolják; ezekben a különbségek miatt osztályozások, azonban ezekben az osztályozásokban jelentős következetlenségek fordultak elő. Az első globális konszenzuskritériumokat az Egyesült Államok Járványvédelmi Központja (CDC) és az Európai Betegségmegelőzési és Járványvédelmi Központja (ECDC) határozta meg, nevezetesen a multidrog-rezisztencia (MDR), a kiterjedt gyógyszer-rezisztencia (XDR) és a pándrog-rezisztencia (PDR) definiálásával (11). Ezek a rezisztenciakategóriák hasznosak a járványügyi epidemiológiai adatok jelentésekor a rezisztenciahelyzetének egy adott földrajzi régióban történő értékeléséhez. Ez a kategorizálás azonban nem veszi figyelembe az egyes antibiotikumok klinikai hatékonyságát és a farmakológiai különbségeket; mindazonáltal, ezek a tulajdonságok jelentősen megváltoztathatják a fertőzések során a klinikai kimenetelt (12). Ezt számos publikáció igazolta már, amelyekben arra a következtetésre jutottak, hogy az MDR-kórokozók (a terápiához használt gyógyszerek jellemzőinek figyelembevétele nélkül) önmagában nem hozhatók összefüggésbe megnövekedett halálozási aránnyal, míg kifejezett toxicitással járó antibiotikumok használata (például a kolisztin-monoterápiában vagy kombinált terápiában) megemelkedett mortalitás kockázatát hordozza (13, 14). Az utóbbi években számos új baktériumrezisztencia-kritérium került közzétételre, a rezisztenciaadatok és a klinikai kimenetel közötti korreláció javításának céljából: ilyenek a multiple antibiotic resistance (MAR) index (15, 16), szokásos gyógyszer-rezisztencia (UDR; meghatározása McDonell és munkatársai nevéhez fűződik) (17) és a nehezen kezelhető rezisztencia (DTR; meghatározása Kadri és munkatársai nevéhez fűződik) (18).
A humán orvoslás szempontjából a húgyúti fertőzések (UTI) a második leggyakoribb infekciók a fejlett országokban, így fontos morbiditási tényezőknek tekinthetők mind a járóbetegek, mind a kórházban ápolt betegek tekintetében (19, 20). Az UTI-k ezen kívül jelentős gazdasági terhet jelentenek az egészségügyi intézmények számára, beleértve gyógyszeres terápiájuk és a kórházi ellátás költségeit és a kezelésük miatt elveszített munkanapokat; az UTI-k által okozott gazdasági veszteségbecslések szerint körülbelül három milliárd dollár csak az Egyesült Államokban (21). Az UTI leggyakoribb okai a mind a közösségben szerzett, mind a nozokomiális infekciókban az Enterobacterales rend tagjai (az E. colit tekintik a legfontosabb etiológiai ágensnek, azonban a rend többi tagjának relevanciáját nem szabad alábecsülni) (22). Az UTI-k epidemiológiáját lokálisan (Szent-Györgyi Albert Klinikai Központ; Szeged, Magyarország) korábban már széleskörűen jellemeztük (23). A jelen tanulmány célja az E. coli- és Klebsiella fajok rezisztenciaszintjeinek vizsgálata lokálisan, egy 10 éves vizsgálati periódus alatt (2008–2017), amelyben a baktériumok rezisztenciáját meglévő és új kritériumok alapján osztályozzuk (amelyeket korábban még nem alkalmaztak az UTI-ban).
Anyag és módszer
Jelen tanulmányban mikrobiológiai- és rezisztenciaadatok retrospektív gyűjtése történt, a 2008. 01. 01 – 2017. 12. 31. közötti (10 éves) periódusra vonatkozóan az SZTE ÁOK Klinikai Mikrobiológiai Diagnosztikai Intézetében. A felhasznált adatok gyűjtését az intézet laboratóriumi információs rendszerének nyilvántartásában (LIS) végeztük, a tanulmány szempontjából releváns, Gram-negatív kórokozókra pozitív vizeletmintákra vonatkozóan. Azok a minták, kerültek bevonásra az elemzésbe, amelyekben a bacteriuria klinikailag szignifikánsnak volt tekinthető (>105 CFU/ml) és amelyek pozitívak voltak nitrit- és leukocitaészteráz-tesztekre (24). Betegenként csak az első izolátumot vontuk be az elemzésbe; azonban, az izolátumok eltérő antibiotikumérzékenységi mintázatot mutató, ugyanabból a betegből származó baktériumtörzseket egyedi izolátumoknak tekintettük.
A centrifugálatlan vizeletmintákból tíz mikrolitert oltottunk ki UriSelect kromogén agar (Bio-Rad, Berkeley, CA, USA), véres agar (bioMérieux, Marcy-l’Étoile, Lyon, Franciaország) és eozin-metilénkék agar (EMB; Bio-Rad, Berkeley, CA, USA) táptalajokra kalibrált kaccsal, a gyártó utasításai szerint; a lemezeket 37 °C-on inkubáltuk 24–48 órán át, aerob módon (25). A vizsgálati időszak első felében (2008–2012) preszumptív, biokémiai reakciókon alapuló módszerek és a VITEK 2 Compact ID/AST (bioMérieux, Marcy-l’Étoile, Franciaország) került alkalmazásra a baktériumok identifikálásra. 2013-tól bevezetésre került a mátrix-asszisztált lézerdeszorpció/-ionizáció repülési idő mérésén alapuló tömegspektrometriás (MALDI-TOF MS) módszer az intézet bakteriológiai laboratóriumában. A tömegspektrometriás méréseket a microFlex LT MALDI Biotyper segítségével végeztük (Bruker Daltonics, Bréma, Németország), a MALDI Biotyper RTC 3.1 szoftver használatával.
A releváns Gram-negatív baktériumok antibiotikumérzékenységi vizsgálatát az európai módszertani ajánlásoknak és szabványoknak (EUCAST 9.0-ás verzióig) megfelelően végeztük korongdiffúziós módszerrel (Liofilchem, Abruzzo, Olaszország) és E-tesztekkel (fosfomycinérzékenységi vizsgálat; Liofilchem, Abruzzo, Olaszország) a Müller–Hinton-agar lemezeken, illetve mikroleves-hígításos módszerrel (kolisztin esetén érzékenységi vizsgálat; MERLIN Diagnostik) végeztük (24). Az ellentmondásos eredmények ellenőrzése érdekében a VITEK 2 Compact ID/AST (bioMérieux, Marcy-l’Étoile, Franciaország) automatát használtuk. Az érzékenységi vizsgálat tartalmazta az E. coli és Klebsiella spp. baktériumokra vonatkozó releváns antibiotikumot, hogy lehetővé tegyék azok osztályozását a rezisztenciakategóriák szerint; ha genetikailag kódolt rezisztencia állt fenn, akkor a szóban forgó antibiotikumot kizártuk az elemzésből. Az alábbi kontrolltörzseket használtuk (QC): S. aureus ATCC 29213, E. faecalis ATCC 29212, P. mirabilis ATCC 35659, E. coli ATCC 25922, P. aeruginosa ATCC 27853, A. baumannii ATCC 19606 és Stenotrophomonas maltophilia ATCC 13637.
Az adatok elemzése során a bakteriális izolátumokat különféle rezisztenciakategóriákba soroltuk. Az izolátumokat akkor tekintették vad típusúnak/érzékenynek, ha érzékenyek az összes vizsgált antibiotikumra. Az izolátumok a szokásos rezisztencia- (UDR; usual drug resistance, McDonell és munkatársai) (17) kategóriába kerültek, ha legalább egy vizsgált antibiotikumra rezisztensnek bizonyultak. Az izolátumok osztályozása az MDR (rezisztencia legalább 1 antibiotikummal szemben legalább 3 antibiotikumcsoportban), XDR (csak két antibiotikumcsoporttal szemben megtartott az érzékenység) és PDR (rezisztens az összes ágensre) a CDC/ECDC-ajánlásokon alapult (11). A nehezen kezelhető rezisztenciát (DTR; difficult-to-treat resistance) Kadri és munkatársai (18) meghatározása szerint alkalmaztuk: ha egy izolátum karbapenemekkel (imipenem, meropenem és ertapenem), kiterjesztett spektrumú cefalosporinokkal és fluorokinolonokkal (ciprofloxacin, levofloxacin és moxifloxacin) szemben mutatott rezisztenciát (18). A módosított nehezen kezelhető rezisztencia (mDTR) esetén egy izolátum rezisztens volt a kiterjesztett spektrumú cefalosporinokkal, fluorokinolonokkal, fosfomycinnel és sulfametoxazol-trimetoprimmel szemben. E. coli esetében csak egy további kategóriát (mcDTR; módosított nehezen kezelhető rezisztencia az E. coli-ban) is bevezettünk, amely magában foglalja a nitrofurantoin-érzékenységi adatait is.
A statisztikai elemzéseket, ideértve a deszkriptív elemzéseket és a statisztikai teszteket (Student-féle t-teszt és Mann–Whitney U teszt) az IBM SPSS Statistics for Windows 24.0 (IBM Corp., Armonk, NY, USA) programmal végeztük. A változók normalitását Shapiro–Wilk-teszttel vizsgáltuk. Korrelációs analízist végeztünk, hogy meghatározzuk az UDR-izolátumok arányának időbeli változását a vizsgálati időszak alatt időszak alatt, amelynek során a determinációs együttható (R2) kiszámításra került sor. Ezeket az elemzéseket a Past 3.16 statisztikai szoftver alkalmazásával végeztük (Paleontológiai Múzeum, Oslói Egyetem; Oslo, Norvégia). A p-értékeket <0,05 tekintettük statisztikailag szignifikánsak.
Eredmények
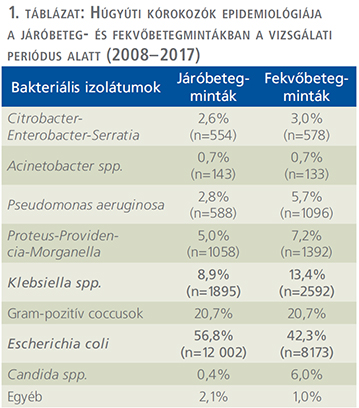
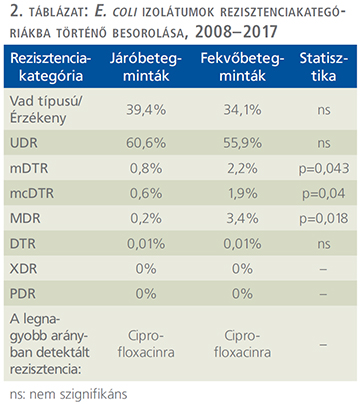
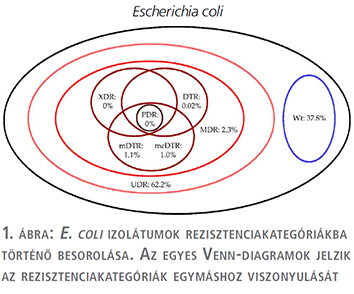
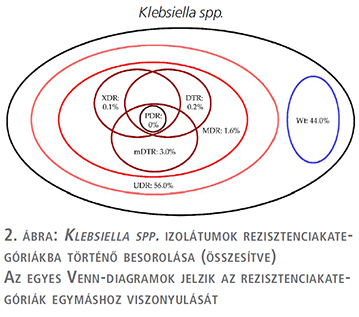
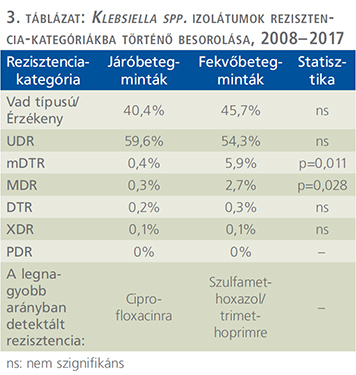
A tízéves vizsgálati periódus alatt (2008. január 1. és 2017. december 31. között) az Intézetbe 21 150 húgyúti kórokozóra pozitív vizeletminta érkezett járóbeteg-ambulanciákról és 19 325 pozitív minta járóbeteg-osztályoktól. Ezen minták közül n=16 240 (76,8%) járóbetegmintából és n=13 386 (69,3%) fekvőbetegmintából került izolálásra Gram-negatív baktérium (p=0,038). Az E. coli izolátumok száma a járó beteg mintákban (p=0,029), a Klebsiella spp. izolátumok száma a fekvőbetegmintákban (p=0,016) volt magasabb. Az izolátumok részletes eloszlását az 1. táblázat mutatja. Az E. coli izolátumok rezisztenciakategóriákba történő besorolását az 2. táblázat és az 1. ábra, a Klebsiella spp. izolátumok besorolását pedig a 3. táblázat és a 2. ábra tartalmazza.
Az UDR-izolátumok prevalenciája az E. coli izolátumokra vonatkozóan 2013-ban volt a legalacsonyabb és 2011-ben a legmagasabb (3. ábra), a Klebsiella spp. esetében 2017-ben volt a legalacsonyabb és 2011/2013-ban a legmagasabb (4. ábra); ugyanakkor az évek során statisztikailag szignifikáns összefüggést csak az E. coli fekvő beteg és a Klebsiella spp. járóbetegmintái esetén figyeltünk meg.
Az E. coli izolátumokra vonatkozóan a vad típusú törzsek 34,1-39,4%-át tették ki az összes izolátumnak, míg a Klebsiella spp. törzsek esetén 40,4-45,7%-ot (2. és 3. táblázat). Az UDR-státuszt leggyakrabban az E. coli törzsek ciprofloxacin-rezisztenciájának, a Klebsiella spp. törzsek esetén a ciprofloxacin vagy szumetrolim-rezisztenciájának tudható be. A járó- és fekvőbetegektől származó minták rezisztenciaviszonyait illetően az mDTR, mcDTR és MDR E. coli törzsek, illetve az mDTR és MDR Klebsiella spp. törzsek esetén volt megfigyelhető szignifikáns különbség (2. és 3. táblázat).
Megbeszélés
Jelen tanulmányban húgyúti patogének 10 éves periódusra vonatkozó rezisztenciaadatait elemeztünk ismert és újszerű indikátorok fényében. Az UTI-k etiológiájának és rezisztenciatrendjeinek vizsgálata lehetővé teszi azok célzott terápiáját a különböző egészségügyi intézményekben (26). Gram-negatív baktériumok antibiotikumokkal szembeni rezisztenciája a klinikumban fontos problémát jelent, a plazmidmediált karbapenem- és kolisztinrezisztencia esetén nagyon kevés terápiás lehetőség áll rendelkezésre (27). Az itt bemutatott adatok hasznosak lehetnek klinikai mikrobiológus, epidemiológus és közegészségügy szakembereknek. Az antibiotikumrezisztencia „klasszikus” osztályozásán kívül (MDR-XDR-PDR), a szakirodalomban leírtak új rezisztenciakategóriákat (nevezetesen UDR-t és DTR-t), amelyeket korábban nem alkalmaztak az UTI-kkal összefüggésben. Kiterjedt rezisztencia esetén a klinikusok kénytelenek olyan antibiotikumokat is alkalmazni a terápiában, amelyek hátrányos farmakológiai tulajdonságokkal rendelkeznek, mint például az aminoglikozidok (nefrotoxicitás, ototoxicitás, neurotoxicitás, rossz penetráció számos anatómiai régióba), tetraciklinek (különösen tigeciklin gyógyszerrezisztens fertőzések esetén; alacsony szérumszint és megnövekedett mortalitási ráta kezelt betegekben) és a kolisztin (nefrotoxicitás, neurotoxicitás, adagolási nehézségei, rossz penetráció számos anatómiai régióba) (28). A klasszikus rezisztenciaosztályozás (MDR-XDR-PDR) nagyon hasznos az epidemiológiai vizsgálatok során célokra; azonban nem feltétlenül korrelálnak jól a klinikai kimenetellel (29). A klinikumközpontú filozófiáján túlmenően, a DTR (és annak a jelen ebben a tanulmányban részletezett módosításai) a betegágy mellett és a klinikai gyakorlatban történő alkalmazása jelentős előnyökkel járhat a klinikai adatokkal összefüggésben (30).
Köszönetnyilvánítás
Gajdács Máriót a Magyar Tudományos Akadémia Bolyai János Kutatási Ösztöndíja (BO/00144/20/5), az Új Nemzeti Kiválóság Program (ÚNKP) Bolyai+ Ösztöndíja (ÚNKP-20-5-SZTE-330) és az ESCMID „30 under 30” Award támogatta.
References
1. Shallcross LJ, Howard SJ, Fowler T, Davies SC. Tackling the threat of antimicrobial resistance: From policy to sustainable action. Philos Trans R Soc Lond B Biol Sci 2015; 370: 20140082, doi: https://doi.org/10.1098/rstb2014.0082
2. Medina E, Pieper DH. Tackling Threats and Future Problems of Multidrug-Resistant Bacteria. Curr Top Microbiol Immunol 2016; 398: 3–33. doi: https://doi.org/10.1007/82_2016_492
3. Lyddiard D, Jones GL, Greatrex BW. Keeping it simple: Lessons from the golden era of antibiotic discovery. FEMS Microbiol Lett 2016; 363: fnw084. doi: https://doi.org/10.1093/femsle/fnw084
4. Hughes D, Karlén A. Discovery and preclinical development of new antibiotics. Ups J Med Sci 2014; 119: 162–169.
doi: https://doi.org/10.3109/03009734.2014.896437
5. Gajdács M. The concept of an ideal antibiotic: Implications for drug design. Molecules 2019; 24: e892.
doi: https://doi.org/10.3390/antibiotics8020052
6. Darrow JJ, Kesselheim AS. Drug development and FDA approval, 1938–2013. N Engl J Med 2014; 370: e39.
doi: https://doi.org/10.1056/NEJMp1402114
7. Santajit S, Indrawattana N. Mechanisms of Antimicrobial Resistance in ESKAPE Pathogens. Biomed Res Int 2016; 24: 75067.
doi: https://doi.org/10.1155/2016/2475067
8. Munita JM, Arias CA. Mechanisms of Antibiotic Resistance. Microbiol Spectr 2016; 4, 10.1128/microbiolspec.VMBF-0016-2015
doi: https://doi.org/10.1128/microbiolspec.VMBF-0016-2015
9. Rice LB. Federal funding for the study of antimicrobial resistance in nosocomial pathogens: No ESKAPE. J Infect Dis 2009; 197: 1079–1081.
doi: https://doi.org/10.1086/533452
10. Fridkin SK, Cleveland AA, See I, Lynfield R. Emerging infections program as surveillance for antimicrobial drug resistance. Emerg Infect Dis 2015; 21: 1578–1581. doi: https://doi.org/10.3201/eid2109.150512
11. Magiorakos AP, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect 2012; 18: 268–281. doi: https://doi.org/10.1111/j.1469-0691.2011.03570.x
12. Burnham JP, Lane MA, Kollef, MH. Impact of sepsis classification and multi-drug-resistance status on outcome among patients treated with appropriate ther-apy. Crit Care Med 2015; 43: 1580–6.
doi: https://doi.org/10.1097/CCM.0000000000001013
13. Zak-Doron Y, Benattar YD, Pfeffer I, Daikos DL, Skiada A, Antoniadou A, Durante-Mangoni E, et al. The Association Between Empirical Antibiotic Treatment and Mortality in Severe Infections Caused by Carbapenem-resistant Gram-negative Bacteria: A Prospective Study. Clin Infect Dis 2018; 67: 1815–1823. doi: https://doi.org/10.1093/cid/ciy371
14. Paul M, Daikos GL, Durante-Mangoti, E, Yahav D, Carmeli Y, Benattal DY, et al. Colistin alone versus colistin plus meropenem for treatment of severe infections caused by carbapenem-resistant Gram-negative bacteria: an open-label, randomised controlled trial. Lancet Infect Dis 2018; 18: 391–400. doi: https://doi.org/10.1016/S1473-3099(18)30099-9
15. Al-Dulaimi MMK, Mutalib SA, Ghani MA, Zaini NAM, Ariffin AA. Multiple Antibiotic Resistance (MAR), Plasmid Profiles, and DNA Polymorphisms among Vibrio vulnificus Isolates. Antibiotics 2019; 8: e68.
doi: https://doi.org/10.3390/antibiotics8020068
16. Gajdács M. Epidemiology and Resistance Levels of EnterobacteriaceaeIsolates from Urinary Tract Infections Expressed as Multiple Antibiotic Resistance (MAR) Indices. J Pharm Res Int 2019, 29: 1–7.
doi: https://doi.org/10.9734/jpri/2019/v29i330238
17. McDonnell A, Rex JH, Goosens H, Bonten M, Fowler VG, Dane A. Efficient Delivery of Investigational Antibacterial Agents via Sustainable Clinical Trial Networks. Clin Infect Dis 2016; 63: S57–S59.
doi: https://doi.org/10.1093/cid/ciw244
18. Kadri SS, Adjemian J, Lai YL, Spaulding AB, Ricotta E, Prevots DR, Palmore TN, et al. Difficult-to-Treat Resistance in Gram-negative Bacteremia at 173 US Hospitals: Retrospective Cohort Analysis of Prevalence, Predictors, and Outcome of Resistance to All First-line Agents. Clin Infect Dis 2018; 67: 1803–1814. doi: https://doi.org/10.1093/cid/ciy378
19. Wiedemann B, Heisig A, Heisig P. Uncomplicated urinary tract infections and antibiotic resistance-epidemiological and mechanistic aspects. Antibiotics 2014; 3: 341–352.
doi: https://doi.org/10.3390/antibiotics3030341
20. Calzi A, Grignolo S, Caviglia I, Calevo, MG, Losurdo G, Piaggio G, Bandettini R, Castagnola E. Resistance to oral antibiotics in 4569 Gram-negative rods isolated from urinary tract infection in children. Eur J Pediatr 2016; 175: 1219–1225. doi: https://doi.org/10.1007/s00431-016-2763-1
21. Simmering JE, Tang F, Cavanaugh JE, Polgreen LA, Polgreen PM. The Increase in Hospitalizations for Urinary Tract Infections and the Associated Costs in the United States, 1998–2011. Open Forum Infect Dis 2017; 4: ofw281. doi: https://doi.org/10.1093/ofid/ofw281
22. Gajdács M, Ábrók M, Lázár A, Burián K. Széles spektrumú béta-laktamáz-termelő (ESBL) húgyúti patogének kezelési lehetőségei: tapasztalatok a SZTE Szent-Györgyi Albert Klinikai Központban. Gyógyszerészet 2019; 63: 405–411.
23. Gajdács M, Bátori Z, Ábrók M, Lázár A, Burián K. Characterization of Resistance in Gram-Negative Urinary Isolates Using Existing and Novel Indicators of Clinical Relevance: A 10-Year Data Analysis. Life 2020; 10: e16.
doi: https://doi.org/10.3390/life10020016
24. Gajdács M, Burián K, Terhes G. Resistance Levels and Epidemiology of Non-Fermenting Gram-Negative Bacteria in Urinary Tract Infections of Inpatients and Outpatients (RENFUTI): A 10-Year Epidemiological Snapshot. Antibiotics 2019; 8: e143.
doi: https://doi.org/10.3390/antibiotics8030143
25. Gajdács M, Ábrók M, Lázár A, Burián K. Comparative Epidemiology and Resistance Trends of Common Urinary Pathogens in a Tertiary-Care Hospital: A 10-Year Surveillance Study. Medicina 2019; 55: e356.
doi: https://doi.org/10.3390/medicina55070356
26. Stefaniuk E, Suchocka U, Bosacka K, Hryniewicz W. Etiology and antibiotic susceptibility of bacterial pathogens responsible for community-acquired urinary tract infections in Poland. Eur J Clin Microbiol Infect Dis 2016; 35: 1363–1369.
doi: https://doi.org/10.1007/s10096-016-2673-1
27. Gajdács M. Pánrezisztens kórokozók által okozott többlethalálozás: mi áll valójában a szakirodalomban? Egészségfejlesztés 2019; 60: 29–35.
28. Nation RL, Garonzik SM, Thamlikitkul V, Giamarellos-Bourboulis EJ, Forrest A, Paterson DL, Li J, Silveira FP. Dosing Guidance for Intravenous Colistin in Critically Ill Patients. Clin Infect Dis 2017; 64: 565–571.
doi: https://doi.org/10.1093/cid/ciw839
29. Gajdács M, Ábrók M, Lázár A, Burián K. Microbiology of urine samples obtained through suprapubic bladder aspiration: A 10-year epidemiological snapshot. Dev Health Sci 2019; 2: 76–78.
doi: https://doi.org/10.1556/2066.2.2019.012
30. Abat C, Rolain JM, Dubourg G, et al. Evaluating the clinical burden and mortality attributable to antibiotic resistance: the disparity of empirical data and simple model estimations. Clin Infect Dis 2017; 65: S58–S63. doi: https://doi.org/10.1093/cid/cix346