Effect of PDE-5 inhibition on testicular ischemia/reperfusion injury in a rat model
DOI: 10.22591/magyurol.2021.2.oroszim.66
Authors:
Oroszi Márton dr.1, Szabó Andrea dr.2, Bajory Zoltán dr.1
1SZTE SZAKK, Urológiai Klinika, Szeged (igazgató: Bajory Zoltán dr.)
2SZTE, Sebészeti Műtéttani intézet, Szeged (igazgató: Boros Mihály dr.)
Summary
Introduction: During torsion, testicular tissue can suffer irreversible hypoxic damage within a short period of time. Therefore, testicular torsion requires an immediate solution. Because preoperative preparation takes time, a drug that may alleviate short- and long-term ischemic/reperfusion (I/R) damage to the testis administered preoperatively may be extremely important. In the present study, we demonstrate the beneficial effect of intravenous PDE-5 inhibitor sildenafil on microcirculatory damage following torsion in a rat model.
Material and method: 11 male Sprage-Dawley rats (250 g ± 10 g) were examined by fluorescent intravital video microscopy (IVM) to examine testicular microcirculation (erythrocyte flow rate and pulsatility in capillaries), before torsion, immediately after 60 min of torsion, and after 1-4. hours of reperfusion. The animals were randomly divided into 2 groups. In the first group animals received 0.7 mg/kg sildenafil intravenously in the at 50th minutes of torsion (n=5), while individuals in the control group received 1 ml/kg saline (solvent for sildenafil) intravenously at the 50th minutes (n=6).
Results: Following torsion, the flow rate and pulsatile flow pattern of RBCs deteriorated significantly in both groups. In the sildenafil-treated group, there was a significant improvement in study parameters compared to the control group at all-time points studied.
Conclusion: Intravenous sildenafil treatment improved I/R microcirculatory damage due to experimental testicular torsion. Based on these results, preoperative sildenafil therapy may also be beneficial in alleviating post-operative microcirculatory damage following clinical testicular torsion.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 33. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Bevezetés: Az uretero-ileo-cutaneostomia (Bricker-konduitképzés) Magyarországon elterjedt és leggyakrabban használt vizeletdeviációs módszer cystectomia esetén. A deviáció módja (ileum-konduit vagy ortotópikus hólyagpótlás) az onkológiai kimenetelt nem befolyásolja. Cystectomia után a felső húgyutakban megjelenő uroepitheliális tumorok a legjellemzőbb távoli kiújulást jelentő elváltozások. Az olyan betegek esetében, akiknél ileum-konduit-képzést vagy ortotóp hólyagpótlást követően felső húgyúti tumor megjelenésekor, a radikális nephroureterectomia jelent túlélést javító megoldást.
Esetbemutatás: Egy 63 éves férfi betegnél 2015-ben radikális cystectomia és uretero-ileo-cutaneostomia történt izominvazív hólyagtumor miatt. Kontrollvizsgálatokon rendszeresen megjelent, nagyobb szövődménye nem volt. 2020 szeptemberében a beteg sürgősséggel került felvételre, az Urológiai Klinikára stomából észlelhető masszív haematuria miatt. A vérzés forrása a bal szájadék urostomába szájadzásánál elhelyezkedő exophyticus tumor volt. Gyors előkészítést követően bal oldali nephroureterectomia és a Bricker-stoma explorációja mellett döntöttünk. A műtét során a tumor és a Bricker-kacs proximális végének reszekciója kivitelezhetőnek bizonyult a jobb oldali anasztomózis megkímélése mellett. A szövettani diagnózis pT3-uréter tumort igazolt.
Következtetések: A radikális cystectomián átesett betegek hosszú távú, életen át tartó követése különösen fontos. A felső húgyutakban akár sok év után is kialakulhat recidíva, amely akár a kirekesztett bélkacsba is propagálhat. Az urétero-enterális anasztomózis szintjében megjelenő urotheliális recidív tumorok esetén is lehetséges a konduit megkímélése.
Bevezetés
A heretorzió (HT) az egyik leggyakoribb sürgősségi műtéti indikáció a gyermekek, serdülők és fiatal felnőttek körében. A torzió előfordulása 100 000 férfiből 3,8–4,5-et érint (1, 2). A gyors diagnózis és a kezelés elengedhetetlen, mivel a szöveti károsodás mértéke a hipoxia időtartamával arányosan növekszik (2–4).
A műtéti beavatkozás 90-100%-ban sikeres, ha a panaszok megjelenésétől számított 4-8 órán belül elvégzik azt. A teljes sikeresség azonban az idő múlásával drasztikusan csökken (12 órán belül 50%, 24-nél pedig csak 10%) (5). A jelentős mikrocirkulációs károsodás és a tartós hipoxia visszafordíthatatlan károsodást okozhat, a fájdalom megjelenésének 6. órájától kezdve (2). Amint azt korábban Gandhi és munkatársai leírták, a szildenafil javíthatja a herék mikrocirkulációját, amely által mérséklődik a hipoxiával összefüggő irreverzibilis sejtpusztulás és javul a prognózis is. A herék iszkémiás/reperfúziós (I/R) károsodása közvetlenül is csökkenthető antioxidánsok alkalmazásával is (6). A here károsodása (torzió/detorzió során) két különálló mechanizmusból származhat. Az első mechanizmus szerint is a funiculus spermaticus torziója drámai módon csökkentheti vagy leállíthatja a herék vérbeáramlását, ami állandó hipoxiát és azt követő sejthalált okozhat. A funiculus elzáródása következtében a hereszövetben a hipoxia csökkent ATP-szintet okoz. Az ATP nélkül az elengedhetetlen folyamatok nem tudnak végbemenni, ezért kiváltják a sejthalált. Régóta ismert, hogy a hypoxaemia hossza és a sejtkárosodás súlyossága fordított arányban változik (7). A második mechanizmus részeként a reaktív oxigéngyökök (ROS) a reperfúziót követően okozhatnak károsodást (reperfúziós károsodás). Közvetlenül a véráramlás helyreállítása után megkezdődik a ROS-képződés. A reaktív oxigéngyökök egy bizonyos koncentráció felett károsítják a posztiszkémiás szöveteket, beleértve az endotheliális barrierfunkció romlását, az endothelsejt-eredetű adhéziós molekula-expresszió fokozódását, a fokozott leukocita-endothelsejt-adhéziót és a gyulladásos mediátorok termelődését (pl. thrombocytaaktiváló-faktor) (7, 8). A leukocitákban elsősorban a nikotinamid-adenin-dinukleotid-foszfát (NADPH)-oxidáz felelős a ROS képződéséért (9).
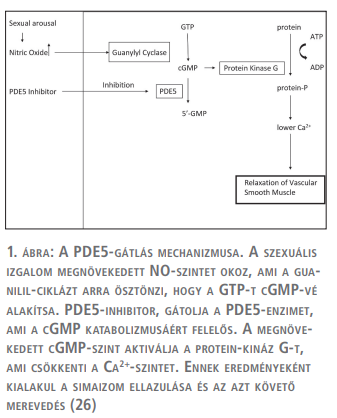
A here mikrocirkulációjának dinamikus, térbeli jellemzésére elsősorban a fluoreszcens intravitális videomikroszkópia (IVM) és az ortogonális polarizációs spektrális képalkotás alkalmazható kísérletes körülmények között in vivo (10). Feltételezésünk szerint, mivel a szildenafil fokozza az erek dilatációját a simaizom relaxációjának fenntartása révén (1. ábra), pozitív hatással lehet a torziót követően kialakult érkárosodásokra. Így jelen tanulmányunkban a foszfodiészteráz-5 (PDE5)-gátló szildenafil, here mikrocirkulációra gyakorolt hatását kívántuk vizsgálni intravitális mikroszkópiás (IVM) módszerrel a vörösvértestek sebességének (VVTS, Red Blood Cell Velocity – RBCV) akut változása és a kapillárisok áramlási mintázata szempontjából here I/R során patkányon.
Anyagok és módszerek
Kísérleteinket a hatályos nemzetközi és hazai állatjóléti szabályokkal összhangban, az Állatkísérleti Tudományos Etikai Tanács és a Szegedi Tudományegyetem Munkahelyi Állatvédelmi Bizottsága által jóváhagyott etikai engedélyeknek megfelelően végeztük (11).
Kísérleti csoportok
Hatvanperces HT-t hajtottunk végre hím Sprague–Dawley-patkányokon (súly: 250±10 g, n=11). Az állatokat véletlenszerűen két csoportba osztottuk. A szildenafilt, 0,7 mg/kg dózisban (1 ml/kg sóoldatban oldva, iv.) oldva, intravénásan adtuk be, 10 perccel a reperfúzió előtt (torzió + SIL-csoport, n=5), míg a kontrollállatok sóoldatot kaptak (1 ml/kg sóoldat iv. + torzió, n=6). A herék mikrocirkulációját fluoreszcens IVM-vel vizsgálatuk a torzió előtt, közvetlenül utána és minden órában a 4 órás reperfúziós periódus során.
Sebészeti feltárás
A narkózist nátrium-pentobarbitál intraperitoneális (45 mg/kg) oltása révén hoztuk létre. A tracheát intubáltuk a szükséges oxigénszintjének fenntartása céljából. A jugularis vénát is izoláltuk és kanüláltuk Ringer-laktát infúziója 10 ml/kg/h sebességgel, a homeosztatikus térfogatstabilitás fenntartása, pentobarbitál
5 mg/kg-os adagolása, az anesztézia fenntartása és szildenafil vagy sóoldat adása érdekében. A nyaki artériát izoláltuk a vérnyomásméréshez (Experiment Kft., Budapest, Magyarország). Ezt követően a here izolálását végeztük el, megóvva az ereket, a tunica albugineat és a funiculus spermaticust. Végül a művi heretorzió elvégzése érdekében a herét 720o-kal elforgattuk az óramutató járásával megegyező irányba, 60 percig fenntartva a hipoxiát.
A herék mikrocirkulációjának monitorozása
A 60 perc torzió után fluoreszcein-izotiocianáttal jelzett vörösvértesteket (0,2 ml intravénásan, Sigma Aldrich) injektáltunk a juguláris vénán keresztül. Ezt követően a heréket izoláltuk. A posztkapilláris venulákat Zeiss Axiotech Vario 100HD mikroszkóppal, 100 W HBO higanylámpával és Acroplan 20× vízimmerziós objektívvel (Carl Zeiss GmbH, Jena, Németország) vizsgáltuk és a mikrokeringésről készült videofelvételeket számítógéphez csatlakoztatott videokamerával (AVT HORN -BC 12, Aalen, Németország) rögzítettük (11). Minden időpillanatban legalább 5 posztkapilláris venulában vizsgáltuk a VVTS-t és a pulzáló mintázat jelenlétét (2. ábra).
Statisztikai analízis
Az időbeli- és csoportok közötti különbségeket kétutas ANOVA-teszttel hasonlítottuk össze SigmaStat® for Windows® statisztikai program segítségével (Jandel Corporation, San Rafael, CA, USA).
Eredmények
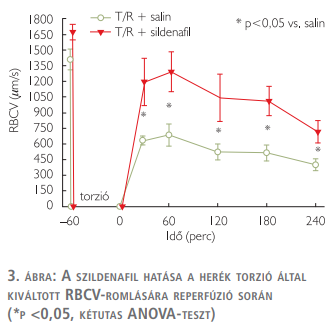
A here mikrokeringését kiindulási állapotban egy pulzatilis keringési mintázat és homogén mikrokeringés jellemezte a kapillárisokban. A heretorzió a mikrocirkulációs teljes mértékű leállását eredményezte a herék kapillárisaiban. A reperfúzió a VVTS jelentős romlásával járt (az összes posztiszkémiás érték alacsonyabb volt, mint a kiindulási érték mindkét csoportban) (p <0,05). A detorzió után csak a szildenafillal kezelt csoportban tért vissza a pulzáló véráramlási mintázat. A szildenafilkezelés szintén szignifikánsan magasabb VVTS-értékeket okozott (minden vizsgálati időpillanatban) a kontrollcsoporthoz képest (p <0,05, 2 mintás ANOVA-vizsgálattal mérve), habár a véráramlási értékek így is a kiindulási szint alatt maradtak ebben a csoportban is (3. ábra).
Megbeszélés
Jelen tanulmányban a szildenafil mikrocirkulációra gyakorolt hatását vizsgáltuk patkányhere I/R előtt, alatt és után. Kimutattuk, hogy a szildenafil jelentősen javítja a posztkapilláris venulákban a VVT-k áramlási sebességét és visszaállítja az áramlás pulzatilitását.
A heretorzió klinikai diagnózisához elsősorban a pontos anamnézis (hirtelen és kifejezett fájdalom a herében) szükséges. Elengedhetetlen azonban a fizikális vizsgálat, illetve Doppler-ultrahangvizsgálat a csökkent véráramlás megerősítése céljából (3). Mivel a here leggyakrabban mediális irányba torquálódik, fizikális vizsgálat során az érintett herét, belülről kifelé irányuló tekeréssel detorquálhatjuk. Az esetek egyharmadában azonban laterális irányba csavarodik a here (9), így az előzővel ellentétes irányú manőverrel próbálkozhatunk. Manuális detorzió sikertelensége esetén akut műtétet kell elvégezni. A sikeres műtétet követően is azonban reperfúziós károsodás fordulhat elő, amely további szövetkárosodást okozhat. A leukociták jelentősen hozzájárulnak a herekárosodáshoz a NADPH-oxidáz általi reaktív oxigéngyök-képződés révén (12–15). Meddőség és azoospermia is előfordulhat hosszú távon, elsősorban a spermiumok morfológiai károsodása és a műtét utáni spermiumellenes antitestek képződése miatt (16).
A szildenafil jótékony hatását számos más szervben I/R során igazolták korábban. Egy nemrégiben készült tanulmányban Behmengurt és munkatársai patkányokban a foszfodiészteráz-5 (PDE5)-inhibitor akut kardioprotektív hatását vizsgálták a mitokondriális Ca2+-szenzitív káliumcsatornák vonatkozásában. 30 perc iszkémiát, majd 60 perc reperfúziót hoztak létre és 10 perccel az iszkémia előtt alkalmazták a szildenafilt, amelynek hatására jelentősen csökkent az infarktus nagysága (17). A kísérleteinkben is alkalmazott szildenafildózis (0,7 mg/kg, iv.) Ockaili és munkatársai tanulmányában is mérsékelte a szívizom elhalását (18). Kolettis és munkatársai különböző szildenafildózisokat vizsgálták (alacsony dózis [0,7 mg/kg], magas dózis [1,4 mg/kg] I/R [20 perc/45 perc]) károsodáson átesett szívizomban, ahol az alacsonyabb dózisú kezelés kedvező hatását igazolták a bal kamrai kontraktilitásra (19). A gyomornyálkahártya-károsodást azonban a PDE5-inhibitor nagy dózisa csökkentette az indometacinnal kiváltott gastritisben patkányokban (20).
A PDE5-gátlás kedvező hatását a herében is több kutatócsoport leírta. Zavras és munkatársai az eritropoetin (EPO) (1000 NE/kg) és a szildenafil (0,7 mg/kg) hatását vizsgálta I/R-károsodást követően patkányherékben. Az iszkémia 60. percében alkalmazták a kezeléseket, majd további 30 perc múlva szüntették meg az iszkémiát és 24 órás reperfúzió után végeztek hisztopatológiai vizsgálatot a heréken. Mindkét kezelés szignifikáns mértékű morfológiai javulást eredményezett, de a szildenafil hatása az EPO-hoz képest is kedvezőbb volt (21).
Egy másik tanulmányban Beheshtian és munkatársai a szildenafilt a 60 perces torzió alatt, a torzió 30. percében, intraperitonealisan adták patkányoknak. A szildenafil jelentősen mérsékelte a szabadgyök-károsodással összefüggő paramétereket (malondialdehid-szint, katalázaktivitás) 4 órás reperfúzió során, illetve mérsékelte az apoptotikus sejtmagok számát 24 órás reperfúzióban (22).
Yildiz és munkatársai 2 órás heretorziót, majd 2 órás reperfúziót indukálnak és a torzió 60. percében adták a szildenafilt (0,7 mg/kg és 1,4 mg/kg dózisokban). A reperfúzió második órája után megvizsgálták a laboratóriumi paramétereket (23, 24). Szignifikánsan kedvezőbb eredményeket detektáltak abban a csoportban, ahol a patkányok 0,7 mg/ml szildenafillel voltak kezelve, összehasonlítva azokkal a csoportokkal, ahol a patkányok 1,4 mg/ml szildenafilt kaptak és a kontrollcsoport értékeihez képest a szöveti glutation és maldialdehid, valamint a nitrogén-monoxid-szintek vonatkozásában (24).
Istanbulluoglu és munkatársai orálisan beadott PDE5-gátló (vardenafil) hatását vizsgálták sertésekben, heréjük I/R károsodását követően 2 órás torziót követően és 45 perccel a torzió vége előtt szájon adták be a vardenafilt (0,4 mg/kg). 8 órás reperfúzió után a herék ún. apoptózis-proteáz-aktiváló faktor (APAF-1) mennyiségi változásán keresztül vizsgálták a csírasejtek apoptózisát (25), Nem találtak szignifikánsan javulást a vardenafillal kezelt csoportban a kontrollcsoporthoz képest, amely eredmény vélhetően az alkalmazott PDE5-inhibitor alacsony koncentrációjának köszönhető.
A fenti vizsgálatok bizonyítják a szildenafil védő hatását here I/R-károsodást követően, annak ellenére, hogy mind az iszkémia, mind pedig a reperfúzió jelentős szövetkárosodást okoz a herében. Vizsgálatunknak ugyan számos limitációja van, hiszen a vizsgálatba bevont patkányok száma viszonylag kevés volt és hosszú távú követés sem történt meg, ám eredményeink egyértelműen igazolják a szildenafil protektív hatását a korai mikrocirkulációs paraméterek vonatkozásában 1 óra torziót követően.
References
Az iszkémia alatt elkezdett intravénás szildenafilkezelés javítja a here a mikrocirkulációját I/R-károsodást követően, ami kihathat a here hosszabb távú károsodásának mérséklésére és a fertilitás megtartására is.
References
1. Williamson RC. Torsion of the testis and allied conditions. Br J Surg 1976; 63(6): 465–76.
https://doi.org/10.1002/bjs.1800630618
2. DaJusta DG, et al. Contemporary review of testicular torsion: new concepts, emerging technologies and potential therapeutics. J Pediatr Urol 2013; 9(6 Pt A): 723–30.
https://doi.org/10.1016/j.jpurol.2012.08.012
3. Fehér ÁM, Bajory Z. A review of main controversial aspects of acute testicular torsion. Journal of Acute Disease 2015; 5(1): 1–8.
https://doi.org/10.1016/j.joad.2015.06.017
4. Gatti JM, Patrick Murphy J. Current management of the acute scrotum. Semin Pediatr Surg 2007; 16(1): 58–63.
https://doi.org/10.1053/j.sempedsurg.2006.10.008
5. Sharp VJ, Kieran K, Arlen AM. Testicular torsion: diagnosis, evaluation, and management. Am Fam Physician 2013; 88(12): 835–40.
6. Gandhi J, et al. Testicular compartment syndrome: an overview of pathophysiology, etiology, evaluation, and management. Transl Androl Urol 2016; 5(6): 927–934.
https://doi.org/10.21037/tau.2016.11.05
7. Granger DN, Kvietys PR. Reperfusion injury and reactive oxygen species: The evolution of a concept. Redox Biol 2015; 6: 524–551.
https://doi.org/10.1016/j.redox.2015.08.020
8. Bradley JR, Johnson DR, Pober JS. Endothelial activation by hydrogen peroxide. Selective increases of intercellular adhesion molecule-1 and major histocompatibility complex class I. Am J Pathol 1993; 142(5): 1598–609.
9. Sessions AE, et al. Testicular torsion: direction, degree, duration and disinformation. J Urol 2003; 169(2): 663–5.
https://doi.org/10.1097/00005392-200302000-00059
https://doi.org/10.1016/S0022-5347(05)63987-0
10. Bajory Z, et al. Orthogonal polarization spectral imaging: a novel tool for examination of microcirculatory changes in the testis. J Androl 2012; 33(3): 499–504.
https://doi.org/10.2164/jandrol.111.013599
11. Bajory Z, et al. Microcirculatory effects of selective endothelin-A receptor antagonism in testicular torsion. J Urol 2014; 192(6): 1871–7.
https://doi.org/10.1016/j.juro.2014.06.086
12. Endrich B, et al. Technical report – a new chamber technique for microvascular studies in unanesthetized hamsters. Res Exp Med (Berl) 1980; 177(2): 125–34.
https://doi.org/10.1007/BF01851841
13. Menger MD, Marzi I, Messmer K. In vivo fluorescence microscopy for quantitative analysis of the hepatic microcirculation in hamsters and rats. Eur Surg Res 1991; 23(3–4): 158–69.
https://doi.org/10.1159/000129148
14. Messmer K, Krombach F. [Microcirculation research in experimental surgery]. Chirurg 1998; 69(4): 333–8.
https://doi.org/10.1007/s001040050422
15. Szabo A, et al. Possible relationship between histamine and nitric oxide release in the postischemic flow response following mesenteric ischemia of different durations. Shock 1997; 7(5): 376–82.
https://doi.org/10.1097/00024382-199705000-00011
16. Arap MA, et al. Late hormonal levels, semen parameters, and presence of antisperm antibodies in patients treated for testicular torsion. J Androl 2007; 28(4): 528–32.
https://doi.org/10.2164/jandrol.106.002097
17. Behmenburg F, et al. Impact of Mitochondrial Ca2+-Sensitive Potassium (mBKCa) Channels in Sildenafil-Induced Cardioprotection in Rats. PLoS One 2015; 10(12): e0144737.
https://doi.org/10.1371/journal.pone.0144737
18. Ockaili R, et al. Sildenafil (Viagra) induces powerful cardioprotective effect via opening of mitochondrial K(ATP) channels in rabbits. Am J Physiol Heart Circ Physiol 2002; 283(3): H1263–9.
https://doi.org/10.1152/ajpheart.00324.2002
19. Kolettis TM, et al. Dose-dependent effects of sildenafil on post-ischaemic left ventricular function in the rat isolated heart. J Pharm Pharmacol 2010; 62(3): 346–51.
https://doi.org/10.1211/jpp.62.03.0009
20. Karakaya K, et al. Mitigation of indomethacin-induced gastric mucosal lesions by a potent specific type V phosphodiesterase inhibitor. World J Gastroenterol 2009; 15(40): 5091–6.
https://doi.org/10.3748/wjg.15.5091
21. Zavras N, et al. Comparison of erythropoietin and sildenafil protective role against ischemia/reperfusion injury of the testis in adult rats. Int Urol Nephrol 2014; 46(4): 731–6.
https://doi.org/10.1007/s11255-013-0569-x
22. Beheshtian A, et al. Protective effects of sildenafil administration on testicular torsion/detorsion damage in rats. World J Urol 2008; 26(2): 197–202.
https://doi.org/10.1007/s00345-008-0243-6
23. Yildiz H, et al. Effects of sildenafil citrate on torsion/detorsion-induced changes in red blood cell and plasma lipid peroxidation, antioxidants, and blood hematology of male rats. Eur J Obstet Gynecol Reprod Biol 2011; 159(2): 359–63.
https://doi.org/10.1016/j.ejogrb.2011.07.023
24. Yildiz H, et al. Dose-dependent protective effect of sildenafil citrate on testicular injury after torsion/detorsion in rats. Andrologia 2012; 44(Suppl 1): 300–6.
https://doi.org/10.1111/j.1439-0272.2011.01181.x
25. Istanbulluoglu MO, et al. Effects of vardenafil on testicular torsion/detorsion damage: an experimental study in pigs. Urol Int 2011; 86(2): 228–32.
https://doi.org/10.1159/000321492
26. Corbin JD. Mechanisms of action of PDE5 inhibition in erectile dysfunction. Int J Impot Res 2004; 16(Suppl 1): p. S4–7.
https://doi.org/10.1038/sj.ijir.3901205