Test methods and indications for DNA fragmentation analysis of spermatozoa
DOI: 10.22591/magyurol.2021.3.mateg.125
Authors:
Máté Gábor dr.1,2, Balló András dr.1,2, Török Attila dr.1
1Pannon Reprodukciós Intézet, Tapolca (igazgató: Török Attila dr.)
2Pécsi Tudományegyetem, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
Summary
Male infertility is a problem that affects about half of couples in infertility treatment. In reality, this number may be much higher, as recent research confirms that infertility of idiopathic origin (15-30% of cases), when no problems are found in conventional andrological examinations, increased sperm DNA fragmentation value can be detected. However, it is not the only case when an increased DNA fragmentation can be observed. Several studies have found an increase in the DNA fragmentation index in couples with habituated abortions, multiple failed assisted reproduction cycles, leukocytospermia, varicocele, high sperm reactive oxygen radicals, and so on. In our manuscript we would like to present the indications in the literature for sperm DNA fragmentation testing and DNA fragmentation testing methods.
LAPSZÁM: MAGYAR UROLÓGIA | 2021 | 33. ÉVFOLYAM, 3. SZÁM
Összefoglalás
A férfi eredetű meddőség a meddőségi kezelésben résztvevő párok mintegy felét érintő probléma. A valóságban ez a szám sokkal nagyobb is lehet, mivel a legújabb kutatások egyre inkább alátámasztják, hogy az ismeretlen eredetű meddőség esetén (az esetek 15-30%-a), amikor a hagyományos andrológiai vizsgálatok során semmilyen problémát nem találunk, akkor sok esetben emelkedett, illetve magas spermium DNS-fragmentációs érték detektálható. Azonban nem csak ebben az esetben figyelhető meg emelkedett DNS-fragmentáció. Több kutatásban is a DNS-fragmentációs index megemelkedését tapasztalták habituális vetélő hölgyek párjainál, többszöri sikertelen lombikbeavatkozás esetén, leukocytospermia esetén, a varicocele-vel küzdőknél, magas spermium reaktív oxigénszabadgyök-értéknél stb. Kéziratunkban szeretnénk bemutatni a szakirodalomban felelhető indikációit a spermium DNS-fragmentáció vizsgálatnak és a DNS-fragmentáció vizsgálati módszereit.
Bevezetés
A meddőség több mint a párok 15%-át érinti világszerte és az esetek 50%-ában kapcsolódik a férfi partnerhez (1). A férfiak kivizsgálása alapvetően a hagyományos ondóvizsgálatokon alapszik, amelyek nem tükrözik teljes egészében a meddőségi kezelés várható sikerét, gondoljunk csak arra, hogy a páciensek mintegy 15-30%-a ismeretlen eredetű meddőséggel küzd, amely esetekben teljesen normális spermiogram tapasztalható (2). A spermiumkoncentráció, a motilitás és a morfológia meghatározása nem ad kellő információt a spermiumok DNS-állományának intaktságáról, fragmentáltságáról (DNS-fragmentáció – DF) (3). Bizonyos összefüggések megfigyelhetően az abnormális spermiogram (pl.: súlyos oligoasthenoteratozoospermia-szindróma vagy asthenozoospermia) és DF emelkedése között, de normozoospermia esetén semmilyen paraméter nem utal DF-re, csak a direkt vizsgálat (4, 5).
Habár úgy tűnik, hogy a petesejtek megtermékenyülésére nincs igazán hatással a spermium DF, azonban számos metaanalízis bizonyítja, hogy az embriók fejlődését, az implantációt és a terhességet már annál inkább negatívan befolyásolhatja az emelkedett DF (6, 7). A nemzetközi tendenciák mindinkább afelé mutatnak, hogy a hagyományos spermiogram felvétele mellett a spermiumok DF meghatározásának is részét kell képeznie a meddőségi betegellátásnak, hiszen a spermium, a petesejt és a képződő embrió örökítő anyagának stabilitása elengedhetetlen a sikeres fogantatáshoz (8). Bár a DF vizsgálati technológiája több évtizedes múltra tekint vissza, andrológiában, in vitro fertilizációban (IVF) történő rutinszerű alkalmazása csak az utóbbi néhány évben/évtizedben került előtérbe, hazánkban pedig teljesen gyerekcipőben jár. Ebből kifolyólag kéziratunk célja, hogy összefoglaljuk a DF vizsgálatának módszereit és indikációit a nemzetközi szakirodalom alapján.
A DNS-fragmentáció vizsgálatának indikációi
A DF kialakulásához mind külső, mind pedig belső tényezők hozzájárulhatnak. Külső tényező lehet a magas hőmérséklet, a drogok fogyasztása, a toxinoknak való kitettség, a dohányzás, a sugárzás vagy a kemoterápia; míg belső tényező a sérült spermiumérési folyamat, valamilyen fertőzés/gyulladás/leukocytospermia, a magas BMI, a varicocele, egy daganatos megbetegedés, vagy a diabetes mellitus stb. (9). Ezek mindegyikében közös, hogy kapcsolatba hozhatóak reaktív oxigén-szabadgyökök (ROS) képződésével, amelyek oxidatív károsodásokhoz vezethetnek. A ROS-ok nélkülözhetetlenek számos fiziológiai folyamathoz, spermiumok esetében például az akroszómareakcióhoz, illetve a kapacitációhoz, de a spermium-petesejt fúzióhoz is elengedhetetlenek (10). Kórosan megemelkedett koncentrációjuk azonban számos káros hatás kifejtésére képes, rendkívül reaktívak, képesek az élő sejteknek gyakorlatilag bármilyen összetevőjével reakcióba lépni, károsítani azt, úgy, mint a szénhidrátokat, fehérjéket, lipideket, de magát az örökítő anyagot is, amely utóbbinak fragmentálódása hibás génátírást vagy hibás kromoszóma-szegregációt, aneuploidiát okozhat (11).
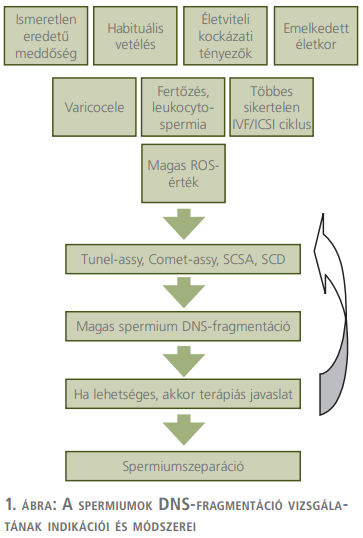
Az alábbiakban tekintsük át milyen indikációk lelehetők fel a szakirodalomban (1. ábra):
- Ismeretlen eredetű meddőség: kutatások alapján az ismeretlen eredetű meddőséggel diagnosztizált pároknál, a férfiak 20-30%-a küzd 30% feletti DF-értékkel (12). Az ilyen esetek egy jó részében a mellékherében vagy az ondóvezetékben eltöltött idő alatt károsodhat a spermiumok DNS-állománya (13).
- Habituális vetélés: több kéziratban vizsgálták, hogy azoknál a pároknál, ahol legalább két vetélés történt a huszadik terhességi hét előtt, ott szignifikánsan magasabb spermium DF volt kimutatható a kontrollcsoporthoz viszonyítva. Amennyiben az ivarsejtek, illetve a belőlük képződő embrió genetikai állományában valamilyen súlyos hiba található, akkor sok esetben vagy ki sem alakul a terhesség, vagy pedig korai vetéléssel végződik (7, 14, 15).
- Életviteli kockázati tényezők: több tanulmány is született már bizonyos életviteli faktorokról, mint DF-et súlyosbító tényezőkről. Ezek nem más, mint: a sugárzás, a magas hőmérséklet, a kemikáliák, a dohányzás, az alkoholfogyasztás, a drogok, túlsúly, cukorbetegség stb. Nagyon fontos megemlíteni, hogy ezeknek a kockázati tényezőknek hosszú távú fennállására van szükség, hogy a negatív hatás megnyilvánuljon (16–18).
- Emelkedett életkor: ahogy a hölgyek esetében azt már régóta tudjuk, az életkor növekedésével párhuzamosan a petesejtek kromoszómális rendellenességei is emelkednek, egyre nagyobb az esélye az aneuploidiának (19). Hasonló jelenség figyelhető meg a férfiaknál is. Albani és munkatársai (20) munkájában idősebb férfiaknál szignifikánsan magasabb spermium DF-értékeket mértek. Több esetben is azonos eredményt publikáltak (21, 22). A problémát az jelentheti, hogy nincs egységes állásfoglalás azzal kapcsolatban, hogy mi minősül a férfiaknál magas életkornak.
- Varicocele: a klinikai varicocele-vel küzdő férfiak ondómintájában szignifikánsan magasabb ROS-tartalom és alacsonyabb antioxidáns szint mérhető, amivel párhuzamosan megemelkedett DF is tapasztalható (23–25). Ami még inkább bizonyítja, hogy a varicocele és a DF között szoros korreláció áll fen, hogy varicocelectomia után szinte minden esetben csökkennek az előbbiekben említett markerek szintjei (DF és ROS) és akár a spontán fogantatás esélye is fennáll (26).
- Leukocytospermia és fertőzések: a meddőséggel küzdő férfiak akár több, mint 15%-ánál előfordulhat valamilyen fertőzés és leukocytospermia (27). Ami közös ezekben az esetekben, hogy maga a fertőzés, illetve annak szervezet általi leküzdése is ROS-képződéssel és oxidatív stresszel jár, ami pedig megemelkedett DF-et okozhat (28). Mind a fertőzésekre, mind a leukocytospermiára hatékony kezelésként szolgálhatnak különféle antibiotikumterápiák, amelyek a betegség leküzdésén túl, „mellékhatásként” a megemelkedett DF-szint csökkentésére is alkalmasak (29).
- Többszöri sikertelen IVF/ICSI (in vitro fertilizáció/intra-citoplazmatikus spermiuminjektálás) beavatkozás: mind a fentebb említett vetéléshez, mind pedig a sikertelen IVF/ICSI-beavatkozáshoz hozzájárulhat az emelkedett spermium DF. Több munkában is szoros negatív korrelációt találtak a spermiumok DF emelkedése és a terhességi ráta csökkenése között (6, 30, 31).
- Az ondómintán mért magas ROS-tartalom, vagy valamilyen oxidatív stresszel kapcsolatos paraméter: a DF hátterében közvetett vagy közvetlen módon, de majdnem minden esetben a ROS-ok állnak. In vitro kísérletekben humán spermiumokat kezeltek 5 órán keresztül 0,001% H2O2-dal, mint oxidatív stresszt okozó ágenssel, és szignifikáns csökkenést tapasztaltak a DNS integritásában (32). Hasonló eredményeket publikáltak más vizsgálati rendszereken is, például halak spermiumain (33). A ROS-ok és a kiváltott oxidatív károsodások ellen hasznos terápiaként szolgálhatnak különféle antioxidáns terápiák, amelyek több klinikai vizsgálatban is bizonyítottak már (34, 35). A problémát az jelenti, hogy ez idáig nem született egységes protokoll a használatukra, illetve indokolatlan, vagy utánkövetés nélküli túlzott használatuk ártalmas is lehet a kiváltott reduktív stressz miatt (36).
DNS-fragmentáció vizsgálati technikák és azok határértékei
Fennálló indikáció esetén alapvetően négy módszer közül választhatunk, hogy meghatározzuk a spermiumok DF mértékét (1. ábra):
- Tunel-assay: a terminal deoxinukleotidil-transzferáz d-UTP
Nick End Labeling (TUNEL) assay a DNS kettős spiráljában elhelyezkedő DNS-töréseket detektálja, azok szabad 3’-OH végeire általában deoxyuridint (dUTP) épít be enzimatikusan, amely dUTP-hez fluorofórok konjugálhatóak. A módszer leginkább az egyszálú DNS-törések detektálására alkalmas, a fluorofórok által emittált jel pedig egyenesen arányos a DNS-törések mennyiségével. A detektáláshoz használhatunk vagy fluoreszcens mikroszkópot, vagy pedig áramlási citométert. A nemzetközileg megállapított határérték, amely felett magas DF-ről beszélhetünk, az 17% (37), de Javed és munkatársai (38) munkájában ez az érték 22% volt. - Comet-assay: egy elektroforézisen alapuló detektálási technika.
Alapja, hogy a DNS-molekula negatív töltéssel rendelkezik, elektromos térbe helyezve a pozitív irányba fog vándorolni. Az intakt DNS-állomány a vándorlás során egy, jól definiált csoportba fog tömörülni, ez a comet „feje”. A fragmentált DNS-állomány viszont a fragmentek méretének megfelelően szét fog válni, egy „farokra” hasonlító képet adva (39). Ha egyáltalán nem figyelhető meg feji rész, akkor 100% DF-ről beszélhetünk. Kiértékelése történhet pusztán vizuálisan, illetve szoftveresen is, amely kvantitatív eredménnyel szolgál. A módszer alkalmas egy- és kétszálú DNS-törések detektálására. A szakirodalomban nem lelhető fel egységes határérték spermium DF terén (25% és 50% között változik), amely annak köszönhető, hogy a mintakészítési protokoll számos olyan lépést tartalmaz, ami nagy tapasztalatot igényel – emiatt a klinikumban talán legkevésbé alkalmazott módszer –, emiatt rendkívül időigényes és nagy a laborok közötti szórás (38). - Sperm Chromatin Dispersion (SCD) assay: a DF vizsgálatára alkalmas technikák közül talán az egyik legkevesebb speciális berendezést igénylő technika, egyszerűen fénymikroszkópiával, brightfield optika segítségével végrehajtható. A vizsgálat alapját az képezi, hogy a spermiumok DNS-állománya mennyire érzékeny savas denaturációra. Az intakt DNS-sel rendelkező sejteknél, a denaturációt és a nukleáris fehérjék eltávolítását követően, a DNS mintegy kiterjed, ún. „halo-t” képez. Ha a DNS fragmentált, akkor a DNS-nek ez a fajta kiterjedése nem történik meg, vagy csak minimálisan. Mivel a fragmentált DNS érzékenyebb a savas denaturálásra, mintegy „feloldódik” az és nem képez „halo-t”. Egy- és kétszálú törések detektálására egyaránt alkalmas. A nemzetközileg megállapított határérték szerint 25%-os DF-indexnél már magas értékről beszélhetünk, azonban bizonyos SCD-kiteket forgalmazó márka ezt 30%-ban állapította meg, de ezektől teljesen eltérő határértékek is olvashatók a szakirodalomban (38). Nagy hátránya, hogy nem közvetlenül méri a DF-et, hanem közvetve, a denaturálásra való érzékenység alapján. Továbbá eredménye nagyban függ a minta előkészítést és a kiértékelést végző technikustól, ebből kifolyólag nagy lehet a szórás egyes mérések között.
- Sperm Chromatin Structure Assay (SCSA): a módszer azon az elven alapszik, hogy az acridine orange nevű jelölő molekula, ha kétszálú DNS-hez kapcsolódik, akkor gerjesztést követően zöld fényt emittál, ha pedig egyszálú DNS-hez, akkor piros fényt. A jelölést megelőzően itt is savas denaturálás történik, amelyre a DNS-törések miatt a fragmentált örökítő anyag lesz az érzékeny, így az a denaturálást követően egyszálúvá válik, a jelölő bekötődik, és piros fényt emittál. Kiértékelése történhet fluoreszcens mikroszkópiával és áramlási citometriával is. A szakirodalomban fellelhető határérték 25% (38). Ez esetben is a módszer indirekt mivolta a legnagyobb hátrány, illetve leginkább az egyszálú DNS-törések kimutatására alkalmas. Továbbá mind az SCD-, mind az SCSA-technika olyan vegyszereket használ a denaturáció és a lízis során, amelyek toxikusak lehetnek.
Következtetések
Az előbbiekben, ahogy olvashattuk, több technika is rendelkezésünkre áll a spermiumok DF-indexének meghatározására. Minden módszernek van előnye és hátránya is, az egyes laborok le tudják tenni a voksukat a számukra legmegfelelőbb módszer mellett (Tunel-assay, Comet-assay, SCD, SCSA). Fontos megemlíteni, hogy ezek a módszerek mindaddig „hatástalanok”, amíg nincs egy egységesen elfogatott álláspont mind a vizsgálat indikációi terén, mind pedig annak terén, hogy mi történjen a férfi betegeinkkel, ha emelkedett DF-értéket kapunk. Intézetünkben lehetővé vált mind a DF, mind az intra- és extracelluláris ROS helyben végzett vizsgálata. A DF-meghatározáshoz – Magyarországon elsőként – SCA Sope-ot (Microptic, Spanyolország) használunk, annak érdekében, hogy ahol csak lehetséges, a meghatározások eredményei alapján terápiás javaslatok kidolgozása történjen meg. A terápia alkalmazását követően utánkövetést végzünk, hogy a vizsgált paraméterekben történt-e valamilyen jellegű javulás (1. ábra). Fontos, hogy a pár mindkét tagját párhuzamosan, együtt vizsgáljuk ki, hiszen lehetséges, hogy az alap férfi kivizsgálás, spermiogram nem mutat semmilyen indikációt a DF-vizsgálatra. Amennyiben nem lehetséges terápiás javaslat felállítása, illetve a terápiát követően továbbra is magas a DF-index, akkor a hazánkban is már elérhető spermiumszeparálási módszerek (pl.: mágneses szeparálás, mikrofluiditáson alapuló szeparálás) valamelyikét alkalmazzuk a termékenyítés során, amelyek csökkenthetik a használt ondóminta DF-értékét, bár alkalmazásuk tényleges hasznáról egyelőre megoszlanak a vélemények (8).
References
1. Öztekin Ü, Canikliog ˘ lu M, Sarı S, et al. Evaluation of male infertility prevalence with clinical outcomes in middle Anatolian region. Cureus 2019; 11: e5122.
https://doi.org/10.7759/cureus.5122
2. Quaas A, Dokras A. Diagnosis and treatment of unexplained infertility. Rev Obstet Gynecol 2008; 1: 69–76.
3. Guzick DS, Overstreet J, Factor-Litvak P, et al. National cooperative reproductive medicine network. Sperm morphology, motility, and concentration in fertile and infertile men. N Engl J Med 2001; 345: 1388–93. https://doi.org/10.1056/NEJMoa003005
4. Belloc S, Benkhalifa M, Cohen-Bacrie M, et al. Which isolated sperm abnormality is most related to sperm DNA damage in men presenting for infertility evaluation. J Assist Reprod Genet 2014; 31: 527–32. https://doi.org/10.1007/s10815-014-0194-3
5. Evgeni E, Charalabopoulos K, Asimakopoulos B. Human sperm DNA fragmentation and its correlation with conventional semen parameters. J Reprod Infertil 2014; 15: 2–14.
6. Simon L, Zini A, Dyachenko A, et al. A systematic review and meta-analysis to determine the effect of sperm DNA damage on in vitro fertilization and intracytoplasmic sperm injection outcome. Asian J Androl 2017; 19: 80–90. https://doi.org/10.4103/1008-682X.182822
7. Tan J, Taskin O, Albert A, et al. Association between sperm DNA fragmentation and idiopathic recurrent pregnancy loss: a systematic review and meta-analysis. Reprod Biomed Online 2019; 38: 951–960. https://doi.org/10.1016/j.rbmo.2018.12.029
8. Máté G, Török A. Spermiumdiagnosztikai- és szelekciós eljárások. Magyar Nőorvosok Lapja 2020; 83: 271–275.
9. Kim GY. What should be done for men with sperm DNA fragmentation? Clin Exp Reprod Med 2018; 45: 101–109. https://doi.org/10.5653/cerm.2018.45.3.101
10. Takeshima T, Kuroda S, Yumura Y. Reactive Oxygen Species and Sperm Cells. In Filip C, Albu E eds, Reactive Oxygen Species (ROS) in Living Cells. In Tech Open 2018. https://doi.org/10.5772/intechopen.73037
11. Halliwell B, Gutteridge JMC. Free radicals in biology and medicine. Oxford: Oxford University Press; 2007.
12. Oleszczuk K, Augustinsson L, Bayat N, et al. Prevalence of high DNA fragmentation index in male partners of unexplained infertile couples. Andrology 2013; 1: 357–60. https://doi.org/10.1111/j.2047-2927.2012.00041.x
13. Esteves SC, Roque M, Garrido N. Use of testicular sperm for intracytoplasmic sperm injection in men with high sperm DNA fragmentation: a SWOT analysis. Asian J Androl 2018; 20: 1–8. https://doi.org/10.4103/aja.aja_7_17
14. Bareh GM, Jacoby E, Binkley P, et al. Sperm deoxyribonucleic acid fragmentation assessment in normozoospermic male partners of couples with unexplained recurrent pregnancy loss: a prospective study. Fertil Steril 2016; 105: 329–36. https://doi.org/10.1016/j.fertnstert.2015.10.033
15. Khadem N, Poorhoseyni A, Jalali M, et al. Sperm DNA fragmentation in couples with unexplained recurrent spontaneous abortions. Andrologia 2014; 46: 126–30. https://doi.org/10.1111/and.12056
16. Boeri L, Capogrosso P, Ventimiglia E, et al. Undiagnosed prediabetes status is associated with a reduced effectiveness of phosphodiesterase type 5 inhibitors in men with erectile dysfunction. Int J Impot Res 2020; 32: 393–400. https://doi.org/10.1038/s41443-019-0149-4
17. Pacey AA. Environmental and lifestyle factors associated with sperm DNA damage. Hum Fertil (Camb) 2010; 13: 189–93.
https://doi.org/10.3109/14647273.2010.531883
18. Zhang MH, Zhai LP, Fang ZY, et al. Impact of a mild scrotal heating on sperm chromosomal abnormality, acrosin activity and seminal alpha-glucosidase in human fertile males. Andrologia 2018; 50: e12985.
https://doi.org/10.1111/and.12985
19. Franasiak JM, Forman EJ, Hong KH, et al. The nature of aneuploidy with increasing age of the female partner: a review of 15,169 consecutive trophectoderm biopsies evaluated with comprehensive chromosomal screening. Fertil Steril 2014; 101: 656–663. https://doi.org/10.1016/j.fertnstert.2013.11.004
20. Albani E, Castellano S, Gurrieri B, et al. Male age: negative impact on sperm DNA fragmentation. Aging (Albany NY) 2019; 11: 2749–2761.
https://doi.org/10.18632/aging.101946
21. Lu R, Chen X, Yu W, et al. Analysis of age-associated alternation of SCSA sperm DNA fragmentation index and semen characteristics of 1790 subfertile males in China. J Clin Lab Anal 2020; 34: e23548.
https://doi.org/10.1002/jcla.23548
22. Pino V, Sanz A, Valdés N, et al. The effects of aging on semen parameters and sperm DNA fragmentation. JBRA Assist Reprod 2020; 24: 82–86.
https://doi.org/10.5935/1518-0557.20190058
23. Sheehan MM, Ramasamy R, Lamb DJ. Molecular mechanisms involved in varicocele-associated infertility. J Assist Reprod Genet 2014; 31: 521–6.
https://doi.org/10.1007/s10815-014-0200-9
24. Agarwal A, Sekhon LH. Oxidative stress and antioxidants for idiopathic oligoasthenoteratospermia: Is it justified? Indian J Urol 2011; 27: 74–85.
https://doi.org/10.4103/0970-1591.78437
25. O’Brien J, Zini A. Sperm DNA integrity and male infertility: A review. Urology 2005; 65: 16–22. https://doi.org/10.1016/j.urology.2004.07.015
26. Yao H, Li F, Qiu X, et al. The effect of varicocele repair for sperm DNA fragmentation: A protocol for systematic review and meta-analysis. Medicine (Baltimore) 2020; 99: e21960. https://doi.org/10.1097/MD.0000000000021960
27. Jung JH, Kim MH, KimJ, et al. Treatment of leukocytospermia in male infertility: A systematic review. World J Mens Health 2016; 34: 165–172.
https://doi.org/10.5534/wjmh.2016.34.3.165
28. Agarwal A, Mulgund A, Alshahrani S et al. Reactive oxygen species and sperm DNA damage in infertile men presenting with low level leukocytospermia. Reprod Biol Endocrinol 2014; 12: 126.
https://doi.org/10.1186/1477–7827-12-126
29. Moubasher A, Sayed H, Mosaad E, et al. Impact of leukocytospermia on sperm dynamic motility parameters, DNA and chromosomal integrity. Cent European J Urol 2018; 71: 470–475. https://doi.org/10.5173/ceju.2018.1724
30. Bach PV, Schlegel PN. Sperm DNA damage and its role in IVF and ICSI. Basic Clin Androl 2016; 26: 15. https://doi.org/10.1186/s12610-016-0043-6
31. Benchaib M, Braun V, Lornage J, et al. Sperm DNA fragmentation decreases the pregnancy rate in an assisted reproductive technique. Hum Reprod 2003; 18: 1023–8. https://doi.org/10.1093/humrep/deg228
32. Wu J, Wu, S, Xie Y, et al. Zinc protects sperm from being damaged by reactive oxygen species in assisted reproduction techniques. Reprod Biomed Online 2015; 30: 334–9. https://doi.org/10.1016/j.rbmo.2014.12.008
33. Dietrich GJ, Szpyrka A, Wojtczak M, et al. Effects of UV irradiation and hydrogen peroxide on DNA fragmentation, motility and fertilizing ability of rainbow trout (Oncorhynchus mykiss) spermatozoa. Theriogenology 2005; 64: 1809–22. https://doi.org/10.1016/j.theriogenology.2005.04.010
34. Majzoub A, Agarwal A, Esteves SC. Antioxidants for elevated sperm DNA fragmentation: a mini review. Transl Androl Urol 2017; 6: S649–S653.
https://doi.org/10.21037/tau.2017.07.09
35. Micic S, Lalic N, Djordjevic D, et al. Double-blind, randomised, placebo-controlled trial on the effect of L-carnitine and L-acetylcarnitine on sperm parameters in men with idiopathic oligoasthenozoospermia. Andrologia 2019; 51: e13267. https://doi.org/10.1111/and.13267
36. Henkel R, Sandhu I, Agarwal A. The excessive use of antioxidant therapy: a possible cause of male infertility? Andrologia 2019; 51: e13162.
https://doi.org/10.1111/and.13162
37. Sharma, R, Ahmad G, Esteves SC, et al. Terminal deoxynucleotidyl transferase dUTP nick end labeling (TUNEL) assay using bench top flow cytometer for evaluation of sperm DNA fragmentation in fertility laboratories: protocol, reference values, and quality control. J Assist Reprod Genet 2016; 33: 291–300. https://doi.org/10.1007/s10815-015-0635-7
38. Javed A, Talkad MS, Ramaiah MK. Evaluation of sperm DNA fragmentation using multiple methods: a comparison of their predictive power for male infertility. Clin Exp Reprod Med 2019; 46: 14–21.
https://doi.org/10.5653/cerm.2019.46.1.14
39. Klaude M, Eriksson S, Nygren J, et al. The comet assay: mechanisms and technical considerations. Mutat Res 1996; 363: 89–96.
https://doi.org/10.1016/0921-8777(95)00063-1