Active monitoring of prostate cancer with multiparametric magnetic resonance imaging: present and future perspectives
DOI: 10.22591/magyurol.2021.4.buzoganyi.154
Authors:
Buzogány István dr., Dombóvári Péter dr., Ráfi Tamás dr.,Vrecenár László dr., Beöthe Tamás dr.
Dél-pesti Centrum Korházak, Péterfy Kórház Rendelőintézet Manninger Jenő Országos Traumatológiai Intézet Urológiai Osztály, Budapest (osztályvezető: Buzogány István dr.)
Summary
Over the last ten years, active surveillance (AS) has become increasingly applied for patients with low-risk prostate cancer. Appropriately selected AS patients have a 10-year prostate cancer-specific survival (PCSS) approaching 99%. Therefore, some international and domestic institutions have expanded the inclusion criteria for AS to avoid the unnecessary morbidity associated with overtreatment. Although statistical methods of data provision and processing were heterogeneous across the relevant AS studies, data from several high-evidence studies was compared to reach the final agreement in the Detective and Redeem consensus studies. Patients with histologically confirmed PCa are eligible for AS programme when the following criteria are met: PSA Among patients with a Gleason score of 3+4=7, ISUP 2, AS programme may be started only when low numbers of positive cores are present with a PSA 10 ng/ml, Gleason score of ≥4+3=7, ISUP 3, clinical stage >cT2a and pathological features of the tumour include any of the following: dominant ductal carcinoma (including pure intraductal carcinoma), sarcomatoid carcinoma, small cell carcinoma, tumour involving or spreading through the prostatic capsule, and lymphovascular or perineural invasion. As multiparametric MRI (mpMRI) scans are becoming more widespread in daily practice, AS protocols based on uniform principles are being followed, it has proven to be safe to keep patients under close observation without unnecessary rebiopsies. Since the introduction of mpMRI fusion histological sampling, the cancer detection rate has also improved significantly. Although the implementation of AS has increased the number of PCa patients who are safely observed with active surveillance, there are still too many people undergoing curative therapy prematurely, resulting in overtreatment. Additional research on genetic tests and clinical parameters such as multiparametric magnetic resonance imaging (mpMRI) are needed to further refine therapeutic groups.
LAPSZÁM: MAGYAR UROLÓGIA | 2021 | 33. ÉVFOLYAM, 4. SZÁM
Összefoglalás
Az elmúlt tíz évben a szövettanilag kimutatott, de klinikailag irreleváns prosztatadaganatok alacsony kockázatot jelentő aktív megfigyelése (aktív surveillance, AS) egyre nagyobb arányban használatos.
Az AS-programba megfelelő kritériumok alapján kiválasztott betegek 10 éves prosztatarák specifikus túlélése (prostate cancer-specific survival, PCSS) megközelíti a 99%-ot. A nemzetközi és a hazai gyakorlatban jó néhány intézet kibővítette az AS beválasztási kritériumait, hogy minél több beteg kerülhessen megfigyelés alá, így elkerülve a túlkezeléssel járó felesleges kellemetlenségeket, morbiditási tényezőket. Több magas evidenciájú tanulmány adatait összehasonlítva született megállapodás mindezekről a Detective és a Redeem konszenzus study-k alkalmával, bár a vizsgálatok során az adatszolgáltatás és a feldolgozás statisztikai módszerei heterogének voltak. Az AS-programba az a szövettanilag igazolt alacsony kockázatú prosztatadaganatos (PCa) beteg vonható, akinél a PSA 10 ng/ml, malignitási fokozat GS ≥4+3=7 ISUP 3, a klinikai stádium > cT2a vagy ha a daganat patológiai jellemzői között szerepel a domináns ductalis karcinóma (beleértve a tiszta intraductalis karcinómát), sarcomatoid karcinóma, kissejtes karcinóma, prosztatatokot elérő, vagy meghaladó folyamat, limfovaszkuláris, perineurális invázió bármelyike. A multiparametrikus mágnesesrezonancia-képalkotás (mpMRI) gyakorlatban való eltejedésével és az egységes AS-protokoll alkalmazásával a betegek beválasztása, követése a felesleges rebiopsziák nélkül is biztonságossá vált. Az mpMRI fúziós hisztológiai mintavételek bevezetése óta a biopsziák találati biztonsága jelentősen javult. Az AS alkalmazása növekszik , de még mindig túl sokan idő előtt feleslegesen esnek át a végleges kuratív kezelésen. A klinikai paraméterek és a genetikai tesztek további kutatásai szükségesek a terápiás csoportok pontosításának érdekében.
Bevezetés
A prosztatarák (PCa) a férfiak leggyakoribb rosszindulatú daganata. A szérum prosztataspecifikus-antigén (PSA) mérésének bevezetésével és széleskörű alkalmazásával, majd a szűrés bevezetésével az újonnan diagnosztizált betegek kezdetben 25, később 50-74%-a korai stádiumban és alacsony klinikai kockázattal kerül felismerésre és kezelésre (1. ábra) (1, 2, 3).
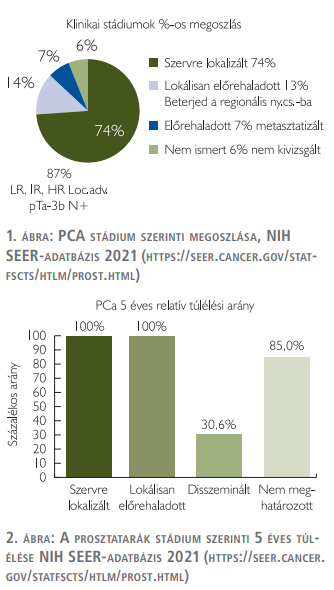
A PCa természetes kórlefolyását vizsgálva egyre inkább bizonyítottá vált, hogy az alacsony kockázatú betegség kevésbé hajlamos disszeminációra, áttétképződésre. Az alacsony kockázatú, korai stádiumú prosztatarákos betegek túlélési valószínűsége magas, 5 év elteltével a betegek 100, míg 10 év után 98-95%-a túlélő lehet (NIH SEER-adatbázis 2021) (2. ábra). Ugyanakkor nehezíti ennek a betegcsoportnak a biztonságos megítélését, hogy nincsenek olyan diagnosztikai vagy prognosztikai biomarkerek, amelyekkel egészen korai stádiumukban, biztonsággal el lehetne különíteni egymástól az indolens és az agresszív daganatokat (4).
Az idő előrehaladtával egyre több információ halmozódott fel a prosztatarákos betegek kezelésének eredményességéről. A csak megfigyelt betegek adatainak feldolgozása kapcsán vetődött fel annak lehetősége, hogy az alacsony kockázati csoportba sorolható daganatokat – pl. alacsony kiindulási PSA-érték, kis tumorvolumen, alacsony malignitásfok (GS 3+3=6 ISUP-1) –, nem feltétlen kell azonnal, agresszíven kezelni. Kezdetben az aktívan monitorizált (Aktív Monitoring – AM), majd az aktív megfigyelési (Aktív Surveillance – AS) programba kiválasztott és megfigyelt betegek prosztatarák-specifikus túlélése (CSS) megegyezik az egyéb kezelésben részesült alacsony rizikócsoportba sorolható (low risk – LR) PCa páciensekével.
Sok esetben az LR tumoros betegeknél a nem-kezelés, a várakozás és aktív megfigyelés (AS) stratégiája előnyösebbnek tűnt, mint az idejekorán elkezdett kuratív terápia. Egyidejűleg viszont az is igazolódni látszott, hogy a rejtve maradt agresszív daganatentitások időben történő felfedezése és adekvát kezelése rendkívül lényeges a betegek túlélése szempontjából. Felmerül tehát annak az igénye, hogy megfelelő kritériumok szerint és elegendő érzékenységgel bíró vizsgálatok alapján, logikusan és bizonyított hatékonysággal működő szabályok felhasználásával kerüljenek a betegek az egyes terápiás kategóriákba besorolásra (5, 6).
A prosztatarák aktív megfigyelésének koncepciója
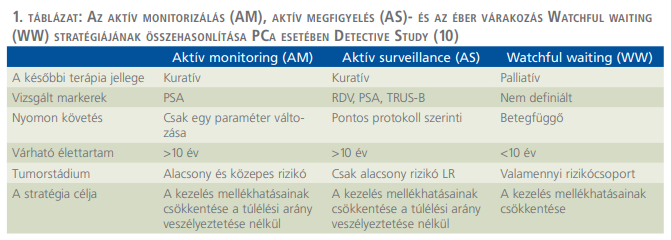
Prosztatarák esetén elengedhetetlen, hogy a terápia megkezdése előtt a tumor jelenléte szövettanilag is bizonyított legyen. A prosztatarák aktív megfigyelése (AS) a szövettanilag igazolt, LR PCa-betegek kezelésének stratégiája, amely a kuratív terápia késleltetett elkezdését jelenti, a betegség folyamatos és aktív, pontos, előírtak szerint történő felügyelete és rendszeres kontrollja mellett. A prosztatarák diagnózisát igazoló szövettani valamint az elvégzett kivizsgálás adatainak (staging) ismeretében történt rizikócsoport-besorolás után lehet dönteni a várakozás (AS), vagy az azonnali aktív, kuratív kezelési lehetőségek valamelyikének kiválasztásáról. A beavatkozás szándékos késleltetése a betegek számára klinikailag csekély veszélyt jelent. AS mellett az indolens daganatokat ritkábban ítéljük veszélyesnek, csökken a túlkezelés aránya. Az AS célja, hogy csak akkor kezdődjön a kezelés, ha a betegség progressziója beigazolódott, és az a beteg számára ténylegesen magasabb kockázatot jelent, mint a további várakozás. Az AS koncepciója alapvetően különbözik az aktív monitorizálástól (AM), ahol csak egy klinikai paraméter aktív követése történik, bár mindkét esetben a megfigyelés után tényleges, kuratív terápia következik. Még inkább eltér az AS az éber várakozástól (watchful waiting – WW), amely csak palliatív és nem kuratív kezelést kezdeményez, ha a megfigyelés során a daganat progressziója észlelhető (1. táblázat) (8).
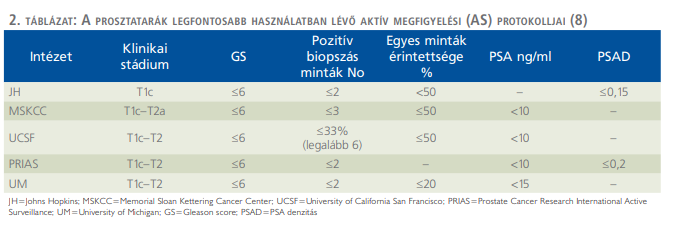
A megfigyelési stratégia első értékelhető vizsgálatában, a ProtecT study-ban 1643 szövettanilag bizonyítottan prosztatarákos beteg nyomonkövetése történt, akiket radikális prostatectomia (RP), külső sugárforrással történő besugárzás (external beam radiation therapy – ERBT) és megfigyelési (AM) csoportba randomizáltak (7). Az AM stratégiájában csak egy klinikai paraméter, a PSA változásának nyomonkövetése történt. PSA-növekedés (≥50%/12 hó) esetén, ismételt TRUS-B-t végeztek az esetleges progresszió igazolására. A vizsgálatba vont betegek 56%-a tartozott alacsony kockázati csoportba, amelyben a PSA ISUP 2-3-as, közepes kockázati csoportba tartozott. A metasztatikus folyamat kialakulásának valószínűsége eltérő volt ugyan a két csoportban (RRP és ERBT 2,3% vs. AM 6%), ami szignifikáns különbségnek bizonyult. Valószínűleg az AS-ben tapasztaltakhoz képest az AM-ben észlelt magasabb arány az eltérő obszervációs stratégia alaposságának lehetett a következménye. Azt sem szabad figyelmen kívül hagyni, hogy ProtecT-vizsgálatba beválasztott és randomizált betegek körülbelül 40%-ának közepes kockázatú betegsége volt. A vizsgálat komoly kritikája, hogy mivel csak AM történt, a kiválasztás és a kontrollok szinte kizárólag PSA-méréseken alapultak; sem a beválasztáskor, sem a megfigyelési időszak alatt, nem történt képalkotó, pl. mpMRI-vizsgálat, és a rendszeres időközönként végzett kontrollok protokolljában nem volt előírt az ismételt prosztatabiopszia sem. Tíz éven túl egyelőre nem állnak rendelkezésre túlélési adatok, de az bizonyos, hogy az AS-ben lévő betegek nagyobb biztonságban vannak az AM-hez képest, mivel már a beválasztás során pontosabb a kockázati csoportbesorolás. A nyomonkövetés során a rendszeres képalkotó vizsgálatok (mpMRI) és az előírt ismételt biopsziák révén a csoportátsorolás is szigorúbb kritériumok alapján, biztonságosabban történik. Mindazonáltal a ProtecT-tanulmány megerősítette, hogy a halasztott aktív kezelés alkalmas az alacsony kockázatú és alacsony stádiumú PCa-betegek ellátására. A vizsgálat igazolta a kezdeti AM, vagy később bevezetett AS bármely formájának pozitív szerepét, és mint megvalósítható terápiás alternatívát ajánlotta (9).
Számos tényező egyidejű értékelésére van szükség annak megállapításához, hogy az AS stratégiája alkalmas-e a beteg kezelésére, illetve a kiválasztott beteg alkalmas-e az AS-re. A beválasztás alapvető kritériuma a betegség malignitási foka, a kockázati csoportbesorolás, a kiindulási stádium, a legmagasabb PSA-érték és annak különböző frakciói, mint pl. a szabad PSA, proPSA, PSA-index, PHI (prostata helth index), PSA-denzitás (PSA-D), -velocitás (PSA-Vel), és -duplikációs idő (PSA-DT). Alapvető tehát a PSA abszolút értékéről és változásának dinamikájáról informáló változók pontos felmérése, amelyek közül érdekes módon csak a denzitás PSAD (≤0,15 ng/ml/cm3) került be a beválasztási kritériumok közé. Nagyon fontos ezen felül a staging vizsgálatok, az általános állapot (ECOG), a várható élettartam, a kezelés lehetséges mellékhatásai, és nem utolsó sorban a beteg kívánságainak figyelembevétele. A konszenzus eredmények alapján, már nem kérdés, hogy az AS stratégiáját figyelembe kell venni minden alacsony Gleason pontszámú (≤3+3=6), korai stádiumú, tehát alacsony kockázatú (LR) prosztatadaganatos beteg kezelésének lehetőségeként. Nem teljesen kiforrott, konszenzuson alapuló, evidenciákkal csak részben alátámasztott kérdés ugyanakkor a betegek kiválasztásának és nyomon követésének protokollja. Az AS beválasztási kritériumok és a nyomonkövetés-feltételek meghatározása valamint az eredményességének értékelése rendhagyó módon egy nemzetközi konszenzus tanulmány, a DETECTIVE-study (DKS) alapján történt, mivel nincs elegendő számú kontrollált, megfelelő evidenciákon alapuló vizsgálat (10). A DKS egyértelmű határozatokat hozott a szervre lokalizált alacsony kockázatú prosztatarák (LR-PCa) kuratív kezelésének tudatos és pontos előíratok szerint történő halasztásáról és az egyidejűleg követendő aktív megfigyelés stratégiájáról (AS). A DKS konszenzus értekezletén döntöttek a betegbeválasztás és a -kizárás kritériumairól és az obszerváció lényeges lépéseiről. A megegyezés alapját a legmeghatározóbb intézetekben alkalmazott AS-protokollok (2. táblázat) idevonatkozó előírásai és a DKS során levont következtetések adták. Egy további, 2015-ben publikált, szintén konszenzusvizsgálat, a REDEEM-study (RKS) az AS patológiai ismérveit tekintette át. Ez a vizsgálat meghatározta azokat a szövettani ismérveket, entitásokat amelyek jelenlétében a beteg kizárandó az AS-programból (11). A konszenzus study egyértelműen kizárni javasolja az AS-ből azokat a betegeket, akiknek a daganata az alábbi patológiai jellemzők bármelyikével rendelkezik:
- domináns ductalis karcinóma (beleértve a tiszta intraductalis karcinómát),
- sarcomatoid karcinóma,
- kissejtes karcinóma,
- EPE – a prosztatatokot elérő, vagy meghaladó folyamat,
- LVI – nyirokér-invázió,
- PNI – perineális invázió (11, 12).
Nem született megegyezés a DKS során beválasztás, vagy kizárási feltételként a pozitív biopsziás minták számáról és az egyes mintákban észlelt tumoros érintettség maximális százalékos arányáról. A konszenzusvizsgálat során megállapodtak arról, hogy azok a klinikai cT2c stádiumba sorolható esetek, akiknél viszonylag nagyméretű és előrehaladott tumor észlelhető, amely a mpMRI-n PIRAD’S 4-5 pontszámú lézióként látható, nem választhatók be az AS-csoportba.
A DKS során arra az izgalmas következtetésre jutottak, hogy az közepes kockázatú GS 3+4=7, ISUP 2 esetek, amelyekben a PSA 0,15 ng/ml/cm3, pozitív biopsziás mintaszám >2, és az afroamerikai rassz (16). A DKS egyértelművé tette, hogy a GS 4+3 =7 ISUP 3 malignitású, közepes kockázatú betegek számára AS-csoportban való megfigyelés túl nagy kockázatot jelent, ezért nem javasolt!
Az AS során javasolt vizsgálatok:
- 3-6 havonta PSA-ellenőrzés PSAD és DT nyomonkövetés,
- minimum évente RDV,
- 6 havonta mpMRI.
6-12 hónapnál ismételt biopszia szükséges, amennyiben a beteg továbbra is az AS stratégiáját választja a kuratív terápiával szemben. A mintavétel lehetőleg multiparametrikus prosztata-MRI alapján kognitív, vagy fúziós módon javasolt. Amennyiben az első biopsziát megelőzően nem történt mpMRI, mindenképp szükséges elvégezni azt az ismételt szövettani mintavétel, ún. rebiopszia előtt. Későbbiekben a szövettani mintavétel ismétlése 3-5 évente javasolt (22). Az mpMRI a kiindulási állapottal való egzakt összehasonlíthatóság miatt a jövőben akár a rebiopsziák alternatívájaként is szóba jöhet (27, 28).
A REDEEM-studyban alapvetően azt vizsgálták, hogy az AS során van-e létjogosultsága az 5a-reduktáz-enzim-gátló gyógyszerek alkalmazásának. Egyértelmű választ sikerült adni a kérdésre, miszerint az 5a-reduktáz I-II koenzim-bénító (Dutasterid) alkalmazása AS-ben egyértelmű szignifikáns előnyt jelent a progresszió megelőzésében (38,9%; 95% CI: 12,4–57,4%, p=0,007). A vizsgálat eredményei alapján az 5a-reduktáz-enzim-bénítók hasznos kiegészítői az AS-nek, mert:
- megnyújtják a progresszióig eltelt időt,
- növelik a PCa nélküli biopsziás minták %-át,
- alkalmazásukkal nem emelkedik a kontrollbiopsziák tumorainak GS-értéke,
- jelentősen csökkenti a beteg PCa miatti szorongását azáltal, hogy lecsökkenti a beteg PSA-értékét.
A gyógyszer alkalmazásakor mindig figyelembe kell venni a PSA csökkentő hatását! Mindig az új, legalacsonyabb értékhez (PSA-nadír) viszonyítva kell nézni a PSA-szint változását, elsősorban annak dinamikáját – a duplázódási időt (PSA-DT), és a velicitását (PSA-Vel) – figyelembe véve.
Az AS-programba való betegbeválasztás és -kizárás egyes kritériumait a 3. táblázat foglalja össze.

Amennyiben a betegség progressziójára van gyanú, haladéktalanul aktív kezelésben kell részesíteni a beteget. Progressziót jelez a PSA emelkedése, a rebiopsziában észlelt Gleason/ISUP-érték növekedése, vagy az mpMRI-vizsgálat során látott daganatos terület növekedése különösen, ha az eredmények a kockázati besorolásban alacsonyból közepes kockázatra való „csoportugrás”-t eredményeznek. Minden kontroll során el kell végezni az eredmények alapján történő kockázati csoportbesorolás újraértékelését!
A multiparametrikus mágneses rezonancia vizsgálat (mpMRI) szerepe a prosztatarák aktív megfigyelésében
Már 2010-ben javaslatot tettek arra, hogy az AS-be való beválasztás elbírálásakor a klinikai vizsgálatok és a biopsziák hisztológiai eredményeinek együttes értékelése mellett az mpMRI eredményét is figyelembe vegyék (18, 19).
A rendelkezésre álló korlátozott számú vizsgálat tapasztalatai alapján azok a betegek, akiknél mpMRI is történt a szövettani mintavétel előtt, jobb eredményeket mutattak az AS során, mint a tisztán csak a klinikai paraméterek alapján kiválasztott csoportok (p <0,05) (19, 20, 21).
Az Európai Urológus Társaság (EAU) érvényben lévő 2021-es irányelvei szerint az AS-ben megfigyelt alacsony kockázatú daganattal rendelkező, aktív betegek esetében, amennyiben az első biopsziát megelőzően nem történt mpMRI, mindenképp javasolt elvégezni azt az ismételt szövettani mintavétel, ún. rebiopszia előtt (22).
Az AS-programban megfigyelt betegek esetében a magasabb rizikócsoportba való átsorolását legtöbbször nem a korábban indolensnek tartott daganatrészletek feltételezett hisztológiai progressziója okozza. A tévedést sokkal valószínűbb módon az első biopszia alkalmával történt nem kielégítő mintavétel és annak következtében végzett hibás kockázati csoportbesorolás eredményezi (23). Ez a megállapítás azt is jelzi egyben, hogy a standard szisztematikus biopszia (S-TRUSB) eredményei annak pontatlansága miatt félrevezetőek lehetnek. Egyre inkább szükségessé vált egy olyan módszer kidolgozása, amely javítja a biopsziák találati arányát, és így csökkenti a tévedés lehetőségét a stádium és kockázati csoportbeosztás alkalmával.
Az S-TRUSB-k egyik fő hátránya, hogy a prosztata mellső, anterior kvadránsában lévő daganatokat aluldiagnosztizálja. Az ilyen betegek esetében, amennyiben AS-csoportba kerültek, két év után 25%-ban átminősítés és terápiamódosítás válik szükségessé (29, 30).
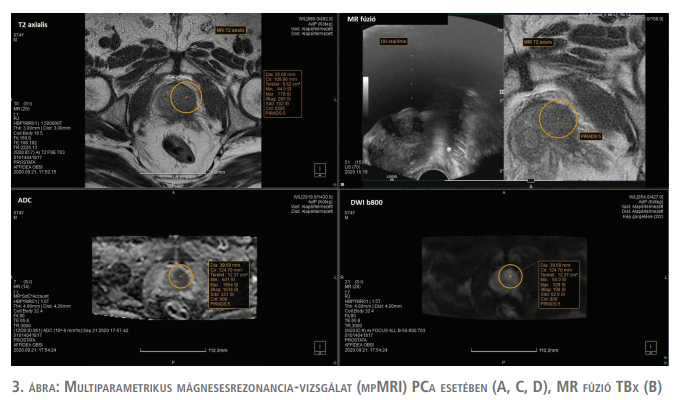
A mpMRI megkönnyíti a prosztatarák gyanús területek észlelését, lokalizálását, méretének kontrollját és a gyanús terület további jellemzését. A PIRAD’S pontérték a tumor klinikai stádiumát tekintve is releváns információt képes adni (3. ábra) (13–19). A mpMRI-vizsgálat az AS-protokollok két szakaszában is hasznos. Egyfelől a beválasztást megelőző hisztológiai mintavétel előtt, alapvizsgálatként alkalmazható a feltételezett tumorgyanús terület pontos lokalizálásában kognitív, vagy fúziós biopszia során. Másrészt az mpMRI biztonságos kontrollt tesz lehetővé a megfigyelési periódus alatt végzett kontrollvizsgálatok során. Az AS-programban a követés során az mpMRI a kiindulási állapottal való egzakt összehasonlítás miatt akár a rebiopsziák alternatívájaként is szóba jöhet. A prosztata mpMRI-vizsgálatának 95%-os negatív prediktív értéke lehetővé teszi az ismételt biopsziák elkerülését az AS során (27, 28).
A jelenleg ismert klinikai és konszenzus vizsgálatok rutinszerűen nem vizsgálták a prosztata-képalkotók – jelesül a mpMRI –, szerepét a daganat felfedezésében, a 12 mintás prosztatabiopsziák lokalizálásában és a daganatok nyomonkövetésében sem. Elgondolkodtató, hogy az indolens rákok azonosításának pontossága ezen modern képalkotók alkalmazásával sem haladja meg a 75%-ot (29, 30). Több vizsgálat indult annak tisztázására, mennyire képes az AS-ben obszervált betegek esetében a mpMRI felismerni, vagy kognitív S-TRUSB-eredményekkel alátámasztott módon előre jelezni azokat az elváltozásokat, amelyek a későbbiek során átsorolást eredményezhetnek a reklasszfikációk során (31, 32).
A kognitív S-TRUSB egyértelműen bizonyítottan jelentős hozzáadott értékkel bír az AS indulásakor indolensnek, klinikailag irrelevánsnak ítélt daganatok későbbi reklasszifikációja alkalmával. Ugyanakkor Schoots és munkatársai metaanalízissel értékelték az AS-betegeknél progresszió gyanúja miatt (abszolút PSA, FPSA PSAD, PSADT változás), illetve 6-12 hónap után esedékes stádiummegerősítő, vagy -átsorolás indokát képező rebiopszia során a S-TRUSB mellett alkalmazott magnetic resonance imaging-targeted biopsy (MRI-TBx) találati arányt javító képességét is (33).
Magnetic resonance imaging-targeted biopsy (MRI-TBx)
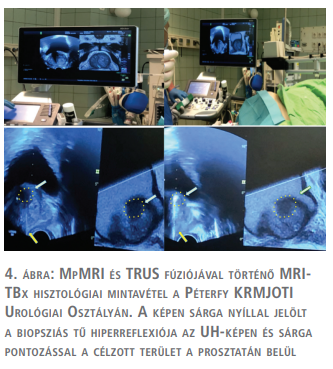
Az MRI-TBx során, a mintavételeket megelőzően az MR-vizsgálatok képanyaga feltöltésre kerül a beavatkozáshoz használt ultrahangkészülék szoftverébe, majd a műtőasztalon a beavatkozás előtt egy ellenőrző rectalis digitális vizsgálat történik a helyes pozicionálás végett. A transrectalis ultrahang során az MR- és a valós idejű ultrahangképek fúziója egy speciális navigációs szoftver segítségével történik, amely a beteg csípője fölött elhelyezett rádiófrekvenciás jeladó egység és az ultrahangfejre rögzített két érzékelő marker segítségével regisztrálja az ultrahangfej térbeli helyzetét. A biopszia a korábban készített és bekalibrált MR-képen megjelölt tumorgyanús területeknek az UH-képen végzett pontos célzásával történik (4. ábra). A konvencionális kognitív S-TRUSB 12 mintás biopszia során rectalis UH-célzással random mintavételként történik. A S-TRUSB és az MRI-TBx kombinációjakor az MRI vizsgáló által pontosan megjelölt tumorgyanús területekről még további 3-4 mintavételre kerül sor. Tisztán MRI-TBx csak a már korábban kombináltan történt mintavételek valamilyen okból történő ismétlésekor végezhető.
Mindkét biopsziás módszer kb. 10%-kal – MRI-TBx (95% CI: 5–10%), S-TRUS-B (95% CI: 8–14%) – volt képes megemelni a prosztatabiopszia találati arányát, azokban az esetekben, ahol felmerült, hogy reklasszifikáció szükséges. Az MRI-TBx és a S-TRUSB eredményességét külön-külön vizsgálva, megállapítható volt, hogy egyik metódus sem jelent többletelőnyt reklasszifikáció során a találati arány növelésében. Egyidejűleg a két biopsziás technika kombinálása tűnik a legjobb mintavételi módnak az AS-betegek kiválasztása előtt és a stádiumértékeléskor is. AS-stratégia során, amennyiben az első biopszia előtt végzett mpMRI-vizsgálaton a tumorgyanú PIRAD’S 4-5 besorolású léziónak bizonyult, háromszor nagyobb eséllyel (RR=2,77; 95% CI: 1,76–4,38) jelentkezik a későbbiekben progresszió, mint ahol bizonytalan, vagy negatív volt az mpMRI (33). Hasonló eredményeket észleltek ISUP 1 stádiumú betegek esetében, amikor összehasonlították a kiindulási és a megfigyelési kohorszokat a reklasszifikációk tekintetében; az MRI-negatív esetek kockázati aránya (HR) 0,61 (95% CI: 0,39–0,95, p= 0,03), míg az MRI-pozitív eseteké 1,96 (95% CI: 1,36–2,82, p <0,01) volt (34). Az ASIST (The Active Surveillance Magnetic Resonance Imaging Study) vizsgálatot AS-ben megfigyelt betegek stádiumellenőrző 12 mintás biopsziájára tervezték, ahol két karon randomizáltan S-TRUSB, illetve MRI-TBx történt. Az első értékeléskor minimális előny mutatkozott az MRI-TBx javára. Kétéves követés után viszont már markánsabban igazolódott az MRI fúziós metódus előnye. A stádiummegerősítő rebiopsziák előtt alkalmazott mpMRI kevesebb tévedést, aluldiagnosztizálást eredményezett (19% vs. 35%, p=0,017), ezáltal kevesebb betegnél észlelték a daganat az ISUP >2-es fokozatúvá történt progrediálását (9,9% vs. 23%, p=0,048) (35, 36).
Nagy előrelépést jelentett az a DKS-konszenzus ülésén kötött megállapodás, miszerint, ha az AS programbavétel előtti szövettani mintavétel az S-TRUSB és MRI-TBx kombinációjával történt, akkor a továbbiakban nincs szükség időszakonkénti megerősítő rebiopsziákra, elegendő az mpMRI-vizsgálat hathavonkénti ismétlése, mindaddig, amíg a progresszió jelei nem jelentkeznek az MRI során (10).
Megbeszélés
Az alacsony kockázatú prosztatarákos (LRPCa) betegek esetében gyakran túlkezelés történik, mivel olyanok is aktív terápiában részesülnek, akik egészségét abban a pillanatban nem feltétlen veszélyezteti a daganatuk. A túlkezelés problémáját az aktív megfigyelés (AS) segíthet megoldani. Az AS során alkalmazott mpMRI finomíthatja az okkult, magasabb kockázatú tumorok korai azonosítását, és csökkentheti a diagnosztikus biopsziák számát az alacsony kockázatú betegeknél (35, 36, 37). Az AS-re jelöltek kiválasztása és az adott tumor megítélése, mpMRI birtokában is kizárólag biopsziával lehetséges. Hasznos lenne, ha a betegség átminősítésekor és a megfigyelés, nyomonkövetés során a képalkotó vizsgálatok a párhuzamosan monitorizált klinikai változókkal együtt értékelve, elegendő biztonságot nyújtanának az adott beteg tumorstádiumának megtartásában, vagy átminősítésében. Mindez növelné a diagnosztikai pontosságot és javítaná a betegek kezelésének eredményességét, csökkentené a felesleges iatrogenitást. A PCa aktív megfigyelési programokban az mpMRI szerepének megítélésére azonban további klinikai vizsgálatokra van szükség. Az aktív megfigyelés (AS), előnyei között szerepel a szükségtelen kezelés elkerülése, ideértve az RP-t, és a sugárkezelést is, ami által megőrizhető a beteg eredeti életminősége, és csökkenthetőek a kezelési költségek.Ugyanakkor az AS hátrányai közé vehető a végleges kezelés esetlegesen nem optimális időben történő elkezdése, valamint a szükséges kezelés megkezdése előtt megjelenhető daganatos progresszió, vagy a metasztázis kialakulásának kockázata. További veszélyt jelenthet, ha a daganat a kezelésekor az eredetileg tervezettnél nagyobb megterhelést jelentő beavatkozást igényel, mivel a tumor agresszívebbé válik a megfigyelés során. A DKS egyértelműen határozott lokalizált PCa-k gyógyító szándékú halasztott kezeléséről, amely gyakorlatilag az AS összes aspektusát érinti. A prosztatatumoros betegek, miután diagnosztizálásra került a betegségük, szoronghatnak attól, hogy rákjuk van, és ez a tudat ronthatja életminőségüket. Ha ebből az szemszögből vizsgáljuk az alacsony kockázatú prosztatarák diagnózisának megismerése nem biztos, hogy előnyös a páciensek számára, hiszen a betegségük valószínűleg nem lesz halálos kimenetelű, ami komoly és feleslegesen átélt stresszt okoz. Ezt a komoly szorongást képes ellensúlyozni az 5a-reduktáz-enzim-bénítók alkalmazása AS-ben, mert azon túl, hogy bizonyítottan csökkenti a progresszió valószínűségét (REDEEM-study), a napi PSA-érték felezésével a hatásosság képzetét erősíti a betegben. A jelenlegi AS-protokollok szerint bevont betegek nyomonkövetése során szükség lehet ismételt hisztológiai mintavételre, ami nemcsak kényelmetlenséget okoz, de növeli a iatrogén fertőzések kockázatát. A nem kezelt alacsony kockázatú prosztatarák pontos patomechanizmusa, esetleg bekövetkező metamorfózisa még nem minden aspektusból tisztázott, ami valószínűleg szintén nem előnyös ezen betegcsoport számára.
Következtetés
A DKS és az RKS egyértelművé tették, hogy az AS-programba az a szövettanilag igazolt PCa-beteg vonható be, akinek a PSA 10 ng/ml, GS ≥4+3=7 ISUP 3 vagy a klinikai stádium > cT2a, illetve a daganat patológiai jellemzői között szerepel: domináns ductalis karcinóma (beleértve a tiszta intraductalis karcinómát), sarcomatoid karcinóma, kissejtes karcinóma, a prosztatatokot elérő, vagy meghaladó folyamat (EPE), nyirokér-invázió (LVI) vagy perineális invázió (PNI) jelenléte a biopsziás mintában.
A klinikai gyakorlatban már elfogadott a prosztatarák képalkotásának, az mpMRI-vizsgálatnak alapvető szerepe a kiindulási diagnózis és kockázati besorolás felállításában. Ugyancsak deklarált az ismételt képalkotó vizsgálatok időzítése az AS-programban. Az 5a-reduktáz-bénítók hasznos kiegészítői az AS-nek.
A jövőben az mpMRI-nek az AS-protokollokban várhatóan meghatározó szerepét döntően befolyásolja a betegek aktív megfigyelésére vonatkozó kritériumok heterogenitása, a klinikailag jelentős betegség még mindig nem egészen pontos meghatározása és a radiológiai progresszió konszenzuson alapuló definiálása.
References
1. Crawford ED, Wilson SS, Torkko KC et al. Clinical staging of prostate cancer: A computer-simulated study of transperineal prostate biopsy. BJU Int 2005; 96: 999–1004. https://doi.org/10.1111/j.1464-410X.2005.05801.x
2. Carroll PR, Parsons JK, Andriole G et al. NCCN Guidelines Insights: Prostate cancer early detection, Version 2. 2016. J Natl Compr Canc Netw 2016; 14: 509–19. https://doi.org/10.6004/jnccn.2016.0060
3. Schröder FH, Hugosson J, Roobol MJ, et al. Screening and prostate-cancer mortality in a randomized European study. N Engl J Med 2009; 360: 1320–28. https://doi.org/10.1056/NEJMoa0810084
4. Whitson JM, Porten SP, Hilton JF et al. The relationship between prostate-specific antigen change and biopsy progression in patients on active surveillance for prostate cancer. J Urol 2011; 185: 1656–60.
https://doi.org/10.1016/j.juro.2010.12.042
5. Adamy A, Yee DS, Matsushita K et al. Role of prostate-specific antigen and immediate confirmatory biopsy in predicting progression during active surveillance for low-risk prostate cancer. J Urol 2011; 185: 477–82. https://doi.org/10.1016/j.juro.2010.09.095
6. Whitson JM, Porten SP, Hilton JF et al. The relationship between prostate-specific antigen change and biopsy progression in patients on active surveillance for prostate cancer. J Urol 2011; 185: 1656–60.
https://doi.org/10.1016/j.juro.2010.12.042
7. Hamdy FC et al. 10-Year Outcomes after Moitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 2016. 375: 1415
8. Skalinda K et al. Active Surveillance of Prostate Cancer Using Multiparametric Magnetic Resonance Imaging: A Review of the Current Role and Future Perspectives 2020
https://doi.org/10.12659/MSM.920252: e920252-1-e920252-9. Published online 2020 Apr12. Prepublished online 2020 Feb 17
9. Briant RJ. The ProtecT trial: analysis of the patient cohort, baseline risk stratification and disease progression BJU Int 2020 Apr; 125(4): 506–514. https://doi.org/10.1111/bju.14987
10. Panel Consensus Statements for deferred Treatment with Curative Intent for Localised Prostate Cancerfrom an International Collaborative Study (DETECTIVE Study). Eur Urol 2019; 76: 790.
11. Moreira DM et al. Baseline Perineural Invasion is Associated with Shorter Time to Progression in Men with Prostate Cancer Undergoing Active Surveillance: Results from the REDEEM Study. J Urol 2015; 194: 1258. https://doi.org/10.1016/j.juro.2015.04.113
12. Giri VN et al. Implementation of Germline Testing for Prostate Cancer: Philadelphia Prostate Cancer Consensus Conference 2019. J Clin Oncol 2020; 38: 2798. https://pubmed.ncbi.nlm.nih.gov/3251609
13. Loeb S et al. Active surveillance for prostate cancer: a systemic review of clinicopathologic variables and biomarkers for stratification. Eur Urol 2015; 67: 619. https://doi.org/10.1016/j.eururo.2014.10.010
14. Morash, C., et al. Active surveillance for the management of localized prostate cancer: Guideline recommendations. Can Urol Assoc J, 2015. 9: 171. https://doi.org/10.5489/cuaj.2806
15. Satasivam P et al. Can Confirmatory Biopsy be Omitted in Patiens with Cancer Favorable Diagnostic Features on Active Surveillance? J Urol 2016; 195: 74. https://doi.org/10.1016/j.juro.2015.07.078
16. Petrelli F et al. Predictive Factors for Reclassification and Relapse in Prostate Cancer Eligible for Active Surveillance: A Systematic Review and Meta-analysis. Urology 2016; 91: 136.
https://doi.org/10.1016/j.urology.2016.01.034
17. Marks RA et al. The relationship between the extent of surgical margin positivity and prostate specific antigen recurrence in radical prostatectomy specimens. Hum Pathol 2007; 38: 1207.
https://doi.org/10.1016/j.humpath.2007.01.006
18. Turkbey B, Rosenkrantz AB, Haider MA et al. Prostate imaging reporting and data system version 2.1: 2019 Update of prostate imaging reporting and data system.
19. Klotz L, Zhang L, Lam A et al. Clinical results of long-term follow-up of a large, active surveillance cohort with localized prostate cancer. J Clin Oncol 2010; 28: 126–31. https://doi.org/10.1200/JCO.2009.24.2180
20. Shukla-Dave A, Hricak H, Akin O et al. Preoperative nomograms incorporating magnetic resonance imaging and spectroscopy for prediction of insignificant prostate cancer. BJU Int. 2012; 109(9): 1315–22. version 2. Eur Urol 2019; 76(3): 340–51.
https://doi.org/10.1111/j.1464-410X.2011.10612.x
21. Arabi A, Deebaja M, Yaguchi G et al. Systematic biopsy does not contribute to disease upgrading in patients undergoing targeted biopsy for PI-RADS 5 lesions identified on magnetic resonance imaging in the course of active surveillance for prostate cancer. Urology 2019; 134: 168–72. https://doi.org/10.1016/j.urology.2019.08.035
22. Mottet N, Bellmunt J, Briers E et al. Members of the EAU – ESTRO – ESUR – SIOG Prostate Cancer Guidelines Panel. EAU – ESTRO – ESUR – SIOG Guidelines on Prostate Cancer. Edn. presented at the EAU Annual Congress; Copenhagen. Arnhem, The Netherlands: EAU Guidelines Office 2018. 978-94-92671-02-8
23. Porten SP, Whitson JM, Cowan JE et al. Changes in prostate cancer grade on serial biopsy in men undergoing active surveillance. J Clin Oncol 2011; 29: 2795–800. https://doi.org/10.1200/JCO.2010.33.0134
24. Ayres BE, Montgomery BS, Barber NJ et al. The role of transperineal template prostate biopsies in restaging men with prostate cancer managed by active surveillance. BJU Int 2012; 109(8): 1170–76. (PubMed) (Google Scholar) https://doi.org/10.1111/j.1464–410X.2011.10480.x
25. Lawrentschuk N, Haider MA, Daljeet N et al. ‘Prostatic evasive anterior tumours’: The role of magnetic resonance imaging. BJU Int 2010; 105: 1231–36. https://doi.org/10.1111/j.1464-410X.2009.08938.x
26. Barrett T, Haider M. The emerging role of MRI in prostate cancer active surveillance and ongoing challenges. Am J Roentgenol 2017; 208(1): 131–39. https://doi.org/10.2214/AJR.16.16355
27. Lee DH, Koo KC, Lee SH et al. Tumor lesion diameter on diffusion-weighted magnetic resonance imaging could help predict insignificant prostate cancer in patients eligible for active surveillance: Preliminary analysis. J Urol 2013; 190: 1213–17.
https://doi.org/10.1016/j.juro.2013.03.127
28. Kim TH, Jeong JY, Lee SW et al. Diffusion-weighted magnetic resonance imaging for prediction of insignificant prostate cancer in potential candidates for active surveillance. Eur Radiol 2015; 25: 1786–92. https://doi.org/10.1007/s00330-014-3566-2
29. Stephenson AJ, Kattan MW. Nomograms for prostate cancer. BJU Int 2006; 98: 39–46. (PubMed) (Google Scholar)
https://doi.org/10.1111/j.1464-410X.2006.06173.x
30. Serefoglu EC, Altinova S, Ugras NS et al. How reliable is 12-core prostate biopsy procedure in the detection of prostate cancer? Can Urol Assoc J 2013; 7: E293–98. https://doi.org/10.5489/cuaj.1248
31. Dieffenbacher S et al. Standardized Magnetic Resonance Imaging Reporting Using the Prostate Cancer Radiological Estimation of Change in Sequential Evaluation Criteria and Magnetic Resonance Imaging/Transrectal Ultrasound Fusion with Transperineal Saturation Biopsy to Select Men on Active Surveillance. Eur Urol Focus 2020; 7: 102.
https://doi.org/10.1016/j.euf.2019.03.001
32. Gallagher KM et al. Four-year outcomes from a multiparametric magnetic resonance imaging (MRI)-based active surveillance programme: PSA dynamics and serial MRI scans allow omission of protocol biopsies. BJU Int 2019; 123: 429. https://doi.org/10.1111/bju.14513
33. Schoots IG et al. Is magnetic resonance imaging-targeted biopsy a useful addition to systematic confirmatory biopsy in men on active surveillance for low-risk prostate cancer? A systematic review and meta-analysis. BJU Int 2018; 122: 946.
https://doi.org/10.1111/bju.14358
34. Mamawala MK et al. Utility of multiparametric magnetic resonance imaging in the risk stratification of men with Grade Group 1 prostate cancer on active surveillance. BJU Int 2020; 125: 861.
https://doi.org/10.1111/bju.15033
35. Klotz L et al. Active Surveillance Magnetic Resonance Imaging Study (ASIST): Results of a Randomized Multicenter Prospective Trial. Eur Urol 2019; 75: 300. https://doi.org/10.1016/j.eururo.2018.06.025
36. Klotz L et al. Randomized Study of Systematic Biopsy Versus Magnetic Resonance Imaging and Targeted and Systematic Biopsy in Men on Active Surveillance (ASIST): 2-year Postbiopsy Follow-up. Eur Urol 2020; 77: 311. https://doi.org/10.1016/j.eururo.2019.10.007
37. Berg CJ, Habibian DJ, Katz AE et al. Active holistic surveillance: The nutritional aspect of delayed intervention in prostate cancer. J Nutr Metab 2016; 2016: 2917–065. https://doi.org/10.1155/2016/2917065