Clinical aspects of non-muscle invasive bladder tumours
DOI: 10.22591/magyurol.2024.1.molnara.27
Authors:
Molnár Ágnes dr.
Pécsi Tudományegyetem KK, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
Summary
The urothelial carcinoma of the bladder is the seventh most common type of cancer among men, and the tenth most common among the entire population, and it is the second most common type of cancer among urological tumours. In terms of mortality, it is the ninth leading cause of death among all cancers in men and the eleventh in women. Based on these epidemiological indicators, it is easy to see how important it is to detect and treat patients with bladder cancer. The vast majority of bladder tumours can be classified into the non-muscle-invasive group, however, based on their clinical behaviour and appearance, they form very heterogeneous groups. Based on the chance of subsequent progression and recurrence, risk-adapted treatment and follow-up schemes were introduced. The aim of the summary is to summarize the international, but mainly the European Association of Urology (EAU) guidelines, and thus to provide clear treatment guidelines for the care of these tumours.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 1. SZÁM
Összefoglalás
A hólyag urothelialis karcinómája a férfiak körében a hetedik, míg a teljes populáció körében a tízedik leggyakoribb, míg az urológiai daganatokat tekintve a második leggyakoribb daganattípus. A halálozást tekintve az összes daganat közül a férfiakban a kilencedik, nőkben a tizenegyedik. Ezen epidemiológiai mutatók alapján is könnyen belátható, milyen fontos a hólyagdaganatos betegek felderítése és kezelése. A hólyagdaganatok döntő többsége a nem izominvazív csoportba sorolható, azonban a klinikai viselkedésük és megjelenésük alapján igen heterogén csoportokat alkotnak. A későbbi progresszió és recidíva kialakulásának esélye alapján rizikóadaptált kezelési és utánkövetési sémák kerültek bevezetésre. Az összefoglaló célja a nemzetközi, de főleg az Európai Urológus Társaság (EAU) által közölt irányelvek összefoglalása, és ezzel egyértelmű kezelési útmutatás adása ezen daganatok ellátására.
A hólyagdaganatos betegségek kb. 95%-a urothelialis karcinóma. A betegek kb. 5%-ában egyéb szövettani típus kerül felismerésre, mint squamosus sejtes karcinóma, adenokarcinóma, szarkóma, neuroendokrin karcinóma, illetve egyéb daganatok húgyutakban történő manifesztációja. A fenti daganatentitások kivizsgálása, illetve primer műtéti ellátása az urothelialis karcinómáéval megegyezik. A későbbiekben az urothelialis daganatok etiológiai vonatkozásai, klinikai megjelenése, diagnosztikus és kezelési algoritmusai kerülnek részletezésre.
A rizikófaktorok közül a legjelentősebb a dohányzás, a felismert betegek legalább 50%-a még jelenleg is fogyasztó vagy az anamnézisében évtizedekig tartó szerhasználat szerepel. Ismert tény, hogy a dohányfüstben megtalálható aromás aminok és policiklusos aromás szénhidrogének bizonyítottan karcinogén, mutagén és teratogén hatással rendelkeznek. Ezen anyagok a vizelettel választódnak ki és urothelialis karcinóma kialakulásához vezethetnek. A daganat kialakulásának rizikója exponenciálisan nő az expozíciónak kitett évek számával és annak intenzitásával. Az alacsony kátránytartalmú cigaretta fogyasztása nem csökkenti a rizikót. Az utóbbi években elterjedt elektromos cigaretták esetében az összefüggés még nem bizonyított, azonban ezek hosszan tartó használata során is fellelhetők a karcinogén anyagok a vizeletben (1).
A vegyiparban a különböző eljárások során keletkező aromás szénhidrogének az esetek közel 10%-ában szerepelnek rizikófaktorként, azonban az utóbbi évtizedekben bevezetett szigorú biztonsági előírásoknak köszönhetően a munkások körében előforduló daganatos megbetegedések az átlagpopulációéval egyező szintre csökkent.
A kismedencei irradiáción átesett betegeknél szintén nagyobb valószínűséggel (relatív rizikó: 1,4–4) alakul ki primer urothelialis karcinóma.
A krónikus gyulladást eredményező állapotok, mint a tartós katéterviselés, a hólyagkövesség és a bliharziázis, squamosus sejtes karcinóma kialakulásához vezethetnek.
A betegség családi halmozódására egyértelmű genetikai bizonyíték ez idáig nem került felismerésre.
A táplálkozást tekintve kevés összefüggés került leírásra a hólyagdaganat kialakulásával kapcsolatban. A nyugati típusú – telített zsírsavakban gazdag – táplálkozás emeli a hólyagdaganat kialakulásának valószínűségét.
Tünetek, klinikai kép
A hólyagdaganat leggyakoribb tünete a vérvizelés, amely a betegek kb. 85%-ában fordul elő. Típusosan az ún. néma hematúria képében jelenik meg, amely fájdalmatlan makroszkópos vérvizelés. In situ karcinóma jelenlétére utalnak a LUTS-os, elsősorban a kifejezett tárolási tünetek. Előrehaladott esetben gyakori az alsó végtagi duzzanat a nyirok-, illetve vénás pangás miatt, illetve az uréterszájadék érintettsége esetén az üregrendszeri tágulat. Metasztatikus esetben az általános tünetek, mint csontfájdalom, fogyás, tapintható terime is előfordulhatnak.
Diagnózis
Perzisztáló hematúria esetén a húgyúti fertőzés kizárását követően minden esetben kivizsgálás szükséges. Az ambulanter ellátás során elvégzett ultrahangvizsgálat hólyagdaganat diagnózisában igen alacsony szenzitivitással bír, azonban az intraluminálisan felismert hólyagfali elváltozások daganat alapos gyanúját kelthetik fel, emellett a veseparenchyma szolid vagy cisztózus elváltozásait, illetve az üregrendszeri tágulat meglétét igazolhatják. A hólyagdaganatok, illetve a felső üregrendszeri daganatok diagnózisában a CT-urográfia az elsőként választandó képalkotó vizsgálat. Pyelon és uréterdaganatok esetében a szenzitivitása kb. 90% (2). A papilláris hólyagdaganatok esetén is hasonló érzékenységű, azonban a lap szerint terjedő tumorok esetén ez alacsonyabb, cisztoszkópia elvégzése minden esetben kötelező. CT-vizsgálat a diagnózis mellett a lokális terjedés, a nyirokcsomó- és távoli metasztázisok tisztázására elengedhetetlen.
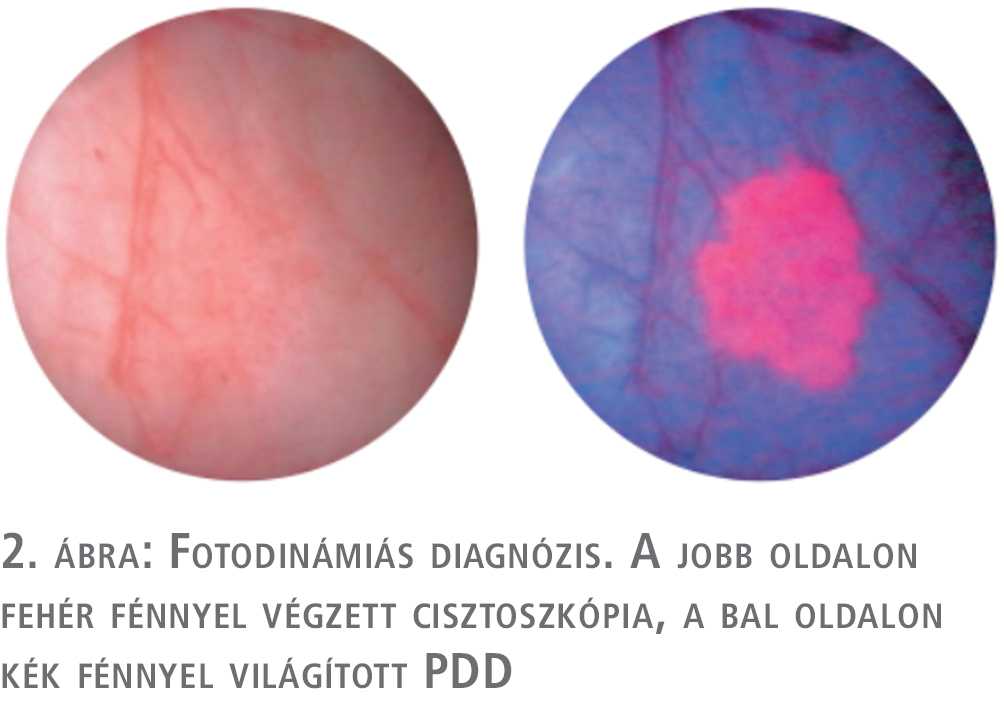
Makroszkópos, illetve mikroszkópos „néma hematúria” esetén cisztoszkópia elvégzése erősen javasolt az urothelialis daganat kizárása céljából. Makroszkópos, illetve tüneteket adó mikroszkópos vérvizelés esetén ez minden kétséget kizáróan szükséges. Az Amerikai Urológus társaság által 2020-ban közölt irányelvek egyértelmű javaslatot tesznek (3). Férfiak esetén, amennyiben erre lehetőség van, javasolt flexibilis eszközzel végezni a beavatkozást. A vizsgálat a papilláris, exofitikus növekedést mutató daganatok diagnózisára igen hatékony, azonban a lap szerint terjedő, hyperaemiás területek elkülönítésére, illetve az in situ carcinoma diagnózisára kevésbé alkalmas. Ebben a fluoreszcens cisztoszkópia alkalmazása nyújthat segítséget. Az eljárás során a konvencionális cisztoszkópia során használt fehér fény helyett kék fénnyel történik a vizsgálat, amelyet megelőzően fotoszenzitivizáló anyag kerül a hólyagba beadásra. A technikával részletesebben külön fejezet foglalkozik.
Vizeletcitológiai vizsgálat elvégzése a hólyagdaganat gyanúja esetén, illetve az utánkövetés során is erősen javasolt diagnosztikus eszköz. A magas grádusú (High grade, Gr. III, in situ carci-
noma) daganatok esetén a vizsgálat igen magas szenzitivitású (84%), de alacsony grádus esetén ez csak 16% körüli. A pozitív eredmény önmagában még nem egyenlő a hólyagdaganat diagnózisával, mivel a daganatsejtek a húgyutak bármely részéről származhatnak, így azt a cisztoszkópiás vizsgálattal együtt kell értékelni. Emellett a negatív eredmény az urothelialis karcinóma jelenlétét nem zárja ki.
Transurethralis reszekció
A cisztoszkópia által igazolt hólyagdaganatok szövettani meghatározására és egyben terápiájára a transurethralis reszekció (TURB), mint „gold standard” műtéti eljárást használjuk. A beavatkozás során pontosan meg kell határozni a daganatok számát, méretét, elhelyezkedését, külső megjelenését (papilláris, nyeles, noduláris, szolid, lap szerint terjedő), in situ carcinoma gyanúját, illetve, hogy az elváltozás primer vagy recidíva. Emellett leírásra kerül, hogy a reszekció makroszkóposan komplettált-e, valamint az izomgerendák látótérbe kerültek-e. Utóbbi a pontos stádiummeghatározáshoz elengedhetetlenül fontos.
A beavatkozás során törekedni kell a komplett reszekcióra. Ez kétféle technikával érhető el. A kisebb méretű, szoliter, papilláris daganatok reszekciója történhet en bloc technikával. Ennek lényege, hogy az elváltozást egyben, a daganat szerkezetének megőrzésével történik (1. ábra).
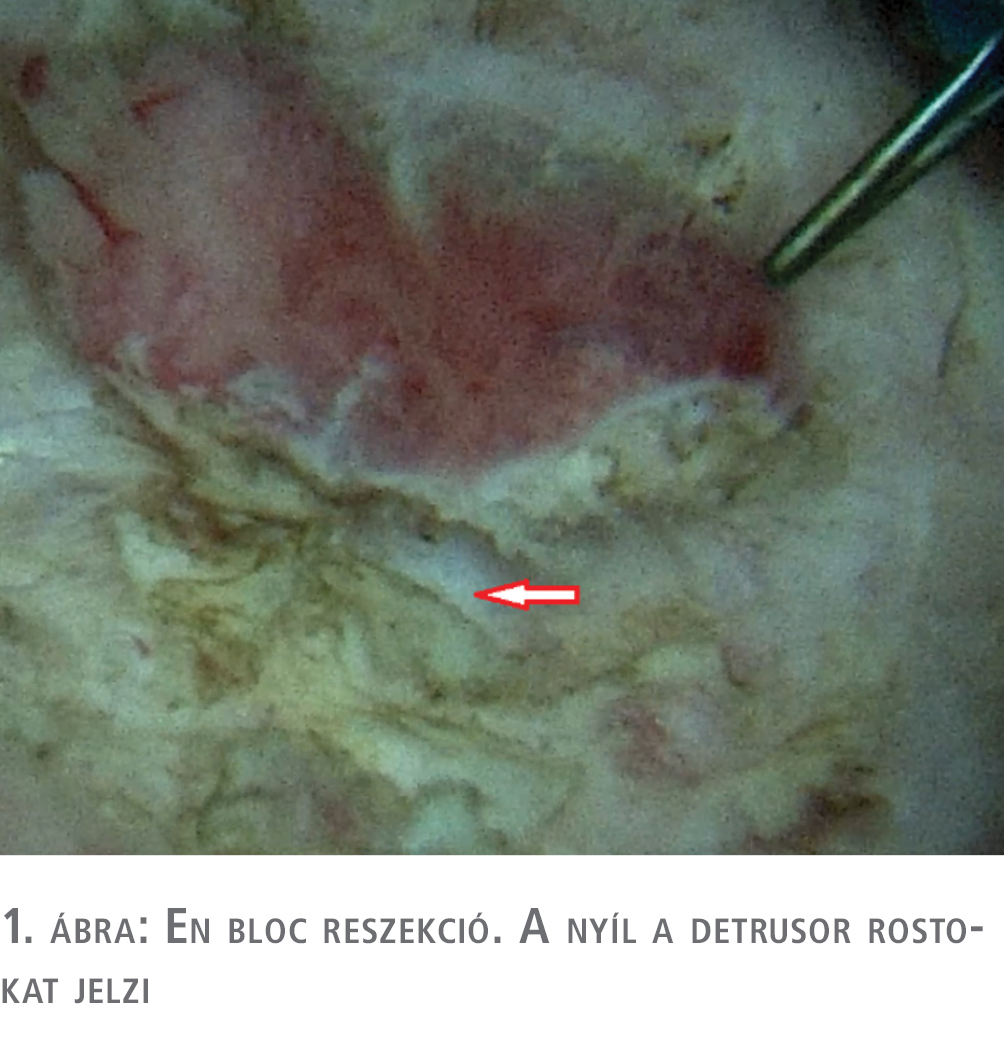
Gyakorlott operatőr esetén a minta közel 100%-ban tartalmaz izomelemeket is. Az eljárás során a daganat termikus károsodása is ritkább, így pontos szövettani feldolgozásra alkalmasabb, mint a frakcionált reszekció esetén nyert szövetminták.
A frakcionált reszekció során a fő daganattömeg, az izomelemeket is tartalmazó „mély minta”, valamint a daganat széli részeiből vett minta külön-külön kerül kiértékelésre. Ez a technika a daganat horizontális és vertikális terjedésének meghatározására alkalmas.
Pozitív vizeletcitológia és negatív hólyagtükri kép esetén az ún. térképbiopszia (mapping biopsy) elvégzése javasolt. Ennek során a szuszpekt, illetve ép nyálkahártya területekről történik mintavétel a hólyag meghatározott területeiről. Szövettani mintát kell venni a trigonum, a hólyagkupola, mindkét oldalfal, a mellső fal, a hátsó fal és a hátsó húgycső területéről. A tumorosan érintett hólyagterületek pontosabb meghatározására, a biopszia pontosítására, amennyiben ez rendelkezésre áll, fotodinámiás technikák alkalmazása javasolt (2. ábra).
Szövettani klasszifikáció és stádiumbeosztás
A hólyagdaganatok döntő többsége rosszindulatú elváltozás. A jóindulatú daganatok, mint az invertált urothelialis papilloma, papilloma, a nephrogen adenoma és a leiomyoma, ritkán fordulnak elő. A primer malignus hólyagdaganatok több mint 90%-a tranzicionális sejtes karcinóma. Kb. 5%-ban fordul elő a squamosus sejtes karcinóma. Azonban azokon a területeken, ahol a schistosomiasis endémiás megjelenésű, az előfordulásának aránya 75% körüli. Az esetek kb. 2%-a primer adenokarcinóma, amely urachus vagy embrionális fejlődés során megmaradt allantois eredetű. A részletesebb patológiai beosztást külön fejezet részletezi. A TNM-beosztást az 1. táblázatban láthatjuk.
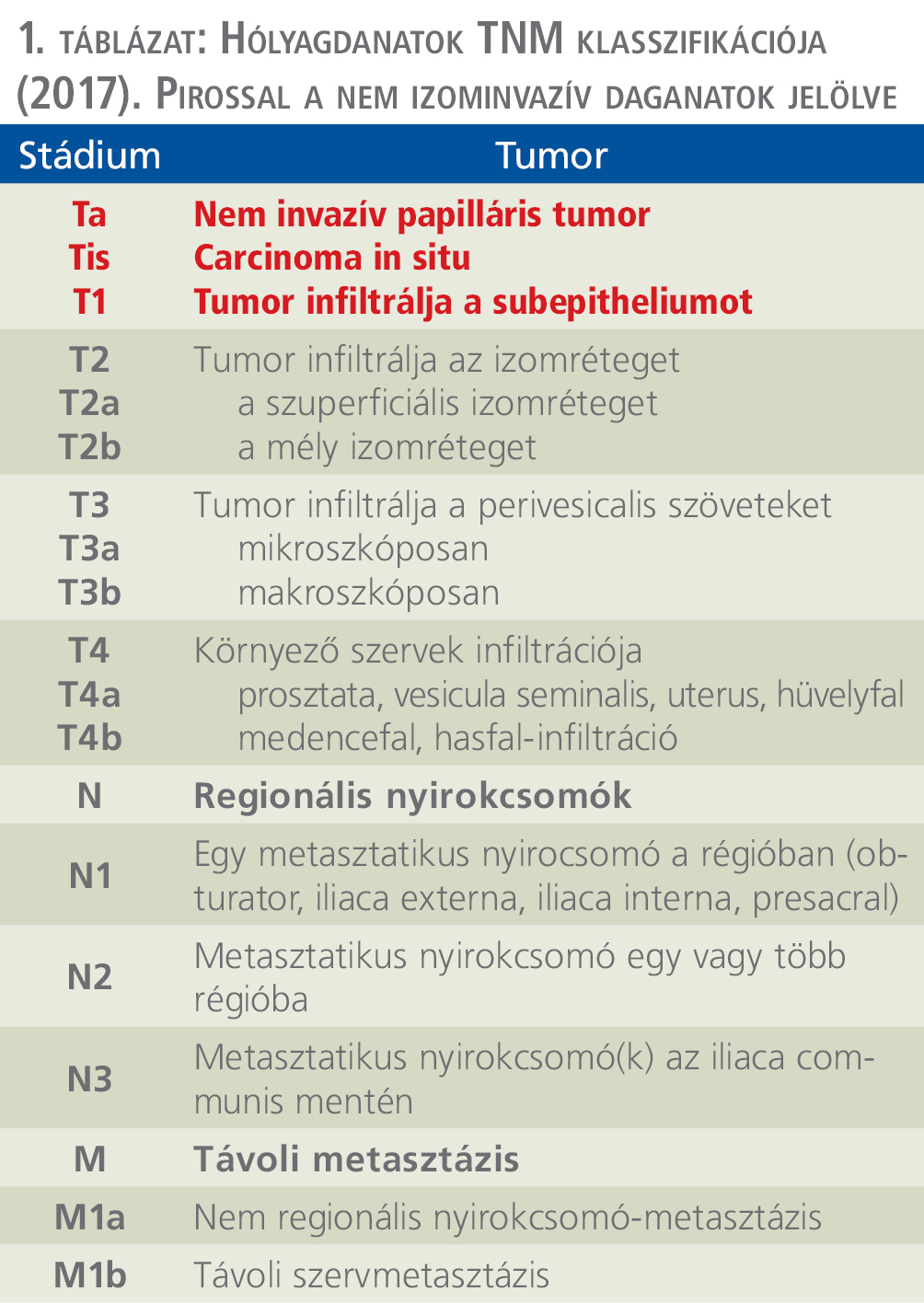
A nem izominvazív hólyagdaganatok közé a fentiek alapján a Ta és a T1 tumorok, valamint az in situ carcinomák sorolhatók. A kockázati csoportba történő besoroláshoz szükséges a grádus megadása is, amely a 3. ábrán látható.
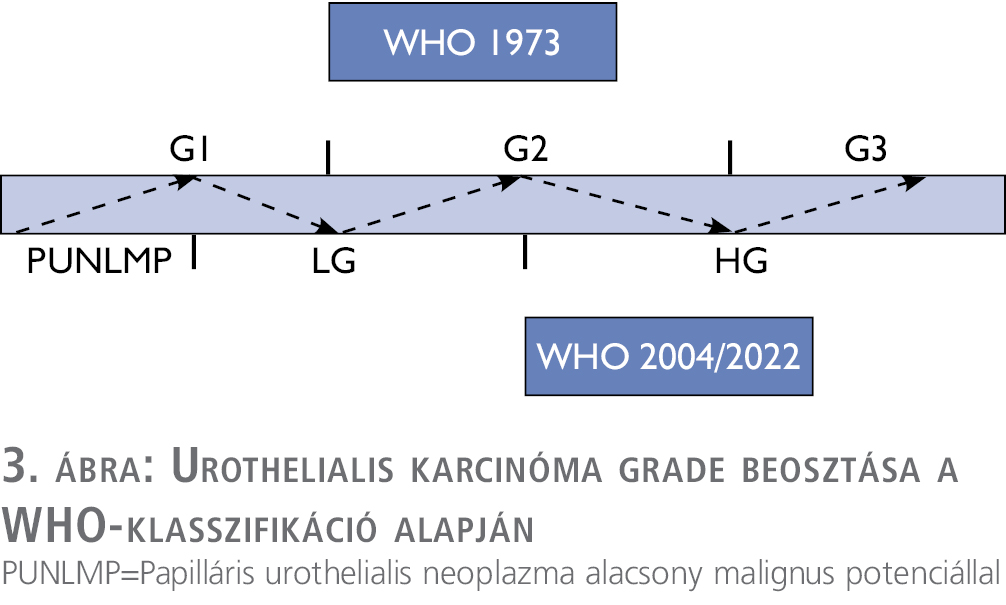
Jelenleg is kétféle klasszifikációt használunk, a WHO által 1973-ban és 2002-ben kiadott besorolás, utóbbi 2022-ben módosításra került.
Több, nagy esetszámot feldolgozó tanulmány egyértelműen bizonyítja, hogy az első transurethralis reszekció után a reziduális tumor jelenlétének esélye igen nagy Ta és T1 daganatok esetén. Ezek alapján kb. 50%-ban fordul elő reszt tumorszövet, míg kb. 10%-ban a T1-es daganatok patológiai stádiummeghatározása a második műtét után kedvezőtlenebb, T2-es eredményt ad (4, 5). Az utóreszekció hosszútávon javítja a kiújulásmentes, a progressziómentes és a teljes túlélést. Ideális időpontja a primer műtétet követő 14-42 nap között, az ennél később végzett beavatkozás szignifikánsan gyengébben befolyásolja a daganat kimenetelét.
A nem izominvazív hólyagdaganatok utókezelésének célja a recidíva megelőzése. Az, hogy melyik beteg és milyen recidívaprofilaxisban részesüljön, kockázatbecslés alapján történik. A kiújulás és a progresszió rizikójának meghatározására különböző modellek kerültek bevezetésre. A European Organisation for Research and Treatment of Cancer (EORTC) egy pán-európai szervezet, amelynek célja, hogy fejlessze, vezesse, irányítsa és ösztönözze a molekuláris és klinikai daganatkutatásokat Európában. Célja a daganatos betegek kezelésének javítására az életminőség és a túlélés növelésével. 2006-ban az 1973-as WHO-klasszifikációt alapul véve egy pontozási rendszert hozott létre, amely alapján egyénre szabottan megjósolható a rövid- (1 éves) és a hosszú távú (5 éves) tumorrecidíva és progresszió valószínűsége. Legfontosabb szerepe az izominvazív betegséggé alakulásra magas rizikójú betegek felderítése. A pontozási rendszer alapja a 6 legjelentősebb klinikai és patológiai tényező, amely a betegség kiújulását és progresszióját befolyásolja. A faktorok az alábbiak: a daganatok száma, mérete, megelőző kiújulási ráta, T-stádium, konkurens CIS, tumor grádusa (2. táblázat).
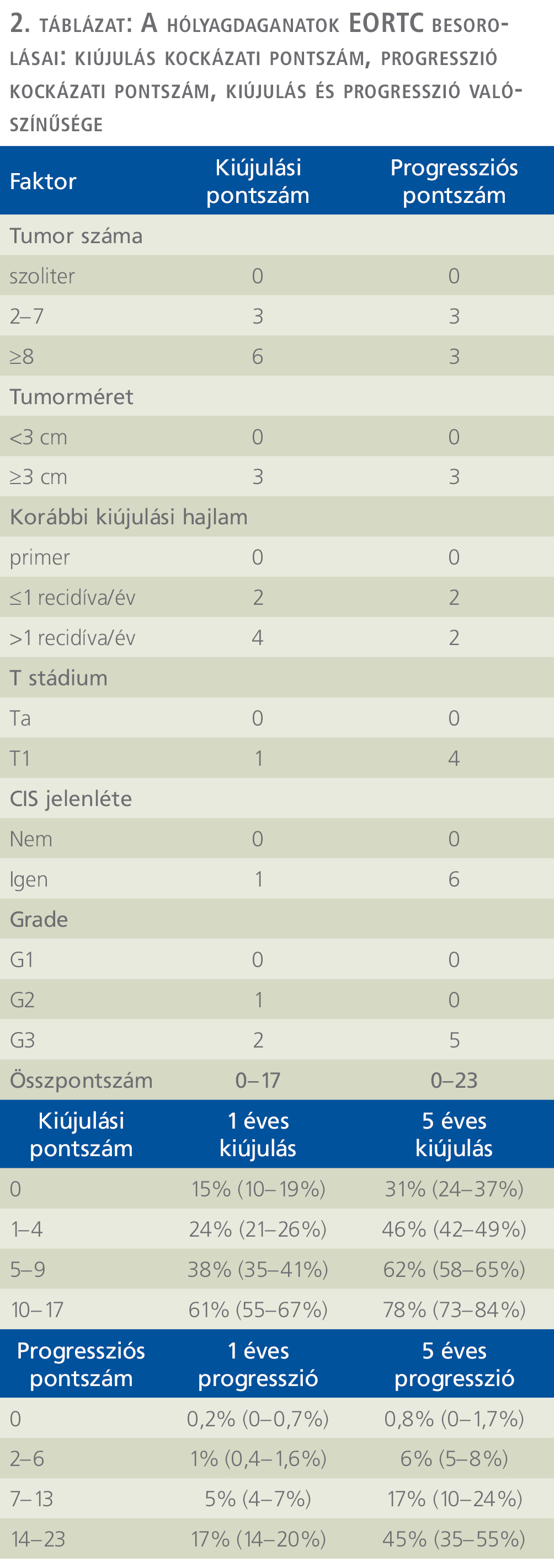
Ahhoz, hogy eldönthessük, melyik beteg milyen recidívaprofilaxisban részesüljön, a betegek különböző rizikócsoportokba történő besorolása javasolt. Alapja a WHO 2004/2016-os vagy a WHO 1973-as grádus beosztása, valamint a WHO 2017-es TNM beosztása, továbbá egyéb rizikótényezők, mint a beteg életkora (>70 év), multiplex tumormegjelenés és a tumor mérete (>3 cm). Ezen paraméterek alapján 4 kockázati csoport került megkülönböztetésre: alacsony, közepes, magas és igen magas kockázatú csoport (3. táblázat).

Recidívaprofilaxis – adjuváns intravesicalis kezelés
Annak ellenére, hogy a TURB során a Ta, T1-es daganatok döntő többsége hiánytalanul eltávolításra kerül, gyakori a recidíva és az izominvazív daganattá történő progresszió. Ennek kivédésére intravesicalis, rizikócsoport szerinti recidívaprofilaxis alkalmazása javasolt. Ezen célra használhatók különböző kemoterápiás szerek, mint a mitomycin C, epirubicin, pirarubicin és a gemcitabin, valamint BCG.
Minden TURB-műtéten átesett betegnél javasolt egyszeri kemoterápiás szer adása közvetlenül a beavatkozás után. Ennek célja a reszekció során lesodródott és a sebfelszínen maradt reszt daganatsejtek elpusztítása. A posztoperatív első néhány órában a leghatékonyabb, mert ilyen rövid idő alatt a daganatsejtek még nem ágyazódtak be az extracelluláris mátrixba.
Az indukciós és fenntartó BCG-kezelés progresszió csökkentésére és recidíva késleltetésére gyakorolt hatásával számos tanulmány foglalkozik. Az eredményeik, valamint a pontos célcsoportok meghatározása és a kezelés pontos időtartama ellentmondásosak, azonban abban mindegyik munkacsoport egyetért, hogy a magas és közepes rizikócsoportba tartozó betegek profitálnak a fenntartó BCG-kezelésből. A NIMBUS, egy EAU által irányított munkacsoport eredményei alapján javasolt 6 hét indukciós kezelés, majd a 3., 6. és 12. hónapban 3 hét fenntartó kezelés alkalmazása (6). A különböző munkacsoportok a fenntartó BCG-kezelés időtartamát 1 év (közepes rizikócsoport) és 3 év (magas rizikócsoport) hosszúságúnak határozzák meg. A BCG-kezelés szövődményeinek csökkentésére számos vizsgálat történt a dózisredukcióval. Ezen eredmények szintén ellentmondásosak, az összességében elmondható, hogy a legkisebb hatásos dózis az egyharmad szintre csökkentett dózis, illetve, hogy a dózis csökkentésével az 1 éven belüli kiújulás aránya magasabb (7, 8).
Az Európai Urológus Társaság (EAU) bizonyos esetekben radikális cystectomia elvégzését javasolja. Azok a betegek, akik a daganat progressziója szempontjából az igen magas rizikócsoportba tartoznak, és a korai cystectomia elvégzésre kerül, az 5 éves daganatmentes túlélés 80% körüli.
A fentiek alapján az EAU által javasolt adjuváns kezelés a különböző rizikócsoportok esetén:
- Alacsony kockázati csoportba tartozó betegeknél az egyszeri intravesicalis kemoterápiás kezelés elégséges, további adjuváns kezelésre nincs szükség.
- A közepes kockázati csoportba tartozó betegeknél az EAU 2021-es adatai alapján, a 10 éven túli progresszió hajlama kb. 7,5-8,5%. Ezeknél a betegeknél javasolt 1 év BCG-kezelés az alábbi protokoll alapján: indukciós kezelés 6 hétig, majd 3 hét fenntartó kezelés a 3., 6. és a 12. hónapban vagy 1 év kemoinstillációs kezelés, amelynek pontos menetrendjére nincsenek egyértelmű ajánlások.
A magas rizikócsoportba tartozó betegek esetén, a 10 éven túli progresszióra való hajlama magas, kb. 14%. Ennél a betegcsoportnál javasolt 1–3 év BCG-kezelés a következő menetrend alapján: indukciós kezelés, majd 3 hét fenntartó kezelés a 3., 6., 12., 18., 24., 30. és 36. héten. Az első évben erősen javasolt a kezelés alkalmazása, míg a második és harmadik évben mérlegelhető annak függvényében, hogy a beteg hogyan viselte a kezeléseket és milyen súlyosabb szövődményei voltak a BCG alkalmazásának. A magas progresszióra való hajlam miatt a betegeknél az azonnali radikális cystectomia elvégzése is szóba jön.
Az igen magas rizikócsoport esetén a progresszió igen magas, akár 50% körül is lehet, így a radikális cystectomia elvégzése a javasolt elsővonalbeli kezelés. Amennyiben a beteg visszautasítja vagy nem alkalmas a radikális műtét elvégzésére, 1-3 év teljes dózisú BCG-kezelés javasolt.
Kezelés sikertelensége intravesicalis kezelést követően – terápiás javaslatok
Az adjuváns intravesicalis kemoterápiát követően kialakult tumorrecidíva esetén BCG-kezelés jön szóba. Ennek sikerességét a korábbi kemoterápiás kezelés nem befolyásolja.
A BCG-kezelést követően kialakult high grade daganatok csoportjai a 4. táblázatban kerültek összefoglalásra.
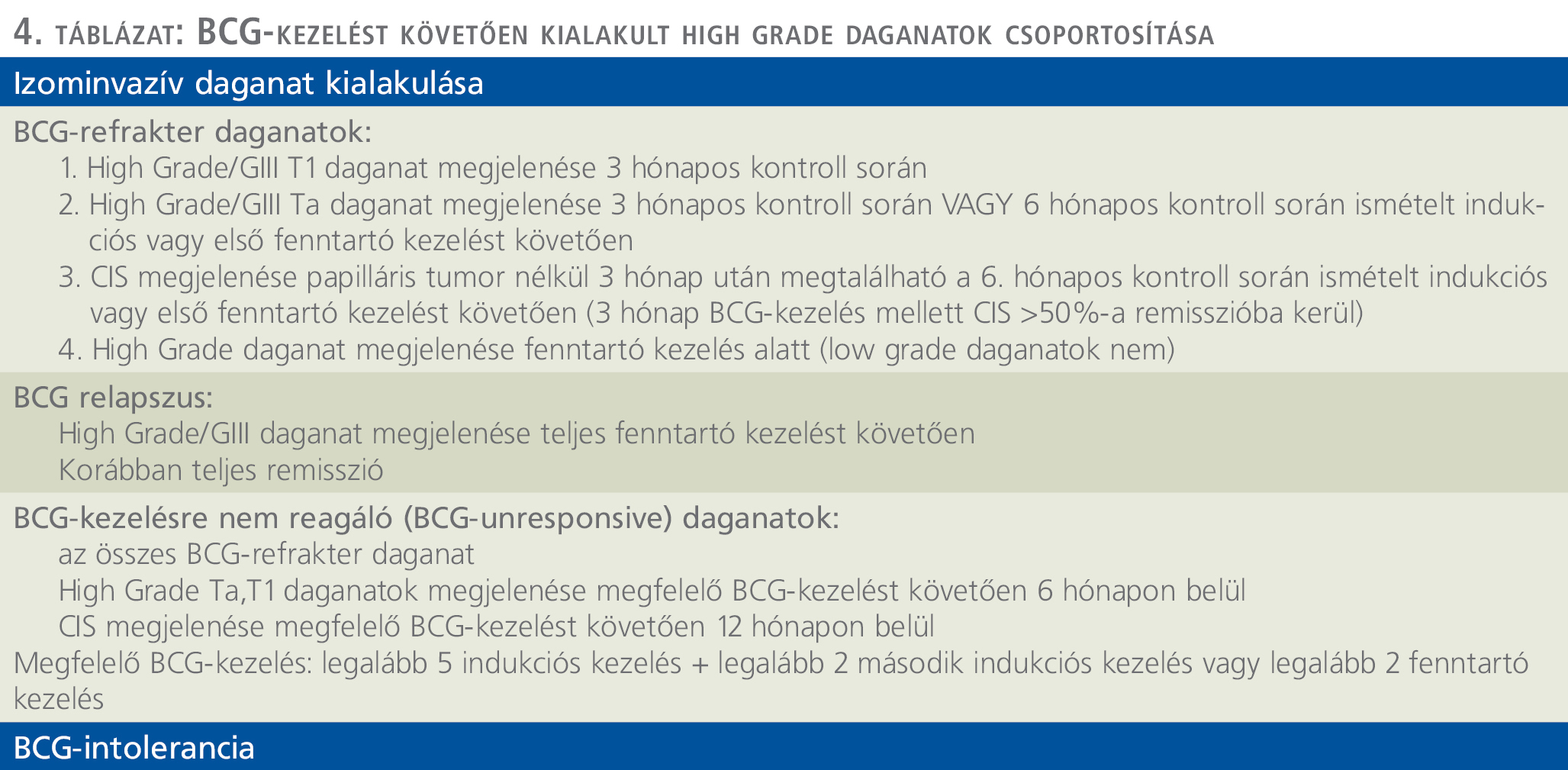
A fent említett csoportoknál a standard további kezelési stratégia a radikális cystectomia elvégzése. Különböző klinikai vizsgálatok folynak a hólyagmegtartó kezelések érdekében, mint a különböző citotoxikus intravesicalis kezelések, eszközös instillációs kezelések, intravesicalis és szisztémás immunterápia, azonban ezek jelenleg onkológiai szempontból a radikális műtéthez képest még háttérbe szorultak, leginkább csak klinikai vizsgálatok keretein belül érhetők el és alkalmazhatóak.
Utánkövetés
Ahogy az a korábbiakban leírásra került, a különböző rizikócsoportba sorolt nem izominvazív hólyagdaganatos betegek recidívára és progresszióra való hajlama különbözik, így az utánkövetésük is eltérő. Minden esetben kötelező az uretrocisztoszkópia elvégzése, azonban ennek gyakorisága és a követés időtartama eltérő a különböző csoportok esetén. Az első kontrollidőpont minden esetben a TURB-t követő harmadik hónap.
Alacsony kockázatú betegek esetén, amennyiben az első kontroll negatív volt, 9 hónap múlva esedékes a következő cisztoszkópia, majd ezt követően évente az első öt évben. Ezen rizikócsoport esetén, az öt éven túli recidíva esélye igen csekély, az invazív cisztoszkópia tünet- és panaszmentes esetben elhagyható.
A közepes, magas és igen magas rizikócsoport esetén a 10 éven túli recidíva nem ritka, így ezen betegek estén élethosszig tartó kontroll szükséges.
Magas és igen magas rizikócsoport esten az első két évben 3 havonta, majd az ötödik évig 5 havonta, ezt követően évente szükséges cisztoszkópia, minden alkalommal vizeletcitológiai vizsgálat elvégzése is javasolt.
A közepes rizikójú betegek esetén nincsenek ilyen egyértelmű EAU-ajánlások, személyre szabottan kell követni élethosszig. Az AUA javaslata, hogy az első 2 évben 3-6 havonta, majd további 2 évig 6-12 havonta, ezt követően évente történjen cisztoszkópia citológiai vizsgálattal együtt. Felső üregrendszeri érintettség kizárására képalkotó vizsgálat csak a magas és igen magas rizikójú betegek esetén szükséges, javasolt CT-urográfia elvégzése. Az 5. táblázat foglalja össze az javasolt utánkövetési tervet.

A leírtak alapján elmondható, hogy a nem izominvazív hólyagdaganatok kezelése és utánkövetése mind technikai, mind szakmai, mind a beteg szempontjából kihívásokkal teli. Az irodalmi adatok alapján régóta bizonyított tény ezen daganatcsoportok izominvazív vagy akár metasztatikus betegséggé történő progressziója, így a magas rizikójú betegek felderítése és a progresszió megakadályozása alapvető fontosságú. Ezért törekedni kell a nemzetközi ajánlások követésére a betegek hosszú távú daganatmentességének és túlélésének javítása érdekében, amelyben a fenti protokollok segítséget nyújthatnak.
Irodalom
1. Bjurlin MA, et al. Carcinogen Biomarkers in the Urine of Electronic Cigarette Users and Implications for the Development of Bladder Cancer: A Systematic Review. Eur Urol Oncol 2021. 4: 766.
https://doi.org/10.1016/j.euo.2020.02.004
2. Elaine M Caoili 1, Richard H Cohan, Prasuna Inampudi, James H Ellis, et al. MDCT urography of upper tract urothelial neoplasms. AJR Am J Roentgenol 2005 Jun; 184(6): 1873–81.
https://doi.org/10.2214/ajr.184.6.01841873
3. Barocas DA, Boorjian SA, Alvarez RD, et al. Microhematuria: AUA/SUFU guideline. J Urol 2020; 204: 778.
https://doi.org/10.1097/JU.0000000000001297
4. Marcus G K Cumberbatch, Beat Foerster, James W F Catto, Ashish M Kamat, Wassim Kassouf, et al. Repeat Transurethral Resection in Non-muscle-invasive Bladder Cancer: A Systematic Review. Eur Urol 2018 Jun; 73(6): 925–933. https://doi.org/10.1016/j.eururo.2018.02.014
5. Angelo Naselli, Rodolfo Hurle, Stefano Paparella, Nicolò Maria Buffi, Giovanni Lughezzani, et al. Role of Restaging Transurethral Resection for T1 Non-muscle invasive Bladder Cancer: A Systematic Review and Meta-analysis. Eur Urol Focus 2018 Jul; 4(4): 558–567.
https://doi.org/10.1016/j.euf.2016.12.011
6. Marc-Oliver Grimm, Antoine G van der Heijden, Marc Colombel, Tim Muilwijk, Luis Martínez-Piñeiro, et al. Treatment of High-grade Non-muscle-invasive Bladder Carcinoma by Standard Number and Dose of BCG Instillations Versus Reduced Number and Standard Dose of BCG Instillations: Results of the European Association of Urology Research Foundation Randomised Phase III Clinical Trial “NIMBUS”. Eur Urol 2020; 78(5): 690–698. https://doi.org/10.1016/j.eururo.2020.04.066
7. C Antonio Ojea, José Luís Nogueira, Eduardo Solsona, Nicolás Flores, Jesús María Fernández Gómez, et al. A multicentre, randomised prospective trial comparing three intravesical adjuvant therapies for intermediate-risk superficial bladder cancer: low-dose bacillus Calmette-Guerin (27 mg) versus very low-dose bacillus Calmette-Guerin (13.5 mg) versus mitomycin. Eur Urol 2007; 52(5): 1398–1406. https://doi.org/10.1016/j.eururo.2007.04.062
8. Maurizio Brausi, Jorg Oddens, Richard Sylvester, Aldo Bono, Cees van de Beek, et al. Side effects of Bacillus Calmette-Guérin (BCG) in the treatment of intermediate- and high-risk Ta, T1 papillary carcinoma of the bladder: results of the EORTC genito-urinary cancers group randomised phase 3 study comparing one-third dose with full dose and 1 year with 3 years of maintenance BCG. Eur Urol 2014; 65(1): 69–76. https://doi.org/10.1016/j.eururo.2013.07.021