Experiences of active surveillance (AS) treatment for organ confined prostate adenocarcinoma with very low, low or favourable intermediate risk patients based on the material of the PTE KK Urology Clinic
DOI: 10.22591/magyurol.2024.2.belakm.85
Authors:
Belák Mátyás dr.1, Cserjesi Zoé Lili2,
Damásdi Miklós dr.1, Szántó Árpád dr.1
1Pécsi Tudományegyetem KK, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
2Pécsi Tudományegyetem ÁOK, Pécs (dékán: Nyitrai Miklós dr.)
Summary
Introduction: Introduction: In our retrospective study, we mainly examined the data of patients with organ confined prostate cancer with very low, low or medium but favourable risk. Our clinical examination mainly focused on the frequency of the attending physician and his patient chose AS treatment in patients with the appropriate parameters, and which variables during the patient’s follow-up led to the decision to suspend AS or start active therapy.
Patients and methods: At the Urology Clinic of the University of Pécs, a total of 809 positive cases with a malignant histological patterns were confirmed by the prostate biopsy patient material performed between January 2015 and December 2020.
The selection of patients for the clinical trial was based on the urological guidelines of the EAU effective in 2021. During the 6-year study period, a total of 54 patients from the 809 positive patient samples met the criteria for AS. The average age of the 54 patients selected for AS treatment was 68 years (52–83), the average starting PSA value was 6.28 ng/ml (0.9–17.7), the average PSAD value was 0.16 ng/ml/cm3 (0.03–0.27), and 45 patients had ISUP1 and 9 ISUP2 histopathological grades. Out of the 54 selected patients, 24 patients progressed (40%) during the study period, the average follow-up time was 43 months (12–79), while the average time to progression was 27 months (12–48).
Results: At the time of withdrawal from AS treatment, the average PSA value of the patients was 7.8 ng/ml (1.1–12.1), the average PSAD value was 0.175 ng/ml/cm3 (0.022–0.291), and during the follow-up of the patients, only 48% (26/54) had PSA, imaging, and control biopsy as part of the follow-up at the same time. After withdrawal from AS, 8,3% (2/24) of patients received mono-ADT, 66.6% (16/24) received ADT and radiotherapy, 25% (6/24) received radical prostatectomy care.
During the processing of the results of the retrospective clinical examination carried out by our working group, we measured a slightly higher progression values as the literature data, the selection criteria corresponded to the effective European and domestic guidelines.
However, during follow-up, only 48% of patients could find the combined results of PSA, radiological and histological examinations. Although the short follow-up time, after an average of 43 months, falls short of the literary follow-up times of 5-10 years, it seems that the domestic practice is insufficient. The early withdrawal of patients from AS is mainly due to the monitored PSA values, instead the calculated PSA values (PSAD, velocity, PSAdt), radiological examinations (lack of multiparametric MRI), and histological results.
Conclusions: Based on literature data, more than a third of patients show progression (biochemical, radiological, histological) during AS, so it is reclassified into one of the active treatment strategies. Based on the currently effective 2023 EAU guidelines, the follow-up practice of patients in the AS patient group is still particularly heterogeneous; despite the fact that the recommendations are given, the selection and reclassification into active treatment takes place according to different conditions in each country and area. In our country, in the region we investigated, the number of AS treatments is still lacking.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Bevezetés: A vizsgálati anyagban elsősorban az alacsony kockázatú, illetve a közepes, de kedvező prognosztikájú szervre lokalizált prosztatadaganattal rendelkező betegek adatait vizsgáltuk. Klinikai vizsgálatunk döntően arra fókuszált, hogy a megfelelő paraméterekkel rendelkező betegek esetén a kezelőorvos, illetve betege milyen gyakorisággal választotta az AS-kezelést, illetve a beteg követése során milyen változók mellett döntött az AS felfüggesztése, illetve aktív terápia megkezdése mellett.
Betegek és módszer: A Pécsi Tudományegyetem Urológiai Klinikáján a 2015. január és 2020 decembere között elvégzett prosztatabiopsziás beteganyagból összesen 809 pozitív, malignus szövettani mintázatot adó eset igazolódott.
A klinikai vizsgálatba történt betegbeválogatás a 2021-ben hatályos EAU urológiai irányelvei alapján történt. A 6 éves vizsgálati időintervallum alatt a 809 pozitív beteg mintából összesen 54 beteg felelt meg az AS feltételeinek. Az AS-kezelésbe beválogatott 54 beteg átlagéletkora 68 év (52–83), átlag induló PSA-értéke 6,28 ng/ml (0,9–17,7), átlag PSAD-értéke 0,16 ng/ml/cm3 (0,03–0,27) voltak, illetve 45 beteg ISUP1, 9 beteg ISUP2 kórszövettani grádussal rendelkezett. A beválogatott 54 betegből 24 beteg progrediált (40%) a vizsgált időintervallum alatt, az átlag követési idő 43 hónap (12–79), míg a progresszióig eltelt átlag idő 27 hónap (12–48) volt.
Eredmények: Az AS-kezelésből történő kiléptetéskor a betegek átlag PSA-értéke 7,8 ng/ml (1,1–12,1), átlag PSAD-értéke 0,175 ng/ml/cm3 (0,022–0,291) volt. A betegek utánkövetése során, csak 48%-nál (26/54) volt egyidejűleg a követés része a PSA, képalkotó vizsgálat, illetve kontroll-
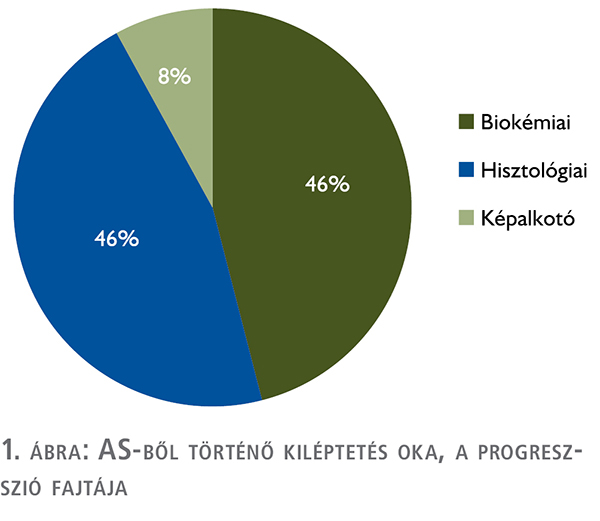
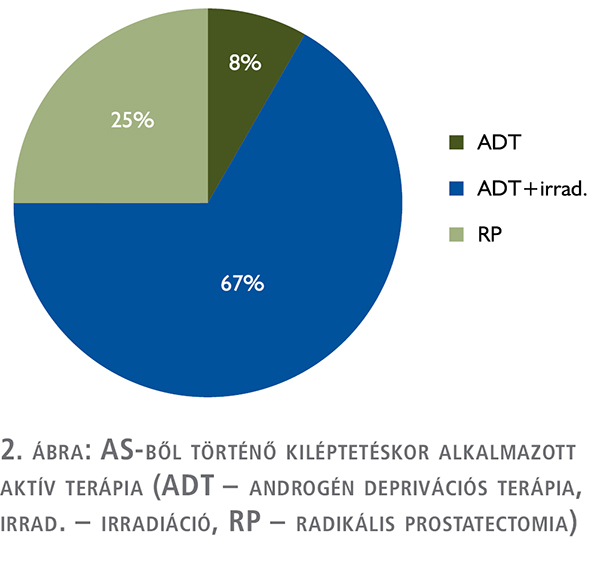
biopszia. A kiléptetés oka az esetek 46%-ában (11/24) önmagában a biokémiai progresszió, 46%-ában hisztológiai progresszió (11/24), 8%-ában (2/24) pedig képalkotó progresszió volt. Az AS-ből történt kiléptetést követően a betegek 8,3%-a (2/24) mono-ADT, 66,6%-a (16/24) ADT és sugárterápia, 25%-a (6/24) radikális prostatectomia ellátásban részesült.
A munkacsoportunk által elvégzett retrospektív klinikai vizsgálat eredményeinek feldolgozása során az irodalmi adatoknál kissé magasabb progressziós értékeket mértünk.
A beválogatás kritériumai megfeleltek a hatályos európai, illetve hazai irányelveknek, a nyomon követés során azonban a betegek csak 48%-ánál lehetett mind a PSA, radiológiai, illetve szövettani vizsgálatok együttes eredményeit fellelni. A rövid, átlag 43 hónapos utánkövetési idő ugyan elmarad az irodalmi 5-10 éves után követési időktől, de jól látható az a nem kellően megalapozott hazai gyakorlat, hogy a betegek AS-ből történő korai kiléptetése döntően a monitorizált PSA-értékek, és nem a számított PSA-értékek (PSAD, velocitás, PSAdt), radiológiai vizsgálatok (multiparametrikus MRI hiánya), illetve szövettani eredmény birtokában történik.
Következtetés: Az irodalmi adatok alapján a betegek több mint egyharmada az AS ideje alatt progressziót mutat (biokémiai, radiológiai, szövettani), így az aktív kezelési stratégiák egyikébe sorolódik át. A jelenleg hatályban lévő 2023-as EAU-irányelvek alapján továbbra is kifejezetten heterogén, az AS-betegcsoportba kerülő betegek utánkövetési gyakorlata; annak ellenére, hogy az ajánlások adottak, országonként, területenként eltérő feltételek mentén történik a beválogatás, illetve az aktív kezelésbe történő átsorolás.
Bevezetés
A prosztatarák a második leggyakoribb tumoros megbetegedés a férfiakban (1). Alapvetően egy lassan progrediáló betegségről van szó, amelynél mind a diagnosztikai mind a terápiás lehetőségek az utóbbi időben jelentősen fejlődtek. A szervre lokalizált prosztatakarcinóma rizikóbesorolásához elengedhetetlen a beteg induló prosztataspecifikus-antigén (PSA) értéke, a pontos klinikai T stádium meghatározáshoz multiparametrikus MRI képalkotó vizsgálatok elvégzése, illetve a patológiai T stádiumhoz, szövettani alcsoportok meghatározásához prosztata biopsziás szövettani lelet (Gleason-score, ISUP-grade). A prosztata malignus folyamatának szövettani igazolását követően, a magas Gleason-score, illetve lokálisan kiterjedt folyamatok esetén elengedhetetlen kiegészítő hasi-, mellkasi CT-képalkotás, illetve a csontmanifesztációk kizárása céljából csontszcintigráfiás vizsgálat elvégzése (2).
A szervre lokalizált prosztata adenokarcinóma kezelési lehetőségei a vizsgálati eredmények alapján felállított kockázati besorolás (nagyon alacsony, alacsony, kedvező-közepes, kedvezőtlen-közepes, magas) szerint tervezhetők. A ProtecT-study vizsgálati eredményei óta ismert, hogy a nagyon alacsony, alacsony, illetve a kedvező-közepes kockázati besorolású szervre lokalizált prosztata adenokarcinóma kezelési lehetőségei között az aktív surveillance (AS) 10 éves teljes túlélésben és daganatspecifikus túlélésben megegyező eredményeket hoz, mint a hivatkozott csoportokban alkalmazható aktív kezelési lehetőségek (radikális prostatectomia, irradiáció) (3).
Az aktív surveillance célja a klinikailag szervre lokalizált nagyon alacsony-, alacsony, illetve közepes-kedvező prognosztikájú prosztatakarcinómában szenvedő betegek szükségtelen, szövődményekkel terhelt kezeléseinek elkerülése. A betegek szoros megfigyelés alatt maradnak a strukturált diagnosztikai vizsgálatok révén, amelyek a PSA-mérésből, fizikális vizsgálatokból, multiparametrikus mágneses rezonancia képalkotás (mpMRI) és ismételt prosztatabiopsziákból állnak (4).
A betegek több mint egyharmada azonban az AS ideje alatt progressziót mutat (biokémiai, radiológiai, szövettani), így az aktív kezelési stratégiák egyikébe sorolódik át (5).
Az AS magyar eredményeiről mindezidáig kevés publikáció született, ezért munkacsoportunkkal célul tűztük ki az említett beteganyag adatainak feldolgozását régiónkban.
Betegek és módszer
A klinikai vizsgálatba történt betegbeválogatás a 2021-ben hatályos EAU urológiai irányelvei alapján történt. Vizsgálatunk során a PTE KK Urológiai Klinikán 2015 januárja és 2020 decembere között elvégzett prosztatabiopsziák eredményei alapján kerestük vissza az AS-be sorolt betegeket, majd az utánkövetés alapján nyertünk adatokat. Ebben az időintervallumban klinikánkon 809 malignitásra pozitív hisztológiai eredménnyel zárult biopszia történt, ebből 54 beteg felelt meg az AS feltételeinek.
Az AS-kezelésbe beválogatott 54 beteg átlagéletkora 68 év (52–83), átlag induló PSA-értéke 6,28 ng/ml (0,9–17,7), átlag PSAD-értéke 0,16 ng/ml/cm3 (0,03–0,27) voltak, illetve 45 beteg ISUP1, 9 beteg ISUP2 kórszövettani grádussal rendelkezett (1. táblázat).

Kockázati besorolás alapján 34 beteg került be a nagyon alacsony, 10 az alacsony, és 10 beteg a kedvező közepes kockázati csoportból, utóbbiak döntően ISUP 2-es szövettannal rendelkeztek, valamint 10 alatti PSA-val, 3 betegnél volt az induló PSA 10 ng/ml feletti.
A betegek 18,5%-ánál (10/54) volt a kivizsgálás része az mpMRI-vizsgálat. A betegek 48%-ánál (26/54) volt az utánkövetési protokoll része félévente PSA-vizsgálat, évente mpMRI és az első évben konfirmációs biopszia, 2 betegnél csak PSA-kontrollok, 26 betegnél PSA és képalkotó kontroll történt.
Eredmények
A beválogatott 54 betegből 24 beteg progrediált (40%) a vizsgált időintervallum alatt, az átlag követési idő 43 hónap (12–79), míg a progresszióig eltelt átlag idő 27 hónap (12–48) volt. Az AS-kezelésből történő kiléptetéskor a betegek átlag PSA-értéke 7,8 ng/ml (1,1–12,1), átlag PSAD-értéke 0,175 ng/ml/cm3 (0,022–0,291) volt. A 24 progrediáló betegből 8 a nagyon alacsony kockázati csoportból, 10 az alacsony, és 6 a kedvező közepes kockázati csoportból került ki.
A kiléptetés oka az esetek 46%-ában (11/24) önmagában biokémiai progresszió, 46%-ában hisztológiai progresszió (11/24), 8%-ában (2/24) pedig képalkotó progresszió volt (1. ábra).
Az AS-ből történt kiléptetést követően a betegek 8,3%-a (2/24) mono-ADT, 66,6%-a (16/24) ADT és sugárterápia, 25%-a
(6/24) radikális prostatectomia ellátásban részesült (2. ábra). A mono-ADT-ben részesülő 2 beteg időskorára és rossz általános állapotára való tekintettel kapta ezt a kezelést.
Megbeszélés
A jelenleg hatályban lévő 2023-as EAU-irányelvek alapján továbbra is kifejezetten heterogén, az AS-betegcsoportba kerülő betegek utánkövetési gyakorlata. Annak ellenére, hogy az ajánlások adottak, országonként, területenként eltérő feltételek mentén történik a beválogatás, illetve az aktív kezelésbe történő átsorolás. A rövid, átlag 43 hónapos utánkövetési idő ugyan elmarad az irodalmi 5-10 éves utánkövetési időktől, de jól látható az a nem kellően megalapozott hazai gyakorlat, hogy a betegek AS-ből történő korai kiléptetése döntően a monitorizált PSA-értékek, és nem a számított PSA-értékek (PSAD – PSA-denzitás, velocitás, PSADT – PSA doubling time), radiológiai vizsgálatok (multiparametrikus MRI hiánya), illetve szövettani eredmény birtokában történik.
A munkacsoportunk által elvégzett retrospektív klinikai vizsgálat eredményeinek feldolgozása során az irodalmi adatoknál kissé kedvezőtlenebb progressziós értéket mértünk (6). Ennek okaként felmerül a rossz rizikócsoport-besorolás, illetve önmagában a biokémiai progressziót követő aktív karra váltás [a betegek 46%-a (11/24) biokémiai progresszió miatt lett kiléptetve az AS-ből, amely nem kellően megalapozott döntés]. Ugyanakkor már ezen rövid időintervallumon belül is látszódik a fejlődő hazai gyakorlat, a 2019–2020-as évet követően már jóval nagyobb számban volt a kezdeti staging része az mpMRI-vizsgálat, illetve a hisztológiailag is megalapozott aktív karra váltás.
Talán az egyik legnehezebb feladat a szövettanilag igazolt prosztata adenokarcinómával rendelkező beteg betegségének lokális T stádium meghatározása. Az elmúlt években a kismedencei radiológiai képalkotó módszerek – elsősorban a multiparametrikus MRI – jelentős fejlődésen mentek keresztül. Az MRI-képalkotás technológiai fejlődése – 3 T MRI-készülékek Magyarországon történő elterjedése – lehetővé tette, hogy a klinikai T stádium pontosabb meghatározásán keresztül precízebb rizikóbesorolást alkalmazzunk. A konvencionális dekáns biopsziák mellett ma már rendelkezésre áll az úgynevezett fúziós UH-készülékek alkalmazásával elvégzett célzott „target” biopsziák elvégzése is. A multiparametrikus MRI-felvétel „real-time UH” képpel történő fúzionálása, majd az MRI-képeken megjelölt gócok pontos mintavételezése lehetővé teszi a nem szignifikáns prosztatarákok kiszűrését, aktív surveillancen keresztül történő kezelési módozat kiterjesztését (7).
A retrospektív klinikai vizsgálat eredményei azt mutatják, hogy a vizsgált időszakban klinikánkon még nem volt elterjedt az mpMRI használata a diagnózis felállításához, valamint az mpMRI célzott biopszia elvégzéséhez, hiszen az AS-be került betegek csupán 18,5%-a rendelkezett mpMRI-lelettel a terápiás döntés meghozatalakor (ennek hátterében felmerül a limitált hazai vizsgálati kapacitás, a következményes nehezített hozzáférés).
Az AS-kezelésbe beválogatott betegek utánkövetésekor alkalmazott PSA-mérések eredményeinek értékelése sem egyszerű. Jogos kérdésként vetül fel, hogy a döntően PSA-alapú utánkövetéskor, milyen PSA-értékek elérésekor mondható ki, hogy a beteg további AS-kezelése nem tartható, aktív kezelést kell, kapjon. Az ide vonatkozó klinikai vizsgálatok alapján három változót találtak, amelyek szignifikáns összefüggést mutattak az AS-csoportból történő kiléptetéssel. Az egyik ilyen változó a prosztatatömegre vonatkoztatott PSA-érték (PSA-denzitás), amelynek 0,15 ng/ml/cm3 feletti értéke aktív kezelésbe történő áthelyezést von maga után, illetve a rebiopsziás mintákban, ha 2 pozitív mintaszám feletti érték igazolódik, illetve az afroamerikai rassz megléte (8).
Csak úgy lehet az AS-kezelési csoportba a várt kedvező onkológiai mutatónak az elérése (OS, CSS), ha standardizált módon történik a betegek követése: 3-6 havonta PSA-ellenőrzés, PSAD és PSADT, minimum évente RDV, 6 havonta mpMRI, illetve az első év végén TRUS-vezérelte rebiopszia elvégzése. Ha a betegség progressziójára van gyanú, a beteget aktív kezelési csoportba kell átléptetni. Progressziót jelez, ha a PSAD meghaladja a 0,15 ng/ml/cm3 értéket, a multiparametrikus MRI-vizsgálaton a korábbi daganatos terület mérete nő, PIRADS (Prostate Imaging-Reporting and Data System) értéke progrediál, illetve a rebiopsziás anyagban a Gleason/ISUP-érték növekszik, ennek megfelelően tehát „kockázati csoportugrás” következik be (9).
Következtetések
Az irodalmi adatok alapján a betegek több mint egyharmada az AS ideje alatt progressziót mutat, így az aktív kezelési stratégiák egyikébe sorolódik át. Hazánkban, az általunk vizsgált régióban továbbra is alacsony az AS-kezelések száma. A retrospektív klinikai vizsgálat rámutat arra is, hogy a multiparametrikus MRI-vizsgálatok hiánya – a klinikai vizsgálatba bevont betegek közül összesen csak 18,5% rendelkezett ilyen típusú vizsgálattal – nem teszi lehetővé a pontos klinikai T stádium meghatározását, így a betegség tokérintettségének, illetve egyik-, vagy mindkét oldali lebenyérintettségének jelenlétét sem tudja kimutatni. A döntően alulbecsült („understaging”) klinikai stádium oda vezet, hogy a betegség prognosztikai meghatározása pontatlan, nagyobb arányban kerülnek be közepes-kedvezőtlen, illetve magas kockázatú prosztatarák-betegek az AS-betegcsoportba rontva ezzel annak hatékonyságát.
Az évről évre megújuló klinikai irányelvek követése, a megjelenő új klinikai vizsgálatok eredményeinek értékelése, a multiparametrikus MRI-vizsgálatok számának emelése, a PIRADS-besorolás pontosítása, gyakorlati szintű, egységes alkalmazása és a klinikai gyakorlatba történő bevonása eredményezné azt, hogy az AS széles körű alkalmazása Magyarországon is megvalósuljon, gyakorlattá váljon.
Irodalom
1. Prashanth Rawla, et al. Epidemiology of Prostate Cancer World. J Oncol 2019 Apr; 10(2): 63–89. https://doi.org/10.14740/wjon1191
2. EAU Guideline Prostate Cancer 2024
3. Hamdy FC, et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 2016; 375: 1415.
4. Maria Komisarenko, Lisa J. Martin, et al. Active surveillance review: contemporary selection criteria, follow-up, compliance and outcomes. Transl Androl Urol 2018 Apr; 7(2): 243–255. https://doi.org/10.21037/tau.2018.03.02
5. Sigrid Carlsson, et al. Long-term outcomes of active surveillance for prostate cancer – the Memorial Sloan Kettering Cancer Center experience. J Urol 2020 Jun; 203(6): 1122–1127.
https://doi.org/10.1097/JU.0000000000000713
6. Klotz, et al. Long-Term Follow-Up of a Large Active Surveillance Cohort of Patients With Prostate Cancer. J Clin Oncol 2015; 33: 272.
https://doi.org/10.1200/JCO.2014.55.1192
7. Sangeet Ghai, et al. Multiparametric-MRI in diagnosis of prostate cancer. Indian J Urol 2015 Jul-Sep; 31(3): 194–201.
https://doi.org/10.4103/0970-1591.159606
8. Rider JR, Sandin F, Andrén O, et al. Long-term outcomes among noncuratively treated men according to prostate cancer risk category in a nationwide, population-based study. Eur Urol 2013; 63: 88–96.
https://doi.org/10.1016/j.eururo.2012.08.001
9. Petrelli F, et al. Predictive Factors for Reclassification and Relapse in Prostate Cancer Eligible for Active Surveillance: A Systematic Review and Meta-analysis. Urology May 2016; 91: 136–142.
https://doi.org/10.1016/j.urology.2016.01.034