A case of active surveillance in our prostate tumor patient with Non-Hodgkin lymphoma
DOI: 10.2259/magyurol.2024.3.kazmart.154
Authors:
Kazmar Tamás dr., Domján Zsolt dr.
Észak-budai Szt. János Centrumkórház, Urológiai Osztály, Budapest (osztályvezető: Domján Zsolt dr.)
Summary
Introduction: In the therapy of prostate tumours, active surveillance may sseems to be a risky form of treatment to the patients as well as their attending doctors. The European Association of Urology (EAU) protocol states that the process should be follow of regular PSA and rectal digital examination, which sometimes needs to be supplemented with histological sampling, not forgetting the imaging assistance provided by prostate MR. Due to the coronavirus pandemic in recent years, the care of patients on active surveillance has become difficult, so a rare appearance of a co-morbidity could make the previously considered certain urological therapeutic choice completely uncertain.
Case report: Our 51-year-old asymptomatic patient was investigated during a control examination due to an elevated PSA value. A prostate biopsy gave the diagnosis of a low-risk prostate tumour, so we decided to start active surveillance, but due to the coronavirus pandemic, he was not monitored as often as he should have been. Next time, he appeared with locomotor pain, weight loss, night sweats and also felt enlarged tumours in the neck and armpit areas. Imaging tests confirmed tumour-suspicious lymph nodes. Sampling from axillary and abdominal lymph nodes showed the appearance of Non-Hodgkin lymphoma. A pelvic MR examination was performed, which evaluated space occupation with extraprostatic spread (PIRADS 5) in the right lobe of the prostate. Repeated prostate biopsy samples taken from the right lobe were described as infiltrative B-cell lymphoma and samples from the left lobe confirmed the prostate tumour known after our first sampling. The patient’s haematological treatment was started, and his complaints disappeared. Control pelvic MRI did not suggest the presence of a clinically significant tumour in the prostate (PIRADS 2).
Conclusion: The exact indication and implementation of active surveillance is vital in the case of low-risk prostate tumours. Progression on active surveillance may refer to the faults of risk assessment, or an appearance of a seconder disease. In these cases rebiopsy can clear the possible process and define the right therapeutic option. In our case, the chosen active surveillance proved to be a right decision which also offers the best quality of life to our patient.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Bevezetés: A prosztatadaganatok terápiájában az aktív követés mind a betegek, mind kezelő orvosuk számára kockázatos kezelésformának hangozhat. Az European Association of Urology (EAU) protokollja kimondja, hogy folyamata rendszeres PSA és rektális digitális vizsgálatból áll, amelyet időnként szövettani mintavétellel szükséges kiegészíteni, nem megfeledkezve a prosztata MR által nyújtott képi segítségről. A koronavírus által terhelt utóbbi években az aktív követésen lévő páciensek gondozása nehezített volt, így egy ritka társbetegség megjelenése teljesen bizonytalanná tehette az addig biztosnak vélt urológiai terápiás álláspontunkat.
Esetismertetés: 51 éves panaszmentes páciensünknek kontrollvizsgálat során emelkedett PSA-érték miatt indult kivizsgálása. Prosztatabiopszia low risk prosztatadaganat diagnózisát adta, így a beteg aktív követése mellett döntöttünk, ám a koronavírus-járvány miatt monitorozása elmaradt. Legközelebb mozgásszervi fájdalmakkal jelentkezett, illetve fogyást, éjszakai izzadást panaszolva, továbbá nyaki, hónalji területeken megnagyobbodott teriméket tapasztalt. Képalkotó vizsgálatok tumorgyanús nyirokcsomókat igazoltak. Hónalj és hasi nyirokcsomókból történt mintavétel non-Hodgkin-lymphoma megjelenését mutatta. Kismedencei MR-vizsgálat készült, amely a prosztata jobb lebenyénél extraprosztatikus terjedésű (PIRADS 5) térfoglalást véleményezett. Ismételt prosztatabiopszia jobb lebenyből vett mintákat infriltratív B-sejtes lympoma szövettanának írta le, a bal oldali lebenyből az első mintavételünk után megismert prosztatadaganatot igazolta. Elindult a páciens hematológiai kezelése, panaszai megszűntek. Kontroll kismedencei MR a prosztatán belül klinikailag szignifikáns tumor jelenlétét nem valószínűsítette (PIRADS 2).
Következtetések: Az aktív követés pontos indikációja és kivitelezése létfontosságú alacsony rizikójú prosztatadaganatok esetében. Alacsony rizikó esetén jelentkező jelentős progresszió a kezdeti rizikóbesorolás hibájára, valamint ritkábban más, szekunder betegség megjelenésére is utalhat. Ezen esetekben a mielőbbi rebiopszia tisztázhatja a kórlefolyást és jelölheti ki a helyes terápiás utat. Amennyiben a páciens részletes monitorozása bármely ok miatt elmarad, gondolnunk kell a daganat progressziójára vagy új, ritkább társbetegség megjelenésére egyaránt. Esetünkben a megválasztott aktív követés jó döntésnek bizonyult, amely a legjobb életminőséget kínálja páciensünknek.
Bevezetés
Aktív követés indikációi között a 10 évnél hosszabb várható élettartam és alacsony kockázatú prosztatadaganat (PSA-értéke 10 ng/ml alatt van, Gleason-értéke 7 alatti és klinikailag T1-2a stádiumú) szerepel. Ekkor nincs szükség azonnali beavatkozásra, hanem gyakori kontrollokkal követjük a pácienst, megkímélve az esetleges korai műtéti vagy sugárterápiás szövődményektől. Az aktív követés folyamata több elemből áll, ezek közül az egyik a PSA-vizsgálat (min. 6 havonta). Rektális digitális vizsgálatot legalább 1× évente szükséges elvégezni. TRUS-prosztata-mintavétel minimum 1× 3 évente, 10 évig. PSA-emelkedés esetén ismételt biopszia szükséges. Prosztata MR-vizsgálat szintén része kell, hogy legyen az aktív követésnek, a daganat progressziójának észlelésében, vagy PSA-emelkedés esetén, a biopszia tervezéséhez tud segítséget nyújtani.
Esetismertetés
51 éves, érdemi kórelőzménnyel nem rendelkező betegünknek PSA-vizsgálata során 4,15 ng/ml érték igazolódott. Rektális digitális vizsgálata negatív eredményt adott. Prosztata MR készült, amely a bal oldali perifériás zónában két darab (kb. 6-7 mm nagyágú) jelszegény gócot mutatott. A prosztata biopsziás mintavétele következett, amely minimális mennyiségű, Gleason 3+3 patológiájú adenocarcinoma daganattípust igazolt (bal oldali perifériás, illetve transitionalis zónából és a jobb oldali basalis és apex területéről vett mintákból). Staging képalkotó vizsgálatok nem igazoltak egyértelmű daganatterjedésre utaló eltéréseket. Fentiekre tekintettel a daganat nemzetközi guideline szerinti low risk kategóriába volt besorolható, ezért a páciens aktív követése mellett döntöttünk.
Ezt követően azonban a COVID-19-pandémia miatt egy évig a beteg részletes monitorozása elmaradt.
Egy év után lumbalis, sacralis és sternalis fájdalmakkal jelentkezett, emellett fogyás, éjszakai verítékezésről számolt be. Nyak, hónalj területen megnagyobbodott nyirokcsomók mutatkoztak. Ultrahang, majd kontrasztanyagos CT-vizsgálat a truncus coeliacus területén, az arteria mesenterica superior magasságában, a mesenterium bal felhasi területén, a bal oldali axillánál jelentősen megnagyobbodott nyirokcsomókat igazolt. Csontszcintigráfia kisebb litikus folyamatot írt le a sacrum területén. Először az axilla és hasi nyirokcsomókból történt mintavétel intervenciós radiológus segítségével. A kórszövettani vizsgálat CD20, CD5 pozitivitású Grade 1 follicularis non-Hodgkin-lymphoma (NHL) diagnózisát adta. Prosztata MR-vizsgálat is készült, amely a prosztata jobb oldali lebenyénél, perifériás zónánál extraprostaticus terjedést mutató, a jobb vesicula seminalis-t, femur fejet, neurovaszkuláris köteget érintő, rectum felé törő (PIRADS 5) térfoglalást írt le (1. ábra).
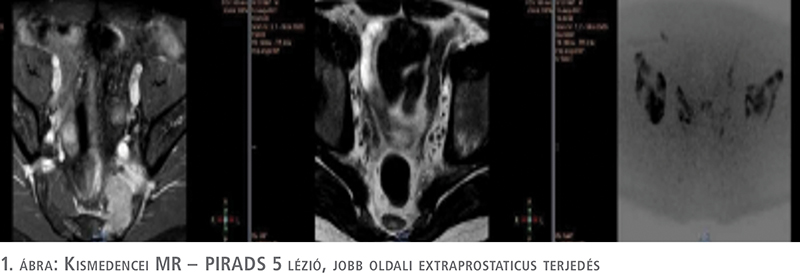
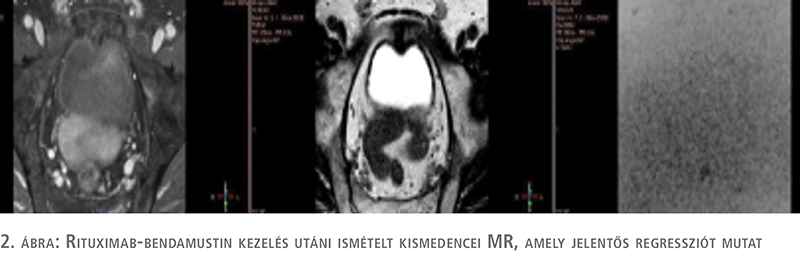
Az urológiai szempontból aktív követés – mint a daganatkezelési eljárás – helyes választása a vizsgálati eredmények birtokában megkérdőjeleződött bennünk. A prosztatabiopszia megismétlése mellett döntöttünk. Meglepetésünkre a patológiai vélemény a prosztata jobb oldali lebenyéből vett mintákat B-sejtes lymphomának véleményezte, amely infiltrálja a környezetet, míg a prosztata bal oldalából vett szövettani eredmény ugyan az az ismert Gleason 3+3 malignitás, amely az első prosztatabiopszia után mutatkozott. Hematológiai indikációval PET-CT-vizsgálat készült, ez alapján a lymphoma IV. stádiumúnak bizonyult. Elindult a páciens kemoterápiás kezelése. Már az első ciklus rituximab-bendamustin terápia után a páciens állapota jelentősen javult, éjszakai izzadása megszűnt, csontfájdalmai szanálódtak, étvágya visszatért. Kismedencei MR-vizsgálat összehasonlítva a kemoterápiás kezelést megelőző MR-vizsgálat képanyagával leírja, hogy a prosztatán belül klinikailag szignifikáns tumor jelenléte nem valószínű (PIRADS 2). Összességében a hematológiai alapbetegség tekintetében kifejezett regresszió volt látható (2. ábra). Urológiai szempontból betegünk panaszmentes.
Megbeszélés
Az aktív követés relevanciája mellett szóló, több mint 1600 beteget bevonó tanulmány (ProtecT), 10 éven keresztül vizsgálta a teljes (és daganatspecifikus) túlélést döntően low risk prosztatadaganatos páciensek esetében, akik terápiája vagy prostatectomia vagy sugárterápia vagy aktív követés volt. Eredményeként közlésre került, hogy túlélés szempontjából az aktív követés low risk prosztatadaganatos betegek esetében nem rosszabb, mint azon páciensek esetében, akik operációban vagy sugárkezelésben részesültek (1).
Egy másik, a 20. század második felében indult, több mint 800 beteget foglalkoztató tanulmány (svéd populációban) prosztatadaganatos páciensek életkilátásait hasonlította össze különböző tumorstádiumok, illetve beavatkozások tekintetében. Egyik lényegi konzekvenciájaként elmondható, hogy alacsony rizikójú prosztatadaganatot aktív követéssel „kezelni” hosszú távon jobb, mint ha annak a túlkezelése történne (2). Életminőség szempontjából több cikk is összehasonlítja a fentebb említett kezelési módszereket (műtét, sugárkezelés, aktív követés). Ezek ismeretében könnyen elmondhatjuk, hogy a prostatectomia utáni átmeneti vagy esetleg megmaradó, különböző mértékű inkontinencia, továbbá a szintén életminőséget rontó impotencia és erektilis diszfunkció, a sugárkezelés utáni gasztrointesztinális és genitourinalis eltérések ronthatják a páciens életminőségét, míg az aktív követés nem jár ilyen és ezekhez hasonló szövődményekkel (3).
A dülmirigyet is infiltráló NHL előfordulása nem gyakori. A primer NHL csupán kb. 0,1%-a érinti a prosztatát, illetve a prosztatadaganatok csupán kb. 0,1%-a lymphoma. Másodlagosan természetesen ennél nagyobb arányban terjed az NHL a prosztata szövetére, de így is ritka jelenségről beszélünk (4, 5).
Ezen szövettani eredményeinek birtokában az urológiai szempontból releváns prosztata adenocarcinoma kezelésének módját nem változtattuk meg, továbbra is aktív követést folytattunk betegünknél.
Következtetések
Esetismertetésünket azért tartottuk bemutatásra érdemesnek, mert egyrészt felhívja a figyelmet az aktív surveillance szigorú követési kritériumaira, amit a pandémia nehezített, másrészről a módszer előnyeire, különösképpen egy szekunder tumor jelentkezése esetén.
Irodalom
1. Hamdy FC, Donovan JL, Lane JA, Mason M, Metcalfe C, et al. ProtecT Study Group. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 2016 Oct 13; 375(15): 1415–1424. https://doi.org/10.1056/NEJMoa1606220
2. Sandblom G, Dufmats M, Varenhorst E. Long-term survival in a Swedish population-based cohort of men with prostate cancer. Urology 2000 Sep 1; 6(3): 442–7. https://doi.org/10.1016/s0090-4295(00)00696-8
3. Donovan JL, Hamdy FC, Lane JA, Mason M, Metcalfe C, et al. ProtecT Study Group. Patient-Reported Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. N Engl J Med 2016 Oct 13; 375(15): 1425–1437. https://doi.org/10.1056/NEJMoa1606221
4. Görgel SN, S¸efik E, Olg˘unelma V, S¸ahin E, Balcı U, Çallı AO. Primary non-Hodgkin follicular lymphoma of the prostate: A case report. Turk J Urol 2014 Mar; 40(1): 57–8. https://doi.org/10.5152/tud.2014.68466
5. Khandelwal KC, Moorjani VK, Mohan C, Udani RJ, Patange VB. Non-Hodgkin lymphoma of the prostate. Can Assoc Radiol J 1994 Feb; 45(1): 56–7.