Our experience with reduced-dose intravesical BCG treatment in cases of in situ bladder cancer
DOI: 10.22591/magyurol.2024.4.pappm.184
Authors:
Papp Máté dr.1, Szabó Kíra2, Szántó Árpád dr.1, Damásdi Miklós dr.1
1Pécsi Tudományegyetem, Klinikai Központ, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
2Pécsi Tudományegyetem, Általános Orvostudományi Kar, Pécs (dékán: Nyitrai Miklós dr.)
Summary
Introduction: In situ carcinoma is a special histological type of non-muscle-invasive bladder tumours with a high grade and extremely aggressive behaviour, which progresses in 54% of cases in the absence of appropriate therapy. The therapeutic options are induction and then maintenance BCG treatment, as well as radical cystectomy.
Patients and methods: Authors reviewed 616 patient’s history who underwent transurethral resection between January 2017 and December 2021 at PTE KK Urology Clinic. Patients data with in situ carcinoma histology pattern (CIS) were analysed. 49 people without synchronic muscle-invasive tumour component were included in the study material, their data were evaluated using the IBM SPSS Statistics program.
Results: In one group of patients BCG relapse prophylaxis, followed by maintenance treatment, and radical cystectomy in the other group was performed. Radical cystectomy reduced the risk of disease progression by approximately four times compared to the group of people who only received BCG therapy (P= 0.063). In the case of patients receiving 80 mg of BCG per treatment, no early relapse occurred, while in the case of patients treated with a reduced dose (40 mg), the relapse rate was 37.8% (14/37). The BCG maintenance treatment doubled the average recurrence-free survival time.
Conclusions: With the of appropriate BCG instillation treatment the rate of early relapse can be reduced. Supplementation of induction therapy with maintenance BCG is justified for all patients in this patient group. In terms of oncological endpoints, more favourable results were confirmed after radical cystectomy than in the case of BCG therapy.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 4. SZÁM
Összefoglalás
Bevezetés: Az in situ carcinoma a nem izominvazív hólyagdaganatok egy speciális, magas grádusú, rendkívül agresszív viselkedést mutató szövettani típusa, amely megfelelő terápia hiányában 54%-ban progrediál. Terápiás lehetőségei az indukciós, majd fenntartó BCG-kezelés, illetve a radikális cystectomia.
Betegek és módszerek: A PTE KK Urológiai Klinika beteganyagán, a 2017 januárja, és 2021 decembere között transurethralis reszekción átesett 616 beteghez tartozó, 1086 pozitív szövettani lelet áttekintését követően az in situ carcinoma (CIS) szövettannal rendelkező betegek vizsgálatát végeztük el. A vizsgálati anyagban 49 fő került bevonásra, amelyek adatainak kiértékelését az IBM SPSS Statistics program segítségével végeztük.
Eredmények: A CIS kezelésekor a betegek egyik csoportjánál alkalmazott BCG recidívaprofilaxis, majd fenntartó kezelés, illetve a másik csoportnál alkalmazott radikális cystectomia során a radikális cystectomia körülbelül négyszeresére csökkentette a betegség progressziójának rizikóját a csak BCG-terápiában részesült személyek csoportjával szemben (p=0,063). A kezelésenként 80 mg BCG-t kapó betegek esetén korai recidíva nem alakult ki, míg a csökkentett dózissal kezelt (40 mg) beteg esetén a recidívaarány 37,8% (14/37). Az indukciós kúra mellé adott fenntartó terápia (40 mg csökkentett dózissal) az átlagos recidívamentes túlélési időt kétszeresére növelte.
Következtetések: A csökkentett BCG-dózis megfelelő alkalmazásával – indukciós, majd fenntartó kezelés – illetve a teljes dózis esetén, a korai recidíva kialakulásának aránya csökkenthető. Az indukciós terápia fenntartó BCG-vel történő kiegészítése indokolt minden beteg esetén ebben a betegcsoportban. Onkológiai végpontokat tekintve kedvezőbb eredmények igazolódtak a radikális cystectomiát követően, mint BCG-terápia esetén.
Bevezetés
A hólyagrákban szenvedő betegek körülbelül 75%-ánál igazolható nem izominvazív hólyagtérfoglaló folyamat (Ta, CIS vagy T1-stádium).
A húgyhólyagdaganatok egy speciális, magas malignitási potenciállal rendelkező szövettani változata az in situ carcinoma (CIS). A de novo (primer) CIS az összes urothelialis daganat kevesebb, mint 3%-át teszi ki; azonban az urothelialis karcinóma követése során egyidejűleg vagy másodlagosan észlelt CIS a hólyagrák 45%-át, illetve 90%-át teheti ki. A diagnózistól számított 5 éven belül a betegek 40-60%-ánál alakul ki invazív betegség, a progresszió kockázata átlagosan 54% (1).
Az elmúlt időszakban a CIS molekuláris biológiai jellegzetességének megismerése irányába számos vizsgálat történt. A CIS magas malignitási fokának köszönhetően a vizsgálatok alapján jóval több kromoszómális eltérés jellemzi, mint az alacsony grádusú papilláris betegségeket.
A malignus papillaris urothelialis daganatokkal egy időben megjelenő CIS a klinikai vizsgálatok alapján (2) sem a progressziómentes túlélési (PFS), sem pedig a teljes túlélési (OS) adatokban nem okoz szignifikáns változást, azonban a transurethralis hólyagreszekciós mintákban a neoadjuváns kezeléseket követően (MIBC esetén kemoterápiás kezelések) mintegy négyszerese volt a komplett patológiai remissziónak a CIS-t nem tartalmazó esetekben.
A CIS jelenlegi kezelési lehetőségei között az intravesicalis BCG (indukciós és fenntartó) és a radikális cystectomia műtéti beavatkozása magas szintű ajánlásként szerepelnek az ide vonatkozó irányelvek (NCCN, ESMO, EBU) mindegyikében.
Célkitűzések
A PTE KK Urológiai Klinikán végzett retrospektív klinikai vizsgálat a húgyhólyag in situ carcinomájának terápiás gyakorlatát, az intravesicalisan adott csökkentett dózisú (40 mg) Bacillus Calmette-Guerin (BCG) kezeléssel, illetve a radikális cystectomia elvégzésével szerzett tapasztalatainkat, illetve összehasonlító vizsgálatok elemzését mutatja be. E két terápiás modalitás betegségmentes túlélésre kifejtett hatásának összehasonlítását, onkológiai kimenetelek elemzését, az alkalmazott BCG dózisának megválasztását, primer szövettan és a választott terápiás modalitások a betegség onkológiai kimenetelének összehasonlító elemzéseit is ismerteti.
Betegek és módszertan
A PTE KK Urológiai Klinikán 2017. január és 2021. december vége között, hólyagtumor miatt transurethralis hólyagreszekción átesett betegeink anyagán végeztünk retrospektív módon vizsgálatot. Először a fent ismertetett időintervallumban transurethralis reszekción átesett 616 beteghez tartozó 1086 pozitív szövettani minta eredményeit tekintettük át, amelyek mindegyike urothelialis karcinóma volt. A klinikai vizsgálatba történő beválogatási kritérium a szövettani minták in situ carcinoma komponens jelenléte volt, amely 68 személy esetén teljesült, kizárásra került minden olyan beteg, akik esetén a CIS-hez T2, illetve ennél magasabb lokális stádiumú daganat társult, így 49 beteg került véglegesen a klinikai vizsgálatba. A primer szövettan – amely esetünkben csak CIS, illetve CIS plusz egyéb Ta/T1 daganat lehetett – minden beteg esetén megállapítható volt a patológiai leletek alapján. A terápiára vonatkozó információkat a kórtörténeti adatok tanulmányozása során nyertük. Betegeink további kategorizálását a jelenleg érvényben lévő protokollok által ajánlott vizsgálatok eredményei alapján folytattuk. Adataink analízise az IBM SPSS Statistics program segítségével történt.
Eredmények
A 616 betegből 68 személy esetén igazolódott CIS komponens, tehát az in situ carcinoma incidenciája 11,03%-ra tehető vizsgálatunkban.
Az átlagéletkor 71 év, a klinikai vizsgálatba bekerült tényleges beteganyag 82%-a (40/49) férfi, 18%-a (9/49) nő volt (1. táblázat).
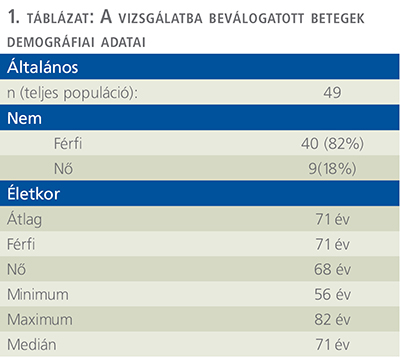
A beválasztott 49 beteg közül 16 beteg esetén in situ carcinoma, mint önálló szövettani entitás került felismerésre, a további 33 személy hisztológiai eredményeit áttekintve a CIS mellé egyéb, nem izominvazív (Ta, T1) komponens is társult.
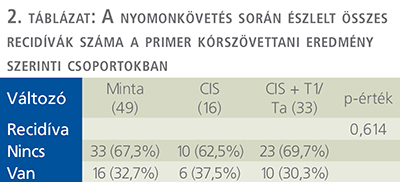
A csak CIS komponensű daganattal rendelkező 16 személyből 6 esetén (6/16, 37,5%) a betegség kiújult, míg a fennmaradó 10 páciens (62,5%) eredményeit áttekintve recidíva nem igazolódott. Azon betegcsoportban, ahol egyéb szövettani elem is kapcsolódott az in situ carcinomához, az ide sorolt 33 személyből 10 esetén (30,3%) alakult ki recidíva, a további 23 főnél (69,7%) ez nem került leírásra. Szövettantól függetlenül a betegek 32,7%-a esetén újult ki a betegség, ami esetünkben 16 beteget jelent, a többséget kitevő 33 fő tekintetében recidíva nem volt megfigyelhető (2. táblázat).
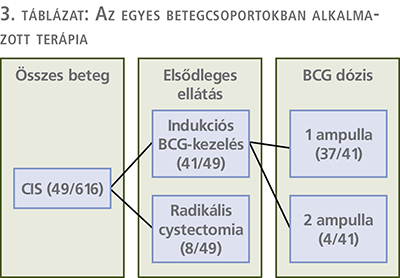
A CIS miatt kezelt betegek közül 41-en részesültek protokoll szerint 6 széria indukciós BCG-kezelésben (41/49, 83,7%), 37-en 1 ampullát (40 mg/1-19,2×108 Colony Forming Units – CFU), míg a fennmaradó 4 beteg 2 ampulla BCG-t kapott (80 mg/2×1-19,2×108 Colony Forming Units (CFU). A fennmaradó 8 beteg esetében részben a korán megjelenő BCG-intolerancia, részben a látott endoszkópos kép miatt az elsődleges terápiát az azonnali radikális cystectomia elvégzése jelentette (8/49, 16,3%) (3. táblázat).
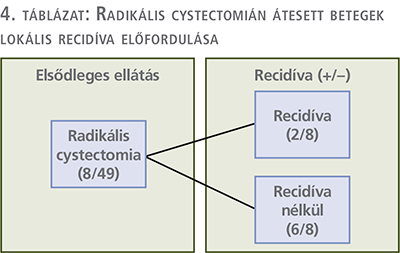
A radikális cystectomiás minták szövettani feldolgozásainak alapján a 8 érintett betegből 4 esetében (4/8, 50%) a CIS-hez egyéb, magas grádusú, izominvazív komponens is társult, 3 beteg esetén (3/8, 37,5%) CIS, mint önálló szövettani entitás igazolódott. A fennmaradó 1 beteg (1/8, 12,5%) mintájában CIS mellett egyéb, magas grádusú, nem izominvazív komponens volt fellelhető. A 8 páciens közül két fő esetén (2/8, 25%) igazolódott lokális recidíva az utánkövetés során, ezen betegek primer patológiai mintáiban a CIS mellett izominvazív komponens is volt, míg a fennmaradó 6 személynél (6/8, 75%) nem újult ki a betegség (4. táblázat).
Az összes per primam csökkentett dózisú indukciós BCG-kezelésben részesült beteg esetén 3 és 6 hónap múlva is kontroll uretrocisztoszkópiát, illetve vizeletcitológiai vizsgálatot végeztünk, amelyek eredményei alapján további alcsoportokba soroltuk betegeinket. 27 fő esetén (27/41, 65,9%) mind az uretrocisztoszkópia, mind a citológia eredménye negatív lett, míg a fennmaradó 14 esetben (14/41, 34,1%) vagy a cisztoszkópos kép, vagy a citológia, esetleg mindkét vizsgálati módszer pozitív eredményre vezetett (5. táblázat).
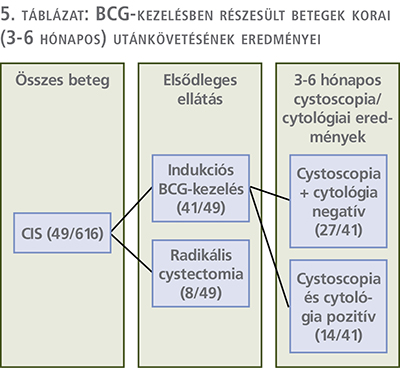
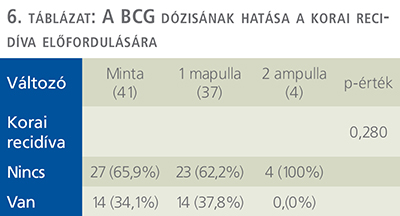
Ezek a betegek 1 ampulla BCG-t kaptak. Azon 37 betegből, akik szimpla dózist kaptak, 14 esetben (37,8%) igazolódott korai recidíva (3 esetben 3 hónap múlva, 11 esetben a 6. hónapban), 23 személynél (62,2%) azonban mindkét vizsgálat negatív eredményt mutatott. A dupla dózisban részesült 4 személy közül egy beteg esetén sem alakult ki korai recidíva (6. táblázat).
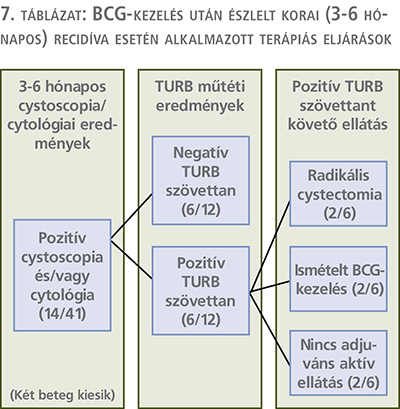
Pozitív eredmények esetén a protokoll szerint ismételt TURB végzése jön szóba, azonban ez csak 12/14 beteg esetén történt meg. Az így kapott minták patológiai eredményeit áttekintve 6 személynél (6/12, 50%) a szövettan ismét malignitásra pozitív lett, közülük egy fő esetén izominvazivitás is leírásra került. A maradék 6 esetben pedig negatív hisztológiai eredmény érkezett vissza. A 6 pozitív eredménnyel rendelkező páciens esetében különböző utókezelést alkalmaztunk, amely 2 személynél (2/6 33,3%) radikális cystectomia elvégzését jelentette, másik 2 főnél ismételt BCG-terápiát indítottunk, a maradék 2 beteg esetében ismételt recidívaprofilaxis megkezdésére nem került sor, kiterjesztett kismedencei műtét nem történt meg. A 2 radikális cystectomián átesett páciensek műtéti preparátuminak szövettani eredményeit áttekintettük, mindkét esetben malignus urothelialis elváltozás került leírásra. A 6 (6/12) negatív hisztológiai eredménnyel rendelkező beteg közül csupán 1 személynél folytatódott a protokoll szerint adandó fenntartó BCG-kezelés (7. táblázat).
A 27 negatív cisztoszkópiás és citológiai eredménnyel rendelkező beteg esetében a Guideline szerint fenntartó BCG-kezelést kell folytatni (3). Közülük anamnesztikus adatok alapján 8 beteg részesült fenntartó kezelésben, 11 páciens nem kapta meg a kúrát, a fennmaradó 8 személy esetén a rendelkezésre álló információk nem voltak elegendők a betegek további elemzésére, így ők kizárásra kerültek. A megmaradt 19 beteg eredményei alapján vizsgáltuk a fenntartó terápia és a kialakuló recidíva kapcsolatát az utánkövetés különböző időpontjaiban.
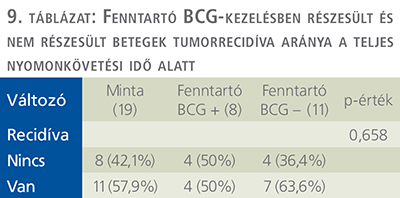
A fenntartó BCG-terápiában részesült 8 páciens közül egy esetben sem újult ki a betegség az első éves kontrollvizsgálatok eredményei alapján, minden beteg daganatmentes volt az első év végén. Ugyanezen arányokat megvizsgáltuk a fenntartó kúrában nem részesült 11 fős csoportban is. Ezen betegek közül 5 fő (45,5%) esetén 1 éven belül recidív tumor került felismerésre, míg a további 6 személy daganatmentes maradt (8. táblázat).

Azon 8 betegből, akik fenntartó BCG-kezelésben részesültek, 4 fő (50%) esetén a betegség nem újult ki az utánkövetés teljes ideje alatt, azonban az esetek másik felében sajnos megjelent a recidíva. A fenntartó terápiában nem részesült 11 páciensből 7 esetében (63,6%) recidíva került felismerésre, 4 személynél (36,4%) ez nem igazolódott (9. táblázat).
A fenntartó BCG-kezelésben részesülő betegeinknél (4 fő) meghatározásra került a recidíva megjelenéséig eltelt átlagos idő, amely 26,25 hónapnak felelt meg, a kiújulásig eltelt idő mediánja 24 hónap lett. Legkorábban 21 hónap után újult ki a daganat, a maximum recidívamentes túlélés pedig 36 hónapra tehető. A fenntartó intravesicalis immunterápiában nem részesült 7 beteg esetén is elvégeztük ugyanezen analíziseket. Ebben a csoportban a recidíva megjelenéséig eltelt átlagos idő 14,14 hónap volt, míg a medián 9 hónapra tehető. Leghamarabb 9 hónap múlva jelent meg ismét a daganat, míg a recidíváig eltelt idő maximuma ezen csoportban 26 hónap volt.
Megbeszélés
Az irodalmi adatok alapján a szövettani mintákban az egyidejű CIS jelenléte növeli a TaT1 daganatok kiújulásának és progressziójának kockázatát (4, 5). Az in situ carcinoma önmagában endoszkópos úton nem gyógyítható, a szövettanilag igazolt CIS kezelése intravesicalis BCG adásával (indukciós és fenntartó), vagy radikális cystectomia elvégzésével kell, hogy kiegészüljön. Kezelés nélkül a CIS-ben szenvedő betegek körülbelül 54%-a izominvazívvá válhat (6). Sajnos nem állnak rendelkezésre megbízható prognosztikai tényezők, de a CIS együttes előfordulása a T1 daganatokkal növeli recidíva, illetve a progresszió arányát a csak CIS szövettani eredménnyel rendelkező betegekhez képest (7, 8).
A BCG unresponse betegeknél a TURB műtéti beavatkozást követően további BCG-kezelés nem jön szóba, radikális cystectomia elvégzése szükséges.
A BCG-kezeléseket követő recidívák szövettani feldolgozása alapján a csak papilláris típusú recidívák sokkal jobban reagáltak a BCG-kezelésekre (1 éven belüli recidívamentesség 44%, 19 hónapon belüli progressziómentesség 89%), mint a CIS-tartalmú recidívák (17% 1 éven belüli recidívamentesség, 95% progressziómentesség) rámutatva arra, hogy a CIS megjelenésű daganatok kórélettana jelentősen eltér a papilláris daganatokétól (9).
Klinikai vizsgálatunk során a CIS miatt BCG-terápiában részesült 41 személy közül 14 beteg esetén (34,15%) lett pozitív a 3. hónapban elvégzett cisztoszkópia és/vagy citológia, amely a korai recidíva kialakulását jelezte. Az általunk vizsgált 41 BCG-kezelt személy közül 15 személy daganata csak CIS, míg a fennmaradó 26 beteg daganata CIS mellett egyéb papilláris komponenst is tartalmazott. Esetünkben a csak CIS-komponenst tartalmazó tumorok esetén a recidíva valószínűsége magasabb volt, mint társuló papilláris daganat esetén.
Számos vizsgálat zajlik az in situ carcinoma kezelésére is használt intravesicalis BCG optimális dózisának megállapítására. Hideyuki és társai által végzett klinikai tanulmány a BCG Connaught-törzs (PMCJ-9) hatékonyságát eltérő dózisok (40,5 mg; 81 mg; 121,5 mg) mellett vizsgálta. A betegek 8 héten keresztül, heti 1 alkalommal részesültek a kezelésben. 23 bevont beteg rendelkezett CIS-komponensű daganattal. A terápia hatékonyságának megállapítására alkalmazott egyik végpontként a komplett válasz (CR) lett kijelölve. Az in situ carcinomás betegek közül 5 fő 40,5 mg, 12 fő 81 mg, míg 6 fő 121,5 mg dózisnak megfelelő BCG-terápiában részesült. A legalacsonyabb alkalmazott dózis esetén 40%-os, a legmagasabb dózis használatakor 66,7%-os, míg a 81 mg-nak megfelelő adag alkalmazását követően 83,3%-os komplett válaszarány alakult ki, azonban statisztikai szignifikancia nem került bizonyításra (P=0,206). A mellékhatások súlyossága és gyakorisága a 40,5 mg-os dózis 81 mg-ra történő növelésével nem emelkedett. A vizsgálat eredményei alapján a 81 mg dózisú BCG mind hatékonyságában, mind tolerálhatóságában kedvezőnek bizonyult (10).
Az általunk vizsgált, primer BCG-terápiában részesült 41 személy közül 37 fő 40 mg (1 ampulla), 4 fő pedig 80 mg (2 ampulla) dózisnak megfelelő terápiában részesült, amely kúrát 6 héten keresztül, heti 1 alkalommal kapták a betegek. A 3. havi kontroll során végzett cisztoszkópos és citológiai vizsgálatok eredményei alapján állapítottuk meg a kezelésre adott választ. Az 1 ampulla BCG-t kapó páciensek esetén 62,2%-os (23/37 fő) volt a komplett válasz, míg ugyanezen arány 100%-nak felelt meg a dupla dózist kapó betegek körében, azonban szignifikáns különbséget saját vizsgálatunkkal sem sikerült kimutatni (P=0,280). Jól látható, hogy az általunk bevont betegek csekély hányada (9,76%) részesült csupán a mindkét vizsgálat által kedvezőbbnek bizonyuló 2 ampulla BCG-terápiában.
Az igen nagy rizikócsoportba tartozó betegek esetén a radikális cystectomia elvégzését azonnal fel kell ajánlani a betegeknek, továbbá korai elvégzése a BCG-terápia sikertelensége esetén is ajánlott, időben történő kivitelezése esetén a betegségmentes túlélési idő hosszabb, mint a műtét elvégzésének késlekedését követően (3). Amennyiben az operáció az invazív daganat kialakulása előtt megtörténik, úgy az 5. évre vonatkozó betegségmentes túlélés eléri a 80%-ot (11). Vizsgálatunkban 8 beteg primer terápiáját jelentette a kismedencei műtét elvégzése. Közülük 6 személy (75%) esetén nem igazolódott recidív betegség az utánkövetés során.
Következtetések
A primer szövettant tekintve vizsgálatunk eredményei alapján CIS mellett előforduló egyéb, nem izominvazív komponenst tartalmazó daganatok esetén a recidíva kisebb arányban jelentkezett (30,3%), mint a csak in situ carcinomával rendelkező csoportban, ahol ez az érték 37,5%-ra tehető. Ez alapján megállapítható, hogy a CIS önmagában is egy rendkívül agresszív, a recidíva kialakulásának valószínűségét emelő entitás. Vizsgálatunk során azon személyek egyikénél sem alakult ki korai recidíva, akik 2 ampulla – 80 mg/50 ml – BCG-kezelésben részesültek. Ebből következik, hogy ebben a magas rizikójú beteganyagban a BCG alul van dozírozva, az adagok emelésével onkológiai szempontból várhatóan kedvezőbb kimenetelt lehetne elérni, viszont ennek korlátot szabnak a terápia során kialakuló mellékhatások. A 6 széria indukciós BCG-kúra fenntartó intravesicalis immunterápiával történő kiegészítése az utánkövetés első évében szignifikánsan csökkentette a recidíva kialakulásának valószínűségét (P=0,045). A vizsgálat teljes idejére vonatkozó eredményeket tekintve a fenntartó terápia 50 százalékkal csökkentette a daganat kiújulásának valószínűségét, továbbá a recidíva megjelenéséig eltelt átlagos időt kétszeresére, mediánját háromszorosára növelte a fenntartó terápiában nem részesült betegekhez képest. Ezen eredményeket figyelembe véve in situ carcinoma esetén erősen ajánlott az indukciós terápiát a protokoll szerinti fenntartó BCG-kezeléssel kiegészíteni minden beteg esetén. A per primam radikális cystectomizált páciensek esetén 75%-ban, míg a BCG-terápiában részesült betegek csoportjában 65,9%-ban volt sikeres az alkalmazott elsődleges terápia, de hatékonyságuk közt vizsgálatunkkal szignifikáns különbséget nem sikerült kimutatni. A vizsgálat során csak BCG-terápiában részesült betegek 52 százalékánál alakult ki késői recidíva az utánkövetés során, míg vizsgálatunk alatt bármikor radikális cystectomián átesett személyek csoportjában ez az arány 21,4%-ra tehető. A műtét elvégzése körülbelül négyszeresére csökkentette a betegség kiújulásának valószínűségét.
Irodalom
1. Stanisic T, Donovan J, Lebouton J, Graham A. 5-year experience with intravesical therapy of carcinoma in situ: an inquiry into the risks of ‚conservative’ management. J Urol 1987; 138: 1158–1161. https://doi.org/10.1016/S0022-5347(17)43534-8
2. Thomas DE, Kaimakliotis HZ, Rice KR, et al. Prognostic Effect of Carcinoma In Situ in Muscle-invasive Urothelial Carcinoma Patients Receiving Neoadjuvant Chemotherapy. Clin Genitourin Cancer 2017; 15(4): 479–86.
https://doi.org/10.1016/j.clgc.2016.11.009
3. Babjuk M, Burger M, Capoun O, et al. European Association of Urology Guidelines on Non-muscle-invasive Bladder Cancer (Ta, T1, and Carcinoma in Situ). Eur Urol 2022; 81(1). https://doi.org/10.1016/j.eururo.2021.08.010
4. Sylvester RJ, et al. Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006; 49: 466. https://doi.org/10.1016/j.eururo.2005.12.031
5. Fernandez-Gomez J, et al. Predicting nonmuscle invasive bladder cancer recurrence and progression in patients treated with bacillus Calmette-Guerin: the CUETO scoring model. J Urol 2009; 182: 2195.
https://doi.org/10.1016/j.juro.2009.07.016
6. Lamm DL. Carcinoma in situ. Urol Clin North Am 1992; 19: 499.
https://doi.org/10.1016/S0094-0143(21)00409-2
7. Losa A, et al. Low dose bacillus Calmette-Guerin for carcinoma in situ of the bladder: long-term results. J Urol 2000; 163: 68.
https://doi.org/10.1097/00005392-200001000-00017
8. Griffiths TR, et al. Treatment of carcinoma in situ with intravesical bacillus Calmette-Guerin without maintenance. J Urol 2002; 167: 2408.
https://doi.org/10.1016/S0022-5347(05)64994-4
9. Li R, et al. Systematic Review of the Therapeutic Efficacy of Bladder-preserving Treatments for Non-muscle-invasive Bladder Cancer Following Intravesical Bacillus Calmette-Guérin. Eur Urol 2020; 78: 387.
https://doi.org/10.1016/j.eururo.2020.02.012
10. Akaza H, Koiso K, Ozono S, et al. A clinical study of PMCJ-9 (Bacillus Calmette-Guérin Connaught strain) treatment of superficial bladder cancer and carcinoma in situ of the bladder. Jpn J Clin Oncol 2003; 33(8).
https://doi.org/10.1093/jjco/hyg073
11. Shariat SF, Karakiewicz PI, Palapattu GS, et al. Outcomes of Radical Cystectomy for Transitional Cell Carcinoma of the Bladder: A Contemporary Series From the Bladder Cancer Research Consortium. Journal of Urology 2006; 176(6). https://doi.org/10.1016/j.juro.2006.08.004