Consensus statement of the Hungarian Urological Society: medical therapy for BPH/LUTS
DOI: 10.22591/magyurol.2025.1.majorosa.2
Authors:
Majoros Attila dr.1, Béres Bence dr.2, Papp Máté dr.2, Beöthe Tamás dr.3, Szántó Árpád dr.2
1Semmelweis Egyetem, Urológiai Klinika, Budapest (igazgató: Nyirády Péter dr.)
2Pécsi Tudományegyetem KK, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
3Péterfy Sándor Utcai Kórház, Urológiai Osztály, Budapest (osztályvezető: Buzogány István dr.)
Summary
This summary presents examination and treatment recommendations for candidates and specialists in urology, in the hope that it will help them navigate the modern examination of various symptoms and find the most suitable, individualized therapy for the patient among the many treatment options.
LAPSZÁM: MAGYAR UROLÓGIA | 2025 | 37. ÉVFOLYAM, 1. SZÁM
Összefoglalás
Jelen összefoglalás olyan kivizsgálási és kezelési javaslatokat fogalmaz meg, amely urológus szakorvosjelölteknek és szakorvosoknak szól, annak reményében, hogy segítsen eligazodni a változatos tünetek korszerű kivizsgálásában és a számos kezelési lehetőség közül a beteg számára legmegfelelőbb, egyénre szabott terápia megtalálásában.
1. Bevezetés
Az alsó húgyúti tünetek (Lower Urinary Tract Symptoms – LUTS) a betegek életminőségét jelentősen befolyásolják, hatással vannak a munkavégzésre, fizikai aktivitásra, társas kapcsolatokra, szexuális életre egyaránt (1). Megkülönböztetünk vizeletürítési, vizelettárolási, vizelés utáni, valamint a LUTS-hoz társuló szexuális tüneteket. Az életkor előrehaladtával a LUTS előfordulása nő, 50 éves korban a férfiak 50%-a, 70 éves kor fölött közel 80%-a számol be valamilyen zavaró panaszról (2). Az esetek döntő többsége a benignus prosztata-hyperplasia (BPH) számlájára írható, amely elöregedő társadalmunkat egyre jelentősebben érinti (3). A gyakori orvos-beteg találkozások, évekig tartó kezelések, komplikált műtéti beavatkozások nagy anyagi terhet rónak az egészségügyi ellátórendszerre és a betegekre egyaránt. A BPH/LUTS a ráfordított kiadások alapján közel húsz éve a 10 legköltségesebb kórállapot közé tartozik (4).
A BPH/LUTS kezelésének első vonalát évtizedek óta a farmakoterápia jelenti, amely hosszú távú összehasonlító tanulmányok (5) alapján nemcsak hatékony, de a sebészi beavatkozásokkal összevetve financiális szempontból is igen kedvező. A megfelelően beállított gyógyszeres kezeléssel a betegek panaszait nagymértékben csökkenteni lehet, a progresszió sokszor megelőzhető, így a műtét elkerülhető.
2. A gyógyszeres kezelés alapjai
Az Európai Urológus Társaság jelenleg érvényes irányelvei alapján a közepes-súlyos LUTS-os (International Prostate Symptom Score, továbbiakban IPSS:>7) betegek elsővonalbeli kezelése az alfa-1-receptor-blokkolók (a továbbiakban: alfa-blokkolók) használatán alapul. Az alfa-blokkolók részben centrális-, részben perifériás hatásmechanizmus révén, a prosztatikus húgycső és detrusor izomzat simaizomsejtjein relaxációt okozva mind a tárolási-, mind az ürítési tüneteket hatékonyan csökkentik (6). Kedvező hatásuk már 24 órán belül jelentkezik, a maximális effektus kifejlődése nagyjából 1 hónapot vesz igénybe, akár 30%-os IPSS és Qmax javulás érhető el alkalmazásukkal (7). Mellékhatásaik közül az ortosztatikus hipotenzió, szédülés elsősorban a korábbi, kevésbé szelektívebb készítményekre jellemző (8), míg az új generációs hatóanyagok (tamsulosin, sildosin) az ejakuláció emissziós fázisának gátlása révén gyakrabban okoznak ejakulációs zavart (9). Használatukkal ugyan a betegség progressziója, invazív beavatkozás szüksége nem előzhető meg, de jelentős életminőségbeli javulás érhető el (10), ezek alapján nem meglepő, hogy a legtöbb kombinációs séma is tartalmazza őket.
3. Mikor érdemes kombinált terápiára váltani?
Meg kell fontolni kombinációs készítmény adását, ha a monoterápia mellett a beteg panaszai nem javulnak megfelelően, esetleg fokozódnak, amely megnyilvánulhat a nocturiás epizódok számának növekedésében, a gyakori vizelési ingerek, egyéb tárolási tünetek halmozott előfordulásában. Az objektív paraméterek romlása esetén hasonlóképpen ajánlott eljárni, ilyenkor az IPSS pontszám emelkedése, uroflowmetria során a Qmax értékének csökkenése, a reziduális vizeletmennyiség (post-void residual volume – PVR) fokozódása észlelhető. Első vonalban javasolt a kombinált terápia alkalmazása, ha a közepesen-súlyosan tünetes betegnél a rizikótényezők (PSA, prosztatavolumen, uroflowmetria, PVR) alapján nagy a klinikai progresszió esélye (11). Az alsó húgyúti tünetek pontos kialakulása máig nem tisztázott, a multifaktoriális eredetre tekintettel, a többféle támadásponttal rendelkező kombinációk alkalmazása komoly terápiás haszonnal kecsegtet (12). A cél mindenképpen olyan gyógyszer-kombináció beállítása, amely a panaszokat megfelelően csökkenti, a mellékhatásai viselhetőek, és nem okoz jelentős anyagi megterhelést a betegnek, ami a hosszú távú adherenciát javítja.
4. Alfa-receptor-blokkoló mellett nem javuló tárolási tünetek
A betegek egy részénél a kezelés ellenére a késztetéses panaszok, gyakori vizelési ingerek nem változnak, amelyet szubjektíven sokkal súlyosabban élnek meg, mint a vizeletürítési nehézségeket (13). Amennyiben a megfelelően alkalmazott alfa-blokkoló terápia mellett a beteg jelentős tárolási tünetekről számol be, mindenképpen szükséges egy legalább 3 napig precízen vezetett vizelési napló. A napló alapján pontosabb képet kaphatunk a háttérben megbúvó kórokról (polyuria, nocturnalis polyuria, pszichés eredet, kóros folyadékbeviteli szokások stb.). A BPH-hoz köthető jóindulatú hólyagnyaki obstrukció (bladder outlet obstruction – BOO) mellett gyakran egyidejűleg jelenlévő detrusor túlműködés (detrusor overactivity – DO), vagy túlműködőhólyag-szindróma (overactive bladder syndrome, OAB) jól ismert jelenségek, amelyek markáns tárolási tünetekkel (sürgősségi tünetek inkontinenciával vagy anélkül, többnyire gyakori vizeléssel, nocturiával) járnak, alfa-blokkoló kezelésre mérsékelten reagálnak (14). Az alfa-blokkoló kezelés kiegészítése egyéb hatóanyaggal emiatt logikus gondolat, az ideális gyógyszerpárosítás azonban egyelőre még nem ismert, mivel a különböző hatóanyag-kombinációk effektivitását egymással összehasonlító hosszú távú tanulmányok száma limitált (15).
4.1. Alfa-receptor-blokkoló és muszkarinreceptor-antagonista kombinációja
Perzisztáló tárolási tünetek esetén általában az urológusok első választása az alfa-blokkolók mellett az anticholinerg kezelés megkezdése. A muszkarinreceptor-antagonistákkal kapcsolatban a fő problémát a gyógyszerek olyan jól ismert mellékhatásai jelentik, mint az obstipáció, szem- és szájszárazság, zavartság (16). A mai modern, uroszelektív hatóanyagok (solifenacin, darifenacin, imidafenacin) alkalmazása mellett a kezelés következményeként kialakuló teljes vizeletrekedés ritka esemény, ennek ellenére a betegek rendszeres kontrollja szükséges a PVR ellenőrzése céljából (17). A meglévő alfa-blokkoló kezelés mellé adott anticholinerg terápia hatására jelentősen csökken a nappali vizelési frekvencia, a késztetéses tünetek száma, az éjszakai vizelések gyakorisága, valamint az IPSS pontszám, javul az életminőség (QoL). Irodalmi adatok alapján jelentős tárolási tünetek esetén a beteg panaszai a korán megkezdett alfa-blokkoló és muszkarinreceptor-antagonista kombinációjával csökkenthetők a leggyorsabban, legnagyobb mértékben (18).

4.2. Alfareceptor-blokkoló és b3-adrenoreceptor-agonista kombinációja
Nem javuló OAB-os tünetek esetén az antimuszkarin kezelés alternatívája lehet az alfa-blokkoló terápia β3-adrenoreceptor-agonistával (a továbbiakban β3-agonista) történő kiegészítése. A detrusor izomzat relaxációjának elősegítése révén a jelenleg ismert készítmények, a mirabegron és a vibegron (Magyarországon csak a mirabegron érhető el) hatékonyan csökkentik a késztetéses tüneteket, a nappali vizelési frekvenciát, a nocturiás epizódok számát, valamint az IPSS és a QoL pontszámot (14). Újabb kutatások alapján a mirabegronnak a hátsó húgycső simaizomsejtjein a1-adrenoreceptorokon kifejtett kompetitív gátló hatást is tulajdonítanak, emiatt alfa-blokkolókkal adva szinergista hatásuk feltételezhető, amely a Qmax-érték javulásában is megnyilvánul (19, 20). A kombináció nem előnyös, ha rosszul beállított magasvérnyomás-betegség áll fent, ugyanakkor kifejezetten ajánlható, ha a gyakori, és a hosszú távú kezelést jelentősen hátráltató anticholinerg mellékhatásokat szeretnénk elkerülni, amelyek különösen az idős, társbetegségekkel rendelkező betegek adherenciáját rontják (20, 21). Az alfa-blokkoló-b3-agonista terápia mellett a reziduum-érték statisztikailag jelentős mértékben nem változik, a teljes vizeletretenció gyakorisága (<1%) nem különbözik a monoterápiában részesülőkétől (22). A hátrányok között a mirabegron jelenlegi piaci árát lehet megemlíteni, amely az anticholinerg készítményekkel összevetve lényegesen magasabb.

4.3. Alfa-receptor-blokkoló és desmopressin kombinációja
A tárolási tünetek közül a betegeket leginkább zavaró eltérés az éjszakai vizelés. A legfrissebb adatok alapján a páciensek közel 85%-a nem érez javulást a nocturiás epizódok számában alfa-blokkoló monoterápia beállítását követően (23). A nocturia hátterében vizelési napló kitöltése alapján gyakran azonosított nocturnalis polyuria (éjszakai vizeletmennyiség meghaladja az összmennyiség 33%-át) sokszor multifaktoriális eredetre vezethető vissza, emiatt elengedhetetlen az egyéb kórokok kizárása (diabétesz, szívelégtelenség, obstruktív alvási apnoé stb.) (24). Amennyiben a betegnek az ürítési tünetei mellett igazolt nocturnalis polyuriája is van, akkor az alfa-blokkoló kezelés mellé adott antidiuretikus hatású arginin vazopresszin szintetikus analóg desmopressin csökkenti a legjelentősebben a nocturiás események számát, az éjszakai vizelet volumenét, ezáltal az IPSS tárolási pontszám is javulhat (25). A zavartalan alvással eltöltött idő növekedése révén javul a betegek általános életminősége. A desmopressin a disztális kanyarulatos csatornákban vízvisszaszívást segít elő, amely koncentrált, csökkent mennyiségű vizelet termelődéséhez vezet. A következményesen kialakuló dilúciós hyponatraemia miatt a dózis fokozatos beállítása szükséges (általában 10-60 µg/nap), valamint a szérum nátriumszintet rendszeresen ellenőrizni kell. A terápia 65 év feletti életkorban csak nagy körültekintéssel alkalmazható, súlyos szív-, vagy veseelégtelenség esetén pedig kontraindikált. A hatóanyag jelenleg parenterális injekció, orrspray, szublingvális tabletta formában is elérhető (26).
5. LUTS és nagyméretű BPH
5.1. Alfa-receptor-blokkoló + 5-a-reduktáz- inhibitor kombinációja
Az 5-alfa-reduktáz-gátló (5-ARI) gyógyszerek alapjaiban változtatták meg a BPH kombinációs kezelését. A mai napig ez az egyetlen hatóanyagcsoport, amely elég hosszú időn keresztül történő alkalmazás mellett az adenoma méretét akár 30%-kal is csökkenteni képes, megelőzve ezzel a lehetséges műtéti megoldás szükségességét, csökkentve az akut vizeletrekedés kialakulásának kockázatát és a betegség progresszióját (27). BPH tervezett műtéti megoldását megelőzően is célszerű az alkalmazásuk, mert a mirigy vaszkularizációját csökkentve javítják a műtét közbeni tájékozódást, csökkentik a vérvesztést és a posztoperatív utóvérzés kockázatát, így járulnak hozzá a betegek rövidebb kórházi tartózkodásához és mielőbbi katétermentesítéséhez. Közismert PSA-értéket csökkentő hatásuk is, amelyet a beteg kontrollvizsgálatai során figyelembe kell vennünk. Hátrányuk, hogy hatásuk kialakulásáig minimálisan 6 hónapig szükséges őket alkalmazni, a maximális hatás kifejlődéséhez pedig akár 1 éves alkalmazás is szükséges, emellett a szexuális vágyat, a libidót, az erektilis és ejakulációs funkciót is negatívan befolyásolják (28).

6. LUTS és erektilis diszfunkció
6.1. Alfa-receptor-blokkoló + foszfodiészteráz-5-inhibitor kombinációja
Az alfa-receptor-blokkolók és foszfodiészteráz-5-inhibitorok kombinációjával csak kevés vizsgálat történt. A legtöbb ilyen kutatás tapasztalata, hogy elsősorban olyan betegeknek javasolható, ahol a BPH progressziójának esélye kicsi, a beteg szexuálisan aktív, a prosztata mérete nem haladja meg a 30 g-ot, valamint a LUTS és ED-s panaszok kombináltan vannak jelen. Ha abból indulunk ki, hogy az alsó húgyúti panaszok 60-80%-ában ED-s panasz is fennáll, akkor ígéretes és nagyon gyakori kombináció lehetne, azonban a kutatások alapján e kombinációtól várható terápiás előny csak diszkrét a monoterápiával összehasonlítva (31). Kombinációban ugyan az IPSS és Qmax-érték jelentősebb javulást mutat, mint a hatóanyagokat külön-külön alkalmazva, de a javulás mértéke nem éri el a statisztikai szignifikancia szintjét (32). Széles körű használatának további gátat szabhat a beteget terhelő jelentős kezelési költség, bár a szexuális funkciókban (IIEF5) és az ehhez kapcsolódó betegelégedettség és QoL mutatók terén jelentős terápiás előny mutatkozik kombináció használata során (33).
A mellékhatások közül a hipotenzió az egyik leggyakoribb, de a kutatásokba bevont betegek többsége ezt jól tolerálta, a súlyos mellékhatások ritkák (34). A PDE5-gátló gyógyszerek alkalmazása akár kombinációban, akár önállóan fokozott elővigyázatosságot igényel, magas szív-ér rendszeri kockázat esetén csak a beteg kardiológiai véleményezését követően javasoljuk adásukat.

7. Triplet kezelés (alfa-receptor-blokkoló + muszkarinreceptor-antagonista + 5AR-inhibitor kombinációja)
Az ún. hármas terápiát jelenleg sem az EAU, sem az AUA legfrissebb irányelve nem tartalmazza. A szakirodalomban elérhető limitált számú tanulmányban a kombinációt olyan beteganyagon vizsgálták, ahol a prosztata mérete, a PSA értéke, valamint a reziduális vizelet mennyisége alapján alfa-blokkoló és 5ARI-kezelés indult, azonban a betegek továbbra is zavaró OAB-os tünetekről számoltak be. Az egyik vizsgálatban (35) tamsulosin, dutasterid és imidafenacin kombinációjának hosszú távú alkalmazása mellett elérhető eredményeket hasonlították össze a csupán alfa-blokkolót és 5ARI-t szedő kontrollcsoporttal. Az 52 hétig tartó utánkövetés során szignifikánsan javult az IPSS tárolási pontszám, az életminőségi pontszám, jelentősen csökkentek a késztetéses tünetek, ugyanakkor a PVR mérsékelt emelkedését figyelték meg, valamint gyakoribbak voltak a kellemetlen mellékhatások.
8. Mit tartogat a jövő?
8.1. 5-alfa-reduktáz-gátló és foszfodiészteráz-5-inhibitor kombinációj
Az elmúlt 2 évtized során a foszfodiészteráz-5-gátlókkal végzett kutatások bebizonyították, hogy a LUTS-os beteg panaszait az 5 mg-os tadalafil csökkenteni képes attól függetlenül, hogy a BPH ED-vel társul-e vagy sem (36). A PDE5-gátlók hatása szubjektív, tehát javítják ugyan a tüneti pontszámokat, de jelentősen nem befolyásolják az áramlási paramétereket és a betegség progressziójára sincsenek hatással (37).
Az utóbbi időben az olyan betegeknél, ahol a prosztata becsült mérete legalább 40 g, az illető szexuálisan aktív valamint a LUTS-os panaszok ED-s panaszokkal is társulnak, PDE5I–5ARI kombinációs sémát javasolnak (38). Az 5ARI-k lassíthatják a BPH progresszióját, és csökkenthetik a vizeletretenció vagy a műtét szükségességének kockázatát. Sajnos ezek az előnyök általában a szexuális funkció rovására valósulnak meg, amely kedvezőtlen mellékhatást a PDE5-gátlók ellensúlyozzák (36).
Fenti kombináció mellett a betegek tüneti pontszámai bár gyors javulásnak indulnak (4 hét után), az áramlási paraméterekben bekövetkező változás csak a kezelés 3. hónapjának végére válik szignifikáns mértékűvé (39), míg a szexuális vágy, a merevedési funkció, az orgazmus, a közösülés és az általános kielégülés terén is jelentős javulás mutatkozik (40).
9. A Magyar Urológusok Társaságának javaslata
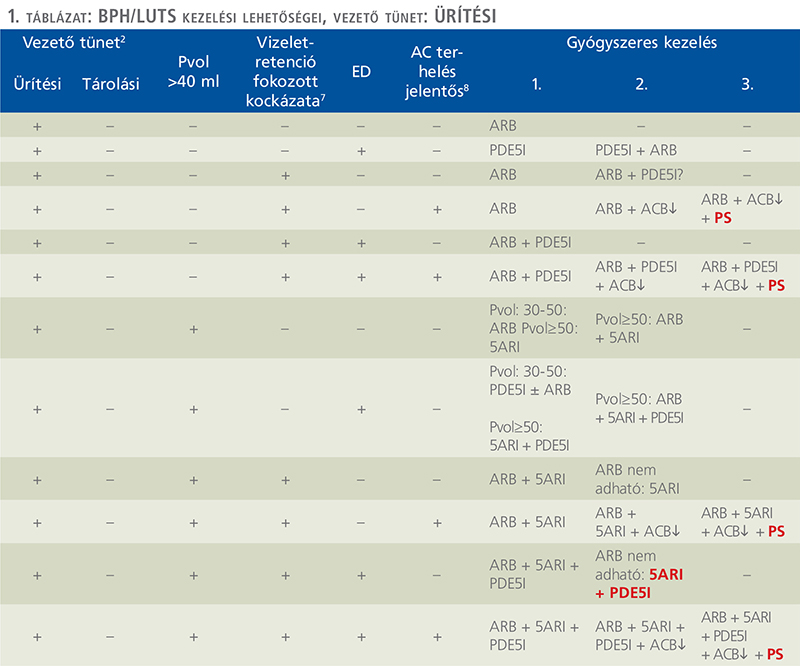
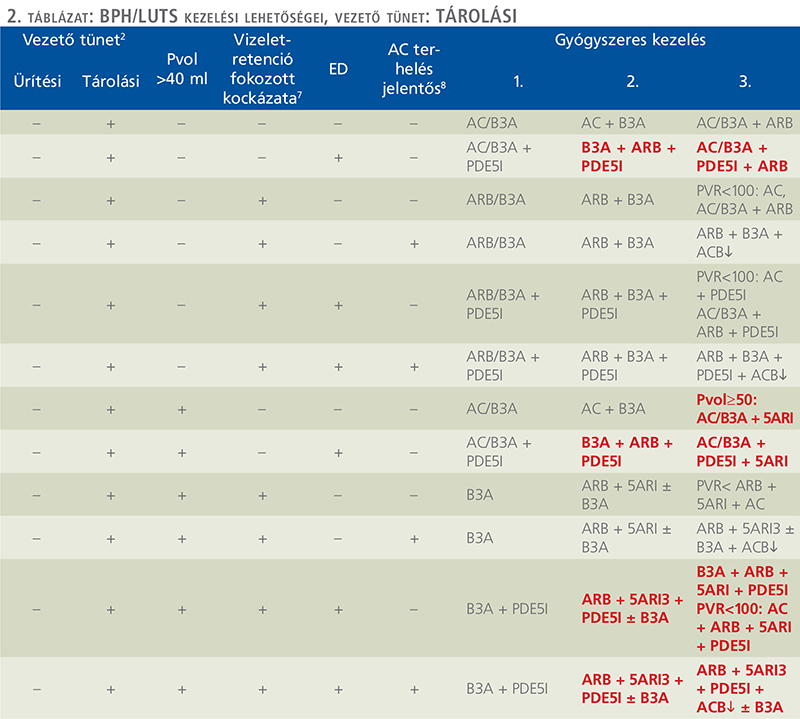
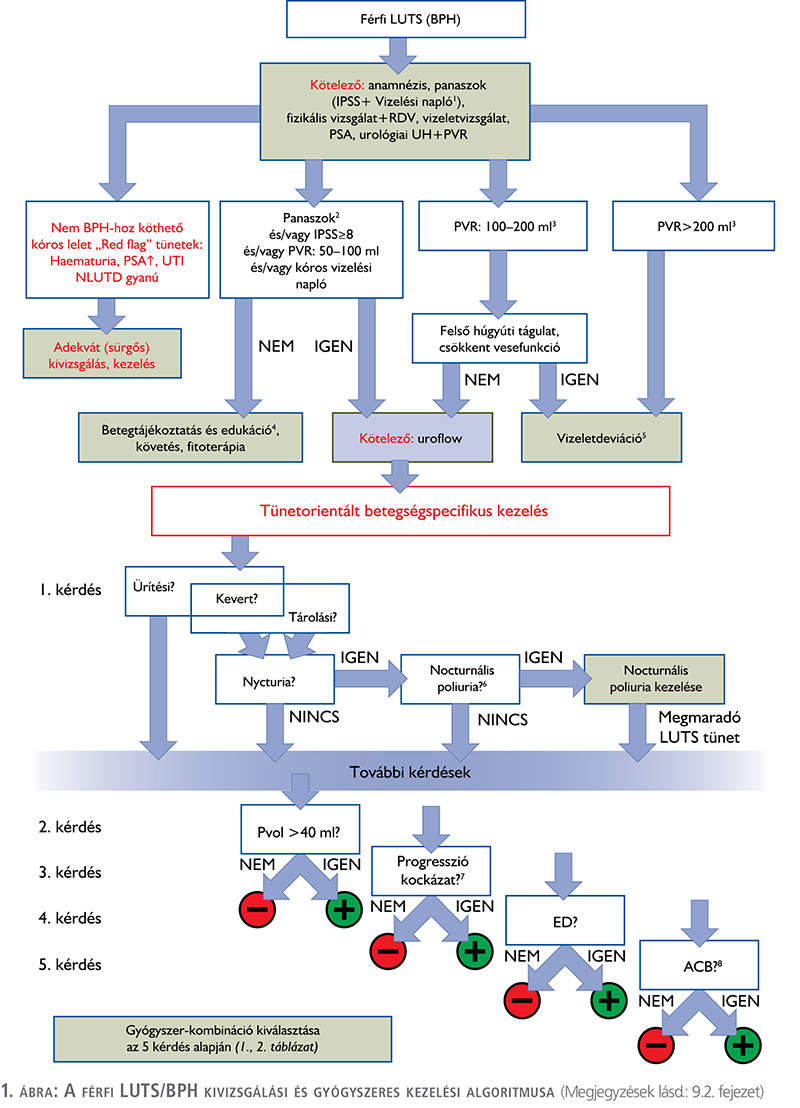
Az alábbiakban bemutatjuk azt a BPH/LUTS kezelési sémát, amely a Magyar Urológusok Társasága 2024-es konferenciáján elhangzott előadások alapján készült, a társaság vezetőségi tagjainak és a MUT jóváhagyásával (1. ábra, 1. és 2. táblázat). A MUT jelen konszenzusnyilatkozat alapján javasolja hazánkban a BPH/LUTS kivizsgálását és kezelését.
9.1. Útmutató az algoritmus és a táblázatok használatához
Az anamnézis és a panaszok (IPSS és vizelési napló kiértékelése is) felvételét követően el kell végezni az 1. ábrán felsorolt alapvizsgálatokat. Ezek segítségével kizárhatók a nem BPH-hoz köthető kóros tünetek, amelyek sürgős urológiai kivizsgálást igényelnek. Ugyancsak meghatározhatók azon betegek, akiknek LUTS tünetei enyhék, további kivizsgálást nem igényelnek, náluk az elsővonalbeli nem gyógyszeres konzervatív kezelés (betegtájékoztatás, edukáció, követés fitoterápia stb.) elkezdhető. Amennyiben a panaszok súlyosabbak, vagy a PVR 50 és 200 ml között van, uroflow-vizsgálat szükséges. PVR >200 ml esetén, vagy ha a PVR 100 és 200 ml között van, de az UH-vizsgálat felső húgyúti tágulatot igazol, vagy a laborvizsgálatban csökkent vesefunkció észlelhető vizeletdeviációra van szükség. Az uroflow vizsgálatot követően kezdődhet el a tünetorientált betegségspecifikus kezelés, amelyet első körben a vizelési tünetek differenciálása alapján végzünk. Első kérdés során kell eldönteni, hogy a beteg domináló vizelési tünete tárolási, ürítési, vagy kevert jellegű. Tárolási vagy kevert tünetek esetén ki kell zárni, hogy a betegnek van-e nycturiája, esetleg azon belül nocturnalis polyuriája. Ebben az esetben ennek megfelelő kezelést kell javasolni. Amennyiben tisztán ürítési tünetről van szó, nycturia vagy nocturnalis polyuria kizárható, akkor további négy kérdést kell tisztáznunk:
- A prosztatavolumen mérete nagyobb, mint 40 ml?
- Fennáll-e a betegségprogresszió fokozott kockázata (lásd megjegyzés 7 pont), tehát a vizeletelakadás fokozott kockázata miatti katéterbehelyezés, vagy műtéti megoldás szükségessége?
- Van-e a betegnek ED-s panasza?
- Van-e a betegnek kóros anticholinerg terhelése (lásd megjegyzés 8. pont)?
A fenti öt kérdés megválaszolásával, megkapjuk azokat a válaszokat, amelyek alapján az 1. és 2. táblázatból kiválasztható a betegnek legmegfelelőbb 1., 2. és 3. vonalbeli gyógyszeres kezelés.
9.2. Megjegyzések, magyarázatok (1. ábrához, és a táblázatokhoz)
- Vizelési napló: Három napon keresztül kell vezetni. Rögzíteni kell a folyadékbevitelt (mikor, mennyi) és a vizeletürítést (mikor, mennyi), illetve jelölni kell az akaratlan vizeletvesztést, vagy az erős vizelési ingert (mikor). Fontos összesíteni a teljes napi folyadékbevitelt (ml) és a napi vizeletmennyiséget (ml). Meg kell határozni a nappali és az éjszakai vizeletürítések számát, kóros: nappali >8, éjszakai >1. Meg kell határozni a legkisebb, legnagyobb és az átlagosan ürített vizeletporciót.
- Panaszok: Ürítési panasz: nehezített vizeletürítés, gyenge vizeletsugár, szakaszos vizeletáramlás, vizelés közben hasprés alkalmazása, nem teljes vizeletürítés érzése. Tárolási panasz: gyakori nappali, vagy éjszakai vizeletürítés, sürgősségi vizelési késztetés vagy inkontinencia, vizelés utáni utócsepegés. Kevert panasz: a fenti panaszok kombinációja.
- PVR: 100 ml feletti vizeletreziduum esetén szükséges a vesefunkció (eGFR, CN, Kreatinin) ellenőrzése. PVR 100-200 ml között, ha van tágulat a felső húgyutakban, vagy a vesefunkció csökkent, vagy PVR >200 ml esetén vizeletdeviációra van szükség.
- Betegtájékoztatás, edukáció: életmód-tanácsadás, folyadékbevitel normalizálása, esti folyadékbevitel csökkentése, kávé, alkoholfogyasztás csökkentése, székrekedés rendezése, húgyhólyagtréning, toalett-tréning, dupla vizelés technikájának elsajátítása.
- Vizeletdeviáció: transurethralisan állandó ballonkatéter behelyezése, vagy indokolt esetben epicystostomia létesítése. Extrém mértékű vizeletretenció esetén javasolt a retenciót több lépcsőben leengedni és a katétert tartósan „zsákon tartani” a húgyhólyag túlnyúlásának rehabilitációja céljából. Alfa-receptor-blokkoló, vagy Pvol >40 ml esetén ARB + 5ARI kombinált kezelés elkezdhető, majd 2-4 hetes kezelés után vizelési próba javasolt, amely később szükség esetén ismételhető.
- Nocturnalis polyuria: azt jelenti, hogy éjszaka az összes napi vizeletmennyiséghez képest sok vizelet termelődik. Abban az esetben áll fenn, ha Nocturnal Poliuria Index (NPI) értéke 35 év alattiak esetén >20%, 35–65 év között >25%, idősebbek (65 év felettiek) esetén >35%. Az NPI értéke az éjszakai és a teljes napi vizeletmennyiség arányát jelenti. NP oka az éjszakai ADH-szint csökkenése, ezért kezelésében hormonpótlás (desmopressin) javasolt.
- Betegségprogresszió-kockázat, tehát a vizeletrekedés és az emiatt szükséges katéterbehelyezés, vagy műtéti beavatkozás fokozott kockázata áll fenn az alábbi esetekben: PVR >100 ml, Qmax
- Anticholinerg terhelés: a vizelettárolás javítására adott anticholinerg gyógyszerek mellett számos olyan gyógyszert szednek a betegek (pl: antidepresszánsok, antipszichotikumok, antihisztaminok, gyomorsavtermelést csökkentő szerek stb.), amelyek rendelkeznek anticholinerg mellékhatásokkal. Minden gyógyszer anticholinerg hatását 0–3 ponttal jellemezzük. Sajnos az összes, vizelést befolyásoló anticholinerg gyógyszer 3-as pontszámot kapott. A szedett gyógyszerek anticholinerg hatása összeadódik, ezt hívjuk anticholinerg terhelésnek (Ancticholinergic Burden-ACB), amelyet egy ACB pontszámmal jellemzünk. Amennyiben az ACB pontszám ≥5, az már jelentős terhelést jelent, amely mellett hosszú távú mellékhatások alakulhatnak ki. Tehát törekednünk kell arra, hogy a betegek ACB pontszámát 5 alatt tartsuk. Az egyes gyógyszerek ACB pontszámáról, illetve ACB kalkulátor használatáról az alábbi linkeken is tájékozódhat:
https://www.derbyshiremedicinesmanagement.nhs.uk/assets/Clinical_Guidelines/Formulary_by_BNF_chapter_prescribing_guidelines/BNF_chapter_4/Drugs_on_the_acb_scale.pdf
https://www.acbcalc.com/
Piros betűszínnel szedett kezelések: jelenleg „off label” indikációk (az így jelölt kezelések alkalmazására jelenleg nincs hivatalos nemzetközi ajánlás).
9.3. Az algoritmusban és a táblázatokban használt rövidítések jegyzéke
AC=Anticholinergicum; ACB=Anticholinergic burden (anticholinerg terhelés); ARB=ALFA-receptor-blokkoló; BPH=Benignus prosztatahyperplasia; B3A=Béta-3-adrenoreceptor-agonista; ED=Erektilis diszfunkció; IPSS=International Prostate Symptom Score (Nemzetközi prosztata tüneti kérdőív); LUTS=Lower urinary tract symptoms (alsó húgyúti tünetek); NLUTD=Neurogenic lower urinary tract dysfunction (neurogén alsó húgyúti diszfunkció); NP=Nocturnalis polyuria; NPI=Nocturnalis polyuria index; PDE5I=Foszfodiészteráz-5-inhibitor; PS=Piridosztigmin; PSA=Prosztataspecifikus-antigén; Pvol=Prosztatavolumen; PVR=Post void residual urine (vizelés utáni maradékvizelet); RDV=Rektális digitális vizsgálat; Qmax=Maximális vizeletáramlás; UH=Ultrahang; UTI=Urinary Tract Infection (húgyúti fertőzés); 5ARI=5-alfa-reduktáz-inhibitor;
Irodalom
1. Coyne KS, Sexton CC, Irwin DE, et al. The impact of overactive bladder, incontinence and other lower urinary tract symptoms on quality of life, work productivity, sexuality and emotional well-being in men and women: results from the EPIC study. BJU Int 2008 Jun; 101(11): 1388–95.
https://doi.org/10.1111/j.1464-410X.2008.07601.x
2. Egan KB. The Epidemiology of Benign Prostatic Hyperplasia Associated with Lower Urinary Tract Symptoms: Prevalence and Incident Rates. Urol Clin North Am 2016 Aug; 43(3): 289–97.
https://doi.org/10.1016/j.ucl.2016.04.001
3. Speakman M, Kirby R, Doyle S, et al. (2014) Burden of male lower urinary tract symptoms (LUTS) suggestive of benign prostatic hyperplasia (BPH)-focus on the UK. BJU Int https://doi.org/10.1111/bju.12745
4. Fenter TC, Naslund MJ, Shah MB, et al. The cost of treating the 10 most prevalent diseases in men 50 years of age or older. Am J Manag Care 2006 Mar; 12(4 Suppl): S90–8. PMID: 16551207.
5. Nickel JC. (2006). The economics of medical therapy for lower urinary tract symptoms associated with benign prostatic hyperplasia. Current Urology Reports, 2006; 7(4): 282–287.
https://doi.org/10.1007/s11934-996-0007-z
6. Gravas S, Gacci M, Gratzke C, et al. Summary Paper on the 2023 European Association of Urology Guidelines on the Management of Non-neurogenic Male Lower Urinary Tract Symptoms. European Urology 2023; 84. https: //doi.org/10.1016/j.eururo.2023.04.008
7. Dunn CJ, Matheson A, Faulds DM. Tamsulosin: a review of its pharmacology and therapeutic efficacy in the management of lower urinary tract symptoms. Drugs Aging 2002; 19(2): 135–61.
https: //doi.org/10.2165/00002512-200219020-00004
8. Lyseng-Williamson KA, Jarvis B, Wagstaff AJ. Tamsulosin: an update of its role in the management of lower urinary tract symptoms. Drugs 2002; 62(1): 135–67. https://doi.org/10.2165/00003495-200262010-00006
9. Gacci M, Ficarra V, Sebastianelli A, et al. Impact of medical treatments for male lower urinary tract symptoms due to benign prostatic hyperplasia on ejaculatory function: a systematic review and meta-analysis. J Sex Med 2014 Jun; 11(6): 1554–66. https://doi.org/10.1111/jsm.12525
10. Roehrborn CG, et al. The effects of dutasteride, tamsulosin and combination therapy on lower urinary tract symptoms in men with benign prostatic hyperplasia and prostatic enlargement: 2-year results from the CombAT study. J Urol 2008; 179: 616.
https://doi.org/10.1016/j.juro.2007.09.084
11. Emberton M, Cornel EB, Bassi PF, et al. Benign prostatic hyperplasia as a progressive disease: a guide to the risk factors and options for medical management. Int J Clin Pract 2008 Jul; 62(7): 1076–86.
https://doi.org/10.1111/j.1742-1241.2008.01785.x
12. Winograd J, Venishetty N, Codelia-Anjum A, et al. Emerging drugs for the treatment of benign prostatic hyperplasia: a 2023 update. Expert Opinion on Emerging Drugs, 2024; 29(3): 205–217.
https://doi.org/10.1080/14728214.2024.2363213
13. Becher E, Roehrborn CG, Siami P, et al. The effects of dutasteride, tamsulosin, and the combination on storage and voiding in men with benign prostatic hyperplasia and prostatic enlargement: 2-year results from the Combination of Avodart and Tamsulosin study. Prostate Cancer Prostatic Dis 2009; 12(4): 369–74.
https://doi.org/10.1038/pcan.2009.37
14. Lemack GE. Defining the role of overactive bladder treatments in men with lower urinary tract symptoms. Nat Clin Pract Urol 2007 Apr; 4(4): 174–5. PMID: 17415351. https://doi.org/10.1038/ncpuro0754
15. Su YT, Chen HL, Teoh JY, et al. Comparison of add-on medications for persistent storage symptoms after a-blocker treatment in BPH patients – a network meta-analysis. BMC Urol 2023 Oct 3; 23(1): 154. PMID: 37789333; PMCID: PMC10546657
https://doi.org/10.1186/s12894-023-01327-1
16. Kaplan SA, Roehrborn CG, Gong J, et al. Add-on fesoterodine for residual storage symptoms suggestive of overactive bladder in men receiving a-blocker treatment for lower urinary tract symptoms. BJU Int 2012 Jun; 109(12): 1831–40. Epub 2011 Oct 3. PMID: 21966995.
https://doi.org/10.1111/j.1464-410X.2011.10624.x
17. Gravas S, Cornu JN, Gacci M, et al. Management of non-neurogenic male lower urinary tract symptoms (LUTS), incl. benign prostatic obstruction (BPO). (European Association of Urology. Guidelines). European Association of Urology 2019.
https://uroweb.org/guideline/treatment-of-non-neurogenic-male-luts/
18. Alexandre EC, Kiguti LR, Calmasini FB, et al. Mirabegron relaxes urethral smooth muscle by a dual mechanism involving b3-adrenoceptor activation and a1-adrenoceptor blockade. Br J Pharmacol 2016 Feb; 173(3): 415–28. Epub 2016 Jan 15. PMID: 26493129; PMCID: PMC4728418.
https://doi.org/10.1111/bph.13367
19. Matsuo T, Miyata Y, Kakoki K, et al. The efficacy of mirabegron additional therapy for lower urinary tract symptoms after treatment with a1-adrenergic receptor blocker monotherapy: prospective analysis of elderly men. BMC Urol 2016 Jul 29; 16(1): 45. PMID: 27473059; PMCID: PMC4966767. https://doi.org/10.1186/s12894-016-0165-3
20. van Gelderen M, Tretter R, Meijer J, et al. Absence of clinically relevant cardiovascular interaction upon add-on of mirabegron or tamsulosin to an established tamsulosin or mirabegron treatment in healthy middle-aged to elderly men. Int J Clin Pharmacol Ther 2014 Aug; 52(8): 693–701. PMID: 24755125. https://doi.org/10.5414/CP201979
21. Herschorn S, McVary KT, Cambronero Santos J, et al. Mirabegron Vs Placebo Add-on Therapy in Men With Overactive Bladder Symptoms Receiving Tamsulosin for Underlying Benign Prostatic Hyperplasia: A Safety Analysis From the Randomized, Phase 4 PLUS Study. Urology 2021 Jan; 147: 235–242. https://doi.org/10.1016/j.urology.2020.09.040
22. Yoong HF, Sundaram MB, Aida Z. Prevalence of nocturnal polyuria in patients with benign prostatic hyperplasia. Med J Malaysia 2005 Aug; 60(3): 294–6. PMID: 16379182.
23. Chang SC, Lin AT, Chen KK, et al. Multifactorial nature of male nocturia. Urology 2006 Mar; 67(3): 541–4. PMID: 16527575.
https://doi.org/10.1016/j.urology.2005.09.037
24. Wang CJ, Lin YN, Huang SW, et al. Low dose oral desmopressin for nocturnal polyuria in patients with benign prostatic hyperplasia: a double-blind, placebo controlled, randomized study. J Urol 2011 Jan; 185(1): 219–23. Epub 2010 Nov 13. PMID: 21074790.
https://doi.org/10.1016/j.juro.2010.08.095
25. Kenyeres Balázs, Pytel Ákos. A nocturia klinikuma. Magyar Urológia 2017; 29: 101–105.
https://doi.org/10.22591/magyurol.2017.3.kenyeresb.101
26. Everaert K, Hervé F, Bosch R, et al. International Continence Society consensus on the diagnosis and treatment of nocturia. Neurourol Urodyn 2019 Feb; 38(2): 478–498. Epub 2019 Feb 19. PMID: 30779378.
https://doi.org/10.1002/nau.23939
27. Füllhase C, Chapple C, Cornu JN, et al. Systematic review of combination drug therapy for non-neurogenic male lower urinary tract symptoms. Eur Urol 2013; 64: 228–43. https://doi.org/10.1016/j.eururo.2013.01.018
28. Chislett B, Chen D, Perera ML, et al. 5-alpha reductase inhibitors use in prostatic disease and beyond. Transl Androl Urol 2023 Mar 31; 12(3): 487–496. Epub 2023 Mar 6. PMID: 37032761; PMCID: PMC10080355.
https://doi.org/10.21037/tau-22-690
29. Fwu CW, Eggers PW, Kaplan SA, et al. Long term effects of doxazosin, finasteride and combination therapy on quality of life in men with benign prostatic hyperplasia. J Urol 2013; 190: 187–93
https://doi.org/10.1016/j.juro.2013.01.061
30. Roehrborn CG, Barkin J, Tubaro A, et al. Influence of baseline variables on changes in International Prostate Symptom Score after combined therapy with dutasteride plus tamsulosin or either monotherapy in patients with benign prostatic hyperplasia and lower urinary tract symptoms: 4-year results of the CombAT study. BJU Int 2014; 113: 623–35.
https://doi.org/10.1111/bju.12500
31. Singh DV, Mete UK, Mandal AK, Singh SK. A comparative randomized prospective study to evaluate efficacy and safety of combination of tamsulosin and tadalafil vs. tamsulosin or tadalafil alone in patients with lower urinary tract symptoms due to benign prostatic hyperplasia. J Sex Med 2014; 11: 187–96 https://doi.org/10.1111/jsm.12357
32. Öztürk MI, Kalkan S, Koca O, et al. Efficacy of alfuzosin and sildenafil combination in male patients with lower urinary tract symptoms. Andrologia 2012; 44(Suppl 1): 791–5.
https://doi.org/10.1111/j.1439-0272.2011.01268.x
33. Lee JY, Park SY, Jeong TY, et al. Combined tadalafil and a-blocker therapy for benign prostatic hyperplasia in patients with erectile dysfunction: a multicenter, prospective study. J Androl 2012; 33: 397–403.
https://doi.org/10.2164/jandrol.111.013185
34. Giuliano F, Kaplan SA, Cabanis MJ, et al. Hemodynamic interaction study between the alpha1-blocker alfuzosin and the phosphodiesterase-5 inhibitor tadalafil in middle-aged healthy male subjects. Urology 2006; 67: 1199–204. https://doi.org/10.1016/j.urology.2006.01.001
35. Yamanishi T, Asakura H, Seki N, et al. A 52-week randomized comparative study of a triple therapy (tamsulosin, dutasteride and imidafenacin) versus a dual therapy (tamsulosin and dutasteride) in benign prostatic hyperplasia patients with overactive bladder (DIrecT Study). European Urology Supplements 2017; 16(3): e924–e925.
https://doi.org/10.1016/S1569-9056(17)30592-4
36. Casabé A, Roehrborn CG, Da Pozzo LF, et al. Efficacy and safety of the coadministration of tadalafil once daily with finasteride for 6 months in men with lower urinary tract symptoms and prostatic enlargement secondary to benign prostatic hyperplasia. J Urol 2014; 191: 727–33.
https://doi.org/10.1016/j.juro.2013.09.059
37. Kaplan SA, Gonzalez RR. Phosphodiesterase type 5 inhibitors for the treatment of male lower urinary tract symptoms. Rev Urol 2007; 9(2): 73–77.
38. Nickel JC, et al. Comparison of dutasteride and fnasteride for treating benign prostatic hyperplasia: the Enlarged Prostate International Comparator Study (EPICS). BJU Int 2011; 108(3): 388–394.
https://doi.org/10.1111/j.1464-410X.2011.10195.x
39. Casabe A, et al. Efcacy and safety of the coadministration of tadalafl once daily with fnasteride for 6 months in men with lower urinary tract symptoms and prostatic enlargement secondary to benign prostatic hyperplasia. J Urol 2014; 191(3): 727–733.
https://doi.org/10.1016/j.juro.2013.09.059
40. Glina S, et al. Sexual function in men with lower urinary tract symptoms and prostatic enlargement secondary to benign prostatic hyperplasia: results of a 6-month, randomized, doubleblind, placebo-controlled study of tadalafl coadministered with fnasteride. J Sex Med 2015; 12(1): 129–138. https://doi.org/10.1111/jsm.12714