Pathology of prostate cancer
DOI: https://doi.org/10.22591/magyurol.2023.2.szekelye.69
Authors:
Székely Eszter dr., Borka Katalin dr.
Semmelweis Egyetem, Patológiai, Igazságügyi és Biztosítási Orvostani Intézet,
Budapest (igazgató: Kiss András dr.)
Summary
The pathological findings of examination of histological samples of the prostate (needle biopsy samples and removed prostate tissue) greatly influence the treatment strategy of the patient suffering from prostate cancer.
In addition to confirming the presence of the tumour, it is of great importance to determine the histological type, assess the extent of the tumour, and in some cases determine the clearly recognizable extraprostatic spread.
This review discusses the current WHO classification, summarising the existing literature, as well as the emerging morphological and molecular data that underpins the classification and prognostication of prostatic carcinoma.
LAPSZÁM: MAGYAR UROLÓGIA | 2023 | 35. ÉVFOLYAM, 2. SZÁM
Összefoglalás
A prosztata szövettani mintáinak vizsgálata (tűbiopsziás minták és eltávolított prosztataszövet), patológiai lelete nagyban befolyásolja a prosztatarákban szenvedő páciens kezelési stratégiáját.
A daganat jelenlétének igazolása mellett kiemelkedő jelentőségű a szövettani típus meghatározása, a tumor kiterjedtségének megítélése, valamint bizonyos esetekben az egyértelműen felismerhető extraprosztatikus terjedés meghatározása.
Ez az áttekintés a legújabb WHO-klasszifikáció alapján összefoglalja a meglévő szakirodalmat, valamint a prosztatakarcinóma osztályozását és prognosztizálását alátámasztó morfológiai és molekuláris adatokat.
A prosztata szövettani mintáinak vizsgálata, a szövettani lelet eredménye nagyban befolyásolja a prosztatarákban szenvedő páciens kezelési stratégiáját. A patológus feladata a daganat jelenlétének vagy hiányának megállapítása mellett a folyamatosan változó leletezési szabályok követése is. Az alábbiakban a prosztata-szövettaniminták elemzésének nehézségeit, illetve az újabb szabályokat igyekszünk a klinikus kollégákkal megismertetni.
Biopsziák
A mai modern technikák bevetésével a tűbiopsziás minták egyre jobban reprezentálják a prosztatában zajló tumoros folyamatot, illetve a képalkotó eljárásokkal tumornak gondolt egyéb elváltozásokat – valóban a kérdéses léziókból származnak a minták.
A daganat jelenlétének igazolása mellett kiemelkedő jelentőségű a szövettani típus meghatározása („szokványos” adenokarcinóma, ductalis, intraductalis adenokarcinóma, urothelialis karcinóma, neuroendokrin karcinóma stb.), a tumor kiterjedtségének megítélése, valamint bizonyos esetekben az egyértelműen felismerhető extraprosztatikus terjedés meghatározása. A patológus „nehezített pályán játszik” abból a szempontból is, hogy többféle uropatológus-társaság létezik, eltérő koncepciót vallva a paraméterek meghatározásának tekintetében, valamint amiatt is, mert abban a pillanatban, hogy nemzetközi konszenzus alakul ki egy leletezési pont kapcsán, azonnal megjelennek meggyőző cikkek, amelyek megkérdőjelezik az újabb szabály érvényességét.
A prosztatarák leggyakoribb fajtája az acináris adenokarcinóma. Ennek szöveti képe is igen változatos a daganat differenciáltságától függően. A ma is érvényes grade-meghatározás a csaknem 60 éve bevezetett Gleason-szisztémán alapul. Ez egy struktúrára épülő beosztás, amely az elmúlt 60 évben jelentős módosításokon ment keresztül. A lényege kissé leegyszerűsítve a következő: az öt kategóriába sorolt mintázatból a Gleason 1. mintázatot nem használjuk, ugyanis immunhisztokémiai vizsgálatokkal bebizonyosodott, hogy ezen eltérésekben a bazális sejtsor jelen van, vagyis nem daganat. Gleason 2. mintázatú adenokarcinóma is igen ritkán fordul elő. Ilyen típusú eltérést leginkább prostatectomiás anyagban, a periurethralis területen vagy transzurethralis reszekátumban (TUR) lehet találni. A Gleason 3. mintázatú daganatokban a tumorsejtek által alkotott mirigyek egymástól jól láthatóan elválasztva tűnnek fel, míg a Gleason 4. mintában mirigyfúzió látszik, amely már a differenciálódás komolyabb zavarát jelzi. (E kétféle mintázat elkülönítése olykor igen nehéz, szubjektív, az inter és az intraobszerver variabilitás is magas [1. ábra]). Gleason 5. mintázat esetén mirigyképzés nincs, a daganatsejtek keskeny kötegek vagy széles sejtlemezek formájában infiltrálják a prosztata állományát, egyes esetekben nekrózissal társulva (2. ábra).
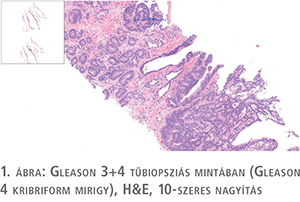
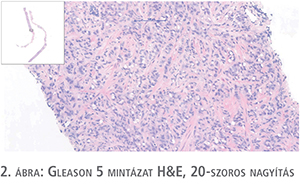
A mikroszkópos leletezéskor meg kell határozni a Gleason score-t, amely a legnagyobb területen látható Gleason-mintázat, illetve a legmagasabb Gleason-számnak (legalacsonyabban differenciált tumornak) az összege. (A score ily módon való kiszámolása a jelenleg érvényes szabályok szerint a tűbiopsziás minta és a TUR-minták értékelésére vonatkozik, prostatectomiás anyagban másképp kell számolni, ld. később). Mivel a Gleason 3 mintázat a legjobban differenciált daganatra vonatkozik, ami core biopsziából adható, a legalacsonyabb Gleason score 6-os lehet, a legmagasabb 10.
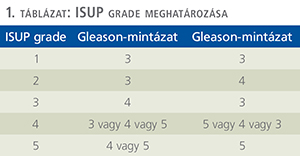
Néhány évvel ezelőtt a Gleason score meghatározása mellett, a score alapján meg kell adni az International Society of Urological Pathology (ISUP) prognosztikus grade-számát is. Ennek értelme a következő: sokáig volt érvényben az a sajátos uropatológiai matematikai állítás, amely szerint 3+4 ≠ 4+3. Vagyis ha tűbiopsziában/prostatectomiás preparátumban a Gleason 4 mintázat területe meghaladja a Gleason 3-at, az rosszabb betegségmentes túléléssel, magasabb recidívaeséllyel jár, mint amikor a tumor fő tömege Gleason 3 mintázatú. Ennek kiküszöbölésére alkalmas az ISUP prognosztikus grade (1. táblázat).
Igen fontos prognózist meghatározó tényezőnek tartják a daganat kribriform mintázatának jelenlétét. A kribriform mintázat Gleason 4-es grade-et jelöl, nekrózissal társuló formája Gleason 5. A statisztikai adatok alapján, ha kribriform mintázatú a daganat egésze, vagy akár csak egy része, a daganat kiújulásának veszélye sokkal magasabb. A mai leletezés szabályai alapján a kribriform mintázatot jelölni kell a leletben, egyesek szerint százalékos arányban is, mivel jelentős prognózist rontó indikátor.
Általában extraprosztatikus terjedést biopsziás mintában, így daganatstádiumot nem lehet meghatározni, azonban előfordul, hogy a mintában megjelenik olyan elem, amely egyértelműen mutatja, hogy a daganat átlépte a prosztata anatómiai határát. Ha a tűbiopsziás mintában zsírsejtek között látható daganat, vagy egyértelműen vesicula seminalis szövetben tűnnek fel tumorsejtek, ezen esetekben egyértelműen legalább T3a vagy T3b stádiumot jelezhet a minta (3. ábra).
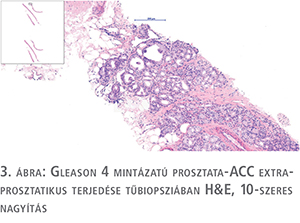
A leletben e tényt mindenképpen jelezni kell.
Tűbiopsziák elemzésekor igen gyakran szükséges immunhisztokémiai reakciók alkalmazása. A biopsziás minták során alkalmazott eszközök méretéből adódóan a keskeny szövethengerekben, a minta technikai károsodásának hiányában is nehéz lehet annak megítélése, hogy a bazális sejtsor eltűnt – ami a prosztatarák diagnózisának sine qua nonja –, vagy csak nehéz kimutatni. Ilyenkor alkalmazunk immunhisztokémiai reakciót a bazális sejtsor megőrzött – vagy eltűnt voltának kimutatására. Mivel a szövethengerek keskeny, sérülékeny szövetek, előfordul, hogy az immunhisztokémiai vizsgálatra való mélyebb metszetek készítésekor épp a kérdéses rész elvész, „kifaragódik” a mintából. Ilyenkor, mivel általában kicsiny, mintegy 1 mm-es apró fókuszban mutatkozó eltérésről beszélünk, atípusos, kis acináris proliferáció (ASAP) a diagnózis, mivel teljes mértékben nem bizonyítható az eltérés malignus természete. Ilyen esetekben a biopszia sürgős ismétlése szükséges (4. ábra).
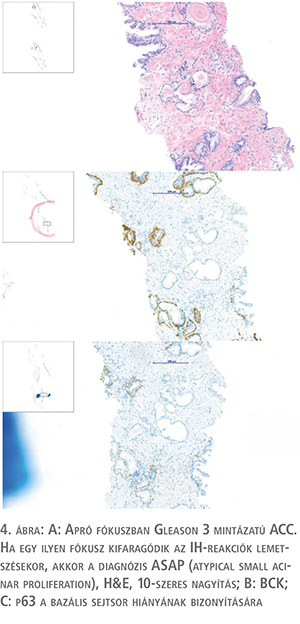
Az immunhisztokémiai reakciók további alkalmazása differenciáldiagnosztikai kérdések eldöntésére szükséges: prosztatahyperplasia vagy high grade PIN (intraepithelialis prosztataneoplasia) nagyon hasonló mikroszkópos képet mutathat. Ilyen esetekben használatos a p63-p504S nevű kettős immunhisztokémiai marker, amelyben a p63 a bazális sejtsort jelöli, a p504S jelű fehérje a diszplasztikus sejtek citoplazmájában mutat pozitivitást.
Előfordulhat, hogy a szöveti kép alapján nehezen dönthető el, hogy prosztatarák vagy egyéb szerv daganata infiltrálja a szöveteket. Ilyen esetekben prosztataspecifikus markerekkel végzünk vizsgálatot. A szokásos PSA-, PSAP-reakciók mellett az NKX3.1 fehérjét alkalmazzuk, ezek nehéz esetekben jelzik a tumorszövet prosztataeredetét mind primer, mind metasztatikus lokalizációban.
Neuroendokrin daganat (NEC) gyanúja esetén is végezhetőek immunhisztokémiai reakciók (chromogranin, synaptophysin) a hematoxylin eozin festett metszet alapján felmerülő diagnózis alátámasztására, bár e markerek negativitása nem zárja ki NEC lehetőségét. Az urothelialis eredetű daganatok citokeratin7-, GATA3-reakciókkal mutatnak pozitivitást.
Az utóbbi évtizedben a prosztataductus-karcinóma eredetét kutatva számos munkacsoport megállapította, hogy ez a különösen rossz prognózisú daganat, amely igen gyakran keveredik „hagyományos” acináris adenokarcinómával, genetikailag nem különbözik az acináris adenockarcinómától, míg más munkacsoport saját, specifikus genetikai eltérésre hivatkozik. A WHO 2022-ben megjelent V. kiadványa alapján ma még meg kell különböztetni a ductalis adenokarcinómát az acináristól, de várható, hogy a jövőben e két entitás közti különbséget eltörlik, és a ductalis adenokarcinóma „visszaminősül” rosszul differenciált (általában Gleason 5) mintázatú adenokarcinómává.
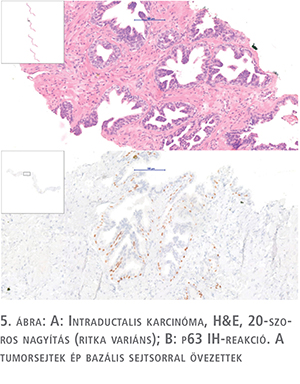
A következő lényeges eltérés az előző entitáshoz névben igen hasonló, de kissé más eltérést jelző intraductalis karcinóma. Valójában két külön betegség fut ezzel a névvel (!).
Az egyik egy olyan alacsonyan differenciált acináris adenokarcinóma, ahol az infiltratív terjedést mutató daganatsejtek ép hámbélésű ductusokba penetrálnak, azok tágulatát okozva, lumenüket kitöltve. E daganatok rossz prognózisúak, és a statisztikák alapján a Gleason-beosztásuk magas számától elvárhatónál is agresszívebben viselkednek. Az intraductalis karcinóma diagnózis egy olyan entitásra is vonatkozik, ahol a daganatsejtek morfológiája minden kétséget kizáróan malignitásra utal, azonban a tumorsejtek nem infiltrálnak, csupán megőrzött bazális sejtsorral rendelkező ductusokon belül helyezkednek el. A szöveti kép emlékeztet a high grade PIN mikroszkópos képére, a tumorsejtek minden kétséget kizáró malignus megjelenése azonban egyértelművé teszi a diagnózist. Ilyen típusú eltérés nagyon ritkán látható, felismerése azonban azért lényeges, mert prostatectomia után további terápia nem szükséges (5. ábra).
Tűbiopsziás minták mikroszkópos leletezése esetén meghatározott szabályoknak kell megfelelni, amelyek a daganat kiterjedésének megbecslésére irányulnak. Ha a tűbiopszia a hagyományos körkörös szextáns vagy decimális biopszia, amely standard módon meghatározott helyekről történik, és külön-külön edényben érkezik a patológiai osztályra, a nemzetközi szabályok értelmében külön-külön hengerenként értékelendő. A daganat hengerenkénti kiterjedését is meg kell adni. Erre a különböző guideline-ok több elképzeléssel szolgálnak. Ha egy szövethengeren belül több apró fókuszban látunk daganatot, megadhatjuk a hengerben látott daganathosszt úgy, hogy a daganatosan infiltrált fókuszok hosszát összeadjuk, de úgy is, hogy a henger két szélén látott daganatos pont közötti távolságot mérjük meg, függetlenül attól, hogy a mért hosszba így beleszámítunk nem daganatos területet is. Meg lehet adni a daganat és a biopsziás henger hosszának százalékát is, de a biokibernetikai számolgatást meg lehet hagyni az onkológusnak is (a leletben le kell írni a szövethenger hosszát és a daganat hosszát is). Egyes ajánlások szerint külön ki kell emelni, hogy melyik hengerben milyen arányban találta a patológus a legrosszabbul differenciált (legmagasabb Gleason score-t mutató)/leghosszabb területen infiltráló daganatot. Természetesen ez csak akkor tehető meg, ha a szövethengerek külön tégelyben, helymeghatározással érkeznek. Ma már gyakran a radiológiailag jól detektálható „gyanús” területről történik a mintavétel. Ilyenkor egy tégelyben több henger érkezik, értelemszerűen egyazon tumorfókuszból. Ilyenkor a hengerek számolgatásának, külön értékelésének nincs értelme, a daganatosan infiltrált terület százalékos arányának meghatározása szükséges, a Gleason score megadása mellett.
Radikális prostatectomia
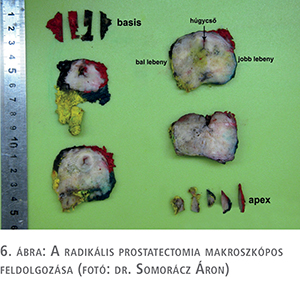
A radikális prostatectomia korrekt szövettani elemzésének előfeltétele a megfelelő makroszkópos feldolgozás. A preparátum reszekciós felszínének festése, méretének és tömegének meghatározása, majd az apex és bázis leválasztása és felszeletelése után – a maradék állományt szuperior-inferior irányban 4 mm-es szeleteket készítve – a teljes reszekátumot makroblokkokba ágyazzuk be (6. ábra).
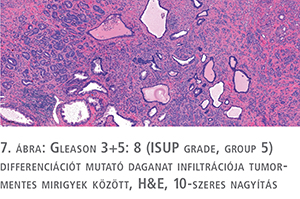
A szövettani vizsgálat során elsőként azt vizsgáljuk, hogy a reszekátumban mennyi különálló nodulus látható. Az egyes nodulusok Gleason score-ját külön kell megadni, mivel a daganat biológiai viselkedését a magasabb Gleason-értékű góc határozza meg. A score-t radikális prostatectomia esetén a két legnagyobb területet elfoglaló daganat Gleason-mintázatának összege adja meg. Ha egy noduluson belül harmadik mintázat is jelen van, és az magasabb, mint az elsődleges és másodlagos mintázat, akkor tercier grade-et kell megadnunk (7. ábra).
 Ha ez a harmadik mintázat a legmagasabb, és a teljes tumor >5%-ára terjed, akkor ezt tekintjük másodlagos komponensnek. A tercier Gleason-mintázat általában magasabb patológiai stádiummal és gyakoribb biokémiai relapszussal jár, mint az azonos Gleason score tercier mintázat nélkül.
Ha ez a harmadik mintázat a legmagasabb, és a teljes tumor >5%-ára terjed, akkor ezt tekintjük másodlagos komponensnek. A tercier Gleason-mintázat általában magasabb patológiai stádiummal és gyakoribb biokémiai relapszussal jár, mint az azonos Gleason score tercier mintázat nélkül.
A Gleason score és a TNM-stádium mellett több szövettani eltérés is van, ami prognosztikai és prediktív jelentőséggel bír.
A legfontosabb, magasabb stádiumot (pT3a) is jelentő extraprosztatikus infiltráció (extraprostatic extension, EPE). Mivel a prosztata valódi tokkal nem rendelkezik, ezért ennek meghatározása nem egyszerű. Extraprosztatikus terjedésről beszélünk periprosztatikus zsírszöveti invázió, extraprosztatikusan észlelhető perineurális terjedés esetén, illetve ha a tumorszövet a szerv anatómiai határain nyilvánvalóan kívül helyezkedik el. A prosztata elülső felszínén és az apex területén a harántcsíkolt izomrostok a prosztata strómájával keverednek, így a harántcsíkolt izom infiltrációja itt nem jelent EPE-t. A hólyagnyak tumoros érintettsége az EPE-vel egyenértékűen pT3a stádiumot jelent, és ahhoz hasonlóan prognosztikai jelentőséggel rendelkezik. A vesicula seminalis izmos falában és a mirigyek között terjedő daganat esetén a tumor már pT3b stádiumú.
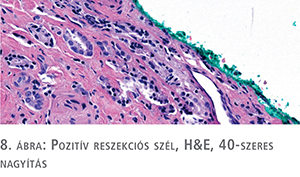
A pozitív reszekciós felszín (R1), azaz ha a daganat a festett felszínen látható (8. ábra), a radikális prostatectomiák 10-48%-ban észlelhetők, és a daganatspecifikus halálozás esélye ebben az esetben 2,6-szeresére emelkedik. A festés előtti rávágás, egyéb arteficialis sérülés sokszor megnehezíti a felszín megítélését. A reszekciós felszín többnyire extraprosztatikus, de ha a reszekció a prosztatán keresztül vezet, akkor intraprosztatikus reszekciós felszínről beszélünk, amelynek pozitivitása kedvezőtlenebb prognózisra utal. Fontos megadni a pozitív felszín helyét, hosszát, valamint az itt elhelyezkedő tumor Gleason score-ját, mivel mindezek előre jelezhetik a recidíva és a metasztázis kialakulásának esélyét. A bazális vagy posterolateralis felszínt elérő daganatok prognózisa kifejezetten rossz.
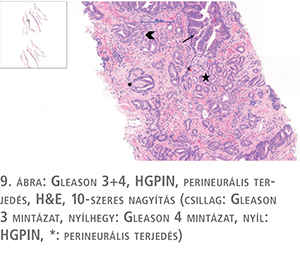
A daganat perineurális (9. ábra) és limfovaszkuláris terjedése is független negatív prognosztikai tényező, és betegekben biokémiai progresszióra, nyirokcsomó- és távoli áttétképződésre számíthatunk. A daganat magasabb Gleason score-t mutat, extraprosztatikus terjedés, vesicula seminalis infiltráció is gyakrabban fordul elő. Perineurális invázió esetén a tumorsejtek idegrostok között vagy azok körül infiltrálnak. A limfovaszkuláris invázió igazolása néha nehéz, kijelentéséhez endothellel körülvett, izomfallal rendelkező vagy nem rendelkező érstruktúrákban kell látnunk endothellel szorosan érintkező vagy thrombussal összefüggő tumorsejteket. Bizonytalan esetben kiegészítő immunhisztokémiai vizsgálatokat (CD31: panendothelmarker, CD34: vérérendothel-marker, D240/podoplanin: nyirokérmarker) végzünk.
Neuroendokrin daganatok
A neuroendokrin (NE) differenciációt mutató prosztatadaganatok NE markereket (synaptophysin, chromogranin-A, CD56, TTF1, NSE, INSM1) expresszálnak, viszont a prosztatamarkerek (PSA, PSAP) többnyire negatívak. Az adenokarcinómák területén elszórt neuroendokrin sejtek csaknem minden esetben észlelhetőek, de rutinszerűen ezek immunhisztokémiai kimutatása nem javasolt, mivel a fokális NE differenciációnak klinikai jelentősége nincs. Ugyancsak NE differenciációt mutatnak a Paneth-sejtszerű eozinofil, granulált citoplazmával rendelkező sejtek is, amelyek, ha kötegeket alkotnak, vagy egysejtes infiltrációt mutatnak, akkor Gleason 5 mintázatot utánozhatnak. Neuroendokrin daganatra Gleason score-t nem kell megadni, csak kevert esetekben az adenokarcinómát kell a Gleason szerint értékelnünk. Az UICC TNM 8. kiadása a stádiumbeosztásra vonatkozóan nem tartalmaz iránymutatást, de ha a daganatnak adenokarcinóma része is van, akkor az ezekre vonatkozó beosztás érvényes.
Jól differenciált (low grade) NE tumor (NET) a prosztatában ritkán fordul elő. A monoton, enyhe magi atípiát, diszpergált chromatint, eosinophil granulált citoplazmát mutató daganatsejtek fészkekbe, kötegekbe, acinusokba rendeződnek, és a NE immunhisztokémiai markerek pozitívak. Mitózis ritkán fordul elő, a Ki-67-ellenes antitesttel észlelhető proliferációs aktivitás 20% alatti. A lokális infiltráció és nyirokcsomó-áttétképződés ellenére is kedvező prognózisa van a NET-nek.
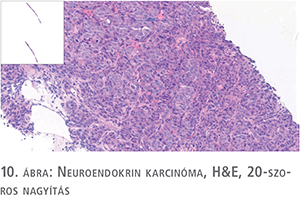
A high grade NE karcinóma (NEC) gyakran adenokarcinómával keverten jelenik meg, és a kissejtes (small cell) variáns (SCNEC) gyakrabban fordul elő, mint a nagysejtes (large cell) NEC (10. ábra). A SCNEC szöveti képe a tüdő kissejtes karcinómájához hasonlít, és így TTF1-pozitivitást mutathat, és a típusos szöveti megjelenés és a változó NE marker expresszió miatt immunhisztokémiai vizsgálat elvégzése nem szükséges. A nagyon agresszív viselkedésű, többnyire metasztatikus NE karcinómák prognózisa nagyon rossz, és az androgén deprivációs terápiára a daganatok nem reagálnak.
Ugyancsak NE differenciációt mutat a 2022-es WHO-klasszifikációban megjelenő új entitás, az ún. kezeléssel kapcsolatos NE prosztatakarcinóma (treatment-related neuroendocrine prostatic carcinoma, t-NEPC), amely androgén deprivációs kezelés után az esetek kb. 10-15%-ában alakul ki az adenokarcinóma transzdifferenciációjával. Szövettanilag tiszta SCNEC, adenokarcinóma és SCNEC vagy alacsonyan differenciált adenokarcinóma képében jelenhet meg, és komplett vagy részleges expressziót mutat NE markerekkel.
Irodalom
1. Srigley JR, Tsuzuki T, Rubin MA, Nettó GJ, Amin MB, Kench JG. WHO Classification of Tumours, 5th Edition, Volume 8 Urinary and Male Genital Tumours (5th ed.) 2022 Tumours of the prostate.
2. Kench JG, Amin MB, Berney DM, Compérat EM, Cree IA, Gill AJ, et al. WHO Classification of Tumours fifth edition: evolving issues in the classification, diagnosis, and prognostication of prostate cancer. Histopathology 2022 Oct; 81(4): 447–458. https://doi.org/10.1111/his.14711
3. Netto GJ, Amin MB, Berney DM, Compérat EM, Gill AJ, et al. The 2022 World Health Organization Classification of Tumors of the Urinary System and Male Genital Organs-Part B: Prostate and Urinary Tract Tumors. Eur Urol 2022 Nov; 82(5): 469–482.
https://doi.org/10.1016/j.eururo.2022.07.002
4. Surintrspanont J, Zhou M. Prostate Pathology: What is New in the 2022 WHO Classification of Urinary and Male Genital Tumors? Pathologica 2023; 115: 41–56. https://doi.org/10.32074/1591-951X-822