Extranodal MALT-lymphoma involving the ureter: a case report and literature review
DOI: 10.22591/magyurol.2025.3.tothf.124
Authors:
Tóth Fruzsina dr.1, Leiner Zoltán dr.1, Kovács Gábor dr.1,
Krenács László dr.2, Bodog Adina Simona dr.3
1Észak-pesti Centrumkórház – Honvédkórház, Urológiai-Andrológiai Osztály
(osztályvezető: Kovács Gábor dr., Budapest)
2Daganatpatológiai és Molekuláris Diagnosztikai Laboratórium, Szeged (laboratóriumvezető: Krenács László dr.)
3Affidea Magyarország Kft., Budapest
Summary
Introduction: Extranodal marginal zone lymphoma is a type of mucosa-associated lymphoid tissue lymphoma (MALT lymphoma), which is a slow-growing form of non-Hodgkin’s lymphoma. It arises from B cells in lymphoid tissue located outside the lymph nodes. While MALT lymphoma is the most common subtype of marginal zone lymphoma (MZL), it remains a rare entity overall, along with splenic and nodal marginal zone lymphomas. Although it can develop in various regions of the body, it most frequently affects the gastrointestinal tract. Involvement of the urothelial system is extremely rare.
Case presentation: We present the case of an 82-year-old male patient with a history of daily smoking (discontinued 11 years ago) and urological follow-up for benign prostatic hyperplasia. A follow-up CT scan after aortic aneurysm repair incidentally raised suspicion of malignancy involving the right ureter. During urological evaluation, urinary cytology was performed, followed by retrograde ureterography and uretero-renoscopy. These investigations could not exclude the presence of a space-occupying lesion observed in prior imaging, and a right ureteronephrectomy was subsequently performed.
Postoperative histopathological analysis revealed low-grade B-cell non-Hodgkin’s lymphoma. Further immunophenotyping identified the tumour as high-grade CD20-positive marginal zone lymphoma.
Conclusions: MALT lymphoma of the upper urinary tract is typically discovered incidentally. Differentiating it from other urothelial tumours is challenging, as imaging studies generally reveal only the presence of a malignancy without specifying its nature. Due to its rarity in this anatomical location, lymphoma is often not included in the urological differential diagnosis, and standardized surgical protocols are lacking. Consequently, conventional onco-urological procedures often guide preoperative decision-making.
If the diagnosis can be established prior to surgery, radical excision might be avoidable, and a more conservative, organ-preserving approach – such as targeted immunotherapy or radiotherapy – may be feasible. In all cases, histological sampling is essential to detect lymphoid infiltrates, typically composed of B cells.
In our patient, immunohistochemical staining showed CD20 and MNDA positivity, while CD5, CD23, CD30, and CD200 were negative. KP1 (CD68) demonstrated moderate cytoplasmic positivity in most tumour cells. Urethral MALT lymphoma rarely presents with subepithelial lymphoid infiltrates or lymphoepithelial lesions, more commonly involving the periureteric fat.
LAPSZÁM: MAGYAR UROLÓGIA | 2025 | 37. ÉVFOLYAM, 3. SZÁM
Összefoglaló
Bevezetés: A mucosához társuló nyirokszövetek extranodalis margináliszóna-lymphomája (MALT-lymphoma) a non-Hodgkin-lymphomák lassan növekvő típusa, amely a nyirokcsomókon kívüli nyirokszövetben alakul ki B-sejtekből. A MALT-lymphoma a margináliszóna-lymphoma (MLZ) leggyakoribb, de ezenfelül ritka altípusa a lép- és a nodalis marginális lymphoma mellett. Bár a test legkülönbözőbb régióiban felbukkanhat, főként a gasztrointesztinális traktus érintett. Az urothelialis rendszer érintettsége extrém ritka.
Esetismertetés: Esetünk egy 82 éves férfi beteget mutat be, akinek kórelőzményében korábban rendszeres napi dohányzás (11 éve felfüggesztve), májgyulladás, magas vérnyomás betegség, illetve benignus prosztatahyperplasia miatti urológiai gondozás szerepel. Az aortaaneurizma rekonstrukciója utáni kontroll-CT-vizsgálat incidentálisan vetette fel a jobb oldali uretert involváló malignitás lehetőségét. Urológiai konzílium során vizeletcitológiai mintavétel, majd retrográd ureterográfia és ureterorenoszkópia történt, amelyek a megelőző képalkotó vizsgálat során talált térfoglaló folyamat gyanúját nem tudták kizárni. A preoperatív képalkotó és a klinikai kép alapján urothelialis karcinóma gyanúját feltételezve, jobb oldali, radikális ureteronephrectomiát végeztünk. A műtét utáni kórszövettani vizsgálat low-grade B-sejtes non-Hodgkin-lymphomát igazolt, majd későbbi tipizálása high-grade CD20-pozitív margináliszóna-lymphomát pontosított.
Következtetések: A felső húgyúti rendszert érintő MALT-lymphomát általában véletlenszerűen fedezik fel. Megkülönböztetése az urothelialis daganatoktól igen nehéz, képalkotó vizsgálatok csak a malignitás meglétét támasztják alá. Az ilyen lokalizációjú lymphoma igen ritka, így gyakran nem szerepel az urológiai differenciáldiagnosztikában, és nem áll rendelkezésre jól definiált sebészi protokoll. Ennek következtében az operációt megelőző döntés során a megszokott onkourológiai eljárások érvényesülnek. Ha a diagnózis már a műtét előtt felállítható, lehetőség nyílik a radikális sebészi beavatkozás elkerülésére, és konzervatívabb, szervmegőrző stratégia (pl. célzott immunterápia, radioterápia) alkalmazására. Minden esetben szövettani mintavétel szükséges, amely feltárja a főként B-sejtekből álló limfoid infiltrátumot. Betegünk esetében az immunhisztokémiai eredmények CD20-, valamint MNDA-pozitivitást mutattak CD5-, CD23-, CD30-, CD200-negativitás mellett. A KP1/CD68 a daganatsejtek többségében mérsékelten erős citoplazmatikus pozitivitású. Az ureteralis MALT-lymphoma ritkán jelentkezik subepithelialis limfoid infiltrátumokkal, illetve lymphoepitheloid elváltozásokkal, főként a periureteralis zsírt érinti.
Bevezetés
Az ureter lymphomatosus infiltrációját elsőként Stow jegyezte le 1909-ben (1). A lymphomák igen ritka előfordulású megbetegedések a húgyúti rendszerben, itt körülbelül 5%-ban alkotják a nem urothelialis tumorokat, és az esetek 90%-ban a húgyhólyag területéről indulnak ki (2, 3). 2015-ig kevesebb mint 10 esetet publikáltak, amelyek közül a leggyakrabban mucosaasszociált limfoid daganatot diagnosztizáltak (4).
A mucosaasszociált limfoid daganat (MALT) első irodalmi megfogalmazása 1983-ra tehető, Isacsoon és Wright publikálták elsőként (5). A margináliszóna-lymphomák (MZL) egyik alcsoportja a non-Hodgkin-lymphomákon belül. Előbbit 50-70%-ban képviseli, míg utóbbit 7-8%-ban (6). A felső húgyúti MALT-lymphoma jellemzően középkorú vagy idős férfiakat érint (4). Különbözik a lépet érintő margináliszóna-lymphomától (SMZL) és a nodalis margináliszóna-lymphomától (NMZL) a diagnosztikai kritériumok, a genetikai elváltozások, a klinikai viselkedés és a terápia tekintetében. Megjelenése olyan szerveknél fordul elő, ahol normál körülmények között nem találunk nyirokszövetet, de a krónikus gyulladás hatására B-sejtek halmozódnak fel. Disszemináció az esetek 25-50%-ban fordul elő (7).
A csontvelő infiltrációt az esetek 2-20%-ban írták le, a legújabb vizsgálatokban ez az arány még alacsonyabb, de gyakoribb a nem gyomornyálkahártya-lymphomákban (8). A MALT-lymphoma felső húgyúti traktust érintő patogenezise még nem tisztázott (7), de általánosságban a többi szervrendszert érintő előfordulásról elmondható, hogy szinte minden esetben bakteriális, vírusos vagy autoimmun ingereknek való krónikus kitettség által kiváltott immunrendszeri keresztreakciókhoz kapcsolódik. Az elhúzódó krónikus fertőzés és/vagy autoimmunitás olyan aktív immun- és gyulladásos válaszokat hoz létre, amelyek lehetőséget biztosítanak az autoreaktív B-sejtek rosszindulatú transzformációjához a szükséges genetikai változások meglétével egyidejűleg, egy többlépcsős folyamatban. Az antigén expozíciónak kitett B-sejtek specifikus csoportokba fejlődnek, és szerzett módon mutálódnak az NF-kB útvonal aktiválódását vagy a NOTCH deregulációját elindítva, amelyek így fenntartják a lymphoma növekedését, és csökkentik a B-sejtek krónikus ingerekhez való adaptációját. Az intratumorális T-sejt-komponens kulcsfontosságú tényező, a CD4 + T-sejtek CD40-függő módon aktiválják a B-sejteket Th2 citokinekkel (interleukin- [IL-] 4 és/vagy IL-10) kombinálva. A lymphomagenesis szempontjából döntő fontosságúak a genetikai aberrációk, 20-30%-ában kromoszóma-rendellenességeket, például a 3., 12. vagy 18. kromoszóma triszómiáját észlelik (6, 8).
A MALT megjelenése a gyomor (kb. 50%) és tüdő szöveteiben a leggyakoribb (6). Irodalmi ritkaságnak számítanak a húgyutakat érintő esetek. Az ureteropelvicus lokalizációjú elváltozások speciálisak a többi szervhez képest, hiszen elvétve mutatnak szubepithelialis-limfoid infiltrátumokat vagy lymphoepithelialis elváltozásokat, illetve főként a periureteralis zsírt involválják. Mindezek tükrében az ureteralis MALT vélhetően nem a mucosa vagy a luminális „betörés” révén növekszik, hanem periureteralis gyulladást okoz. Mivel a MALT-lymphoma a kevésbé agresszív lymphomák közé tartozik, és hajlamos hosszú ideig lassú progresszióval lokalizált maradni, gyakran nem lépnek fel szubjektív tünetek, és a radiológiai képalkotó vizsgálatok (CT, MRI) során véletlenül fedezik fel fali megvastagodás vagy szövetszaporulat formájában. A MALT-lymphomát esetenként nehéz megkülönböztetni az urothelialis karcinómától a képalkotó vizsgálatok segítségével, amikor a betegség a vese, a kismedence vagy a húgyvezeték érintettsége miatt felső vizeletelzáródással jelentkezik. Obstrukciós tünet viszont korai felismerés esetén alig észlelhető, általános gyakorisága a rosszindulatú lymphomás esetekben is csak 0,86–8,8% között mozog (4). Hara és munkatársai (2002) megjegyezték azonban, hogy a vesemedence és az ureter MALT-lymphomái a T2-súlyozott mágneses rezonanciás tomográfiás felvételeken alacsony jelet mutathatnak, valamint megerősítik a korábbiakban elfogadott állítást, miszerint a lokálisan előrehaladott folyamat növekedése képes utánozni a felső húgyutak invazív urothelialis rákjának radiológiai jeleit (9). A pozitronemissziós komputertomográfia (PET-CT) szerepe az eddigi vizsgálatok alapján ellentmondásos: az FDG-aviditás változó, ami a nem gyomorból kiinduló elváltozásokban magasabb. A hisztopatológiai vizsgálat a diagnózis felállításának kulcslépése. A szövettani morfológiai jellemzők közé tartoznak a diffúzan infiltráló sejtek (limfoid infiltrátum), a markáns lymphoepithelialis elváltozások, a plazmasejtek Dutcher-testjei, a muscularis mucosae infiltrációja és a limfoid sejtek mérsékelt citológiai atípiája. A MALT-lymphoma sejtjeinek azon képessége, hogy beszivárognak az elszórtan elhelyezkedő reaktív limfoid tüszőkbe, különböző szövettani megjelenéshez vezet, ami jelentős diagnosztikai bizonytalanságot okozhat. Jellemzően heterogén B-sejtekből állnak, beleértve a közepes méretű centrocytaszerű sejteket vagy a kisebb méretű lymphocytákat kerek magokkal és csomósodott kromatinnal, de monocitoid sejtek is megjelenhetnek. Egy vagy több szövettani tulajdonság dominálhat, de akár a különböző típusú sejtek különböző mértékben, egyidejűleg fordulhatnak elő. A monoklonalitás kimutatása PCR-ral hatalmas segítség a diagnosztikában, bár ez a fajta jelenség benignus gyulladásos folyamatokban is jelen lehet, illetve akár 15%-ban hiányozhat a MALT-lymphomákban (8). Az immunfenotípusos analízis során a sejtek pozitívak a CD19, CD20, CD79-a, CD21, CD35 és CD22 B-sejt-markerekre, valamint negatívak a CD5, CD10 és CD23 cyclin D1 markerekre (6, 8).
A MALT-lymphomák kezelési stratégiáját nagyban meghatározza a primer tumor elhelyezkedése és kiterjedése. Viszonylag kevés kezelési metódust és vegyületet vizsgáltak kifejezetten EMZ kezelésére (11). Aszimptomatikus, a kezelés megkezdéséhez szükséges kritériumoknak nem megfelelő betegeknek felajánlható a watchfull-waiting stratégia. A gyomrot érintő esetekben hatásos lehet a H. pylori eradikációja, de az extragastrialis megbetegedések esetén még ellentmondásosak az eredmények az antibakteriális terápiát illetően. A lokalizált extragastrialis esetekben a first-line terápia sugárkezelés. Az ajánlott dózis 24 Gy, de alacsony dózis (4 Gy) is megfontolandó palliatív esetben vagy nehezen hozzáférhető helyen lévő elváltozás esetén. Ha ez nem kivitelezhető a betegség lokalizációja miatt, akkor CD20 elleni monoklonális antitestekkel (rituximab) végzett monoterápia javasolt. Sugárkezelés kontraindikációjakor, illetve sokszor inkább diagnosztikus jelentősége miatt sebészi excízió ajánlott. Disszemináció esetén mono-, illetve kombinált rituximabterápiát alkalmaznak. Rituximabrezisztens, valamint recidiváló MALT-lymphoma esetén alkilálószereket (cyclophosphamid, chlorambucil) vagy purin-nukleozid-analógokat (fludarabin, cladribin) tartalmazó kemoterápiát vagy kemoimmunterápiát javasolt indítani. Az immunmoduláló szerekkel végzett próbálkozások (pl. thalidomid, lenalidomid) biztatóak (6, 8). A rituximab és bendamustin kombinációjának II. fázisú vizsgálata jó aktivitást mutatott, többek között t(11;18)-at hordozó esetekben is. A legtöbb beteg 4 ciklus után teljes remissziót ér el ezzel a kombinációval, gyakran a kezelést ezen a ponton abbahagyják, elkerülve ezzel a hosszabb kezelési sémák nagyobb toxicitását. A rituximab fenntartásának szükségessége ellentmondásos, mivel nincs bizonyíték az OS előnyére, valamint a publikált adatok is hiányoznak (1, 8). A rituximab-lenalidomid kombinációt előrehaladott EZML-ben szenvedő betegek egy kohorszán tesztelték, 89%-os ORR-t és 67%-os CR-t mutattak ki korábban kezeletlen betegeknél, toxicitásuk jól tolerálható (6, 11). A betegség prognózisa jó, az 5 éves teljes túlélés 86-95% között van, anélkül, hogy jelentős különbségek lennének a kiindulási hely, a lokalizált vagy a disszeminált állapot között (8). Ez a megállapítás igaz a felső húgyutakat érintő esetekben is, ahol a medián túlélés az eddig publikált esetekben meghaladta a 10 évet (2).
Egy saját eset bemutatása
Esetünk egy 82 éves férfi beteget mutat be, akinek kórelőzményéből évekig tartó, rendszeres nikotinabúzus, valamint kezelt hipertónia, NIDDM, korábbi májgyulladás, BPH miatt urológiai gondozás emelendő ki. Az aortaaneurysma műtéti megoldása után elvégzett kontroll-CT-vizsgálat 2022. május hónapban incidentálisan vetette fel a jobb oldali uretert érintő malignitás lehetőségét. Eszerint az iliacalis oszlás magasságában, jobb oldalon 74 mm craniocaudalis kiterjedésű, 34×30 mm anteroposterior átmérőjű, szabálytalan alakú, kontrasztanyagot fokozottan halmozó képlet volt látható, amely a korábbi vizsgálatokhoz képest méretbeli progressziót mutatott (korábbi CT-n 2018. november hónapban: 21×12,5×35 mm átmérőjű volt). A jobb oldali uretertől egyértelműen el nem különíthető, amennyire a késői fázis hiányában megítélhető, elfolyási akadályt nem okozott. Paraaortikusan felhalmozódott nyirokcsomók, amelyek a kóros mérethatárt nem érik el, de a korábbiakhoz képest méretbeli progressziót mutatnak. A páciens panaszmentes volt, áttekintő hasi ultrahangon a vesékben tágulat nem volt látható. A diagnosztikus vizeletcitológia első mintája high-grade urothelialis karcinóma (HGUC), TPS 5. eredményt adott. Retrográd ureterográfiát, majd ureterorenoszkópiát végeztünk, amely egyértelmű uretertumort nem identifikálhat, jobb oldali dupla J katéter lett hátrahagyva. A késői fázissal kiegészített, ismételt CT-vizsgálat (2022. augusztus) a jobb oldali ureter középső harmadában lévő (az aorta oszlásának szintje felett), kb. 7 cm hosszú, 25×27 mm axiális átmérőjű, az ureter lumenét kitöltő, kiszélesítő, minimális halmozást mutató szövetszaporulatot írt le. Szintjében és jobb oldalon a paracolicus zsírszövet köteges jelleggel infiltrált volt. Paraaortikusan és parailiacalisan nem kóros méretű nyirokcsomók ábrázolódtak. A késői fázisú felvételeken mindkét oldali vesében jó ütemű, szimmetrikus kiválasztás volt detektálható. Csontablakkal áttekintve nem látszott metasztázisra utaló szerkezeti eltérés. Egyebekben szklerotikus aortát, aortaaneurysmát fali thrombussal véleményezett az elkészült vizsgálat (1. ábra).
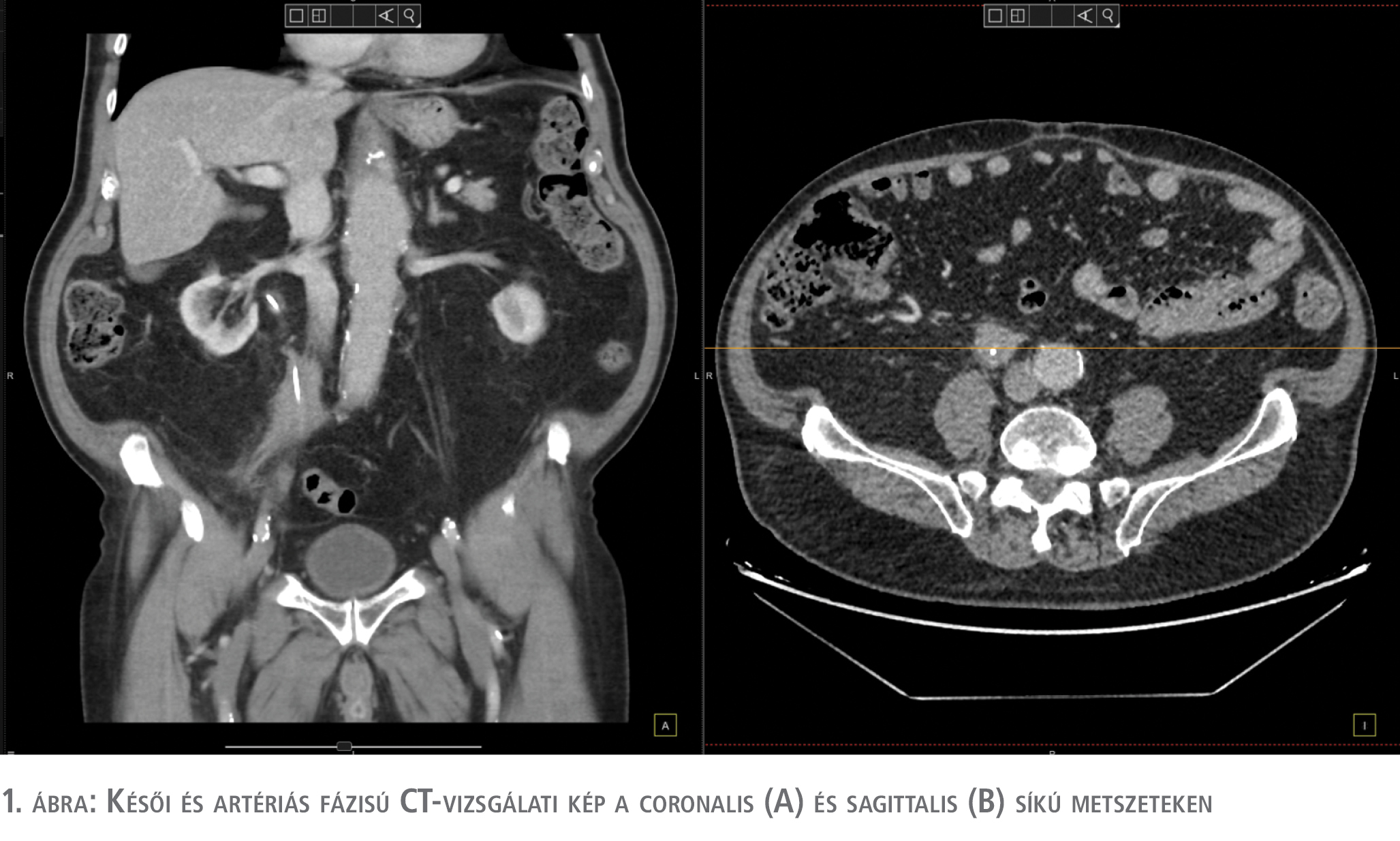
2022. december hónapban jobb oldali ureteronephrectomiát végeztünk. A vesemedencétől kb. 10 cm-re az ureteren megtöretés látszott 30×20×10 mm-es szakaszon, itt a zsírszövetben egy tömött tapintatú, szürkésfehér szövetszaporulat volt detektálható, amely a reszekciós szélt is elérte. 40 mm-es szakaszon az ureter pontszerűre beszűkült, az elváltozás a lument elérte, beszűrte. Mikroszkóp alatt az ureter környezetében zsírsejtekkel keveredve atípusos lymphocyták szolid halmaza látszott. A tumorsejtek keskeny, alig észlelhető citoplazmával, enyhén megnagyobbodott, mérsékelt variábilitást mutató sejtmagokkal rendelkeztek, amelyek magkontúrja egyenetlen, a kromatinja rögös volt, az esetek többségében nucleolus is elkülönült. CD 3/20 immunhisztokémiai régenssel B-sejtes dominancia volt látható. A Ki-67-index 30-35%-os értéket mutatott. A daganat a reszekciós felszínt körkörösen érintette, azonban a hosszanti reszekciós vég tumormentes volt. E leírás alapján low-grade B-sejtes lymphomát véleményeztek, azonban további szakértői tipizálásra, a minta eredményének pontosítására került sor. Eszerint az infiltráló lymphomatosus daganatszövet jellemzői közé tartozott: a kis, lymphocytáknál nagyobb sejtek jelenléte, jól kivehető nucleolussal és bőséges citoplazmával. Immunmorfológiailag a lezionális sejtek diffúz CD20-, valamint NMDA-pozitivitást mutattak, CD5-, CD23-, CD200-, valamint CD30-negativitás mellett. A folyamat a nyálkahártyát nem érintette, inkább másodlagosan infiltrálta az uretert. A végleges szakértői vélemény alapján CD20-pozitivitást mutató, uretert komprimáló margináliszóna-lymphomát állapítottunk meg.
2023. január hónapban a beteg staging vizsgálatát 18F-FDG PET-CT-vel végeztük. A műtéti területen gyulladásnak megfelelő kóros halmozás volt észlelhető. Az aortaoszlás szintjében, a VCI előtt egy 5,5 cm hosszúságban elhelyezkedő, axialisan 2,3×3,5 cm-es, szabálytalan alakú, intenzív halmozású, kötegezett lágyrészképlet (SUV max. 8,6) látszott. Cranialisabban a peritoneum egyenetlenül megvastagodott, a vese helyén a psoasizom előtt egy kb. 3×1 cm-es területen a zsírszövet denzitása inhomogénen szálasan fokozott volt, illetve kórosan fokozott farmakonhalmozás is megfigyelhető volt (vs. posztoperatív állapot, SUV max. 5,4). Kétoldali, mérsékelt fokú hilusi aktivitástöbblet elsősorban reaktív nyirokcsomókra utalhatott.
A patológus kollégával ismét egyeztettünk a korábbiakban pozitív vizeletcitológiai vizsgálat miatt. Eszerint a high-grade urothelialis malignitás gyanúját felvető eltérések a lymphomát kísérő szekunder hámatípiának feleltethetőek meg.
Az onkoteam javaslata alapján rituximab-bendamustin terápia indult lamivudinvédelemben, a HBc-pozitivitásra tekintettel. Első terápiás alkalommal 800 mg Rixathont intravénásan, illetve 180 mg bendamustint adtunk be. Az első kezelés után a betegnél tumorlízis, valamint egyéb szubjektív panasz nem volt detektálható. Összesen 10 ciklus rituximab-bendamustin kemoimmunterápia után, 3 évvel a betegség megjelenése után a páciens panaszmentes, az elvégzett kontrollvizsgálatok recidívát nem mutatnak.
Következtetés
A felső urothelialis traktust érintő extranodalis MALT-lymphoma igen ritka entitás, amelyet a legtöbb esetben csak véletlenszerűen fedeznek fel, ahogy a jelenlegi esetünk is mutatja. A diagnózis felállításának, valamint a megfelelő kezelés elindításának meghatározó lépése a szövettani mintavétel, amely betegünknél jobb oldali ureteronephrectomiát takart. Az extranodalis MALT-lymphoma ezen lokalizációja „véletlen” diagnózis. Az endoszkópos vagy a perkután mintavétel nehézkes lehet a felső húgyutak területén, és előfordul, hogy nem ad elegendő szövetet a pontos immunhisztokémiai vizsgálathoz. Az elvégzett retrográd vizsgálat, valamint az ureterorenoszkópia nem volt kellően informatív, hogy felmerüljön az urothelialis karcinómától eltérő malignoma lehetősége. A radikális műtét után viszont biztos diagnosztikus szövettani eredmény volt nyerhető. A kapott hisztológiai eredmény high-grade CD20-pozitív margináliszóna-lymphomát igazolt, amely egyértelműsítette, hogy a tumor mikrokörnyezete, amely nagymértékben a gyulladásos sejtek által irányított, megkerülhetetlen szereplője a daganatos folyamatnak.
Ajánlott, hogy az MZL diagnosztikai és követéses biopsziáit szakértő hematopatológus vizsgálja felül, majd erősítse meg, szükség esetén másodvélemény kíséretében. A differenciáldiagnózis erősen függ az immunhisztokémiától, valamint speciális, interdiszciplináris megközelítést igényel (8). Javasoljuk a multidiszciplináris megközelítést, hiszen a ritka hematológiai daganatok korai felismerése és megfelelő kezelése érdekében elengedhetetlen a hematopatológus, az onkológus és az urológus összehangolt együttműködése. Ez a szakmaközi kooperáció lehetőséget teremt arra, hogy az ilyen típusú elváltozásokat már a kezdeti stádiumban azonosítsák, így elkerülhetővé válik, hogy a diagnózis csupán egy esetleges radikális sebészi beavatkozás után szülessen meg. Ennek köszönhetően előtérbe kerülhetnek a célzottabb, szervkímélő terápiás megoldások is.
Köszönetnyilvánítás
A szerzők köszönetüket fejezik ki dr. Riesz Péter habilitált egyetemi docensnek a kézirat gondos lektorálásáért és értékes szakmai tanácsaiért.
Rövidítések
CR=cancer ratio, a rákos megbetegedés aránya; EMZL=extranodalis margináliszóna-lymphoma; IL=interleukin; KP1/CD68=anti-CD68 antitest; MNDA=myeloid cell nuclear differentation antigén, myeloid sejtek; MZL=margináliszóna-lymphoma; ORR=overall risk ratio, általános kockázat; OS=overall survival, teljes túlélés; PCR=polimerase chain reaction, polimeráz-láncreakció; SMZL=a lépet érintő margináliszóna-lymphoma; SUV=standardized uptake value, standard felvételi hányados; TPS=The Paris System for Reporting Urinary Cytology; VCI=vena cava inferior
Irodalom
https://doi.org/10.1097/00000658-190911000-00009 PMID: 17862436; PMCID: PMC1407201
2. Volkova MI, Gridneva YV, Probatova NA, et al. Primary Extranodal Marginal Zone Lymphoma of the Renal Pelvis: A Case Report and Review of the Literature. Case Rep Oncol 2022 Mar 31; 15(1): 362–368.
https://doi.org/10.1159/000522555 PMID: 35529296; PMCID: PMC9035957
3. Riesz P, Székely E, Szűcs M, et al. Pyelum- és uréterdaganatok. In.: Nyirády P (főszerk). Urológia. Budapest: Semmelweis Kiadó; 2019. p. 250–266.
4. Otsuki H, Ito K, Sato K, et al. Malignant lymphoma of mucosa-associated lymphoid tissue involving the renal pelvis and the entire ureter: A case report. Oncol Lett 2013 May; 5(5): 1625–1628.
https://doi.org/10.3892/ol.2013.1221 Epub 2013 Mar 1. PMID: 23760192; PMCID: PMC3678586.
5. Isaacson P, Wright DH, Jones DB. Malignant lymphoma of true histiocytic (monocyte/macrophage) origin. Cancer 1983 Jan 1; 51(1): 80–91. https://doi.org/10.1002/1097-0142(19830101)51:13.0.co;2-0. PMID: 6336974.
6. Di RoccoA, Petrucci L, Assanto GM, et al. Extranodal Marginal Zone Lymphoma: Pathogenesis, Diagnosis and Treatment. Cancers (Basel) 2022 Mar 29; 14(7): 1742.
https://doi.org/10.3390/cancers14071742 PMID: 35406516; PMCID: PMC8997163.
7. Lee H, Joo JE, Hong YO, et al. Ureteral Marginal Zone Lymphoma of Mucosa-Associated Lymphoid Tissue, Chronic Inflammation, and Renal Artery Atherosclerosis. J Pathol Transl Med 2015 Jul; 49(4): 339–342.
https://doi.org/10.4132/jptm.2015.04.28 Epub 2015 Jul 15. PMID: 26040774; PMCID: PMC4508573.
8. Thieblemont C, Bertoni F, Copie-Bergman C, et al. Chronic inflammation and extra-nodal marginal-zone lymphomas of MALT-type. Semin Cancer Biol 2014 Feb; 24: 33–42.
https://doi.org/10.1016/j.semcancer.2013.11.005 Epub 2013 Dec 9. PMID: 24333758.
9. Hara M, Satake M, Ogino H, et al. Primary ureteral mucosa-associated lymphoid tissue (MALT) lymphoma – pathological and radiological findings. Radiat Med 2002 Jan–Feb; 20(1): 41–4. PMID: 12002603.
10. Thieblemont C, Berger F, Dumontet C, et al. Mucosa-associated lymphoid tissue lymphoma is a disseminated disease in one third of 158 patients analyzed. Blood 2000 Feb 1; 95(3): 802–806. Erratum in: Blood 2000 Apr 15; 95(8): 2481. PMID: 10648389.
11. Zucca E, Arcaini L, Buske C, et al.; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Marginal zone lymphomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2020 Jan; 31(1): 17–29.
https://doi.org/10.1016/j.annonc.2019.10.010 Epub 2019 Dec 4. Erratum in: Ann Oncol 2023 Mar; 34(3): 325. PMID: 31912792.