Efficacy of radical prostatectomy for the treatment of high-risk prostate carcinomas
DOI: 10.22591/magyurol.2018.2.berczics.55
Authors:
Berczi Csaba dr., Kiss Zoltán dr., Flaskó Tibor dr.
Debreceni Egyetem Általános Orvostudományi Kar, Urológiai Klinika, Debrecen (igazgató: Dr. Flaskó Tibor)
Summary
Objective: At present there is no consensus regarding the optimal treatment of patients with high-risk prostate cancer. The authors measured the efficacy of radical prostatectomies for high-risk tumors at their institute.
Material and method: From January 1996 to January 2016, 2022 patients underwent radical prostatectomy and they were involved into the study. The mean age of the patients was 63.5±6.4 years. In their cases the mean preoperative PSA level was 12.3 ng/ml. High-risk prostate cancer was present in 356 cases (17.6%). The mean age of these patients was 63.7±7.2 years and their mean preoperative PSA level was 29.4 ng/ml.
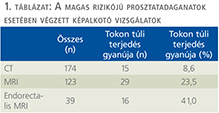
Preoperative CT examination was performed in 174 cases and it showed locally advanced tumor in 15 patients with high-risk tumors. MRI and MRI with endorectal coil were carried out in 123 and 36 occasions and they detected locally advanced tumor in 29 and in 16 patients.
Observation, adjuvant or salvage irradiation or/and hormonal therapy were administered in the follow-up period regarding to the actual guideline and the patient’s condition.
Results: The histology showed locally advanced tumor (pT3) in 169 of the 356 patients (47.4%). Margin positivity occurred in 88 cases (28.7%). Biochemical progression was detected in 42 (11.7%) cases, while local recurrency and distant metastases were diagnosed in 12 (3.3%) and in 7 (1.9%) patients with high-risk tumor during the 5 year follow-up period. Irradiation and hormonal treatment were performed in 22.7% and in 30.8% of the patients after the radical prostatectomy.
Conclusion: The presence of locally advanced tumor and margin positive status are common in patients with high-risk prostate cancer. However, the radical prostatectomy as a part of multimodal treatment provides reasonable oncological outcome.
LAPSZÁM: MAGYAR UROLÓGIA | 2018 | 30. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Célkitűzés: A magas rizikójú prosztatatumorok optimális kezelése jelenleg nem teljesen egyértelmű. A szerzők a magas rizikójú prosztatatumorok miatt végzett radikális prostatectomiák hatékonyságának elemezték intézetükben.
Betegek és módszer: A tanulmányban a 1996. 01. 01. és 2016. 01. 01. között intézetükben radikális prostatectomián átesett 2022 beteg adatai kerültek feldolgozásra. A betegek átlagos életkora 63,5±6,4 év. Esetükben a preoperatív PSA-koncentráció 12,3 ng/ml volt.
Magas rizikójú prosztatadaganat 356 alkalommal (17,6%) fordult elő. Ezen betegek átlagos életkora 63,7±7,2 év, míg a preoperatív PSA-koncentráció 29,4 ng/ml volt.
A műtét előtti kivizsgálás során a magas rizikójú betegcsoportban a 174 esetben történt CT-vizsgálat, s ez 15 betegben (8,6%), míg a 123 MR-vizsgálatból 29 betegben (23,5%), és a 39 endorectalis MR-ből 16 esetben (41,0%) vetette fel lokálisan előrehaladott tumor gyanúját.
A műtétet követően az eltelt időtartam alatt a kezelési protokollok változása miatt a beteg állapotának figyelembevételével obszervációt, adjuváns irradiációt salvage irradiációt és hormonkezelést alkalmaztak.
Eredmények: A szövettani vizsgálat a 356 magas rizikójú prosztatatumornál 169 alkalommal (47,4%) igazolt lokálisan előrehaladott (pT3) daganatot. Margin pozitivitást 88 esetben (24,7%) észleltek. Az 5 éves utánkövetés alatt a magas rizikójú prosztatadaganatos betegcsoportban biokémiai progressziót 42 (11,7%), lokális recidívát 12 (3,3%), míg távoli metasztázist 7 (1,9%) betegben diagnosztizáltak. A radikális prostatectomiát követően sugárterápiára az esetek 22,7%, míg hormonkezelésre a betegek 30,8%-ában került sor.
Megbeszélés: A magas rizikójú prosztatadaganatok esetében mind a lokálisan előrehaladott daganat, mind pedig a margin pozitivitás gyakori. Az eredmények alapján azonban a radikális prostatectomia a multimodálsi terápia részeként megfelelő onkológiai eredményességet biztosít.
Bevezetés
A prosztata-karcinóma a férfiakban leggyakrabban előforduló daganatos megbetegedés. A prosztatadaganatok rizikócsoportba való sorolása D’Amico nevéhez fűződik, aki 1998-ban alacsony, közepes és magas rizikócsoport kategóriákat állított fel (1). Ezt a rizikóbesorolást gyakorlatilag mindegyik urológus társaság átvette és alkalmazta kisebb módosításokkal. Tulajdonképpen a magas rizikójú prosztatatumorra jelenleg több meghatározás létezik. Ezek legtöbbjében a definíció kritériuma, hogy a PSA-szint >20 ng/ml és/vagy a tumor Gleason-score értéke ≥8 és/vagy lokálisan előrehaladott daganat legyen (T3) (2, 3, 4). Az Európai Urológus Társaság módszertani levele alapján a magas rizikójú csoportba az a prosztatadaganat sorolható, amikor a PSA >20 ng/ml vagy Gleason-score ≥8 és a klinikai stádium ≥T2c (5). Megemlítendő, hogy a magas rizikójú prosztatadaganatos csoport azért viszonylag heterogén csoport s ezen belül ma már elkülönítenek egy „nagyon magas rizikójú” csoportot. Ebbe a „nagyon magas rizikójú” csoportba azon betegek tartoznak, akikben több mint 4 biopsziás mintában a Gleason-score 8–10 közötti, vagy cT3b/T4 stádiumú a daganat. A „nagyon magas rizikójú” tumorok esetében a 10 éves daganatspecifikus mortalitás csaknem a háromszorosa a magas rizikójú esetekhez viszonyítva (6, 7). Míg az alacsony rizikójú daganatok esetében elgondolkodtató, hogy a definitív kezelés valóban túlkezelés-e, addig a magas rizikójú tumorok esetében ez nem kérdés, szükséges a definitív kezelés. A magas rizikójú prosztatadaganatra jellemző, hogy a másik két rizikócsoporthoz viszonyítva nehezebb a tumorkontroll biztosítása és ezen daganatok hajlamosak a metasztázis képzésre és a mortalitásuk is magasabb.
Jelen tanulmányunkban vizsgáltuk a magas rizikójú prosztatadaganatos betegekben végzett radikális prostatectomiák eredményességet. Elemeztük az utánkövetés során a biokémiai progresszió, valamint a lokális tumorrecidíva és távoli áttét kialakulásának gyakoriságát.
Betegek és módszerek
A Debreceni Egyetem Urológiai Klinikáján 1996. 01. 01. és 2016. 01. 01. között összesen 2022 esetben végeztünk radikális prostatectomiát. A vizsgálat során ezen betegek adatait dolgoztuk fel retrospektív módon.
A betegek átlagos életkora 63,5±6,4 év volt. Esetükben a műtét előtti PSA-koncentráció 12,3 ng/ml.
A 2022-ből 356 betegnek (17,6%) volt az Európai Urológus Társaság beosztása szerinti magas rizikójú prosztatadaganata. Közülük 296 betegnek volt klinikailag szervre lokalizált, míg 60 betegnek lokálisan előrehaladott magas rizikójú prosztatatumora. A magas rizikójú csoportba tartozó esetekben az átlagos életkor 63,7±7,2 év, míg a preoperatív PSA-koncentráció 29,4 ng/ml volt.
A műtét előtti kivizsgálás során a magas rizikójú tumoros betegeknél valamennyi esetben képalkotó vizsgálatot végeztünk a tumor lokális kiterjedtségének meghatározása céljából.
A kivizsgálás során 174 esetben történt CT-vizsgálat, s ez 15 betegben (8,6%), míg a 123 MR-vizsgálatból 29 betegben (23,5%), és a 39 endorectalis MR-ből 16 esetben (41,0%) vetette fel lokálisan előrehaladott tumor gyanúját.
A képalkotó vizsgálatok sok esetben nem klinikánkon történtek, s így azok végzése során eltérő típusú és érzékenységű készüléket használtak. A CT-vizsgálatokat még a korábbi időszakban végeztük, amikor még nem volt lehetőségünk MR-vizsgálatok kivitelezésére. A Debreceni Klinikán végzett MR-vizsgálatok 2015. 09. 01-ig 1 Teslás érzékenységű készülékkel, míg azt követően 3 Teslás készülékkel történtek. Az endorectalis MR-vizsgálatok során 1 Teslás készüléket alkalmaztak (1. táblázat).
Csontizotóp-vizsgálatot 296 alkalommal (83,1%) végeztünk a preoperatív kivizsgálás során a magas rizikójú prosztatadaganatos csoportban, amely valamennyi esetben negatív volt.
A radikális prostatetomia előtt összesen 97 beteg (27,2%) kapott neoadjuváns hormonkezelést. A neoadjuváns hormonkezelést a legtöbb esetben az operáló orvos indikálta, a jobb lokális tumorkontroll biztosítása céljából. Sok esetben azonban a hormonterápiát más intézetben indították és azt követően küldték klinikánkra a beteget.
A radikális prostatectomia 203 betegben laparoszkópos, 73 alkalommal retropubikus és 80 esetben perinealis behatolásból történt. A perinealis radikális prostatectomiákat a kezdeti időszakban alkalmaztuk, míg a laparoszkópos beavatkozásokat 2004 óta végezzük.
A perinealis radikális prostatectomiák során nyirokcsomó-eltávolítást nem végeztünk. A laparoszkópos és a retropubikus eljárással végzett beavatkozások során kezdetben limitált, majd később a szakmai ajánlások változása miatt kiterjesztett nyirokcsomó-eltávolítást alkalmaztunk.
A szövettani stádium meghatározása a 2009. UICC TNM rendszer szerint történt retrospektíve.
A betegek utánkövetése során PSA-vizsgálat az első 3 évben 3 havonta, azt követően 5 évig 6 havonta, majd ezután évente történt. Képalkotó vizsgálatot (CT, MR, csontizotóp-vizsgálat) PSA-emelkedés vagy a beteg panaszai miatt végeztünk. A biokémiai progressziót úgy definiáltuk, hogy olyan PSA-emelkedés, amely 0,2 ng/ml fölé történt legalább 2 alkalommal.
Lokális recidíva gyanúja esetén MRI-vizsgálatot végeztünk, s amennyiben a prosztataágyban a rectalis digitális vizsgálat során tapintható eltérés is volt, úgy sok esetben prosztata-biopszia is történt. Azokban az esetekben, amikor az MRI lokális recidívát írt le, és ez korrelált a klinikai képpel, nem végeztük el a prosztata-biopsziát.
A korábbi időszakban, azokban az esetekben, amikor a daganat pT3 stádiumú volt, vagy margin pozitivitás fordult elő, vagy a PSA-érték nem csökkent gyakorlatilag mérhetetlen szintre, rutinszerűen adjuváns irradiációt és hormonkezelést alkalmaztunk, amennyiben ezt a beteg elfogadta. A későbbiekben azon esetekben, amikor a szövettan pT3 stádiumú tumort és/vagy margin pozitivitást írt le, a további kezelés eldöntéséhez figyelembe vettük a Gleason-score értéket, valamint a műtét utáni PSA-szintet. Ezek együttes figyelembevételével döntöttünk a sugárkezelés vagy az obszerváció mellett. Az utóbbi években a radikális prostatectomia utáni PSA-emelkedés esetén (PSA>0,5 ng/ml) korai salvage sugárkezelést alkalmazunk.
Az átlagadatok mellett ± standard deviációt adtuk meg. A statisztikai analízist Student féle t-próbával végeztük. A 0,05-nél kisebb p-értékeket tekintettük szignifikánsnak.
Eredmények
A szövettani vizsgálat a 356 magas rizikójú prosztatatumornál 169 alkalommal (47,4%) lokálisan előrehaladott (pT3), míg 187 esetben (52,6%) szervre lokalizált daganatot igazolt. A pT3 stádiumú betegek közül 36, míg a pT2 stádiumúakban összesen 61 esetben történt neoadjuváns hormonkezelés.
Az elvégzett preoperatív képalkotó vizsgálatok a magas rizikójú prosztatatumoroknál az esetek 16,8%-ában vetették fel a tumor prosztatatokon túli terjedésének gyanúját. Ezzel szemben a szövettani vizsgálat csaknem háromszor gyakrabban igazolt lokálisan előrehaladott karcinómát. Megvizsgálva a műtét előtt végzett képalkotó vizsgálatok és az eltávolított prosztatadaganatok szövettani eredményeit a tumor extraprosztatikus terjedésének szempontjából, azt tapasztaltuk, hogy pozitív prediktív érték a CT-vizsgálat vonatkozásában 33,3%, míg az MR és az endorectalis MR esetében 65,5% és 62,5% volt.
A sebészi szél tumoros infiltrációját a szövettani vizsgálat 88 esetben (24,7%) mutatta ki. Margin pozitivitást 76 betegben (86,3%) pT3 stádiumban, míg 12 esetben (13,7%) pT2 stádiumban észleltünk. A margin pozitív esetek közül 15 betegben történt neoadjuváns hormonkezelés.
A neoadjuváns hormokezelést kapott betegekben a tumor 44 esetben volt pT3 és 53 alkalommal pT2 stádiumú. Az előzetes hormonkezelést nem kapott csoportban a daganat 132 alkalommal volt pT3 és 127 esetben pT2 stádiumú. A neoadjuváns terápia mellett lokálisan előrehaladott tumor szignifikánsan ritkábban fordult elő (p=0,021). Neoadjuváns kezelés után margin pozitivitást 15 betegben (15,4%), míg neoadjuváns kezelés nélkül 73 alkalommal (28,1%) mutattak ki (p=0,013).
A szövettani vizsgálat az eltávolított nyirokcsomókban, 21 betegben (5,9%) igazolt tumoros infiltrációt.
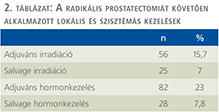
A magas rizikójú prosztatadaganatos betegek esetében az eltelt időtartam alatt a kezelési protokollok változása miatt a beteg-compliance és preferencia figyelembevételével obszervációt, adjuváns irradiációt salvage irradiációt és hormonkezelést alkalmaztunk. Adjuváns sugárkezelés az esetek 115,7%-ában, míg salvage sugárkezelés 7%-ában végeztünk. A radikális prostatectomiát követően hormonkezelésre a betegek 30,8%-ában került sor (2. táblázat).
Az 5 éves utánkövetés alatt a magas rizikójú prosztatadaganatos betegcsoportban biokémiai progressziót 42 (11,7%), lokális recidívát 12 (3,3%), míg távoli metasztázist 7 (1,9%) betegben diagnosztizáltunk.
Megbeszélés
A módszertani levelek és a különböző klinikai vizsgálatok alapján a magas rizikójú prosztatadaganatos betegek kuratív ellátására jelenleg kétféle kezelési lehetőség jön szóba. Az egyik a hagyományos-, a sugárkezelés és emellett hormonkezelés adása. A másik lehetőség a multimodális kezelés, amely a radikális prostatectomia és majd a végleges szövettan, valamint a műtét utáni PSA-szint függvényében, a sugárkezelés kombinációját foglalja magába. Az, hogy melyik kezelési módszer hatékonyabb a másiknál, jelenleg nem teljesen egyértelmű.
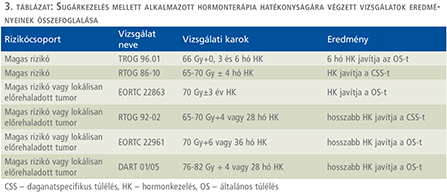
Korábban a magas rizikójú prosztatatumorok esetében a sugárkezelést alkalmazták elterjedten. A sugárkezelés során a kérdés az volt, hogy amellett mennyi ideig történjen androgén deprivációs hormonkezelés. Ezzel kapcsolatban a sugárkezelés és hormonkezelés vonatkozásban több randomizált klinikai vizsgálat történt. Ezek többsége azt igazolta, hogy az irradiáció mellett alkalmazott hosszan tartó hormonkezelés növeli a hatékonyságot (3. táblázat) (7–11).
A radikális prostatectomiát korábban elsősorban azokban az esetekben alkalmazták, amikor a daganat csak a prosztatára lokalizálódott. A magas rizikójú prosztatadaganatok esetében sokáig nem végeztek radikális műtétet a felesleges szövődmények elkerülése céljából, de az újabb vizsgálatok eredményei azt igazolták, hogy a betegek életminősége hasonló a sugárkezelés, illetve a műtét után (12–15).
Az onkológiai eredményesség szempontjából több közlemény arról számolt be, hogy a magas rizikójú prosztatadaganatoknál a radikális prostatectomia és a sugárkezelés eredményessége hasonló a mind a daganatspecifikus, mind az általános túlélés szempontjából (16–18). Ezzel kapcsolatban sok újabb vizsgálati eredmény, pedig inkább a radikális prostatectomia végzését támogatja a sugárkezeléssel szemben (17–24). Kiemelném Wallis és munkatársai nemrég publikált metaanalízisét, amelyben úgy találták, hogy a daganatspecifikus mortalitás 15 vizsgálatban, míg az általános mortalitás 10 vizsgálatban volt szignifikánsan rosszabb a sugárkezelésben részesült betegekben a műtéthez viszonyítva a magas rizikójú daganatok esetében (25).
Ugyanakkor megemlítendő, hogy nincs olyan randomizált klinikai vizsgálat amely fej-fej mellett vizsgálta volna a kétfajta kezelési eljárás onkológiai eredményességét.
Kishan és munkatársai eredményei azt mutatták, hogy bár a magas rizikójú tumoroknál a műtét a daganat szempontjából jobb lokális kontrollt biztosít, a műtét után az esetek 49%-ában történt adjuváns vagy salvage sugárkezelés (17). Vizsgálatukban az utánkövetés során az esetek 30,1%-ában került sor hormonkezelésre. Saját anyagunkban a radikális prostatectomiát követően irradiációt az esetek 22,7%-ában, míg hormonkezelést 30,8%-ában végeztünk.
Több szerző arról számolt be, hogy magas rizikójú prosztatatumorok esetében a műtét után az 5 éves biokémiai progressziómentes túlélés 55-71% között változik (26–29). Ugyanakkor az ilyen betegcsoportban végzett radikális prostatectomiát követően a 10 éves biokémiai progressziómentes túlélést 32-40%-nak, míg a 15 éves biokémiai progressziómentes túlélést 27-28%-nak találták (30, 31). Saját betegeinkben az 5 éves biokémiai progressziómentes túlélés 88,3% volt.
Matulay és munkatársai összefoglaló közleményükben azt a következtetést vonták le, hogy a jelenlegi eredmények alapján a magas rizikójú prosztatadaganatok esetében a radikális prostatectomia eredményesebbnek tekinthető, mint a sugárkezelés (18). Ugyanakkor ezen betegcsoportban a neodjuváns hormonkezelés és a kiterjesztett kismedencei nyirokcsomó-eltávolítás szerepe az onkológiai eredményesség szempontjából jelenleg nem egyértelmű.
Következtetések
Összefoglalva, a magas rizikójú prosztatadaganatok esetében mind a lokálisan előrehaladott daganat, mind pedig a margin pozitivitás gyakori. A neoadjuváns hormonkezelés mellett a lokális tumorkontroll biztosítása eredményesebbnek bizonyult. Az eredmények alapján azonban a radikális prostatectomia a multimodális terápia részeként megfelelő onkológiai eredményességet biztosít ezen daganatok kezelésére.
References
1. D’Amico AV, Whittington R, Malkowicz SB, et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998; 280(11): 969–74. https://doi.org/10.1001/jama.280.11.969
2. Chang AJ, Autio KA, Roach M 3rd, et al. High-risk prostate cancer-classification and therapy. Nat Rev Clin Oncol 2014; 11(6): 308–23. https://doi.org/10.1038/nrclinonc.2014.68
3. Mohler JL, Kantoff PW, Armstrong AJ, et al. Prostate cancer, version 2.2014. J Natl Compr Canc Net 2014; 12(5): 686–718. https://doi.org/10.6004/jnccn.2014.0072
4. Thompson I, Thrasher JB, Aus G, et al. Guideline for the management of clinically localized prostate cancer: 2007 update. J Urol 2007; 177(6): 2106–31. https://doi.org/10.1016/j.juro.2007.03.003
5. Heidenreich A, Bastian PJ, Bellmunt J, et al. EAU guidelines on prostate cancer. part 1: screening, diagnosis, and local treatment with curative intent-update 2013. Eur Urol 2014; 65(1): 124–37. https://doi.org/10.1016/j.eururo.2013.09.046
6. Narang AK, Gergis C, Robertson SP, et al. Very High-Risk Localized Prostate Cancer: Outcomes Following Definitive Radiation. Int J Radiol Oncol Biol Phys 2016; 94(2): 254–62. https://doi.org/10.1016/j.ijrobp.2015.10.056
7. Nguyen PL. Optimization of the Radiation Management of High-Risk Prostate Cancer. Semin Radiat Oncol 2017; 27(1): 43–49. https://doi.org/10.1016/j.semradonc.2016.08.009
8. Bolla M, de Reijke TM, Van Tienhoven G, et al. Duration of androgen suppression in the treatment of prostate cancer. N Engl J Med 2009; 360(24): 2516–27. https://doi.org/10.1056/NEJMoa0810095
9. Denham JW, Steigler A, Lamb DS, et al. Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 2011; 12(5): 451–9. https://doi.org/10.1016/S1470-2045(11)70063-8
10. Horwitz EM, Bae K, Hanks GE, et al. Ten-year follow-up of radiation therapy oncology group protocol 92-02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J Clin Oncol 2008; 26(15): 2497–504. https://doi.org/10.1200/JCO.2007.14.9021
11. Zapatero A, Guerrero A, Maldonado X, et al. High-dose radiotherapy with short-term or long-term androgen deprivation in localised prostate cancer (DART01/05 GICOR): a randomised, controlled, phase 3 trial. Lancet Oncol 2015; 16(3): 320–7. https://doi.org/10.1016/S1470-2045(15)70045-8
12. Hamdy FC, Donovan JL, Lane JA, et al. 10-year outcomes after monitoring, surgery, or radiotherapy for localized prostate cancer. N Engl J Med 2016; 375(15): 1415–24. https://doi.org/10.1056/NEJMoa1606220
13. Donovan JL, Hamdy FC, Lane JA, et al. Patient-reported outcomes after monitoring, surgery, or radiotherapy for prostate cancer. N Engl J Med 2016; 375(15): 1425–37. https://doi.org/10.1056/NEJMoa1606221
14. Jarosek SL, Virnig BA, Chu H, et al. Propensity-weighted long-term risk of urinary adverse events after prostate cancer surgery, radiation, or both. Eur Urol 2015; 67(2): 273–80.
15. Potosky AL, Davis WW, Hoffman RM, et al. Five-year outcomes after prostatectomy or radiotherapy for prostate cancer: the prostate cancer outcomes study. J Natl Cancer Inst 2004; 96(18): 1358–67. https://doi.org/10.1093/jnci/djh259
16. Cooperberg MR, Vickers AJ, Broering JM, et al. Comparative risk-adjusted mortality outcomes after primary surgery, radiotherapy, or androgen-deprivation therapy for localized prostate cancer. Cancer 2010; 116(22): 5226–34. https://doi.org/10.1002/cncr.25456
17. Kishan AU, Shaikh T, Wang PC, et al. Clinical Outcomes for Patients with Gleason Score 9-10 Prostate Adenocarcinoma Treated With Radiotherapy or Radical Prostatectomy: A Multi-institutional Comparative Analysis. Eur Urol 2017; 71(5): 766–773. https://doi.org/10.1016/j.eururo.2016.06.046
18. Matulay JT, DeCastro GJ. Radical Prostatectomy for High-risk Localized or Node-Positive Prostate Cancer: Removing the Primary. Curr Urol Rep 2017; 18(7): 53. https://doi.org/10.1007/s11934-017-0703-x
19. Baker CB, McDonald AM, Yang ES, et al. Pelvic Radiotherapy versus Radical Prostatectomy with Limited Lymph Node Sampling for High-Grade Prostate Adenocarcinoma. Prostate Cancer 2016; 2016: 2674954. https://doi.org/10.1155/2016/2674954
21. Lee BH, Kibel AS, Ciezki JP, et al. Are biochemical recurrence outcomes similar after radical prostatectomy and radiation therapy? Analysis of prostate cancer-specific mortality by nomogram-predicted risks of biochemical recurrence. Eur Urol 2015; 67(2): 204–9 https://doi.org/10.1016/j.eururo.2014.09.017
22. Perez BA, Koontz BF. Radiotherapy before and after radical prostatectomy for high-risk and locally advanced prostate cancer. Urol Oncol 2015; 33(5): 226–34. https://doi.org/10.1016/j.urolonc.2014.09.018
23. Westover K, Chen MH, Moul J, et al. Radical prostatectomy vs radiation therapy and androgensuppression therapy in high-risk prostate cancer. BJU Int 2012; 110(8): 1116–21. https://doi.org/10.1111/j.1464-410X.2012.11012.x
24. Zelefsky MJ, Eastham JA, Cronin AM, et al. Metastasis after radical prostatectomy or external beam radiotherapy for patients with clinically localized prostate cancer: a comparison of clinical cohorts adjusted for casemix. J ClinOncol 2010; 28(9): 1508–13. https://doi.org/10.1200/JCO.2009.22.2265
25. Wallis CJ, Saskin R, Choo R, et al. Surgery versus radiotherapy for clinicallylocalized prostate cancer: a systematic review and meta-analysis. Eur Urol 2016; 70(1): 21–30. https://doi.org/10.1016/j.eururo.2015.11.010
26. Eggener SE, Scardino PT, Walsh PC, et al. Predicting 15-year prostate cancer specific mortality after radical prostatectomy. J Urol 2011; 185(3): 869–75. https://doi.org/10.1016/j.juro.2010.10.057
27. Spahn M, Joniau S, Gontero P, et al. Outcome predictors of radical prostatectomy in patients with prostate-specific antigen greater than 20 ng/ml: a European multi-institutional study of 712 patients. Eur Urol 2010; 58(1): 1–7. https://doi.org/10.1016/j.eururo.2010.03.001
28. Stephenson AJ, Kattan MW, Eastham JA, Bianco FJ Jr, et al. Prostate cancer-specific mortality after radical prostatectomy for patients treated in the prostate-specific antigen era. J Clin Oncol 2009; 27(26): 4300–5. https://doi.org/10.1200/JCO.2008.18.2501
29. Zwergel U, Suttmann H, Schroeder T, et al. Outcome of prostate cancer patients with initial PSA> or =20 ng/ml undergoing radical prostatectomy. Eur Urol 2007; 52(4): 1058–65. https://doi.org/10.1016/j.eururo.2007.03.056
30. Bastian PJ, Gonzalgo ML, Aronson WJ, et al. Clinical and pathologic outcome after radical prostatectomy for prostate cancer patients with a preoperative Gleason sum of 8 to 10. Cancer 2006; 107(6): 1265–72. https://doi.org/10.1002/cncr.22116
31. Bastian PJ, Boorjian SA, Bossi A, et al. High-risk prostate cancer: from definition to contemporary management. Eur Urol 2012; 61(6): 1096–106. https://doi.org/10.1016/j.eururo.2012.02.031
Leave a Reply
You must be logged in to post a comment.