MULTIPARAMETRIC MR IMAGING OF PROSTATE TUMORS: PI-RADS V.2.1
DOI: 10.22591/magyurol.2020.1.kalinai.5
Authors:
Kalina Ildikó dr., Wolf Tamás dr.
Semmelweis Egyetem, Orvosi Képalkotó Klinika, Budapest (igazgató: Maurovich Horvat Pál dr.)
Summary
The MRI scanners operating in our country with 1.5 Tesla and 3 Tesla magnetic field strength are eligible to perform MRI sequences focused on the prostate regarding the implementation of both appropriate anatomical resolution and functional measurement, therefore they enable us to prepare complex multiparametric MR imaging concerning the prostate and to apply the PI-RADS. PI-RADS has been elaborated in order to offer a simplified and standardized MRI reporting method in case of the prostate and to facilitate interdisciplinary communication between the radiologist and the clinician. The system is not used routinely yet in Hungary, our intention with the present article is to draw further public attention to it.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 1. SZÁM
Összefoglalás
A hazánkban működő 1,5 Tesla és 3 Tesla mágneses térerősségű MR-készülékek alkalmasak a prosztatára célzott MR-szekvenciák elvégzésére, mind a megfelelő anatómiai felbontás, mind a funkcionális mérések kivitelezése terén, így lehetőséget nyújtanak a prosztata komplex, multiparametrikus MR képalkotására és a PI-RADS alkalmazására. A PI-RADS azzal a céllal jött létre, hogy egyszerűsített és standard módszert kínáljon a prosztata MR-leletezésére, megkönnyítse a radiológus és a klinikus közötti interdiszciplináris kommunikációt. Hazánkban a rendszer még rutinszerűen nem terjedt el, cikkünk célja, hogy minél szélesebb körben figyelmet kaphasson.
Bevezetés
A prosztata MR-vizsgálattal történő képalkotása az 1980-as évek óta alkalmazott eljárás. A nyert felvétel magas lágyrészkontrasztja a prosztatán belüli finomabb szövettani egységek pontos megítélésére ad lehetőséget, szemben a komputertomográfiás (CT) eljárással, amellyel ez nem lehetséges. Az ultrahangvizsgálat szenzitivitása és specificitása egyaránt alacsony, 40-50% körüli. Az MR-képalkotás fejlődésével, az eszközök mágneses térerősségének növelésével a „klasszikus” spin echo szekvenciák térbeli felbontóképessége megnőtt, valamint elterjedtek a már funkcionális vizsgálatok elvégzésére is képes mérések. Mindezeket megfelelően, együtt alkalmazva lehetőség nyílik a prosztata komplex anatómiai-funkcionális képalkotására. 2012-ben az Európai Urogenitális Radiológiai Társaság (ESUR) gondozásában megjelent a Prostate Imaging Reporting And Data System (PI-RADS) első verziója, amely az emlőtumorok képalkotásában már bizonyított multiparametrikus-MR- (mp-MR) vizsgálat alapján vezeti a radiológusokat a pontos diagnózishoz. 2015-ben a PI-RADS fejlesztésébe az Amerikai Radiológus Társaság (ACR) is bekapcsolódott, megjelent a 2.0-ás verzió. Az ajánlásból ezzel kikerült az MR-spektroszkópia rutinszerű elvégzése. Jelenleg a PI-RADS 2.1-es verziója a legfrissebb, 2019 februárjától érhető el (1). Az eljárás lényege, hogy meghatározott mérések adatait felhasználva történjen a diagnózisalkotás, algoritmusként, következetesen mindig ugyanazon szempontok figyelembevételével. Fontosnak tartjuk hangsúlyozni, hogy a prosztata mp-MR-vizsgálata nem igényel speciális technikai hátteret, megfelelő térerősségű MR-készülék (legalább 1,5 Tesla) és MR-protokoll alkalmazása mellett elvégezhető. A prosztata képalkotásában releváns mérések:
- T2 súlyozott mérés (T2W),
- diffúzió súlyozott mérés (DWI) és az ebből származtatott becsült diffúziós koefficiens (ADC) térkép,
- dinamikus perfúziós mérés (DCE).
A PI-RADS szerinti képalkotás és leletezés legfontosabb célja a klinikailag szignifikáns prosztatatumorok (csPC) detektálása, amelynek kritériumait az ajánlás meg is határozza: Gleason-score ≥7, tumortérfogat ≥0,5 cm3, extraprosztatikus extenziót mutató elváltozás. Az elmúlt évek paradigmaváltásának köszönhetően, a korábban kizárólag lokoregionális stádiumbesorolásra használt MR-vizsgálat ma már alkalmas a tumoroknak a prosztata állományán belüli pontos lokalizálására, a tumorfészkek kimutatására, viselkedésük karakterizálására, rizikóbecslésre, a feltételezett kiújulás kockázatának becslésére, biopszia, műtét és sugárterápia pontosabb megtervezésére, ezek mellett fúziós mintavétel alapjául szolgálhat (2). Az mp-MR-vizsgálat szenzitivitása egyértelműen a klinikailag szignifikáns tumorok esetében a legmagasabb, szubklinikus tumorok kimutatására – ebből következően szűrésre – nem alkalmas.
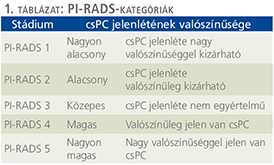
A PI-RADS-rendszer öt prognosztikai stádiumát az 1. táblázat szemlélteti.
Minden leletnek tartalmaznia kell a szerv méretére vonatkozó adatokat. A három maximális átmérőből az ún. ellipszoid formula alkalmazásával kapjuk meg a prosztata térfogatát. A rendelkezésre álló legfrissebb PSA-értéket ezek után elosztjuk a számolt térfogattal, megkapva a prosztata PSA-denzitását (PSAD).
A prosztata leletezése a T2W-szekvencia felvételeinek áttekintésével kezdődik az anatómiai viszonyok megítélése céljából. Ezeken a képeken a tumorok hipointenz jeladásúak mind a perifériás (PZ), mind a tranzícionális zónában (TZ). Mindkét zónának megvan az elsődlegesen értékelendő, ún. primer determináló szekvenciája. Ez azt jelenti, hogy a PI-RADS-besorolás a PZ elváltozásai esetén elsődlegesen a DWI-szekvencia és ADC-térkép alapján történik, míg a TZ-léziói esetén a T2W-szekvencia a determináló. A komplex leletezés természetesen mindhárom szekvencia együttes értékelése alapján történik, azok szinkronizált vizsgálata mellett.
A perifériás zóna értékelése
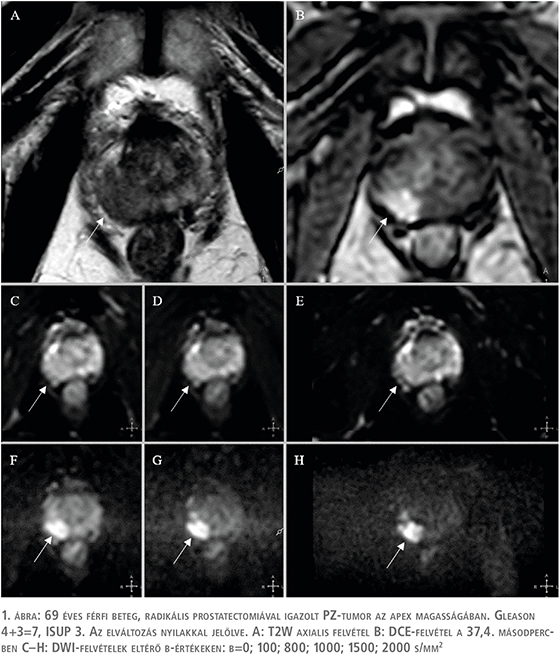
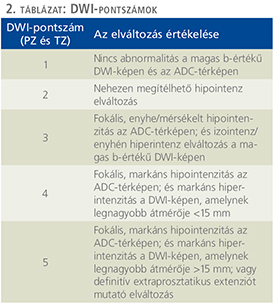
A perifériás zóna T2W-felvételeken a környezeténél magasabb jeladású, homogén terület (1. ábra). Malignitás gyanúját veti fel, ha benne kóros jeleltérés, kontúrjában torzulás jelentkezik. DWI-szekvencián és ADC-térképen történő értékelése során a PZ-ben detektálható elváltozások DWI-pontszámot kapnak
(2. táblázat).
Egy adott DWI-mérés „diffúzió súlyozottságát” az ún. b-érték határozza meg. Minél magasabb b-értéket választunk, a nyert szignál annál alacsonyabb lesz. Azonban, ha a beállított b-érték túl magas, a kép jelszegénnyé válik; viszont a beérkező relatíve kevesebb jel miatt a csökkent diffúziójú területek „világítanak”. Padhani és munkatársai lejegyezték az egyes szövetekben és kórfolyamatokban 1,5 Teslán alkalmazandó „optimális” b-értékeket. Több eltérő kutatás a prosztata vizsgálata során a releváns b-értékeket >1000 s/mm2-ben határozta meg (3, 4). A gyanús elváltozás ADC-értékének meghatározása optimálisan a magas b-értékű képből derivált ADC-térképen történik, vagy konzekvensen mindig ugyanazon b-érték(ek)hez tartozó ADC-térképen. Az ADC-értékek dimenziója mm2/s. 0,75×10–3 mm2/s határérték alatti ADC-értékek jól korrelálnak a csPC-k előfordulásával (1). A magas b-értékű képek fokozott kontrasztjának köszönhetően olyan elváltozások is azonosíthatók a DWI-felvételeken, amelyek az egyébként alacsony szignálintenzitású lokalizációban való elhelyezkedésük miatt (pl. anterior fibromuscularis stromába törő tumor) más szekvenciákon csak nehezen detektálhatók.
Amennyiben az mp-MR-vizsgálat DWI- vagy DCE-komponensét nem végezték el, vagy elvégezték ugyan, de eredménye nem értékelhető, úgy a PI-RADS-értékelési kategória felállításakor ezt a komponenst „X”-szel jelöljük. Mivel a PZ-ben jelentkező klinikailag szignifikáns prosztatatumorok diagnózisában kulcsfontosságú a DWI-szekvencia értékelhetősége, ezért a nem megfelelő vagy hiányzó DWI-adatok esetén az mp-MR-vizsgálat ezen komponense megismétlendő, amennyiben a szekvencia sikertelenségét eredményező okok megszüntethetők. Abban az esetben, ha ez nem lehetséges, a PI-RADS értékelési kategória meghatározható T2W-szekvencián is, ez azonban komoly megszorítást jelent a pontos diagnózis felállításában. A prosztata MR-leletezésekor ezen akadályokról nyilatkozni kell (pl. csípőprotézis okozta műtermék esetén), még akkor is, ha a korlátozott megítélhetőség csak a prosztata egyes területeire vonatkozik.
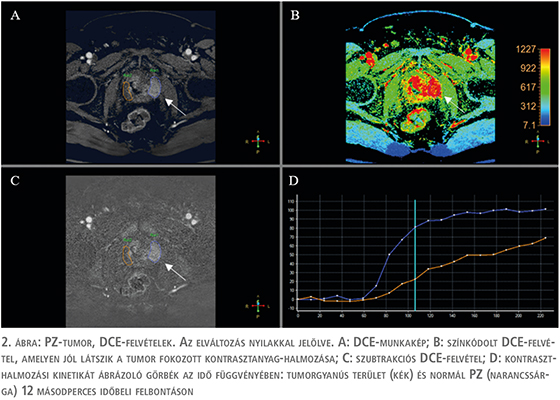
A PZ értékelésének harmadik eleme a DCE-sorozat (2. ábra), amely a prosztata állományán belüli kontraszthalmozás kinetikai különbségeit vizsgálja. A DCE-vizsgálat hozzáadott értéke jelenleg nem teljesen bizonyított, több publikáció is vitatja a prosztata mp-MR-vizsgálata során betöltött szerepét, jelentősége másodlagos a PI-RADS-értékelési kategóriába sorolás szempontjából, azonban a nemzetközi irányelvek továbbra is fontos biztonsági hálóként tekintenek rá (5) (3. táblázat).

A DCE-mérés pozitivitása esetén az értékelési rendszerben 3-as DWI-pontszámmal értékelt PZ-tumorok 4-es PI-RADS-kategóriába kerülnek fel.
A PZ tumorgyanús elváltozásainak mérésére axiális síkban az ADC-térkép a legalkalmasabb, ugyanis a T2W-felvételeken nyert átmérő gyakran alábecsüli a patológiai mintákban tapasztalt valódi kiterjedést (6, 7). A PZ PI-RADS szerinti értékelésére elsődlegesen a DCE-eredménnyel súlyozott DWI-pontszám választandó.
A tranzícionális zóna értékelése
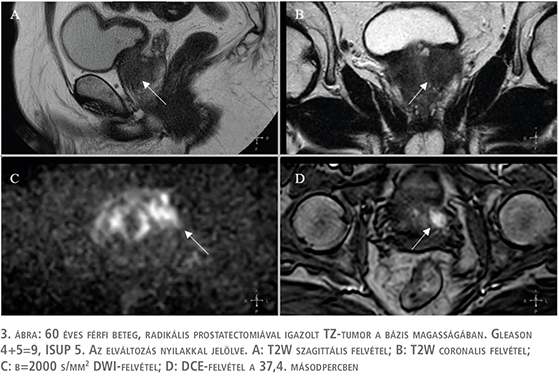
A TZ értékelése során választandó primer determináló szekvencia a T2W-mérés (3. ábra). Az elváltozás a morfológiája alapján T2W pontszámot kap (4. táblázat).

A TZ értékelésekor a domináns T2W-szekvencia eredményét a PZ értékelésénél tárgyalt DWI-pontszám módosíthatja. Az a lézió, amely a TZ vizsgálata során T2W-szekvencián 3 pontot kapott, de DWI-pontszáma 5, PI-RADS 4-es értékelési kategóriába kerül fel.
A TZ-ben detektálható homogén vagy heterogén jelintenzitású ovális, jól körülírt, kapszulált nodulusok gyakori elváltozásoknak számítanak 40 éves kor felett. Gyakran korlátozott diffúziós kapacitással jellemezhetők, esetleg korai fokális halmozási kinetikát mutatnak. A típusos BPH-s nodulust nem szükséges PI-RADS-értékelési kategóriába sorolni.
A TZ elváltozásainak metrikus rendszerben történő rögzítése T2W-szekvencián történik.
Komplex értékelés, szöveti invázió, nyirokcsomók, metasztázisok
A centrális zónára legtöbbször a TZ felől terjedhet tumor, primer vizsgálata így T2W-szekvencián ajánlott. Az anterior fibromuscularis stroma értékelésére – markáns hipointenz jellege miatt – magas b-értékű DWI-felvételeken van lehetőség. Primer tumorok ezekben a régiókban ritkák.
A PI-RADS szerint készült leleteken – ha több elváltozás egyszerre van jelen – meg kell határozni az ún. indexléziót. Amennyiben több elváltozás ugyanazon értékelési kategóriába tartozik, a legnagyobb méretű, legalább PI-RADS 3 kategóriába sorolt DCE-pozitív lézió jelölendő indexlézióként, kivéve, ha a kisebb elváltozás extraprosztatikus extenziót (EPE) mutat. Egy leleten legfeljebb négy elváltozás jelölhető PI-RADS-kategóriával, amennyiben ennél több lézió együttesen van jelen, csak a valószínűsített klinikailag szignifikáns tumorokról kell nyilatkozni.
Az extraprosztatikus terjedés kimutatására a T2W-felvételek a legalkalmasabbak. A tokáttörés során a prosztata kontúrja torzul, jellegzetesen kidomborodhat. A tumor szöveti inváziójának megítélésében kitüntetett szereppel bír a neurovaszkuláris kötegek aszimmetriájának, infiltrációjának vizsgálata, illetve a vesicula seminalisok inváziójának értékelése. Az ondóhólyag érintettséget T2W-szekvencián változatos morfológiájú alacsony jelmenet jellemzi, bizonyos esetekben a vesicula seminalisok és a prosztata bázisa által bezárt szög megtöretésével, a két szerv közötti vékony zsírréteg eltűnésével. EPE-re utalnak a következő tulajdonságok: a prosztata margójának spikulációi; a tumor a prosztata kapszulájához >10 mm hosszan hozzáfekszik; a direkt tumorextenziót egyértelműen bizonyító tokáttörés; a rektoprosztatikus tér beszűrtsége, valamint a hólyagfal infiltrációja.
Mp-MR-vizsgálattal a regionális nyirokcsomók kóros folyamatai szintén megítélhetők. Legalkalmasabb erre a T1W és T2W-SPAIR (zsírelnyomásos) mérés, azonban ezen vizsgálatok nem részei a PI-RADS-nak. Pontosan meghatározható az adott nyirokcsomó mérete, alakja és – DCE-sorozattal kiegészítve – halmozási kinetikája. Bár a metasztatikus nyirokcsomók nem minden esetben nagyobbodnak meg, általánosnak tekinthető szabály, hogy a rövid átmérőjében 8 mm-t meghaladó nyirokcsomó gyanúsnak tekinthető (1). Kiemelten fontos az obturator körüli, az arteria iliaca interna és externa körüli, periprosztatikus és arteria iliaca communis körüli nyirokcsomó régiók vizsgálata (8).
Habár a prosztata MR-vizsgálata során gyakorinak számítanak a különböző csontelváltozások, ezeknek csak kis része metasztázis, ugyanakkor a prosztatatumorok fokozott csontáttétképző tulajdonsága miatt a vizsgálati mezőbe eső csontképleteket minden esetben értékelni kell (9). A prosztatatumorokra jellemző osteoblastikus metasztázisok T1 és T2 jeladása egyaránt alacsony, a következményes szöveti ödéma okozta diffúziógátlás miatt magas DWI jelmenetet mutatnak.
MR-TRUS fúziós biopszia
A prosztata mp-MR-vizsgálata során készült felvételek MR-vezérelt mintavételre is felhasználhatók. Az eljárás első lépéseként az axiális T2W-mérés szeleteinek kontúrozása történik. Ennek során a radiológus kiválasztja a mintavétel szempontjából releváns axiális szeleteket, amelyen bejelöli mind a prosztata, mind a gyanús elváltozás kontúrjait. Ezt követően az elkészült kontúrozott axiális MR-kép koordinátarendszerét szinkronizáltatni kell az ultrahangkészülék saját koordinátarendszerével. Az eljárás során a brachiterápiás applikátorokéhoz hasonló négyzetrácsos koordinátarendszert alkalmaznak. A perineum lemosását és izolálását követően az urológus elhelyezi a TRUS-fejet a beteg rectumában, és rögzíti azt az ún. stepper foglalatában. A stepper biztosítja az axiális szeletek és az TRUS-fej szinkronizált léptetését, érzékelve az ultrahangfej bázis-apex irányú elmozdulását. A szoftver a biopsziás tű kilövését követően coronalis síkú ultrahangképre vált, amelyen jól ellenőrizhető a biopsziás tű kilövése nyomán keletkezett hiperechogén sáv. Az urológus mind a tumorgyanús területről, mind véletlenszerűen a jobb és bal lebenyből mintát vesz. A biopsziás minták száma nagyban függ a tumorgyanús terület méretétől. A következményes húgycsővérzés elkerülése érdekében – amennyiben ez lehetséges – a középvonali struktúrák mintavételét célszerű kerülni. Transperinealis biopszia esetén antibiotikum-profilaxis nem szükséges. Az eljárás természetesen speciális szoftvert és eszközöket igényel. MR-TRUS fúziós biopsziával lehetőség van többszöri sikertelen mintavételt követően célzott módon szövethengereket nyerni az adott elváltozásból; segítségével az alacsony stádiumú tumorok aktív surveillance rendszerű követése válik lehetővé.
Következtetések
Az elmúlt évek során a prosztatatumorok kitüntetett tudományos figyelmet kaptak az urológiai malignitásokon belül. A PI-RADS megjelenésével elérhetővé vált egy tisztán képalkotó alapú besorolási rendszer, amely figyelmen kívül hagy minden klinikai paramétert és következetes leletezési rendszert biztosít a prosztata elváltozásait értékelő radiológus számára. Az értékelés három meghatározott mérés figyelembevételével történik (T2W, DWI-ADC, DCE). A leletezéshez a prosztata zonális szerkezetének ismerete elengedhetetlen, hiszen a tumorgyanús terület különböző lokalizácóban történő elhelyezkedése eltérő értékelési rendszert von maga után. Az egyre fejlődő technikai feltételek lehetőséget biztosítanak többek között MR-vezérelt fúziós mintavétel végzésére, amelynek során kiválaszthatók azok az alacsony rizikócsoportba tartozó betegek, akik aktív követésre alkalmasak. Mivel az mp-MR-technika szenzitivitása a klinikailag szignifikáns tumorok esetében a legmagasabb, csökkenthető a feleslegesen végzett biopsziák száma. A PI-RADS leletezési rendszere megkönnyíti az interdiszciplináris kommunikációt a klinikai és a diagnosztikus területen dolgozó szakemberek között.
References
1. Turkbey B, Rosenkratz AB, Haider MA, et al. Prostate Imaging Reporting and Data System Version 2.1: 2019 Update of Prostate Imaging Reporting and Data System Version 2. Eur Urol 2019; 76(3): 340–351. https://doi.org/10.1016/j.eururo.2019.02.033
2. Bass EJ, Freeman A, Jameson C, et al. Prostate cancer diagnostic pathway: Is a one-stop cognitive MRI targeted biopsy service a realistic goal in everyday practice? A pilot cohort in a tertiary referral centre in the UK. BMJ Open 2018; 8(10): e024941. https://doi.org/10.1136/bmjopen-2018-024941
3. Padhani AR, Liu G, Koh DM, et al. Diffusion-weighted magnetic resonance imaging as a cancer biomarker: consensus and recommendations. Neoplasia 2009; 11(2): 102–25. https://doi.org/10.1593/neo.81328
4. Rosenkrantz AB, Parikh N, Kierans AS, et al. Prostate Cancer Detection Using Computed Very High b-value Diffusion-weighted Imaging: How High Should We Go? Acad Radiol 2016; 23(6): 704–11. https://doi.org/10.1016/j.acra.2016.02.003
5. Verma S, Turkbey B, Muradyan N, et al. Overview of dynamic contrast-enhanced MRI in prostate cancer diagnosis and management. AJR Am J Roentgenol 2012; 198(6): 1277–88. https://doi.org/10.2214/AJR.12.8510
6. Priester A, Natarajan S, Khoshnoodi P, et al. Magnetic Resonance Imaging Underestimation of Prostate Cancer Geometry: Use of Patient Specific Molds to Correlate Images with Whole Mount Pathology. J Urol 2017; 197(2): 320–326. https://doi.org/10.1016/j.juro.2016.07.084
7. Mazaheri Y, Hricak H, Fine SW, et al. Prostate tumor volume measurement with combined T2-weighted imaging and diffusion-weighted MR: correlation with pathologic tumor volume. Radiology 2009; 252(2): 449–57. https://doi.org/10.1148/radiol.2523081423
8. Tokuda Y, Carlino LJ, Gopalan A, et al. Prostate cancer topography and patterns of lymph node metastasis. Am J Surg Pathol 2010; 34(12): 1862–7. https://doi.org/10.1097/PAS.0b013e3181fc679e
9. Vargas HA, Schor-Bardach R, Long N, et al. Prostate cancer bone metastases on staging prostate MRI: prevalence and clinical features associated with their diagnosis. Abdom Radiol (NY) 2017; 42(1): 271–277. https://doi.org/10.1007/s00261-016-0851-3