Efficacy of neoadjuvant hormonal treatment before radical prostatectomy for high-risk clinically localised prostate carcinomas
DOI: 10.22591/magyurol.2020.2.berczics.53
Authors:
Berczi Csaba dr., Dócs János dr., Flaskó Tibor dr.
Debreceni Egyetem Általános Orvostudományi Kar, Urológiai Tanszék, Debrecen (igazgató: Flaskó Tibor dr.)
Summary
Aims: To measure the efficacy of neoadjuvant hormonal therapy before multimodal treatment of patients with clinically localized high-risk prostate carcinomas.
Methods: From January 1996 to January 2019, 394 patients underwent radical prostatectomy for clinically localized high-risk prostate cancer. In Group 1 the patients neoadjuvant hormonal treatment (n: 98) was administered, while in Group 2 the patients didn’t receive any neoadjuvant hormonal treatment (n: 296). In Group 1, the mean age of the patients was 64.6 ± 6.1 years and the mean PSA level was 32.9 ng/mL. In Group 2, the mean age of the patients was 63.8 ± 6.4 years, and the mean PSA concentration was 25.4 ng/mL. In all cases the preoperative imaging examinations showed clinically localized prostate tumor.
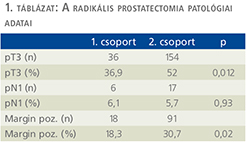
Results: Histology revealed locally advanced tumor (pT3) in 36 cases (36.9%) in Group 1, and in 154 patients (52.0%) in Group 2 (p = 0.012). Margin positivity was detected in 18 patients (18.3%) in Group 1, while it was proved in 91 cases (30.7%) in Group 2 (p = 0.02).
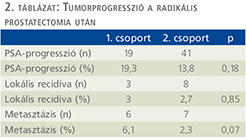
The median follow-up period was 56 months. In Group 1, biochemical progression developed in 19 patients (19.3%). Local recurrence and distant metastasis were diagnosed in 3 cases (3.0%) and in 6 occasions (6.1%) during this period. In Group 2, biochemical progression was diagnosed in 41 cases (13.8%), local recurrence in 8 patients (2.7%) and distant metastasis in 7 occasions (2.3%). There was no significant difference regarding to these parameters in the two groups. Tumor specific mortality was 3.0% in both groups (p = 0.991).
Conclusions: The results showed that the neoadjuvant hormonal therapy provided significantly better local tumor control in clinically localized high-risk prostate carcinomas. However, the neoadjuvant hormonal therapy didn’t prove any advantage according to tumor progression and tumor specific survival.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Célkitűzés: A neoadjuváns hormonkezelés hatékonyságának vizsgálata a klinikailag szervre lokalizált magas rizikójú prosztatatumorok esetében végzett multimodális kezelés során intézetükben.
Módszer: A tanulmányban az 1996.01.01 és 2019.01.01. között a klinikailag szervre lokalizált magas rizikójú prosztatadaganat miatt radikális prostatectomián átesett 394 beteg adatai kerültek feldolgozásra. Az 1. csoportba (n: 98) tartozó betegek a műtét előtt neoadjuváns hormonkezelést kaptak. A 2. csoportba sorolt betegek (n: 296) nem részesültek hormonkezelésben az operáció előtt. Az 1. csoportban az átlagos életkor 64,6 ± 6,1 év, míg az átlagos PSA-szint 32,9 ± 27,1 ng/ml. A 2. csoportban az átlagos életkor 63,8 ± 6,4 év, míg az átlagos PSA-szint 25,4 ± 19,6 ng/ml volt. Valamennyi esetben képalkotó vizsgálat történt, amely egyik esetben sem vetette fel lokálisan előrehaladott tumor gyanúját.
Eredmények: A szövettani vizsgálat 1. csoportban, 36 esetben (36,9%), míg a 2. csoportban 154 alkalommal (52,0%) igazolt lokálisan előrehaladott (pT3) daganatot (p = 0,012). Marginpozitivitás az 1. csoportban, 18 esetben (18,3%), míg a 2. csoportban, 91 betegben (30,7%) fordult elő (p = 0,02).
A medián 56 hónapos utánkövetés alatt az 1. csoportban biokémiai progressziót 19 (19,3%), lokális recidívát 3 (3,0%), míg távoli metasztázist 6 (6,1%) betegben diagnosztizáltak.
A 2. csoportban biokémiai progresszió 41 (13,8%), lokális recidíva 8 (2,7%), míg távoli metasztázis 7 (2,3%) esetben fordult elő. Ezen vizsgált mutatókban a két csoport között nem volt szignifikáns eltérés. A tumorspecifikus mortalitás mindkét csoportban 3% volt (p = 0,991).
Következtetések: Az eredmények alapján a magas rizikójú prosztatadaganatok esetében a neoadjuváns hormonkezelés szignifikánsan jobb lokális tumorkontrollt biztosított. A későbbi tumorprogresszió és tumorspecifikus túlélés szempontjából a neoadjuváns hormonkezelés nem nyújtott lényeges előnyt. A neoadjuváns hormonkezelést követően nem csökkent szignifikánsan az adjuváns és salvage kezelések száma sem.
Bevezetés
A D’Amico-beosztás szerint azokat a daganatokat, amelyeknél a PSA ≥20 ng/ml, vagy a Gleason-score ≥8 vagy a tumor cT3-stádiumú, magas rizikójú prosztatadaganatoknak nevezzük (1). Az a kérdés, hogy ezen prosztatatumoroknál mi az optimális kezelés, a radikális prostatectomia vagy a sugárkezelés, még nem egyértelmű. A magas rizikójú prosztatadaganatokban végzett radikális prostatectomiákat követően biokémia progresszió az esetek 55-70%-ában alakul ki. Esetükben távoli metasztázis 13%-ban míg tumor okozta mortalitás 6%-ban fordul elő (2–4).
A sugárkezelés viszonylatában már több randomizált klinikai vizsgálat igazolta, hogy a sugárkezelés mellett adott androgéndeprivációs hormonkezelés javítja a terápia onkológiai eredményességet (5–9). A magas rizikójú prosztatadaganatok miatt végzett radikális prostatectomia vonatkozásában viszont, az Európai Urológus Társaság módszertani levele alapján, a műtét előtt a neoadjuváns androgéndeprivációs hormonkezelés alkalmazása nem javasolt. Ugyanakkor nem hagyható figyelmen kívül, hogy sok klinikai tanulmány eredménye azt mutatta, hogy a neoadjuváns kezelések javítják a lokális tumorkontrollt. Több vizsgálat során a magas rizikójú daganatoknál a radikális prostatectomia előtt adott androgéndeprivációs hormonkezelés (ADT), ADT + kemoterápia vagy ADT + abirateron-acetát-kezelés mellett javult a tumor patológia stádiuma és a biokémiai progressziómentes túlélés (10–13).
Jelen tanulmányunkban vizsgáltuk a klinikailag szervre lokalizált, magas rizikójú prosztatadaganatos betegekben végzett radikális prostatectomiák előtt adott neoadjuváns androgéndeprivációs hormonkezelés eredményességet.
Módszerek
A DE Urológiai Klinikáján 1996.01.01. és 2019.01.01. között 394 betegben végeztünk radikális prostatectomiát klinikailag szervre lokalizált magas rizikójú prosztatadaganat miatt. A prosztatadaganatok magas rizikócsoportba való besorolása az Európai Urológus Társaság (EAU) erre vonatkozó beosztása szerinti történt (PSA >20 ng/ml vagy Glesaon-score >7 vagy cT ≥2c).
A prosztatabiopsziák szövettani vizsgálata során a 2014-es Gleason-rendszert alkalmaztuk retrospektíve.
A magas rizikójú daganatos betegekben valamennyi esetben képalkotó vizsgálatot végeztünk a tumor helyi kiterjedtségének meghatározása céljából. Korábban CT, majd a későbbiekben, amikor már volt lehetőségünk MRI-vizsgálatok elvégzésére, MRI-vizsgálatokat végeztünk. Az eltelt időtartam alatt különböző típusú és érzékenységű CT- és MRI-készüléket használtunk klinikánkon. Sok alkalommal azonban a beteg más kórházból hozta magával a CT vagy MRI eredményét. A klinikánkon végzett MRI-vizsgálatok 2015.09.01-ig 1 Teslás érzékenységű készülékkel, míg azt követően 3 Teslás készülékkel végezték. Az endorectalis MR-vizsgálatok 1 Teslás készülékkel történtek.
A klinikailag szervre lokalizált magas rizikójú tumoros betegeket két csoportba soroltuk.
Az 1. csoportba (n: 98) tartozó betegek a műtét előtt neoadjuváns androgéndeprivációs hormonkezelést kaptak. A 2. csoportba sorolt betegek (n: 296) nem részesültek hormonkezelésben az operáció előtt. Az 1. csoportban az átlagos életkor 64,6 ± 6,1 év, míg az átlagos PSA-szint 32,9 ± 27,1 ng/ml. A 2. csoportban az átlagos életkor 63,8 ± 6,4 év, míg az átlagos PSA-szint 25,4 ± 19,6 ng/ml volt. A neoadjuváns hormonkezelés időtartama 3 és 6 hónap között változott.
Valamennyi betegben a műtét előtt végzett képalkotó vizsgálat szervre lokalizált tumort véleményezett. Így a CT-vizsgálat 201 betegben, a kismedencei MRI 150 esetben, míg az endorectalis MRI 25 alkalommal mutatott cT2-stádiumú daganatot. Valamennyi betegben történt csontizotóp-vizsgálat, amely negatív volt. Az elvégzett képalkotó vizsgálatok távoli áttétet egyik betegben sem igazoltak.
A radikális prostatectomiát az 1. csoportban, 56 esetben laparoszkópos és 42 betegben nyílt műtéti feltárással végeztük. A 2. csoportban a beavatkozás 195 alkalommal laparoszkópos míg 101 esetben nyílt műtéti feltárással történt.
Az eltávolított prosztata patológiai stádiumának meghatározása a 2009. UICC TNM-rendszer szerint történt retrospektíve.
A műtétet követően az aktuális kezelési protokoll szerint obszervációt, adjuváns irradiációt, salvage irradiációt és hormonkezelést alkalmaztunk.
A betegek utánkövetése során PSA-vizsgálat az első 3 évben 3 havonta, azt követően 5 évig 6 havonta, majd ezután évente történt. Képalkotó vizsgálatot (CT-, MR-, csontizotóp-vizsgálat) PSA-emelkedés vagy a beteg panaszai miatt végeztünk. A biokémiai progressziót úgy definiáltuk, hogy olyan PSA-emelkedés, amely 0,2 ng/ml fölé történt (legalább 2 alkalommal).
Az átlagadatok mellett ± standard deviációt adtuk meg. A statisztikai analízist Student-féle t-próbával végeztük. A 0,05-nél kisebb p-értékeket tekintettük szignifikánsnak.
Eredmények
Az 1. csoportban a szövettani vizsgálat 36 esetben (32,7%) igazolt lokálisan előrehaladott (pT3) daganatot és 18 betegben (18,3%) marginpozitivitást mutatott (1. táblázat). A 2. csoportban pT3-stádiumú tumort 154 alkalommal (52%), míg a sebészi szél tumoros beszűrtségét 91 betegben (30,7%) észlelte a patológiai vizsgálat. A lokálisan előrehaladott prosztatakarcinóma és a marginpozitivitás szignifikánsan gyakrabban fordult elő a neoadjuváns hormonkezlést nem kapott csoportban (0,012 és 0,02). A nyirokcsomó-pozitivitás hasonló mértékben volt jelen mindkét csoportban (p = 0,93) (1. táblázat).
A betegek átlagos utánkövetése 56 hónap volt (7 és 234 hónap között változott).
Az átlagosan csaknem 5 éves utánkövetési idő alatt az 1. csoportban biokémiai progressziót 19 (19,3%), lokális recidívát 3 (3%), míg távoli metasztázist 6 (6,1%) betegben diagnosztizáltunk (2. táblázat). A 2. csoportban biokémiai progresszió 41 (13,8%), lokális recidíva 8 (2,7%), míg távoli metasztázis 7 (2,3%) esetben fordult elő. Ezen vizsgált mutatókban a két csoport között nem volt szignifikáns eltérés (2. táblázat).
A betegek utánkövetése alatt tumorspecifikus mortalitás mindkét csoportban 3% volt (p = 0,991).
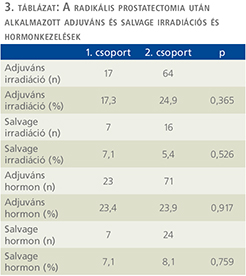
A magas rizikójú prosztatadaganatos betegek esetében az aktuális protokollnak megfelelően a betegcompliance és preferencia figyelembevételével obszervációt, adjuváns irradiációt salvage irradiációt és hormonkezelést alkalmaztunk (3. táblázat). Az 1. csoportban adjuváns és salvage sugárkezelés az esetek 17,3% és 7,1%-ában, míg a 2. csoportban a betegek 21,6% és 5,4%-ában történt (p = 0,365 és p = 0,526). A radikális prostatectomia után adjuváns és salvage hormonkezelést az 1. csoportban az esetek 23,4% és 7,1%-ában, míg a 2. csoportban a betegek 23,9% és 8,9%-ában alkalmaztunk (p = 0,917 és p = 0,759).
Megbeszélés
A férfiakban a leggyakrabban előforduló malignus betegség a prosztatatumor, amelynek 30%-a magas rizikójú daganat. Jelenleg a magas rizikójú prosztatadaganatok optimális kezelésének vonatkozásában a vélemények eltérők (14–17).
A tervezett operáció előtt alkalmazott neoadjuváns kezeléseknek alapvetően két célja van. Az egyik a lokális tumorkontroll biztosítása, míg a másik, a mikroszkópos metasztázisok szisztémás kontrollja. A lokális tumorkontroll javítása réven az eredetileg lokálisan előrehaladott daganat operálhatóvá válhat, és javul az épben eltávolítható daganatok aránya. Általában ha a neoadjuváns kezelésre lokálisan jól reagál a daganat, akkor az jól korrelál a hosszú távú onkológiai eredményességgel, így a tumormentes és a tumorspecifikus túléléssel. A neoadjuváns kezelés már több tumor vonatkozásában – emlő-, vastagbél-, nyelőcső-, hólyagdaganat – egyértelmű előnyöket mutatott (13).
A magas rizikójú prosztatatumorok esetében a radikális prostatectomia előtt alkalmazott neoadjuváns kezelés szintén előnyt nyújthat a jobb tumorkontroll biztosításában, a lokális vagy a lokálisan előrehaladott daganatok „downstagingjében”, a mikroszkopikus metasztázisok eradikálásában. Több tanulmány igazolta, hogy a neoadjuváns ADT-kezelés után végzett műtéteknél javul a marginpozitivitás aránya és jobb a tumor patológiai stádiuma. Azonban az ezzel kapcsolatban végzett klinikai vizsgálatok általában azt mutatták, hogy a biokémiai progresszióig eltelt idő és az általános túlélés nem javult (13, 18).
Saját vizsgálatunk során azt tapasztaltuk, hogy a neoadjuváns hormonkezelést kapott betegcsoportban a daganat patológiai stádiuma és a marginpozitivitás gyakorisága szignifikánsan jobb volt a kontrollcsoporthoz viszonyítva. Így elmondhatjuk, annak ellenére, hogy a lokális tumorkontroll biztosítása egyértelműen eredményesebbnek bizonyult, a biokémia progresszióig eltelt idő és a túlélés vonatkozásában nem volt szignifikáns különbség a két csoport között.
Tekintettel arra, hogy az eddigi vizsgálatok túlnyomó többsége azt mutatta, hogy a radikális prostatectomia előtt alkalmazott neoadjuváns androgéndeprivációs hormonkezelés nem nyújtott érdemi javulást a hosszú távú onkológiai kimenetel szempontjából, más készítményekkel történő neoadjuváns terápia került az érdeklődés előterébe. Neoadjuváns kezelésként LHRH-agonista és esztramusztin-foszfát alkalmazása mellett a patológiai stádium javulása mellett csökkent a biokémiai progresszió rizikója (11, 12). A CALGB 90203-vizsgálatban a neoadjuváns docetaxel +/- ADT-kezelés egyértelmű előnyét mutatták ki a túlélés vonatkozásában (19). Silbertstein és munkatársai paclitaxel + carboplatin + ADT-vel végzett neoadjuváns kemo-hormonális kezelés során a biokémiai progresszió előfordulásának csökkenését, valamint a metasztázismentes túlélés növekedését igazolták (20). Jelenleg több készítménnyel folynak klinikai vizsgálatok (tirozin-kináz-inhibitorok, mTOR-inhibitorok, PARP-inhibitorok, anti CTLA4-antitest) radikális prostatectomia előtti neoadjuváns kezelés céljából (19).
A prosztataműtét előtti neoadjuváns hormonkezelés hatékonysága szempontjából érdemes figyelembe venni, hogy ez mennyiben befolyásolja a későbbiekben alkalmazandó további terápia szükségességét. A radikális prostatectomia után esetlegesen végzendő adjuváns és salvage sugárkezelések és hormonterápia nemcsak a betegek daganatmentes túlélése szempontjából, hanem életminősége szempontjából is fontos. Saját vizsgálatunkban az adjuváns és salvage kezelések gyakorisága között nem volt szignifikáns különbség a két csoport között. Ugyanakkor az eredmények alapján látható, hogy az adjuváns sugárterápia kevesebbszer fordult elő a neoadjuváns hormonkezelést kapott csoportban, holott a preoperatív PSA-érték itt szignifikánsan magasabb volt.
Következtetések
Összefoglalva, a szervre lokalizált magas rizikójú prosztatadaganatok esetében a radikális prostatectomia előtt alkalmazott androgéndeprivációs terápia a lokális tumorkontroll szempontjából szignifikáns előnyt nyújt. Ugyanakkor a biokémiai progresszió, valamint a tumormentes túlélés szempontjából a neoadjuváns ADT-kezelés nem bizonyult eredményesebbnek.
References
1. D’Amico AV, Whittington R, Malkowicz SB, et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998; 280(11): 969–74. https://doi.org/10.1001/jama.280.11.969
2. Loeb S, Schaeffer EM, Trock BJ, Epstein JI, Humphreys EB, Walsh PC. What are the outcomes of radical prostatectomy for high-risk prostate cancer? Urology 2010 Sep; 76(3): 710–4. https://doi.org/10.1016/j.urology.2009.09.014
3. Yossepowitch O, Eggener SE, Serio AM, Carver BS, Bianco FJ Jr, Scardino PT, Eastham JA Secondary therapy, metastatic progression, and cancer-specific mortality in men with clinically high-risk prostate cancer treated with radical prostatectomy. Eur Urol 2008; 53(5): 950–9. https://doi.org/10.1016/j.eururo.2007.10.008
4. Yuh B, Artibani W, Heidenreich A, Kimm S, Menon M, Novara G, Tewari A, Touijer K, Wilson T, Zorn KC, Eggener SE. The role of robot-assisted radical prostatectomy and pelvic lymph node dissection in the management of high-risk prostate cancer: a systematic review. Eur Urol 2014; 65(5): 918–27. https://doi.org/10.1016/j.eururo.2013.05.026
5. Bolla M, de Reijke TM, Van Tienhoven G, et al. Duration of androgen suppression in the treatment of prostate cancer. N Engl J Med 2009; 360(24): 2516–27. https://doi.org/10.1056/NEJMoa0810095
6. Denham JW, Steigler A, Lamb DS, et al. Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 2011; 12(5): 451–9. https://doi.org/10.1016/S1470-2045(11)70063-8
7. Horwitz EM, Bae K, Hanks GE, et al. Ten-year follow-up of radiation therapy oncology group protocol 92-02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J Clin Oncol 2008; 26(15): 2497–504. https://doi.org/10.1200/JCO.2007.14.9021
8. Nguyen PL. Optimization of the Radiation Management of High-Risk Prostate Cancer. Semin Radiat Oncol 2017; 27(1): 43–49. https://doi.org/10.1016/j.semradonc.2016.08.009
9. Zapatero A, Guerrero A, Maldonado X, et al. High-dose radiotherapy with short-term or long-term androgen deprivation in localised prostate cancer (DART01/05 GICOR): a randomised, controlled, phase 3 trial. Lancet Oncol 2015; 16(3): 320–7. https://doi.org/10.1016/S1470-2045(15)70045-8
10. Cha EK, Eastham JA. Chemotherapy and novel therapeutics before radical prostatectomy for high-risk clinically localized prostate cancer. Urol Oncol 2015; 33(5): 217–25. https://doi.org/10.1016/j.urolonc.2014.11.020
11. Fujita N, Koie T, Ohyama C, Tanaka Y, Soma O, Matsumoto T, Yamamoto H, Imai A, Tobisawa Y, Yoneyama T, Hatakeyama S, Hashimoto Y. Overall survival of high-risk prostate cancer patients who received neoadjuvant chemohormonal therapy followed by radical prostatectomy at a single institution. Int J Clin Oncol 2017; 22(6): 1087–1093. https://doi.org/10.1007/s10147-017-1160-8
12. Hagiwara K, Koie T, Ohyama C, Yamamoto H, Imai A, Hatakeyama S, Yoneyama T, Hashimoto Y, Tobisawa Y, Yoneyama T. Efficacy of a neoadjuvant gonadotropin-releasing hormone antagonist plus low-dose estramustine phosphate in high-risk prostate cancer: a single-center study. Int Urol Nephrol 2017; 49(5): 811–816. https://doi.org/10.1007/s11255-017-1546-6
13. McKay RR, Choueiri TK, Taplin ME. Rationale for and review of neoadjuvant therapy prior to radical prostatectomy for patients with high-risk prostate cancer. Drugs 2013; 73(13): 1417–30. https://doi.org/10.1007/s40265-013-0107-2
14. Baker CB, McDonald AM, Yang ES, et al. Pelvic Radiotherapy versus Radical Prostatectomy with Limited Lymph Node Sampling for High-Grade Prostate Adenocarcinoma. Prostate Cancer 2016; 2016: 2674954. https://doi.org/10.1155/2016/2674954
15. Berczi Cs, Kiss Z, Flasko T. A radikális prostatectomia előtt alkalmazott neoadjuváns hormonkezelés hatékonysága lokálisan előrehaladott magas rizikójú prosztatadaganatoknál. Magyar Urológia 2019; 31: 3–7.
16. Kishan AU, Shaikh T, Wang PC, et al. Clinical Outcomes for Patients with Gleason Score 9-10 Prostate Adenocarcinoma Treated With Radiotherapy or Radical Prostatectomy: A Multi-institutional Comparative Analysis. Eur Urol 2017; 71(5): 766–773. https://doi.org/10.1016/j.eururo.2016.06.046
17. Matulay JT, DeCastro GJ. Radical Prostatectomy for High-risk Localized or Node-Positive Prostate Cancer: Removing the Primary. Curr Urol Rep 2017; 18(7): 53. https://doi.org/10.1007/s11934-017-0703-x
18. Gandaglia G, Sun M, Trinh QD, Becker A, Schiffmann J, Hu JC, Briganti A, Montorsi F, Perrotte P, Karakiewicz PI, Abdollah F. Survival benefit of definitive therapy in patients with clinically advanced prostate cancer: estimations of the number needed to treat based on competing-risks analysis. BJU Int 2014; 114(6b): E62–E69. https://doi.org/10.1111/bju.12645
19. Pietzak EJ, Eastham JA. Neoadjuvant Treatment of High-Risk, Clinically Localized Prostate Cancer Prior to Radical Prostatectomy. Curr Urol Rep 2016; 17(5): 37. https://doi.org/10.1007/s11934-016-0592-4
20. Silberstein JL, Poon SA, Sjoberg DD, Maschino AC, Vickers AJ, Bernie A, Konety BR, Kelly WK, Eastham JA. Long-term oncological outcomes of a phase II trial of neoadjuvant chemohormonal therapy followed by radical prostatectomy for patients with clinically localised, high-risk prostate cancer. BJU Int 2015; 116(1): 50–6. https://doi.org/10.1111/bju.12676