Summary of the available and theoretical methods of male contraception
DOI: 10.22591/magyurol.2020.4.balloa.141
Author:
Balló András dr.
Pécsi Tudományegyetem KK, Urológiai Klinika,Pécs (igazgató: Szántó Árpád dr.)
Summary
Despite of available female contraceptive methods, unwanted pregnancy rate is still high, nearly 50%. The half of the men want to participate equally with their partner in family planning, but male contraceptive methods are used only 14% of those worldwide. There are not available pharmaceutical preparations. Currently two methods are available one of this is condom, which despite of the protection against sexually transmitted diseases has high failure rate, while the other option is vasectomy which is very effective but its reversibility is poor. Among the pharmaceutical preparations of contraception, men’s hormonal contraceptives are the closest to commercialization. Their effect based on the disruption of spermatogenesis, as exogenous androgen administration causes the hypothalamic-pituitary gonadal axis to be suppressed. The androgens such as monotherapy or in combination with progestin have been tested in clinical trials – achieving the efficacy of the female oral contraceptive pills – but due to their different individual efficacy and side effects, their usage has not spread. Non-hormonal contraceptive methods may be more specific, and their mechanism of action is based on selective inhibition of spermatogenesis, sperm transport, or fertilizing ability. Only a few of them have been tested in clinical trials most are still in preclinical development or have been abandoned due to its toxicity. Consequently, in the absence of reliable, safe and practical male contraception, women will continue to bear the most of the contraception burden.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 4. SZÁM
Összefoglalás
A rendelkezésre álló női fogamzásgátló módszerek ellenére a nem kívánt terhességek aránya még mindig magas, megközelítőleg 50%. A férfiaknak több mint a fele szeretne partnerével egyenlő mértékben részt venni a családtervezésben azonban a férfi fogamzásgátló módszereket világszerte csak 14%-ban alkalmazzák és jelenleg nincs elérhető gyógyszerkészítmény a piacon. Két módszer alkalmazható. Az egyik az óvszer, amely annak ellenére, hogy a szexuális úton terjedő betegségek elleni védelemben hatékonynak bizonyult, de a fogamzásgátlás tekintetében magas hibaaránnyal rendelkezik, míg a másik lehetőség a vasectomia, amely nagyon hatékony, de a reverzibilitása alacsony. A gyógyszeres megoldások közül a férfi hormonális fogamzásgátlók állnak legközelebb a forgalomba kerüléshez. Hatásuk a spermatogenezis gátlásán alapul, mivel az exogén androgénbevitel a hypothalamus-hypophysis-gonád tengely szuppresszióját idézi elő. Az androgénekkel monoterápiában vagy progeszteronnal kombinálva történtek klinikai vizsgálatok – amelyek elérték a női orális fogamzásgátló tabletta hatékonyságát – de az eltérő egyéni hatékonyság, valamint a mellékhatások miatt egyelőre alkalmazásuk nem terjedt el. A nem hormonális fogamzásgátló módszerek specifikusabbak lehetnek, hatásmechanizmusuk a spermatogenezis, a spermiumtranszport, esetleg a spermiumok megtermékenyítő képességének szelektív gátlásán alapul. Klinikai vizsgálatok csak néhány esetben történtek, a legtöbbjük még mindig a preklinikai fejlesztés szakaszában van, vagy már a toxicitás miatt elvetették használati lehetőségét. Következésképpen megbízható, biztonságos és praktikus férfi fogamzásgátlás hiányában továbbra is a nők viselik a fogamzásgátlás terheit.
Bevezetés
Az Egészségügyi Világszervezet (WHO) adatai szerint a világban 122 millió kívánt terhesség mellett évente 87 millió nem kívánt terhesség alakul ki, amelyből 46 millió végződik művi megszakítással. Meglepő, de a nem kívánt terhességek felében alkalmaznak valamilyen fogamzásgátló módszert. A nők 11 különböző fogamzásgátló módszer közül választhatnak, míg a férfiak számára alapvetően csak két módszer elérhető: az óvszerhasználat és vasectomia. A férfi fogamzásgátló módszerek alkalmazása világszerte körülbelül 14%-ot ér el. Bár a női fogamzásgátló módszerek nagyon hatékonyak, bizonyos esetekben használatuk ellenjavallt vagy mellékhatásaik miatt alkalmazásukat fel kell függeszteni. A gyógyszeripar a kedvező fogadtatás ellenére csökkentette a férfi fogamzásgátlás terén folytatott kutatásokat. Az egyetlen II. fázist elérő klinikai vizsgálatot is elvetették annak ígéretes eredményei ellenére.Férfi fogamzásgátló módszerekA férfi fogamzásgátló módszereket hatásmechanizmusuk alapján három fő kategóriába sorolhatjuk:
1. A spermiumoknak a női reproduktív rendszerhez való eljutásának gátlása révén ható módszerek.
2. A spermatogenezis gátlása révén ható módszerek.
3. A hímivarsejtek érését vagy a megtermékenyítő képességét gátló módszerek.
Mindkét jelenleg alkalmazható férfi fogamzásgátló módszer (óvszer és vasectomia) az első kategóriába tartoznak, amely korántsem teljesíti az ideálisnak mondható fogamzásgátlás minden kritériumát (1. ábra).
Óvszer
Az óvszer a fogamzásgátlás legrégebbi módszere, 2004-től az Egészségügyi Világszervezet (WHO) szabályozta az óvszergyártás előírásait. Az óvszer legfontosabb előnye a szexuális úton terjedő betegségek elleni védelem, fő hátránya pedig a magas hibaszázalék, ami a használat első évében elérheti a 19%-ot.
Vasectomia
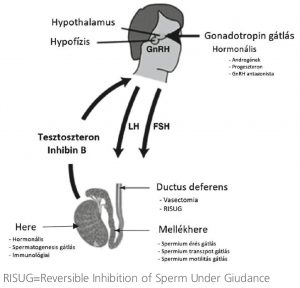
1. ábra: A férfi fogamzásgátlás különböző célpontjai
A vasectomia mindkét oldali ductus deferens disszekcióját és lekötését jelenti, amely a folytonosság megszakításához vezet. Egy nagy hatékonyságú (99%) minimálinvazív, helyi érzéstelenítésben elvégezhető egyszerű sebészi megoldás. Eredményességéről azonban legalább 3 hónappal a műtét után meg kell győződni. A fő hátránya, hogy kevés esély van a visszaállításra, amelyről a pácienst előzetesen részletesen tájékoztatni kell. A modern mikrosebészeti anasztomózis-technikákkal a helyreállítás elérheti a 90%-ot, azonban a terhességi ráta csak kb. 50%, amely a ductus deferens másodlagos elzáródásával, illetve a spermiumellenes antitestek megjelenésével (70%) magyarázható. Termékenységi szempontból meghatározó tényező a vasectomia után eltelt idő, a siker két év után jelentősen csökken, 10 év elteltével pedig megszűnik. A rövid távú szövődmények közé tartozik a vérzés és a vérömleny kialakulása, sebfertőzés és a mellékhere-gyulladás. A szövődményráta 1-6%. A legfontosabb hosszú távú szövődmény az eljárás eredménytelensége a ductus deferens rekanalizációja következtében (0-3%). A ductus deferens lekötésének velejárója lehet a mellékherében keletkező nyomásemelkedés, amelynek következtében fájdalom jelentkezhet. Esetenként a mellékhere-csatornákból spermiumszivárgás történhet, amely granuloma, illetve spermiumellenes antitestek kialakulásához vezethet.
Hormonális fogamzásgátlás
A férfihormonok fiziológiája
A hypothalamusból pulzatilisen felszabaduló gonadotropin-releasing hormon (GnRH) serkenti a luteinizáló hormon (LH) és a folliculusstimuláló hormon (FSH) agyalapi mirigyből történő felszabadulását, ami stimulálja a Leydig-sejteket, hogy tesztoszteront termeljenek és a Sertoli-sejteket a spermatogenezis elősegítésére. Ezzel szemben az exogén tesztoszteron adagolása elnyomja a hypothalamus-hipofízis-gonád tengelyt, ezáltal gátolja az endogén tesztoszterontermelést és a spermatogenezist. Ezek a hatások teljesen reverzibilisek a külső hormonbevitel megszüntetését követően. Mivel az emberi spermatogenezis ciklus kb. 72 nap, ezért 2-3 hónappal a kezelés megkezdése után érik el teljes fogamzásgátló hatásukat. Cél a spermiumkoncentráció olyan drasztikus csökkenése, amely a spontán megtermékenyítést nem teszi lehetővé. Az ideális az azoospermia elérése lenne, de a női fogamzásgátló tablettáknál is alacsonyabb terhességi rátát lehet elérni 1 M/ml spermiumkoncentráció mellett, ezért ez már elfogadhatónak tekinthető.
Androgén-monoterápia
Az exogén tesztoszteron hormonális fogamzásgátlóként való bevezetésére az 1990-es években a WHO több klinikai vizsgálatot finanszírozott.
Tesztoszteron-enathattal (TE) 271 ázsiai és kaukázusi férfi bevonásával végzett multicentrikus tanulmány, amely során 200 mg TE-t adtak be hetente 6 hónapon keresztül, a férfiak 70%-ában sikerült azoospermiát elérni. Az azoospermiás férfiak egy évig történő nyomonkövetése során 1 esetben alakult ki terhesség.
Egy másik tanulmány 357 pár bevonásával szintén hetente 200 mg TE-t beadásával hasonló eredményt hozott.
A hatékonyság tekintetében az azoospermia mellett a súlyos oligozoospermia ( Az első III. fázisú vizsgálatban 305 kínai férfi vett részt. 500 mg tesztoszteron-undekanoátot kaptak havonta és így 296 esetben (97%) tapasztaltak súlyos oligozoospermiát ( Alternatív tesztoszteronkészítmény a tesztoszteron-buciklát, amelynek előnye hosszú hatástartama. Felezési ideje 29,5 nap, ebből adódik, hogy egyszeri adagja hasonló hatást fejt ki a spermatogenezisre, mint más készítmények heti adagolásban. A szubkután implantátum formában bevitt tesztoszteron állandó hormonszintet biztosít, így az injekciós készítményekkel szemben elkerülhető a hirtelen dózisnövekedés és a következményes spermatogenezis-fokozódás („spermium rebound”). A készítmény egyetlen hátránya az implantátum kilökődése lehet, ami 3-7%-ban fordulhat elő.
Az orális tesztoszteronkészítmények nem bizonyultak megfelelőnek a férfi fogamzásgátlásra, nem biztosítottak állandó szérumtesztoszteron-szintet és nem bizonyultak elegendőnek a gonadotropinok szekréciójának gátlásához.
A transzdermális beadási mód sem váltotta be a hozzá fűzött reményeket sem, monoterápiában, sem progeszteronnal kombinálva.
Szupernormális tesztoszteronszint szükséges a spermatogenezis gátlásához, ami fokozott kockázattal járhat a kardiovaszkuláris rendszerre és a prosztatára nézve. Az androgének exogén alkalmazása korrelál a súlygyarapodással, ami elsősorban a zsírmentes testtömegre vonatkozik és a HDL-koleszterin csökkenésével jár. Ugyanakkor párhuzamosan a teljes és az LDL-koleszterin-szint csökkenésével is jár, ami csökkenti a kardiovaszkuláris kockázatot. A prosztatadaganat kialakulásában a magas tesztoszteronszint szerepe nem bizonyított. A meglévő klinikai vizsgálatokban általában fiatalok szerepelnek és az utánkövetési idő is túl rövid, hogy megbízható következtetéseket lehessen levonni. Javasolt csökkenteni a beadott androgének mennyiségét a fogamzásgátlás eléréséhez minimális adagra. Kevésbé súlyos mellékhatás az akne megjelenése a bőrön, még a szexuális funkció úgy tűnik enyhén javul az androgénadagolás hatására. Az androgének fogamzásgátló hatásának reverzibilitását vizsgáló tanulmányok szerint a spermatogenezis összesen 1549 férfinál átlagosan 3-4 hónap alatt helyreállt. Az adagolás hosszabb időtartama és a tartós hatású készítmények a helyreállási időt megnyújthatják.
Androgén-GnRH kombinációk
A GnRH-analógok adása a kezdeti stimuláló hatást követően gátolja a gonadotropin-szekréciót az agyalapi mirigy GnRH-receptorainak csökkentésével. Olyan vizsgálatokban, amelyekben tesztoszteront GnRH-agonistákkal adtak együtt, nem sikerült megvalósítani a spermatogenezis megfelelő gátlását, mert nem alakult ki a teljes FSH-szuppresszió. A GnRH-antagonisták viszont néhány órán belül teljes FSH- és LH-gátlást okozhatnak flare-up jelenség nélkül. Tesztoszeron- és GnRH-antagonista együttes adása egy tanulmány szerint a férfiak 88%-ban azoospermiát okozott, amely tesztoszeron-monoterápiával további 20 hétig volt fenntartható. A cetrorelix vagy abarelix napi adagolásban bizonyult hatékonynak, míg az acyclin egyszeri adagja 2 hét után is gátolta a gonadotropin-szekréciót. A gyakori parenterális adásmód és a magas ár korlátozhatja a használatát. Orális adagolású készítmények vagy implantátumok (histrelin) megjelenésével azonban újra a fejlesztések középpontjába kerülhetnek.
Androgén-progeszteron kombinációk
Az androgén-monoterápiával megegyező spermatogenezis-gátlást észleltek alacsonyabb dózisú androgén adás mellett, ha az androgéneket progeszteronszármazékokkal kombinálták.
A noretiszteron-enanthatot (NETE) tesztoszteron-undekanoáttal (TU) kombinálva 90%-os volt az azoospermia kialakulása. Multicentrikus II. fázisú vizsgálatban 200 mg NETE és 1000 mg TU 8 hetente történő adása mellett 321 párt vizsgáltak, de a kutatást idő előtt meg kellett szakítani a komoly hangulatváltozásokkal járó mellékhatások miatt.
A levonorgestrel a noretiszteron származéka, amely hosszú hatású implantátumok formájában adható és amelyet tesztoszteron-undekanoáttal együtt adva az azoospermia aránya 90% felett volt. A desogestrel a levonorgestrel származéka, amelynek orálisan adható aktív metabolitja az etonogestrel. Az etonogestrel-implantátumokat tesztoszteron-undekanoáttal kombinálva 12 hetente adagolva 90%-ban oligozoospermia (≤1 M/ml) volt elérthető, azonban további vizsgálatok nem történtek az adott kombinációval.
A ciproteron-acetát progeszteronszármazék, ami erős antiandrogén aktivitással rendelkezik. 100 mg ciproteron-acetát együttes alkalmazása 100 mg tesztoszteron-enathattal heti rendszerességgel mind a 15 önkéntesben azoospermia kialakulásához vezetett, amelyhez lényegesen kevesebb időre volt szükség, mint a tesztoszteron-undekanoát monoterápiáé.
33 tanulmányon alapuló multicentrikus vizsgálat eredményeinek elemzése során, ahol a végpont az azoospermia elérése volt, azt a következtetést vonták le, hogy bár a progeszteron hozzáadásával általában javult a fogamzásgátló hatékonyság, de egyiket sem találták szignifikánsan hatékonyabbnak a klinikai felhasználáshoz.
A progeszteron együttes alkalmazása androgénekkel nincs káros hatással a testsúlyra és a HDL-koleszterin szintjére. Úgy tűnik fontos szerepet játszik, a progeszteron adásának módja, mivel az orális adagolás ateroszklerotikus hatással járhat, míg a transzdermális adás nem, amelyben a máj metabolizmusának lehet szerepe. A nőknél progeszteron adásával növekszik a kardiovaszkuláris kockázat és a gyulladásos markerek szintje (IL-6, CRP) a férfiaknál ezt idáig nem sikerült alátámasztani. A progeszteron hozzáadása a kezelés felfüggesztését követően nem befolyásolja a spermatogenezis helyreállásához szükséges időt.
Alternatív hormonális kezelések
Olyan hatóanyagok, amelyek nem csökkentik a tesztoszteron fogamzásgátló hatékonyságát, de csökkentik a mellékhatásait. Tesztoszteron kombinációja 5a-reduktáz-gátlókkal, csökkenti a hatást a prosztatára, de nem javítja a spermatogenezis gátlást.
A szelektív androgénreceptor-modulátorok (SARM) olyan vegyületek, amelyek fenntarthatják a kívánt androgénhatásokat anélkül, hogy befolyásolnák az anyagcserét vagy hatással lennének a prosztatára. 7a-metil19-nor-tesztoszteron minimálisan átalakul dihidrotesztoszteronná. Ez azoospermiát eredményezett a férfiak 73%-ában, de ez sajnos rövidtávúnak bizonyult, valószínűleg az SHBG-hez való gyenge kötődés és a rövid felezési idő miatt.
A hormonális hatású férfi fogamzásgátlókra bizonyos férfiak nem reagálnak megfelelően, annak ellenére, hogy hasonló a kezelés előtti gonadotropin és tesztoszteronszintjük és a spermiumkoncentrációjuk. Ez a klinikai vizsgálatok alapján az 5-20%-ot is eléri. A közelmúltban végzett vizsgálatok azt mutatják, hogy a nem reagálókban magasabb az inzulinszerű növekedési faktor-3 szint (IGF-3 a Leydig-sejt funkciójának markere), de ok-okozati összefüggést nem lehetett megállapítani. Az elhízott férfiak magasabb testzsírtartalommal nagyobb valószínűséggel nem reagálnak a kezelésre. Klinikai vizsgálatok során megfigyelték, hogy az ázsiai férfiak válaszaránya jobb, mint a kaukázusi férfiaké, ennek egyik lehetséges magyarázata az alacsony testzsírszázalék lehet, így ugyanolyan dózisokat adva az androgének hatékonyabbak lehetnek.
Az androgén receptor első exonjának (CAG) genetikai polimorfizmusa az androgénekkel szembeni csökkent érzékenységhez társulva csökkent hatékonysághoz vezet.
Nem hormonális módszerek
A nem hormonális fogamzásgátló módszerek magukban foglalják a hormonális készítmények legígéretesebb kutatási eredményeit, konkrétabb biológiai folyamatokat céloznak, kevesebb mellékhatással. A nem hormonális módszerek a spermatogenezis gátlásán, illetve a spermiumok mozgásának és a mellékherében történő érésének gátlásán alapulnak.
A spermatogenezis gyógyszeres gátlása
Bár számos vegyi anyag képes hatékonyan gátolni a spermatogenezist, legtöbbjük mérgező és gyakran visszafordíthatatlan sterilitást eredményez. Szomatikus vagy csírasejtekre hatnak, a csírasejteken való hatáshoz át kell haladjanak a vér-here gáton.
A gossypol a gyapotmagból származik. Kínai kutatók megfigyelték, hogy a gyapotmagolaj-fogyasztók körében szokatlanul magas volt a meddőség. Dehidrogenáz-enzim-gátló hatással rendelkezik mind a spermatogenezisre, mind a spermiummotilitásra hat. A gossypol orális adagolása 90%-ban súlyos oligozoospermiához vezetett ( A triptolid (Trypterigium wilfordii) gátolja a spermatogenezist és megakadályozza a spermiummotilitás, azonban a vizsgálatok súlyos immunszuppresszív hatást igazoltak, valamint a rágcsálóknál irreverzibilis meddőséghez vezetett. A két anyag közül sem a gossypol, sem a triptolid nem volt vagy elég hatékony vagy elég biztonságos a gyógyszeripari bevezetéshez.
Az adjudin a lonidamin olyan származéka, amely gátolja a spermatogenezist, de nefrotoxicitása már nincs. A csírasejtek és a Sertoli-sejtek közötti kapcsolatra hatva az éretlen, megtermékenyítésre alkalmatlan spermatidák felszabadulását segíti elő. Orális adagolása rágcsálókban reverzibilis meddőséget okozott, de váratlan mellékhatásként májkárosodás és az izomatrófia lépett fel. Egy módosított FSH-molekulához kötődve, biztosította az eljutást a Sertoli-sejtekhez így egyetlen adagban 4-6 héttel az injekció beadás után 5 hónapig fennálló meddőséget okozott.
Az indenopiridinek az új antihisztamin-készítmények hatóanyagai, amelynek toxicitási vizsgálatai során derült fény fogamzásgátló tulajdonságára, azonban a hatásmechanizmus egyelőre ismeretlen, de mind a csírasejt, mind a Sertoli-sejtvonalon hatnak. Állatkísérletekben súlyos oligozoospermiát okoztak toxicitás nélkül.
Az 1920-as évek óta ismert, hogy az A-vitamin a normál spermatogenezis szempontjából elengedhetetlen. A bis-dikloro-acetil-diamin az A-vitamin retinolsavvá történő átalakulását gátolja. Felhasználásával súlyos oligozoospermiát (
Termikus módszer
A herék hőmérsékletnövekedése károsítja a spermatogenezist a csírasejtek apoptózisa révén. Egy speciális alsónadrág használatával a heréket a sérvcsatorna magasságában tartották 42 hétig, ezzel nagyon alacsony spermiumkoncentrációt (<1,6 M/ml) értek el, és csupán egyetlen terhesség jött létre, az is a nem megfelelő használat miatt. A spermatogenezis visszatérését 12 és 18 hónap között észlelték, és nem tapasztaltak semmiféle visszafordíthatatlan következményt. 43 oC-os vízfürdő hat egymást követő napon 30 percig történő alkalmazásával spermiumkoncentráció és -motilitás csökkenését észlelté. A hő a DNS-szintézis károsodásához vezethet a spermatogenezis során, amely az utódokra nézve káros lehet, de állatkísérletek során nem tapasztaltak nagyobb arányú születési rendellenességet.
Ultrahang
Az ultrahanghullámok alkalmazásával állatkísérletekben és önkénteseken végzett tanulmány során a spermiumok számának jelentős csökkenését észlelték a tesztoszteronszint változása nélkül. Az ultrahang hatása a hőmérséklet ideiglenes emelkedésével lehet összefüggésben. A folyamat visszafordíthatósága összefüggésbe hozható az ultrahang-intenzitással és a behatási idővel.
A mellékherében történő transzport- és érésgátlás
A mellékhere szintjén ható fogamzásgátló módszerek feladata megakadályozni a spermiumok ejakulátumba való bekerülését vagy megtermékenyítésre alkalmatlan éretlen spermiumokat juttatni az ondóba. Ezen módszerek elméleti előnye a gyors kezdet és a termékenység ugyanilyen gyors helyreállítása, amely megfelelővé teszi még közvetlenül a közösülés előtti használatra is.
A spermium szállításának megzavarása
Az autonóm idegrendszerre ható különböző anyagok, a ductus deferens simaizom-működésének befolyásolásával elégtelenné teszik a spermiumkiáramlást, így gyorsan alakítható ki azoospermia, amely azonban nagy dózis alkalmazásakor visszafordíthatatlan. A fenoxi-benzamin alkalmazása fokozatos ondómennyiség-csökkenéshez vezet egészen az aspermiáig. Mellékhatásai a szédülés, tachycardia vagy az orrdugulás. Hosszú távú alkalmazásakor felmerült a hosszabb ideig tárolt spermiumok károsodása és a spermium elleni antitestek keletkezése, amely felveti a női ciklushoz igazított alkalmankénti használatot. Ezzel ellentétes a mellékhere simaizomzatának működését fokozó anyagok, a spermiumok gyorsabb átjutása során az érési folyamatokra nincs elég idő, így rossz megtermékenyítő képességű spermiumok kerülnek az ejakulátumba (funkcionális sterilizálás). A peptiderg-agonisták (pl. vazopresszin, oxitocin, endotelin) vagy P2a-purinerg-receptor-antagonisták állatkísérletekben hasonló módon gyors reverzibilis meddőséghez vezettek. Aggodalomra ad okot, hogy a spermiumszám csökkenése nélkül, az éretlen spermiumokkal történő esetleges megtermékenyülés, milyen hatással lehet az utódokra.
A mellékhere mikrokörnyezetének befolyásolásával ható szerek
A mellékhere lumene sajátos mikrokörnyezet. Magasabb az ozmolaritása, savas a pH-ja, egyedi elektrolit és mikromolekula összetétele van. Fontos szerepet tölt be a spermiumok érésében. A mikromolekulák, mint például a karnitin koncentrációjának csökkentése a mellékherékben vagy a mellékhere epithelsejt-szekréció szelektív gátlása révén, olyan vegyületekkel, mint az alfa-klorohidrin vagy a 6-kloro-6-deoxiglükóz csökkenthető a mellékhere lumenében az ozmolaritás, ami a spermiumok duzzadásához vezet. Állatkísérletekben pivalinsavval történő karnitinszint-csökkentés nem eredményezett meddőséget.
A mellékhere savas pH-ja fontosnak tűnik a spermiumok érési folyamata során. A folyamat fenntartásáért az intracitoplazmáris carbanhidráz felel. A carbanhidráz-bénító acetazolamid emlősökben úgy tűnik, hogy nem befolyásolja a mellékhere intraluminalis pH-értékét. A spermiumok mozgásának gátlására egyik lehetséges módszer a metabolizmusban érintett enzimek irreverzibilis gátlása, amely a spermiumok motilitásának károsodásához vezet. Ilyen vegyület az alfa-klolorohidrin azonban hatása nem korlátozódik a spermiumokra, ezért szisztémás toxicitást okoz. Alternatív módon a spermiumkapacitáció gátlásával károsodhat a motilitás. A legújabb tanulmányok a spermiumok feszültségfüggő kalciumcsatornáira összpontosítanak (CatSpers), amelyek lehetővé teszik a kalcium bejutását az érés során, növelve a farok mozgásának frekvenciáját és az amplitúdóját. A CatSpers blokkolása megakadályozhatja a hiperaktivált motilitást, ez olyan anyagokkal érhető el, mint az anti CatSper1 immunglobulin-G. További lehetőség a spermium és petesejt fúziójának gátlása. A spermiumok tartalmaznak egy N-acetil-béta-D hexózaminidáz-B típusú (HEX-B) enzimet, amely lehasítja a ZP-glikoproteinek a petesejtek zona pellucidájáról. ZP-glikoprotein-analógok in vitro gátolják a HEX-B működését így 98%-os hatékonyság érhető el megtermékenyítés-gátlás tekintetében mellékhatások nélkül és a termékenység visszaállhat egy héttel a kezelés abbahagyása után.
Immunológiai megközelítések
A pozitív spermiumellenes antitestek, különösen az IgA-típus kimutatása vasectomia után csökkenti a helyreállító műtétet követően a nemzőképesség visszanyerésének valószínűségét. A vadon élő állatoknál már alkalmazzák a spermium elleni aktív immunizálást, azonban kiszámíthatatlan az egyéni reakció és a folyamat visszaállíthatósága az immunológiai memória miatt. Immunizációs kísérletekben egerek urokináz típusú plazminogén aktivátora ellenes szerek, illetve főemlősökben rekombináns humáneppin (epidymális fehérje) beadásával reverzibilis fogamzásgátlás jött létre. Az eredmény fenntartásához azonban magas antitesttiterre volt szükséges, így 3 hetente emlékeztető dózist kellett adni. A közelmúltban gonadotropinokat vagy a GnRH-t célzó vakcinát teszteltek nőkön (I. fázis vizsgálatok), amely férfiakban is alkalmazható. Immunizáció az FSH-receptorral szemben csökkentette a hím majmok nemzőképességét, míg a szérum hormonszintje és a herék szövettana nem változott.
Mechanikai módszerek
Ezek a vasectomia alternatív módszerei, jobb és gyorsabb reverzibilitással.
Reversible Inhibition of Sperm Under Giudance (RISUG) a legígéretesebb ilyen technika I. és II. fázisban már tesztelték indiai férfiakon, egyszeri alkalmazással 10 évig megbízható fogamzásgátlást biztosított. A RISUG 60 mg sztirol-maleinsavanhidrid-polimert (Xiran) 120 μl dimetil-szulfoxid oldatban oldunk, majd a ductus deferensbe injektáljuk és 10 nap alatt meddőséget okoz. Hatásmechanizmusa az, hogy részben elzárja a ductus deferenseket ugyanakkor morfológiai eltéréseket okoz a hímivarsejteken. Egyetlen alkalmazás hatékony, nincs mellékhatása és könnyen visszafordítható dimetil-szulfoxid vagy szódabikarbóna beinjektálásával, ami a RISUG kiürülését okozza. A mellékhatások közé tartozik a herék enyhe fájdalom nélküli duzzanata, amely általában spontán szűnik. A vasectomiával ellentétben ez nem jár granulomaképződéssel és autoimmun reakcióval. A beadandó anyagokkal kapcsolatban felmerült toxikus és teratogén hatás, rágcsálókon végzett vizsgálatok bizonyították nem valószínű, hogy DNS-károsodást okozna.
Intravasalis dugók
Orvosi poliuretánt és az orvosi szilikongyantát tartalmazó dugókat teszteltek a ductus deferens elzárására. Az poliuretándugók alkalmazása során 98%-ban azoospermia alakult ki, de 18-24 hónap kellett a kialakuláshoz. A szilikondugók eredményei nem voltak ilyen jók, különösen az azoospermia tekintetében. A szövődményarány alacsony, a dugó eltávolítása után a termékenység 85%-ban tér vissza. Az eljárás egyik nagy előnye, hogy a behelyezés és az eltávolítás is könnyen elvégezhető szövődmény nélkül. A poliuretánban található aromás aminok miatt felmerült a toxicitás lehetősége, de a sokéves felhasználás ez idáig ezt nem igazolta.
Jövőbeli megközelítések
A spermiumok glikoszfingolipideket expresszálnak. Azon egerekben, amelyekben károsodott ezen anyagok bioszintézise, szignifikánsan csökkent nemzőképességet figyeltek meg. Azonban a glikoszfingolipid-szintézis-gátló milgustat egészséges férfiakban nem volt hatással a hímivarsejtek megtermékenyítő képességére.
Jelenleg kísérletek folynak BRDT-fehérje-gátlókkal, amely a kromatinkondenzáció gátlása révén fejti ki hatását és rágcsálókban reverzibilis meddőséget értek el vele. Ez a folyamat humán alkalmazásban is sikeres lehet. A proteomika fejlődésével lehetőség nyílhat a testi sejteknél több membránfehérjét tartalmazó spermiumok vizsgálatára, méghozzá fehérjeszintézis gátlásával pontosabban meghatározva a fehérjeösszetételüket, egy hatékonyabb fogamzásgátló kifejlesztéséhez.
Következtetések
Jelenleg gyógyszeralapú férfi fogamzásgátló nincs a piacon. Két lehetőség van az egyik az óvszer, a másik a vasectomia a maga behatárolt lehetőségeivel. Családtervezési céllal a vasectomia elvégzése Magyarországon 2015-ben szigorodott (Eü. törvény 147. paragrafus) csak 40. életévét betöltött személy és/vagy 3 élő gyermek esetén végezhető el írásbeli nyilatkozatot követően, amelyet 6 hónap múlva meg kell erősíteni és így további 6 hónap után végezhető el az eljárás.
A hormonális fogamzásgátlók állnak legközelebb a forgalomba kerüléshez, de a kiszámíthatatlan válaszadási arányok és hosszú távú mellékhatások visszavetették a gyógyszergyártók ezen irányú törekvéseit. A női lobbi szerepe sem elhanyagolható ezen a téren a férfiak compliance-e miatt.
A nem hormonális fogamzásgátló módszerek ígéretesnek tűnnek, elméleti síkon nagyon specifikusak lehetnek, de a legtöbb még mindig kísérleti szakaszban van.
Amíg megbízható, biztonságos és praktikus férfi fogamzásgátlót nem fejlesztenek ki, a nőknek kell továbbra is viselniük a fogamzásgátlás terhét.
References
1. Goldstein M, 1983 Vasectomy failure using an openended technique. Fertil Steril 40: 699–700. https://doi.org/10.1016/S0015-0282(16)47435-2
2. Goldstein M, Li PS, Matthews GJ. Microsurgical vasovasostomy: the microdot technique of precision suture placement. J Urol 1998; 159: 188–190. https://doi.org/10.1016/S0022-5347(01)64053-9
3. Aaltonen P, Amory JK, Anderson RA, et al. 10th Summit Meeting consensus: recommendations for regulatory approval for hormonal male contraception. J Androl 2007; 28: 362–363.
4. World Health Organization Task Force on Methods for the Regulation of Male Fertility Contraceptive efficacy of testosterone-induced azoospermia and oligozoospermia in normal men. Fertil Steril 1996; 65: 821–829. https://doi.org/10.1016/S0015-0282(16)58221-1
5. Liu PY, Swerdloff RS, Christenson PD, Handelsman DJ, Wang C, Group HMCS. Rate, extent, and modifiers of spermatogenic recovery after hormonal male contraception: an integrated analysis. Lancet 2006; 367: 1412–1420. https://doi.org/10.1016/S0140-6736(06)68614-5
6. Brady BM, Anderson RA. Advances in male contraception. Expert Opin Investig Drugs 2002; 11: 333–344.
https://doi.org/10.1517/13543784.11.3.333
7. Singh AP, Rajender S. CatSper channel, sperm function and male fertility. Reprod Biomed Online 2015; 30: 28–38.
https://doi.org/10.1016/j.rbmo.2014.09.014
8. Lohiya NK, Alam I, Hussain M, Khan SR, Ansari AS. RISUG: An intravasal injectable male contraceptive. Indian J Med Res 2014; 140(Suppl): S63–72.
9. Kanakis GA1, Goulis DG. 2 Male contraception: a clinically-oriented review. Hormones (Athens). 2015 Oct-Dec; 14(4): 598–614.
doi: 10.14310/horm.2002.1623. https://doi.org/10.14310/horm.2002.1623
10. Kumar A, Sharma M. Basics of Human Andrology, A textbook Springer; 2017. Part VIII Male contraception pp. 493–509.
https://doi.org/10.1007/978-981-10-3695-8_29