MRI-ultrasound fusion-guided prostate biopsy at Péterfy Hospital
DOI: 10.22591/magyurol.2021.3.rafit.9
Authors:
Ráfi Tamás dr.1, Volford Gábor dr.2, Zóber Tamás dr.1, Beöthe Tamás dr.1,
Buzogány István dr.1, Markó Róbert dr.2, Kardos Lilla dr.2, Papp Éva dr.2,Dombovári Péter dr.1
1Péterfy Kórház-Rendelőintézet és Manninger Jenő Országos Traumatológiai Intézet, Urológiai Osztály, Budapest (osztályvezető: Buzogány István dr.)
2Affidea Magyarország Kft. – Péterfy Kórház-Rendelőintézet és Manninger Jenő Országos Traumatológiai Intézet, Budapest
Summary
Introduction: Prostate cancer is the second most common malignancy diagnosed among men globally. The continuous development of magnetic resonance imaging has brought a breakthrough in prostate cancer diagnostics and enabled us to perform novel sampling techniques.
Objective: The aim of our investigation was to summarize our initial results of mpMRI fusion biopsies in order to further improve the detection rate of future sampling.
Materials and Methods: In our Institution between February 2020 and March 2021 TRUS/MRI fusion biopsies were performed on 36 patients using V Nav needle tracking system. The PI-RADS v2 guidance was followed in our MRI reports. PI-RADS score, size, location, extraprostatic extension of the MRI-detected lesions combined with serum PSA levels PSAD and prostate volumes were all investigated to evaluate how they affect the detection rate.
Results: 64% of our patients were diagnosed with histologically confirmed prostate cancer upon fusion biopsy. The detection rate among PI-RADS 5 lesions was 57%, while only 26% among PI-RADS 4 lesions. Malignancy was found at a higher rate among lesions located in transitional zone compared to peripheral zone lesions (56% vs. 33%). The larger axial diameter of the lesions (detected/not detected 20.5 mm vs. 14 mm), higher PSAD values (detected/not detected 0.22 ng/ml2 vs. 0.10 ng/ml2, the presence of extraprostatic extension all increased the detection rates of fusion biopsies. The average prostatic volumes were higher among patients whose biopsy confirmed no malignancy (71 ml vs. 58 ml).
Conclusion: The results of TRUS/MRI fusion biopsies carried out in our Institution are comparable to the International data, although less successful compared to the results reported by other Hungarian research groups. According to our findings the most important factors affecting the detection rate of fusion biopsies are the PI-RADS score, the size, the location, the presence of extraprostatic extension of the lesions coupled with PSAD and prostatic volume. All of the above factors should be taken into consideration in patient selection when indicating fusion biopsies in order to select those who benefit the most of this procedure.
LAPSZÁM: MAGYAR UROLÓGIA | 2021 | 33. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Bevezetés: A prosztatarák a második leggyakoribb rosszindulatú daganatos elváltozás a férfiak körében. Diagnosztikájában az MR-vizsgálat fejlődése nagy áttörést hozott, újfajta célzott mintavételi technikák lehetőségét teremtette meg.
Célkitűzés: Vizsgálatunk célja az volt, hogy összegezzük kezdeti tapasztalatainkat az általunk végzett mpMR fúziós prosztatabiopsziák terén. Továbbá a kapott eredmények tanulsága alapján növeljük a jövőbeni mintavételek sikerrátáját.
Anyag és módszerek: A Péterfy Kórház-Rendelőintézet és Manninger Jenő Országos Traumatológiai Intézet Urológiai Osztályán 2020. február és 2021 márciusa között összesen 36 páciens esetében végeztünk transrectalis ultrahangvezérelt mpMR fúziós prosztatabiopsziát, az ultrahangkészülékhez biztosított V-nav navigációs program segítségével. Az MR-vizsgálatok értékelése a PI-RADS v2 ajánlása szerint történt. Elemeztük, hogy az MR-en észlelt léziók PI-RADS besorolása, mérete, elhelyezkedése, extraprosztatikus terjedés jeleinek megléte, illetve a betegek szérum PSA-szintje, PSAD-értéke, továbbá prosztatatérfogata miként befolyásolta a biopsziák eredményét.
Eredmények: A biopsziák szövettani feldolgozása alapján a páciensek 64%-ában igazolódott prosztatadaganat. Az MR által leírt elváltozásokból célzottan vett minták hisztológiai eredményeit elemezve, a PI-RADS 5-ös besorolású gócok esetén a találati arány 57% volt, míg a PI-RADS 4-es léziók esetén 26%. A tranzicionális zónából kiinduló elváltozások esetén nagyobb arányban igazolódott malignitás a hisztológiai vizsgálatok során, mint a perifériás zóna gócai esetén (56% vs. 33%). Az elváltozások nagyobb axiális átmérője (talált/nem talált 20,5 mm vs. 14 mm), a magasabb PSAD-értékek (talált/nem talált 0,22 ng/ml2 vs.
0,10 ng/ml2), és az extraprosztatikus terjedés jeleinek megléte mind növelték a mintavételek találati arányát. Az átlagos prosztatavolumen nagyobb volt azon páciensek esetében, akiknél a biopsziák nem igazoltak malignitást (71 ml vs. 58 ml).
Következtetések: Az általunk végzett mpMR fúziós biopsziák eredményessége megfelel a nemzetközi adatoknak, ugyanakkor más hazai munkacsoport által végzett beavatkozások eredményeitől elmarad. Tapasztalataink alapján a mintavételek sikerességét befolyásolja az elváltozások PI-RADS besorolása, mérete, elhelyezkedése, extraprosztatikus terjedés jele, PSAD-érték, valamint a prosztata térfogata. Mindezen tényezőket érdemes figyelembe venni az indikáció felállításakor, hogy megfelelően kiválaszthassuk azon pácienseket, akik a legtöbbet nyerhetnek a beavatkozással.
Bevezetés
A prosztatarák világszerte a második leggyakoribb daganatos elváltozás a férfiak körében, 2018-ban közel 1,3 millió új eset került felismerésre (1). A Nemzeti Rákregiszter adatbázisa szerint Magyarországon 2017-ben 4855 betegnél diagnosztizáltak prosztatatumort, ezzel hazánkban a harmadik leggyakoribb malignus megbetegedésnek számít a férfiak esetében (2).
A szűrések alkalmával történő rectalis digitális vizsgálat (RDV), prosztataspecifikus antigén- (PSA) meghatározás és a transrectalis ultrahangvizsgálat egyre szélesebb körű elterjedése elősegítette a korai felismerést (3). A pontos diagnózis felállításához ugyanakkor nélkülözhetetlen a dülmirigyből történő hisztológiai mintavétel, amelynek segítségével a prosztatarák szövettanilag is igazolható. Ennek egyik legelterjedtebb módja a transrectalisan történő ultrahangvezérelt szisztémás biopszia (systematic transrectal ultrasound guided prostate biopsy – TRUSB), amelynek során random 10-14 mintát veszünk, törekedve a prosztata minél nagyobb területének lefedésére (4, 7). Ultrahangvizsgálattal ugyanakkor a prosztatában lévő daganatos elváltozás gyakran nem különíthető el az ép szövettől, így a TRUS mintavételi technikával célzott biopszia a legtöbb esetben nem kivitelezhető (5). Gyakori az álnegatív eredmény, így a kezelést igénylő prosztatatumorok jelentős része nem kerül felfedezésre az első mintavétel alkalmával. Egyes tanulmányok szerint ez az arány elérheti akár a 30-50%-ot is (7). Negatív szövettani eredmény esetén sem zárható ki teljes biztonsággal a prosztatadaganat, így fontos ezen betegek szoros követése és a továbbra is fennálló klinikai gyanú esetén ismételt mintavétel elvégzése (6). Az ebből fakadó teher mind a pácienst, mind az egészségügyi ellátórendszert érinti, fokozva a költségeket és az ismételt beavatkozásokból eredő esetleges szövődmények rizikóját is (9).
Az utóbbi években a képalkotó vizsgálatok rohamos fejlődése újfajta mintavételi technikák lehetőségét teremtették meg. A multiparametrikus mágnesesrezonancia- (mpMR) vizsgálat megjelenésével és gyakorlati alkalmazásával a prosztatáról részletgazdag képet kaphatunk, amelynek segítségével ezen régióról fontos információkat tudunk nyerni. Ez a noninvazív képalkotó eljárás a prosztatatumor kimutatására igen érzékeny, a daganatgyanús gócok célzott mintavételét teszi lehetővé (8). Az egyik ilyen módszer az MR-vizsgálat közben (in-bore) az MR-csőben történő célzott biopszia, ez azonban az eljárás relatíve hosszú időtartama és magas költségei miatt a mindennapi gyakorlatban kevésbé terjedt el (11). A kognitív fúziós mintavételi technika során az operatőr a korábban készült MR-felvétel eredményét gondolatban rávetíti a transrectalis úton történő ultrahang valós idejű képére és pozícionálja a biopsziás tűt a gyanús régió irányába. Ezen eljárás nem igényel egyéb drága, speciális berendezéseket, ugyanakkor eredményessége nagyban függ a beavatkozást végző személy gyakorlottságától (4). Jóval pontosabb és a klinikai gyakorlatban is egyre szélesebb körben alkalmazott beavatkozás az mpMR fúziós ultrahangvezérelt biopszia, amely során egy speciális szoftver és eszköz segítségével vetítik össze a korábbi MR-felvételt a transrectalis ultrahang „real time” képével, így megvalósítva a célzott mintavétel lehetőségét (11).
A klinikai tanulmányok szerint mindhárom MR-vezérelt mintavételi technika hatékonyabb a kezelést igénylő, klinikailag szignifikáns prosztatatumorok kimutatásában, mint a hagyományos TRUSB. További előnyük, hogy a klinikailag nem szignifikáns daganatok kisebb arányban kerülnek felismerésre, amely mind a páciens, mind az egészségügy megterhelése szempontjából meghatározó tényező (12).
Vizsgálatunk célja az volt, hogy összegezzük kezdeti tapasztalatainkat az általunk végzett mpMR fúziós prosztatabiopsziák terén. Továbbá a kapott eredmények tanulsága alapján növeljük a jövőbeni mintavételek sikerrátáját.
Anyag és módszerek
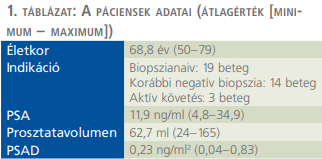
A Péterfy Kórház-Rendelőintézet és Manninger Jenő Országos Traumatológiai Intézet Urológiai Osztályán 2018 óta minden prosztatabiopszia előtt lehetőségünk nyílt az mpMRI elvégzésére. 2019-ben történt az első fúziós biopsziás beavatkozás és 2020. február valamint 2021 márciusa között összesen 36 transrectalis ultrahangvezérelt mpMR fúziós prosztatabiopsziát (mpMRI-transrectal ultrasound fusion-guided prostate biopsy – MRI-TRBx) végeztünk. Indikáció szerint a betegeket három csoportba sorolhatjuk: korábbi negatív mintavételen átesettek (14 eset), prosztatadaganat miatt aktív követésen lévők (3 eset) és korábban még nem biopsziázottak (19 eset). A páciensek adatait az 1. táblázat foglalja össze.
Prosztata MR-vizsgálata
A prosztatáról készült mpMR-vizsgálatok mindegyike 1,5 Tesla térerősségű MR-készülékkel történt. Intézetünkben az Affidea Magyarország Kft. által üzemeltetett GE Signa Voyager 1,5T készülék áll rendelkezésre a mpMRI-k elkészítésére. A fúziós biopsziákhoz használt MR-felvételek minden esetben megfeleltek a PI-RADS v2 (Prostate Imaging-Reporting and Data System version 2) szerinti kritériumoknak, tartalmazták a T2 súlyozott, diffúzió súlyozott és dinamikus kontrasztanyagos méréseket. Külső intézményben történt MR-vizsgálatok is elfogadásra kerültek, amennyiben a felvétel minősége megfelelt az előbbiekben felsorolt kritériumoknak. A felhasznált képanyagok kiértékelését az MR diagnosztikában és urogenitális régióban tapasztalt radiológus kollégák végezték a PI-RADS v2 ajánlása szerint. Az MR-vizsgálatok felvételei alapján kiszámoltuk a prosztata térfogatát (ml), a következő képlettel: (maximális longitudinális átmérő [cm]) × (maximális transzverzális átmérő [cm]) × (maximális antero-posterior átmérő [cm]) × 0,52. A vizsgálati képanyagokon meghatároztuk a gyanús léziók lokalizációját, maximális axiális átmérőjét (mm), valamint a szérum PSA (ng/ml) és a prosztatavolumen (ml) hányadosaként kiszámoltuk a PSA-sűrűséget [prostatic-specific antigen density – PSAD] (ng/ml2/sup>) is. Rögzítettük a gyanús léziók PI-RADS besorolását, továbbá külön vettük azon eseteket, ahol extraprosztatikus terjedés lehetősége merült fel az MR-felvételek alapján. Célzott biopsziára a PI-RADS 4-s és PI-RADS 5-s kategóriába eső léziók kerültek. A tanulmányunkban vizsgált 36 beteg esetében összesen 49 gócot azonosítottunk az MR-felvételek alapján (PI-RADS 4-s 19; PI-RADS 5-s 30). A betegek adatait a 2. táblázat foglalja össze.
Transrectalis ultrahangvezérelt mpMR fúziós prosztatabiopszia
A biopszia előtt a betegek, infektológus által javasolt, egyszeri dózisú antibiotikumprofilaxisban (iv. 1×2 g Ceftriaxon és iv.
3 mg/ttkg Gentamicin) részesültek. A mintavételek a kezdeti tanulási fázisban még inhalációs narkózisban történtek, később azonban áttértünk a betegek által is igen jól tolerált helyi érzéstelenítésben végzett beavatkozásra. A lokális anesztéziát két oldalra a periprosztatikus térbe 5-5 ml 1%-os lidocainoldat adásával értük el. A beavatkozáshoz a pácienseket bal oldalukra fordulva, térdet a mellkas felé húzva fektettük, majd Betadine-oldatos fertőtlenítést követően izoláltuk a rectumot és környékét. Ezt a pozíciót a betegek is stabilan, mozdulatlanul tudták tartani a beavatkozás alatt, amely a célzott mintavétel szempontjából kiemelten fontos. Ebben a pozícióban az eszközöket is optimálisan el tudtuk helyezni, minimalizálva a mágneses interferenciát. A mintavételeket megelőzően az MR-vizsgálatok képanyagát feltöltöttük a beavatkozáshoz használt ultrahangkészülék szoftverébe (GE Logiq S8 XDClear).
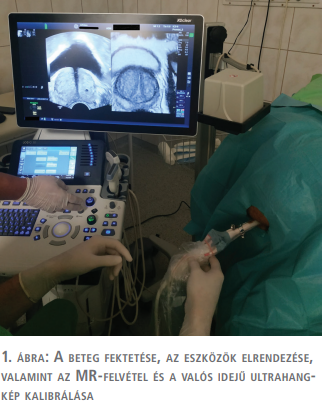
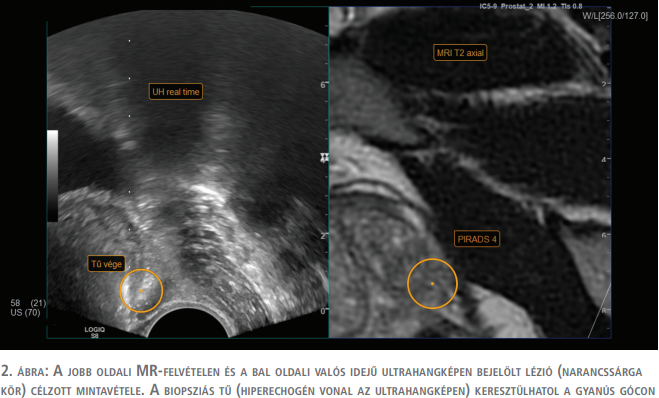
A műtőasztalon a beavatkozás előtt minden esetben egy ellenőrző rectalis digitális vizsgálat történt, majd a transrectalis ultrahangfejet bevezetve az MR- és a valós idejű ultrahangképek fúziója következett. Ehhez az ultrahangkészülékhez biztosított „V-nav” navigációs szoftvert használtuk, amely a beteg csípője fölött elhelyezett rádiófrekvenciás jeladó egység és az ultrahangfejre rögzített két érzékelő marker segítségével regisztrálja az ultrahangfej térbeli helyzetét (1. ábra). Az ultrahangképeket rendszerint a prosztata csúcsán átvezetett síkban kalibráltuk az előre feltöltött MR-képekkel. A mintavételekhez az ultrahangkészülékkel kompatibilis biopsziás pisztolyt (BARD MAGNUM MG1522, USA) használtunk, 18 G-s, 25 cm-es tűvel átlagosan 10 mm hosszú szövethengereket vettünk a rectumon keresztül a prosztata állományából (2. ábra).

Minden alkalommal random szisztémás biopsziát is végeztünk (4-6 minta a prosztata mindkét lebenyéből), a gyanús gócokból további, minimum 2 mintavétel történt. Szövődménymentes beavatkozást követően amennyiben narkózisban történt a beavatkozás másnap reggel, helyi érzéstelenítés esetén rövid obszerváció után aznap távozott otthonába a páciens.
Eredmények
A tanulmányunkban részt vett betegek átlagéletkora 68,8 év (50–79), átlag PSA-értéke 11,9 ng/ml (4,8–34,9), az átlagos prosztatatérfogat 62,7 ml (24–165) és az átlag PSA-denzitás 0,23 ng/ml2 (0,04–0,83) volt (1. táblázat). A beavatkozás a tanulási fázist követően 20-25 percet vett igénybe. Hospitalizációt igénylő szövődményt egy páciens esetében regisztráltunk, akinél a mintavételt követő napon magas lázzal, emelkedett gyulladásos paraméterekkel járó állapot alakult ki, amelyet széles spektrumú parenterális antibiotikumterápiával sikeresen kezeltünk.
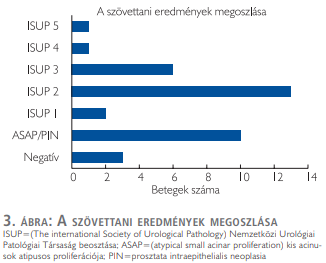
A mintavételek szövettani eredményét a 3. ábra foglalja össze. A betegek hisztológiai leleteinek feldolgozása alapján 23/36 (64%) esetben igazolódott prosztatatumor. Azon pácienseknél, akik anamnézisében korábbi biopszia nem szerepelt, 12/19 (63%), klinikailag szignifikáns (ISUP ≥2) tumorok esetében 11/19 (57%) volt a pozitív minták száma. Az előzetes negatív mintavételi eredménnyel rendelkező betegek csoportjában 8/14 (57%) esetben igazolódott prosztatatumor, közülük 7/14 (50%) páciensnél klinikailag szignifikáns karcinómát igazolt a szövettani feldolgozás. Az aktív követés alatt álló betegek közül, mindhárom esetben a korábban ismertnél magasabb grádusú prosztatakarcinóma igazolódott a fúziós biopszia segítségével.
Külön megvizsgáltuk a random szisztémásan vett és az MR által leírt gyanús gócból célzottan nyert minták szövettani eredményét a pozitív betegek körében. Eredményeink alapján 4/23 (17,4%) páciens esetében csak a gyanús lézióból vett célzott minta igazolta a malignus tumor jelenlétét, amely mind a négy beteg esetében klinikailag szignifikáns (ISUP ≥2) daganat volt. Ezen páciensek közül 2/4 (50%) esetében a kórelőzményben korábbi negatív biopszia szerepelt, egy beteg pedig aktív követés alatt állt. Szintén 4/23 (17,4%) beteg volt, akiknél csak a szisztémásan random vett mintákból került leírásra malignitás, közülük 3/4 (75%) páciens esetében nem szerepelt korábbi biopszia az anamnézisben és mindannyiuknál klinikailag szignifikáns tumor igazolódott. Mind a célzott, mind a szisztémás mintákból prosztatarákot igazolt a szövettani vizsgálat 15/23 (65,2%) beteg esetében.
Az MR fúziós mintavételek alkalmával a PI-RADS 4-s (19) és PI-RADS 5-ös (30) besorolású elváltozásokból vettünk célzott biopsziát. Ezen célzott minták szövettani eredményeit elemezve, a PI-RADS 5-ös gócok esetén 57%-ban (17/30), míg a PI-RADS 4-es léziók esetén 26%-ban (5/19) igazolódott malignitás a hisztológiai vizsgálatok során.
Az MR által leírt és célzott biopsziára került gyanús léziókat elhelyezkedésük szerint is csoportosítottuk. A tranzicionális zónában lévő gócok 14/25 (56%) esetben, míg a perifériás zónából kiinduló elváltozások 8/24 (33%) esetben bizonyultak malignus tumornak a célzott mintavételek alkalmával.
A fúziós biopsziára kerülő betegek MR-felvétele alapján rögzítettük a gyanús gócok legnagyobb axiális átmérőjét is, amelyek átlagértéke 17,9 mm (7–37 mm) volt. A célzott hisztológiai mintavételek során azt tapasztaltuk, hogy a malignitást igazoló elváltozások medián átmérője (20,5 mm) nagyobb volt, mint a negatív szövettani eredményt adó gócoké (14 mm).
Külön megvizsgáltuk azokat az eseteket, akiknél az mpMRI-vizsgálat képanyagai alapján felmerült az extraprosztatikus terjedés lehetősége. A hisztológiai mintavételek kapcsán ezen betegek közül 9/11 (82%) esetben igazolódott malignitás a szövettani vizsgálatok során.
Az MR-képek alapján meghatároztuk a prosztata térfogatát, amelyet összehasonlítottunk a pozitív és negatív hisztológiai eredménnyel rendelkező páciensek között. Azt tapasztaltuk, hogy az átlagos prosztatatérfogat nagyobb volt azon betegek csoportjában, akiknél a fúziós biopsziák során nem igazolódott prosztatatumor (71 ml vs. 58 ml). A prosztatavolumen 10 esetben haladta meg a 80 ml-t, akik közül hatnál nem igazolódott malignitás a mintavétel során.
A medián PSA-értékeket összehasonlítva nem mutatkozott lényeges különbség a pozitív és negatív szövettani eredménnyel rendelkezők között (9 ng/ml vs. 7,2 ng/ml). A medián PSAD-érték magasabb volt a pozitív, mint a negatív hisztológiai eredményű páciensek esetében (0,22 ng/ml2 vs. 0,10 ng/ml2).
A beavatkozásokat a kezdeti tanulási fázisban, narkózisban (16 eset), később helyi érzéstelenítésben (20 eset) végeztük. Akiknél a MRI-TRBx során prosztatadaganat igazolódott, 61%-ban (14/23) lokális anesztéziában történt a mintavétel. A lidocainos érzéstelenítést a páciensek is jól tolerálták, megfelelő fájdalommentességet biztosított, nem mozogtak a beavatkozás közben.
Megbeszélés
A multiparametrikus mágnesesrezonancia-vizsgálat lehetőségével egyre szélesebb körben terjedt el az mpMR fúziós prosztatabiopszia, amely hazánkban is kibontakozóban van, több intézményben alkalmazzák. Ezen mintavételi technika segítségével lényegesen növelhető a klinikailag szignifikáns prosztatadaganatok detekciós rátája a megfelelő betegpopuláción alkalmazva, csökkentve az ismételt biopsziák számát és az ezekből eredő esetleges szövődmények rizikóját (4).
A transrectalis mintavételi út tapasztalataink szerint nem jelentett nagyobb rizikót a betegek számára. Egy alkalommal alakult csak ki szeptikus állapot a beavatkozást követően, annak ellenére, hogy mind a preoperatív vizsgálatok alkalmával történt vizelettenyésztés, mind a lázas állapot jelentkezése után frissen vett vizelet és hemokultúra-minták negatív eredményt mutattak. Infektológus bevonásával indikált széles spektrumú parenterális antibiotikumkezelés hatására a beteg állapota rendeződött. Súlyos szövődményt más esetben nem észleltünk. A mintavételeket a kezdeti tanulási fázist követően helyi érzéstelenítésben végeztük, amely tapasztalataink és irodalmi adatok alapján is megfelelő fájdalommentességet biztosít (13). A lokális anesztézia rövidebb hospitalizációt igényel, amely a betegek és az egészségügyi ellátórendszer szempontjából is fontos tényező. A jövőbeni beavatkozásainkat is helyi érzéstelenítésben tervezzük elvégezni.
Azon betegek csoportjában, akiknek az anamnézisében korábbi biopszia nem szerepelt, a nemzetközi szakirodalomban publikált adatokat meghaladó arányban sikerült kimutatnunk klinikailag szignifikáns prosztatatumort (14). Hazánkban más intézetben végzett beavatkozások eredményeitől ugyanakkor elmaradtunk (15). Fontos kiemelni, hogy előfordultak olyan esetek, ahol csak a random, szisztémásan vett minták igazoltak klinikailag szignifikánsnak bizonyuló tumoros elváltozást. Ezen eredményeink egybehangzóak a szakmai előírásokkal, miszerint a biopszianaiv páciensek esetében a célzott mintavételt ki kell egészíteni random, szisztémás biopsziával is, mert felfedezetlenül maradhatnak a kezelést igénylő klinikailag releváns prosztatatumorok (16).
A korábbi negatív mintavételi eredménnyel rendelkező betegek csoportjában szintén magasabb arányban tudtunk kimutatni klinikailag szignifikáns prosztata daganatot, mint a külföldi adatok (17), azonban más hazai munkacsoport eredményeit itt sem értük el (15). Ezen esetekben előfordult, hogy csak az MR által leírt gyanús gócból célzottan vett minták mutattak malignitást, amelyek minden esetben klinikailag szignifikáns elváltozást igazoltak, elősegítve a korai felismerést és a terápia időben történő megkezdését.
A multiparametrikus MR-vizsgálaton észlelt gyanús léziók a PI-RADS-besorolás szerint osztályozhatók, amelynek segítségével megbecsülhető a klinikailag szignifikáns prosztatadaganat jelenléte. Ennek valószínűsége PI-RADS 5-ös besorolás esetén nagyon magas, míg PI-RADS 4-es érték esetén magas (18). Tanulmányunkban magunk is azt tapasztaltuk, hogy a találati arány lényegesen magasabb volt a PI-RADS 5-ös gócok esetén, mint a PI-RADS 4-es besorolású lézióknál.
Azon betegek csoportjában, akik aktív követés alatt álltak, minden esetben magasabb grádusú prosztatatumort igazolt az mpMRI során progressziónak minősített esetek rebiopsziás mintáinak szövettani feldolgozása. Ez a multiparametrikus MR-vizsgálat érzékenységét jelzi a klinikailag szignifikáns prosztatadaganatok kimutatásában. A magasabb grádusú tumor igazolása módosítja a terápiás tervet, kuratív kezelés válik szükségessé.
Eredményeink alapján arra a következtetésre jutottunk, hogy az MR-en feltüntetett léziók mérete meghatározó a mintavételek kimenetele szempontjából. Azt tapasztaltuk, hogy a nagyobb axiális átmérőjű elváltozások esetében nagyobb arányban igazolódott malignitás a szövettani feldolgozás során. A nagyobb gócokat tehát nagyobb valószínűséggel találtuk el, ugyanakkor ebben az is szerepet játszhat, hogy a nagyobb léziók magasabb PI-RADS-besorolásúak lehetnek, amely érzékenyebben jelzi malignus tumor jelenlétét. Ugyanakkor magában hordozza azt a veszélyt, hogy a kisméretű, de később klinikailag magas kockázatú daganatok a TRUSB során nem kerülnek időben felismerésre.
Vizsgálataink alapján azt tapasztaltuk, hogy az MR-vizsgálaton leírt elváltozások elhelyezkedése is befolyásolhatja a biopszia eredményét. A tranzicionális zónából kiinduló léziókból vett minták nagyobb arányban igazoltak malignitást, mint a perifériás zónából kiinduló gócok. A tranzicionális zónában lévő gócok PI-RADS besorolása átlagosan magasabb volt, amely nagyobb valószínűséggel jelzi rosszindulatú daganat jelenlétét és ez is oka lehetett a magasabb találati aránynak. Másrészt a tranzicionális zónából kiinduló gócok átlagos mérete is nagyobb volt, így valószínűleg ezeket a gócokat emiatt nagyobb valószínűséggel találtuk el.
Feldolgozásunk során, akiknél az előzetes MR-vizsgálat extraprosztatikus terjedés jeleit mutatta, közel minden esetben malignitás igazolódott a szövettani minták feldolgozása alkalmával. Az extraprosztatikus terjedés a lokálisan előrehaladott, nagyméretű, agresszív viselkedésű tumorok jellemzője lehet, amelynek korai felismerése kiemelten fontos a mielőbbi terápia megkezdése szempontjából.
Nem mutatkozott lényeges különbség a pozitív és negatív eredményű mintavételek között, amikor a betegek mintavétel előtti szérum PSA-szintjét hasonlítottuk össze. A PSAD esetében ugyanakkor azt tapasztaltuk, hogy a malignitást igazoló biopsziák magasabb PSA-denzitással társultak. Ez megfelel azon irodalmi ismereteknek, amely szerint a PSAD a prosztatarák érzékenyebb markere, mint maga a szérum PSA-szint (19). Ezt mindenképpen fontos szem előtt tartani a biopszia indikációjának felállításakor.
Eredményeink alapján a páciensek prosztatamérete is befolyásolta a mintavételek kimenetelét. Vizsgálataink szerint a negatív szövettani eredményt adó biopszián átesett betegek prosztata mérete nagyobb volt, mint azon pácienseké, akiknél malignitás igazolódott. Ennek a hátterében részben az állhat, hogy a jóindulatú prosztatamegnagyobbodás önmagában is okozhat PSA-szint-emelkedést, amely fals irányba terelheti a biopszia indikációját (20). Továbbá a nagyméretű prosztata lényegesen megnehezíti az MR-felvétel és a real time ultrahangkép pontos kalibrálását, ebből eredően pedig a gyanús gócból történő célzott mintavételt is.
Következtetés
Összességében kezdeti eredményeink az mpMR fúziós biopsziák terén megegyezőek a nemzetközileg publikált adatokkal, ugyanakkor másik hazai munkacsoport által végzett beavatkozások eredményeitől elmaradtak. Az eltérő mintavételi technika, illetve más szoftver és eszközök használata állhat a különbségek hátterében. Tanulmányunkban vizsgált mindhárom betegcsoport esetében sikeresen alkalmaztuk a célzott mintavételt. Tapasztalataink alapján az MR által leírt elváltozások kisebb mérete, illetve a nagyobb prosztatavolumen rontotta a biopsziák detekciós rátáját, ugyanakkor a magasabb PI-RADS-besorolás és PSAD-érték, az extraprosztatikus terjedés jele, illetve a tranzicionalis zónából való kiindulás, növelte a mintavételeink sikerességét. A jövőben ezen tényezőket szem előtt tartva fogjuk kiválasztani azokat a pácienseket, akik a legtöbbet profitálhatnak a beavatkozásból.
Irodalom
1. Bray F, Ferlay J, Soerjomataram I, et al. Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. American Cancer Society Journals 2018; 68: 394–424. https://doi.org/10.3322/caac.21492
2. Kenessey I, Dobozi M, Kiss É, és mtsai. Nemzeti Rákregiszter. 2021. www.onkol.hu/nemzeti-rakregiszter/
3. Xue J, Qin Z, Cai H, et al. Comparison between transrectal and transperineal prostate biopsy for detection of prostate cancer: a meta-analysis and trial sequential analysis. Oncotarget 2017; 8: 23322–23336.
https://doi.org/10.18632/oncotarget.15056
4. Puech P, Rouvière O, Renard-Penna R, et al. Prostate Cancer Diagnosis: Multiparametric MR-targeted Biopsy with Cognitive and Transrectal US-MR Fusion Guidance versus Systematic Biopsy – Prospective Multicenter Study. Radiology 2013; 268: 461–469.
https://doi.org/10.1148/radiol.13121501
5. Géczi L, Kásler M, Gödény M, és mtsai. Prosztatarák – Gyakorlati kézikönyv / Képalkotók szerepe a prosztatarák vizsgálatában. Zafír Press 2013: 71–88.
6. Djavan B, Remzi M, Schulman C, et al. Repeat prostate biopsy: who, how and when? A review. European Urology 2002; 42: 93–103.
https://doi.org/10.1016/S0302-2838(02)00256-7
7. Peltier A, Aoun F, El-Khoury F, et al. 3D versus 2D Systematic Transrectal Ultrasound-Guided Prostate Biopsy: Higher Cancer Detection Rate in Clinical Practice. Prostate Cancer 2013; 2013:783243.
https://doi.org/10.1155/2013/783243
8. Costa D, Pedrosa I, Donato F, et al. MR Imaging-Transrectal US Fusion for Targeted Prostate Biopsies: Implications for Diagnosis and Clinical Management. RadioGraphics 2015; 35: 696–708.
https://doi.org/10.1148/rg.2015140058
9. Pepe P, Pepe G, Garufi A, et al. Cost-effectiveness of Multiparametric MRI in 800 Men Submitted to Repeat Prostate Biopsy: Results of a Public Health Model. Anticancer Research 2018; 38: 2395–2398.
https://doi.org/10.21873/anticanres.12489
10. Peltier A, Aoun F, Lemort M, et al. MRI-Targeted Biopsies versus Systematic Transrectal Ultrasound Guided Biopsies for the Diagnosis of Localized Prostate Cancer in Biopsy Naive Men. BioMed Research International. 2015; 2015: 571708. https://doi.org/10.1155/2015/571708
11. Venderink W, Bomers J, Overduin C, et al. Multiparametric Magnetic Resonance Imaging for the Detection of Clinically Significant Prostate Cancer: What Urologists Need to Know. Part 3: Targeted Biopsy. Europen Urology 2020; 77: 481–490.
https://doi.org/10.1016/j.eururo.2019.10.009
12. Goldberg H, Ahmad A, Chandrasekar T, et al. Comparison of Magnetic Resonance Imaging and Transrectal Ultrasound Informed Prostate Biopsy for Prostate Cancer Diagnosis in Biopsy Naive Men: A Systematic Review and Meta-Analysis. The Journal of Urology 2020; 203: 1085–1093. https://doi.org/10.1097/JU.0000000000000595
13. S, ahin A, Ceylan C, Gazel E, et al. Three different anesthesia techniques for a comfortable prostate biopsy. Urology Annals. 2015; 7(3): 339–344.
14. Benelli A, Vaccaro C, Guzzo S, et al. The role of MRI/TRUS fusion biopsy in the diagnosis of clinically significant prostate cancer. Therapeutic Advances in Urology 2020; 12: 1–8.
https://doi.org/10.1177/1756287220916613
15. Hüttl AB, Korda DÁ, Lénárd MZs, et al. Kezdeti tapasztalataink az mpMR fúziós ultrahangvezérelt prosztatabiopsziával. Orvosi Hetilap 2020; 161(52): 2188–2194. https://doi.org/10.1556/650.2020.31942
16. Drost FJH, Osses DF, Nieboer D, et al. Prostate MRI, with or without MRI-targeted biopsy, and systematic biopsy for detecting prostate cancer. Cochrane Database of Systematic Reviews 2019; 4: CD012663.
https://doi.org/10.1002/14651858.CD012663.pub2
17. Wegelin O, Exterkate L, van der Leest M, et al. The FUTURE Trial: A multicenter randomised controlled trial on target biopsy techniques based on magnetic resonance imaging in the diagnosis of prostate cancer in patients with prior negative biopsies. Europen Urology 2019; 75: 582–590. https://doi.org/10.1016/j.eururo.2018.11.040
18. Israel B, van der Leest M, Sedelaar M, et al. Multiparametric Magnetic Resonance Imaging for the Detection of Clinically Significant Prostate Cancer: What Urologists Need to Know. Part 2: Interpretation. Europen Urology 2020; 77: 469–480. https://doi.org/10.1016/j.eururo.2019.10.024
19. Yusim I, Krenawi M, Mazor E, et al. The use of prostate specifc antigen density to predict clinically signifcant prostate cancer. NatureResearch Scientific Reports 2020; 10: 20015.
https://doi.org/10.1038/s41598-020-76786-9
20. Bo M, Ventura M, Marinello R, et al. Relationship between Prostatic Specific Antigen (PSA) and volume of the prostate in the Benign Prostatic Hyperplasia in the elderly. Critical Reviews in Oncology/Hematology 2003; 47(3): 207–211. https://doi.org/10.1016/S1040-8428(03)00094-5