First-line treatment of prostate cancer by disease stage and risk classification – review article
DOI: 10.22591/magyurol.2021.4.fazekasf.163
Authors:
Fazekas Fruzsina dr.1, Maráz Anikó dr.2, Lakosi Ferenc dr.3,
Buzogány István dr.1, Beöthe Tamás dr.1
1Dél-pesti Centrumkórház, Péterfy Sándor Kórház-Rendelőintézet és Manninger Jenő Országos Traumatológiai Központ, Urológiai Osztály, Budapest (osztályvezető: Buzogány István dr.)
2Szegedi Tudományegyetem, Onkoterápiás Klinika, Szeged (igazgató: Oláh Judit dr.)
3Kaposi Mór Oktató Kórház Dr. Baka József Diagnosztikai és Onkoradiológiai Központ,Onkoradiológiai Részleg, Kaposvár (osztályvezető: Lakosi Ferenc dr.)
Summary
The treatment of prostate cancer has changed radically in the last two decades; a trend that continues to this day. In localised, low risk cases treatment can be deferred (active surveillance) and therefore adverse effects can be avoided or delayed. Curative interventions (surgery or radiotherapy) can be offered to patients with more extensive disease, thus increasing the number of patients recovered. More and more treatment steps can be offered in metastatic prostate cancer consequently increasing patient survival and quality of life. Complex and combined treatments are essential at every stage for optimal results. Appropriate management plan at first presentation can add multiple asymptomatic years and increase overall survival. Involvement of a multidisciplinary cancer care team is therefore crucial before starting any oncology treatment.
LAPSZÁM: MAGYAR UROLÓGIA | 2021 | 33. ÉVFOLYAM, 4. SZÁM
Összefoglalás
A prosztatadaganat kezelése az elmúlt két évtizedben gyökeresen megváltozott, sőt ez a változás jelenleg is zajlik.
A szervre lokalizált alacsony rizikójú betegek kezelésének halasztásával (aktív surveillance) elkerülhetőek, de legalább halaszthatóak a szövődmények. A kuratív célú műtéti és sugárterápiás beavatkozások egyre kiterjedtebb prosztatadaganatok esetén alkalmazhatóak, így növekszik a gyógyult betegek aránya. A metasztatikus esetekben egyre több kezelési lépcső alkalmazható, ezzel növekszik a betegek túlélése, ráadásul ezt az időt jobb életminőséggel tölthetik.
Mindezekhez a pozitív változásokhoz elengedhetetlen, hogy minden stádiumban komplex, kombinált kezelésekben gondolkozzunk. A betegek első jelentkezésekor felállított terápiás terv meghatározó, mert a megfelelő kezelési irány hosszabb élettartamot, több tünet- és panaszmentes évet jelent. Nagyon fontos ezért, hogy bármely kezelés megkezdése előtt a kezelőorvos által javasolt terápiás tervről onkoteam döntsön.
Bevezetés
A prosztatadaganatban szenvedő beteg sorsát alapvetően meghatározza a betegség felismerésekor meghatározott kezelési útvonal. Mivel a prosztatarák nem gyors lefutású, érdemes minden szükséges vizsgálatot a végleges kezelés megkezdése előtt elvégezni. A terápiás tervet ezek együttes figyelembevételével kötelezően onkoteam határozza meg, de a terápiás javaslatot a kezelőorvos terjeszti fel (1).
A stádium és a kockázati beosztáshoz szükséges kötelező vizsgálatok:
- általános állapot (ECOG-státusz) (2),
- PSA (3),
- rectalis digitális vizsgálat (4),
- szövettani eredmény (Gleason Score/ISUP Grade meghatározással) – amennyiben a szövettani eredmény nem prosztatabiopsziából származik, megfontolandó a prosztatabiopszia pótlólagos elvégzése is (5),
- multiparametrikus prosztata MRI (6).
Távoli metasztázisok vizsgálata: - csontszcintigráfia (7),
- (mellkas)-has-kismedence kontrasztanyagos CT (8),
- speciális indikációval: Cholin-, illetve PSMA PET CT (9, 10).
Amennyiben a kockázati besorolás alapján szervre lokalizált, alacsony kockázatú betegséget véleményezünk, a távoli metasztázisok vizsgálatai nem kötelezőek. Minden más esetben – ha kontraindikáció nem áll fenn – a csontszcintigráfia és a hasi-kismedencei kontrasztanyagos CT együttes elvégzése indokolt (11).
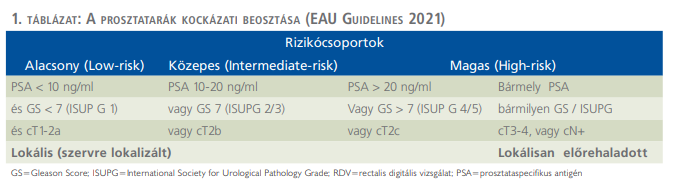
Kockázati besorolás az Európai Urológus Társaság irányelvei alapján
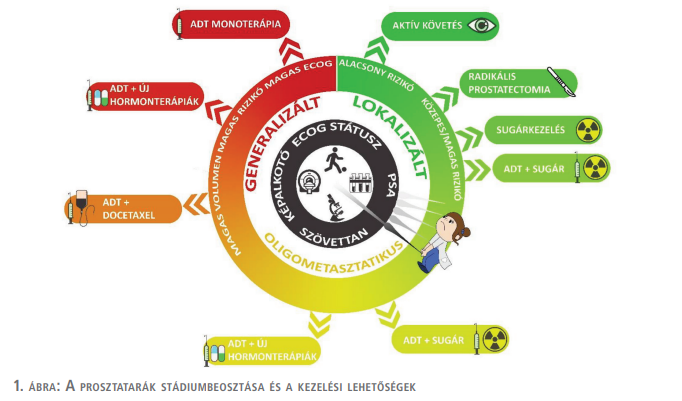
A vizsgálatok eredményei alapján sorolható a beteg a különböző stádium és kockázati csoportok valamelyikébe (1. ábra). Nagyon fontos kiemelni, hogy a megfelelő kockázati csoportbesorolás alapján kiválasztott terápia alapvetően meghatározza a beteg további sorsát.
Az első eldöntendő kérdés a terápia megkezdése előtt: van-e TÁVOLI METASZTÁZIS?
1. NINCS – a szervre lokalizált prosztatadaganatokat a PSA-érték, a cT-stádium (RDV, CT, mpMRI) és a Gleason/ISUP-érték alapján kockázati csoportokba soroljuk (1. táblázat).
2. NINCS, DE – lokálisan kiterjedt folyamatot (cT3-4), vagy regionális nyirokcsomóáttétet látunk (1. táblázat).
3. VAN TÁVOLI ÁTTÉT – ezeket a betegeket az áttétek száma, elhelyezkedése és a Gleason/ISUP-érték alapján csoportosíthatjuk (1. ábra).
A kockázati besorolás mellett nagyon fontos, hogy felmérjük a beteg általános állapotát. A legtöbb kezelés csak jó (ECOG 0-1) állapot mellett alkalmazható. Ne felejtkezzünk meg arról, hogy egy gyenge beteg számára a kezelés is megterhelő, ráadásul – a betegség lassú lefolyása miatt – életkilátásait sem fogja feltétlenül javítani. Ezt a kezelési terv felállításakor mindig mérlegelni kell!
Az egyes kockázati csoportok terápiás lehetőségeit külön tárgyaljuk. Érdemes megfigyelni, hogy az elmúlt évtizedben nem csupán a terápiás lehetőségek bővültek, hanem a betegek kezelési terve is változott. A legalacsonyabb kockázati csoportban ma már inkább megfigyelési csoportba (aktív surveillance) helyezzük az arra alkalmas beteget, és csak a daganat progressziója esetén indítunk aktív kezelést. Ugyanakkor a kuratív kezeléseket egyre magasabb stádiumokra is kiterjesztjük (pl. a lokálisan előrehaladott vagy az oligometasztatikus csoportra).
Az aktív beavatkozás a legtöbb esetben komplex, több kezelési lehetőség épül egymásra, vagy követi egymást, ezért fontos, hogy erről a beteget még a terápiás terv felállításakor tájékoztassuk. Tudnia kell, hogyha több különböző kezelésre lehet szükség, egyidejűleg a több lehetőség nagyobb reményt is adhat a gyógyulásra, vagy a hosszabb idejű túlélésre.
Nevezéktan
- „De novo” metasztatikus prosztatadaganat – ha az áttétek már a daganat felismerésekor jelen vannak (másik lehetőség, hogy az áttétek kuratív kezelés után relapszusként jelennek meg).
- „Metastatic hormone-naive prostate cancer” (mHNPC) – metasztatikus, hormonmegvonásban (ADT) még nem, vagy legfeljebb 3 hónapja részesült prosztatadaganat (LATITUDE-vizsgálat használta először) (12).
- „Metastatic hormone-sensitive prostate cancer” (mHSPC) – metasztatikus, hormonmegvonásra érzékeny prosztatadaganat (TITAN-vizsgálat használta először) (13).
- „Nonmetastatic castration resistant prostate cancer” (nmCRPC) kasztrációrezisztens prosztatadaganat; hormonmegvonás mellett biokémiai relapszus alakul ki, de nincs hagyományos képalkotó vizsgálattal kimutatható áttét. A PSA duplázódási idő (PSADT) n „Metastatic castration resistant prostate cancer” (mCRPC) – metasztatikus, kasztrációrezisztens prosztatadaganat; hormonmegvonás mellett biokémiai, vagy radiológiai progresszió alakul ki.
- „Nagy volumenű, igen kiterjedt (high volume)” metasztatikus prosztatadaganat – ≥4 helyen mutatható ki csontáttét, amelyek közül legalább egy kívül esik a gerincen és a medence csontjain, és/vagy visceralis metasztázis azonosítható (CHAARTED-vizsgálatban alkalmazott definíció) (14, 15).
- „Magas rizikójú” (high risk) metasztatikus prosztatadaganat – az alábbi három kritériumból kettő teljesülése kimeríti a definíciót:
– 3 ≤csontmetasztázis,
– visceralis metasztázis,
– GS ≥8 (LATITUDE-vizsgálat definíciója) (15). - „Oligometasztatikus” prosztatadaganat – „kevés” metasztázis van jelen, de pontos definíciója vitatott; általában 3, vagy annál kevesebb áttétel esetére értjük (15,16, 17).
A szervre lokalizált prosztatarák és kezelése
Összefoglalás: Szervre lokalizált daganatoknál, az alacsony kockázati csoportba tartozó betegeknél aktív surveillance (AS) javasolt a túlkezelés elkerülése végett. Szigorúan megválogatott esetekben a közepes kockázati csoport egyes eseteiben is felajánlható az AS, ám itt a nyomonkövetés szabályai még szigorúbbak (18). A közepes kockázati csoport fennmaradó részében és a magas rizikójú, valamint a lokálisan előrehaladott prosztatarák esetében az azonnali aktív kezelés – radikális prostatectomia, vagy sugárterápia – szükséges. Szervre lokalizált daganatok esetében az önálló gyógyszeres kezelés ellenjavallt (19)!
A szervre lokalizált, alacsony kockázati csoportba tartozó betegek esetében amennyiben nem részesülnek aktív kezelésben, 10 éves követés után kevesebb, mint 6%-ban fedezhető fel a betegség progressziója (20).
Ezeknél a betegeknél az aktív kezelés – és az azzal járó legtöbb szövődmény – átmenetileg biztonsággal halasztható. Az esetek mintegy fele kerül végül aktív kezelésre, ám ezek a betegek is több, a kezelés szövődményeitől mentes évet nyernek (21, 22).
Szervre lokalizált, alacsony kockázati csoportba tartozó betegek számára fel kell ajánlani az AS lehetőségét (19). A betegeknek tudniuk kell, hogy nem kezelés nélkül maradnak, hanem majd abban az időpontban tervezzük elvégezni a beavatkozást, amikor a betegségük előrelép, vizsgálati eredményeiben progresszió észlelhető, de még ugyanolyan biztonságosan és teljes mértékben meggyógyíthatóak, mintha azonnal elkezdődött volna terápiájuk (22). A betegség progressziója kisebb veszélyt jelent, mint a haladéktalanul elvégzett kezelés esetleges szövődményei.
Szigorú utánkövetés során javasolt vizsgálatok:
- 3-6 havonta PSA-ellenőrzés,
- évente RDV,
- 6 havonta mpMRI,
- 6-12 hónapnál ismételt biopszia szükséges (lehetőleg multiparametrikus prosztata-MRI alapján), későbbiekben a szövettani mintavétel ismétlése 3-5 évente javasolt (23).
Amennyiben az AS során a betegség progressziójára van gyanú, haladéktalanul aktív kezelésben kell részesíteni a beteget. Progressziót elsősorban a PSA-érték emelkedése, a Gleason/ISUP-érték növekedése (biopszia), a daganatos terület növekedése (biopsziás mintákban vagy mpMRI-vizsgálat során) jelent – különösen, ha az eredmények alapján a kockázati besorolásban „csoportugrás” következik be, vagyis a beteg a közepes kockázati csoportba kerül (23). A vizsgálati eredmények alapján a kockázati csoportbesorolás újraértékelését minden kontroll után el kell végezni.
A közepes kockázati besorolású Gleason Score 3+4/ ISUP 2-es szövettani eredményű betegek is választhatják az AS-t nagyon kis kiterjedésű daganat esetén (20). Ilyenkor a magasabb kockázatról a betegeket fel kell világosítani (19).
Természetesen a szigorú megfigyelés alatt álló betegek bármikor dönthetnek úgy, hogy aktív kezelést választanak (függetlenül az eredményektől) (21).
A terápiás terv felállítása során a beteget a kezelési alternatívákról részletesen fel kell világosítani és a véleményét figyelembe kell venni.
A tájékoztatásnak feltétlenül tartalmaznia kell, hogy a vizsgálatok alapján a kuratív kezelési lehetőségek – a radikális prostatectomia és a sugárterápia – onkológiai eredményessége azonos, valamint minden kezelési forma szövődményekkel járhat (19).
Fiatal, igen jó általános állapotú beteg esetén előnyösebbnek tűnik a műtéti megoldás, különösen abban az esetben, ha a páciens retteg a rosszindulatú betegségtől. Magas kockázatú esetekben fontos elmondanunk, hogy a műtét mellett még kiegészítő sugárkezelésre, illetve gyógyszeres kezelésre is szükség lehet.
Idősebb, több társbetegségben szenvedő betegek esetében, ha a műtét túl nagy megterheléssel jár, előtérbe kerülhet a sugárterápia.
A szervre lokalizált, közepes, vagy magas kockázati csoportba sorolt, illetve lokálisan előrehaladott daganattal felismert betegeknél kuratív szándékú kezelés szükséges (19).
Műtéti megoldás
A radikális prostatectomia célja a daganat maradéktalan eltávolítása a szervezetből, amelynek során a teljes prosztata a benne futó húgycsővel és az ondóhólyagokkal együtt, illetve – ha indokolt – a kismedencei nyirokcsomó-régiók eltávolításra kerülnek (19).
A műtét retropubikus behatolásból, nyílt, laparoszkópos vagy robotasszisztált technikával egyaránt elvégezhető. A három technika között onkológiai, funkcionális eredmények és szövődmények tekintetében nincs szignifikáns eltérés (24). Perineális megközelítésből a nyirokcsomó-régiók nem elérhetőek, ezért ezt a technikát mára szinte egyáltalán nem alkalmazzák (25).
A közepes kockázati besorolású betegeknek felajánlható az idegkímélő műtét, amennyiben a daganat tokon kívüli terjedésének valószínűsége alacsony (26, 27). Ennél a betegcsoportnál kiterjesztett kismedencei nyirokcsomó-eltávolítást kell végezni abban az esetben, ha a nyirokcsomó-pozitivitás valószínűsége az 5%-ot meghaladja (28). A magas kockázati csoportba tartozó, illetve lokálisan előrehaladott daganat esetén szintén kiterjesztett kismedencei lymphadenectomia indokolt (28).
Sebészeti kezelést megelőző ADT-kezelés megítélése ellentmondásos. A neoadjuváns ADT- (NAADT) kezelés csökkenti a pozitív sebészi szél rizikóját, ugyanakkor technikailag nehezebbé teszi a műtétet, és az eddig rendelkezésre álló adatok szerint nem növeli az onkológiai eredményességet. A NAADT jelenleg nem ajánlott, de elfogadott – fontos, hogy alkalmazásáról a radikális prostatectomiát végző urológus döntsön (29).
Már a kezelési terv felállításakor tájékoztatni kell a betegeket a műtéti megoldás két leggyakoribb hosszú távú szövődményéről: inkontinencia az esetek mintegy 20%-ában, merevedési zavar (ha nincs lehetőség idegkíméletre) kb. 70%-ban fordul elő (30).
Sugárterápia
A sugárterápia során a teljes daganatos prosztata és az ondóhólyag, magas kockázatú, lokálisan előrehaladott esetekben, vagy ha nyirokcsomó-pozitivitás merül fel, a regionális nyirokrégiók sugárkezelése is megtörténik.
A radioterápia történhet külső sugárforrásból (ún. külső sugárterápia) valamint a prosztatába ültetett izotópok segítségével, ez utóbbit brachiterápiának nevezünk (19).
A kuratív külső sugárterápia során hagyományos napi dózisokkal (2 Gy/nap) magas, összesen 76-80 Gy dózis kerül leadásra. Ez 7,5-8 hét kezelési időt jelent (31). A hipofrakcionált kezelés során a napi dózis nagyságát mérsékelten növeljük, és így a kezelések hossza 4-5 hétre csökkenthető (20×3 Gy, 28×2,5 Gy) (31, 32). Mára ez is standardkezeléssé lépett elő; speciális formája a sztereotaxiás besugárzás, ahol még nagyobb napi dózisok adhatók le, miközben a környező szövetek maximálisan megkímélhetők (33).
Brachiterápia során transrectalis UH-vezérlés mellett a gáton keresztül bevezetett tűkön át radioaktív izotópot jutattunk a prosztatába. Alkalmazhatunk magas dózisrátával történő brachiterápia esetén 192 Ir, vagy tartós beültetés során 125 I vagy 103 Pd izotópot. Alacsony és kedvező prognózisú közepes kockázatú betegeknél monoterápiában is alkalmazható, de lehetséges a két technika kombinációja is (19, 34).
A brachiterápia előnye, hogy egynapos kezelésként végezhető, a prosztatában magas sugárdózis koncentrálódik, a rizikószervek maximális védelme biztosított. Valamennyi sugárterápiás módszer közül a legjobb potenciamegőrző.
A sugárterápia leggyakoribb akut mellékhatása (technikától függetlenül) a húgycső- és a hólyagalap gyulladása, ami obstruktív és irritatív tüneteket is okozhat. A kezelés hatására hasmenés, hasi görcsök és gyakori sürgető székelési ingerek jelentkezhetnek, és ritkán hosszú távon is fennmaradhatnak. Húgycsőszűkület, radiogén hólyaggyulladás vagy végbélgyulladás előfordulhat, gyakorisága az évek elteltével emelkedik, de a progrediáló fekélyek, sipolyok aránya extrém ritka (35, 36, 37).
Fontos kiemelni, hogy a sugárkezelés tolerálhatósága nagyban függ a beteg vizelési képességétől. Obstruktív vagy irritatív panaszok mellett végzett sugárkezelés rontja a vizelési képességet, fokozza a tüneteket rövid és hosszútávon egyaránt (38). A sugárkezelés előtt a beteg vizelési képességét helyre kell állítani, panaszait rendezni szükséges, vagy a radikális műtéti alternatívában kell gondolkodni.
A műtétet követően a lokálisan előrehaladott, nem szervre lokalizált, közepes vagy annál magasabb rizikójú daganatok esetében, amennyiben a PSA NADÍR 0,01 ng/ml körüli értéket mutat, 2 hónappal a műtétet követően, halasztott (salvage), ellenkező esetben azonnali kiegészítő sugárkezelést kell végezni (19).
Szervre lokalizált prosztatadaganat esetén fontos kérdés, hogy mi történjen azokkal a betegekkel, akiknél a kuratív kezelés indokolt, de sem műtéti, sem sugárkezelésre nem alkalmasak. Gyógyszeres kezelés (ADT) ezen esetekben csak akkor indítható, ha a daganat lokálisan előrehaladott, kiemelten magas rizikójú, vagy nyirokcsomó-áttéteket igazoltunk. Alacsony, közepes, akár magas kockázat esetén önmagában gyógyszeres kezelés nem indítható (12, 14).
A generalizált prosztatarák elsővonalbeli kezelése
Összefoglalás: Generalizált prosztatarákban alapvető az ADT alkalmazása, amely a szérumtesztoszteron-érték kasztrációs szinten tartását célozza.
Huggins, Hodges és Scott 1941-ben bizonyították előrehaladott prosztatadaganat az androgéndepriváció hatékonyságát (39). Ezt a felismerést 1966-ban fiziológiai és orvosi Nobel-díjjal jutalmazták.
A következő évtizedekben a metasztatikus daganat kezelésére gyakorlatilag egyetlen lehetőségünk volt: az androgén hormonszint csökkentése (40). Az ezredforduló után ez a helyzet megváltozott, számos új terápiás lehetőség jelent meg; sőt jelenik meg folyamatosan. A „hagyományos” androgéndepriváció továbbra is részét képezi a kezelésnek, de önmagában ma már csak ritkán alkalmazható (12, 14, 41–48). Az ezredforduló előtt a hormonmegvonás után várható túlélés mindössze egy év volt (40). Az új kezeléseknek köszönhetően – ha azokat időben indítjuk –, ma a várható átlagos túlélés meghaladja az 5 évet (12, 48).
Androgéndepriváció – mindig szükséges!
A metasztatikus prosztatarákos betegeknél a progresszió lassítása érdekében elengedhetetlen a tesztoszteronszint markáns csökkentése, kasztrációs szinten tartása (SeT A gold standardnak számító bilaterális orchiectomia során a mindkét oldali működő hereállomány kerül eltávolításra. A műtét egyszerű, gyors, akár helyi érzéstelenítésben is elvégezhető, és végleges megoldást jelent a megfelelő tesztoszteronszint elérésére (49). A betegek egy része nagy lelki megterhelésként éli meg a herék elvesztését, nekik a kémiai kasztráció jelenthet megoldást.
Az LHRH-agonisták nagy affinitással kötődnek az agyalapi mirigy LHRH-receptoraihoz. Folyamatos, erős stimulust létrehozva elnyomják a szervezet normális, pulzáló dinamikájú LHRH-termelését.
Ezek a gyógyszerek első alkalmazásukkor erős tesztoszteronszint-emelkedést – tesztoszteron-flare – hoznak létre (51). Néhány nap elteltével az LH-receptor downregulációja következtében kialakul a kívánt alacsony tesztoszteronszint.
LHRH-agonista gyógyszerek:
- buserelin,
- goserelin,
- leuprolelin,
- triprotelin.
A szakirodalom nem tesz különbséget a különböző LHRH-agonisták hatékonysága között (52).
Az LHRH-antagonisták nem hoznak létre kezdeti tesztoszteronszint-emelkedést, mert azonnal gátolják az LHRH-receptorokat, így a kasztrációs hormonszint gyorsan kialakul (19). A betegek egy része rosszul tolerálja a havonta adandó, esetenként fájdalmas subcutan injekciókat, ilyen esetben érdemes a beteget 3 havi LHRH-agonista gyógyszerre átállítani. Egyes szakirodalmi adatok szerint azonban az LHRH-antagonisták használata kedvezőbb lehet a PSA-emelkedés-mentes túlélés szempontjából (53).
Egyetlen LHRH-antagonista szer áll rendelkezésre:
- degarelix.
A degarelix elsőként választandó, biztonságosabb alternatíva kardiovaszkulárisan terhelt betegek esetében (54).
Az antiandrogén hatású szerek a periférián hatnak, az androgének kompetitív antagonistái. Alkalmazásuk ma háttérbe szorult. Generalizált prosztatadaganat esetén az LHRH-agonista kezelés bevezetésekor, a kezdeti tesztoszteron-flare elkerülésére, legfeljebb egy hónapig szükségesek (19, 51).
Az európai kezelési irányelvek szerint antiandrogén monoterápia metasztatikus prosztata-gyógyszerek:
- bicalutamid,
- flutamid,
- nilutamid,
- cyproteron.
A gold standardnak számító folyamatos ADT-kezelés hőhullámokat, szexuális zavarokat és egyéb életminőséget rontó mellékhatásokat – pl. osteoporosis, izomvesztés, növekvő kardiovaszkuláris rizikó, demencia – okozhat (55). A terápiára jól reagáló, súlyos mellékhatásoktól szenvedő betegeknek jó alternatívát jelenthet az intermittáló ADT-kezelés. Egyes szakirodalmi adatok szerint azonban az intermittáló kezelés rövidebb túléléshez vezethet (56).
Oligometasztatikus prosztatarák
Az onkológiai dogma szerint a lokalizált és a generalizált daganat két eltérő állapot, amely különböző kezelést igényel (1956 Keynes, 1980 Fischer). Ezzel szemben az ún. „spektrumterápia” hívei azt állítják, hogy a két állapot között folyamatos átmenet van, a daganat folyamatosan „fejlődik” (1894 Halstead, 1995 majd 2011 Hellmann és Weichselbaum). Ez azt jelenti, hogy létezik korai, kevés metasztázissal járó állapot, és létezik a már sok kialakult áttétet adó, késői állapot. A korai állapotot ma durva megközelítéssel az áttétek alacsony száma alapján különítjük el, és oligometasztatikus daganatnak nevezzük (16, 17).
Az oligometasztázis nem pontosan definiált a szakirodalomban, prosztatadaganat esetén pedig elméleti átfedést is találhatunk a „magas rizikójú” és a „magas volumenű” csoporttal. Ugyanakkor a gyakorlatban szerencsére a legtöbb esetben jól elkülönül a rengeteg áttétel és a csupán egy-két csontmetasztázissal rendelkező betegek csoportja.
Prosztatadaganat oligometasztatikus eseteiben igazolt, hogy a primer daganat eliminálása, illetve a metasztázisok kezelése eredményes, és javítja a beteg túlélési esélyeit. Bár más kezelési opciókkal (pl. műtét) elért eredmények is biztatónak tűnnek, a sugárkezelés túlélést növelő hatékonysága a prosztatadaganat oligometasztatikus eseteiben egyértelműen igazolt (57, 58).
A sugárkezelés előtt a kivizsgálás részeként PSMA- vagy Cholin PET/CT javasolt. Ezek a vizsgálatok jóval érzékenyebbek a hagyományos képalkotó modalitásoknál (59, 60).
Az ún. „alacsony volumenű” (Charteed) mHSPC esetén a prosztata radioterápiája javítja a túlélést (61). Itt fontos megjegyeznünk, hogy ezekben a vizsgálatokban „csak” a prosztata volt irradiálva, de a metasztatikus nyirokcsomók nem. Ugyanakkor szinkron áttétek esetén valamennyi lézió kezelése megfontolandó. A vizsgálatok alapján a klinikai gyakorlatban limitált számú hormonérzékeny oligometasztázis mellett érdemes sztereotaxiás kezelést végezni. Érdekes, hogy a vizsgált betegek nem kaptak ADT-t, tehát a sugárkezelés akár hormonterápia nélkül is alkalmazható (62).
A metasztatikus prosztatarák elsővonalbeli gyógyszeres kezelése
Kemoterápia
Eisemberger 2004-ben igazolta, hogy a docetaxelkezelés meghosszabbítja a kasztrációrezisztens beteget túlélését (41). Logikusnak tűnt, hogy a korábban alkalmazott docetaxelkezelés előbb tudja támadni a tesztoszteron-független daganatos gócokat, illetve a betegek is jobb állapotúak, mint a progresszió után.
2015-ben a CHAARTED-vizsgálat igazolta, hogy az ADT-kezelés mellett korán alkalmazott docetaxelkezelés csökkenti a klinikai progressziót, és javítja a túlélést. Különösen kifejezett volt a különbség a „magas volumenű” betegek csoportjában, ahol a túlélés 17 hónappal növekedett az önmagában alkalmazott ADT-kezeléshez képest (14)!
A docetaxelkezelés ugyan onkológiai osztályokon történik, de elengedhetetlen, hogy az urológiai kivizsgálás során még az ADT-kezelés megkezdése előtt azonosítsuk a „magas volumenű” csoportba tartozó, jó állapotú betegeket. A két kezelést egyszerre szükséges indítani (legfeljebb 90 nap eltérés engedélyezett) (12, 14). Ha a beteg az elhúzódó vizsgálatok miatt kiesik ebből az időablakból, akkor egyúttal jelentős túlélési előnyt is veszít.
Androgénreceptor-targetáló terápia (ARTA)
Abirateron-acetát + prednizolon (ABI-P): a tesztoszteron szintézisét gátolja.
Az abirateron-acetátot mineralokortikoid mellékhatásai miatt minden esetben kis dózisú szteroiddal (prednizolon) együtt szükséges adni (19).
Kasztrációrezisztens prosztatadaganatban eredményességét először docetaxelkezelésen átesett betegeknél igazolták (44), később docetaxelkezelésben nem részesült betegek esetén is hatékonynak bizonyult (45).
Az eredmények alapján a kemo-naiv esetekben is logikusnak tűnt korábbra hozni a kezelést. 2017-ben a LATITUDE-vizsgálat igazolta, hogy az ADT-vel együtt kezdett abirateron-acetát-kezelés is eredményes, a „magas rizikójú” „de novo” áttétes betegek esetén a 3 éves teljes túlélés 49%-ról 66%-ra emelkedett, a halálozási rizikó 38%-kal csökkent (12).
A kezelés alapvető feltétele, hogy megkezdése az ADT beállításával együtt történjen (legfeljebb 90 napon belül), ezért a klinikai állapotfelmérő (staging) vizsgálatokat ebben az esetben is el kell végezni, bármilyen terápiás döntés előtt.
Mindkét kezelés hatékonysága bizonyított jó általános állapotú beteg újonnan felismert metasztatikus prosztatadaganata esetén (mHSPC), különösen, ha a beteg a „magas volumenű” (docetaxel) illetve a „magas rizikójú” (abirateron-acetát) kritériumainak megfelel (12, 14, 15). A korai docetaxel és a korai abirateron-acetát közötti összehasonlítás alapján a két kezelés között nem volt különbség a túlélésben (47). A kezelés onkoteam döntése alapján kezdhető meg, de csak az ADT beállításával egy időben, vagy rövid időn belül (12, 14). Éppen ezért kiemelten fontos, hogy az ADT-kezelés ne kezdődjön meg a vizsgálatok komplettálása és a végleges onkoteam döntése előtt.
Ha a beteg jó általános állapotú, kifejezetten aktív életet él, és megfelel a „magas rizikójú” kritériumoknak, akkor célszerűbb abirateron-acetát-kezelést ajánlani.
A „magas volumenű” daganattal rendelkező, jó állapotú (ún. kemo-fitt) betegek a docetaxelkezeléssel járnak jobban (12, 14, 47).
Fontos kiemelni, hogy nem a két kezelés között döntünk, hanem a két kezelés sorrendjét, szekvenciáját választjuk meg! Ez azt jelenti, hogy az abirateron-acetát-kezelésen átesett betegek docetaxelkezelésben, míg a docetaxelkezelésben részesül betegek abirateron-acetát-kezelésben részesülhetnek progresszió esetén (12, 47). Fontos a betegek figyelmét felhívni arra, hogy a teljes kezelés során több, egymás után következő kezelésben fognak részesülni; most csupán az első lépcső kiválasztása történik meg.
Éppen ezért arra is ügyelnünk kell, hogy csak kifejezetten jó állapotú betegnek ajánljunk abirateron-acetát-kezelést, aki az esetleges progresszió mellett várhatóan még alkalmas lesz kemoterápiára is.
Gyenge általános állapotú, tünetekkel rendelkező betegek várhatóan nem fognak profitálni a kombinációs kezelésből. Ezekben az esetekben – onkoteam döntés alapján – továbbra is az önmagában alkalmazott ADT-kezelés javasolt (19).
Új generációs androgénreceptor-blokkolók – „-lutamidok”:
- enzalutamid (ENZ),
- apalutamid (APA).
A jövőben várható a terápiás lehetőségek további bővülése. Az apalutamid és az enzalutamid két, új generációs hormonkészítmény – amelyek szintén az ARTA-csoportba tartoznak. A prosztatadaganat komplex kezelésében mindkét gyógyszer régóta szerepet kapott, azonban első vonali kezelésként hatékonyságukat csak most igazolták (13, 63). Mivel európai alkalmazási engedéllyel bírnak, Magyarországi alkalmazásuk is rövidesen várható, újonnan felismert, jó állapotú metasztatikus prosztatadaganat esetén (mHSPC).
A helyes terápiás szekvenciát Maráz és munkatársai 2020-ban a Magyar Onkológiában közzétett folyamatábra alapján javasolt indikálni (15).
Fontos kiemelni, hogy a gyógyszerek hatékonyságát minden metasztatikus prosztatadaganat esetén igazolták, így a jövőben (ezen készítmények alkalmazásakor) a „magas volumenű” és „magas rizikójú” esetek megkülönböztetése már nem lesz szükséges.
Következtetések
A prosztatarák komplex terápiájának indikációja minden esetben a betegség klinikai stádiuma, rizikóbesorolása és a beteg általános állapota, valamint óhaja alapján kerül meghatározásra. A prosztatarák multimodális kezelésével elért eredményekben az utóbbi években tapasztalt pozitív változásokhoz elengedhetetlen, hogy minden stádiumban komplex, kombinált kezelésekben gondolkozzunk. A betegek első jelentkezésekor felállított terápiás terv meghatározó, mert a megfelelő kezelési irány hosszabb élettartamot, több tünet- és panaszmentes évet jelent. Nagyon fontos ezért, hogy bármely kezelés megkezdése előtt a kezelőorvos által javasolt terápiás tervről onkoteam döntsön! Az adekvát terápia és annak a megfelelő evidenciákon alapuló szekvenciában történő alkalmazása már a kezelőorvos és az adott intézmény onkológiai bizottságának felelőssége. Amennyiben helyes konszenzus alapján, megfelelő kezelési stratégia szerint zajlik a terápia, a korábbi évtizedek gyakorlatával összehasonlítva akár 5-10 éves előnyt élvezhetnek az egyébként szomorú sorsra ítélt áttételes prosztatadaganatos betegek, ráadásul ezt az időt jobb életminőséggel tölthetik.
References
1. Kásler M, Ottó Sz, Kenessey I. A rákmorbiditás és -mortalitás jelenlegi helyzete a Nemzeti Rákregiszter tükrében. Orv hetil 2017; 158: 84–89. http://dx.doi.org/10.1556/650.2017.30654
2. Oken MM, Creech RH, Tormey DC et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5: 649–655. https://doi.org/10.1097/00000421-198212000-00014
3. Stamey TA, Yang N, Hay AR et al. Prostate-specific antigen as a serum marker for adenocarcinoma of the prostate. N Engl J Med 1987; 317: 909–916. https://doi.org/10.1056/NEJM198710083171501
4. Gosselaar C, Roobol MJ, Roemeling S et al. The role of the digital rectal examination in subsequent screening visits in the European randomized study of screening for prostate cancer ERSPC. Rotterdam Eur Urol 2008; 54: 581–588. https://doi.org/10.1016/j.eururo.2008.03.104
5. Zigeuner R, Schips L, Lipsky K et al. Detection of prostate cancer by TURP or open surgery in patients with previously negative transrectal prostate biopsies. Urology 2003; 62: 883–887.
https://doi.org/10.1016/s0090-429503.00663-0
6. Drost FH, Osses DF, Nieboer D et al. Prostate MRI, with or without MRI-targeted biopsy, and systematic biopsy for detecting prostate cancer. Cochrane Database Syst Rev 2019; 20194. CD012663.
https://dx.doi.org/10.1002%2F14651858.CD012663.pub2
7. Briganti A, Passoni N, Ferrari M et al. When to perform bone scan in patients with newly diagnosed prostate cancer: external validation of the currently available guidelines and proposal of a novel risk stratification tool. Eur Urol 2010; 57: 551–558. https://doi.org/10.1016/j.eururo.2009.12.023
8. Abuzallouf S, Dayes I, Lukka H et al. Baseline staging of newly diagnosed prostate cancer: a summary of the literature. J Urol 2004; 171: 2122–2127. https://doi.org/10.1097/01.ju.0000123981.03084.06
9. von Eyben FE, Kairemoet K. Meta-analysis of 11.C-choline and 18.F-choline PET/CT for management of patients with prostate cancer. Nucl Med Commun 2014; 35: 221–230. https://doi.org/10.1097/mnm.0000000000000040
10. Perera M, Papa N, Roberts M et al. Gallium-68 Prostate-specific membrane antigen positron emission tomography in advanced prostate cancer-updated diagnostic utility, sensitivity, specificity, and distribution of prostate-specific membrane antigen-avid lesions: A systematic review and meta-analysis. Eur Urol 2020; 77: 403–417. https://doi.org/10.1016/j.eururo.2019.01.049
11. Gabriele D, Collura, D, Oderdaet M et al. Is there still a role for computed tomography and bone scintigraphy in prostate cancer staging? An analysis from the EUREKA-1 database. World J Urol 2016; 34: 517–523. http://dx.doi.org/10.1016/S1569-905615.60915-0
12. Fizazi K, Tran N, Fein L et al. Abiraterone plus prednisone in metastatic, castration-sensitive prostate cancer. N Engl J Med 2017; 377: 352–360.
https://doi.org/10.1056/nejmoa1704174
13. Chi KN, Agarwal N, Bjartell A et al. Apalutamide for metastatic, castration-sensitive prostate cancer. N Engl J Med 2019; 381: 13–24.
https://doi.org/10.1056/nejmoa1903307
14. Sweeney CJ, Chen YH, Carducci M et al. Chemohormonal therapy in metastatic hormone-sensitive prostate cancer. N Engl J Med 2015; 373: 737–746. https://doi.org/10.1056/nejmoa1503747
15. Maráz A, Géczi L, Bíró K, Küronya Zs. Terápiás szekvenciák az előrehaladott/ áttétes prosztatadaganatok gyógyszeres kezelésében. Magyar Onkol 2020; 64: 263–272.
16. Ost P, Reynders D, Decaestecker K et al. Surveillance or metastasis-directed therapy for oligometastatic prostate cancer recurrence: a prospective, randomized, multicenter phase II trial. J Clin Oncol 2018; 36: 446–453. https://doi.org/10.1200/jco.2017.75.4853
17. Ost P, Bossi A, Decaestecker K et al. Metastasis-directed therapy of regional and distant recurrences after curative treatment of prostate cancer: a systematic review of the literature. Eur Urol 2015; 67: 852–863. https://doi.org/10.1016/j.eururo.2014.09.004
18. Chen RC, Rumble RB, Loblaw DA et al. Active surveillance for the management of localized prostate cancer Cancer Care Ontario Guideline. American Society of Clinical Oncology Clinical Practice Guideline Endorsement. J Clin Oncol 2016; 34: 2182–2190.
https://doi.org/10.1200/jco.2015.65.7759
19. Mottet N, Bellmunt J, Briers E, Bolla M, Bourke L et al. members of the EAU – ESTRO – ESUR –SIOG Prostate Cancer Guidelines Panel. EAU – ESTRO – ESUR – SIOG Guidelines on Prostate Cancer. Retrieved from: https://uroweb.org/guideline/prostate-cancer/2020.07.19
20. Rider JR, Sandin F, Andrén O et al. Long-term outcomes among noncuratively treated men according to prostate cancer risk category in a nationwide, population-based study. Eur Urol 2013; 63: 88–96.
https://doi.org/10.1016/j.eururo.2012.08.001
21. Tosoian JJ, Mamawala M, Epstein JI et al. Intermediate and longer-term outcomes from a prospective active-surveillance program for favorable-risk prostate cancer. J Clin Oncol 2015; 33: 3379–3385.
https://doi.org/10.1200/jco.2015.62.5764
22. Bruinsma SM, Roobol MJ, Carroll PR et al. Expert consensus document: Semantics in active surveillance for men with localized prostate cancer – results of a modified Delphi consensus procedure. Nat Rev Urol 2017; 14: 312–322.
23. Thomsen FB, Brasso K, Klotzet LH et al. Active surveillance for clinically localized prostate cancer–a systematic review. J Surg Oncol 2014; 109: 830–835. https://doi.org/10.1002/jso.23584
24. Ilic D, Evans SM, Allanet CA et al. Laparoscopic and robotic-assisted versus open radical prostatectomy for the treatment of localised prostate cancer. Cochrane Database Syst Rev 2017; 9: CD009625.
https://doi.org/10.1002/14651858.cd009625.pub2
25. Hatzinger M, Hubmann R, Moll F et al. The history of prostate cancer from the beginning to DaVinci.. Aktuelle Urol 2012; 43: 228–230.
https://doi.org/10.1055/s-0032-1324651
26. Neill MG, Louie-Johnsun M, Chabert C et al. Does intrafascial dissection during nerve-sparing laparoscopic radical prostatectomy compromise cancer control? BJU Int 2009; 104: 1730–1733.
https://doi.org/10.1111/j.1464-410x.2009.08670.x
27. Ward JF, Zincke H, Bergstralh EJ et al. The impact of surgical approach nerve bundle preservation versus wide local excision. on surgical margins and biochemical recurrence following radical prostatectomy. J Urol 2004; 172: 1328–1332. https://doi.org/10.1097/01.ju.0000138681.64035.dc
28. Briganti A, Larcher A, Abdollah F et al. Updated nomogram predicting lymph node invasion in patients with prostate cancer undergoing extended pelvic lymph node dissection: the essential importance of percentage of positive cores. Eur Urol 2012; 61: 480–487.
https://doi.org/10.1016/j.eururo.2011.10.044
29. Kumar S, Shelley M, Harrison C et al. Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. Cochrane Database Syst Rev 2006; CD006019. https://doi.org/10.1002/14651858.cd006019.pub2
30. Haglind E, Carlsson S, Stranne J et al. Urinary incontinence and erectile dysfunction after robotic versus open radical prostatectomy: a prospective, controlled, nonrandomised trial. Eur Urol 2015; 68: 216–225. https://doi.org/10.1016/j.eururo.2015.02.029
31. Dearnaley D, Syndikus I, Sumo G et al. Conventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol 2012; 13: 43–54. https://doi.org/10.1016/s1470-204511.70293-5
32. Gou, W., Sun, Y. C., Bi. J. Q. et al. Hypofractionated radiotherapy versus conventional radiotherapy in patients with intermediate- to high-risk localized prostate cancer: a meta-analysis of randomized controlled trials. BMC Cancer 2019; 19: 1063. https://doi.org/10.1186/s12885-019-6285-x
33. Mirabell R. Stereotactic body radiotherapy for prostate cancer: treatment approaches and clinical outcomes. J Radiosurg SBRT 2011; 1: 147–154.
34. Zamboglou N, Tselis N, Baltas D et al. High-dose-rate interstitial brachytherapy as monotherapy for clinically localized prostate cancer: treatment evolution and mature results. Int J Radiat Oncol Biol Phys 2013; 85: 672–678. https://doi.org/10.1016/j.ijrobp.2012.07.004
35. Matzinger O, Duclos F, van den Bergh A et al. Acute toxicity of curative radiotherapy for intermediate- and high-risk localised prostate cancer in the EORTC trial 22991. Eur J Cancer 2009; 45: 2825–2834.
https://doi.org/10.1016/j.ejca.2009.07.009
36. Hoskin P, Rojas A, Ostler P et al. High-dose-rate brachytherapy alone given as two or one fraction to patients for locally advanced prostate cancer: acute toxicity. Radiother Oncol 2014; 110: 268–271.
https://doi.org/10.1016/j.radonc.2013.09.025
37. King CR, Collins S, Fuller D et al. Health-related quality of life after stereotactic body radiation therapy for localized prostate cancer: results from a multiinstitutional consortium of prospective trials. Int J Radiat Oncol Biol Phys 2013; 87: 939–945. https://doi.org/10.1016/j.ijrobp.2013.08.019
38. Stone NN, Winoker JS, Kaplan SA et al. Factors influencing long-term urinary symptoms after prostate brachytherapy. BJU Int 2018; 122: 831–836.
https://doi.org/10.1111/bju.14365
39. Huggins C, Hodges C. Studies on prostatic cancer. I. The effect of castration, of estrogen and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. Cancer Res 1941; 1: 293–297.
40. Kantoff PW, Halabi S, Conaway M et al. Hydrocortisone with or without mitoxantrone in men with hormone-refractory prostate cancer: results of the cancer and leukemia group B 9182 study. J Clin Oncol 1999; 17: 2506–2513. https://doi.org/10.1200/jco.1999.17.8.2506
41. Tannock IF, de Wit R, Berry WR et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351: 1502–1512. https://doi.org/10.1056/nejmoa040720
42. De Bono JS, Oudard S, Ozguroglu M et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010; 376: 1147–1154.
https://doi.org/10.1016/s0140-673610.61389-x
43. Oudard S, Fizazi K, Sengeløv L et al. Cabazitaxel versus docetaxel as first-line therapy for patients with metastatic castration-resistant prostate cancer: a randomized phase III trial-FIRSTANA. J Clin Oncol 2017; 35: 3189–3197. https://doi.org/10.1200/jco.2016.72.1068
44. Fizazi K, Scher HI, Molina A et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 2012; 13: 983–992.
https://doi.org/10.1016/s1470-204512.70379-0
45. Ryan CJ, Smith MR, Fizazi K et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer COU-AA-302.: final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 2015; 16: 152–160. https://doi.org/10.1016/s1470-204514.71205–7
46. Beer TM, Armstrong AJ, Rathkopf D et al. Enzalutamide in men with chemotherapy-naïve metastatic castration-resistant prostate cancer: extended analysis of the phase 3 PREVAIL study. Eur Urol 2017; 71: 151–154. https://doi.org/10.1016/j.eururo.2016.07.032
47. James ND, Sydes MR, Clarke NW et al. Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer STAMPEDE: survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet 2016; 387: 1163–1177. https://doi.org/10.1016/s0140-673615.01037-5
48. James ND, de Bono JS, Spears MR et al. Abiraterone for prostate cancer not previously treated with hormone therapy. N Engl J Med 2017; 377: 338–351. https://doi.org/10.1056/nejmoa1702900
49. Desmond AD, Arnold AJ, Hastie KJ et al. Subcapsular orchiectomy under local anaesthesia. Technique, results and implications. Br J Urol 1988; 61: 143–145. https://doi.org/10.1111/j.1464–410x.1988.tb05063.x
50. Pagliarulo V, Bracarda S, Eisenberger MA et al. Contemporary role of androgen deprivation therapy for prostate cancer. Eur Urol 2012; 61: 11–25. https://doi.org/10.1016/j.eururo.2011.08.026
51. Bubley GJ. Is the flare phenomenon clinically significant? Urology 2001; 58: 5–9. https://doi.org/10.1016/s0090-429501.01235-3
52. Seidenfeld J, Samson DJ, Hasselblad V et al. Single-therapy androgen suppression in men with advanced prostate cancer: a systematic review and meta-analysis. Ann Intern Med 2000; 132: 566–577. https://doi.org/10.7326/0003-4819-132-7-200004040-00009
53. Crawford ED, Shore ND, Moul JW et al, Long-term tolerability and efficacy of degarelix: 5-year results from a phase III extension trial with a 1-arm crossover from leuprolide to degarelix, Urology 2014; 83: 1122–1128. https://doi.org/10.1016/j.urology.2014.01.013
54. Higano CS, Crawford ED, Shore ND et al. Risk of cardiovascular events with degarelix versus leuprolide after biochemical relapse of prostate cancer: Exploratory analysis of a randomized controlled trial. Journal of Clinical Oncology 2015; 33: 151–151. DOI: 10.1200/jco.2015.33.7_suppl.151
55. Kumar RJ, Barqawi A, Crawford ED et al. Adverse events associated with hormonal therapy for prostate cancer. Rev Urol 2005; 7: S37–S43. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1477613/
56. Hussain M, Tangen CM, Berry DL et al. Intermittent versus continuous androgen deprivation in prostate cancer. N Engl J Med 2013; 368: 1314–1325. https://doi.org/10.1056/nejmoa1212299
57. Heidenreich A, Pfister D, Porres D et al. Cytoreductive radical prostatectomy in patients with prostate cancer and low volume skeletal metastases: results of a feasibility and case-control study. J Urol 2015; 193: 832–838. https://doi.org/10.1016/j.juro.2014.09.089
58. Phillips R, Shi WY, Deek M et al. Outcomes of observation vs stereotactic ablative radiotherapy for oligometastatic prostate cancer. JAMA Oncol 2020; 6: 650–659. doi:10.1001/jamaoncol.2020.0147
59. Zschaeck S, Lohaus F, Becket M et al. PSMA-PET based radiotherapy: a review of initial experiences, survey on current practice and future perspectives. Radiat Oncol 2018; 11: 13:90. https://doi.org/10.1186/s13014-018-1047-5
60. López E, Lazo A, Gutiérrez A et al. Influence of 11.C-choline PET/CT on radiotherapy planning in prostate cancer. Rep Pract Oncol Radiother 2014; 20: 104–112. https://dx.doi.org/10.1016%2Fj.rpor.2014.11.008
61. Burdett, S., Boevé, L. M., Ingleby, F. C. et al. Prostate Radiotherapy for Metastatic Hormone-sensitive Prostate Cancer: A STOPCAP Systematic Review and Meta-analysis. Eur Urol 2019; 76: 115–124. https://doi.org/10.1016/j.eururo.2019.02.003
62. Palacios-Eito A, Béjar-Luque A, Rodríguez-Liñán M et al. Oligometastases in prostate cancer: Ablative treatment. World J Clin Oncol 2019; 10: 38–51. https://doi.org/10.5306/wjco.v10.i2.38
63. Davis ID, Martin AJ, Stockler MR et al. Enzalutamide with standard first-line therapy in metastatic prostate cancer. N Engl J Med 2019; 381: 121–131. https://doi.org/10.1056/nejmoa1903835