Demonstration of clinicopathological characteristics and clinical significance of rare intraductal prostate carcinoma detected in prostate needle biopsy
DOI: 10.22591/magyurol.2022.2.farkast.79
Authors:
Farkas Tamás dr.1, Szabó Balázs dr.1, Tordé Ákos dr.1, Tóth Zoltán dr.1, Salamon Ferenc dr.2
1Uzsoki Utcai Kórház, Urológiai Sebészeti Osztály, Budapest (osztályvezető: Tóth Zoltán dr.)
2Uzsoki Utcai Kórház, Patológia Osztály, Budapest (osztályvezető: Salamon Ferenc dr.)
Summary
Introduction: Intraductal carcinoma of the prostate (IDC-P) is a rare entity, which is characterized by prostatic carcinoma involving ducts and acini. This includes two biologically distinct diseases, named IDC-P associated with invasive carcinoma and the more rarely presented pure IDC-P which is a precursor of prostate cancer. Histological differential diagnosis is often challenging and out of atypical cribriform lesions it is crucial to separate it from high grade prostate intraepithelial neoplasia (HGPIN). The presence of IDC-P is associated with large tumour volume, high grade Gleason score and poor prognostic parameters.
Case report: In our case, the histopathological examination revealed pure intraductal carcinoma of the prostate after a transrectal ultrasound (TRUS) guided biopsy. After these findings, we decided to perform rebiopsy.
Conclusions: The proper differential diagnosis has a great clinical significance, because the different entities have different therapeutic and prognostic outcomes. Nevertheless, there is no consensus whether pure IDC-P in the needle biopsies should be managed with rebiopsy or radical treatment. IDC-P often associates with invasive prostate cancer, in other words pure IDC-P without invasive PCa is extremely rare, so the authors have concluded that presence of pure IDC-P in the needle biopsy sample requires close follow-up. A larger prospective study in the future would provide more accurate estimation of the incidence of IDC-P and may help to specify the independent predictive value of IDC-P thus guiding the clinical decision making.
LAPSZÁM: MAGYAR UROLÓGIA | 2022 | 34. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Bevezetés: Az intraduktális prosztatakarcinóma (IDC-P) egy ritkán előforduló szövettani entitás, amelynek jellemzője a prosztatikus daganatos sejtek duktuszokon/acinuszokon belüli terjedése. Az IDC-P hisztomorfológiai kategóriája klinikopatológiai szempontból két különálló elváltozást jelenthet: az invazív karcinómával asszociált IDC-P-t, valamint a ritkábban előforduló izolált IDC-P-t, amely a prosztata adenokarcinóma prekurzorának tartható. Szövettani differenciáldiagnózisa komoly kihívást jelent, az atípusos kribriform léziók közül az egyik legfontosabb a magas grádusú prosztata intraepithelialis neopláziától (HGPIN) való elkülönítése. Az intraduktális prosztatakarcinóma jelenléte rendszerint magas Gleason-értékű invazív karcinómával, nagy tumortömeggel, és hátrányos prognosztikus paraméterekkel társul.
Esetismertetés: Esetünkben páciensünk prosztata-tűbiopsziás mintájának szövettani vizsgálata során izolált intraduktális prosztatakarcinómát észleltünk. Az eredmény ismeretében rebiopszia végzése mellett döntöttünk.
Következtetések: A prosztata atípusos kribriform elváltozásainak megfelelő szövettani differenciáldiagnosztikája fokozott klinikai jelentőséggel társul, tekintettel arra, hogy a különböző entitások eltérő terápiás és prognosztikus következményekkel járnak. Mindazonáltal nincs egyértelmű konszenzus, hogy a prosztata-tűbiopsziás mintában jelenlévő izolált IDC-P rebiopsziát, vagy azonnali radikális kezelést igényel-e. Mivel azonban az izolált IDC-P csak extrém raritásként fordult elő a vizsgálatokban, és az invazív prosztatakarcinómával való társulás valószínűsége meglehetősen nagy, abban egyetértés mutatkozik a szerzők között, hogy az intraduktális karcinóma egyedüli megjelenése a tűbiopsziás mintában minimálisan igen szoros obszervációt igényel. A jövőbeli nagyobb prospektív vizsgálatok sokkal pontosabb képet nyújthatnak az IDC-P incidenciájáról, és segíthetnek meghatározni az IDC-P biopsziás mintában való jelenlétének független prediktív értékét, ezáltal segítséget nyújthatnak ezen betegek kezelésében, a klinikai döntéshozatal irányításában.
Bevezetés
Az intraduktális prosztatakarcinóma (IDC-P) egy ritka entitás, amely kifejezett klinikai jelentőséggel bír. Az IDC-P olyan malignus-elváltozás, amit a prosztatakarcinómás sejtek duktuszokon és acinuszokon belüli proliferációja, valamint kifejezett citológiai atípia jellemez. Az IDC-P jelenléte a szövettani mintában gyakran társul kiterjedt invazív karcinómával, előrehaladott stádiummal, magas Gleason-értékkel és a kiújulás magas rizikójával (1). Egy nagy elemszámú vizsgálatban 1176 prosztata-tűbiopsziás mintából 312 esetben igazolódott prosztatakarcinóma (PCa) és 33 IDC-P-eset került leírásra. Az IDC-P az összes minta 2,8%-ában volt jelen (1176-ból 33 esetben). Az intraduktális prosztatakarcinóma 91%-ban társult invazív prosztatakarcinómával (33 esetből 30-ban). Az IDC-P-vel rendelkező betegek átlagéletkora 65 év, az átlagos PSA-érték a diagnózis idején 16,2 ng/ml volt. Ezen betegek Gleason-értékének vonatkozásában a következő arányok mutatkoztak: 3+4=7 (13,3%), 4+3=7 (40%), 4+4=8 (13,3%) és Gleason 9, illetve 10 (33,3%) (2). Az IDC-P-vel foglalkozó sokasodó tanulmányok tisztázzák a szövettani diagnosztikus kritériumokat, az elváltozás klinikai jelentőségét, az immunhisztokémiai és genetikai vizsgálatok pedig ezen entitás patogenezisét segíthetnek megérteni.
Esetismertetés
A 78 éves páciensünk urológiai anamnézisében évek óta fennálló mérsékelt dizúria szerepel. Aktuális vizsgálatát megelőzően utoljára 3 éve látta urológus, ekkor normális (1 ng/ml) PSA-szint, negatív prosztatatapintási lelet igazolódott. A páciens dokumentációjában korábbi, illetve ennél frissebb PSA-érték nem állt rendelkezésre. Belgyógyászati kórelőzményét tekintve magasvérnyomás-betegség és 2-es típusú cukorbetegség emelendő ki. Urológiai szűrővizsgálat keretében elvégzett PSA-vizsgálat 8,03 ng/ml értéket mutatott, emiatt jelentkezett urológiai szakambulanciánkon. UH-vizsgálattal ép vesék és hólyag mellett enyhe fokú prosztata-megnagyobbodás volt észlelhető. Rektális vizsgálattal a prosztata bal oldalán, a bázisnál enyhe tömöttség igazolódott, azonban malignitásra utaló terület összességében nem volt tapintható. Első lépésben multiparametrikus prosztata MR elvégzése történt, amelynek során bal oldalon, dorzálisan, 4-5 óra irányában T2 axiális sorozaton jelszegény területet írtak le, amellyel együtt diffúziógátlás is megfigyelhető volt (ezt az ADC-kép is megerősítette). PI-RADS 5 lézió került leírásra a radiológiai leletben (1. ábra).
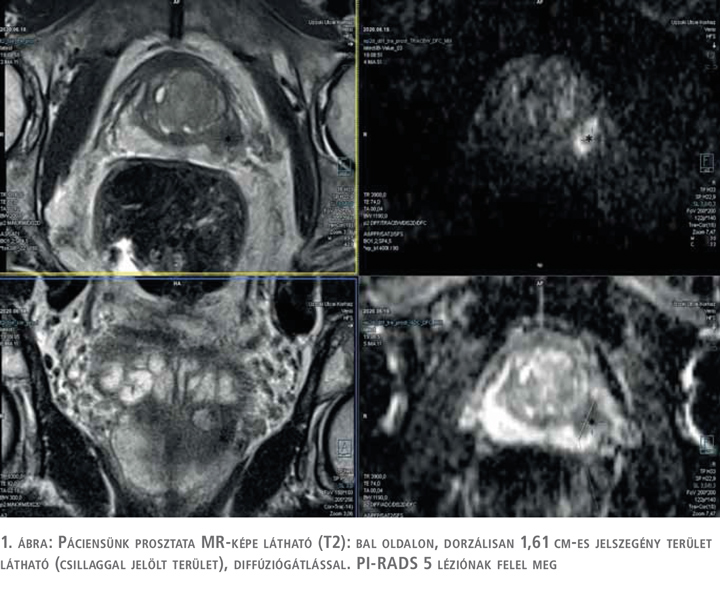
Ezt követően transzrektális ultrahang- (TRUS) vezérelt prosztatatérkép sorozatbiopszia, valamint real time MR-fúziós szövettani mintavétel történt. A szövettani lelet izolált intraduktális prosztatakarcinómát (IDC-P) igazolt (12 mintából 3 mintában, 10%-10%-5%-ban, 2 az MR-fúziós célzott, 1 a random biopsziás helyről). Az ezt követő onkoteam – tekintettel arra, hogy ezen elváltozás igen nagy valószínűséggel társul invazív prosztatadaganattal – ismételt szövettani mintavétel elvégzését javasolta, amelyet el is végeztünk, ezúttal csak térképbiopszia történt. A szövettani értékelés során ismételten izolált IDC-P igazolódott 12 mintából 2 mintában 20, illetve 25%-os arányban invazív prosztata-karcinóma nélkül (2. ábra).
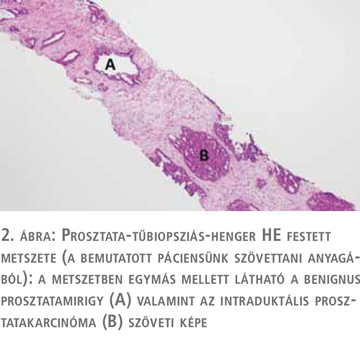
Mivel az irodalomban fellelhető adatok az izoláltan – invazív PCa nélkül – előforduló intraduktális prosztatakarcinóma kezelése kapcsán ellentmondásosak abban a tekintetben, hogy a szoros obszerváció/ismételt szövettani mintavétel vagy a radikális sebészi ellátás, illetve annak alternatívájaként hormon- és sugárkezelés javasolt-e, a beteg korát és várható élettartamát figyelembe véve, az onkoteam szoros obszervációt vagy ismételt szövettani mintavételt javasolt. A páciens a szoros megfigyelés mellett döntött, amelynek alapján háromhavonta PSA-vizsgálat, szükség esetén MR-vizsgálat ismétlését javasoltuk. A COVID okozta pandémia miatt a tervezett kontrollvizsgálat elmaradt, a beteg 1 évvel később jelentkezett más intézetben urológiai kontrollra, az elvégzett friss PSA-vizsgálat 24 ng/ml értéket mutatott. Újabb prosztata MR-vizsgálat történt, amely a korábbihoz képest – összhangban a PSA emelkedésével – progressziót írt le: korábbinál nagyobb kiterjedésű PI-RADS 5 léziót bal oldalon a perifériás zónában, a bázist és a középső harmadot érintve. Tekintettel a PSA ugrásszerű emelkedésére, a képalkotón látott progresszióra és a korábbi szövettani leletre, ismételt real-time MR fúziós mintavétel mellett döntöttek (invazív daganat jelenlétére gyanakodva). A szövettani feldolgozás során 1 fúziós mintában 20%-ban acináris adenokarcinóma igazolódott (Gleason-score 4+4, ISUP 4). Ebben és a többi mintában is több helyen intraduktális karcinóma jelenlétét írták le. Ezt követően PSMA-PET-CT-vizsgálat történt, amely a prosztata bal lebenyében ismert malignitás mellett a bal ondóhólyag érintettségét valószínűsítette. Áttétre utaló PSMA-halmozás nem volt kimutatható. Onkoteamet követően a betegnél hormonkezelés elkezdése és sztereotaxiás sugárkezelés tervezett.
Megbeszélés
Az intraduktális prosztatakarcinóma szövettani differenciáldiagnózisa sokszor igen nehéz, és számos entitást magában foglal, amelynek klinikai jelentősége az eltérő terápiás és prognosztikus következmény. Ezek közül a legnagyobb jelentőséggel a magas grádusú prosztata intraepithelialis neoplázia (HGPIN) bír, ami egy prekancerózus elváltozás, és sokszor rendkívül nehéz az IDC-P-től való elkülönítése. A szövettani megkülönböztetésben fontos, hogy a HGPIN esetében a prosztatamirigyek általában hasonló méretűek a benignus mirigyekhez, valamint a sejtekben nincs jelentős magatípia és a sejtmag mérete 2-3-szor nagyobb csak, mint a szomszédos benignus mirigyekben. Ezen kívül a mitotikus aktivitás nem emelkedett szignifikánsan. A HGPIN daganatsejtjeinek magjai az IDC-P-ben látott kifejezett pleomorfiával ellentétben monomorfak, komedonekrózis is csak fokálisan és rendkívül ritkán látható, ellentétben az IDC-P-vel (3. ábra). Az elkülönítést segítő immunhisztokémiai reakciók elvégzése ilyen esetekben elengedhetetlen. Mindkettőre jellemző az alfa-metilacil-koenzim-A racemáz (AMACR) over-expresszió, és az intraduktális lokalizációt jelző bazális sejtmarker (p63) pozitivitás (4. ábra).
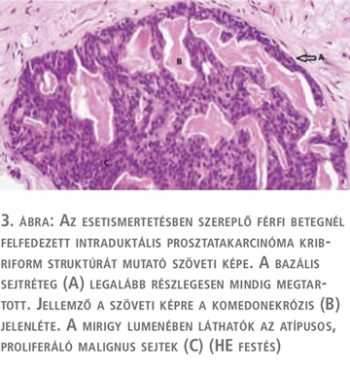
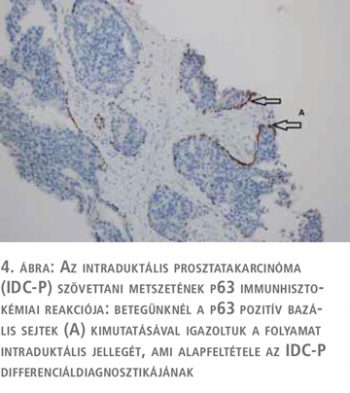
A PTEN (foszfatáz- és tenzinhomológ) és ERG immunhisztokémia segíthet az elkülönítésben, amennyiben a PTEN-expresszió elvesztése és ERG overexpresszió látható IDC-P-ben, ellentétben a HGPIN-nel (1). A HGPIN jelenléte a biopsziás mintában nem igényel definitív kezelést, és nem indokol feltétlenül újabb szövettani mintavételt (3). Ezzel ellentétben az izolált IDC-P jelenléte a tűbiopsziás mintában azonnali rebiopsziát igényel, és esetenként definitív kezelés is szükséges (4).
Az intraduktális prosztatakarcinóma helyes szövettani felismerése érdekében – különös tekintettel a differenciáldiagnosztikai nehézségekre – diagnosztikus kritériumokat állítottak fel (5).
Öt major kritériumot javasoltak az IDC-P diagnózisára:
- nagy mirigyek (átmérőben kétszerese a normális perifériás zónában levő mirigyeknek);
- immunhisztokémiai markerekkel azonosított bazális sejtek mindig jelen vannak;
- citológiailag malignus sejtek által kitöltött mirigyek;
- a sejtek mindig átérik a mirigy lumenét;
- kiterjedt centrális komedonekrózis jelenléte.
Ezen kívül 3 minor kritériumot javasoltak:
- derékszögben elágazódó mirigyek;
- sima és kerek mirigykontúr;
- két sejtpopuláció: egy külső, mitotikusan aktív sejtcsoport, hosszúkás sejtekkel, pleomorf magokkal, és alacsony PSA immunoreaktivitással, illetve egy belső sejtcsoport, monomorf, szögletes magokkal, és magas PSA immunoreaktivitással.
Fentiek ismerete elengedhetetlen a helyes szövettani diagnózishoz (1. táblázat). Az IDC-P differenciáldiagnózisában szerepet játszó további entitások: magas grádusú, kribriform invazív acináris adenokarcinóma, prosztata duktális adenokarcinóma és a prosztata duktuszokat involváló urotheliális karcinóma.
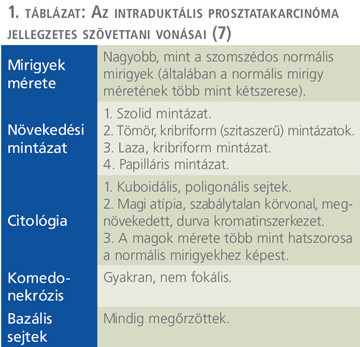
Az intraduktális prosztatakarcinóma az esetek többségében a prosztata adenokarcinóma késői stádiumú progresszióját képviseli az előrehaladott daganat intraduktális terjedése által. Ezt az elméletet, ami jelenleg a legelfogadottabb, a molekuláris vizsgálatok is támogatják (6). Az IDC-P-re jellemző PTEN-expresszió elvesztésén kívül a heterozigótaság vesztése (LOH) is nagyobb gyakorisággal került leírásra az intraduktális prosztatakarcinóma esetekben, összehasonlítva akár a Gleason 3 prosztata adenokarcinómával, akár a HGPIN eseteivel, ahol ez sokkal ritkább. A molekuláris vizsgálatok megmutatták, hogy az IDC-P és a szövettani mintában hozzá közel lévő invazív PCa ugyanazokat a LOH-mintázatokat mutatják (7). A p53 vagy Rb-géneket érintő heterozigótaság vesztés gyakran látható IDC-P-ben. További bizonyítékot jelent a TMPRSS2-ERG-gén fúzió, ami a leggyakoribb kromoszomális módosulás a prosztata adenokarcinómában (az esetek kb. 50%-ában azonosítható) és jelen van az IDC-P-esetek több mint kétharmadában is, a HGPIN-ben azonban hiányzik (1). Ezek a felismerések szintén támogatják azt az elméletet, hogy az IDC-P a magas grádusú, invazív PCa duktális terjedésének tekinthető. McNeal és Yemoto – nevükhöz fűződik az intraduktális karcinóma elnevezés – ezzel összhangban azt találták, hogy az IDC-P szinte mindig magas grádusú és nagy volumenű invazív PCa-val társul (8). A későbbi tanulmányok is igazolták, hogy az intraduktális prosztatakarcinóma jelenléte összefügg egyéb, hátrányos kórszövettani vonásokkal, ide értve a magasabb Gleason-értéket, nagyobb tumortömeget, az extraprosztatikus terjedést (EPE), illetve vesicula seminalis inváziót (SVI) és a kismedencei nyirokcsomó-metasztázisok nagyobb valószínűségét a radikális prostatectomiás preparátumokban. Ezen kívül az IDC-P-t tartalmazó esetekben a prognózis rosszabb, a progressziómentes túlélés alacsonyabb (2).
Két tanulmány tesz említést továbbá azon intraduktális prosztatakarcinómák klinikai jelentőségéről, ahol az IDC-P a biopsziás mintában izoláltan – egyidejű invazív PCa hiányában – van jelen. Guo és Epstein beszámolt olyan IDC-P-s esetekről (9), ahol a biopsziás mintákban nem volt kimutatható egyidejű invazív prosztatakarcinóma, majd újabban Robinson és Epstein kibővítette a fenti tanulmányt, amely így már 86 esetet tartalmaz (10). Guo és Epstein anyagában csak 27 izolált IDC-P-t azonosított 45 ezer tűbiopsziás mintából (0,06%). Ezen két tanulmány konklúziója, hogy az IDC-P, még dokumentált invazív PCa hiányában is, hátrányos kórszövettani vonásokkal társult a radikális prostatectomiás mintákban, ezenkívül agresszív klinikai viselkedés jellemezte. Mindezek következtében izolált IDC-P esetén is indokolt lehet a definitív kezelés. Ezen tanulmányok azt sugallják, hogy a prosztatabiopsziás mintákban az IDC-P jelenlétének további prognosztikus értéke lehet, függetlenül az egyéb gyakran használt prognosztikus paraméterektől, mint pl. a Gleason grade vagy a tumor térfogata. Emiatt a szövettani leletben történő pontos rögzítése mindenképpen javasolható, akár társul kiterjedt, magas grádusú, invazív PCa-val, akár nem (2). Mindazonáltal az IDC-P megjelenése invazív PCa nélkül extrém ritka, így ezt a diagnózist (invazív PCa nélküli intraduktális karcinóma) a tűbiopsziás mintákban csak óvatosan és kellő körültekintéssel, a differenciáldiagnosztikai patológia módszerek teljes birtokában és használatával alkalmazhatjuk.
Következtetések
Összegzésként elmondható, hogy az invazív rákkal asszociált intraduktális prosztatakarcinóma ritka, az izolált IDC-P extrém ritka elváltozás prosztata bioptátumokban. Ezen entitás legfontosabb klinikai jellemzője, amelyet fenti esetünk is alátámaszt, hogy szinte kivétel nélkül agresszív, magas grádusú és nagy volumenű invazív PCa-val és rossz prognózisú betegséglefolyással társul. Következésképpen az izolált IDC-P szövettani diagnózisa esetén igen szoros obszerváció (rendszeres PSA és MR) javasolható. Az atípusos kribriform léziók tárgykörébe tartozó elváltozások differenciáldiagnosztikájához a szövettanász alapos uropatológiai gyakorlata, és a megfelelő immunhisztokémiai vizsgálatok elvégzése nélkülözhetetlen. Fentiek alapján továbbá erős ajánlás adható, hogy a prosztatabiopsziák kórszövettani leletében fel kell tüntetni az IDC-P jelenlétét, függetlenül attól, hogy társul-e invazív prosztatakarcinómával (2).
Köszönetnyilvánítás
A cikk megírásában köszönetemet szeretném kifejezni dr. Kátai Tamásnak az MR-képanyag biztosításáért.
Irodalom
1. Mukul K, Jae YRo. Intraductal Carcinoma of the Prostate Gland: Recent Advances. Yonsei Med J 2016; 57(5): 1054–1062. https://doi.org/10.3349/ymj.2016.57.5.1054
2. Watts K, Li J, Magi-Galluzzi C, Zhou M. Incidence and clinicopathological characteristics of intraductal carcinoma detected in prostate biopsies: a prospective cohort study. Histopathology 2013; 63: 574–9. https://doi.org/10.1111/his.12198
3. Epstein JI, Netto GJ. Biopsy Interpretation of the Prostate. 5th ed. Philadelphia, PA: Wolters Kluwer Health/Lippincott Williams & Wilkins; 2015.
4. Robinson BD, Epstein JI. Intraductal carcinoma of the prostate without invasive carcinoma on needle biopsy: emphasis on radical prostatectomy findings. J Urol 2010; 184: 1328–33. https://doi.org/10.1016/j.juro.2010.06.017
5. Cohen RJ, Wheeler TM, Bonkhoff H, Rubin MA. A proposal on the identification, histologic reporting, and implications of intraductal prostatic carcinoma. Arch Pathol Lab Med 2007; 131: 1103–9. https://doi.org/10.5858/2007-131-1103-APOTIH
6. Zhou M. Intraductal carcinoma of the prostate: the whole story. Pathology 2013; 45: 533–9. https://doi.org/10.1097/PAT.0b013e3283653322
7. Tsuzuki T. Intraductal carcinoma of the prostate: A comprehensive and updated review. Int Jour of Urol 2015; 22: 140–5. https://doi.org/10.1111/iju.12657
8. McNeal JE, Yemoto CE. Spread of adenocarcinoma within prostatic ducts and acini. Morphologic and clinical correlations. Am J Surg Pathol 1996; 20; 802–814. https://doi.org/10.1097/00000478-199607000-00003
9. Guo CC, Epstein JI. Intraductal carcinoma of the prostate on needle biopsy: histologic features and clinical significance. Mod Pathol 2006; 19; 1528–1535. https://doi.org/10.1038/modpathol.3800702
10. Robinson BD, Epstein JI. Intraductal carcinoma of the prostate without invasive carcinoma on needle biopsy: emphasis on radical prostatectomy findings. J Urol 2010; 184; 1328–1333. https://doi.org/10.1016/j.juro.2010.06.017