Thoughts on systemic treatment of bone metastases in prostate cancer patients
DOI: 10.22591/magyurol.2022.3.pikob.107
Authors:
Pikó Béla dr.1, Kis Anita dr. 1, Bassam Ali dr.1, Molnár Zsanett1, Ovidiu Rus-Gal Paul dr.1, Szeberényi Tamás dr.2, Mészáros Tibor dr.2
1 Békés Megyei Központi Kórház, Tagkórház Pándy Kálmán, Megyei Onkológiai Központ, Gyula (osztályvezető: Pikó Béla dr.)
2Békés Megyei Központi Kórház, Tagkórház Pándy Kálmán, Urológiai Osztály, Gyula (osztályvezető: Mészáros Tibor dr.)
Summary
Prostate cancer is a serious public health issue; which treatment possibilities are constantly developing. Metastases are common, and the vast majority, up to 90%, alone or in combination with other localizations, are bone metastases. The authors briefly describe the molecular mechanism of cancer formation and the possibilities of imaging diagnostics. They emphasize the importance of the Onko-team during the treatment and the therapeutic options, even, when there is no further active therapy, and also some aspects of the legislation that prescribes its process, and their practical significance. The treatment of bone metastases (in addition to the standard therapy of the malignancy) includes systemic therapy in almost all cases beside the local surgical and radiotherapeutic interventions. They present zoledronic acid (the only bisphosphonate with proven efficacy), denosumab acting on the “Receptor activator of NF-kB “[RANK] system”, alpha and beta emitting isotopes, as well as the important aspects of day-to-day patient care and side effects. They emphasize the interdisciplinary nature of palliative medicine, the adaptation of the patient’s environment to the patient’s needs, and also the importance of beginning the treatment as soon as possible.
LAPSZÁM: MAGYAR UROLÓGIA | 2022 | 34. ÉVFOLYAM, 3. SZÁM
ÖSSZEFOGLALÓ
A prosztatarák komoly népegészségügyi problémát jelent, bár ellátási lehetőségei folyamatosan fejlődnek. Az áttétek gyakoriak, s döntő többségük, akár 90%-uk – önmagukban vagy más lokalizációkkal együtt – csontmetasztázis. A szerzők röviden ismertetik a kialakulás molekuláris mechanizmusát és a képalkotó diagnosztika lehetőségeit. Hangsúlyozzák – az ellátásban és a terápiás lehetőségekben – az onkoteam jelentőségét, abban az esetben is, amikor további aktív terápiára már nincs lehetőség, továbbá a működését előíró jogszabályok egyes aspektusait, azok gyakorlati jelentőségét. A csontáttétek ellátása (a malignus alapbetegség szokásos terápiáján túl) a lokális műtéti és sugárterápiás beavatkozások mellett csaknem minden esetben szisztémás terápiát is igényel. Bemutatják a zoledronsav (egyedüliként igazolt hatásosságú biszfoszfonát), a „Receptor activator of NF-kB” (RANK) rendszeren ható denoszumab, az alfa- és béta-sugárzók alkalmazását, a mindennapos betegellátásban fontos szempontokat és a mellékhatásokat. A palliatív medicina interdiszciplináris jellegét, a betegen kívül környezetének igényeihez való alkalmazkodását és az ellátás minél hamarabb történő fontosságát emelik ki.
A prosztatarák – jellemzően különböző differenciáltságú adenocarcinoma – komoly népegészségügyi problémát jelent: a férfiak harmadik leggyakoribb rosszindulatú daganata; hazánkban évi 4500 új megbetegedést diagnosztizálnak, a betegséggel élők száma meghaladja a 20 000 főt, s ez mind a társadalom, mind az egészségügy számára jelentős terhet jelent (1). Az eleve áttétes esetek gyakorisága 5-30% a fejlett országokban (egyebütt 40-70%), és a korai stádiumban felismert betegség 40%-ban metasztatikussá válik, s ebben a stádiumban mintegy 30 hónap teljes túlélés várható (2, 3). A csontrendszeri érintettség a leggyakoribb – egyes adatok szerint önmagában vagy más lokalizációkkal kombinációban a 90%-ot is meghaladja – ezért a kérdéssel külön érdemes foglalkozni (4).
Bár a betegség komplex kérdéskörével foglalkozó átfogó hazai ajánlás nem áll rendelkezésre, az áttétes prosztatarák gyógyszeres kezelésével – a nemzetközi ajánlások mellett – az utóbbi években számos magyar nyelvű közlemény foglalkozott (1, 5, 6, 7, 2, 8, 9). Ezért ezt a kérdést részletekbe menően nem tárgyaljuk, de utalunk arra a tényre, hogy a betegség kedvező befolyásolása a csontmetasztázisokra is jótékony hatást fejt ki.
A csontáttétek kialakulása és kimutatása
A csontáttétek kialakulása komplex folyamat, amelyet terjedelmi okokból csak érintőlegesen említünk: fontos szerepe van a molekuláris tényezőknek: a csontvelői és tumorsejtek közötti interakcióban az E-szelektin, inzulinszerű növekedési faktor-1, interleukin-17 hatásának, valamint a stroma sejtből származó 1-es faktornak (SDF1), amely mind az oszteo- és fibroblasztokra, mind a hemopoietikus őssejtekre hat. Az oszteoblasztok és -klasztok egyensúlyát a Receptor activator of NF-kB (RANK), a RANKL (RANK-ligand) és oszteoprotegerin-citokin rendszer szabályozza, valamint a parathormonhoz kapcsolódó proteinek (PTHrP) és mátrix-metalloproteináz-7 (MMP7) expressziója. A gerinc metasztázisaiban speciális szerepet játszik a főleg lumbális csigolyák környékén elhelyezkedő paravertebrális vénás plexus („Batson-vénák’), ahol a lassult keringés elősegíti a daganatsejtek megtapadását a teljes gerincben (1. ábra).
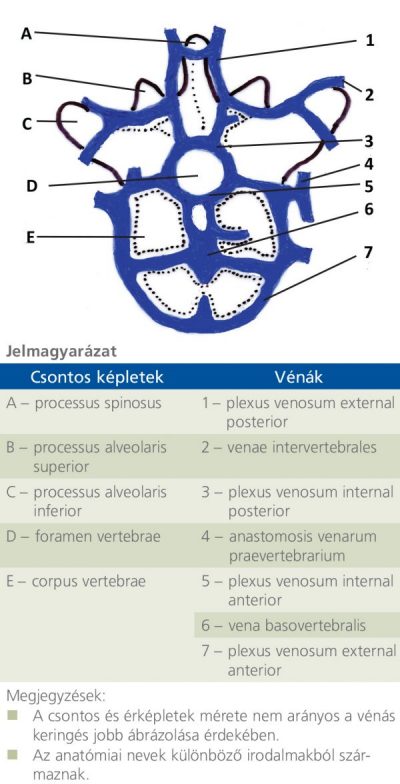
1. ábra: A Batson-vénák rendszere (9) nyomán, módosítva
Az áttétek radiomorfológiája általában oszteoplasztikus (szklerotikus), de az így kialakult csontszerkezet szabálytalan, rigid, benne az oszteoblaszt-aktivitással egy időben fokozódik az oszteoklasztok aktivitása is, ami fokozott csontreszorpcióval és oszteolízissel jár. A képalkotó vizsgálatokon felritkulásként jelentkező oszteolitikus áttétekhez képest ugyan ritkábban, de itt előfordulnak a csontrendszeri események (skeletal-related events – SRE): patológiás csonttörés, gerincvelő-kompresszió, ezeknek a megelőzésére vagy ellátására irányuló műtét, valamint sugárkezelés (ideértve a lokalizált fájdalom csillapítását is) és a tumor-indukálta hyperkalcaemia [TIH]). A csontmetasztázisok magas gyakorisága miatt fokozottan ügyelni kell az életminőséget és -kilátást kedvezőtlenül befolyásoló következmények elkerülésére (1, 3, 4, 5, 8, 9, 10, 11).
A csontáttétek kimutatásában a konvencionális radiológiai vizsgálat („csontröntgenfelvétel”) szerepe kisebb, mivel csak az 1 cm-t elérő áttéteket jelzi, s elsősorban (bár nem kizárólag) a lízis vehető észre, ha a csont ásványi anyaga mintegy 50%-ban csökkent. (Ennek ellenére a prosztatarákot nemegyszer ma is a csont-ízületi fájdalom okát keresve végzett röntgenfelvételeken leírt áttétek primer tumorát kutatva fedezik fel.) Az ugyancsak röntgensugárzással működő CT-vizsgálat során vagy „melléklelet” a szklerotikus terület, vagy az ismert betegség stádiumba sorolásának eleme. A módszer jó felbontású, a csontok felszívódását, szklerózisát, az esetleges kísérő lágyrész-elváltozásokat jelzi, de nem tud különbséget tenni az aktív és inaktív áttét, valamint a progresszió és a kezelés hatása között (oszteoplasztikus csontáttét kiterjedtebbé válása, vagy a terápia hatására történő mészbeépülés). Az MR a tumor és a csontvelő jelintenzitásának különbsége alapján alkot képet, s bár érzékenyebb a gerinc elváltozásainak kimutatásában (gerincvelői kompresszió igazolásához, műtét tervezéséhez elengedhetetlen), egésztest-vizsgálatra, panasz- és tünetmentes betegekben csontáttétek keresésére nem alkalmas.
A 99mTechnéciummal jelölt difoszfonátokkal végzett csontszcintigráfia a csontanyagcsere változásainak jelzésével a stádium megállapításának, a beteg követésének elengedhetetlen eszköze, amelynek érzékenysége magasabb, mint fajlagossága, de SPECT/CT-vizsgálattal kiegészítve mindkettő javítható. A speciális PET/CT-vizsgálatok köre tág; leggyakrabban 11C, vagy 18F nukliddal jelzett kolin, vagy újabban 68Ga vagy 18F jelölt PSMA [prosztataspecifikus membránantigén] alkalmazása még nem a rutindiagnosztika részei (1, 5, 6, 9, 10, 11, 12, 13, 14, 15, E).
Prosztatarákos betegek csontáttétének kezelése
Az onkoteam szerepe
Az onkoteam (multidiszciplináris team) meghatározó szerepét a prosztatarák kezelésével foglalkozó közlemények egybehangzóan kiemelik. A felesleges ismétlések elkerülése végett csak a legfontosabb elemekre utalunk: minden beteg kezelésbe vételekor és a terápia változtatásakor – jogszabályi előírás alapján is – kötelező, mivel az elsődleges kezelés helyes választása, valamint a későbbi vonalak optimalizálása meghatározza a beteg sorsát. Tagjai – a rendelet szóhasználatával élve – „legalább” a szakmailag illetékes szakorvos (esetünkben urológus), klinikai onkológus és sugárterápiás szakorvos, s amennyiben nem azonos az előbbiekben meghatározottak valamelyikével, a kezelőorvos, valamint az onkoteam szervező (a kör természetesen a beteg és betegség jellemzői alapján bővíthető). Mivel a rendeletben „tag” és nem „résztvevő” szerepel, nézetünk szerint a protokollált módon készített lelet a képalkotó diagnoszta és patológus véleményét tartalmazza, s elegendő elérhetőségük biztosítása (esetlegesen felmerülő kérdés esetén); a beteg (hozzátartozó) részvétele – jogszabályi előírás szerint is – csak speciális esetekben szükséges. A betegre vonatkozó adatokat a kezelőorvos referálja, s az ő feladata az Egészségügyi törvény értelmében a beteg tájékoztatása is. A lehetőségként eleve létező online („virtuális”) onkoteam létrehozását a COVID-19-pandémia tette gyakorlattá és hasznos, időt és energiát megtakarító módszernek bizonyult (1, 5, 6, 7, 11, 12, 14, 16, 18, A, B, C, D, F).
Csontáttétek lokális kezelése
Témánk jellege miatt ezzel a kérdéssel csak röviden foglalkozunk. A sürgősségi esetek kivételével (amelyekről a team-et utólagosan szükséges tájékoztatni) az onkoteam feladata annak mérlegelése, hogy mikor szükséges stabilizáló műtét indikációjának felállítása érdekében konzílium kérése (jellegzetesen teherviselő csontok érintettsége esetén), illetve a statikai veszély elhárítása vagy körülírt fájdalom csökkentése érdekében mikor javasoljunk sugárkezelést. A besugárzási technika és frakcionálás bemutatása éppúgy meghaladja jelen dolgozat kereteit, mint a lokális, lokoregionális sugárkezelés és az oligometasztatikus betegség ellátásának kérdésköre (1, 2, 3, 5, 6, 9, 11, 12, 18, 19).
Csontáttétek szisztémás kezelése
Csontanyagcserére ható szerek
Mint a bevezetőben említettük, a metasztatikus betegségre alkalmazott gyógyszerek értelemszerűen befolyásolják a csontáttéteket is, de a közleményben részletesebben a közvetlenül ezekre ható készítményekkel foglalkozunk.
Zoledronsav
A biszfoszfonátok közül mind klinikai vizsgálatokban (CALGB 90202, STAMPEDE, ZAPCA) mind a mindennapos gyakorlatban egyedül a zoledronsav (ZS) bizonyult hatásosnak, csökkentve a csontrendszeri események gyakoriságát, javítva a betegek életminőségét. Hatását az oszteoklasztok, a RANK és RANK ligand, a kalmodulin-dependens protein-kináz útvonalakon történő jelátvitel, és a makrofágok differenciálódásának gátlásával fejti ki. Az alkalmazási előírás 3-4 hetente, intravénás infúzióban javasolja adását a vesefunkciós értékeknek megfelelő dózisban (1. táblázat).
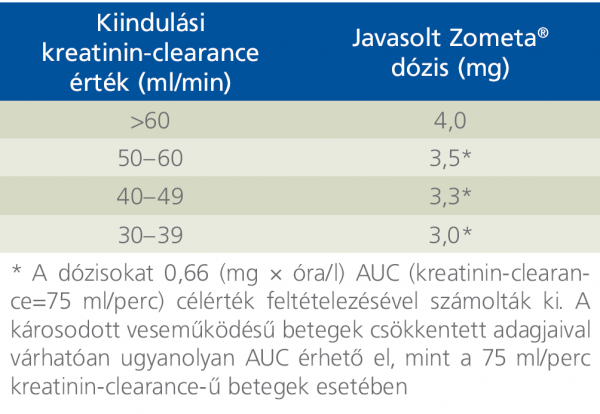
1. táblázat: A zoledronsav dózisának meghatározása a vesefunkció függvényében (22)
Felhívjuk a figyelmet arra, hogy a táblázatban nem a laboratóriumi leletekben megadott GFR (Glomerular Filtration Rate) vagy eGFR (Estimated Glomerular Filtration Rate), hanem a kreatinin-clearence szerepel. A clearance az a plazmamennyiség, amely a vizeletképzés során egy meghatározott anyagtól egységnyi idő alatt megtisztul. A (endogén) kreatinin-clerance mérése a gyakorlatban könnyen kivitelezhető (nincs szükség a vizsgált anyag infúziójára), beszűkült vesefunkció esetén már igen korán kóros értéket mutathat. (Tudományos célból meghatározása az inulin [növényi eredetű fruktózpolimer] bevitelével történik, amely szabadon filtrálódik, a vesében nem szecernálódik, nem szívódik vissza és nem szintetizálódik, de a klinikai gyakorlatban a rutinban mért szérumkreatinin értékéből végezhetjük a számolást.) A kreatinin-clearance meghatározására a Cockroft–Gault-formula használatos (2. ábra).
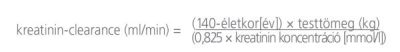
2. ábra: Az endogén kreatinin-clearance kiszámítása a Cockroft–Gault-formula alapján (25)
Mivel a laboratóriumi kérőlapokon nem szerepel a testtömeg, ennek az értéknek a rutinszerű meghatározása nem történik! A prosztatarákos betegeknél az életkor és a testtömeg fontos tényezők, ezért érdemes (és az alkalmazási előírás szerint kötelező is) a kreatinin-clearance figyelembevétele, amelyet a gyakorlatban számítógépre, „okostelefonra” letölthető kalkulátorokkal határozhatunk meg. Néhány példát (különböző életkorokra és testtömegekre) a 2. táblázatban mutatunk be.
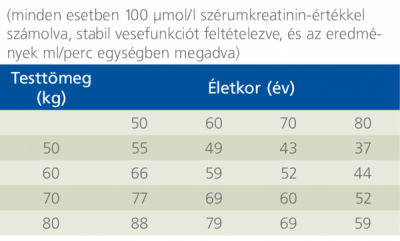
2. táblázat: Az életkor és a testtömeg hatása az endogén kreatinin-clearance alakulására
https://www.mdcalc.com/creatinine-clearance-cockcroft-gault-equation#use-cases
A betegeknek per os napi 500 mg kalciumpótlást és 400 NE D-vitamint is kell kapniuk. A hazai népesség jellegzetesen D-vitamin-hiányban szenved, így a túladagolás veszélye elenyésző. Az aktuális szérumkalcium értékének meghatározása szükséges (az eredményt befolyásolhatja a tumoros hyperkalcaemia, egyes – a betegek által szedett, de az orvossal nem közölt – multivitamin-készítményekben levő kalcium mennyisége, a csontokba történő beépülés, a tartós hasmenés, a túlhajtott diéta, a kalcium-anyagcsere rendellenességei). Bár a ZS alkalmazási előírása az albuminra korrigált kalciumszint meghatározását TIH esetén írja elő, a gyakran tapasztalt hypalbuminaemia miatt javasoljuk az áttétek kezelésekor is alkalmazását. A Payne és munkatársai által javasolt számítás (3. ábra) helyett a gyakorlatban itt is kalkulátorokat alkalmazunk.

3. ábra: Az albuminra korrigált kalcium értékének kiszámítása (27)
Mivel igen gyakran használunk a betegek ellátásában ZS-t, a várható főbb mellékhatásokat és azok megelőzési, ellátási lehetőségét ismerni szükséges (3. táblázat) (4, 5, 6, 7, 8, 12, 21, 22,(23) 24, 25, 26,(27, F, G).

3. táblázat: A zoledronsav főbb mellékhatásai és megelőzésük, valamint a szükséges további lépések (22, 28, 29, E)
Denoszumab
A denoszumab (DS) IgG2-típusú humán monoklonális antitest, amely nagy affinitással és szelektivitással kötődik az RANKL-hoz és az RANKL/RANK kölcsönhatás kialakulásának megakadályozásával csökkenti az oszteoklasztok számát és működését, ezáltal mérsékelve a csontreszorpciót és a csontrendszeri eseményeket. Indikációs köre hasonló a ZS-éhoz, de szerepel benne az óriássejtes csontdaganat ellátása és nem törzskönyvezett TIH kezelésére. Alkalmazása szubkután injekcióként (120 mg, azaz 1 ampulla), 28 naponta a combba, a hasfalba vagy a felkarba) gyors és kényelmes. A DS kisméretű peptidekre, majd különálló aminosavakra történő lebomlással eliminálódik. A veseműködés érdemben nem befolyásolja a denoszumab farmakokinetikáját, s vesekárosodás esetén nincs szükség az adagolás módosítására, viszont alacsony kreatinin-clearance ( Ennél a szernél is szükséges naponta legalább 500 mg kalcium és 400 NE D-vitamin pótlása, kivéve, ha hyperkalcaemia áll fenn. Mellékhatásai részben eltérnek a ZS alkalmazásakor ismertektől (4. táblázat).

4. táblázat: A denoszumab főbb mellékhatásai és megelőzésük, valamint a szükséges további lépések
Fizazi és munkatársai 2011-ben számoltak be a DS és ZS összehasonlításáról olyan kasztrációrezisztens, csontáttétes prosztatarákos betegekben, akiknek betegsége legalább egy hormonkezelés után progrediált és albuminnal korrigált kalciumszintjük 2,0 és 2,9 mmol/l között volt. Az első SRE-ig eltelt időszak a ZS-karon 17,1 (15,0–19,4) hónap, DS esetében 20,7 (18,8–29,4) hónap volt, a kialakult SRE típusa nem mutatott érdemi eltérést a két csoportban. A kiemelt társadalombiztosítási támogatással rendelhető készítmények körében a 8/c pont az alkalmazási előírásnak való megfelelést írja elő (lokalizációt illető korlátozás nélkül), de a 8/d3 pont prosztatarákban a biszfoszfonátok ellenjavallatát, rossz tolerálhatóságát vagy sikertelenségét szabja feltételül (3) 5, 7, 8, 12, 28, 29, 31, G, H, (I).
Izotópkezelés
A gyakorlat szempontjából két csoportot különböztetünk meg, az a- és a b-sugárzók csoportját (a valóságban mindkét bomlás társul g-emisszióval is, és a döntő hatást kifejtő, indikáció alapját képező emisszió típusba végezzük a besorolást) (5, 7, 8, 29, 32).
Alfa-sugárzók
Az alfaradin rádiumsót (223Ra-dikloridot) tartalmaz, amely kalciumanalóg, s mint ilyen, a csontba (azon belül is elsősorban a prosztatarák csontáttéteibe) épül be, s ott a hidroxiapatittal komplexet képezve fejti ki ionizáló sugárzásként sejtpusztító hatását, a DNS-lánc kettős destrukcióját. A sugárzás teljes energiájának százalékos megoszlása: 95,3% a-, 3,6% b-, 1,1% g-emisszió, így okkal nevezzük alfa-sugárzónak. Igen kedvező hatását két fizikai tényezőnek köszönheti. Az egyik a magas energiaátadás (ionizálóképesség), amit a lineáris energiatranszferrel (LET) jellemezhetünk (alapvető sugárbiológiai elv, hogy csak az elnyelt energia fejt ki az élő anyagban hatást). A másik az atomi szinten „nagy” részecskék (hélium-atommagok) rövid távolságon (100 µm) való elnyelődése, ami a környező szervek, különösen a csontvelő alacsony dózisterhelésével jár. A kezelés eredményességét az ALSYMPCA („ALpharadin in SYMPtomatic Prostate CAncer is an international Phase III clinical study to evaluate the efficacy and safety of Radium-223 dichloride in patients with hormone refractory prostate cancer and skeletal metastases”) klinikai vizsgálatban igazolták. 921 beteg (vizsgálati készítmény: 614 fő, placebo: 307 fő) adatainak elemzése alapján a 223Ra kezelésben részesültek medián túlélése 14,9 hónap volt a „best supportive care” és „helyileg szokásos ellátás” 11,3 hónapjával szemben, az első tünetekkel járó SRE idejéig az aktív karon 15,6 hónap, a kontrollon 9,8 hónap telt el. A grade 3-4 hematológiai mellékhatások az izotóppal kezelt és „szokásosan ellátott” csoportban következőképpen alakultak: anémia: 13%, (vs. 13%), neutropaenia: 3% (vs. 3%), thrombopaenia: (6% vs. 3%). Az alfaradin helyét a terápiás palettán az alkalmazási előírás és a finanszírozási követelmények határozzák meg: tüneteket okozó csontáttétes, kasztrációrezisztens prosztatarákban szenvedők, visceralis és 3 cm-nél nagyobb nyirokcsomóáttét nélkül, ha a betegség progrediált legalább két korábbi vonalbeli szisztémás terápia (kivéve az LHRH-analógokat) után, vagy a beteg alkalmatlan a rendelkezésre álló egyéb szisztémás kezelésre. A kísérleti fázisban levő, PSMA-hoz kötött, alfa-sugárzó 225Aktínium (225Ac) – mivel nem fizikokémiai úton, hanem célzottan kapcsolódik a célponthoz – nemcsak csontáttétek, hanem akár zsigeri metasztázisok esetén is hatásosnak bizonyult, a teljes betegcsoportban a medián OS 8,5 hónap. Kritikus szerv a vese, fő mellékhatás a nyálmirigyek károsodása következtében kialakult szájszárazság, de a könnymirigyek is károsodhatnak (5, 6, 7, 8, 15, 29, 32, 33, 34, E, J, K, L).
Béta-sugárzók
Ebbe a csoportba a terápiás rutinban a 89Stroncium (89Sr), a 153Szamárium (153Sm) és a 188Rénium (188Re) sorolhatók (természetesen ezek sugárzásának is van g-komponense). Közös jellemzőjük az alacsonyabb LET, a kisebb méret (elektronok) és azonos energia esetén az a-sugárzásnál mintegy tízszer hosszabb úton történő elnyelődés, emiatt fennáll a csontvelő-károsodás kockázata. Nem okoznak kettős lánctörést. A 89Sr és a 188Re fizikokémiai úton, a kalciumhoz hasonlóan épülnek be a hidroxiapatitba, míg a 153Sm a biszfoszfonátokhoz hasonló vivőmolekulát igényel. Indikációjuk a (főleg oszteoplasztikus) csontáttétekben a fájdalom csillapítása, mely 50-90%-ban érhető el, a teljes panaszmentesség pedig 12-33%-ban, s tartama néhány héttől néhány hónapig terjed (ugyanakkor a néha tartós csontvelői toxicitás elodázhatja egyéb kezelés adását). Túlélési előnyt nem hoznak, s nem alkalmasak az SRE kivédésére sem. (Szerzők véleménye szerint a korrektül beállított fájdalomcsillapítás ennek a kezelésnek reális alternatívája.) Természetesen a célzott terápia lehetőségét ebben a sugárminőségben is vizsgálták. 177Lutécium-(177Lu)-PSMA- és 225Ac-PSMA-kezelés alternálva adható, (nem kizárólag csont-, hanem egyéb áttétekben is szenvedő betegeknél). 42 és 45% közötti biokémiai regressziót értek el, a progressziómentes túlélés (PFS) medián értéke 13,7 hónap volt, az OS-t (15,5 hónapos követési idő alatt) nem érték el (5, 6, 8, 32, 35, 36, 37, 38, E, M).
Palliatív medicina
Betegeink előbb-utóbb – minden új kezelési lehetőség, és logikusan felépített terápiás terv ellenére – eljutnak abba az állapotba, amikor palliatív, tüneti (és végül terminális) ellátásra van csak lehetőség. Ez nézetünk szerint olyan lényeges pont, aminek megállapításához az onkoteam (gondos mérlegelésen alapuló) javaslata szükséges. Megjegyezzük, hogy „palliáció” alatt (a palliatív orvoslás értelmezését alapul véve) olyan betegek aktív, teljes körű ellátását értjük, akiknél gyógyításra már nincs mód. A középpontban a fájdalomcsillapítás, egyéb tünetek enyhítése, szociális, lelki és spirituális problémák kezelése áll. A megközelítés interdiszciplináris (különböző orvosi és egyéb szakterületek, szakápoló, gyógytornász, dietetikus, pszichológus, mentálhigiénés szakember stb. bevonásával); célcsoportja a beteg, a család és a tágabb közösség. Az utóbbi évtizedekben fontos szemléletbeli változást jelent, hogy a palliatív ellátást nem a terminális állapotban szorgalmazzuk, hanem annak minél korábbi megkezdésére törekszünk, az oki daganatellenes terápia kiegészítéseként. Ezzel nemcsak az életminőséget, a betegek és család elégedettségét fokozzuk, hanem a túlélési esélyt, az egymásra épülő kezelési vonalak elviselhetőségét is javítjuk (18, 39, 40, A).
Irodalom
1. Tenke P, Bodoky Gy, Géczi L, et al. A prosztatarák korszerű ellátásának feltételrendszere a betegek jó életminőségben eltöltött, hosszabb túléléséért. Magy Urol 2021; 3: 104–124, https://doi.org/10.22591/magyurol.2021.3.tenkep.104
2. Maráz A, Géczi L, Bíró K, et al. Terápiás szekvenciák az előrehaladott/áttétes prosztatadaganatok gyógyszeres kezelésében. Magy Onkol 2020; 64: 263–272.
3. Francini E, Montagnani F, Nuzzo PV, et al. Association of Concomitant Bone Resorption Inhibitors With Overall Survival Among Patients With Metastatic Castration-Resistant Prostate Cancer and Bone Metastases Receiving Abiraterone Acetate With Prednisone as First-Line Therapy. JAMA Netw Open 2021 Jul 1; 4(7): e2116536. https://doi.org/10.1001/jamanetworkopen.2021.16536
4. Mollica V, Rizzo A, Rosellini M, et al. Bone Targeting Agents in Patients with Metastatic Prostate Cancer: State of the Art. Cancers (Basel) 2021 Feb 1; 13(3): 546. https://doi.org/10.3390/cancers13030546
5. Schaeffer EM, Srinivas S, Antonarakis ES, et al. Prostate Cancer. Version 3.2022 – January 10, 2022. NCCN Clinical Practice Guidelines in Oncology. (NCCN Guidelines®). https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf
6. Mottet N, Cornford P, van den Bergh RCN, et al. European Association of Urology Oncology Guidelines. Prostate cancer 2021. https://uroweb.org/guideline/prostate-cancer/
7. Szűcs M, Szalontai M, Nyírády P. A prosztatarák diagnosztikája és kezelése napjainkban. Orvostovképző Szle 2020; 28(12): 37–45.
8. Küronya Zs, Bíró K, Maráz A, et al. Metasztatikus kasztrációrezisztens prosztatadaganat korszerű kezelése. Magy Onkol 2019; 63: 41–50.
9. Carpenter K, Decater T, Iwanaga J, et al. Revisiting the Vertebral Venous Plexus – A Comprehensive Review of the Literature. World Neurosurg 2021 Jan; 145: 381–395. https://doi.org/10.1016/j.wneu.2020.10.004
10. Sisay M, Mengistu G, Edessa D. The RANK/RANKL/OPG system in tumorigenesis and metastasis of cancer stem cell: potential targets for anticancer therapy. Onco Targets Ther 2017 Jul 27; 10: 3801–3810. https://doi.org/10.2147/OTT.S135867
11. Maráz A, Küronya Zs, Géczi L. Hormonérzékeny prosztatadaganatok kezelésének új irányai. Magy Onkol 2019; 63: 33–39.
12. Coleman R, Hadji P, Body JJ, et al. Bone health in cancer: ESMO Clinical Practice Guidelines. Ann Oncol 2020 Dec; 31(12): 1650–1663. https://doi.org/10.1016/j.annonc.2020.07.019
13. Barna S, Garai I, Nagy G. A gammasugárzó radiofarmakonok alkalmazása az onkológiában. Magy Onkol 2020; 64: 98–103.
14. Crawford ED, Stone NN, Yu EY, et al. Challenges and recommendations for early identification of metastatic disease in prostate cancer. Urology 2014 Mar; 83(3): 664–9. https://doi.org/10.1016/j.urology.2013.10.026
15. Garai I, Nagy G, Bátyi F, et al. Teranosztikumok alkalmazása prosztatarákban. Magy Onkol 2020; 64: 133–137.
16. Palkó A, Forrai G, Kiss I, et al. Képalkotó diagnosztikai eljárások szabványos negatív leletei A Radiológiai Szakmai Kollégium ajánlása, 2008. Magy Radiol 2008; 82(7–8): 288–299.
17. Tóth E, Salamon F. A prosztatarák prognosztikai patológiai leletének tartalmi követelménye – tűbiopsziás és radikális prosztatektómiás specimen. Magy Onkol 2019; 3: 10–15.
18. Csikósné ME, Szabó A, Pikó B. Online onkoteam kialakítása a Békés Megyei Központi Kórházban. IME 2020; 19(4): 17–20.
19. Inaba K, Tsuchida K, Kashihara T, et al. Treatment results of radiotherapy to both the prostate and metastatic sites in patients with bone metastatic prostate cancer. J Radiat Res 2021 May; 62(3): 511–516. https://doi.org/10.1093/jrr/rraa056
20. Khondakar NR, Owens-Walton J, Daneshvar M, et al. Emerging role for local therapy in oligometastatic prostate cancer. Clin Adv Hematol Oncol 2021 Jul; 19(7): 460–467. PMID: 34236345
21. Wang L, Fang D, Xu J, et al. Various pathways of zoledronic acid against osteoclasts and bone cancer metastasis: a brief review. BMC Cancer 2020; 20: 1059. https://doi.org/10.1186/s12885-020-07568-9
22. Fonyó A, Geiszt M. Az orvosi élettan tankönyve. Budapest. Medicina Könyvkiadó Zrt.; 2019; 257–285.
23. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976; 16(1): 31–41. https://doi.org/10.1159/000180580
24. Takács I, Bittner N, Bakos B, et al. Harmadik magyarországi konszenzus a D-vitamin szerepéről a betegségek megelőzésében és kezelésében. Orvostovképző Szle 2016; 23(2): 13–26.