Cardiological aspects of prostate cancer treatment
DOI: https://doi.org/10.22591/magyurol.2023.3.drobnizs.114 
Authors:
Drobni Zsófia Dóra dr.1, Fazekas Tamás dr.2,
Becker Dávid dr.1, Nyirády Péter dr.2
1Városmajori Szív- és Érgyógyászati Klinika, Kardiológia Tanszék,
Semmelweis Egyetem, Budapest (tanszékvezető: Becker Dávid dr.)
2Semmelweis Egyetem, Urológiai Klinika és Andrológiai Centrum, Budapest (igazgató: Nyirády Péter dr.)
Summary
Several new therapeutic agents have been recently approved for prostate cancer (PC) treatment, significantly improving patient survival. Currently, the systemic treatment of PC consists of hormone therapy, chemotherapy, immunotherapy, radiopharmaceuticals, and targeted therapy, many of which are associated with cardiovascular complications. In patients with PC, the prevalence of cardiovascular comorbidity is about 30%, and the incidence of cardiovascular mortality is 25-35%. This review provides an overview of systemic PC therapies’ prevalence and possible mechanisms of cardiovascular toxicity, including state-of-the-art anticancer agents. We also present the relevant recommendations of the European Society of Cardiology, published in the summer of 2022, on screening, risk assessment, follow-up, and prevention of the most common cardiac complications.
LAPSZÁM: MAGYAR UROLÓGIA | 2023 | 35. ÉVFOLYAM, 3. SZÁM
Összefoglalás
A prosztatarák (PC) kezelésében az elmúlt években számos új terápiás készítményt hagytak jóvá, jelentősen javítva a betegek életminőségét és túlélését. Jelenleg a PC szisztémás kezelése hormonterápiából, kemoterápiából, immunterápiából, radiofarmakonokból és célzott terápiából áll, amelyek közül sok kardiovaszkuláris szövődményekkel jár. A PC-ben szenvedő betegeknél a kardiovaszkuláris komorbiditás prevalenciája kb. 30%, és a szív- és érrendszeri okokból bekövetkező halálozás előfordulása 25-35%. Összefoglaló közleményünkben áttekintjük a szisztémás PC-terápiák, köztük a leggyakoribb daganatellenes szerek kardiovaszkuláris toxicitásait és lehetséges mechanizmusait. Ezen túl ismertetjük az Európai Kardiológiai Társaság 2022 nyarán publikált, témába illő ajánlásait is a szűréssel, rizikóbecsléssel, utánkövetéssel és a leggyakoribb kardiális szövődmények megelőzésével kapcsolatban.
A prosztatarák (PC) kezelésében az elmúlt években számos új terápiás készítményt vezettek be. Jelenleg a PC szisztémás kezelése hormonterápiából, kemoterápiából, immunterápiából, radiofarmakonokból és célzott terápiából áll, amelyek közül sok kardiovaszkuláris szövődményekkel jár (1).
Androgéndeprivációs terápiák
és kardiovaszkuláris rizikófaktorok
A PC-s betegek körében a szív- és érrendszeri okokból bekövetkező halálozás a vezető halálok, és a PC hatékonyabb terápiái miatt jelenleg a halálozások 25-35%-át teszik ki (2). A PC-s férfiak körülbelül 30%-ának van ismert kardiovaszkuláris betegsége (CVD), és e betegek között még nagyobb arányban fordulnak elő különböző kardiovaszkuláris kockázati tényezők (CVRF), úgymint az elhízás, a cukorbetegség, a magas vérnyomás és a magas vérzsírszintek (3). A PC-ben szenvedő férfiak körében gyakori a módosítható rizikótényezők gyenge kontrollja.
A RADICAL-PC-vizsgálatban 2811 PC-s beteg vizsgálata során, a résztvevők (9% metasztatikus PC-vel és 23% már meglévő CVD-vel) 99%-ának legalább egy kontrollálatlan rizikótényezője volt, és 51%-uknak gyenge volt a kockázatitényező-kontrollja (3).
Az előrehaladott prosztatadaganatok szisztémás kezelésének alapja az androgéndeprivációs terápia (ADT), amelyet leggyakrabban gonadotropinfelszabadítóhormon- (GnRH-) agonisták vagy antagonisták alkalmazásával végeznek. A beteg életminőségének és túlélésének szempontjából kiemelt jelentőségű, hogy az ADT okozta hormonális változások negatív kardiometabolikus következményekkel járnak, amelyeket a kezelésében részt vevő szakorvosoknak (urológus, onkológus, sugárterapeuta) fel kell ismerniük, és kezelniük kell (4). Az ADT által kiváltott hypogonadismus többek között centrális elhízáshoz, dyslipidaemiához, glükózintoleranciához, izomtömegvesztéshez és csökkent terhelhetőséghez vezet, amely különösen kritikus azon prosztatadaganatos betegek esetében, akiknél már korábban is fennállt CVD vagy CVRF, mivel az ADT-kezelés során náluk a legnagyobb a kardiovaszkuláris (CV) szövődmények kockázata (4).
Bár ezek a változások összefüggenek az ateroszklerózis kialakulásával, úgy tűnik, hogy a CV szövődmények korábban jelentkeznek, és gyakrabban fordulnak elő az intermittáló ADT során, amikor a terápiás expozíciót ciklikusan kapcsolják be és ki. Ez alapján feltehető, hogy az aterogenezisen túl a kardiotoxicitás további mechanizmusai közé tartozhatnak az ADT megkezdésekor fellépő folliculusstimuláló hormonlökés (FSH-surge), a hormonális állapotok közötti hirtelen átmenetek és a GnRH-agonista hatása az ér- és szívizomsejtekre. A kardiotoxikus hatások felismerése után az American Heart Association és az American Urologic Association közös bizottsága tudományos ajánlást tett közzé, amelyben figyelmeztetett az ADT-vel összefüggő diabetes mellitus és a súlyos, nemkívánatos CV események fokozott kockázatára. Ezek a kockázatok a leghangsúlyosabbak azoknál a férfiaknál, akiknek alapvetően CVD-jük vagy CVRF-jük van, valamint a fokozott vagy hosszan tartó ADT-expozícióban részesülő férfiak esetében (5).
GnRH-antagonisták és -agonisták
A GnRH-antagonisták és -agonisták kardiológiai vonatkozásait többek között a HERO- (Study to Evaluate the Safety and Efficacy of Relugolix in Men With Advanced Prostate Cancer) és a PRONOUNCE- (Trial Comparing Cardiovascular Safety of Degarelix Versus Leuprolide in Patients With Advanced Prostate Cancer and Cardiovascular Disease) vizsgálatok elemezték (6). Preklinikai és klinikai adatok arra utalnak, hogy a GnRH-antagonisták alkalmazása az agonistákhoz képest jelentősen alacsonyabb összhalálozással és CV eseményekkel jár (7).
A HERO-vizsgálatban előrehaladott prosztatarákban szenvedő betegeket 2:1 arányban randomizáltak, 48 héten keresztül relugolixra (120 mg naponta egyszer szájon át) vagy leuprorelinre (3 havonta egyszeri injekció). A vizsgálatba beválasztott férfiak több mint 90%-ának volt CVRF-je. Az előre meghatározott biztonságosságelemzésben a súlyos nemkívánatos CV eseményeket nem halálos szívinfarktusként, nem halálos stroke-ként és bármilyen okból bekövetkező halálesetként definiálták. A súlyos nemkívánatos CV események előfordulása 2,9% volt a relugolixcsoportban, és 6,2% a leuprorelincsoportban. Azoknak a betegeknek az alcsoportjában, akiknek a kórtörténetében már előfordultak a fent definiált CV események, a súlyos nemkívánatos CV események előfordulása 3,6% volt a relugolixcsoportban, és 17,8% a leuprorelincsoportban, ami azt jelzi, hogy az esemény bekövetkezésének esélye 4,8-szer nagyobb volt a leuprorelin-, mint a relugolixcsoportban pozitív CV anamnézis mellett (6).
A nemzetközi, multicentrikus, prospektív, randomizált PRONOUNCE-vizsgálatban PC és egyidejűleg CVD betegségben szenvedő férfiak véletlenszerűen 1:1 arányban kapták a GnRH-
antagonista degarelixet vagy a GnRH-agonista leuprorelint 12 hónapon keresztül. Az elsődleges végpont a 12 hónapon belüli súlyos CV esemény (halál, szívinfarktus vagy stroke) volt. A vizsgálatot a lassabb betegbevonás miatt a tervezetthez képest hamarabb leállították. Súlyos nemkívánatos CV esemény a degarelixet kapó betegek között 5,5%-ban, a leuprorelint kapó betegeknél 4,1%-ban fordult elő, így nem találtak különbséget a két csoport között egy év utánkövetés során. A korábbi vizsgálatokhoz képest összességében alacsonyabb kardiovaszkuláris eseményszámot észleltek, és kiemelt fontosságú, hogy minden beválasztott beteget kardiológus vizsgált meg a bevonáskor, ami a meglévő CVRF-ek optimális kezeléséhez vezetett (8).
A mechanizmus, amellyel a GnRH-agonisták növelik a súlyos kardiovaszkuláris események rövid távú kockázatát, nem világos, bár feltételezhető, hogy az agonisták elősegíthetik az ateroszklerotikus plakk destabilizációját és rupturáját. Ezt támasztja alá az a megfigyelés, hogy GnRH-agonistával kezelt egerekben a plakkok nekrotikus magterülete szignifikánsan nagyobb az antagonistával kezeltekéhez képest. Bár a plakk méretében nem találtak különbséget, jellegében, vulnerabilitásban igen, mivel a nekrotikus mag térfogata a GnRH-agonistákkal kezelt egerek esetében magasabb volt (9).
Új generációs antiandrogén-kezelés
Az Európai Urológus Társaság legfrissebb irányelvei alapján az előrehaladott prosztatadaganatok kezelésének fontos részét képezik az új generációs antiandrogén készítmények (ARTA), úgymint az abirateron (alacsony dózisú prednizolonnal együtt használva), az enzalutamid, az apalutamid és a darolutamid. Bár az új típusú kezelések jelentős túlélésbeli előnyökkel járnak, a klinikusnak számolnia kell azok kardiovaszkuláris mellékhatásaival is. Az abirateront a magas vérnyomás, a diabetes mellitus, a hypokalaemia és az ödéma fokozott kockázatával hozták összefüggésbe, amelyek mind hozzájárulhatnak a kardiovaszkuláris betegségek kialakulásához (9). Az enzalutamid a kardiovaszkuláris események, köztük a magas vérnyomás, a pitvarfibrilláció és a szívinfarktus fokozott kockázatával járhat. Az irodalmi adatok alapján az abirateron esetében nagyobb valószínűséggel fordul elő szívbetegség, mint az enzalutamid esetében; míg az enzalutamid esetében nagyobb valószínűséggel fordult elő magas vérnyomás, mint az abirateron esetében (10, 11). Ezen kardiovaszkuláris hatások hátterében álló pontos mechanizmusok azonban nem teljesen tisztázottak, bár az abirateron mellett alkalmazandó alacsony dózisú prednizolonpótlás az alacsony glükokortikoid-szinteket hivatott kivédeni, nem zárható ki szerepe a mellékhatások kialakulásában (12).
Kemoterápia
A PC-s betegeknél a leggyakrabban alkalmazott kemoterápiás szerek közé tartozik a docetaxel, amely alkalmazása során a szívelégtelenség fokozott kockázatával kell számolni, különösen a már meglévő CVRF-fel rendelkező betegek esetében (13).
Az Európai Kardiológiai Társaság
onkokardiológiai ajánlása
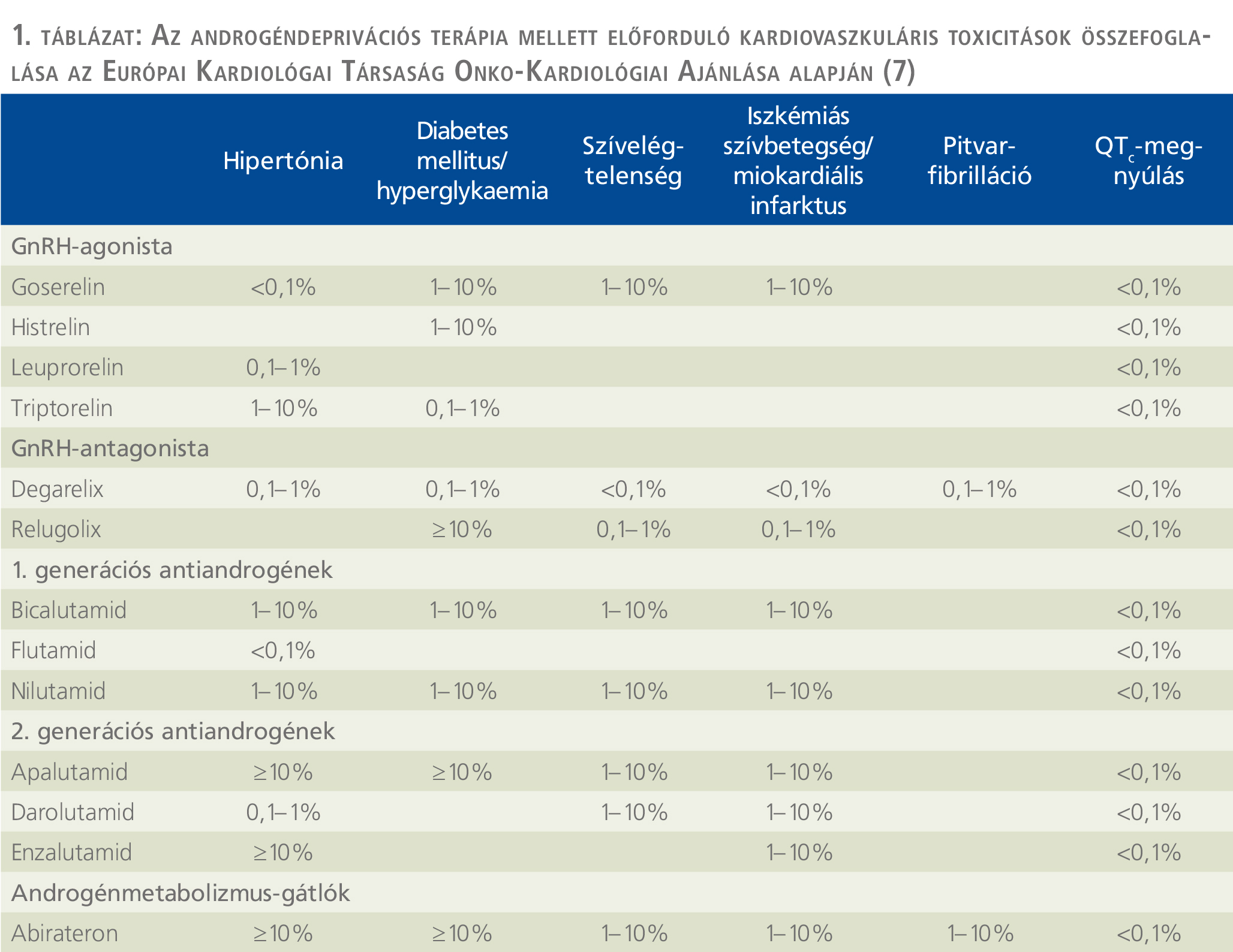
Az alábbiakban összefoglaljuk a 2022 nyarán először publikált Európai Kardiológai Társaság onkokardiológiai ajánlásának PC-s betegekre vonatkozó részeit. Az ajánlásban hasznos összesítő táblázat található a különböző típusú ADT-k kardiovaszkuláris toxicitásának típusairól és gyakoriságáról
(1. táblázat).
Az európai ajánlásban továbbá részletes útmutatást találhatunk a kiindulási kardiovaszkuláris rizikóbecslésre és utánkövetésre (2. táblázat) (7).

Mivel a PC eleve a kardiovaszkuláris rizikó szempontjából magasabb kockázatú betegcsoportot érint, amelyhez hozzáadódik a daganatellenes kezelés(ek) esetleges kardiovaszkuláris mellékhatása, a kérdés tárgyalása kiemelten fontos.
Összességében elmondható, hogy azon prosztatadaganatos férfiak kezelése során, akiknek már meglévő CVD-jük, vagy kettőnél több CVRF-jük van, lehetőség szerint fontolják meg az onkokardiológus vagy onkológiában jártas kardiológussal való közös konzultációt. Az ADT-ben részesülő PC-s férfiak többségének optimális ellátása magában foglalja az onkológiai és kardiovaszkuláris szempontok közötti kényes egyensúlyt, beleértve a kardiovaszkuláris rizikófaktorok optimalizálását az ADT-expozíció előtt és után (4).
Finanszírozás, támogatás
A közlemény a Kulturális és Innovációs Minisztérium ÚNKP-22-4-II-SE és ÚNKP-22-3-1-SE-19 kódszámú Új Nemzeti Kiválóság Programjának a Nemzeti Kutatási, Fejlesztési és Innovációs alapból finanszírozott szakmai támogatásával készült. A TKP2021-EGA-23 számú projekt az Innovációs és Technológiai Minisztérium Nemzeti Kutatási Fejlesztési és Innovációs Alapból nyújtott támogatásával, a TKP2021-EGA pályázati program finanszírozásában valósult meg.
Irodalom
1. Wilk M, Was´ko-Grabowska A, Szmit S. Cardiovascular Complications of Prostate Cancer Treatment. Front Pharmacol 2020; 11: 555475. https://doi.org/10.3389/fphar.2020.555475
2. Weiner AB, Li EV, Desai AS, Press DJ, Schaeffer EM. Cause of death
during prostate cancer survivorship: A contemporary, US population-
based analysis. Cancer 2021; 127: 2895–904.
https://doi.org/10.1002/cncr.33584
3. Klimis H, Pinthus Jehonathan H, Aghel N, Duceppe E, Fradet V, Brown I, et al. The Burden of Uncontrolled Cardiovascular Risk Factors in Men With Prostate Cancer. JACC: CardioOncology 2023; 5: 70–81.
https://doi.org/10.1016/j.jaccao.2022.09.008
4. Narayan V, Ross Ashley E, Parikh Ravi B, Nohria A, Morgans Alicia K. How to Treat Prostate Cancer With Androgen Deprivation and Minimize Cardiovascular Risk. JACC: CardioOncology 2021; 3: 737–41.
https://doi.org/10.1016/j.jaccao.2021.09.014
5. Levine GN, D’Amico AV, Berger P, Clark PE, Eckel RH, Keating NL, et al. Androgen-Deprivation Therapy in Prostate Cancer and Cardiovascular Risk. Circulation 2010; 121: 833–40.
https://doi.org/10.1161/CIRCULATIONAHA.109.192695
6. Shore ND, Saad F, Cookson MS, George DJ, Saltzstein DR, Tutrone R, et al. Oral Relugolix for Androgen-Deprivation Therapy in Advanced Prostate Cancer. New England Journal of Medicine 2020; 382: 2187–96.
https://doi.org/10.1056/NEJMoa2004325
7. Lyon AR, López-Fernández T, Couch LS, Asteggiano R, Aznar MC, Bergler-Klein J, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). European heart journal. 2022.
8. Lopes RD, Higano CS, Slovin SF, Nelson AJ, Bigelow R, Sørensen PS, et al. Cardiovascular Safety of Degarelix Versus Leuprolide in Patients With Prostate Cancer: The Primary Results of the PRONOUNCE Randomized Trial. Circulation 2021; 144: 1295–307.
https://doi.org/10.1161/CIRCULATIONAHA.121.056810
9. Hopmans SN, Duivenvoorden WC, Werstuck GH, Klotz L, Pinthus JH. GnRH antagonist associates with less adiposity and reduced characteristics of metabolic syndrome and atherosclerosis compared with orchiectomy and GnRH agonist in a preclinical mouse model. Urol Oncol 2014; 32: 1126–34. https://doi.org/10.1016/j.urolonc.2014.06.018
10. Zheng X, Zhao X, Xu H, Han X, Xu H, Dong X, et al. Efficacy and safety of abiraterone and enzalutamide for castration-resistant prostate cancer: A systematic review and meta-analysis of randomized controlled trials. Medicine (Baltimore) 2019; 98: e17748.
https://doi.org/10.1097/MD.0000000000017748
11. Lee HY, Chen HL, Teoh JY, Chen TC, Hao SY, Tsai HY, et al. Abiraterone and enzalutamide had different adverse effects on the cardiovascular system: a systematic review with pairwise and network meta-analyses. Prostate Cancer Prostatic Dis 2021; 24: 244–52.
https://doi.org/10.1038/s41391-020-00275-3
12. Auchus RJ, Yu MK, Nguyen S, Mundle SD. Use of prednisone with abiraterone acetate in metastatic castration-resistant prostate cancer. Oncologist 2014 Dec; 19(12): 1231–40.
https://doi.org/10.1634/theoncologist.2014-0167
13. Lyon AR, Yousaf N, Battisti NML, Moslehi J, Larkin J. Immune checkpoint inhibitors and cardiovascular toxicity. Lancet Oncol 2018; 19: e447–e58. https://doi.org/10.1016/S1470-2045(18)30457-1