Sexual rehabilitation after radical prostatectomy
DOI: 10.22591/magyurol.2023.3.kopazs.118
Authors:
Kopa Zsolt dr.1, Hajdú-Tóth Erzsébet dr.1, 2
1Semmelweis Egyetem, Urológiai Klinika, Andrológiai Centrum, Budapest (igazgató: Nyirády Péter dr.)
2Kiskunhalasi Semmelweis Kórház, SZTE Oktató Kórháza, Urológiai Osztály, Kiskunhalas (osztályvezető: Molnár Sándor dr.)
Summary
The number of radical prostatectomies shows an increasing trend, more and more men are diagnosed with the disease at an early stage, so they receive curative surgical therapy. In addition to
making them tumour-free, the question of quality of life plays an increasingly important role. Erectile dysfunction (ED) is the main complication next to urinary incontinence, affecting quality of life.
The authors analyse the pathophysiology and possible causes of erectile dysfunction following radical prostatectomy. The possibilities of early and late penile rehabilitation methods are summarized. With decreasing age of the affected patients, preserving and improving the postoperative sexual function is of increasing importance.
LAPSZÁM: MAGYAR UROLÓGIA | 2023 | 35. ÉVFOLYAM, 3. SZÁM
Összefoglalás
A radikális prosztataműtétek száma hazánkban is növekvő tendenciát mutat, egyre több férfinál ismerik fel a betegséget még korai stádiumban, így kuratív sebészi terápiában részesülnek. A tumormentességen kívül e betegek gyógyítása kapcsán egyre nagyobb szerepet kap az életminőség kérdése, amelynek egyik fokmérője a szexuális teljesítőképesség.
A szerzők elemzik a radikális prostatectomia kapcsán kialakuló erektilis diszfunkció mechanizmusát, lehetséges okait. Összefoglalják a korai és késői péniszrehabilitáció lehetőségeit.
Mivel megnőtt a fiatalabb korú betegek száma, így a szexuális aspektus egyre inkább előtérbe került, ezáltal a radikális műtét utáni péniszrehabilitáció jelentősége is megnő.
Míg a betegek műtét előtt inkább csak a rosszindulatú betegség tényével, annak elfogadásával, a gyógyulás esélyének mérlegelésével vannak elfoglalva, addig a radikális prostatectomián átesett férfiak többségének irreálisak az elvárásai a szexuális és vizelési funkcióról. Amikor már túl vannak a műtéten, a túlélést és a gyógyulás közelségét látják, az életminőségre terelődik a figyelem. Ennek pedig egyik legnagyobb fokmérője a férfiaknál a merevedési képesség. A műtét utáni szexuális zavarok negatív hatással vannak az önbizalomra, és sajnos a párkapcsolatokra is, pedig azok általában az érintett korcsoportban már tartós, erős jellegűek. Az újabb és újabb műtéti technikák egyre inkább fókuszálnak a lehető legkíméletesebb eljárás megtalálására, de még így is jelentős számban fordul elő a hosszú távú szexuális diszfunkció. Irodalmi adatok szerint a posztoperatív erektilis diszfunkció (ED) előfordulását 14 és 90% közötti előfordulással találjuk, ha a műtét után eltelt idő függvényében vizsgáljuk, 12 hónappal a műtét után 10-46%-ban fordul elő merevedési zavar (2), ez az arány 24 hónap után 6-37% (3). Annak ellenére, hogy a műtét után az erektilis funkció (EF) 2 év után is vissza tud térni, a legtöbb páciens nem tudja elérni a műtét előtti merevedési képességét (12). Mindezek mellett a prosztatarák diagnosztikájának kiterjesztésével megnőtt a fiatalabb korú betegek száma, így a szexuális aspektus is természetesen még inkább előtérbe került, még fontosabbá vált, ezáltal a radikális műtét utáni péniszrehabilitáció jelentősége is megnőtt.
A műtét utáni ED kialakulásának okai
Az erekció kialakulásában kiemelt szerepet játszanak a barlangos testek simaizmai. 1982 óta ismert ezek döntő szerepe (4), a merevedés elérésének és fenntartásának is a simaizom funkciója a nyitja (11). De ugyanígy a szöveti oxigenizáció is ennek függvénye. Ez az összefüggés igazolható az éjszakai pénisz tumescentia és rigiditási vizsgálat (nocturnal penile tumescense and rigidity, NPTR) során is, ugyanis az éjszakai erekciók hiánya esetén a corpus cavernosumokban perzisztens hypoxia igazolható, ami mintegy ördögi körként a merevedés károsodását eredményezi (7). A simaizom relaxációjában, ami a lakunáris terek megnyitásában játszik fő szerepet, a neurális funkció meghatározó jelentőségű. A radikális műtétek során ezeknek az idegkötegeknek a sérülése az elsődleges a posztoperatív merevedési zavar kialakulásában. Az idegkímélő műtéti technikák során az idegsérülés mértéke jóval kisebb, de gyakran nem kerülhető el, tehát így is számolni kell 12-24 hónapon belül, valamelyes EF csökkenéssel (dormant nerves, „alvó idegek”). Az irradiáció során pedig a besugárzott területen fekvő idegek károsodásával kell számolni.
Az idegek sérülése során a nitrogén-monoxid- (NO-) rendszer károsodik. A NO a merevedés mechanizmusának kulcsszereplője, a szexuális ingerek hatására L-argininből hasad le a nonkolinerg, nonadrenerg idegvégződéseken, és diffundál a corpus cavernosum artériájának simaizomsejtjeibe, ahol a ciklikus GMP (guanozin-monofoszfát) felszaporodását eredményező reakciót indítja el. Ez a folyamat generálja a sejten belüli kalciumszint változását, ami végül is a simaizom relaxációjához vezet. A NO-szintáz enzim aktivitásának csökkenése már 3 héten belül kimutatható idegsérülések esetén. A patomechanizmus egyik következő lépése a cavernosus idegek károsodása, amellyel a simaizmok apoptosisa növekszik, az idegsérülés időtartamának arányában a pénisz súlya is csökken. Radikális prostatectomia során, illetve után, a hímvessző rövidül, ez a hosszcsökkenés 1 éven át folyamatosan tart, de legkifejezettebb a katéter eltávolításának időpontjában. Fontos szerepet tölt be a szexuális diszfunkció kialakulásában a barlangos testek műtét utáni kollagenizációja, amely a parciális oxigéntenzió függvénye, és végül fibrózis kialakulásához vezet. A szimpatikus tónus növekedése is hozzájárul a posztoperatív ED kialakulásához. A neurogén diszfunkció önmagában (tk. neuropraxia) átmeneti jellegű, a radikális műtét után kb. 2 év után javulhat, ez magyarázza az erektilis funkció javulását ezen időszakot követően. A műtét utáni időszakban a hímvessző tartósan flakcid állapota következtében romlik a barlangos testek oxigenizációja, a corpus cavernosumok idegei károsodnak. Az ezzel járó oxidatív stressz tovább ront az állapoton, hormoneltérések is jelentkeznek, amelyek súlyosbítják a képet. A kialakuló fibrózis és a venookkluzív diszfunkció által válik teljessé a kép, és alakul ki az erektilis zavar.
Péniszrehabilitáció
A radikális prostatectomia utáni szexuális rehabilitáció elsődleges célja az erekció visszatértének korai elérése. Ez célozhatja a spontán-, vagy akár a gyógyszeres stimulációra létrejövő merevedést is. A corpus cavernosumok oxigenizációjának javítása egyrészt gátolja a fibrózis kialakulását, másrészt csökkenti az apoptosist. Figyelmet kell fordítani a rehabilitáció során a pénisz méretének megóvására is. A kezelés személyre szabott kell hogy legyen, és figyelembe kell venni a beteg együttműködését, illetve a költségvonzatot is (6).
A szexuális rehabilitáció már a műtét előtt kezdődik. A beavatkozás előtt 2-4 héttel célszerű az erektilis funkció objektív felmérése, elsősorban az IIEF (International Index of Erectile
Function) és a SEP (Sexual Encounter Profile) kérdőívekkel. Összegeznünk kell az ED rizikótényezőit, és fel kell világosítanunk a beteget – és lehetőség szerint partnerét is – a szexuális funkció javítására tervezett lépésekről, ezek időfaktoráról. Ha a preoperatív merevedési funkció már eleve gyengült, szóba jöhet PDE5- (5-ös típusú foszfodiészteráz enzim) gátló profilaktikus kezelés is. A rehabilitáció következő lépése a műtét után történik. A hólyagkatéter eltávolításakor célszerű indítani a gyógyszeres kezelést: L-arginin adása a NO-rendszer aktiválásához járul hozzá, a napi PDE5-gátló-kezelés az erekció korai visszatérésének esélyét hivatott növelni, a vákuumterápia rendszeres alkalmazása gátolja a fibrózis kialakulását, a pénisz hosszcsökkenését, és javítja a vénás szökés káros hatásait. A PDE5-gátló tartós alkalmazása jótékony hatású a simaizom-tartalom növelésében, csökkenti a simaizmok apoptosisát. Ezáltal javul a venookkluzív funkció (5). Schwartz és munkatársai másnaponkénti 50 mg sildenafil mellett már az apoptosis korai csökkenését mutatták ki, 100 mg-os adagolás megnövelte a simaizom-tartalmat (10). A PDE5-gátló tartós adása során az endotheliumfüggő simaizom-relaxációs képesség is növekszik (1).
A vákuumos eszköz használatával a teljes erekció elérését célozzuk, ha ez sikerül, a merevedés 1 percen át történő megtartása javasolt. Ezt a kezelést egymás után többször ismételve alkalmazzuk, rövid szünetek beiktatásával, akár 6-12 hónapon át. Fontos, hogy az öninjekciós terápia mellett ez az eljárás nem alkalmazható, csak azokon a napokon, amikor prosztaglandinterápia nem történik.
A műtét után 1 hónappal a gyógyszeres kezelést folytatjuk, súlyosabb zavar esetén a PDE5-gátló mellett ilyenkor már elkezdhetjük a rendszeres prosztaglandininjekciós terápiát. Az EF visszatérésének aránya ezzel jelentős mértékben javítható (67%), míg a kezelés e lépcsője nélkül, ebben az időben ez az arány csak 20%-os. Jótékony hatású az öninjekciós kezelés a vénás szökés vonatkozásában is (53% versus 17%). Ebben az időszakban kezdődhetnek a szexuális aktusok is, PDE5-gátlóval, illetve a vákuumos eszközzel történő kombináció is opció lehet. A posztoperatív 3. hónap után, a gyógyszeres kezelés hatástalansága esetén prosztaglandininjekciós terápia szükséges, illetve a gyógyszeres kezelés további 2 hónapig ilyenkor is folytatható a javulás reményében. Terápiarezisztens ED esetén végső megoldásként péniszprotézis-implantáció végzése jön szóba (1. ábra).
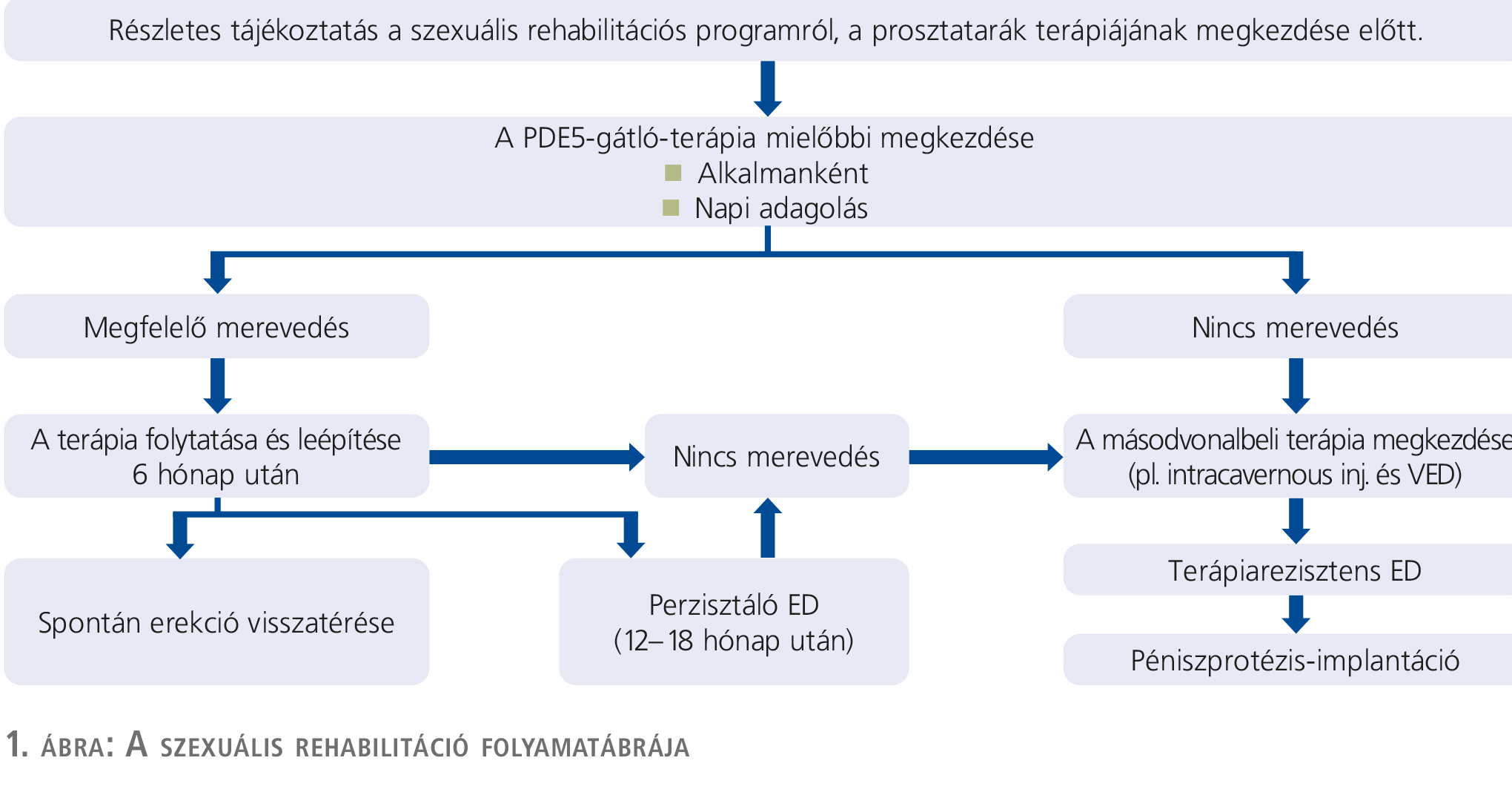
A péniszrehabilitációt tehát személyre szabott kezelésként tervezzük és végezzük, így a leghatékonyabb. A PDE5-gátló-kezelés nem hatékony enyhe fokú posztoperatív ED esetén, 65 év alatti betegeknél, amikor az IIEF-pontszám 26 feletti, és a Charlson-féle komorbiditási index 1 alatti. Az igény szerinti kezeléssel szemben a tartós adagolás hatékonyabb 65-70 éves pácienseknél, 11-25 IIEF-pont és 1 alatti Charlson-index mellett. A kétféle adagolási séma hatékonysága között nincs különbség 70 éves életkor felett, amikor az IIEF-pont 10 alatti, és a Charlson-index 2 feletti.
Újabban az alacsony intenzitású lökéshullám-kezelés (low intensity extracoporal shock wawe therapy, li-ESWT) szerepe is felvetődött a péniszrehabilitáció folyamatában. Alapja az a teoretikus hatás, amely a neoangiogenezist, a progenitor sejtek számának növelését, a vazodilatáció módosítását, neurális regenerációt jelentene. A kezelést klinikai vizsgáltban 6 héten át alkalmazták, PDE5-gátlóval kombinálva. Jelenleg nem áll rendelkezésünkre olyan evidenciaalapú ismeret, amely által ezt a kezelési módszert a rehabilitáció szerves részének tekinthetnénk (9). A legújabb kísérleti irányok: ideggraftok alkalmazása, őssejtterápia, génterápia, immunofil ligandok alkalmazása, növekedési faktorok, hiperbárikus oxigénterápia, losartankezelés, atorvastatin alkalmazása, jelenleg mind kísérleti stádiumban vannak.
Egy, a közelmúltban készült nemzetközi statisztika szerint a megkérdezett szakorvosok 15%-a indítja el a rehabilitációt már a műtét előtt, 9%-uk a beteg kórházi emissziójakor, legnagyobb részük – egyharmaduk – a katéter eltávolítása után kezdi. Huszonkét százalék kezdi a terápiát 1 hónap után, 4% 2 hónap után, és 5% 3 hónap után. A legnagyobb arányban a tartós PDE5-gátló-kezelést (54,8%), a PDE5-gátló + prosztaglandin (20%), és a PDE5-gátló + vákuum kombinációt (12%) alkalmazzák (8).
Egyre több férfinél ismerik fel a betegséget még korai stádiumban, így a radikális prosztataműtétek száma hazánkban is növekvő tendenciát mutat.
A nyílt műtétek után a laparoszkópia, és napjainkban a robottechnika révén ezek a férfiak kuratív sebészi terápiában részesülnek. Életük meghosszabbítása, tumormentessé tételük mellett ne feledjük el, hogy az urológus sebész sikeres munkája után a beteg tovább éli az életét, és neki akkor már ismét fontos az élet minősége, amelynek egyik leglényegesebb fokmérője a szexuális teljesítőképesség. A péniszrehabilitáció szempontjait figyelembe véve segíthetünk a teljes gyógyulás felé vezető úton, és egyre több, gyógyult és elégedett férfi folytathatja mindennapjait.
Irodalom
1. Behr-Roussel D, Gorny D, Mevel K, Caisey S, Bernabé J, et al. Chronic sildenafil improves erectile function and endothelium-dependent cavernosal relaxations in rats: lack of tachyphylaxis. Eur Urol 2005 Jan; 47(1): 87–91. https://doi.org/10.1016/j.eururo.2004.09.005.
2. Bratu O, Oprea I, Marcu D, et al. Erectile dysfunction post-radical prostatectomy – a challenge for both patient and physician. J Med Life 2017; 10(1): 13–18.
3. Ficarra V, Novara G, Ahlering TE, Costello A, Eastham JA, Graefen M, et al. Systematic review and meta-analysis of studies reporting potency rates after robot-assisted radical prostatectomy. Eur Urol 2012; 62: 418–30.
4. Goldstein AM, Meehan JP, Zakhary R, Buckley PA, Rogers FA. New observations on microarchitecture of corpora cavernosa in man and possible relationship to mechanism of erection. Urology 1982 Sep; 20(3): 259–66. https://doi.org/10.1016/0090-4295(82)90634-3.
5. Kovanecz I, Rambhatla A, Ferrini M, Vernet D, Sanchez S, Rajfer J, Gonzalez-Cadavid N. Long-term continuous sildenafil treatment ameliorates corporal veno-occlusive dysfunction (CVOD) induced by cavernosal nerve resection in rats. Int J Impot Res 2008 Mar–Apr; 20(2): 202–12. https://doi.org/10.1038/sj.ijir.3901612.
6. Montorsi F, Guazzoni G, Strambi LF, Da Pozzo LF, Nava L, et al. Recovery of spontaneous erectile function after nerve-sparing radical retropubic prostatectomy with and without early intracavernous injections of alprostadil: results of a prospective, randomized trial. J Urol 1997 Oct; 158(4): 1408–10.
7. Moreland RB. Is there a role of hypoxemia in penile fibrosis: a viewpoint presented to the Society for the Study of Impotence. Int J Impot Res 1998 Jun; 10(2): 113–20. https://doi.org/10.1038/sj.ijir.3900328
8. Nicolai M, Urkmez A, Sarikaya S, Fode M, Falcone M, et al. Penile Rehabilitation and Treatment Options for Erectile Dysfunction Following Radical Prostatectomy and Radiotherapy: A Systematic Review. Front Surg 2021 Mar 2; 8: 636974. https://doi.org/10.3389/fsurg.2021.636974.
9. Rho BY, Kim SH, Ryu JK, Kang DH, Kim JW, Chung DY. Efficacy of Low-Intensity Extracorporeal Shock Wave Treatment in Erectile Dysfunction Following Radical Prostatectomy: A Systematic Review and Meta-Analysis. J Clin Med 2022 May 14; 11(10): 2775.
https://doi.org/10.3390/jcm11102775.
10. Schwartz EJ, Wong P, Graydon RJ. Sildenafil preserves intracorporeal smooth muscle after radical retropubic prostatectomy. J Urol 2004 Feb; 171(2 Pt 1): 771–4. https://doi.org/10.1097/01.ju.0000106970.97082.61.
11. Sattar AA, Salpigides G, Vanderhaeghen JJ, Schulman CC, Wespes E. Cavernous oxygen tension and smooth muscle fibers: relation and function. J Urol 1995 Nov; 154(5): 1736–9. PMID: 7563335.
12. Sivarajan G, Prabhu V, Taksler GB, Laze J, Lepor H. Ten-year outcomes of sexual function after radical prostatectomy: results of a prospective longitudinal study. Eur Urol 2014; 65: 58–65.