The effectiveness of radical prostatectomy for intermediate- and high-risk prostate tumours
DOI: 10.22591/magyurol.2023.4.docsj.177
Authors:
Dócs János dr., Berczi Csaba dr., Flaskó Tibor dr.
Debreceni Egyetem, KK Urológiai Klinika, Debrecen (igazgató: Flaskó Tibor dr.)
Summary
Introduction: Introduction: One of the possible treatments for patients with intermediate-risk and high-risk prostate cancer is radical prostatectomy.
Patients and methods: In our study, we examined the effectiveness of radical prostatectomy in patients with intermediate-risk and high risk prostate cancer. Data from 913 patients with intermediate-risk and 527 high-risk prostate cancer patients who underwent radical prostatectomy in our institute between 01.01.1996 and 01.01.2019 were processed retrospectively.
Results: After surgery, biochemical progression occurred in only 14.5% of cases and the development of both local recurrences and distant metastases was very low. Following radical prostatectomy, the high-risk group had significantly higher incidences of locally advanced tumours and margin positivity. There was no significant difference between the two groups in the frequency of either biochemical progression or local recurrence. After surgery, secondary interventions (excluding salvage irradiation) became significantly more necessary in the high-risk group.
Conclusion: For intermediate- and high-risk prostate tumours, radical prostatectomy provided excellent oncological effectiveness. In our study, we confirmed the results of previous studies about the effectiveness of radical prostatectomy for intermediate- and high-risk prostate cancer patients.
LAPSZÁM: MAGYAR UROLÓGIA | 2023 | 35. ÉVFOLYAM, 4. SZÁM
Összefoglalás
Bevezetés: A közepes és magas rizikójú prosztatadaganatos betegek egyik lehetséges kezelési módja a radikális prostatectomia.
Betegek és módszerek: Tanulmányunkban az intézetünkben végzett radikális prostatectomiák eredményességét vizsgáltuk a közepes és magas rizikójú prosztatarákos betegek vonatkozásában. Az 1996. 01. 01. és 2019. 01. 01 között végzett radikális prostatectomián átesett 913 közepes rizikójú és 527 magas rizikójú prosztatadaganatos beteg adatai kerültek feldolgozásra retrospektív módon.
Eredmények: A műtétet követően a biokémiai progresszió az eseteknek csak 14,5%-ában fordult elő és mind a lokális recidíva, mind a távoli metasztázisok kialakulása nagyon alacsony volt. A radikális prostatectomiát követően a magas rizikójú csoportban szignifikánsan magasabb lokálisan előrehaladott tumorok és a marginpozitivitás előfordulása. Sem a biokémiai progresszió, sem a lokális recidíva gyakoriságában nem volt szignifikáns különbség a két csoport között. A műtétet követően a szekunder beavatkozások (kivéve a salvage irradiációt) szignifikánsan gyakrabban váltak szükségessé a magas rizikójú csoportban.
Megbeszélés: A közepes és magas rizikójú prosztatadaganatok esetében a radikális prostatectomia kiváló onkológiai eredményességet biztosított. Eredményeink szerint a magas rizikójú tumorok esetében a lokálisan előrehaladott daganat előfordulása valamint az adjuváns kezelések alkalmazása szignifikánsan gyakoribb volt.
Bevezetés
A prosztatadaganat a második leggyakrabban diagnosztizált daganat férfiaknál (1). 2020-ban 1,4 millió prosztatatumoros beteg került diagnosztizálásra (2). A prosztatadaganat klasszifikációjára a 2017-es TNM-besorolást (3), illetve az EAU kockázati csoportok besorolását használjuk, amely utóbbi alapvetően a D’Amico prosztatadaganat osztályozási rendszerén alapul (4).
A kockázati besorolás 3 csoportot különít el, az alacsony, közepes (IR), és magas rizikójú (HR) prosztatadaganatokat (1. táblázat).
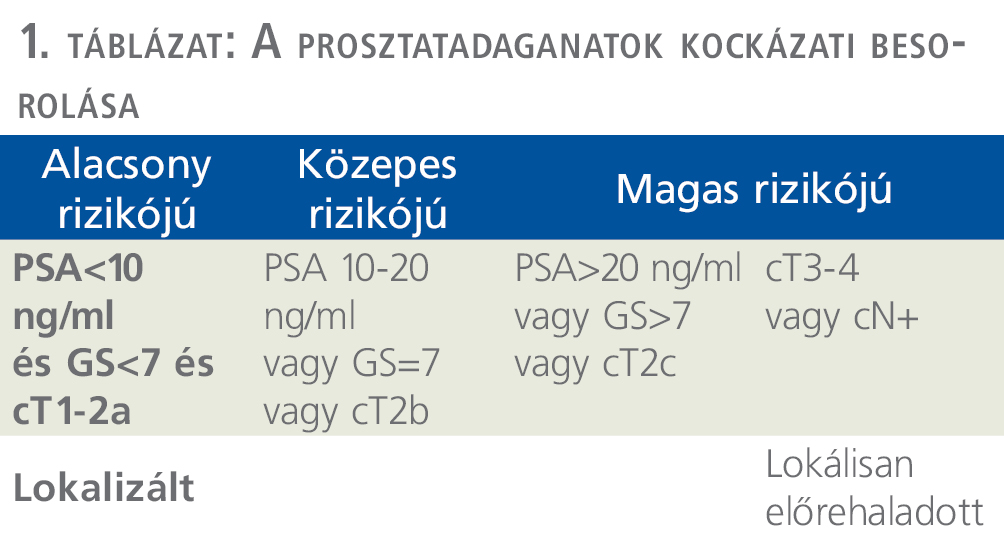
A kezelést tekintve az alacsony rizikójú betegeknél az elsődlegesen választandó kezelés az aktív követés. A legnagyobb, 1298 betegen végzett prospektív vizsgálat igazolta, hogy alacsony rizikó esetén az aktív követés kiváló hosszú távú túlélést és daganatspecifikus túlélést biztosít. A teljes túlélés (OS) 10 éves megfigyelés során 93%-os, míg a daganatspecifikus túlélés (CSS) 99%-os. Ugyanakkor kiemelendő, hogy a betegek több mint harmada a követés során magasabb rizikóbesorolásba kerül, így már az aktív kezelési módszerek egyike válik szükségessé a betegség kezelésének szempontjából (5).
IR esetekben aktív kezelés szükséges, amely magába foglalja a radikális prostatectomiát (RP) kiterjesztett nyirokcsomó-disszekcióval vagy nélkül és a sugárterápiát. A perinealis RP 1904-ben került először leírásra, azonban a feltárásból eredően a lymphadenectomia nem végezhető el (6). Napjainkban az RP nyílt retropubikus vagy transperinealis behatolásból (7), laparoszkópos (8) vagy robotasszisztált műtéttel végezhető (9). A nyirokcsomó-disszekció szükségességét jóváhagyott rizikóbecslő formulákkal szükséges eldönteni, ilyen nomogrammok a Briganti (10), Partin (11), MSKCC (11) vagy a Roach-formula (12).
HR lokalizált betegség esetén az RP kiterjesztett nyirkocsomó-disszekcióval vagy a sugárterápia hormonkezeléssel kiegészítve az elsődlegesen választandó kezelési módszer. HR lokálisan előrehaladott esetekben az aktív kezelés androgéndeprivációs terápiával legalább 2 évig kiegészítendő (13).
Az RP-t követően a szövettani eredmény és a posztoperatív PSA-szint függvényében a kezelést további adjuváns-, illetve salvage-beavatkozással kell folytatni, amely magába foglalja a sugárkezelést és hormonkezelést (14).
Jelen tanulmányunkban az IR- és a HR-prosztatatumorok esetében végzett RP eredményességét vizsgáltuk intézetünkben, retrospektív módon.
Betegek és módszerek
Intézetünkben 1996. 01. 01. és 2019. 01. 01. között RP-n átesett 913 IR- és 527 HR-prosztatadaganatos beteg adatai kerültek feldolgozásra retrospektív módon. IR esetén az átlagéletkor 63,8±6 évnek, míg HR esetén 64,0±6,3 évnek bizonyult. IR esetén a preoperatív PSA: 11,8±3,9 ng/ml volt. HR esetén a PSA 26,2±21,9 ng/ml volt.
Az IR-betegek esetén az elvégzett képalkotó vizsgálatok extraprostatikus terjedést, illetve távoli áttétet nem igazoltak. Az RP 107 esetben perinealisan, 100 esetben retropubicusan, illetve 706 esetben laparoszkópos beavatkozással történtek. Lymphadenectomia során minden esetben az MSKCC által is meghatározott 5%-os határt használtuk. Relapszusnak a műtét utáni PSA 0,2 ng/ml-t meghaladó értékét vettük. A műtét után észlelt biokémiai progresszió esetén rutinszerűen csontizotóp-vizsgálatok és mellkas-has-medence CT-t végeztünk. Esetenként kismedencei MR vagy Cholin PET CT, illetve PSMA PET CT is történt.
Eredmények
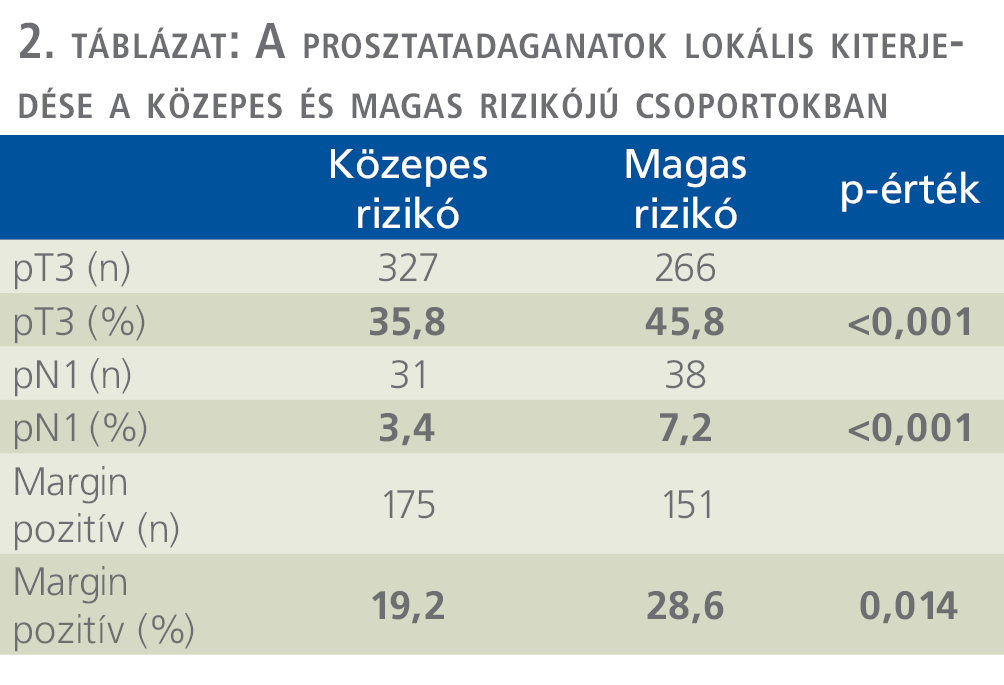
IR esetén a szövettani vizsgálat 327 esetben (35,8%) igazolt lokálisan előrehaladott (pT3) daganatot. A sebészi szél marginpozitivitása 175 betegben (19,1%), nyirokcsomó-pozitivitás 31 esetben (3,4%) fordult elő (2. táblázat).
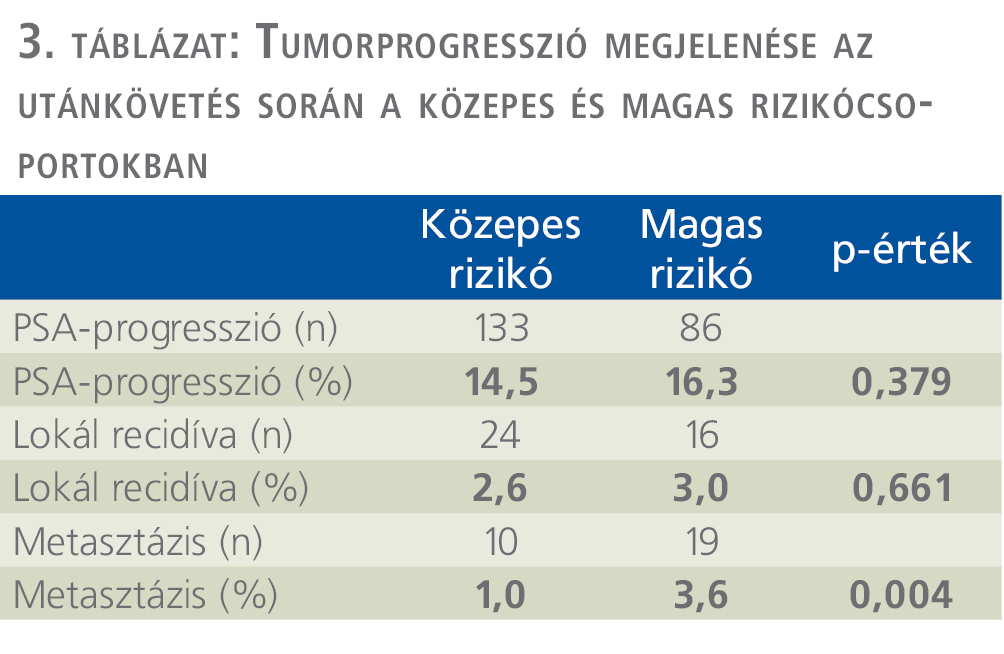
A medián 5,1 éves utánkövetés alatt, biokémiai progresszió 133 esetben (14,5%), lokális recidíva 24 esetben (2,6%), távoli metasztázis 10 esetben (1,0%) fordult elő (3. táblázat).
Az IR prosztatadaganatos betegek műtéte után adjuváns irradiációt 108 (11,8%), salvage sugárkezelést 43 (4,7%), adjuváns hormonkezelést 159 (17,4%), salvage hormonkezelést 30 (3,2%) esetben alkalmaztunk (4. táblázat).
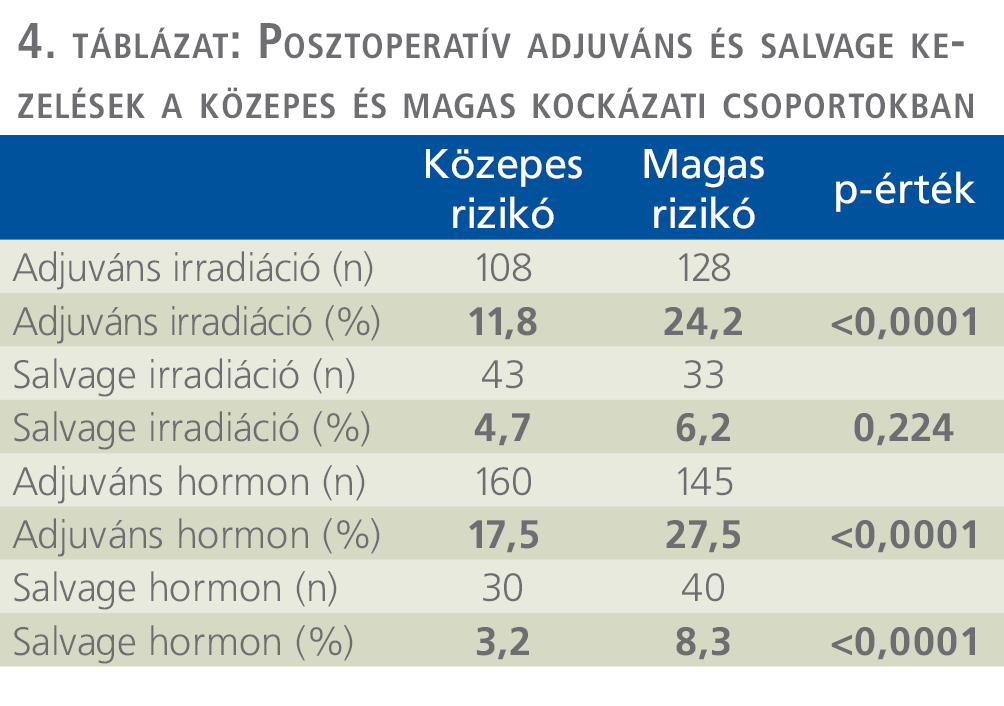
HR esetén a szövettani vizsgálat 266 esetben (45,8%) igazolt lokálisan előrehaladott (pT3) daganatot. A sebészi szél marginpozitivitása 151 betegben (28,6%), nyirokcsomó-pozitivitás 38 esetben (7,2%) fordult elő. Tumorprogresszió a medián 5,1 éves utánkövetés alatt, 86 esetben (16,3%) biokémiai progressziót, lokális recidívát 16 esetben (3%), távoli metasztázist 19 esetben (3,6%) mutatott (ld. 2–3. táblázat). A HR-prosztatadaganatos betegek műtéte után adjuváns irradiációt 128 (24,2%), salvage sugárkezelést 33 (6,2%), adjuváns hormonkezelést 145 (27,5%), salvage hormonkezelés 44 (8,3%) esetben alkalmaztunk (4. táblázat).
Megbeszélés
Az intézetünkben 22 év alatt közel 1500 közepes és magas rizikójú prosztatarákos beteg kezeléseként alkalmaztunk radikális prostatectomiát.
Retrospektív vizsgálatunk során a műtétet követően a biokémiai progresszió az esetek 14,5%-ában fordult elő a medián 5,1 éves utánkövetés során.
Biokémiai progresszió az irodalmi adatok alapján leggyakrabban 5 éves követés során 8% és 30% között fordul elő (15, 16, 17). Han és társai 5 éves utánkövetés során 8%-os biokémiai progressziót talált, amely az irodalomban fellelhető legalacsonyabb adat (18), míg Chun és munkacsoportja 30%-os értéket igazolt hasonló, 5 éves utánkövetés során, amely a legmagasabb közölt érték (19).
Lokális recidíva és a távoli metasztázis nagyon ritkán fordult elő a műtétet követően, habár a HR-csoportban szignifikánsan gyakoribb volt a metasztázis előfordulásának gyakorisága az IR-csoporthoz viszonyítva. IR esetén a műtétet követően szekunder beavatkozás (sugárkezelés, hormonkezelés) viszonylag ritkán vált szükségessé. A HR-csoportban a műtétet követően a szekunder beavatkozások (kivéve a salvage irradiációt) szignifikánsan gyakrabban váltak szükségessé.
Az RP-t követően a HR-csoportban szignifikánsan magasabb a lokálisan előrehaladott tumorok és a marginpozitivitás előfordulásának valószínűsége. Tanulmányunkban a marginpozitivitás magas rizikójú esetek 28,6%-ában fordult elő. Az irodalmi adatok alapján a sebészi szél pozitivitása lokalizált tumorok esetében a 17,6 és 23,6% között fordul elő (20). Lokálisan előrehaladott esetekben a sebészi szél pozitivitása akár 71,5%-ában is előfordulhat (21). Gyakorlott operatőr esetén a sebészi szél pozitivitási gyakorisága szignifikánsan csökkenthető. Ramsay és munkacsoportja a nyílt, laparoszkópos, illetve robotsebészeti műtétet összehasonlítva jutott arra a következtetésre, hogy a sebészi szél pozitivitása a legalacsonyabb robotasszisztált műtét esetén, amelyet a laparoszkópos majd nyílt műtét követ (20).
A biokémiai progressziót és a lokális recidíva gyakoriságát vizsgálva nem volt szignifikáns különbség az IR- és a HR-csoport között. A lokális recidíva ritka előfordulását tekintve kijelenthető, hogy a műtéttel kiváló lokális tumorkontroll érhető el, ugyanakkor kiemelendő, hogy a HR-esetekben a műtétet követően gyakran szükséges további sugár- és/vagy hormonkezelés.
Az eredmények alapján egyértelműen elmondható, hogy a közepes és magas rizikójú prosztatadaganatok esetében a radikális prostatectomia kiváló onkológiai eredményességet biztosított.
Irodalom
1. Culp MB, et al. Recent Global Patterns in Prostate Cancer Incidence and Mortality Rates. Eur Urol 2020; 77: 38. https://doi.org/10.1016/j.eururo.2019.08.005
2. IARC. Data visualization tools for exploring the global cancer burden in 2020.
3. Brierley JD, et al. TNM classification of malignant tumors. UICC International Union Against Cancer 8th edn. 2017.
4. Cooperberg MR, et al. The University of California, San Francisco Cancer of the Prostate Risk Assessment score: a straightforward and reliable preoperative predictor of disease recurrence after radical prostatectomy. J Urol 2005; 173: 1938. https://doi.org/10.1097/01.ju.0000158155.33890.e7
5. Tosoian JJ, et al. Intermediate and Longer-Term Outcomes From a Prospective Active-Surveillance Program for Favorable-Risk Prostate Cancer. J Clin Oncol 2015; 33: 3379. https://doi.org/10.1200/JCO.2015.62.5764
6. Hatzinger M, et al. [The history of prostate cancer from the beginning to DaVinci]. Aktuelle Urol 2012; 43: 228. https://doi.org/10.1055/s-0032-1324651
7. Walsh PC, et al. Impotence following radical prostatectomy: insight into etiology and prevention. J Urol 1982; 128: 492.
https://doi.org/10.1016/S0022-5347(17)53012-8
8. Schuessler WW, et al. Laparoscopic radical prostatectomy: initial short-term experience. Urology 1997; 50: 854. https://doi.org/10.1016/S0090-4295(97)00543-8
9. Binder J, et al. [Robot-assisted laparoscopy in urology. Radical prostatectomy and reconstructive retroperitoneal interventions]. Urologe A 2002; 41: 144.
10. Briganti A, et al. Updated nomogram predicting lymph node invasion in patients with prostate cancer undergoing extended pelvic lymph node dissection: the essential importance of percentage of positive cores. Eur Urol 2012; 61: 480. https://doi.org/10.1016/j.eururo.2011.10.044
11. Cimino S, et al. Comparison between Briganti, Partin and MSKCC tools in predicting positive lymph nodes in prostate cancer: a systematic review and meta-analysis. Scand J Urol 2017; 51: 345.
https://doi.org/10.1080/21681805.2017.1332680
12. Roach M. 3rd, et al. Predicting the risk of lymph node involvement using the pre-treatment prostate specific antigen and Gleason score in men with clinically localized prostate cancer. Int J Radiat Oncol Biol Phys 1994; 28: 33. https://doi.org/10.1016/0360-3016(94)90138-4
13. European Association of Urology Prostate Cancer Treatment Guideline
14. Ventimiglia E, et al. A Systematic Review of the Role of Definitive Local Treatment in Patients with Clinically Lymph Node-positive Prostate Cancer. Eur Urol Oncol 2019; 2: 294. https://doi.org/10.1016/j.euo.2019.02.001
15. García-Barreras S, et al. Biochemical recurrence-free conditional probability after radical prostatectomy: A dynamic prognosis. Int J Urol 2019 Jul; 26(7): 725–730. https://doi.org/10.1111/iju.13982
16. Negishi T, et al. Predictive factors of late biochemical recurrence after radical prostatectomy. Jpn J Clin Oncol 2017 Mar 1; 47(3): 233–238.
https://doi.org/10.1093/jjco/hyw181
17. Ficarra V, et al. Retropubic, laparoscopic, and robot-assisted radical prostatectomy: a systematic review and cumulative analysis of comparative studies. Eur Urol 2009 May; 55(5): 1037–63.
https://doi.org/10.1016/j.eururo.2009.01.036
18. Misop Han, et al. Long term biochemical disease-free and cancer-specific survival following anatomic radical retropubic: The 15-Year Johns Hopkins Experience, Urologic Clinics of North America 2001; 28(3): 555–565
https://doi.org/10.1016/S0094-0143(05)70163-4
19. Chun FKH, Graefen M, Zacharias M, et al. Anatomic radical retropubic prostatectomy-long-term recurrence-free survival rates for localized prostate cancer. World J Urol 2006; 24: 273–280. https://doi.org/10.1007/s00345-006-0058-2
20. Ramsay C, et al. Systematic review and economic modelling of the relative clinical benefit and cost-effectiveness of laparoscopic surgery and robotic surgery for removal of the prostate in men with localised prostate cancer. Health Technol Assess 2012; 16(41): 1–313. https://doi.org/10.3310/hta16410
21. Ceylan C, et al. Impact of positive surgical margin on biochemical recurrence following radical prostatectomy in locally advanced prostate cancer. Kaohsiung J Med Sci. 2016 Oct; 32(10): 514–517.
https://doi.org/10.1016/j.kjms.2016.08.007