The role of fosfomycin as an antibiotic profilaxis before transrectal prostate biopsy: a systematic review
DOI: 10.22591/magyurol.2023.4.fehera.191
Authors:
Fehér Ádám Miklós dr.1, Bajory Zoltán dr.1, Köves Béla dr.2
1Szegedi Tudományegyetem, Szent-Györgyi Albert Klinikai Központ,
Urológiai Klinika, Szeged (igazgató: Bajory Zoltán dr.)
2Jahn Ferenc Dél-pesti Kórház, Urológiai Osztály, Budapest (osztályvezető: Tenke Péter dr.)
Summary
Introduction: Transrectal prostate biopsy is one of the most frequently performed urological procedure. During the biopsy enteral bacteria may pass into the urinary tract or the blood stream causing infectious complications. To prevent possible infectious complications antibiotic prophylaxis must be used. Due to the increasing number of resistant bacterial strains and the potential side effects, the previously widely used fluoroquinolones are not permitted anymore in this indication. Therefore, there is a growing interest in alternative prophylactic antibiotics for prostate biopsies, with fosfomycin being a promising candidate. The aim of this systematic review is to summarize and report the available scientific evidence on the prophylactic use of fosfomycin for prostate biopsies.
Materials and methods: We systematically reviewed the PubMed and ScienceDirect databases until 25.09.2022 for studies comparing the prophylactic use of fosfomycin versus fluoroquinolones in case of prostate biopsies. Prospective randomized controlled trials were highlighted.
Results: Eleven original publications were identified from which 3 were prospective completely randomized controlled trials. According to the majority of the studies, the preventive effect of fosfomycin on postoperative infectious complications was at least as good as the fluoroquinolones. The two thirds of prospective randomized controlled trials showed better results of fosfomycin.
Conclusion: Fosfomycin could be a good alternative to fluoroquinolones as a choice for antibiotic prophylaxis during transrectal prostate biopsies.
LAPSZÁM: MAGYAR UROLÓGIA | 2023 | 35. ÉVFOLYAM, 4. SZÁM
Összefoglalás
Bevezetés: A transrectalis prosztatabiopszia az egyik leggyakrabban elvégzett urológiai beavatkozás. A mintavétel során bélbaktériumok juthatnak be az urotraktusba és a véráramba, infekciós szövődményeket okozva. A beavatkozást emiatt antibiotikumprofilaxisban végezzük. A rezisztens kórokozók számának növekedése mellett a lehetséges mellékhatások miatt – a korábban goldstandard – fluorokinolon antibiotikumcsoport használata már nem engedélyezett. Emiatt más antibiotikumok felé fordult a szakma figyelme. Az egyik ilyen lehetőség a foszfomicin használata. Jelen irodalomkutatás célja, hogy összefoglalja a prosztatabiopsziák során profilaktikusan alkalmazott foszfomicinnel kapcsolatban rendelkezésre álló adatokat.
Anyag és módszer: A nemzetközi szakirodalmat áttekintve feldolgoztuk a profilaktikus foszfomicint és a fluorokinolonokat összehasonlító tanulmányokat. A PubMed és a ScienceDirect adatbázisában szereplő, 2022. szeptember 25-ig publikált közleményeket vizsgáltuk. A prospektív, randomizált, kontrollált vizsgálatokat külön elemeztük.
Eredmények: A keresési feltételek alapján 11 eredeti közleményt azonosítottunk, amelyből 3 db volt prospektív, randomizált, kontrollált vizsgálat. A publikációk döntő többsége alapján a foszfomicin legalább olyan jó eredményt hozott a posztoperatív infekciós szövődmények megelőzésében, mint a fluorokinolonok. A prospektív, randomizált, kontrollált tanulmányok kétharmada alapján a foszfomicin jobb eredményt mutatott a fluorokinolonokkal szemben.
Következtetés: Antibiotikumprofilaxisként a foszfomicin használata jó alternatívája lehet a fluorokinolonoknak a transrectalis prosztatabiopsziák esetében.
Bevezetés
A transrectalis prosztatabiopszia (TRPB) az egyik leggyakrabban elvégzett urológiai beavatkozás, amelynek célja a prosztatatumor hisztológiai verifikációja, ami a kezelés alapfeltétele. Magyarországon a mintavétel leggyakrabban transrectalis úton, ultrahangvezérléssel történik, habár a legújabb irányelvek már a transperinealis mintavételt helyezik előtérbe (1).
Az Európai Urológus Társaság (EAU) ajánlása alapján a beavatkozást profilaktikus antibiotikumvédelemben kell elvégezni. A korábban goldstandardként alkalmazott fluorokinolon (FQ) antibiotikumok profilaktikus használatát az Európai Bizottság 2019-ben megtiltotta a rossz mellékhatásprofilra való tekintettel (2). Ennek következtében a szakma egyéb antibiotikumok használata felé fordult, mint például a cefalosporinok, az aminoglikozidok vagy a foszfomicin (FM). Ezeken felül különféle antibiotikumkombinációk használatának lehetősége (augmentált profilaxis) vagy direkt széklettenyésztés alapján történt antibiotikumválasztás (célzott profilaxis) is szóba jöhet. Mivel az empirikus antibiotikumprofilaxis ellenére az infekciós szövődmények aránya TRPB-t követően 1-7% közötti (3) és további növekedő tendenciát mutat (4), kiemelt jelentőségű az ideális antibiotikumprofilaxis lehetőségeinek meghatározása. A rendelkezésre álló lehetőségek közül az FM-védelemben végzett prosztatabiopszia mind a húgyúti kórokozók rezisztenciaspektruma, a készítmény prosztataszövetekben való hasznosulása és az antibiotikum stewardship elvei szempontjából is megfelelő választás lehet. Jelen irodalomkutatás célja, hogy összefoglalja a prosztatabiopsziák során profilaktikus célzattal adott FM-mel kapcsolatban rendelkezésre álló eredményeket.
Anyag és módszerek
A szakirodalomban publikált, prosztatabiopszia előtt profilaktikus célzattal adott FM hatékonyságát az FQ-okkal összehasonlító angol nyelvű közleményeket tekintettük át. Ehhez a PubMed, és a ScienceDirect adatbázisát használtuk. A keresés időpontja 2022 szeptember 25 volt, címszavai a „prostate biopsy” és „fosfomycin” voltak. A publikálás kezdő dátumát nem limitáltuk. A keresés során kizártuk a szakirodalmi áttekintő közleményeket, a metaanalíziseket, a kizárólag absztrakttal rendelkező találatokat, az esetismertetéseket és a duplikációkat. A fenti publikációk irodalmi hivatkozásait is megvizsgáltuk.
Eredmények
Az irodalomkutatás során a ScienceDirecten 181 db, a PubMeden 49 db közleményt azonosítottunk (1. ábra).
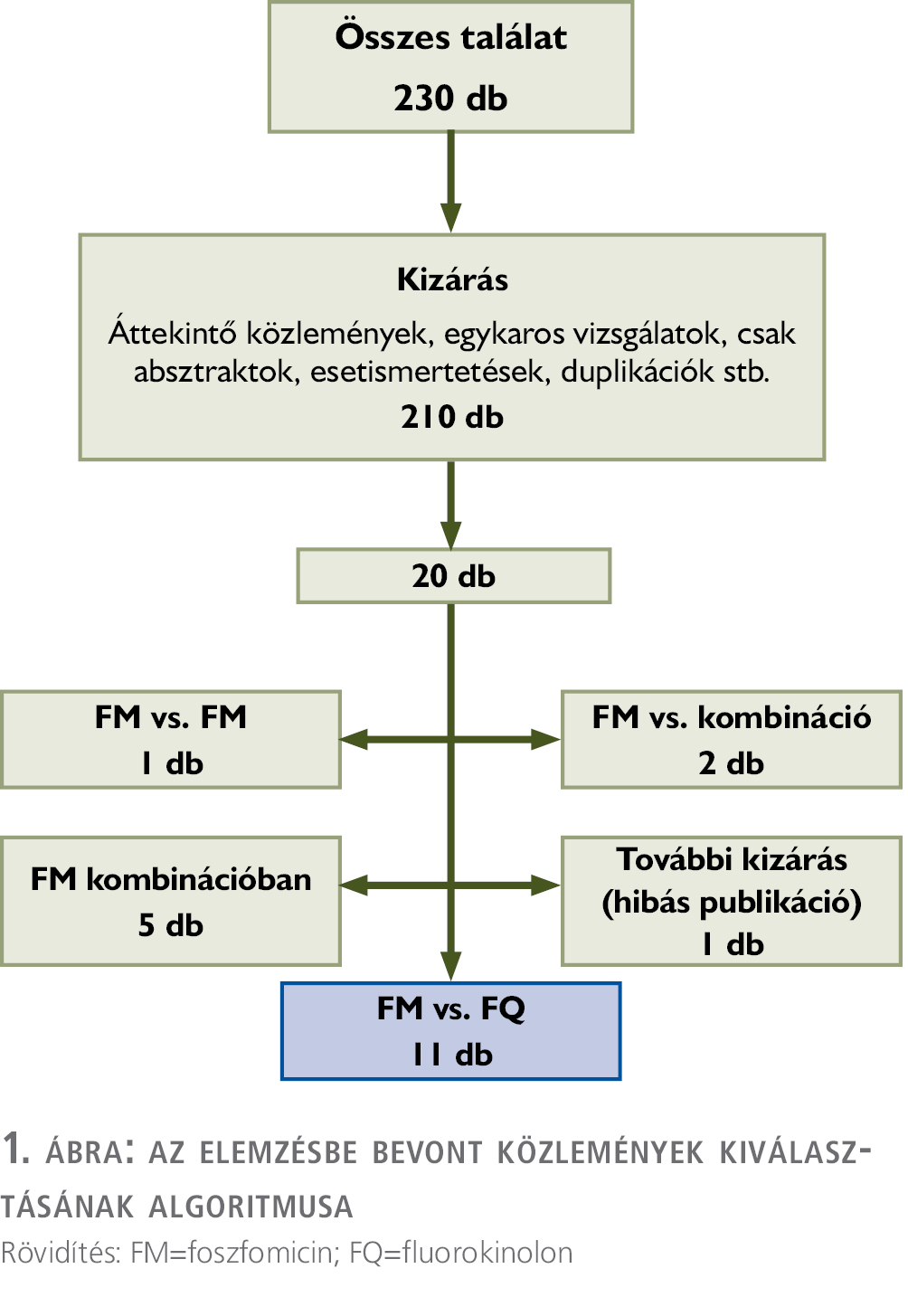
A szűrési feltételek alapján 11 eredeti közlemény hasonlította össze a CF és FM antibiotikumprofilaxist TRPB során, ebből 3 db volt prospektív, teljes mértékben randomizált, kontrollált vizsgálat (RCT) (1. táblázat).
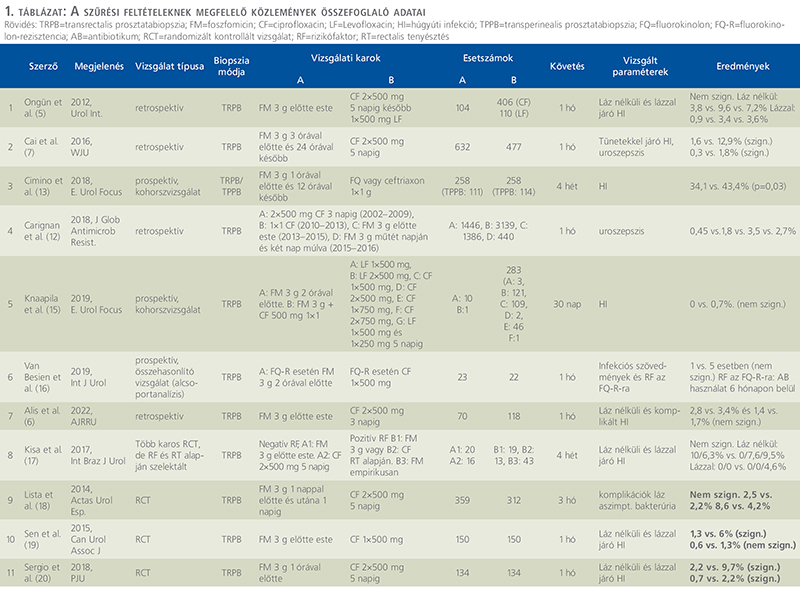
Több retrospektív tanulmány került publikálásra, amelyekben a beavatkozás előtti napon (5, 6) vagy a beavatkozás előtt 3 órával és azt követően 24 órával később adott (7) 1, illetve 2 dózis FM hatékonyságát vizsgálták FQ-val vagy FQ + cefoxitinnel (8) összevetve. Egyik esetben sem mutattak ki szignifikáns különbséget a húgyúti fertőzések kialakulásának gyakoriságában. Más szerzők szerint az FM szignifikánsan csökkentette az infekciós szövődmények előfordulási gyakoriságát ciprofloxacin (CF) + metronidazollal összevetve: 4/202 fő – 1,9% vs. 18/210 fő – 8,5%, p=0,001 (9).
Számos vizsgálatban az FM-et kombinációban hasonlították össze a CF-fel. Ezek közül két nagyobb esetszámú tanulmányt emelünk ki. Morinék 2287 beteg retrospektív analízisével vizsgálták az uroszepszis gyakoriságát az egy dózis per os (po) CF és a 3 g po FM-mel kombinált CF-profilaxisa eseteiben. Az utóbbi kezelés esetében szignifikánsan kisebb százalékban fordult elő uroszepszis: 1,1 vs. 0,2%, p=0,021 (10). Lim és munkatársai 1578 beteg eredményeit elemezték retrospektíven. Az 1-2 napig alkalmazott parenterális CF mellé adott egy dózis FM szignifikánsan csökkentette az infekciós szövődmények gyakoriságát a kizárólag FQ-profilaxissal szemben (p=0,015) (11).
Carignan és munkacsoportja 9391 TRPB-án 2002–2016 között átesett beteg leleteit dolgozták fel utólagosan. A helyi rezisztenciaviszonyoknak megfelelően kezdetben CF (2002–2013), majd 1 adag FM (1FM, 2013–2015) végül 2 adag FM (2FM, 2015–2016) antibiotikumprofilaxist alkalmaztak. Az uroszepszis előfordulási gyakoriságát vizsgálták a magas ciprofloxacinrezisztenciájú érában (2010–2013) alkalmazott CF és az 1FM-, valamint 2FM-kezelés tekintetében. Magasabb uroszepszis rátát mutattak ki mind az 1FM-, mind a 2FM-kezelés mellett: 1,8 vs. 3,5, (p=0,004) és 2,7%, (p=0,19). Tekintettel a vizsgálat kivitelezésére (retrospektív, nem kontrollált és nem randomizált) véleményünk szerint az eredmények fenntartással értékelendők (12).
Cimino és munkatársai egy multicentrikus vizsgálatban hasonlították össze az FM („A” kar, 258 fő) és FQ vagy ceftriaxon („B” kar, 258 fő) antibiotikumprofilaxist. Az eredményeket limitálja, hogy a közleményből nem derül ki hányan kaptak FQ-t vagy ceftriaxont. Érdekesség, hogy a csoportokba a TRPB (147 vs. 144 fő) mellett transperinealis prosztatabiopszián átesett pácienseket is bevontak (111 vs. 114 fő). A mintavétel típusától függetlenül magasabb arányban fordult elő húgyúti fertőzés a „B” karon: 34,1 vs. 43,4%, p=0,03 (13).
Deloryék 1 dózis FM-profilaxis hatékonyságát vetették össze 1 dózis FQ-val (ofloxacin, CF vagy levofloxacin). A prospektív vizsgálatban az antibiotikum kiválasztása a kezelőorvos döntése alapján született meg. A húgyúti fertőzések a betegek visszajelzéséből következtetett gyakorisága nem mutatott szignifikáns különbséget a két kar közt, de az FM-mel jobb eredmények mutatkoztak: FM: 9% vs. FQ: 15%, p=0,209 (14).
Több esetben előzetes rectalis tenyésztés és/vagy bizonyos rizikótényezők alapján választották meg az antibiotikumprofilaxis típusát. Knaapila és munkatársai egy multicentrikus kohorszvizsgálat során FQ-okat és az FM-et (önállóan vagy FQ-val kombinálva) hasonlították össze, emellett rectalis tenyésztést is végeztek. Nem találtak különbséget a húgyúti fertőzések gyakoriságában a karok közt (0 vs. 0,7%), bár a betegszám megoszlása jelentősen különbözött: 11 és 283 fő (15).
Van Besienék egy multicentrikus vizsgálat kereteiben, prospektív módon hasonlították össze az infekciós szövődmények gyakoriságát rectalis tenyésztést követően elvégzett TRPB-k során. A vizsgálati karon FQ-rezisztens kórokozó jelenlétekor egy dózis FM-et (23 fő), egyébként egy dózis CF-et (79 fő) kaptak. A kontrollkaron a rectalis tenyésztés eredményétől függetlenül CF (102 fő) profilaxis történt. Alcsoport-analízis során az FQ-rezisztens flórával rendelkező betegcsoportokat is összehasonlították: 23 vs. 22 fő. A húgyúti fertőzések tekintetében nem mutattak ki szignifikáns különbséget a két csoport vagy az alcsoportok közt. Eredményeik alapján FQ-rezisztens bélbaktériumok előfordulási gyakorisága magasabb fél éven belüli FQ-kezelést követően (16).
Kisa és munkatársai több karos randomizált, kontrollált vizsgálat során hasonlították össze az FM és CF antibiotikumprofilaxis hatékonyságát. A vizsgálati populációt rizikófaktorok (cukorbetegség, katéterviselés, az utóbbi fél évben történt antibiotikumkezelés, korábbi urológiai beavatkozás) hiánya („A” kar) vagy megléte („B” kar) alapján két csoportba osztották. TRPB előtt minden esetben rectalis tenyésztésre mintát vettek, azonban az „A” karnál ennek eredményét nem várták meg, 20 fő FM-et, 16 fő CF-et kapott. „B” kar esetében FQ-rezisztens baktérium izolálásakor FM (19 fő), egyébként CF (13 fő) profilaxis történt. „B” karon 43 fő a tenyésztés eredménye előtt FM-et kapott empirikusan. A húgyúti fertőzések előfordulási gyakoriságában nem mutattak ki szignifikáns különbséget. További következtetés, hogy FM előtt nem indokolt rectalis tenyésztés elvégzése (17).
A fenti három publikációban önállóan FM-et csak a páciensek kis csoportja kapott. Nagyrészt kombinált vagy FQ-profilaxist alkalmaztak, ezért a vizsgálatok eredményeiből messzemenő következtetés nem vonható le. Kiemelendő azonban, hogy a széklettenyésztések során FM-rezisztencia csak 0-2,7%-ban fordult elő.
Összesen 3 db prospektív, teljes mértékben randomizált, kontrollált vizsgálatot találtunk a szakirodalomban, amelyekben kizárólag az FM és az FQ-k hatékonyságát (különböző kezelési protokollok alapján) hasonlították össze. Mindhárom fenti vizsgálatban preoperatív beöntést is alkalmaztak a TRPB előtt.
Lista és munkatársai a 2 dózis FM-kezelés hatékonyságát vetették össze az 5 napig alkalmazott CF-kezeléssel. Az összes szövődmény (22,6 vs. 27,6%, p=0,17) vagy lázas állapot (2,5 vs. 2,2%, p=0,08) tekintetében sem találtak különbséget a két kar közt. A kéthetes kontroll alkalmával a tünetmentes bakteriúria szignifikánsan gyakrabban fordult elő az FM-profilaxist követően (8,6 vs. 4,2%, p=0,02), viszont az 1 hónapos kontroll során ez nagyobb arányban, spontán rendeződött (71 vs. 46,1%) (18).
Senék 2015-ben publikált vizsgálatában az egy-egy dózis FM és CF eredményességét elemezték. Mind a lázzal nem járó, mind a lázas húgyúti fertőzések tekintetében az FM-kar bizonyult alacsonyabb szövődményrátájúnak, előbbi esetén szignifikáns mértékben: 1,3 vs. 6%, p=0,032 és 0,6 vs. 1,3% (19).
Sergioék vizsgálatában az egy dózis FM és az 5 napos CF-profilaxis hatékonyságát hasonlították össze. A lázzal nem járó és a lázas húgyúti fertőzések egyaránt szignifikánsan alacsonyabb arányban fordultak elő az FM-karon: 2,2 vs. 9,7%, p=0,01 és 0,7 vs. 2,2%, p=0,006 (20). A fenti vizsgálatokban a lázzal nem járó húgyúti fertőzést 38 oC-os testhő feletti értéknél definiálták.
Megbeszélés
Az EAU legfrissebb irányelvei alapján amennyiben kivitelezhető, transperinealis prosztatabiopszia elvégzését kell előnyben részesíteni. Hazánkban jelenleg még döntő többségében a TRPB a mintavétel bevett módja. Azonban mindkét műtéttípusnál antibiotikumprofilaxist kell alkalmazni, amelyet javasolt helyi fertőtlenítő használatával – rectalis povidon-jódos előkészítés – kiegészíteni.
A korábban elsődlegesen ajánlott FQ-antibiotikumokkal szembeni rezisztencia növekedésével párhuzamosan a prosztatabiopsziák utáni fertőzéses szövődmények aránya is egyértelmű növekedésnek indult. Egy ettől független folyamatként, alapvetően az előnytelen mellékhatásprofiljuk miatt az FQ-antibiotikumokra vonatkozó átfogó jogi szabályozás keretében az Európai Bizottság 2019-ben betiltotta használatukat (egyebek mellett) műtéti profilaxis indikációban. Az így kialakult helyzetben bonyolultabbá vált annak megválaszolása, hogy milyen antibiotikumot, illetve milyen alkalmazási módszert válasszunk prosztatabiopsziáknál antibiotikumprofilaxisként.
Az antibiotikumprofilaxis kiválasztása történhet rectalis tenyésztés alapján (célzott, targeted profilaxis), több antibiotikum kombinálásával (augmentált profilaxis) vagy egyéb alternatív antibiotikumok használatával (1).
Célzott profilaxis során az antibiotikum kiválasztása a beavatkozás előtt levett és kiértékelt rectalis kenetet alapján történik. FQ-érzékeny rectalis törzsek esetén célzottan fluorokinolonok, FQ-rezisztens törzsek jelenléte esetén alternatív antibiotikumok kerültek alkalmazásra. Ez a módszer hatékony megoldásnak bizonyult a fluorokinolonokkal szembeni rezisztencia problémájára, azonban azok profilaktikus alkalmazásának betiltásával ez a jogilag már nem alkalmazható.
Az augmentált profilaxis pedig hatékony ugyan a fertőzések megelőzésében, azonban több antibiotikum egyidejű használata és az okozott kollaterális károk ellentmondanak az infekciókontroll általános elvének, hogy csak a minimálisan szükséges antibiotikumot használjuk.
Így a figyelem egyre inkább az alternatív antibiotikumok, például a cefalosporinok, aminoglikozidok vagy a FM használata felé fordul. Ezek közül az FM a húgyúti kórokozók antibiotikumrezisztenciája, a készítmények prosztataszövetekben való hasznosulása és az antibiotikum stewardship elvei szempontjából is megfelelő választás.
A prospektív, randomizált, összehasonlító vizsgálatok mindegyike egyetért abban, hogy az FM legalább olyan jó – sőt, az esetek többségében jobb – eredményt hozott a posztoperatív, tünetekkel járó infekciós szövődmények megelőzésében, mint az FQ-ok. Az irodalmi adatok alapján tehát az FM hatékonyan alkalmazható antibiotikumprofilaxis céljából prosztatabiopsziák során.
Az ezidáig publikált tanulmányok alapján nem egyértelmű, hogy a FM antibiotikumprofilaxist mikor érdemes megkezdeni és elegendő-e egy dózis, vagy szükség van-e ismételt, vagy fenntartó használatra? A vizsgálatok többségében az FM 1 vagy 2 dózisát alkalmazták, ráadásul a több adag használata esetében különbözőek voltak a beadások közt eltelt időtartamok. Emellett az első dózis beadásának műtéttől számított ideje is változatosnak bizonyult. Egyes szerzők szerint a prosztata perifériás zónájában a po úton bevitt FM 1-4 óra elteltével éri el a megfelelő szöveti koncentrációs szintet (21). Egy másik tanulmány alapján az FM akár 17 órán keresztül is kimutatható volt terápiás koncentrációban (22).
Következtetések
TRPB kapcsán az FM jó alternatívája lehet a korábban használt FQ-antibiotikumoknak a húgyúti fertőzések megelőzése szempontjából, azonban további randomizált, kontrollált vizsgálatok szükségesek az FM ideális dózisának és alkalmazási sémájának meghatározásához.
Irodalom
1. EAU Guidelines. Edn. presented at the EAU Annual Congress Amsterdam 2022. ISBN 978-94-92671-16-5. https://uroweb.org/guidelines/prostate-cancer
2. Bonkat G, Pilatz A, Wagenlehner F. Time to adapt our practice? The European Commission has restricted the use of fluoroquinolones since March 2019. Eur Urol 2019; 76: 273–5
3. Pilatz A, Veeratterapillay R, Köves B, et al. Update on Strategies to Reduce Infectious Complications After Prostate Biopsy. Eur Urol Focus 2019 Jan; 5(1): 20–28.
https://doi.org/10.1016/j.euf.2018.11.009
4. Pilatz A, Dimitropoulos K, Veeratterapillay R, et al. Antibiotic Prophylaxis for the Prevention of Infectious Complications following Prostate Biopsy: A Systematic Review and Meta-Analysis. J Urol 2020 Aug; 204(2): 224–230.
https://doi.org/10.1097/JU.0000000000000814
5. Ongün S, Aslan G, Avkan-Oguz V. The effectiveness of single-dose fosfomycin as antimicrobial prophylaxis for patients undergoing transrectal ultrasound-guided biopsy of the prostate. Urol Int 2012; 89(4): 439–44. https://doi.org/10.1159/000342370
6. Alias AB, Yusoff A, Nasuha NA et al. Prophylaxis Antibiotics for TRUS Biopsy: A Retrospective Analysis Comparing 2 Regimens. AJRRU 2022; 5(1): 10–16.
7. Cai T, Gallelli L, Cocci A, et al. Antimicrobial prophylaxis for transrectal ultrasound-guided prostate biopsy: fosfomycin trometamol, an attractive alternative. World J Urol 2017 Feb; 35(2): 221–228. https://doi.org/10.1007/s00345-016-1867-6.
8. Abascal JM, Fumadó Ll, Gasa B, et al. Comparative Effectiveness of Single-Dose of Fosfomycin vs. Cefoxitin Plus Ciprofloxacin as A Prophylaxis to Prevent Transrectal Prostate Biopsy Complications. Int Arch Urol Complic 2021; 7: 079.
https://doi.org/10.23937/2469-5742/1510079
9. Fahmy AM, Kotb A, Youssif TA, et al. Fosfomycin antimicrobial prophylaxis for transrectal ultrasound-guided biopsy of the prostate: A prospective randomised study. Arab J Urol 2016 Jun 27; 14(3): 228–33. https://doi.org/10.1016/j.aju.2016.05.003.
10. Morin A, Bergevin M, Rivest N, et al. Antibiotic prophylaxis for transrectal ultrasound-guided prostate needle biopsy: Compared efficacy of ciprofloxacin vs. the ciprofloxacin/fosfomycin tromethamine combination. Can Urol Assoc J 2020 Aug; 14(8): 267–272. https://doi.org/10.5489/cuaj.6248
11. Lim DG, Jung SI, Kim MS, et al. Comparison of a combined regimen of fosfomycin and ciprofloxacin with ciprofloxacin alone as antimicrobial prophylaxis for transrectal prostate biopsy in the era of high fluoroquinolone-resistant rectal flora. Prostate Int 2021 Sep; 9(3): 163–168. https://doi.org/10.1016/j.prnil.2021.03.001
12. Carignan A, Sabbagh R, Masse V, et al. Effectiveness of fosfomycin tromethamine prophylaxis in preventing infection following transrectal ultrasound-guided prostate needle biopsy: Results from a large Canadian cohort. J Glob Antimicrob Resist 2019 Jun; 17: 112–116. https://doi.org/10.1016/j.jgar.2018.11.020
13. Cimino S, Verze P, Venturino L, et al. Complication Rate After Antibiotic Prophylaxis with Fosfomycin Versus Fluorochinolones or b-lactam Antibiotics in Patients Undergoing Prostate Biopsy: A Propensity Score-adjusted Analysis. Eur Urol Focus 2020 Mar 15; 6(2): 370–375. https://doi.org/10.1016/j.euf.2018.06.014
14. Delory T, Goujon A, Masson-Lecomte A, et al. Fosfomycin-trometamol (FT) or fluoroquinolone (FQ) as single-dose prophylaxis for transrectal ultrasound-guided prostate biopsy (TRUS-PB): A prospective cohort study. Int J Infect Dis 2021 Jan; 102: 269–274. https://doi.org/10.1016/j.ijid.2020.10.065
15. Knaapila J, Gunell M, Syvänen K, et al. Prevalence of Complications Leading to a Health Care Contact After Transrectal Prostate Biopsies: A Prospective, Controlled, Multicenter Study Based on a Selected Study Cohort. Eur Urol Focus 2019 May; 5(3): 443–448. https://doi.org/10.1016/j.euf.2017.12.001
16. Van Besien J, Uvin P, Weyne E, et al. Use of fosfomycin as targeted antibiotic prophylaxis before prostate biopsy: A prospective randomized study. Int J Urol 2019 Mar; 26(3): 391–397. https://doi.org/10.1111/iju.13883
17. Kisa E, Altug MU, Gurbuz OA, et al. Fosfomycin: a good alternative drug for prostate biopsy prophylaxis the results of a prospective, randomized trial with respect to risk factors. Int Braz J Urol 2017 Nov-Dec; 43(6): 1068–1074.
https://doi.org/10.1590/S1677-5538.IBJU.2016.0619
18. Lista F, Redondo C, Meilán E, et al. Efficacy and safety of fosfomycin-trometamol in the prophylaxis for transrectal prostate biopsy. Prospective randomized comparison with ciprofloxacin. Actas Urol Esp 2014 Jul-Aug; 38(6): 391–6.
https://doi.org/10.1016/j.acuro.2014.01.002
19. Sen V, Aydogdu O, Bozkurt IH, et al. The use of prophylactic single-dose fosfomycin in patients who undergo transrectal ultrasound-guided prostate biopsy: A prospective, randomized, and controlled clinical study. Can Urol Assoc J 2015 Nov-Dec; 9(11–12): E863–7.
https://doi.org/10.5489/cuaj.3068
20. Sergio S, Tan KM, Reyes S. The Use of Fosfomycin as Preoperative Antibiotic Prophylactic for Transrectal Ultrasound-Guided Prostate Needle Biopsy: A Randomized, Controlled Clinical Study in Veterans Memorial Medical Center. Philippine Journal of Urology 2018; 28(1): 1–6.
21. Rhodes NJ, Gardiner BJ, Neely MN, et al. Optimal timing of oral fosfomycin administration for pre-prostate biopsy prophylaxis. J Antimicrob Chemother 2015 Jul; 70(7): 2068–73. https://doi.org/10.1093/jac/dkv067
22. Rhodes NJ, Gardiner BJ, Neely MN, et al. Optimal timing of oral fosfomycin administration for pre-prostate biopsy prophylaxis. J Antimicrob Chemother 2015 Jul; 70(7): 2068–73. https://doi.org/10.1093/jac/dkv067