Clinical application of photodynamic diagnostics, narrow band imaging, and the Storz professional image enhancement system in the diagnosis of bladder tumours
DOI: 10.22591/magyurol.2024.1.pytela.17
Authors:
Pytel Ákos dr.
Pécsi Tudományegyetem KK, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
Summary
Introduction: In the diagnostics of non-muscle invasive bladder tumours, cystoscopy is referred as gold standard. Main criticism of the procedure is the misdiagnosis of lesion potentially responsible for recurrence and progression.
Objective: The goal of recent paper is to present the innovative endoscopic technics in the diagnosis of bladder tumours and to demonstrate their clinical impact. Hungarian data are also demonstrated.
Method and results: Literature review about photodynamic diagnosis (PDD), narrow band imaging (NBI) and Storz Professional Image Enhancing System (IMAGE1 S®/SPIES). Own data of 89 patients operated by PDD guided TURB demonstrate using 5-amino-levulinic acid, hexyl amino-laevulinic acid, and hypericin 98% ,97% and 100% sensitivity, 82%, 72% and 81% specificity respectively. Previous Hungarian data demonstrated in two patient diagnostic benefit among the 26 patient treated with NBI guided TURB. As a Hungarian pilot study using IMAGE1 S®/SPIES guidance demonstrated diagnostic improvement in 3 patients from a cohort of 10.
Conclusion: The innovative technics described in the article have superior diagnostic accuracy compared with standard cystoscopy and may prolong not only recurrence over time but also risk of progression, so we have to strive the utilise the enhanced visualisation technics in wider range.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 1. SZÁM
Összefoglalás
Bevezetés: A nem izominvazív hólyagdaganatok diagnosztikájában alapvető a cisztoszkópia. A legnagyobb problémát a recidíva és a progresszió egy részéért felelős elváltozásoknak, a nem jól vizualizálható daganatoknak a diagnosztikája jelenti.
Célkitűzés: Jelen közlemény célja a vizualizációt javító innovatív technikák és klinikai jelentőségük bemutatása, és az azokkal nyert magyarországi tapasztalatok ismertetése.
Módszer és eredmények: Irodalmi áttekintés a fotodinámiás diagnosztikáról (PDD), a szűkített hullámhosszú képalkotásról (NBI) és a Storz professzionális képerősítés-rendszerről (IMAGE1 S®/SPIES) és magyarországi adatok bemutatása. Saját tanulmány alapján 89 betegnél végzett PDD-vezérelt beavatkozás. Különböző fluorokrómokra lebontva 5-amino-levulinsavval végezve 98%-os szenzitivitás és 82%-os specificitást, hexil-amino-levulinsavval végezve 97%-os szenzitivitás mellett 72%-os specificitást, míg a kis esetszámban végzett hypericin indukálta fluoreszcens vizsgálat során 100%-os szenzitivitás és 81%-os specificitás igazolódott. Korábbi magyar közlemény alapján NBI használata során 26 beteg vizsgálata során kettőnél jelentett diagnosztikus előnyt a szűkített hullámhosszú képalkotás. Első magyarországi iniciális vizsgálatként 10 beteg IMAGE1 S®/SPIES-rendszerrel történő vizsgálata során egy esetben, míg a hagyományos cisztoszkópia negatív volt, az IMAGE1 S® alkalmazása mutatott pozitív eltérést. Két további betegnél sikerült a fehér fényű cisztoszkópos pozitív lelet mellett további pozitív területet IMAGE1 S®-sel kimutatni. A szövettani vizsgálat minden IMAGE1 S®/SPIES pozitív eltérés esetében malignitást (CIS) igazolt.
Megbeszélés és következtetés: A javított endoszkópos kép segítségével a felvázolt technikák a hagyományos cisztoszkópia diagnosztikus értékét meghaladják, ezzel összefüggésben a recidívaarányt és adott esetben a progresszió arányt is csökkenthetik. Magyar viszonyok között is alkalmazható az eljárások mindegyike így törekedni kell a minél szélesebb körben történő alkalmazásukra.
Bevezetés
A hólyagdaganatok diagnosztikája, terápiája a mindennapi urológiai munkában kiemelkedő jelentőséggel bír, mivel a hólyagdaganatos betegek képezik az egyik legnagyobb urológiai betegcsoportot. A hólyagdaganat a második leggyakoribb malignoma a férfi urogenitális traktuson belül és a leggyakoribb urológiai daganatos megbetegedés a nők esetében. Közel háromszor több férfi betegszik meg, mint nő, férfiaknál a negyedik, nőknél a nyolcadik leggyakoribb daganatos halálok. Incidenciája folyamatosan növekszik (évente mintegy 2%-kal) és jelenleg az Egyesült Államokban a középkorú, illetve idős férfi populáció második leggyakoribb daganatos megbetegedése (1). A frissen felismert daganatok 55-60%-a jól, vagy közepesen differenciált, felületes folyamat, 40-45%-a rosszul differenciált daganat, amelyeknek a fele izominvazív. Az urothelialis daganatoknak magas a recidíva aránya (75-80%) és a felületes daganatok mintegy 20%-a progrediál (2). A hólyagdaganatok magas száma, a növekvő incidencia, a magas recidíva- és progresszióarány ismeretében érthető, milyen fontos szerepet tölt be az urológiai gyakorlatban a hólyagdaganatok diagnosztikája és nyomonkövetése, valamint a minél tökéletesebb diagnosztikai eljárások kifejlesztésére irányuló törekvések. A hólyagdaganatok diagnosztikájának az alapja az alsó húgyúti endoszkópos diagnosztika.
Hagyományos, fehér fényű
cisztoszkópia és ennek hiányosságai
A legelterjedtebb endoszkópos vizsgálat a hólyagdaganatok diagnosztikájában a fehér fényű, hagyományos cisztoszkópia. Minimális elvárás az 1080p HD felbontású cisztoszkóp, de legtöbb centrumban már 4K,8K UHD felbontású rendszereket használnak. A diagnosztika pontossága fókuszközelítéssel és kettős fókuszú beállítással növelhető. A hólyagtumor diagnózisát csak uretrocisztoszkópia után, a mintavétel szövettani vizsgálatát követően mondhatjuk ki (25). A cisztoszkópiát flexibilis és rigid eszközzel egyaránt végrehajthatjuk. A vizsgálat során a daganat méretéről, elhelyezkedéséről, növekedési formájáról és az esetleges többgócúságáról kapunk pontos információt. Annak ellenére, hogy a legelterjedtebb endoszkópos diagnosztika, a fehér fényű cisztoszkópiának számos hiányossága van (3). A legnagyobb problémát a recidíva és a progresszió egy részéért felelős elváltozásoknak, a diagnosztikája jelenti. Míg a papilláris, exofititikus, a hólyag lumene felé növekvő daganatok cisztoszkópia során jól diagnosztizálhatóak, a lapos elváltozások és a kimutatható tumorok széli részein elhelyezkedő, a nyálkahártya szintjéből nem kiemelkedő malignus elváltozások gyakran felfedezetlenek maradnak a cisztoszkópos vizsgálat során. Ezen elváltozások felderítésében a vizelet citológiai vizsgálata, a kvadráns és random biopszia terjedt el a konvencionális diagnosztikában. A randombiopszia során, mikor negatívnak imponáló hólyagfali részekről történik a mintavétel, a találati arány a véletlen függvénye (4, 5). Ennek ismeretében, bár a citológia magas szenzitivitással képes ezeket az elváltozásokat kimutatni, hisztológiai igazolásuk kétséges. Ugyanakkor jól differenciált daganatok, diszpláziák esetében a citológia szenzitivitása alacsony és pozitivitás esetén sem ad felvilágosítást a folyamat mélységi terjedéséről. Ezek ismeretében érthető az urológusok törekvése új diagnosztikus módszerek kialakítására, amelynek során a megjelölt malignus elváltozásokat célzottan lehet eltávolítani.
Technikai lehetőségek a hólyagdaganatok endoszkópos diagnosztikus értékének növelésére
A hagyományos fehér fényű cisztoszkópia diagnosztikus értékének javítását célzó számos innovatív technikai megoldás közül, a gyakorlatban két csoportba osztható újítások tartoznak (6). Az egyik csoportba a virtuális kromoendoszkópos eljárások, másik csoportba a fluoreszcens endoszkópok tartoznak. A virtuális kromoendoszkópok előzetes vagy utólagos, illetve esetenként ezek kombinációját használó képfeldolgozás révén érnek el jobb diagnosztikus értéket. Ezek közül a legelterjedtebb a szűkített hullámhosszú képalkotás (Narrow Band Imaging, NBI) és a Storz cég által kifejlesztett professzionális képerősítés rendszere ( IMAGE1 S®/SPIES). A fluoreszcens technikák közül az autofluorerszcens képalkotás, az inkább laparoszkópos diagnosztikában használt közel infravörös indigocianin zöld fluoreszcens technikák mellett elsősorban a fotodinámiás diagnosztika (PDD) nyert teret a hólyagdaganatok diagnosztikájában.
Az NBI a fény vörös spektrumának kiszűrése után szelektíven a fény kék és zöld szegmensét közvetíti, és ez mivel a hemoglobin abszorbciós spektrumával egybe esik a vaszkularizáltság kimutatásával képes neoplasztikus elváltozásokat jobb kontrasztminőséggel megmutatni. Klinika használatáról és az első magyarországi tapasztalatokról, alkalmazhatóságról Mosonyi és munkatársai számoltak be részletesen (7).
Hólyagdaganatok in vivo és in vitro fotodinámiás diagnosztikájáról a szerző doktori értekezése számolt be részletesen (3), de magyar nyomtatott tudományos folyóiratban történt publikáció nem történt mind ez idáig. A IMAGE1 S®/SPIES-rendszerről magyarországi használatáról szóló közleményről tudomásom nincs, így jelen közleményben elsősorban a fotodinámiás diagnosztikára és a SPIES-technikára fókuszálok.
PDD (fotodinámiás diagnosztika)
A daganatok fotodinámiás diagnosztikája az egyes szövetek fluoreszcens tulajdonságainak vizsgálatán, és azok tumorspecifikus különbségének kimutatásán alapszik. Molekuláris szinten a fény és a szövetek kölcsönhatását, egy fényrészecskének, a fotonnak egy molekulával történő interakciójaként írhatjuk le. Egy foton különböző energiaszinteken lehet, és az emberi szem ezt különböző színekként érzékeli. Ezek alapján a színspektrum két végén elhelyezkedő kék, illetve vörös fotonok közül az előbbi rendelkezik magasabb energiaszinttel. Fényelnyelés során a fotonok energiája a molekulára tevődik át, miáltal az energetikailag gerjesztett állapotba kerül. Sikeres abszorpció esetén a molekulák gerjesztett állapotba kerülnek. Ez az állapot nem stabil, a többletenergia különböző formákban leadásra kerül. Ezek közül az új fotonok kibocsátása által történő energialeadás a fluoreszcencia. A fluoreszcenciát okozó anyagokat fluorokrómoknak nevezzük. Amennyiben exogén úton juttatunk a szervezetbe fotoszenzitivizáló fluorokrómokat, megfelelő gerjesztés mellett azok fluoreszcenciáját vizsgálhatjuk. Az így észlelhető fénykibocsátást indukált fluoreszcenciának nevezzük. A hólyagdaganatok diagnosztikájában az 5-amino-levulinsav és annak észterei, valamint a hypericin használatos fotoszenzitivizáló anyagként. Az 5-amino-levulinsav (5-ALA) és hexil-észterének, a hexil-amino-levulinsavnak (h-ALA) exogén beadása után azok a hem bioszintézisbe lépnek be és a tumorsejtek enzimatikus változásai miatt tumorszelektíven a hem prekurzora a protoporfirin IX, ami a tényleges fluorokróm, felszaporodik a sejtekben (8). Megfelelő gerjesztése után megfelelő szűrőrendszer használatával a tumorsejtek indukált fluoreszcenciáját detektálni lehet, és ezáltal diagnosztikus előnyhöz juthatunk.
A hypericin természetes, növényi eredetű, aromás, policiklikus kinonvegyület, amit a Hypericum családba tartozó növények szintetizálnak. Ezek a növények a világon széles körben elterjedtek, legismertebb képviselőjük az orbáncfű (Hypericum perforatum). Igazolt tény a hólyagdaganatos betegeknél a hypericin tumorszelektív celluláris felvétele, de a pontos mechanizmus nem tisztázott (9). Spektrális karakterisztikája nagyon hasonló a protoporfirin IX-hez, így ugyanazzal a gerjesztő fénnyel és szűrő rendszerrel lehet az indukált fluoreszcenciát vizsgálni, mint az 5-ALA instillációját követő fluoreszcens endoszkópia során (10).
SPIES (Storz professzionális képerősítés-rendszer – IMAGE1 S®)
A SPIES-rendszer egy előzetes és utólagos szoftver alapú képfeldolgozással ér el kontrasztváltoztatást. Különböző hullámhosszúságú fény használatával különböző kontrasztspecifikáció érhető el. A fehér fény képének erősítéséhez két modalitást használ a rendszer: Clara és Chroma modalitást. Clara használata során a sötét területek fényesebbé tételével, míg Chroma modalitás esetén a színkontrasztok erősítésével érhető el a jobb diagnosztikai képminőség. Ezen kívül két utólagos képfeldolgozási rendszert is alkalmazhatunk az
Image1 S® cisztoszkópia során, a Spectra A és Spectra B módot. Ezekben az alkalmazásokban színkontrasztváltozást hoznak létre, úgy, hogy a képek spektrális válaszát változtatják meg (11). A Spectra A módban a zöld és kék fény szignálok kerülnek leválasztásra. Így a nyálkahártya és submucosa kapillárisai kontrasztosabban kerülnek kiemelésre. A Spectra B módban nincs színátváltoztatás, csak a színek tónusának eltolásával lesz kontrasztosabb a kép, és a felületes kapillárisokhoz képest a mélyebb struktúrák is jobban láthatóak (12). A Spectra B mód hematúria során észlelt vizuális interferenciák esetében különösen hatékony lehet (13).
Az innovatív technikák jelentősége a klinikai gyakorlatban
A fotodinámiás diagnosztika primer diagnosztikai értékét, és annak a hagyományos cisztoszkópiával szembeni előnyét számos tanulmány, egyértelműen és egybehangzóan bebizonyította (14, 15). Mind biopszia, mind betegszintű elemzések alapján 21-28%-os előny igazolódott a PDD-vezérelt diagnosztika javára. A másik aspektusa a vizsgálatoknak a recidívaarányban történt változások vizsgálata volt. Egy, később nem kellő minőségűnek véleményezett, randomizált vizsgálat (16) kivételével a többi ilyen irányú vizsgálat recidívaarány-csökkenést is igazolt, ha a reszekciót PDD-vezérléssel végezték (17, 18, 19). Maish és munkatársai Cochrane-analízis alapján ennél még komolyabb előnyt mutattak ki, a PDD-vezérelt beavatkozás nemcsak a recidívaarányt, hanem a progresszió rizikóját is csökkentette (20). Saját korábbi vizsgálatunk során 89 betegnél 342 mintavételt hajtottunk végre. 184 minta szövettani vizsgálata igazolt urothelialis daganatos elváltozást, míg 158 minta vizsgálata során malignitás nem igazolódott. Összesen 208 indukált fluoreszcenciát mutató területből történt mintavétel, ezek közül 145 elváltozás hagyományos cisztoszkópia során is tumorgyanús volt. 184 igazolt daganatos elváltozás közül 180 mutatott indukált fluoreszcenciát, míg 158 negatív területből 29 mutatott álpozitivitást a fotodinámiás diagnosztika során. Minden beteg, akinél álpozitivitást észleltünk a fotodinámiás vizsgálat során, korábban intravesicalis terápiában részesült. Vizsgálati anyagunkban három TaG1 daganatot és egy diszplasztikus elváltozást nem sikerült fluoreszcens cisztoszkópia során detektálnunk. A diszpláziát (low grade intraurotheliális neoplázia) a tanulmányunk során tumoros elváltozásként vettük figyelembe. Hagyományos cisztoszkópia során 33 daganatos elváltozás (6 diszplázia, 19 CIS, 4 TaGI, 1 T1GI, 1 T1GII, 2 T1GIII) nem került felismerésre, ezeket a fluoreszcens cisztoszkópia során sikerült detektálnunk. Különböző fluorokrómokra lebontva 5-amino-levulinsavval végzett beavatkozás során 98%-os szenzitivitás és 82%-os specificitást, hexil-amino-levulinsavval végzett PDD során 97%-os szenzitivitás mellett 72%-os specificitást, míg a kis esetszámban végzett hypericin indukálta fluoreszcens vizsgálat során 100%-os szenzitivitást és 81%-os specificitást igazoltunk (1–2. ábra) (3).
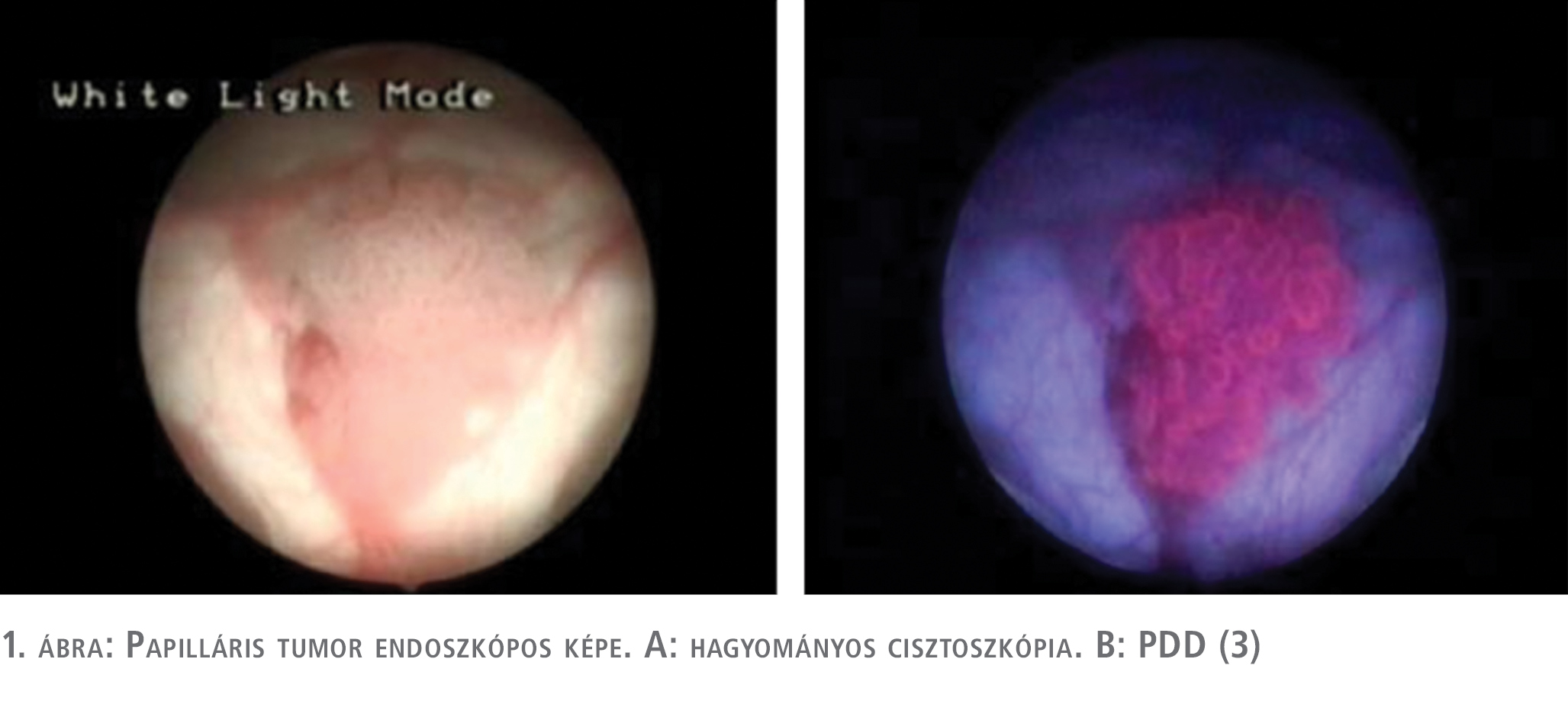
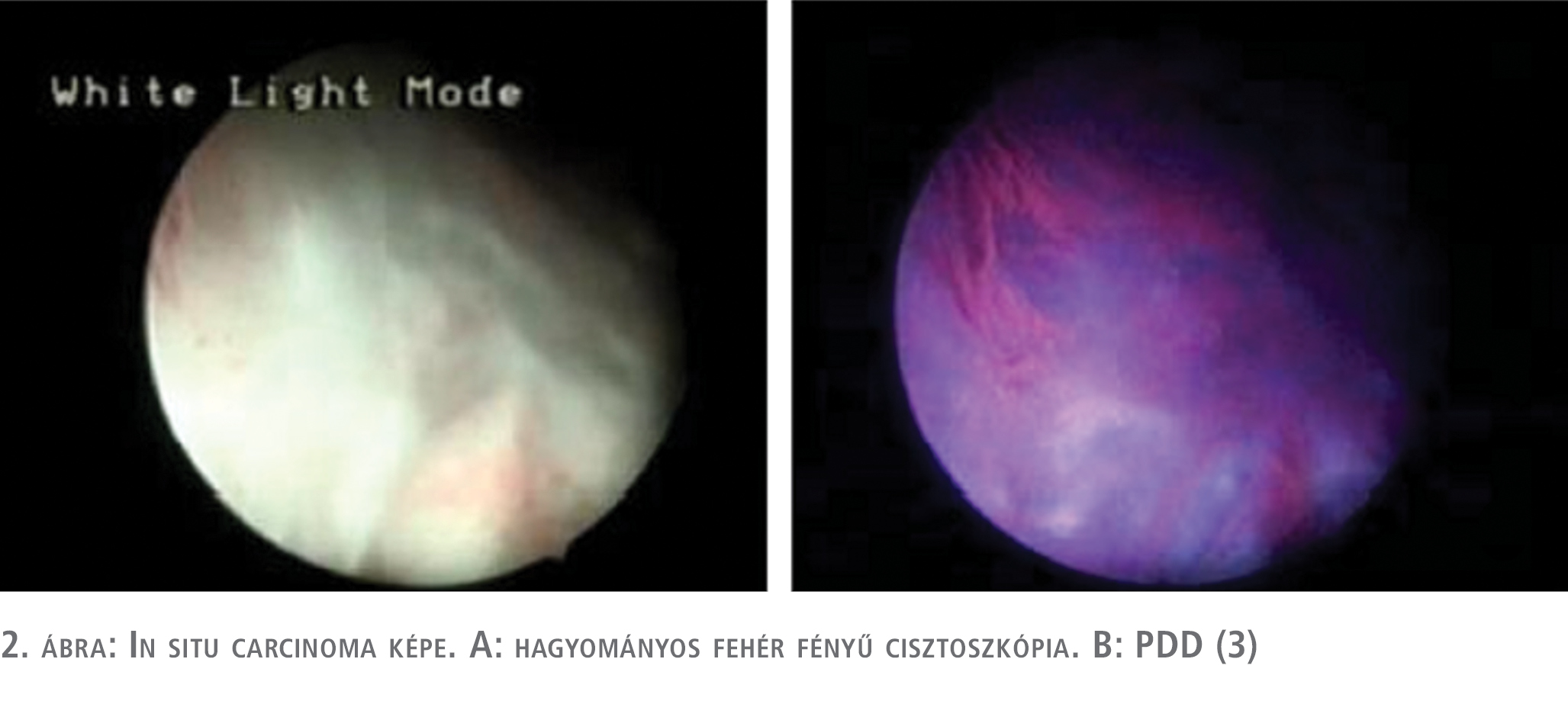
Az NBI diagnosztikus értékét és előnyét a hagyományos cisztoszkópiával összehasonlítva, szintén számos közlemény bizonyítja (21, 22, 23, 24). A közölt szenzitivitási adatok 92-100% között mozognak, míg a specificitást 76-82% közöttinek találták. Betegszintű 35%-os többletdiagnosztikát és egyéves vonatkozásban 12%-kal magasabb recidívamentességet sikerült kimutatni NBI-vezérelt beavatkozások során. Mosonyi és munkatársai, akik elsőként számoltak be hazánkban az NBI klinikai használatáról, 26 beteg közül kettőnél mutattak ki diagnosztikus előnyt (7).
Az IMAGE1 S®/SPIES-rendszerről a PDD-hez és NBI-hoz képest jóval kevesebb számú tanulmány áll rendelkezésünkre. Jó minőségű randomizált tanulmányok a hosszú távú értékét illetően még váratnak magukra, de a diagnosztikus értékét és előnyeit a rendszernek a hagyományos cisztoszkópiával szemben számos közlemény bizonyította (25, 26). Saját limitált beteganyagon végzett vizsgálatunk során, mi magunk is igazolni tudtuk a rendszer előnyeit. 10 pozitív vizeletcitológiával bíró betegnél végeztük el a vizsgálatot, ahol egy esetben csak az IMAGE1 S® alkalmazása mutatott pozitív eltérést, míg a hagyományos cisztoszkópia negatív volt. 2 betegnél sikerült a fehér fényű cisztoszkópos pozitív lelet mellett további pozitív területet IMAGE1 S®-sel kimutatni és célzottan reszekálni. A szövettani vizsgálat minden IMAGE1 S®/SPIES pozitív eltérés esetében malignitást (CIS) igazolt (3–4. ábra).
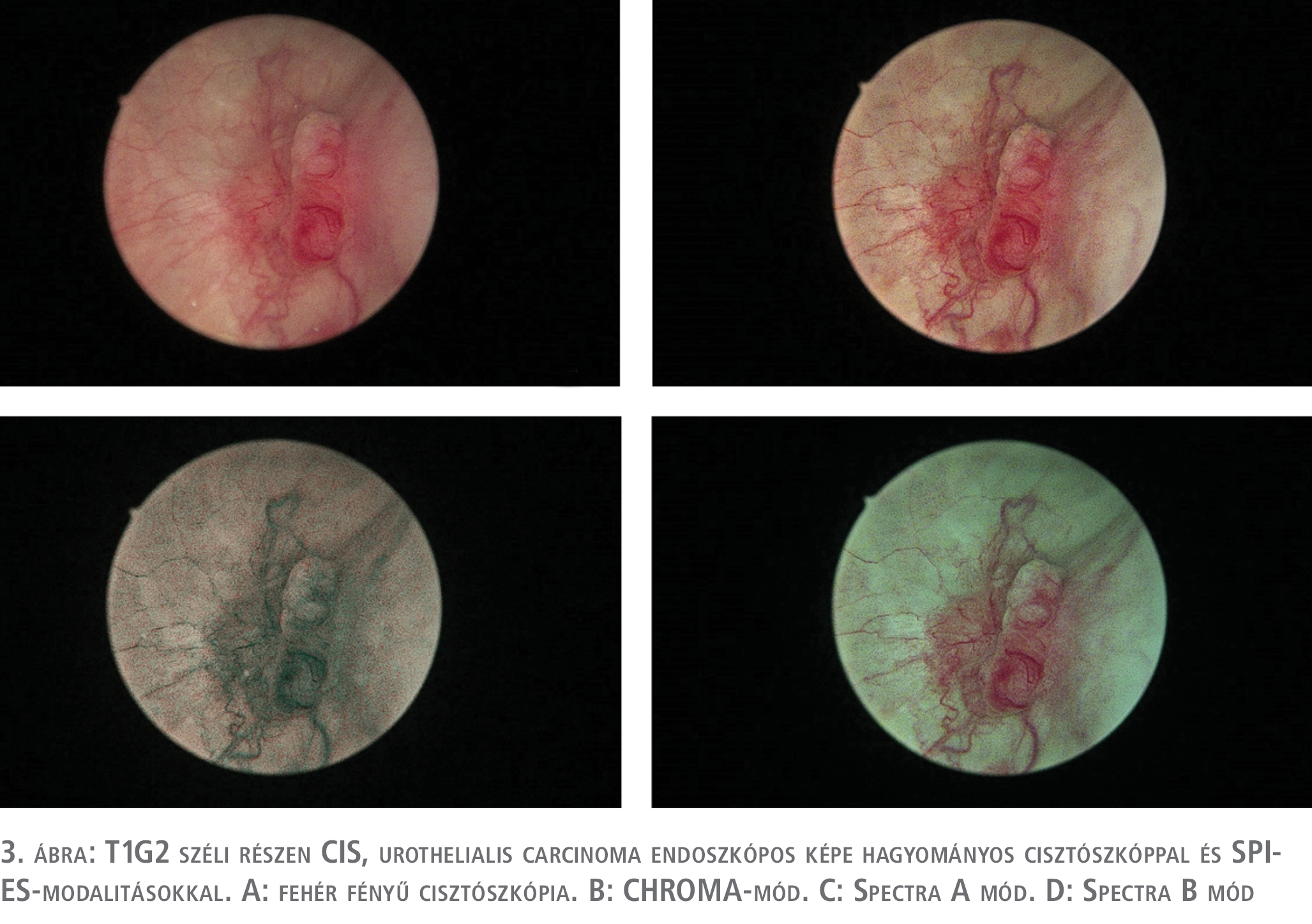
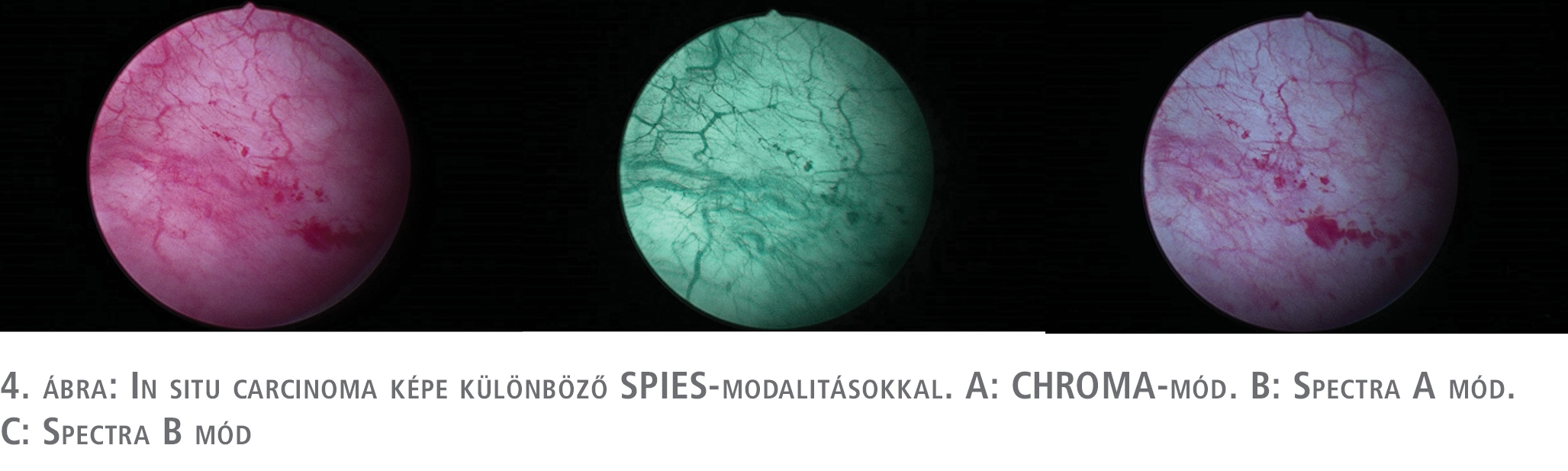
A daganatok reszekciója, és a reszekciós szél megítélése is könnyebb volt (5. ábra).
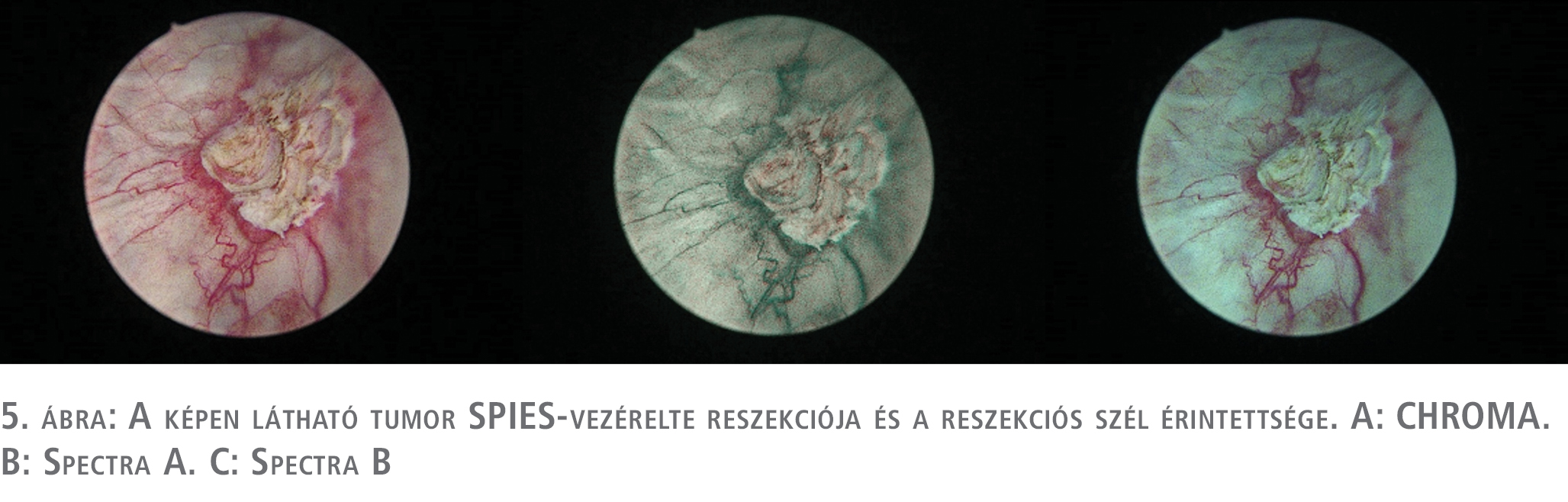
Megbeszélés
A hólyagdaganatok döntő többsége felismerésekor felületes; izominvázió, metasztázis nem mutatható ki. A megfelelő terápia ellenére ezeknek a daganatoknak az 50-70%-ában lokális recidíva és 15-20%-ában izominvazivitás alakul ki (27, 28, 29). Mind a magas recidíva, mind a magas progresszióarány jelentős kihatással van a beteg életvitelére, életminőségére és az egészségügyi hálózat munkájára. Ebben a problémakörben figyelembe kell venni a daganatok természetes biológiai viselkedésén kívül a rutindiagnosztika hiányosságait is. Két jelentős oki tényező hatása bizonyítottan közrejátszik az említett morbiditási adatokba. Az egyik legfontosabb ilyen tényező a transurethrális reszekciók után a hólyagban visszamaradt reziduális daganat. 2-6 héttel a primer beavatkozás után az esetek több mint a felében mutatható ki tumorreziduum a hólyagban. Még szoliter papilláris folyamat esetén is mintegy 25%-ban sikerült a vizsgálóknak reziduális daganatot kimutatni (30, 31, 32). A reziduális tumorok mellett igen jelentős szerepük van a recidíva, illetve progresszió kialakulásában az úgynevezett lapos neoplasztikus elváltozásoknak. Ide a hólyag diszplasztikus elváltozásai és a carcinoma in situ (CIS) tartoznak. A diszpláziák prekancerózus jellege bizonyított és gyakran már kialakult daganatok mellett találhatók a hólyagban (az ISUP az urothelialis neoplazmák közé sorolja a diszpláziát). A carcinoma in situ progresszióban betöltött szerepe igazolt. Több tanulmánynak sikerült összefüggést igazolnia a CIS-elváltozások és a progresszió kialakulása között. Egyes szerzők 50%-os progressziórátát mutattak ki CIS-es betegeknél. CIS esetében a recidívaarány is igen magas, megközelíti a 70%-ot (33).
A hólyagdaganatok diagnosztikájában alapvető cisztoszkópia hiányosságai jól ismertek. Ez tette szükségessé az innovatív technikák alkalmazását a hólyagdaganatok endoszkópos diagnosztikájában. A rendelkezésre álló technikák közül úgy tűnik a mindennapi urológiai gyakorlatban a PDD, az NBI és IMAGE1 S®/SPIES-rendszer nyert/nyer létjogosultságot. Ezek azok a diagnosztikus eljárások, amelyek az Európai Urológus Társaság hatályos irányelvében is szerepelnek. A döntő többsége a publikált eredményeknek igazolják a diagnosztikus, és adott esetben a terápiás, előnyét az innovatív diagnosztikának. Korábban mind PDD, mind NBI vonatkozásában magyar adatok is igazolták az eljárások létjogosultságát és magyar körülmények közötti használatát. Jelen közleményben, statisztikai adatnyerésre ugyan nem alkalmas számú beteganyagon, Magyarországon elsőként, bemutatom az IMAGE1 S®/SPIES-rendszert és az azzal szerzett kezdeti tapasztalatokat. Ezek alapján kijelenthető, hogy a világirodalomban publikált és a hatályos irányelveinkben szereplő innovatív technikák mindegyike, magyar viszonyok között is alkalmazhatóak. Ugyan Lee és munkatársai kijelentését, miszerint az urológustársadalomnak el kellene gondolkodni, hogy a hagyományos fehér fényű endoszkóp vezérelt transurethralis reszekciót, mint arany standard beavatkozás le kellene váltani (34) kissé eltúlzottnak érzem, de mindenképpen érdemes törekedni az új eljárások alkalmazására.
Következtetés
A közleményben szereplő innovatív diagnosztikai eljárások bizonyították diagnosztikus erejüket, és a hagyományos cisztoszkópiával szembeni előnyüket. Magyar viszonyok között is alkalmazható az eljárások mindegyike így törekedni kell a minél szélesebb körben történő alkalmazásukra, ezzel javítva a hólyagdaganatos betegek ellátását.
Irodalom
1. Waters WB. Invasive bladder cancer-where do we go from here? Editorial J Urol 1996; 155: 1910–1911, 1996.
https://doi.org/10.1016/S0022-5347(01)66044-0
2. Herr HW. Tumour progression and survival in patients with T1 G3 bladder tumours: 15 year outcome. Br J Urol 1997; 80: 762–765.
https://doi.org/10.1046/j.1464-410X.1997.00431.x
3. Pytel Á. Húgyhólyag daganatok in vivo és in vitro fotodinámiás diagnosztikája. Doktori (PhD) értekezés, Pécsi Tudományegyetem Általános Orvosi Kar 2005.
https://pea.lib.pte.hu/bitstream/handle/pea/16846/pytel-akos-phd-2005.pdf
4. Zaak D. Bladder cancer, in Baumgartner R, Kriegmair M, Hofstetter A. (Eds.): Fluorescence diagnosis of bladder tumor using 5-aminolevulinic acid – Fundamentals and Results. Tuttlingen: Verlag Endo-Press; 2000. pp. 8–10.
5. Kiemeney LA, Witjes JA, Heijbroek RP, et al. Predictability of recurrent and progressive disease in individual patients with primary superficial bladder cancer. J Urol 1993; 150: 60–64.
https://doi.org/10.1016/S0022-5347(17)35397-1
6. He Z, Wang P, Liang Y, et al. Clinically Available Optical Imaging Technologies in Endoscopic Lesion Detection: Current Status and Future Perspective. Journal of Healthcare Engineering Volume 2021, Article ID 7594513, 27 https://doi.org/10.1155/2021/7594513
7. Mosonyi P, Szepesváry Zs, Kerényi G, et al. Ígéretes képalkotó technika a nem-izominvazív hólyagdaganatok diagnosztikájában: az NBI (narrow band imaging) alkalmazása az urológiában. Magy Urol 2017; 57–63. https://doi.org/10.22591/magyurol.2017.2.mosonyip.57
8. Uehlinger P, Zellweger M, Waginieres G, et al. 5-aminolevulinic acid and its derivates: physical chemical properties and protoporphyrin IX formation in cultured cells. J Photochem Photobiol B Biol 54(1): 72–80. https://doi.org/10.1016/S1011-1344(99)00159-1
9. Kamuhabwa AR, Agostinis P, D’Hallewin MA, et al. Photodynamic activity of hypericin in human urinary bladder carcinoma cells. Anticancer Res 2000; 20: 2579–2584.
10. D’Hallewin MA, De Witte PA, Waelkens E, et al. Fluorescence detection of flat bleder carcinoma in situ after intravesical instillation of hypericin. J Urol 2000; 164: 349–351. https://doi.org/10.1016/S0022-5347(05)67357-0
11. Kamphuis GM, de Bruin DM, Fallert J, Gultekin MH, De Reijke TM. Storz professional image enhancement system: a new technique to improve endoscopic bladder imaging. J Cancer Sci Ther 2016; 08: 71–7.
https://doi.org/10.4172/1948-5956.1000394
12. Mulawkar PM, Sharma G, Tamhankar A, Shah U, Raheem R. Role of Macroscopic Image Enhancement in Diagnosis of Non-Muscle-Invasive Bladder Cancer: An Analytical Review. Front Surg 2022; 9:762027.
https://doi.org/10.3389/fsurg.2022.762027
13. Bach T, Muschter R, Herrmann TRW, Knoll T, Scoffone CM, Laguna MP, et al. Technical solutions to improve the management of non-muscleinvasive transitional cell carcinoma: summary of a european association of urology section for uro-technology (ESUT) and section for uro-oncology (ESOU) expert meeting and current and future pers. BJU Int 2015; 115: 14–23. https://doi.org/10.1111/bju.12664
14. Kausch I, et al. Photodynamic diagnosis in non-muscle-invasive bladder cancer: a systematic review and cumulative analysis of prospective studies. Eur Urol 2010; 57: 595. https://doi.org/10.1016/j.eururo.2009.11.041
15. Mowatt G, et al. Photodynamic diagnosis of bladder cancer compared with white light cystoscopy: Systematic review and meta-analysis. Int J Technol Assess Health Care 2011; 27: 3.
https://doi.org/10.1017/S0266462310001364
16. Heer R, et al. A Randomized Trial of PHOTOdynamic Surgery in Non-Muscle-Invasive Bladder Cancer. NEJM Evidence 2022; 1: 10.
https://doi.org/10.1056/EVIDoa2200092
17. Liedberg F, et al. Re: Rakesh Heer, Rebecca Lewis, Thenmalar Vadiveloo, et al. A Randomized Trial of PHOTOdynamic Surgery in Non-muscle-invasive Bladder Cancer. NEJM Evid. Eur Urol Open Sci 2022 Dec; 46: 53–54. https://doi.org/10.1016/j.euros.2022.09.021
18. Stenzl A, et al. High-quality Transurethral Resection of Bladder Tumour Needs Additional Forms of Tumour Delineation. EUROPEAN UROLOGY 2023; 3(2): 193–194. https://doi.org/10.1016/j.eururo.2022.11.017
19. Dahm P, et al. Photodynamic Diagnosis-Assisted Transurethral Resection-Lights Out? NEJM Evid 2022; 1(10). https://doi.org/10.1056/EVIDe2200194
20. Maisch P, et al. Blue vs white light for transurethral resection of non-muscle-invasive bladder cancer: an abridged Cochrane Review. BJU Int 2022; 6: 730. https://doi.org/10.1111/bju.15723
21. Zheng C, et al. Narrow band imaging diagnosis of bladder cancer: systematic review and metaanalysis. BJU Int 2012; 110: E680.
https://doi.org/10.1111/j.1464-410X.2012.11500.x
22. Drejer D, et al. Clinical relevance of narrow-band imaging in flexible cystoscopy: the DaBlaCa-7 study. Scand J Urol 2017; 51: 120.
https://doi.org/10.1080/21681805.2017.1295101
23. Ye Z, et al. A comparison of NBI and WLI cystoscopy in detecting non-muscle-invasive bladder cancer: A prospective, randomized and multi-center study. Sci Rep 2015; 5: 10905. https://doi.org/10.1038/srep10905
24. Kim SB, et al. Detection and recurrence rate of transurethral resection of bladder tumors by narrow-band imaging: Prospective, randomized comparison with white light cystoscopy. Investig Clin Urol 2018; 59: 98. https://doi.org/10.4111/icu.2018.59.2.98
25. Sari Motlagh R, et al. Impact of enhanced optical techniques at time of transurethral resection of bladder tumour, with or without single immediate intravesical chemotherapy, on recurrence rate of non-muscle-invasive bladder cancer: a systematic review and network meta-analysis of randomized trials. BJU Int 2021; 128: 280.
https://doi.org/10.1111/bju.15383
26. Howard JM, et al. Enhanced Endoscopy with IMAGE1 S CHROMA Improves Detection of Nonmuscle Invasive Bladder Cancer During Transurethral Resection. J Endourol 2021; 35: 647.
https://doi.org/10.1089/end.2020.0821
27. Oosterlinck W, Kurth KH, Schroeder F, et al. A prospective European Organisation for Research and Treatment of Cancer Genitourinary Group randomized trial comparing transurethral resection followed by a single intravesical instillation of epirubicin or water in single stage Ta, T1 papillary carcinoma of the bladder. J Urol 1993; 149: 749–752. https://doi.org/10.1016/S0022-5347(17)36198-0
28. Fitzpatrick JM, West AB, Butler MR, et al: Superficial bladder tumors (stage pTa, grades 1 and 2): the importance of of recurrence pattern following initial resection. J Urol 1986; 135: 920–922.
https://doi.org/10.1016/S0022-5347(17)45923-4
29. Holmäng S, Hedelin H, Anderstrom C, et al. Recurrence and progression in low grade papillary urothelial tumors. J Urol 1999;162: 702–707.
https://doi.org/10.1097/00005392-199909010-00019
30. Zaak D, Kriegmair M, Stepp H, et al. Endoscopic detection of transitional cell carcinoma with 5-aminolevulinic acid: results of 1012 fluorescence endoscopies. Urology 2001; 57: 690–694.
https://doi.org/10.1016/S0090-4295(00)01053-0
31. Klän F, Loy V, Huland H. Residual tumor discovered in routine second transurethral resection in patients with stage T1 transitional cell carcinoma of the bladder. J Urol 1991; 146: 316–318.
https://doi.org/10.1016/S0022-5347(17)37779-0
32. Vögeli TA, Grimm MO, Ackermann R. Prospective study for quality control of TUR of bladder tumors by routine 2nd TUR (ReTUR). J Urol 1998; 159: 5 (Suppl).
33. Kiemeney L, Witjes JA, Heijbrodk R, et al. Should random urothelial biopsies be taken from patients with primary superficial bladder cancer? A decision analysis. Members of the Dutch South-East-Co-operative Urological Group. Br J Urol 1994; 73: 164–171.
https://doi.org/10.1111/j.1464-410X.1994.tb07486.x
34. Lee JY, Cho KS, Kang DH, et al. A network meta-analysis of therapeutic outcomes after new image technology-assisted transurethral resection for non-muscle invasive bladder cancer: 5-aminolaevulinic acid fluorescence vs hexylaminolevulinate fluorescence vs narrow band imaging BMC Cancer 2015; 15: 566
https://doi.org/10.1186/s12885-015-1571-8