Experiences and results obtained with laparoscopic radical cystectomy at our department
DOI: 10.22591/magyurol.2024.1.nemethm.33
Authors:
Németh Máté dr., Kerényi Gábor dr., Szepesváry Zsolt Jenő dr.
Petz Aladár Egyetemi Oktató Kórház, Urológiai Osztály, Győr (osztályvezető: Szepesváry Zsolt Jenő dr.)
Summary
Bladder cancer is the eleventh most common cancer worldwide, the seventh among men. Radical cystectomy is the procedure of choice for the treatment of muscle-invasive urothelial carcinoma in muscle-invasive and in selected non-muscle-invasive cases. The procedure can be done by open surgery or minimally invasive (laparoscopic or robotic surgery) method. Due to the high risk of complications and high patient stress, the minimally invasive approach has gained ground.
We have been performing laparoscopic radical cystectomy at the Department of Urology of Petz Aladár University Teaching Hospital in Győr since 2014. After the introduction of the method, data from 63 patients were processed from January 2017 to May 2023. Oncology results and complication rates were consistent with data available in international literature.
Laparoscopic radical cystectomy is a safe treatment for advanced urothelial carcinoma, with similar oncological results and faster recovery than open surgery. In centrums with large laparoscopic volumes, after a short period of learning curve, surgery can be performed in experienced hands in the same way as open cystectomy. Its introduction until robotic assisted surgeries become widespread, based on selected patient material, can reduce patient stress and complication rate.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 1. SZÁM
Összefoglalás
A hólyagtumor világviszonylatban a tizenegyedik leggyakoribb tumoros megbetegedés, férfiak között a hetedik. A radikális cystectomia a választandó eljárás az izominvazív urotheliális karcinóma kezelésére izominvazív és válogatott nem izominvazív esetekben. A beavatkozás történhet nyílt sebészeti vagy minimál invazív (laparoszkópos, illetve robotsebészeti) módszerrel. A magas szövődménykockázat és a betegek nagy terhelése miatt, a minimál invazív megközelítés teret nyert.
A győri Petz Aladár Egyetemi Oktató Kórház Urológiai Osztályán 2014 óta végzünk laparoszkópos radikális cystectomiát. A módszer bevezetését követően 2017. januártól 2023. májusig 63 beteg adatait dolgoztuk fel. Az onkológiai eredmények és a szövődményarány megfeleltek a nemzetközi irodalomban fellehető adatoknak.
A laparoszkópos radikális cystectomia biztonságos kezelési módja az előrehaladott urothelialis betegségeknek, hasonló onkológiai eredményekkel és gyorsabb felépüléssel, mint a nyílt műtét esetén. Nagy laparoszkópos volumenű centrumokban, rövid tanulási időt követően, tapasztalt kezekben ugyanúgy elvégezhető műtét, mint a nyílt cystectomia. Bevezetése a robotasszisztált műtétek széles körű elterjedéséig, válogatott beteganyagon, csökkentheti a betegek terhelését és a szövődményarányt.
Bevezetés
A hólyagtumor világviszonylatban a tizenegyedik leggyakoribb tumoros megbetegedés, férfiak között a hetedik. Körülbelül 3% az újonnan diagnosztizáltak száma és a betegek 2,1%-a hal meg hólyagtumorban évente (1). A páciensek 75%-ánál a diagnózis pillanatában a hólyagtumor stádiumát tekintve lokális, nem izominvazív. Azokban az esetekben a prognózis lényegesen kedvezőtlenebb, amikor a daganat felismerésekor a folyamat már az izomréteget is érinti (2).
Prognosztikai és kezelési szempontból nem-izominvazív és izominvazív hólyagtumort különböztetünk meg. A nem-izominvazív kezelési módja a transurethralis reszekció, valamint az intravesicalis kemoinstilláció. A nem-izominvazív, magas rizikójú betegségben szenvedők közel 21%-ánál a daganat izominvazív formába progrediál (1).
A radikális cystectomia a választandó eljárás az izominvazív urothelialis karcinóma kezelése során (T2–T4a, N0M0, illetve a nem izominvazív forma válogatott eseteiben) kétoldali kismedencei lymphadenectomiával, ha a páciens kemofitt, neoadjuváns kemoterápiával kiegészítve (1, 2). Az EAU Guideline szerint (2016 óta) ez a kezelési lehetőség javasolt minden páciensnél, hiszen a gyógyulási arány a legmagasabb összehasonlítva más módszerek önálló alkalmazásával (radioterápia, kemoterápia) (3). Cystectomiát követően a 10 éves kiújulásmentes túlélés 50-59%, és a teljes túlélési arány 45% körül mozog. A kiterjesztett műtét általában hosszú hospitalizációval és gyógyulási idővel és magas szövődményaránnyal jár, valamint nem elhanyagolható a perioperatív halálozás rizikója. A beavatkozás lehet nyílt radikális cystectomia, laparoszkópos radikális cystectomia, vagy robotasszisztált műtéti megoldás (2, 4). Az izominvazív urothelialis hólyagtumor klasszikus kezelése a nyílt radikális cystectomia. A betegek közel felénél a tumor kiújul. Az 5 éves kiújulásmentes túlélési arány 73-89% között mozog nyirokcsomó negatív, szervre lokalizált daganatnál, 45-55% extravesicalis betegségnél és 25-35% nyirokcsomó-érintettség esetén. A túlélési arány javítása érdekében a kiterjesztett kismedencei lymphadenectomia a műtét szerves része, amely a minimál invazív beavatkozások során is kötelező. A nyílt radikális cystectomia szövődményaránya 40-65% között van, ebből transzfúzióigény 66%, major szövődmény 10-12%, a mortalitás 2-3%-ra tehető (5, 6).
A magas szövődménykockázat és a betegek magas terhelése miatt, a minimál invazív megközelítés teret nyert (7). Több tanulmány igazolta, hogy a laparoszkópos vagy robotasszisztált radikális cystectomia szignifikánsan csökkenti a kórházban tartózkodás idejét, valamint a becsült vérveszteséget a nyílt műtéthez képest. A robotasszisztált beavatkozás költségei magasabbak, mint a nyílt, vagy a laparoszkópos megoldásnak (1). A laparoszkópos radikális cystectomia gyakorlata bő két évtizedes múltra tekint vissza, ám azóta a robotasszisztált radikális cystectomia is teret nyert és a laparoszkópos eljárásnál is kevesebb szövődménnyel végezhető (7).
Az első laparoszkópos radikális cystectomiáról 1993-ban számoltak be, Badajoz és munkatársai végezték először onkológiai indikációval, azóta nagy népszerűségnek örvend (8). Ez az eljárás kevésbé invazív, csökkenti a vérveszteséget, a fájdalomcsillapító igényt és a posztoperatív szövődmények számát. Lehetővé teszi a beteg bélműködésének gyorsabb helyreállását és a normálaktivitás mielőbbi visszaszerzését, így a rövidebb hospitalizációt. Jó tumorkontrollt biztosít és hasonló onkológiai kimenetelt, mint a nyílt műtét (2, 9). A minimál invazív technikák hátrányai a hosszabb tanulási idő, valamint a magasabb műtéti költségek (4).
Egy a laparoszkópos radikális cystectomia eredményeit vizsgáló tanulmány során a következőkről számoltak be a szerzők. Az esetek döntő többségében ileumkonduitot (39/65), illetve ortotóp hólyagot (24/65) hoztak létre, továbbá néhány esetben ureterocutaneostomiát végeztek (2/65). Az átlagos műtéti idő 294 perc, az átlagos vérveszteség 249,69 ml, az átlagos kórházban tartózkodás 9,42 nap, az átlagos morfinigény pedig 3,69 nap volt. A teljes szövődményráta 44,6% volt, bár a betegek többségénél minor szövődményt észleltek (90%), amely nem igényelt műtéti ellátást (Clavien Dindo score I-II). A betegek 4,6%-ánál volt szükség reoperációra. A szövődmények száma csökkent a betegszám növekedésével (10). Huang és munkatársai 171 laparoszkópos cystectomiát vizsgáltak. 325 perces átlagos időről, 39,2%-os szövődményarányról – 6,4% Clavien I, 19,3% Clavien II és 13,5% Clavien III szintű – számoltak be. Mindegyik tanulmány több szövődményt írt le az ortotóp hólyaggal rendelkezők esetén, mint az ileumkonduitnál (11).
A legfontosabb onkológiai mutatók a lokális kiújulás, pozitív sebészi szél, eltávolított nyirokcsomók száma és a tumormentes túlélés. Az elvégzett tanulmányokban a lokális kiújulás, eltávolított nyirokcsomók és tumormentes túlélés tekintetében hasonló eredményeket kaptak a laparoszkópos és nyílt csoportban, így onkológiai szempontból egyenértékűnek tekinthetők (9, 12). Herr és munkatársai szerint amennyiben a preparátumban 10–14 nyirokcsomó található és a pozitív sebészi szél arány 10% alatt van, úgy a laparoszkópos cystectomia onkológiai eredményét ekvivalensnek kell tekinteni a nyílt műtéttel (13). Xie és munkatársai 13 centrumban több mint 2000 páciens adatait bemutatva a teljes-, illetve a daganatspecifikus túlélést illetően nem talált szignifikáns különbséget (14). Fonseka csapata által készített, nagy esetszámot felölelő (2104 eset) metaanalízis nem talált különbséget az eltávolított nyirokcsomók számában és a pozitív sebészi szél incidenciájában a nyílt és a laparoszkópos műtét között (7,7% laparoszkóp, 10,0% nyílt) (7). Több vizsgálat kimutatta, hogy laparoszkópos beavatkozás esetén szignifikánsan alacsonyabb a szövődmények kockázata, mint nyílt műtét esetén (4, 15). Egy tanulmány szerint 50 esetet követően hasonló vagy jobb műtéti idő, intraoperatív vérveszteség és kórházi bennfekvés érhető el, mint a nyílt műtéteknél. Irodalmi adatok alapján megfelelő gyakorlattal, a műtéti idő a nyílt cystectomiánál rövidebb lehet (4).
Egy metaanalízis összehasonlította a robotasszisztált, a laparoszkópos és a nyílt radikális cystectomiát. A robotasszisztált módozat hosszabb műtéti idővel jár a nyílt verzióval összehasonlítva, ám kisebb vérveszteséggel, rövidebb kórházban tartózkodással és hasonló vagy kevesebb szövődménnyel. A robotasszisztált radikális cystectomiát a laparoszkópos módszerrel összehasonlítva nem mutatható ki statisztikai különbség a kórházban tartózkodás ideje és a becsült vérveszteség között, viszont a műtéti idő hosszabb volt a robot esetén. Az onkológiai kimenetel egyenértékű volt (eltávolított nyirokcsomók száma és pozitív sebészi szél). A robotasszisztált műtétek során használt intracorporalis vizeletdiverzió technikailag jól kivitelezhető, jó onkológiai eredménnyel (7). Guru és munkatársai azt mutatták ki, hogy a sebészi és onkológiai eredmény folyamatosan javul a sebész által elvégzett minden egyes robotasszisztált műtéttel. A műtét minőségénél figyelembe vették a műtéti időt, becsült vérveszteséget, eltávolított nyirokcsomók számát és a sebészi szél pozitivitását, és ezek alapján 30 műtét elvégzése elegendő volt a megfelelő jártasság megszerzéséhez (16). Lee és munkatársai úgy találták, hogy a robotasszisztált műtét kevésbé drága, mint a nyílt műtét Bricker-hólyag vagy ortotóp hólyagképzés esetén. A költségek zömét a kórházban tartózkodás tette ki, és annak ellenére, hogy az eszközök drágábbak robotasszisztált műtétnél, nagy esetszámú centrumokban a robotasszisztált műtét költséghatékonyabb, különösen Bricker-féle stoma készítésekor (17). Kimutatták, hogy a robotsebészet laparoszkópiával szembeni előnye a rövidebb tanulási fázis, segít felülemelkedni a laparoszkópia technikai nehézségein, ideértve az operatőr kimerülését, a tremort és a varrást (1).
Betegek és módszerek
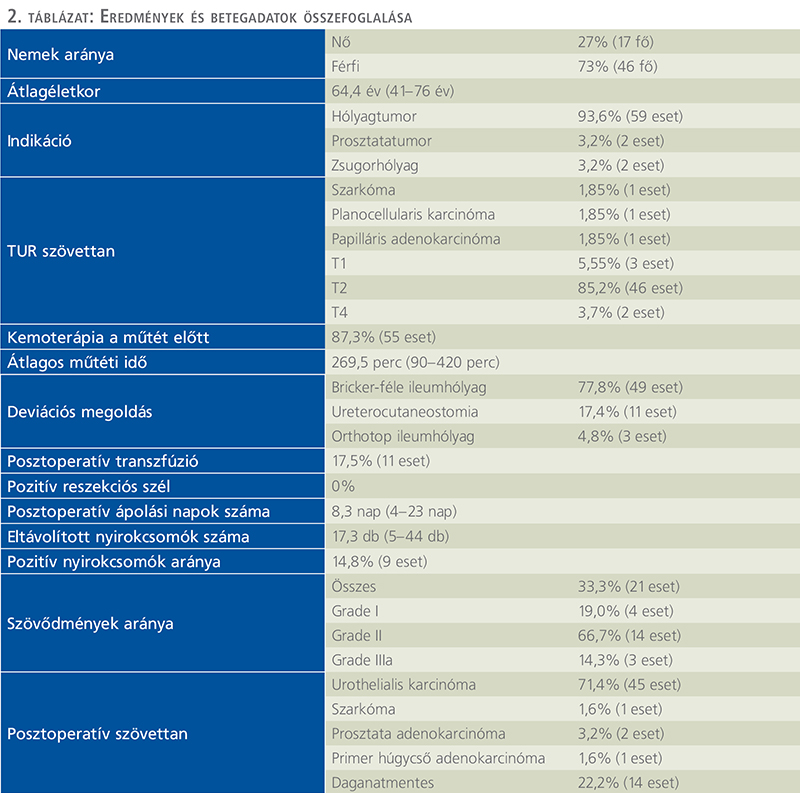
Osztályunkon 2014 óta végzünk radikális cystectomiát. A megfelelő gyakorlat megszerzését követően az utolsó hat év adatait retrospektív módon dolgoztuk fel. 2017. január és 2023. május közötti időszakban 63 laparoszkópos radikális cystectomiát végeztünk. 2 eset kivételével – ahol a műtét indikációja zsugorhólyag volt – minden páciens esetében kiterjesztett kismedencei lymphadenectomia és vizeletdeviáció történt. A műtét indikációja 59 esetben (93,6%) hólyagtumor volt, 2 esetben zsugorhólyag (3,2%), 2 esetben pedig húgyhólyagot nagymértékben infiltráló prosztata adenokarcinóma. Minden betegnél a műtétet megelőzően transurethralis reszekció történt, 54 esetben állt rendelkezésre pontos szövettani adat. Izominvazív urothelialis karcinóma (legalább T2) volt az indikáció 88,9%-ban (48 beteg), nem izominvazív urothelialis karcinóma 5,55%-ban (3 eset), szarkóma egy esetben (1,85%), papilláris adenokarcinóma egy esetben (1,85%) és planocellularis karcinóma szintén egy esetben (1,85%). A műtétet megelőzően neoadjuváns kemoterápia 87,3%-ban történt (55 eset). A páciensek 73%-a férfi volt (46 fő), 27%-a nő (17 fő). Az átlagéletkor 64,41 év volt (41–76 év).
Az eredmények áttekintésére a műtéti időt, konverziós rátát, kórházban tartózkodás idejét, posztoperatív transzfúzióigényt, eltávolított és pozitív nyirokcsomók számát, pozitív sebészi szél arányát, cystectomia szövettanát és a szövődményeket vizsgáltuk. A szövődmények besorolásánál a Clavien–Dindo-klasszifikációt használtuk (3, 18).
A cystectomiák bevezetését megelőzően már több mint 100 radikális prostatectomiát és kismedencei rekonstrukciót (promontofixációt) végeztünk osztályunkon, így a kismedencei anatómia, műtéti előkészületek és intraoperatív szövődmények ellátásában megfelelő gyakorlatunk volt. Három részre bontottuk a cystectomiát. A kismedencei lymphadenectomia, a húgyhólyag eltávolítása, illetve a vizeletdeviáció megoldása. A megfelelő gyakorlat megszerzése érdekében budapesti klinikai és kórházi centrumokban több alkalommal végeztünk esetmegfigyelést. A perioperatív betegmenedzsment szempontjából a Semmelweis Egyetem Urológiai Klinikájának jó gyakorlatát követtük. Kiképeztünk sztómás asszisztenst, betegeinknek fényképes oktatóanyagokat készítettünk. A minimál invazív megoldásra hazánkban nem volt gyakorlat, a műtéti technikát szakmai videóanyagok adaptálásával dolgoztuk ki.
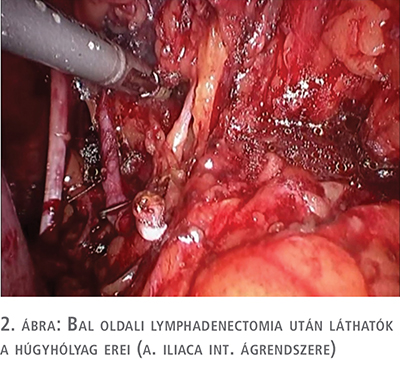
A műtét első része a kiterjesztett kismedencei lymphadenectomia volt, amelyet a radikális prostatectomiás gyakorlatnak megfelelően hajtottuk végre, azzal a kiegészítéssel, hogy a presacralis régióban lévő nyirokcsomók eltávolítását minden esetben elvégeztük. A presacralis nyirokcsomók eltávolítása során a szigmabelet mobilizáltuk, így a bal uréter átvezetése is egyben megoldható volt (1–2. ábra).

A második részben a húgyhólyag eltávolítása történt, nők esetében a kétoldali petefészkeket, a méhet és a hüvely mellső falát is beleértve. Minden esetben kombinált koaguláló vágó berendezést (bipolar + UH-energia) használtunk. A kétoldali infundibulopelvicus szalagot klipekkel elláttuk, a Retzius-teret középső részen meghagyva kétoldalon a medencefenékig, illetve laterálisan a vesicalis erek szintjéig szabaddá tettük. A hátsó hüvelyboltozatot megnyitva a hüvely mellső falára kanyarodva kétoldalon a hüvelyfalat a húgycső magasságáig átvágtuk. A hüvelybe a gázszivárgás megelőzésére gumikesztyűbe helyezett tampont tettünk. A középső szabad rész és a laterális leválasztott medencefal között a vesicalis ereket klipekkel elláttuk, a külső húgycsőnyílást is kivágtuk. Végül a Retzius-tér középső részének átvágását és a Santorini-plexus ellátása után a húgycső preparációját is elvégeztük. Az urétereket a húgyhólyag szintje előtt klippeltük és átvágtuk. A preparátumot szervzsákba helyeztük és a hüvelyen eltávolítottuk. A hüvely zárását kívülről indulva, majd belül folytatva, a gázszivárgás tamponos blokkolásával, önrögzítő fonallal végeztük (3. ábra).

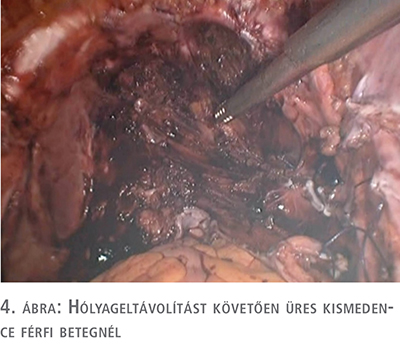
Férfi betegek esetén a hólyageltávolítást a kétoldali ductus deferenseket követve az ondóhólyagok szabaddá tételével kezdtük a rectovesicalis tér felől, közöttük a húgycsőig preparáltunk a Denonvilliers-fascia kettőzete között. A nőkhöz hasonlóan nyitottuk meg a Retzius-teret, majd a medencefalon kétoldalt a vesicalis erekig jutottunk laterálisan. A középső szabaddá tett rectovesicalis tér és a laterális medencefal között a vesicalis ereket elláttuk, kétoldalt az endopelvikus fasciát megnyitva a prosztata pedunculusait hemoklippek felhelyezése után átvágtuk. Minden esetben törekedtünk a maximális neurovaszkuláris köteg kíméletre. Ezt követően a Retzius-tér megnyitását komplettáltuk és a Santorini-plexus ellátása és átvágása után és az uréterek a megelőzőekben leírt klippelése után a preparátumot szervzsákba helyeztük (4. ábra).
A vizeletdeviáció elvégzését minden esetben a köldök alatti bőrmetszésből, nyíltan végeztük. Férfi betegek esetén a preparátum kiemelése is itt történt. Ha szükség volt adheziolízisre azt laparoszkóppal megelőzően elvégeztük, ahogy az uréterek mobilizálását és a szigmabél alatti átvezetését is. Így a nyílt metszés hossza jelentősen csökkenthető volt, az anasztomózisok elkészítését, a belet, illetve az urétereket a bőr szintje elé emelve végeztük el. Szólóvese esetén ureterocutaneostomát helyeztünk fel, három esetben ortotóp húgyhólyagképzést, többi betegnél Bricker szerinti uretero-ileo-cutaneostomát képeztünk (5. ábra).
A belek varrása a kezdeti néhány eset után bélvarrógéppel történt. Ortotóp hólyagképzés esetén (Studer szerint) a hólyag kialakítása és az uréterek beszájaztatása nyíltan történt, majd a sebzést bezárva a húgycső-bélhólyag anasztomózist laparoszkóppal végeztük.
Eredmények
Az átlagos műtéti idő 269,5 perc volt (90–420 perc). Vizeletdeviációs megoldásként javarészt Bricker-féle ileumhólyag került kialakításra (49 eset, 77,8%), az esetek majdnem ötödében ureterocutaneostomiát végeztünk (11 eset, 17,4%), és 4,8%-ban ortotóp ileumhólyagot készítettünk (3 eset). Posztoperatív transzfúziót a páciensek 17,5%-a igényelt. A posztoperatív ápolási napok száma átlagosan 8,3 nap volt (4–23 nap). Pozitív sebészi szélt nem találtunk (39 esetben állt rendelkezésre adat erre vonatkozóan). Az eltávolított nyirokcsomók számáról 50 páciensnél állt rendelkezésünkre pontos adat (2 betegnél, akiknél zsugorhólyag miatt indikáltuk a műtétet, nem történt lymphadenectomia) – átlagosan 17,3 darab nyirokcsomó került műtétenként eltávolításra (5–44 darab, 4 alkalommal került eltávolításra kevesebb, mint 10 nyirokcsomó). Pozitív nyirokcsomót a 61 lymphadenectomia alatt 9 alkalommal találtak (14,8%), regresszió jeleit egy nyirokcsomóban írták le. A szövettani vizsgálat a következőket mutatta: 71,4% urothelialis karcinóma (45 eset), 1,6% szarkóma (1 eset), 3,2% prosztata-adenokarcinóma (2 eset), 1,6% primer húgycsőtumor (1 eset), 22,2% daganatmentes minta volt (14 eset) (6. ábra).

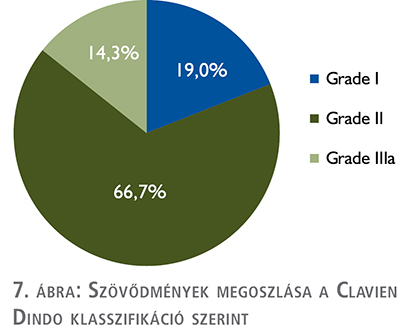
Szövődményeket tekintve az összesített szövődményarány 33,3% volt – ezek nagy része (85,7%) Grade I és II, 14,3% pedig Grade IIIa csoportba tartozott (7. ábra).
Műtétet követően halál nem fordult elő és reoperációra egy esetben sem volt szükség. A szövődmények típusait a Clavien–Dindo-klasszifikáció szerint besorolva az 1. táblázat részletezi. Eredményeinket a 2. táblázatban összegeztük.

Következtetések
Az átlagos műtéti idő 269,5 perc volt, ami némiképp alacsonyabb az irodalmi adatokban fellelhetőknél. Továbbá szövődmények tekintetében is a nemzetközi adatoknál előnyösebb eredményt kaptunk, az összesített szövődményarány 33,3% volt, ráadásul perioperatív halálozás nem fordult elő és a korai posztoperatív időszakban (30 nap) reoperációra sem került sor. A szövődmények súlyosság szerinti megoszlása hasonló abban, hogy legnagyobbrészt Grade II kategóriába sorolhatók, előnyösebb azonban abban, hogy a legsúlyosabb szövődmény a Grade IIIa csoportba tartozik. Az ápolási napok száma átlagosan 8,3 nap volt, ami hasonló a külföldi adatokhoz. Az eltávolított nyirokcsomók száma átlagosan 17,3 volt, ami megfelelne Herr és munkatársai által előírtaknak (10-14 nyirokcsomó/műtét), csupán 4 páciensnél nem sikerült elérni ezt az előírt minimum 10 nyirokcsomót (6,6%).
A laparoszkópos radikális cystectomia biztonságos kezelési módja az előrehaladott urothelialis betegségeknek, hasonló onkológiai eredményekkel és gyorsabb felépüléssel, mint a nyílt változat során. 50 műtétet követően tapasztalt kezekben legalább olyan könnyen elvégezhető műtét, mint a nyílt cystectomia. A perioperatív szövődmények súlyossága, alacsonyabb vérveszteség és a rövidebb hospitalizációs idő, amit a laparoszkópos csoportban láttak arra enged következtetni, hogy ez a megközelítés jó alternatívája lehet a nyílt műtéteknek több magyarországi centrumban is.
A laparoszkópos és robotasszisztált műtéti megoldásnak hasonló az onkológiai hatékonysága és a biztonsági profilja izominvazív hólyagtumor kezelésében. A robot egyértelmű előnye kimutatható a minimál invazív cystectomiák esetén is, különösen a vizeletdeviációk tekintetében. Szélesebb körű magyarországi elterjedéséig a laparoszkópos megoldás a kiváló választási lehetőség képzett sebészeknek robotsebészeti rendszerrel nem rendelkező intézményekben (1).
Irodalom
1. Li P, Meng C, Peng L, et al. Perioperative comparison between robot-assisted and laparoscopic radical cystectomy: An update meta-analysis. Asian J Surg 2023 Sep; 46(9): 3464–3479.
https://doi.org/10.1016/j.asjsur.2023.04.030
2. Lisin´ski J, Kienitz J, Tousty P, et al. Comparison of Laparoscopic and Open Radical Cystectomy for Muscle-Invasive Bladder Cancer. Int J Environ Res Public Health 2022 Nov 30; 19(23): 15995.
https://doi.org/10.3390/ijerph192315995
3. EAU Guidelines. Edn. presented at the EAU Annual Congress Milan 2023. ISBN 978-94-92671-19-6.
4. Adamczyk P, Juszczak K, Kadłubowski M, et al. Can laparoscopic cystectomy become the method of choice in the treatment of invasive urothelial urinary bladder cancer? Adv Clin Exp Med 2020 Mar; 29(3): 301–306. https://doi.org/10.17219/acem/115084
5. Challacombe BJ, Bochner BH, Dasgupta P, et al. The role of laparoscopic and robotic cystectomy in the management of muscle-invasive bladder cancer with special emphasis on cancer control and complications. Eur Urol 2011 Oct; 60(4): 767–75. https://doi.org/10.1016/j.eururo.2011.05.012
6. Irwin BH, Gill IS, Haber GP, Campbell SC. Laparoscopic radical cystectomy: current status, outcomes, and patient selection. Curr Treat Options Oncol 2009 Aug; 10(3–4): 243–55. https://doi.org/10.1007/s11864-009-0095-3
7. Fonseka T, Ahmed K, Froghi S, et al. Comparing robotic, laparoscopic and open cystectomy: a systematic review and meta-analysis. Arch Ital Urol Androl 2015 Mar 31; 87(1): 41–8. https://doi.org/10.4081/aiua.2015.1.41
8. Sánchez de Badajoz E, Gallego Perales JL, Reche Rosado A, et al. Radical cystectomy and laparoscopic ileal conduit [in Spanish]. Arch Esp Urol 1993 Sep; 46(7): 621–4.
9. Albisinni S, Rassweiler J, Abbou CC, et al. Long-term analysis of oncological outcomes after laparoscopic radical cystectomy in Europe: results from a multicentre study by the European Association of Urology (EAU) section of Uro-technology. BJU Int 2015 Jun; 115(6): 937–45. https://doi.org/10.1111/bju.12947
10. Aboumarzouk OM, Drewa T, Olejniczak P, Chlosta PL. Laparoscopic radical cystectomy: a 5-year review of a single institute’s operative data and complications and a systematic review of the literature. Int Braz J Urol 2012 May-Jun; 38(3): 330–40. https://doi.org/10.1590/s1677-55382012000300006
11. Huang J, Lin T, Liu H, et al. Laparoscopic radical cystectomy with orthotopic ileal neobladder for bladder cancer: oncologic results of 171 cases with a median 3-year follow-up. Eur Urol 2010 Sep; 58(3): 442–9. https://doi.org/10.1016/j.eururo.2010.05.046
12. Porpiglia F, Renard J, Billia M, et al. Open versus laparoscopy-assisted radical cystectomy: results of a prospective study. J Endourol 2007 Mar; 21(3): 325–9. https://doi.org/10.1089/end.2006.0224
13. Her H, Lee C, Chang S, Lerner S. Bladder Cancer Collaborative Group. Standardization of radical cystectomy and pelvic lymph node dissection for bladder cancer: a collaborative group report. J Urol 2004 May; 171(5): 1823–8; discussion 1827–8. https://doi.org/10.1097/01.ju.0000120289.78049.0e
14. Xie W, Bi J, Wei Q, et al. Survival after radical cystectomy for bladder cancer: Multicenter comparison between minimally invasive and open approaches. Asian J Urol 2020 Jul; 7(3): 291–300.
https://doi.org/10.1016/j.ajur.2020.06.002
15. Tang K, Li H, Xia D, et al. Laparoscopic versus open radical cystectomy in bladder cancer: a systematic review and meta-analysis of comparative studies. PLoS One 2014 May 16; 9(5): e95667.
https://doi.org/10.1371/journal.pone.0095667
16. Guru KA, Perlmutter AE, Butt ZM, et al. The learning curve for robot-assisted radical cystectomy. JSLS 2009 Oct-Dec; 13(4): 509–14.
https://doi.org/10.4293/108680809X12589998404128
17. Lee R, Ng CK, Shariat SF, et al. The economics of robotic cystectomy: cost comparison of open versus robotic cystectomy. BJU Int 2011 Dec; 108(11): 1886–92. https://doi.org/10.1111/j.1464-410X.2011.10114.x
18. Patidar N, Yadav P, Sureka SK, et al. An audit of early complications of radical cystectomy using Clavien-Dindo classification. Indian J Urol 2016 Oct-Dec; 32(4): 282–287. https://doi.org/10.4103/0970-1591.191244