When is radical cystectomy indicated for non-muscle invasive bladder tumours?
DOI: 10.22591/magyurol.2024.1.engertz.39
Authors:
Engert Zoltán Vendel dr.
Vas Vármegyei Markusovszky Egyetemi Oktatókórház, Urológiai Osztály,
Szombathely (osztályvezető: Engert Zoltán Vendel dr.)
Summary
Radical cysto-vesiculo-prostatectomy (RCVP) and, in women, extended pelvic exenteration (EPE) are the gold standard surgical procedures for muscle-invasive bladder tumours (MIBC). Currently, it is not possible to show acceptable long-term results with other oncological methods. It is true that the operation is stressful for both the patient (mortality 3-7.9%; morbidity 30-70%) and the operator. The latter requires serious anatomical/surgical technical preparation, which can only be obtained with many years of practical experience. But the payoff is also great, as the patient lives with an acceptable quality of life for years, even decades (5-year survival ~70%).
Apart from MIBC, however, surgery may also be indicated in certain cases of non-muscle invasive bladder tumour (NMIBC), where transurethral bladder resection (TURB) and chemo- or BCG instillation was not effective and the process recurred.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 1. SZÁM
Összefoglalás
A radikális cysto-vesiculo-prostatectomia (RCVP), illetve nőknél a kiterjesztett kismedencei exenteráció (EPE) a gold standard műtéti eljárás izominvazív hólyagtumornál (MIBC). Jelenleg más onkológiai módszerrel nem lehet elfogadható hosszú távú eredményt felmutatni. Igaz, hogy a műtét megterhelő mind a beteg (mortalitás 3-7,9%; morbiditás 30-70%,) mind az operatőr számára. Az utóbbitól komoly anatómiai/műtéti technikai felkészültséget igényel, amelyeket csak hosszú évek gyakorlati tapasztalatával lehet megszerezni. De a hozadéka is nagy, hiszen a beteg elfogadható életminőséggel él éveket, esetleg évtizedeket is (5 éves túlélés ~70%).
MIBC-n kívül azonban indikálható a műtét nem izominvazív hólyagtumor (NMIBC) bizonyos eseteiben is, ahol transurethralis hólyagreszekció (TURB) és a kemo-, illetve BCG-instilláció nem volt eredményes és a folyamat recidivált.
Bevezetés
A radikális cysto-vesiculo-prostatectomia (RCVP), illetve nőknél a kiterjesztett kismedencei exenteráció (EPE) és valamilyen típusú hólyagpótlás már az 1950-es évektől teret hódított az invazív hólyagtumorok (MIBC) kezelésében. Jelenleg más onkológiai módszerrel nem lehet elfogadható hosszú távú eredményt felmutatni. A műtét megterhelő a beteg számára (mortalitás 3-7,9%; morbiditás 30-70%) (1), de elfogadható életminőséggel él éveket, esetleg évtizedeket is (5 éves túlélés ~70%) (2).
Ez a tendencia a 80-as évektől felerősödött és az indikációs kör is kiszélesedett (1. táblázat, 1. ábra).

MIBC-n kívül azonban azon betegeknél, akiknél ugyan nem izominvazív hólyagtumor (NMIBC) van jelen, de a transurethralis hólyagreszekció (TURB) és az azt követő kemo-, illetve BCG-instilláció nem volt eredményes és a folyamat recidivált, indikálható az RPVC, illetve nőknél az EPE. Ugyanez a helyzet, ha a szerekkel szemben intolerancia áll fenn, mert kezelés nélkül igen magas a recidívaarány és a progresszió lehetősége. Jelenleg ilyen esetekben is – akárcsak izominvazív tumoroknál – a fentnevezett két műtét adja a legjobb hosszú távú eredményt, más onkológiai kezelés meg sem közelíti (2. táblázat).
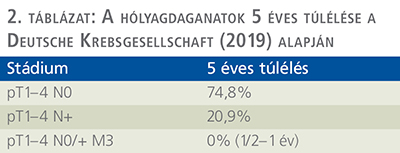
Ahogy a 2. táblázatból kiderül, viszonylag korán kell indikálni a cystectomiát, mivel a progresszió jelentősen rontja a betegek túlélési esélyeit. Mindenképpen el kell kerülnünk, hogy a folyamat a hólyagból „kiszabaduljon”, hiszen már nyirokcsomóáttétnél is csak 20% körüli az ötéves túlélés, távoli áttétnél pedig a betegek egy-másfél éven belül meghalnak (3)!
Miben különbözik a radikális műtét és hólyagpótlás izominvazív és nem izominvazív hólyagtumoroknál?
Alapvetően hasonlóak az elvek csak néhány – ámbár igen lényegi – különbséget találunk. Mindkét esetben kerülni kell műtétig az erőszakos katéterezéseket, mivel az esetleges sérülés és extravasatio a prognózist és a műtéti eredményességet jelentősen lerontja. Ha szükséges, inkább egyéb vizeletdeviációs módszert alkalmazzunk, pl. definitív epicystostomát vagy transrenalis drént, ha már üregrendszeri tágulat is kialakult az intramurális uréterszakasz tumoros kompressziója által.
Nőknél az eltérő anatómia, az instabil medencefenék miatt mindenképpen a Bricker-hólyagot részesítsük előnyben. Orthotopikus hólyagpótlás esetén ugyanis igen magas az inkontinencia aránya. A nappali inkontinencia 15% az éjszakai inkontinencia 35% és még hiperkontinenciával (35%) is számolni kell! Mindezek a beteg életminőségét jelentősen befolyásolják negatív irányba. Hosszú távon ezért a Bricker-típusú hólyagpótlás eredményesebb, a nőbetegek számára elfogadhatóbb.
Szintén csak nedves stoma jön szóba mindkét nemnél, ha a hátsó húgycső is érintett a tumoros folyamattól. Ilyenkor az urethrectomia elkerülhetetlen, orthoptotikus hólyagpótlás tehát kivitelezhetetlen.
A radikális hólyagkiirtás adekvát része a kiterjesztett lymphadenectomia (LA) az aorta bifurkációig és presacralisan is. A csak kismedencei LA kevés, a „szuper kiterjesztett” (paraaorto-cavalisan az a. mesenterica inferior esetenként az a. mesenterica superior eredéséig) pedig nem nyújt túlélési előnyt (4).
A különbség a két műtéti típus között a következő: míg MIBC-nél a diagnózis felállítása után három hónapon belül a műtétet el kell végezni, ez – értelemszerűen – NMIBC esetekben nem jön szóba. Viszont az utóbbinál a magas és igen magas rizikócsoportba sorolt betegeknél (lásd alant) a fokozott recidíva- és progresszióhajlam miatt nem végzünk neoadjuváns kemoterápiát, hanem amilyen gyorsan csak lehet, műtét irányába mozdulunk el (5)!
Továbbá azon betegek, akiknél megelőzően NMIBC volt a diagnózis, majd a kezelések ellenére MIBC alakult ki, sokkal rosszabb a túlélési esélye, mint azoknak, akiknél primeren kerül felfedezésre a MIBC (6). Ez is mindenképpen a korai cystectomia mellett szól a magas és az igen magas rizikójú csoportnál!
Nem izominvazív hólyagdaganatok
A kiújulás és progresszió/propagáció
veszélyének megítélése NMIBC-nél
Ahhoz, hogy eldönthessük, hogy valóban „agresszívebb”-en kell-e fellépnünk, mint a TURB és adjuváns hólyagkezelés, jól használható European Organisation for Research and Treatment of Cancer (EORTC) által ajánlott rizikókalkulátor, amely hat klinikai és patológiai prognosztikai paramétert vesz figyelembe (7):
- a tumorok intravesicalis száma,
- tumornagyság,
- korábbi recidíva/rekurrencia megléte, gyorsasága,
- pT stádium,
- carcinoma in situ (CIS) jelenléte,
- grading (WHO Grade 1973 és/vagy WHO Grade 2004/2016),
- életkor (az eredeti verzióban még nem szerepelt, a módosítottban már igen, ≤70, illetve >70).
Javasolható mindenképpen a www.nmibc.net honlap egységes használata, ezzel a rizikócsoport-besorolás egyértelműen elvégezhető (7).
Ezek alapján négy rizikócsoportba kell besorolni az NMIBC-s betegeket úgy, mint
- alacsony,
- átmeneti,
- magas és
- igen magas rizikójúak.
E két utóbbinál, de mindenekelőtt az igen magas rizikójú csoportnál az RCVP, illetve az EPE indikálható! Ugyanis még BCG-terápia mellett is az 5 éven belüli progresszió lehetősége majdnem eléri az 50%-ot (40-44%) (8).
Egyéb tényezők a rizikócsoportokon kívül, amelyek miatt RCVP, illetve EPE elvégzése mérlegelendő, mivel ezen esetekben a progresszió lehetősége szintén jelentős:
- CIS a prosztatikus húgycsőben. Egyébként is tudott, hogy carcinoma in situ esetén az esetek felében izominvazív daganat alakul ki öt év alatt! Ugyanígy igen rossz a prognózis akkor, ha a CIS nem önállóan, hanem felületes hólyagdaganat kísérőjeként van jelen. A radikális műtét ezen esetekben mindenképpen mérlegelendő (9).
- A hólyagtumorok szövettani variánsai, úgy mint mikropapilláris, sarcomatoid, neuroendokrin, laphám irányú differenciálódás. Ha ilyenkor csak BCG-kezelés történik, az ötéves túlélés csupán 60%, míg cystectomiát követően ez 100% (10).
- Lymphovascularis tumorinvázió a TURB szövettanában.
- Hólyagdiverticulumban elhelyezkedő tumornál a musculatura hiánya miatt eleve magasabb kockázattal, rapidabb progresszióval kell számolni. Ebben az esetben az egygócú folyamatnál a diverticulectomia/hólyagfal-reszekció is operatív alternatíva lehet. Több góc esetén azonban inkább RCVP vagy az EPE jön szóba (11).
- Mindenképpen fel kell ajánlani a cystectomia és hólyagpótlás lehetőségét magas és igen magas rizikójú betegeknek, akiknél a BCG hólyaginstillációt intolerancia miatt fel kellett függeszteni. Mert azt tudni kell, hogy BCG-kezelés mellett is ezekben a csoportokban mintegy 10-20%-ban izominvazívvá válik a folyamat, ha azonban a kezelés felfüggesztődik ez az érték 66%-ra emelkedik (12), és jelenleg nincs olyan onkológiai kezelési eljárás, amely alternatívája lehetne a műtétnek!
Megbeszélés
A 80-as évektől, különösen Richard E. Hautmann professzor munkássága nyomán (13) felerősödött az igény – a jó onkológiai és funkcionális eredményekre tekintettel –, hogy a lehető legkorábban végezzük el a radikális cystectomiát hólyagtumor esetében. Sőt, az addig egyeduralkodó Bricker-hólyag mellett megjelentek egyéb „nedves stomák”, illetve egyre szélesebb körben alkalmazták az orthotopikus hólyagképzést (Orthotopische Neoblase, Orthotopic Neobladder, ONB) is (3. táblázat).
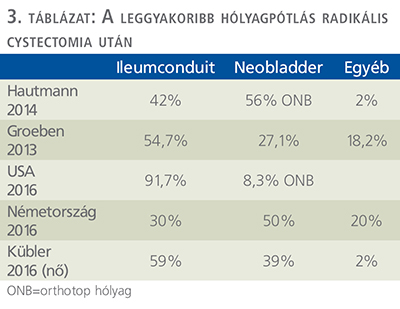
Érdekes, hogy Európában ez utóbbi műtéti típus sokkal jobban tért hódított, mint a tengerentúlon.
Az eredeti indikációs körbe az izominvazív tumorok tartoztak bele. Felvetődött azonban és tanulmányokkal alátámasztható is volt, hogy magas és igen magas rizikócsoportba tartozó felületes tumorok esetén is a radikális műtét elvégezhető. Sőt, megfelelő betegszelekciót követően, jelenleg ez adja a legjobb hosszú távú onkológia eredményt, összevetve egyéb onkoterápiákkal.
Tehát az „evidence based medicine” szerint jelenleg ez a leghatékonyabb kezelés MIBC-nél, és mint fent írtam, NMIBC bizonyos eseteinél is. Mégis gyakran felvetődik a kérdés, hogy akkor miért is van kevés RCVP és EPE?
Ennek több oka is van, amelyek közül néhányat felsorolnék. Ezeken mindenképpen javítani, változtatni kell.
A betegek nem választják ezt a csonkoló műtétet, mivel elmaradt a korrekt felvilágosításuk. Esetleg az interneten tájékozódnak, ami lehet jó is, de igen sok álinformációt is kapnak. Ha eléjük tárjuk, hogy mi várható az EORTC rizikókalkulátora szerint, biztosan segítene nekik helyesen dönteni!
A kezelőorvos – ha a műtétet maga nem végzi – csak igen előrehaladott stádiumban küldi tovább a beteget, ameddig lehet a TURB „erőlteti”. Ez a szemlélet nem jó, a majdani RCVP és EPE eredményeit jelentősen lerontja!
Az onkoteam döntése inkább konzervatív irányba tereli a beteget. Előszeretettel javasolják a neoadjuváns kezelést, noha tudott, hogy a betegek mindössze 5-7%-a profitál belőle. De az operáció idejét rendkívül kitolja, nem beszélve az általa okozott mellékhatásokról, amely a műtét eredményességét negatívan befolyásolja!
Végül, de nem utószor, sajnos kevés azon urológus-sebészek száma, akik készek és képesek a beteg és az operatőr számára is igen megterhelő műtétet elvégezni. Ezért mindenképpen szükséges lenne megfelelő „tréning”-eket tartani az alapműtétekben már gyakorlatot szerzett kollégáknak.
Irodalom
1. Roghmann F, et al. Indikation und Technik der Frühzystetomie. Urologe 2021; 60: 1424–1431. https://doi.org/10.1007/s00120-021-01682-7
2. Herr HW, Sogani PC. Does early cystectomy improve the survival of patients with high risk superfitcial bladder tumors? J Urol 2001; 166(4): 1296–1299.
https://doi.org/10.1016/S0022-5347(05)65756-4
3. Gschwend JE, et al. Extended versus limited lymph node dissection in bladder cancer patients undergoing radical cystectomy: survival results from a prospective, randomized trial. Eur Urol 2018. https://doi.org/10.1016/j.eururo.2018.09.047
4. Roghmann F, et al. Quality assessment of radical cystectomy-opportunities, risks, challenges. Urologe 2021; 60(2): 151–161.
https://doi.org/10.1007/s00120-020-01439-8
5. Russell B, et al. A systematic review and metaanalysis of delay in radical cystectomy and the effect on survival in bladder cancer patients. Eur Urol Onkol 2020; 3(2): 239–249.
6. Moschini M, et al. Comparing long-term outcomes of primary and progressive carcinoma invading bladder muscle after radical cystectomy. BJU Int 2016; 117(4): 604–610. https://doi.org/10.1111/bju.13146
7. Sylvester RJ, et al. European Association of Urology (EAU) prognostic factor risk groups for non-muscle-invasive bladder cancer (NMIBC) incorporating the WHO 2004/2016 and WHO 1973 classification systems for grade: an update from the EUA NMIBC guidelines panel. Eur Urol 2021; 79(4): 480–488. https://doi.org/10.24908/ss.v19i4.15170
8. AWMF S3-Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms. AWMF-Registernummer: 032/0387OL; 2020
9. Babjuk M, et al. European Association of Urology guidelines on non.muscle-invasive bladder cancer (TaT1 and carcinoma in situ). Eur Urol 2019; 76(5): 639–657.
10. Willis DL, et al. Clinical outcomes of cT1 micropapillary bladder cancer. J Urol 2015; 193(4): 1129–1134. https://doi.org/10.1016/j.juro.2014.09.092
11. Voskuilen CS, et al. Urothelial carcinoma in bladder diverticula:a multicenter analysis of characteristics and clinical outcomes. Eur Urol Focus 2020; 6(6): 1226–1232. https://doi.org/10.1016/j.fopow.2020.05.029
12. Shabsigh A, et al. Defining early morbidity of radical cystectomy for patients with bladder cancer using a standardized reporting methodology. Eur Urol 2009; 55(1): 164174.
13. Hautmann RE, et al. The ileal neobladder. J Urol 1988; 139(1): 39–42.
https://doi.org/10.1016/S0022-5347(17)42283-X