Novel trends in the systemic treatment of advanced urothelial cancers
DOI: 10.22591/magyurol.2024.1.maraza.42
Authors:
Maráz Anikó dr., Rozsvai Tímea dr.
Szegedi Tudományegyetem, Onkoterápiás Klinika, Szeged (igazgató: Oláh Judit dr.)
Summary
Systemic treatment of urothelial cancers has shown dynamic development in recent years. The standard therapy for bladder cancers in stage T2-T4a N0 M0, in cases suitable for cisplatin, is radical cystectomy (RC) after neoadjuvant (NA) cisplatin (CDDP)-based chemotherapy (ChT). If NA ChT is not performed, in pT3-4 and/or N+ stage, ChT with adjuvant CDDP can be recommended with lower effectiveness. A 1-year adjuvant nivolumab therapy may be considered in PD-L1 positive patients with a high recurrence risk, in case of CDDP ineligibility or after NA ChT. CDDP-based ChT is the first-line treatment for locally advanced or metastatic patients suitable for CDDP, but in a recent study, combining nivolumab with ChT further improved the outcome. The first-line treatment of advanced patients unfit for CDDP but suitable for ChT is carboplatin (CBP)-based ChT, but based on new results, the combination of enfortumab vedotin (EV) and pembrolizumab showed excellent results in any platinum-eligible patient group. In cases responding to 4-6 cycles of platinum-based ChT, maintenance avelumab immunotherapy improves patient survival. In patients progressing
during or after platinum-based ChT, classical ChT is modestly effective in second/multiple lines, immunotherapy should be chosen. In many cases, modern antibody-drug conjugates such as EV and sacituzumab govitecan, as well as erdafitinib in case of FGFR alteration, expand the therapeutic possibilities, improving the life expectencies of patients.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 1. SZÁM
Összefoglalás
Az urothelialis daganatok szisztémás kezelése az elmúlt években dinamikus fejlődést mutat. A húgyhólyagdaganatok standard terápiája T2-T4a N0 M0 stádiumban, ciszplatinra alkalmas esetekben neoadjuváns (NA) ciszplatin (CDDP)-bázisú kemoterápia (KT) utáni radikális cystectomia (RC). Ha NA KT nem történik, pT3-4 és/vagy N+ stádiumban szerényebb eredményességgel, mint az NA, de adjuváns CDDP-tartalmú KT javasolható. Magas kiújulási rizikó, CDDP alkalmatlanság esetén, vagy NA KT után, PD-L1 pozitív betegeknél 1 éves adjuváns nivolumab terápia jöhet szóba. Lokálisan előrehaladott vagy áttétes, CDDP-ra alkalmas betegek elsővonalas kezelése a CDDP-bázisú KT, de egy legújabb vizsgálatban nivolumab KT-hoz kombinálása tovább javította a kimenetelt. Előrehaladott, CDDP-ra alkalmatlan, de KT-ra alkalmas betegek elsővonalbeli kezelése karboplatin (CBP) bázisú KT, bármely platinára alkalmas betegcsoportban. Platina KT 4-6 ciklusára reagáló esetekben fenntartó avelumab immunterápia javítja a betegek túlélését. Platinabázisú KT alatt vagy után progrediáló betegeknél másod/többedvonalban a klasszikus KT eredményessége szerény, immunterápia választandó. Többedvonalban a modern, antitest-gyógyszer konjugátumok, mint az EV és a sacituzumab govitecan, valamint FGFR-alteráció esetén az erdafitinib bővítik a terápiás lehetőségeket, javítva a betegek életkilátásait.
Bevezetés
Az izominvazív és előrehaladott urothelialis karcinómák (UC) kezelési lehetőségei dinamikus fejlődést mutatnak, különös tekintettel az immunterápiák alkalmazásának egyre szélesebb körű elterjedésére (1–3).
Az izominvazív (muscle invasive – MI) húgyhólyagdaganat (bladder cancer – BC) standard kezelése a radikális cystectomia (RC), amelynek eredményessége javítható ciszplatin (CDDP) bázisú neoadjuváns (NA), szelektált esetekben adjuváns (A) kemoterápiával (KT), vagy új eredmények alapján posztoperatív immunellenőrzési-pont gátlóval (ICI) (1–4).
A CDDP nemcsak a NA-KT báziskészítménye, hanem a lokálisan előrehaladott (locally advanced – LA) és áttétes urothelialis daganat (UC) esetén is az elsőként választandó gyógyszer. A KT és ICI egymás után alkalmazhatóak a törzskönyvi indikációk alapján, progresszió után szekvenciálisan, vagy a KT hatásának fenntartására, de a legújabb 2023-as eredmények alapján az ICI KT-val és antitest-gyógyszer konjugátummal (ADC) való kombinálása a legújabb jövőbeli trendek. A molekuláris célpontok elemzése is egyre jobban elterjed az UC diagnosztikájában (5, 6), a készítmények között a fibroblaszt-növekedési faktor 1–4 receptor (FGFR) gátló erdafitinib eredményei igen bíztatóak (6, 7). Az ADC-k bővítik a terápiás lehetőségeket KT utáni vonalakban is, amelyek célzottan juttatják be a sejtekbe a citosztatikus hatású készítményeket egy linkerrel kapcsolt antitest segítségével (pl. enfortumab vedotin (EV) és a sacituzumab-govitecan (SG) (8, 9).
A citotoxikus szerek helye és indikációs köre folyamatosan változik, de az új terápiás lehetőségek mellett is maradt szerepük. Összefoglalónk célja segítséget nyújtani a klinikusok, urológusok, onkológusok és onkoteamek számára az UC-k szisztémás kezelésének optimális megválasztásához, amelynek során a korábbi standardok mellett az legújabb kezelési lehetőségek is említésre kerülnek (1–3).
Tartalmilag 5 fő terület kerül ismertetésre:
- neoadjuváns szisztémás kezelés indikációja,
- adjuváns szisztémás kezelési lehetőségek,
- előrehaladott/áttétes daganatok elsővonalbeli szisztémás terápiái,
- másodvonalbeli szisztémás terápiák,
- többedvonalbeli szisztémás kezelések.
Neoadjuváns szisztémás kezelés cystectomia előtt
Az urothelialis és egyéb változatos szövettani MIBC-ben szenvedő betegek standard kezelése az RC, amely a betegek körülbelül 50%-ánál biztosít 5 éves túlélést (1–3).
A NA-KT-t a tervezett műtét előtt, reszekálható cN0M0 MIBC UC-ban szenvedő betegeknél alkalmazzák. A NA-KT elméleti előnyei meghaladják az esetleges hátrányok arányát (1–3).
A potenciálisan operábilis (T2b-T4a N0 M0), radikális cystectomiára dedikált MIBC-s betegek műtétjét megelőzően, NA ciszplatinbázisú KT javasolt.
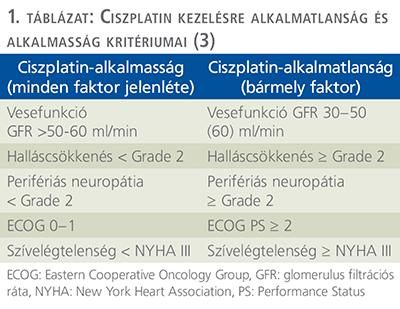
Több, III. fázis klinikai vizsgálatban igazolták a 80’-as évektől kezdve a cystectomiára dedikált T2-T3 N0 stádiumú betegek NA-KT után végzett cystectomia melletti 26-33%-os halálozási rizikócsökkenését a csak műtéthez képest (10–13). A vizsgálatok jelentős különbözősége miatt az eredmények összevonása nem volt lehetséges. A betegeknek alkalmasnak kellett lenniük a CDDP-terápiára (1. táblázat).
Egy, 11 randomizált vizsgálatból származó metaanalízis (n = 3005) 5-8%-os 5 éves teljes túlélési (OS) és 9%-os 5 éves betegségmentes túlélési (disease free survival – DFS) előnyt mutatott a NA-KT javára (2, 3, 12, 14). A legutóbbi metaanalízis négy további randomizált vizsgálatot tartalmazott (Nordic I, Nordic II és BA06 30894 vizsgálatok), amely 427 új és 1596 beteg frissített adatait tartalmazta. Eredményei megerősítették a korábban publikált adatokat, 8%-os abszolút javulást mutattak a túlélésben 5 év után (13–15). Csak a CDDP bázisú KT kombinálása eredményezett jelentős terápiás előnyt.
A leggyakoribb NA-KT-kombinációk mellett, amelyeket hazánkban is alkalmazunk (MVAC és gemcitabin-ciszplatin – GC), a pT0/pT1 esetek és a patológiai komplett remisszió (pCR) aránya hasonló (12-50% MVAC, 12-22% GC) (2, 3, 13). A módosított dózis denz (dd) MVAC hatására kisebb egykarú II. fázis tanulmányokban a pCR-ráta magasabb volt, de a GETUG/AFU V05 VESPER-vizsgálatban kezelt 437 NA-KT-s beteg adatai alapján a GC-hoz hasonló pCR-arány adódott (ypT0N0 – ddMVAC vs. GC: 42% vs. 36%, p = 0,2). Kedvezőbb volt a ddMVAC hatására a szerven belül maradó daganatok aránya, a lokális kontroll és a 3 éves PFS, de jelentősen több gasztrointesztinális toxitással és aszténiával járt a GC-kezeléssel szemben (16).
Folyamatban van a NA-KT MIBC-ben való hatékonyságának javítására irányuló számos vizsgálat, amelyekben ICI-KT, KT tirozin-kináz-inhibitor (TKI) és ICI-ADC kombinációkat értékelnek a KT-val szemben.
Nemzetközi ajánlások radikális cystectomia előtt javasolják a multidiszciplináris döntés alapján meghatározott, NA CDDP-bázisú KT-t (a protokoll pontosítása nélkül), amennyiben a beteg KT-ra és CDDP-kezelésre alkalmas (1–3) (1. táblázat).
NA-KT indikációja nem teljesen egyértelmű cT2a N0 M0 esetén
A cT2a (izomréteg belső fele érintett), kis tumorok esetén a mikrometasztázisok aránya csekély, a klinikai vizsgálatokban alacsony arányban vettek részt ezen betegek, ezért a NA-KT indikációja ebben a stádiumban nem egyértelmű, bár javallatát erősíti, hogy a műtéti specimenekben 43-73%-ban magasabb patológiai tumorstádiumot találtak, mint a képalkotók diagnózisa. A T2 tumorok klinikai stádiuma így alulértékelt lehet (3, 18).
Alkalmazhatóak-e biomarkerek a NA-KT predikciójára?
A NA-KT alatti progresszió azonosítására számos központban képalkotást alkalmaznak annak ellenére, hogy nincsenek magas evidenciájú bizonyítékok. Egy nemrégiben közölt tanulmány alapján a molekuláris altípusok között a genomilag instabil és urothelialis daganatos betegeknél nagyobb arányban fordul elő pCR, mint a bazális/laphám altípus esetén. A molekuláris altípus független összefüggést mutatott a betegek túlélésével is. A molekuláris tumorprofilozás irányíthatja a NA-KT használatát a jövőben, de ez jelenleg nem alkalmazható a rutin gyakorlatban (4, 19).
Adjuváns szisztémás terápia (KT vagy ICI) radikális cystectomia után
Az RC-t követő posztoperatív kezelés az adjuváns terápia. Jelenleg korlátozott bizonyíték áll rendelkezésre az adjuváns KT rutinszerű alkalmazása mellett, mivel nincs olyan tervezett betegbeválasztást befejező, III. fázis klinikai vizsgálat, amely egyértelmű adatot adna.
Adjuváns ciszplatin-bázisú KT eredményessége
Számos metaanalízis, retrospektív adatelemzés és obszervációs vizsgálat történt. A kezelési sémák leggyakrabban a neoadjuváns és metasztatikus betegség esetén alkalmazható, CDDP-bázisú MVAC és GC, bár ezeket a kombinációkat nem vizsgálták III. fázis vizsgálatokban adjuváns protokollként. A korábbi randomizált vizsgálatok alapján nem volt egyértelmű az adjuváns KT OS-t javító hatása. Hat nagyobb vizsgálatból készült metaanalízis (491 eset). A studyk felében korai vizsgálatzárás, alacsony betegszám, nem megfelelő statisztikai módszerek, valamint az irreleváns végpontok miatt jelentős módszertani hibák szerepeltek. A vizsgálatok alapján nem volt kimutatható előny az RC-t követő posztoperatív KT hatására a csak RC-hoz képest (20, 21). Az újabb adjuváns III. fázis vizsgálatokkal (9 trial, 945 beteg), amelyekből 3 vizsgálatban modern KT-s kombinációkat (GC, paclitaxel-GC) alkalmaztak (22), 23% OS és 34% DFS, míg N+ betegeknél 36% DFS-beli rizikócsökkenés volt detektálható (22). Kedvező trend volt észlelhető az adjuváns KT hatására különösen pT3-4 és/vagy N+ stádiumban, de az alkalmazás evidenciája alacsony.
A legutóbbi szisztematikus áttekintésben és metaanalízisben (23) 10 study (n = 1183) elemzése során a CDDP-alapú adjuváns KT javította az OS-t (HR: 0,82, p = 0,02), amely 6%-os abszolút javulást jelentett a túlélésben 5 év után, 50%-ról 56%-ra. Az adjuváns KT javította az RFS-t (HR: 0,71, p <0,001), a lokoregionális RFS-t (HR: 0,68, p <0,001) és az MFS-t (HR: 0,79, p = 0,01) is, az abszolút haszon 11%, 11%, illetve 8%. Az EORTC 30994-es III. fázis trialben az adjuváns KT előnyét igazolták pT3/T4 és/vagy N+ betegek radikális cystectomiája utáni azonnali 4 ciklus adjuváns KT hatására a késleltetett, relapszuskor indított 6 ciklus KT-val szemben. A progressziómentes túlélésben (PFS) a műtét után alkalmazott KT mellett kifejezett előny mutatkozott a késleltetett kezeléssel szemben, 48%-os rizikócsökkenéssel. Bár a halálozás rizikója 22%-kal csökkent, nem volt teljes túlélési előny (24). Legjobban profitálhatnak a magas rizikójú betegek (pT3-4 és/vagy N+, pozitív sebészi szél, high grade tumor), amennyiben NA-KT nem történt. Az adjuváns KT esetén is szükséges ismerni a ciszplatin-alkalmatlanság definícióját, mivel a választandó báziskészítmény a ciszplatin, ha a beteg NA-KT-ban nem részesült (3, 4, 21).
Adjuváns ICI-terápia eredményessége
Az adjuváns szisztémás kezelések új lehetőségei az ICI-k, a nivolumab és a pembrolizumab, amelyek közül a nivolumab rendelkezik Európai Gyógyszerügyi Hatóság (EMA) törzskönyvvel ebben az indikációban, programozott sejthalál ligand-1 (PD-L1) pozitív esetekben. A PD-1/PD-L1 ellenőrzőpont-gátlók előnyeinek értékelésére három III. fázis vizsgálat történt.
Nivolumab (Opdivo)
A CheckMate 274 III. fázis, többközpontú, kettős vak studyban adjuváns 1 évig tartó nivolumab vs. placebo hatását értékelték pT3, pT4a vagy pN+ MIUC-os betegeknél. A NA CDDP-bázisú KT megengedett volt a vizsgálatba lépés előtt. A nivolumab hatására szignifikáns javulás mutatkozott a medián DFS 20,8 hónap vs. placebo hatására 10,8 hónap. Azoknál a betegeknél, akiknél a PD-L1 expressziós szintje >1%, a betegek százalékos aránya 74,5%, illetve 55,7% volt (HR: 0,55; p <0,001). A teljes túlélési adat még éretlen (4).
Adjuváns nivolumabkezelés javasolt PD-L1 pozitív UCC-s betegeknek yT3, yT4 vagy yN+ esetben NA ciszplatinbázisú KT után, vagy pT3, pT4 vagy pN+ esetekben, ha a beteg nem alkalmas ciszplatinbázisú KT-ra, vagy azt elutasítja (2–4).
Atezolizumab (Tecentriq)
A DFS-t, mint elsődleges végpontot, nem érték el az adjuváns atezolizumab IMvigor010 vizsgálatban, amelyben NA-KT utáni ypT2–4a vagy ypN+ vagy NA-kezelés nélküli pT3–4a vagy pN+ tumoros betegek vettek részt. A medián DFS 19,4 hónap volt atezolizumab mellett, míg 16,6 hónap megfigyelés mellett
(p = 0,24) (25). Utólagos keringő DNS (ctDNS)-analízis alapján az RC után kimutatható ctDNS esetén profitáltak a betegek az ICI-kezelésből.
Pembrolizumab (Keytruda)
A pembrolizumab adjuváns kezelésben végzett, fentiekhez hasonlóan megtervezett vizsgálata a Keynote123, AMBASSADOR-study volt. Első eredményeit a 2024-es GU ASCO-n ismertették. Húgyhólyag, felső traktus vagy húgycső NA-KT utáni ≥ pT3 és/vagy pN+, vagy primer műtét esetén ≥ pT2 és/vagy pN+ vagy margin+ MIUC-os betegeknél, vagy akik CDDP-alkalmatlanok, avagy azt elutasították, 1 éven át alkalmazott pembrolizumab hatására 702 1:1 arányban értékelt betegnél a medián DFS 29,0 hónap volt az obszerváció 14,0 hónap eredményével szemben (HR: 0,69 p = 0,0013). A medián OS 50,9 hónap volt pembrolizumab esetén vs. 55,8 hónap obszerváció esetén (HR: 0,98 p=0,88) (26). Az adjuváns pembrolizumab jelenleg nem törzskönyvezett indikáció adjuváns kezelésben.
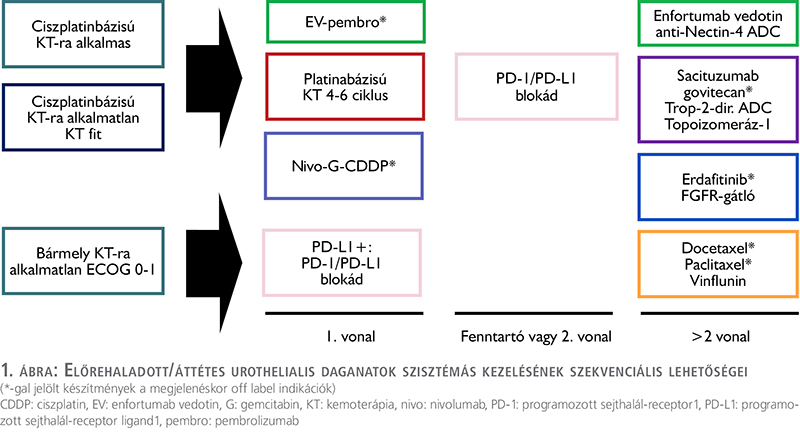
Lokálisan előrehaladott vagy áttétes betegek elsővonalbeli szisztémás kezelése (1. ábra)
Ciszplatinra alkalmas betegek elsővonalbeli kezelése
A lokálisan előrehaladott (cT4), kiterjedten nyirokcsomó-áttétes (cN1-2), technikailag irreszekábilis betegeknél radikális műtét csak szelektált esetekben, jelentős regresszió után jöhet szóba (2, 3, 15). A T4 N+ betegek kezelését lehetséges KT-val indítani 4-6 ciklusban, nagyon kedvező tumorválasz esetén radikális műtét (esetleg definitív sugárkezelés/kemoirradiáció) választható. Ha műtét nem történik, az alkalmazott neoadjuváns céllal végzett KT a lokálisan előrehaladott betegség elsővonalbeli kezelésének tekintendő.
A MIUC kemoterápiás kezelésének alapját 15-20 éve az áttétes betegek elsővonalbeli terápiája során vizsgált platinabázisú kombinációk jelentik.
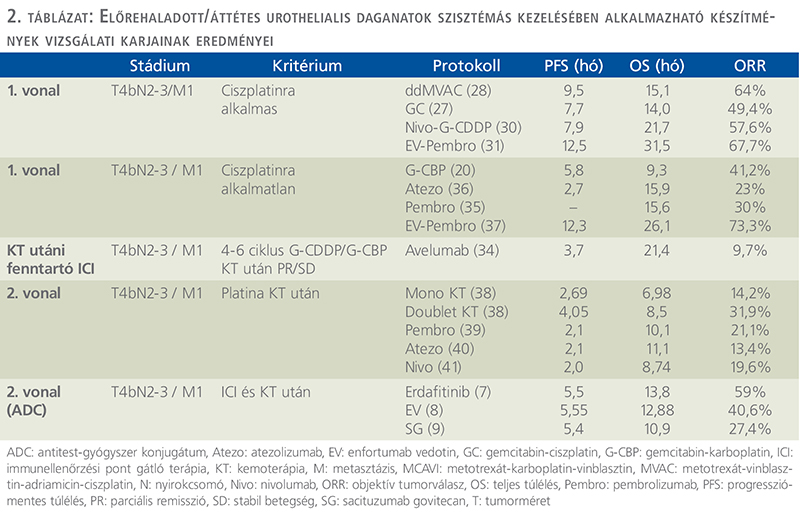
A CDDP a KT-s kezelések alapkészítménye, objektív válaszarány (ORR) monoterápia hatására 33%. Az MVAC mellett II. fázis vizsgálatban 70% ORR és 13 hónap OS jelentkezett. Az 1990-es években III. fázis vizsgálatokban kedvezőbb eredmény volt detektálható a kombináció hatására, mint CDDP-monoterápiával (ORR: 39% vs. 12%; p <0,0001; PFS: 10,0 vs. 4,3 hónap; OS: 12,5 vs. 8,2 hónap). Előnyösebb volt az MVAC a CDDP, ciklofoszfamid, doxorubicin (CISCA) (ORR: 65% vs. 46%; p <0,05; mOS 48,3 vs. 36,1 hét) protokollnál is, így ez vált az MIBC standard elsővonalas kezelésévé éveken át. Súlyos toxicitási profilja (grade 3 vagy 4 leukopénia, thrombocytopenia, lázas neutropenia, szepszis, mucositis, hányinger/hányás, renális és hepatikus toxicitás) miatt csak igen jó állapotú, válogatott betegeknél került alkalmazásra (27).
A GC-kombináció azonban gyorsan terjedt el és vált a leginkább preferált elsővonalas kezeléssé az MVAC-nál kedvezőbb toxicitása és csaknem azonos effektivitása miatt III. fázis vizsgálat alapján (ORR-t (GC vs. MVAC 49% vs. 46%), mPFS (7,7 vs. 8,3 hónap) és mOS-t (14,0 vs. 15,2 hónap) (27). Bár a vizsgálatban 4 hetes protokollt használtak, de a jobb toxicitási mutatók mellett elért hasonló dózisintenzitás és válaszráták (ORR 4 heti vs. 3 heti 55,6% vs. 59,7%) miatt napjainkban, a gyakorlatban a 3 hetes protokoll használatos.
Megkísérelték intenzifikálni a KT effektivitását. III. fázis vizsgálatban a ddMVAC vs. MVAC hatása között nem mutatkozott mOS előny (15,1 vs. 14,9 hónap, p = 0,049), de az ORR (64% vs. 50%) és az 5 éves OS is (22% vs. 14%) javult (28).
A CDDP-tartalmú kezelésekkel kedvezőbb terápiás eredmény érhető el, mint CBP-vel. A CDDP-alapú protokollokkal az ORR 45-50%, az elsővonalbeli medián OS 14-15 hónap, a 2 éves OS 30% körüli, míg CBP-bázisú kombinációk esetén ez elmarad a ciszplatinhoz képest, 30-40% ORR, medián OS 8-9 hónap, 2 éves OS 20% alatti arányú (2, 3, 27, 29). Az előnyösebb kimenetel miatt, ha a beteg alkalmas, ciszplatinbázisú KT-s kombináció javasolt elsővonalbeli választásként. CDDP-kemoterápiára a betegek 50%-a azonban nem alkalmas gyenge általános állapot, csökkent vesefunkciós érték, halláscsökkenés, perifériás neuropátia vagy kardiális okok miatt (3) (1. táblázat). Platinaszármazékot nem tartalmazó terápiás lehetőségek a mono gemcitabin, vinflunin, paclitaxel és docetaxel, utóbbiak leginkább másodvonalban indikáltak (2, 3) (2. táblázat).
Nivolumab-gemcitabin-ciszplatin
Az egyik legújabb, 2023-as ESMO-n publikált III. fázis vizsgálatban nem operálható vagy metasztatikus UC-s betegek 1.L kezelésében nivolumab és GC kombináció (maximum 6 ciklus), majd nivolumab fenntartó kezelés (legfeljebb 2 éven át), szemben a kontrollkar maximum 6 ciklus GC KT hatására 608 beteg kezelése során hosszabb OS mutatkozott nivolumab-kombináció mellett, mint GC esetén (HR: 0,78; p = 0,02); a medián OS: 21,7 hónap vs. 18,9 hónap, PFS (HR: 0,72; p = 0,001), 7,9 vs. 7,6 hónap. Az ORR: 57,6% (CR: 21,7%) volt nivolumab kombináció mellett, míg 43,1% (CR: 11,8%) csak GC esetén. Ez az első ICI és KT-kombináció, amely OS és PFS tekintetében is előnyt mutatott a klasszikus CDDP-bázisú KT-val szemben (30) (2. táblázat).
Enfortumab vedotin (Padcev) és pembrolizumab (Keytruda) kombinációja
Az egyik legújabb és legígéretesebb kombinációt értékelték az EV-302/Keynote-A39 vizsgálatban korábban nem kezelt, lokálisan előrehaladott vagy mUC elsővonalbeli kezelésében (PD-L1 expressziótól függetlenül), amelynek során EV-t és pembrolizumabot vizsgáltak G-CDDP vagy G-CBP-nal összehasonlítva. A kettős elsődleges végpont a PFS és az OS voltak. 886 beteget randomizáltak. A PFS szignifikánsan kedvezőbb volt EV + pembrolizumab mellett KT-val szemben, 55%-kal csökkentve a progresszió vagy a halál kockázatát (PFS: 12,5 hónap vs. 6,3 hónap; HR: 0,45 p<0,00001). Az OS is szignifikánsan meghosszabbodott, 53%-kal csökkentve a halálozás kockázatát (OS: 31,5 hónap vs. 16,1 hónap; HR: 0,47 p<0,00001). Az új kombináció szignifikánsan javította a korábban nem kezelt LA/mUC-s betegek kimenetelét, közel megkétszerezve a medián PFS-t és OS-t a KT-hoz képest. Fenti eredmények alapján az EV-pembrolizumab kombináció válhat az előrehaladott/mUC új standard kezelésévé a jövőben (31) (2. táblázat).
Ciszplatinra alkalmatlan, de karboplatin KT-ra alkalmas betegek elsővonalbeli kezelése
A IV. stádiumú UC-s betegek relatív 5 éves túlélése az ICI megjelenése előtt 15% volt. A betegek közel fele alkalmatlan CDDP-alapú kezelésre, túlélésük 8-9 hónap volt (2, 3). A CDDP alkalmatlanság az NA fejezetben került ismertetésre (2, 3) (1. táblázat). A ciszplatinra alkalmatlan, de KT-ra fit betegeknél a karboplatin a fő terápiás választás, tekintettel arra, hogy a CDDP-hoz képest kevésbé nefrotoxikus és emetogén, de 30 ml/perc alatti kreatinin clearance (CrCL) esetén nem alkalmazható. Platina nélküli protokollok korábbi opciók (pl. mono gemcitabin, mono paclitaxel), 38-60% ORR érhető el (3). A CDDP-ra alkalmatlan betegek első klinikai vizsgálatában metotrexat-CBP-vinblasztin és G-CBP összehasonlítása történt. A súlyos toxicitások aránya kedvezőbb volt a G-CBP karon, előnyösebb ORR mellett (42% vs. 30), amelyet III. fázis eredmények is megerősítettek (3). A leggyakrabban alkalmazott protokoll a rosszabb vesefunkciójú, de KT-s kezelésre alkalmas betegek esetén a G-CBP kombináció. A CDDP-ra alkalmatlan betegcsoportban a COACH-vizsgálat alapján lehetőség a gemcitabin és oxaliplatin (GEMOX) is nagyon alacsony vesefunkció esetén, amelynek hatására magasabb válaszadási arány alakult ki, mint G-CBP mellett (32).
Hazánkban 2016–2020 között összességében az előrehaladott betegek 50%-a kapott szisztémás terápiát; az elsővonalbeli kezelés 86%-ban platinaalapú KT volt, nem platinaalapú kezelés 8%-ban és ICI 6%-ban történt. A kezelésben részesülő betegek aránya a 2016-os 41%-ról 2020-ra 59%-ra nőtt (33) (2. táblázat).
Kemoterápia utáni fenntartó immunterápia
A CDDP- vagy CBP-alapú KT-s kezelések kedvező hatásának és hosszú távú megőrzésének célja a fenntartó immunterápia alkalmazása.
Avelumab (Bavencio)
Az avelumab fenntartó monoterápia hatékonyságát legjobb tüneti ellátással (BSC) szemben a JAVELIN Bladder 100 randomizált, III. fázis klinikai vizsgálatban elemezték lokálisan előrehaladott vagy áttétes urothelialis daganatos betegeknél bármely platinaalapú KT-s kombinációt követően, amennyiben a 4-6 ciklus KT mellett regresszió vagy stabil betegség alakult ki (34). Az infúzióval kapcsolatos reakciók csökkentésére antihisztamint és acetaminofent alkalmaztak premedikációként az első 4 avelumab infúzió előtt.
A teljes túlélés volt az elsődleges végpont, amely 21,4 hónapra javult avelumab hatására, míg BSC esetén 14,3 hónap (HR: 0,69, 95% CI: 0,56–0,86; p <0,001) volt. Azok a betegek, akik abbahagyták a BSC-t és ezt követően kezelésben részesültek, 53%-a kapott immunterápiát (34). A KT kezdetétől az avelumabbal kezelt betegek teljes túlélése medián 29,7 hónap volt, ami az eddigi legkedvezőbb eredmény ebben a betegcsoportban, így minden irányelv a legmagasabb kategóriával javasolja alkalmazását. Hazánkban is finanszírozottá vált.
Avelumabbal végzett fenntartó ICI-kezelés standard ellátás minden olyan beteg számára, akiknél a betegség stabilizálódott az elsővonalbeli 4-6 ciklus platinaalapú kemoterápia mellett (2, 3, 34) (2. táblázat).
Bármely platina KT-ra alkalmatlan betegek elsővonalbeli ICI kezelése
Két, egykarú, II. fázisú vizsgálat eredményei alapján a pembrolizumab és az atezolizumab EMA-törzskönyvvel rendelkezik ciszplatinra alkalmatlan betegek elsővonalbeli kezelésére pozitív PD-L1 státusz esetén. A pembrolizumab kritériuma CPS ≥10, míg az atezolizumabé IC score≥5% (tumorinfiltráló immunsejtek) (2. táblázat).
Pembrolizumab (Keytruda)
A pembrolizumab hatékonyságát a Keynote-052-vizsgálatban, 370 előrehaladott vagy metasztatikus, ciszplatinra alkalmatlan UC-s betegen tesztelték, amelynek során 29%-os ORR-t és 7% CR-t eredményezett (35).
Atezolizumab (Tecentriq)
Az atezolizumabot az IMvigor-130 II. fázisú vizsgálatban ugyanabban a betegpopulációban értékelték (n = 119), amely 23%-os ORR-t mutatott, és a betegek 9%-a érte el a CR-t (36).
Az IMvigor 130 és a Keynote 361 vizsgálatok alapján nem találtak előnyt a PFS vagy az OS szempontjából az ICO-monoterápia alkalmazásával a platinaalapú KT-hoz képest, ezért a CBP/gemcitabin kombináció az előnyben részesített első vonalbeli kezelési mód a CDDP-ra nem alkalmas, de CBP-ra alkalmas betegek esetében.
Enfortumab-vedotin (EV – Padcev) és pembrolizumab (Keytruda) kombinációja
Az enfortumab-vedotin és a pembrolizumab kombinációja (átlagosan 9 ciklusban) elsővonalbeli kezelésként 45, CDDP-ra nem alkalmas, LA/mUC-ban szenvedő betegnél igazolt 73,3% ORR-t, a teljes válaszarány 15,6% volt. A válasz medián időtartama 25,6 hónap és 26,1 hónap volt (37). Az EV-pembrolizumab új és nagyon ígéretes kombináció előrehaladott/mUC-ban.
Lokálisan előrehaladott vagy áttétes betegek másodvonalbeli szisztémás kezelése (1. ábra)
Kemoterápia
A másodvonalbeli KT-s eredmények meglehetősen szerények. Az NA/adjuváns KT vagy elsővonalbeli platinabázisú kezelés esetén, ha progresszió 12 hónapon túl jelentkezik, az előzőleg alkalmazott KT-s kombináció reindukciója alkalmazható. 12 hónapon belüli rosszabbodás esetén leggyakrabban a paklitaxel, docetaxel, nab-paklitaxel, topotekán, vinflunin alkalmazhatóak, amelyek ORR arányai II. fázis vizsgálatok alapján 0-28%, metaanalízis szerint monoterápiában 14,2%, doubletben 31,9% (38). A vinflunin törzskönyvezése platinabázisú kemoterápia utáni progressziókor III. fázis vizsgálat alapján történt, 8,6% ORR volt észlelhető, valamint kedvezőbb klinikai haszon ráta (CBR) és OS a kontrollkarhoz képest (3). Kemoterápiás kezelés másod- vagy többedvonalban akkor jön szóba, ha immunterápia ellenjavallt (pl. aktív autoimmun-betegség), vagy ha a betegség immunterápia mellett progrediált (2. táblázat).
Másodvonalbeli immunterápia platinaalapú KT-s kezelés utáni progressziókor
A pembrolizumab, nivolumab, atezolizumab ICI-k hasonló hatékonyságot és biztonságosságot mutattak korábbi platinaalapú kemoterápia alatt vagy utáni progresszió esetén (2. táblázat).
Pembrolizumab (Keytruda)
A pembrolizumab jelentős OS javulást mutatott másodvonalbeli kezelésként III. fázisú randomizált vizsgálat során, platinabázisú KT-s kezelést követően, amely alapján EMA törzskönyvezése történt ebben az indikációban. A betegeket (n = 542) pembrolizumab monoterápiára vagy KT (paclitaxel, docetaxel vagy vinflunin) kontroll karra randomizálták. A medián OS pembrolizumab esetén 10,3 hónap volt, szemben a KT-val végzett 7,4 hónappal (HR: 0,73, p = 0,002) a PD-L1 expressziós szintektől függetlenül (39).
Atezolizumab (Tecentriq)
Az atezolizumab volt az első ICI, amelyet az Amerikai Gyógyszerügyi Hatóság (U.S. Food and Drug Administration – FDA) a II. fázisú vizsgálatok eredményei alapján jóváhagyott a metasztatikus UC esetében. A III. fázis IMvigor211-vizsgálatban 931 beteget kezeltek atezolizumab versus másodvonalbeli KT-val (paklitaxel, docetaxel vagy vinflunine). A vizsgálat nem érte el elsődleges végpontját, a magas PD-L1-expressziós betegeknél észlelt OS-t, amely 11,1 hónap volt atezolizumab és 10,6 hónap KT mellett (HR: 0,87, p = 0,41) (40).
Nivolumab (Opdivo)
A nivolumabot az FDA és EMA is törzskönyvezte egy egykarú, II. fázis CheckMate 275 vizsgálat eredményei alapján, amelybe 270 platina-előkezelt beteget vontak be. Az ORR elsődleges végpontja 19,6%, az OS pedig 8,74 hónap volt a teljes csoportban (41).
A randomizált klinikai vizsgálatok alapján a pembrolizumab rendelkezik legmagasabb evidenciával a platinabázisú KT utáni progresszió esetén másodvonalbeli kezelésként, így nemzetközi ajánlásokban az immunterápiák közötti preferált standard lett.
Platinabázisú KT utáni progresszió esetén leginkább pembrolizumab, vagy a törzskönyvi indikációk alapján atezolizumab, esetleg nivolumab is választható.
Lokálisan előrehaladott vagy áttétes betegek többedvonalbeli szisztémás kezelése (1. ábra)
Modern antitest-gyógyszer konjugátumok (ADC)
Az ADC-k modern szerkezetű molekulák, a nagy hatású biológiai gyógyszerek új osztálya, amelyet úgy alakítottak ki, hogy egy kis molekula daganatellenes gyógyszert (pl. kemoterapeutikumot vagy más terápiás szert) erősítettek egy ellenanyaghoz. Az antitest egy specifikus antigént céloz meg, amely csak a daganatos célsejteken található. Az UC-daganatok kezelésében 2 új ADC eredményei igen bíztatóak, amelyeknél az antigénhez kapcsolt készítmények mikrotubulus-, illetve topoizomeráz-gátló kemoterápiás szerek (2. táblázat).
Enfortumab vedotin (Padcev)
Az EV parenterálisan alkalmazható monoklonális antitest, ADC, amely a Nektin-4 receptoron keresztül fejti ki antitubuláris hatását a kapcsolt monometil-aurisztatin által. A Nektin-4 sejt-adhéziós molekula UC-ban erős expressziót mutat. Az EV károsítja a mikrotubuláris hálózatot, leállítja a sejtciklust és apoptózist eredményez.
Az EV-301 multicentrikus, III. fázis nyílt vizsgálatban, lokálisan előrehaladott vagy metasztatikus, korábban platinaalapú KT-ban és ICI-ban is részesült UC-s betegeket kezeltek EV monoterápiával vagy a vizsgáló által választott kemoterápiával (docetaxel, paklitaxel, vinflunin) (8). Az elsődleges végpont medián OS 608 betegnél 12,88 szignifikánsan kedvezőbb volt EV mellett vs. a kontrollkaron 8,97 hónap. A PFS is kedvezőbbnek bizonyult az EV-karon, 5,55 hónap vs. 3,71 hónap. CR a vizsgálati készítménynél 4,9%-ban alakult ki, a KT-karon 2,7%-ban. A készítmény 2021 óta FDA, 2023 óta EMA törzskönyvvel rendelkezik korábban platinabázisú kemoterápiában és PD-1 vagy PD-L1-gátló immunterápiában is részesült betegek részére (8).
Sacituzumab govitecan (Trodelvy)
Az SG is ADC, az irinotecan SN-38 nevű aktív metabolitját tartalmazza az UC-ban magasan expresszálódó, antitrofoblaszt sejtfelszíni 2 antigént (Trop-2) célzó humanizált monoklonális antitesthez kapcsolva.
A TROPHY-U-01 II. fázis nyílt vizsgálat I. karjába előrehaladott UC-ban szenvedő betegek kerültek bevonásra, akik korábban platinaalapú KT-ban és ICI-terápiában is részesültek (9). Az 1. kohorsz került elemzésre. Elsődleges végpont az ORR volt. Az 1. kohorszban 112/113 beteg korábban immunterápiában is részesült. A betegek átlagosan 6 ciklus SG-ban részesültek, a kezelés medián hossza 3,7 hónap volt. Az ORR 27,4% (31/113) volt, 6 betegnél alakult ki komplett remisszió (5,3%), 25 betegnél parciális remisszió (22,1%). A medián PFS 5,4 hónap volt, az OS 10,9 hónap. Az SG hatékonynak és biztonságosnak bizonyult, ezért gyorsított FDA-jóváhagyást kapott. 2021.04.13-án befogadta az FDA az alkalmazását LA vagy mUC-s betegek részére, akik korábban platinabázisú KT-ban és PD-1 vagy PD-L1-gátló kezelésben részesültek. Az SG hatékonyságának megerősítése III. fázis (NCT04527991) vizsgálatban zajlik taxán és vinflunin kontrollkarok mellett.
Target terápia – FGFR-gátlás
Az UC molekuláris felosztása alapján a luminális papilláris altípusra jellemző, hogy KT-ra kevésbé reagál, míg magas fibroblasztnövekedési-faktor receptor 3 (FGFR) aktivitást mutat. Az erdafitinib multikináz FGRF 1-4 gátló készítmény, amely bizonyos FGFR-alterációk esetén, daganatellenes aktivitást mutatott preklinikai modellekben és korai vizsgálatokban.
A BLC2001 (NCT02365597) II. fázis vizsgálatban LA vagy mUC-s, ECOG 0-2, FGFR alterációt mutató betegeket kezeltek, akik betegsége legalább egy ciklus KT alatt, vagy után progrediált, vagy NA/adjuváns KT-tól nem telt el 12 hónap vagy akiket CDDP-kezelésre alkalmatlannak minősítettek (7). A betegeket két különböző kezelési sémával kezelték, intermittálva 10 mg (7 nap kezelés, 7 nap szünet) per os, vagy folyamatos napi 7 mg dózisú karok. Az elsődleges végpont az ORR, 99 beteg adatai alapján 40% volt. Annál a 22 betegnél, akik korábban ICI-ben részesültek, az ORR 59% volt. PFS: 5,5 hónap, OS: 13,8 hónapnak bizonyult (7).
FGFR-alteráció esetén a betegek kevésbé reagálhatnak az ICI-re. Fenti vizsgálatban 22 betegből 1-nél (5%) alakult ki válasz a korábbi ICI-re, míg az immunterápia sikertelensége után 59% reagált az erdafitinibre. Az FDA 2019. április 12-én gyorsított eljárásban engedélyezte az erdafitinib alkalmazását lokálisan előrehaladott vagy áttétes urothelialis daganatok kezelésére, FGFR2 vagy FGFR3 genetikai alteráció esetén, platinabázisú KT-s kezelés során vagy követő progresszióban.
A készítmény EMA befogadása is folyamatban van (2. táblázat).
Következtetések
Az izominvazív urothelialis daganatok szisztémás gyógyszeres kezelést igényelnek, mivel távoli disszeminációra képes kórképek. Legoptimálisabb időzítés az NA-terápia, amely ciszplatinbázisú KT formájában javasolt jelenleg, arra alkalmas betegek részére. Az NA-kezelések hatékonysága a jövőben potenciálisan javítható a daganatok genetikai profiljának megismerésével, új kombinációk bevezetésével.
Az adjuváns ciszplatinbázisú KT alkalmazása NA-KT elmaradása esetén javasolható, de magas kiújulási rizikót jelentő szövettani faktorok esetén PD-L1 pozitív esetben posztoperatív nivolumab ICI is terápiás lehetőség, ha ciszplatin-alkalmatlanság definiálható.
Lokálisan előrehaladott vagy távoli áttétes betegek elsővonalas kezelése lehetőség szerint ciszplatinalapú KT, arra nem alkalmas esetben karboplatin. 4-6 ciklus bármely platinabázisú KT-ra reagáló betegeknél fenntartó avelumab immunterápia választása javasolt. Kemoterápiára nem alkalmas, PD-L1 expresszáló betegek induló kezelésként mono ICI-terápiában részesülhetnek. Az újabb vizsgálati eredményekben nivolumab-KT és enfortumab vedotin-pembrolizumab kombinációk tovább színesítik az elsővonalbeli kezelések palettáját.
Platinabázisú KT utáni másodvonalban ICI választandó, legmagasabb evidenciával pembrolizumab formájában, vagy atezolizumab, esetleg nivolumab.
A KT és ICI utáni harmadvonalban előremutató eredmények születtek enfortumab vedotin és sacituzumab govitecan, valamint FGFR-alterációt mutató esetekben FGFR-gátló erdafitinib hatásáról (1. ábra, 3. táblázat).

Újabb közleményekben körvonalazódik az urothelialis daganatok molekuláris profil szerinti felosztása, amely alapján várható lesz, hogy a terápiás effektivitás is előre megjósolhatóvá válhat (42). Emellett az ICI és a KT, valamint a célzott és új típusú gyógyszerek kombinálása is további új, még hatékonyabb terápiákkal gazdagíthatja majd az UC kezelési lehetőségeit a jövőben (43).
Irodalom
1. Horwich A, Babjuk M, J Bellmunt J, et al. EAU–ESMO consensus statements on the management of advanced and variant bladder cancer—an international collaborative multi-stakeholder effort: under the auspices of the EAU and ESMO Guidelines Committees. Ann Oncol 2019; 0: 1–31. https://doi.org/10.1093/annonc/mdz296
2. Powles T, Bellmunt J, Comperat E et al. Bladder cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2022; 33: 244–258. https://doi.org/10.1016/j.annonc.2021.11.012
3. Witjes JA, Bruins HM, Cathomas R, et al. European Association of Urology Guidelines on Muscle-invasive and Metastatic Bladder Cancer: Summary of the 2020 Guidelines Eur Urol Oncol 2021; 79: 82–104.
https://doi.org/10.1016/j.eururo.2020.03.055
4. Bajorin DF, et al. Adjuvant Nivolumab versus Placebo in Muscle-Invasive Urothelial Carcinoma. N Engl J Med 2021; 384: 2102.
https://doi.org/10.1056/NEJMoa2034442
5. Revesz J, Posfai B, Pajor L, et al. Correlation between fibroblast growth factor receptor mutation, programmed death ligand-1 expression and survival in urinary bladder cancer based on real-world data Patol. Oncol Res 2023; 21: 1611077. https://doi.org/10.3389/pore.2023.1611077
6. Kessel KE, Zuiverloon TC, Alberts AR, et al. Targeted therapies in bladder cancer: an overview of in vivo research. Nat Rev Urol 2015; 12: 681–94. https://doi.org/10.1038/nrurol.2015.231
7. Loriot Y, Necchi A, Park SH, et al. Erdafitinib in Locally Advanced or Metastatic Urothelial Carcinoma. N Engl J Med 2019; 381: 338–48.
https://doi.org/10.1056/NEJMoa1817323
8. Powles TP, Rosenberg JE, Guru PS, et al. Enfortumab Vedotin in Previously Treated Advanced Urothelial Carcinoma. N Engl J Med 2021; 384: 1125–1135. https://doi.org/10.1056/NEJMoa2035807
9. Tagawa ST, Balar VA, Petrylak PD, et al. TROPHY-U-01: A Phase II Open-Label Study of Sacituzumab Govitecan in Patients With Metastatic Urothelial Carcinoma Progressing After Platinum-Based Chemotherapy and Checkpoint Inhibitors. J Clin Oncol 2021; 39: 2474–2485.
https://doi.org/10.1200/JCO.20.03489
10. Grossman HB, Natale RB, Tangen CM, et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N Engl J Med 2003; 349: 859–66.
https://doi.org/10.1056/NEJMoa022148
11. David KA, et al. Low incidence of perioperative chemotherapy for stage III bladder cancer 1998 to 2003: a report from the National Cancer Data Base. J Urol 2007; 178: 451–4. https://doi.org/10.1016/j.juro.2007.03.101
12. Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) meta-analysis collaboration. Eur Urol 2005; 48: 202–5. https://doi.org/10.1016/j.eururo.2005.04.006
13. International Collaboration of Trialists, on behalf of the Medical Research Council Advanced Bladder Cancer Working Party the European Organisation for Research and Treatment of Cancer Genito-Urinary Tract Cancer Group, the Australian Bladder Cancer Study Group, the National Cancer Institute of Canada Clinical Trials Group, et al. International Phase III Trial Assessing Neoadjuvant Cisplatin, Methotrexate, and Vinblastine Chemotherapy for Muscle-Invasive Bladder Cancer: Long-Term Results of the BA06 30894 Trial. J Clin Oncol 2011; 29: 2171–77. https://doi.org/10.1200/JCO.2010.32.3139
14. Yin M, Joshi M, Meijer RP, et al. Neoadjuvant Chemotherapy for Muscle-Invasive Bladder Cancer: A Systematic Review and Two-Step Meta-Analysis Oncologist 2016; 21: 708–15.
https://doi.org/10.1634/theoncologist.2015-0440
15. Sherif A, Holmberg L, Rintala E, et al. Neoadjuvant cisplatinum based combination chemotherapy in patients with invasive bladder cancer: a combined analysis of two Nordic studies. Eur Urol 2004; 45: 297–303.
https://doi.org/10.1016/j.eururo.2003.09.019
16. Pfister C, Gravis G, Fléchon A, et al. Randomized Phase III Trial of Dose-dense Methotrexate, Vinblastine, Doxorubicin, and Cisplatin, or Gemcitabine and Cisplatin as Perioperative Chemotherapy for Patients with Muscle-invasive Bladder Cancer. Analysis of the GETUG/AFU V05 VESPER Trial Secondary Endpoints: Chemotherapy Toxicity and Pathological Responses. Eur Urol 2021; 79: 214–221. https://doi.org/10.1016/j.eururo.2020.08.024
17. Lee CT, Madii R, Daignault S, et al. Cystectomy delay more than 3 months from initial bladder cancer diagnosis results in decreased disease specific and overall survival. J Urol 2006; 175: 1262–7.
https://doi.org/10.1016/S0022-5347(05)00644-0
18. Rosenblatt, R., et al. Pathologic downstaging is a surrogate marker for efficacy and increased survival following neoadjuvant chemotherapy and radical cystectomy for muscle-invasive urothelial bladder cancer. Eur Urol 2012; 61: 1229–38. https://doi.org/10.1016/j.eururo.2011.12.010
19. Miron B, et al. Defects in DNA Repair Genes Confer Improved Long-term Survival after Cisplatin-based Neoadjuvant Chemotherapy for Muscle-invasive Bladder Cancer. Eur Urol Oncol 2020; 3: 544.
https://doi.org/10.1016/j.euo.2020.02.003
20. Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Adjuvant chemotherapy in invasive bladder cancer: a systematic review and meta-analysis of individual patient data Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Eur Urol 2005; 48: 189–99.
https://doi.org/10.1016/j.eururo.2005.04.005
21. Leow JJ, et al. Adjuvant chemotherapy for invasive bladder cancer: a 2013 updated systematic review and meta-analysis of randomized trials. Eur Urol 2014; 66: 42–54. https://doi.org/10.1016/j.eururo.2013.08.033
22. Paz-Ares LG, Solsona E, Esteban E, et al. Randomized phase III trial comparing adjuvant paclitaxel/gemcitabine/cisplatin (PGC) to observation in patients with resected invasive bladder cancer: Results of the Spanish Oncology Genitourinary Group (SOGUG) 99/01 study. J Clin Oncol 2010; 28: LBA4518. https://doi.org/10.1200/jco.2010.28.18_suppl.lba4518
23. Adjuvant Chemotherapy for Muscle-invasive Bladder Cancer: A Systematic Review and Meta-analysis of Individual Participant Data from Randomised Controlled Trials. Eur Urol 2022; 81: 50.
https://doi.org/10.1016/j.eururo.2021.09.028
24. Sternberg CN, et al. Immediate versus deferred chemotherapy after radical cystectomy in patients with pT3-pT4 or N+ M0 urothelial carcinoma of the bladder (EORTC 30994): an intergroup, open-label, randomised phase 3 trial. Lancet Oncol 2015; 16: 76–86.
https://doi.org/10.1016/S1470-2045(14)71160-X
25. Bellmunt J, et al. Adjuvant atezolizumab versus observation in muscle-invasive urothelial carcinoma (IMvigor010): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2021; 22: 525.
https://doi.org/10.1016/S1470-2045(21)00004-8
26. Apolo AB, Ballmann. KV, Sonpavde G, et al. AMBASSADOR Alliance A031501: Phase III randomized adjuvant study of pembrolizumab in muscle-invasive and locally advanced urothelial carcinoma (MIUC) vs observation. J Clin Oncol 2024; 42(Suppl 4): abstr LBA531.
https://doi.org/10.1200/JCO.2024.42.4_suppl.LBA531
27. von der Maase H, Sengelov L, Roberts JT, et al. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol 2005; 23: 4602–8.
https://doi.org/10.1200/JCO.2005.07.757
28. Sternberg CN, de Mulder P, Schornagel JH, et al. EORTC Genito-Urinary Cancer Group. Seven year update of an EORTC phase III trial of high-dose intensity M-VAC chemotherapy and G-CSF versus classic M-VAC in advanced urothelial tract tumours. Eur J Cancer 2006; 42: 50-4. https://doi.org/10.1016/j.ejca.2005.08.032
29. von der Maase H, Hansen SW, Roberts JT, et al. Gemcitabine and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advanced or metastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol 2000; 18: 3068–77. https://doi.org/10.1200/JCO.2000.18.17.3068
30. van der Heijden MS, Sonpavde G, Powles T, et al. Nivolumab plus Gemcitabine–Cisplatin in Advanced Urothelial Carcinoma. N Engl J Med 2023; 389: 1778–1789 https://doi.org/10.1056/NEJMoa2309863
31. Powles TB, Valderrama BP, Gupta S, et al. LBA6 EV-302/KEYNOTE-A39: Open-label, randomized phase III study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (Chemo) in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC) J. Ann Oncol 2023; 34: S1340.
https://doi.org/10.1016/j.annonc.2023.10.106
32. Park I, Kim BS, Lim HY, et al. Gemcitabine plus carboplatin versus gemcitabine plus oxaliplatin in cisplatin-unfit patients with advanced urothelial carcinoma: a randomised phase II study (COACH, KCSG GU10-16). Eur J Cancer 2020; 127: 183–190. https://doi.org/10.1016/j.ejca.2019.08.034
33. Maráz A, Nagy B, Macher T, et al. Nationwide Study of Real World Treatment Patterns and Clinical Outcomes in Patients with Metastatic Urothelial Carcinoma in Hungary. Adv Ther 2023; 40: 5475–5488.
https://doi.org/10.1007/s12325-023-02694-9.
34. Powles T, Park SH, Voog E, et al. Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma. N Engl J Med 2020; 383: 1218–1230. https://doi.org/10.1056/NEJMoa2002788
35. O’Donnel PH, Balar AV, Vuky J, et al. KEYNOTE-052: Phase 2 study evaluating first-line pembrolizumab (pembro) in cisplatin-ineligible advanced urothelial cancer (UC)-Updated response and survival results. J Clin Oncol 2019; 37: 4546–4546.
https://doi.org/10.1200/JCO.2019.37.15_suppl.4546
36. Balar AV, Galsky MD, Rosenberg JE, et al. Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet, 2017; 389: 67.
https://doi.org/10.1016/S0140-6736(16)32455-2
37. Hoimes CJ, Flaig TW, Miliwsky MI, et al. Enfortumab Vedotin Plus Pembrolizumab in Previously Untreated Advanced Urothelial Cancer. J Clin Oncol 2022: Jco2201643. https://doi.org/10.1200/JCO.22.01643
38. Raggi D, Miceli R, Sonpavde G, et al. Second-line single-agent versus doublet chemotherapy as salvage therapy for metastatic urothelial cancer: a systematic review and meta-analysis. Ann Oncol 2016; 27: 49–61. https://doi.org/10.1093/annonc/mdv509
39. Bellmunt J, de Wit R, Vaughn DJ, et al. Pembrolizumab as second-line therapy for advanced urothelial carcinoma. N Engl J Med 2017; 376: 1015–26. https://doi.org/10.1056/NEJMoa1613683
40. Powles T, Durán I, van der Heijden MS, et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor 211): a multicentre, open-label, phase 3 randomised controlled trial. Lancet 2018; 391: 748–757.
https://doi.org/10.1016/S0140-6736(17)33297-X
41. Sharma P, Rezt M, Siefker-Radtke A, et al. Nivolumab in metastatic urothelial carcinoma after platinum therapy (CheckMate 275): a multicentre, single-arm, phase 2 trial. Lancet Oncol 2017; 18: 312–22.
https://doi.org/10.1016/S1470-2045(17)30065-7
42. Kamoun A, de Reyniès A, Yves Allory Y, et al. A Consensus Molecular Classification of Muscle-invasive Bladder Cancer. Eur Urol 2020; 77: 420–433. https://doi.org/10.1016/j.eururo.2019.11.011
43. Maráz A, Varga L, Küronya Zs. Opportunities that improve the effectivity of immunotherapy, bringing targeted therapies into focus. Magy Onkol 2019; 63: 209–216.