Complicated case of radical cystectomy – temporary abdominal wall closure with negative pressure therapy
DOI: 10.2259/magyurol.2024.3.weigertt.147
Authors:
Weigert Tamás dr.1, Zsirka-Klein Attila dr.2, Vargha Judit dr.1, Majoros Attila dr.1, Keszthelyi Attila dr.1
1Semmelweis Egyetem, Urológiai Klinika, Budapest (igazgató: Nyirády Péter dr.)
2Semmelweis Egyetem, Sebészeti, Transzplantációs és Gasztroenterológiai Klinika, Budapest (igazgató: Szijártó Attila dr.)
Summary
Introduction: Introduction: Radical cystectomy is an operation with a high rate of postoperative complications. If abdominal compartment syndrome develops, open abdominal management may be required. Modern wound management techniques can significantly accelerate wound healing.
Case report: A 69-year-old man underwent radical cysto-prostatectomy, uretero-ileo-cutaneostomy and reoperations. Because of the risk of abdominal compartment syndrome, we used open abdominal treatment with negative pressure wound therapy. The abdominal wall was closed step by step.
Conclusion: Intestinal oedema due to multiple reoperations after abdominal operations may lead to abdominal compartment syndrome, and open abdominal management may be required. Negative pressure wound therapy can be used to achieve complete abdominal wall closure and prevent further complications.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Bevezetés: A radikális cystectomia magas posztoperatív szövődményaránnyal járó beavatkozás. Amennyiben abdominális kompartmentszindróma alakul ki, nyitott hasi kezelés válhat szükségessé. A korszerű sebkezelési módszerekkel a sebgyógyulás jelentősen felgyorsítható.
Esetismertetés: A 69 éves férfinél radikális cysto-prostatectomiát, uretero-ileo-cutaneostomiát követően többszöri reoperációra kényszerültünk. Abdominális kompartmentszindróma veszélye miatt nyitott hasi kezelést alkalmaztunk negatívnyomás-terápiával. A hasfalat lépésről lépésre zártuk.
Következtetések: A hasi műtétek után többszörös reoperáció miatt létrejött intesztinális ödéma abdominális kompartmentszindrómához vezethet, nyitott hasi kezelés válhat szükségessé. A negatívnyomás-terápia segítségével teljes hasfali zárás érhető el, megelőzve ezzel további szövődmények kialakulását.
Bevezetés
A radikális cystectomia napjainkban is magas posztoperatív szövődményaránnyal járó beavatkozás (1). Egy 506 pácienst bevonó retrospektív vizsgálat alapján urogenitális, gasztrointesztinális, illetve infekciós szövődmények fordulnak elő leg-
gyakrabban a perioperatív időszakban. Laparotómiát igénylő bélanasztomózis-elégtelenség 0,40%-ban, eviszceráció (faszcia dehiszcencia) 2,8%-ban, ileusz 7,7%-ban, vizeletdrenálást igénylő ázás/urinóma 0,40%-ban, transzfúziót igénylő vérzés 26%-ban, intenzív osztályos kezelést igénylő, többszervi elégtelenséggel járó szepszis 0,40%-ban jelentkezett (2). Bár a radikális cystectomiával foglalkozó tanulmányok külön nem említik, fontos felsorolni az abdominális kompartmentszindrómát (ACS), amely definíció szerint a hasűri nyomás 20 Hgmm felé emelkedését jelenti, szervi diszfunkció megjelenésével (3).
Fiziológiás körülmények között az intraabdominális nyomás (IAP) 0 Hgmm körüli értéken van. Amennyiben ez folyamatosan, vagy ismétlődően 12 Hgmm felé emelkedik, intraabdominális hipertóniáról (IAH) beszélünk, amelynek négy fokozatát különíthetjük el (I. fokozat: IAP 12–15 Hgmm, II. fokozat: IAP 16–20 Hgmm, III. fokozat: IAP 21–25 Hgmm, IV. fokozat: IAP >25 Hgmm).
Az ACS, illetve IAH kialakulására számos sebészi-, illetve nem sebészi rizikófaktor ismert: hasi sebészeti beavatkozás (szoros fasciazárással), laparoszkópos műtét (intraabdominális inszufflációval), ileusz, peritonitis, politranszfúzió, akut pancreatitis, nem kompenzált májcirrózis ascitessel, intrathoracalis nyomásemelkedéssel járó akut légzési elégtelenség (4). Megkülönböztetünk primer, szekunder, illetve rekurrens abdominális kompartmentszindrómát, (illetve intrabdominális hipertóniát). Primer esetben az abdomino-pelvikus régió sérülése/egyéb kórállapota okoz ACS-t/IAH-t, amely gyakran korai sebészi, vagy intervenciós radiológiai beavatkozást tesz szükségessé. Szekunder esetben az állapotot kiváltó ok nem az abdomino-pelvicus régióból származik. Rekurrens ACS/IAH esetében az állapot korábbi gyógyszeres/sebészeti ellátás ellenére visszatér.
Az intraabdominális nyomásfokozódásával számos szerv funkciója válhat elégtelenné: csökken a cerebrális perfúzió, csökken a vénás visszaáramlás, nő a centrális vénás nyomás, csökken a tüdő compliance, intesztinális iszkémia, agresszív folyadékbevitel ellenére oligo-anuria alakulhat ki (5). Egy 2009-ben megjelent tanulmány alapján az akut sebészeti ellátást követően intenzív osztályos kezelésben részesülő páciensek 40%-ánál jelentkezik II. vagy annál nagyobb fokú IAH (6). Az IAH/ACS kezelése függ a kiváltó etiológiai tényezőtől, az intraabdominális nyomás mértékétől, dinamikájától, illetve a szervdiszfunkció karakterisztikájától. A teljesség igénye nélkül néhány kezelési mód: prokinetikumok, nazogasztrikus, rectalis szondabehelyezés, endoszkópos dekompresszió, analgézia, szedáció, illetve dekompresszív laparotómia (3). Amennyiben nyitott hasi kezelés válik szükségessé, számos ideiglenes sebzárási módszer áll rendelkezésre. Egyik legújabb lehetőség a negatívnyomás-terápia (NPWT), amelyet magas fertőzési rizikóval járó műtéteknél akár preventív módon – úgynevezett incízionális NPWT-t – alkalmazhatunk (7, 8).
Esetismertetés
A 69 éves férfi beteg primer húgyhólyagtumor reszekciója pT2 urothelialis karcinómát igazolt. Ezért radikális húgyhólyag- és prosztataeltávolítást, uretero-ileo-cutaneostomiát végeztünk. A posztoperatív szövettani vizsgálat pT3a, N0, R0, laphám irányú differenciációt mutató, urothelialis karcinómát írt le. A hetedik posztoperatív napon a sebvonalból vékonybéltartalom ürülését észleltük. CT-vizsgálat egyértelmű bélfali folytonossághiányt nem látott, a Bricker-hólyagot feltöltve varratelégtelenség nem volt igazolható. CT-vizsgálati lelet ellenére, tekintettel a hasfalon keresztül ürülő béltartalomra, exploráció mellett döntöttünk. A hasfalat felnyitva peritonitist nem észleltünk. A sebvonal alatt perforált jejunumkacsot találtunk, reszekciót és vég a véghez anasztomózist készítettünk. A hasfali punktátum kreatinintartalma alapján a bél-uréter kapcsolat elégtelensége nem merült fel. Bőséges lavázs után a hasfalat – drént visszahagyva – zártuk.
A reoperációt követő hetedik napon ismételt műtétre kényszerültünk, a húgycsőnyíláson keresztül ürülő vastagbéltartalom miatt. Exploráció során a szigmabél symphysis alatti szakaszán – vélhetően egy divertikulumnak megfelelően – perforációt észleltünk. Tekintettel arra, hogy ebben a környezetben bélvarratot nem tudtunk készíteni, a colon descendensen kétlövetű stomát képeztünk. A hasfalat nagy átöltő öltések segítségével próbáltuk zárni, amely feszülésmentesen nem volt kivitelezhető, így átmenetileg vizeletgyűjtő zsák falával zártuk a sebet, majd negatívnyomás-terápiás szettet helyeztünk fel (1. ábra).
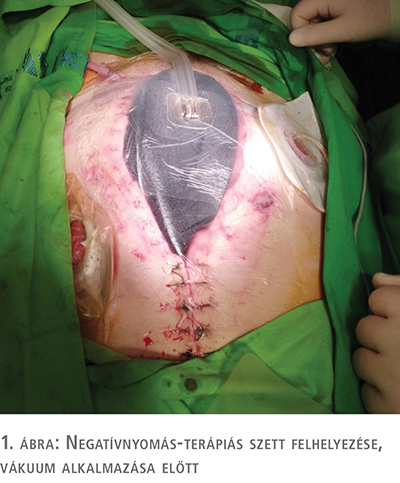
Jelentős mennyiségű, érdemben csökkenést nem mutató sebváladék miatt az uréter-bél anasztomózis elégtelensége merült fel, amelyet a váladék kreatinintartalma, illetve CT-vizsgálat is igazolt. Kétoldali perkután nephrostomiát végeztünk. A háromnaponta történő kötéscserék, folyamatosan alkalmazott negatívnyomású-sebkezelés során a sebváladék csökkenését tapasztaltuk, a hasfal lépésről lépésre zárhatóvá vált (2., 3. ábra). A második reoperációt követő 24. napon a pácienst zárt hasi sebbel otthonába bocsájtottuk (4. ábra).
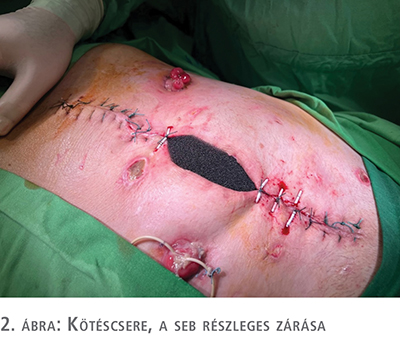
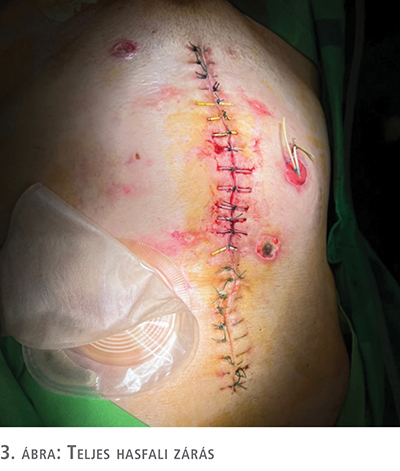
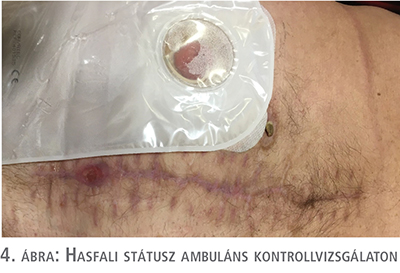
Megbeszélés
A radikális műtétek után kialakult szövődmények ellátása komplex, multidiszciplináris feladat. Amennyiben az intesztinális ödéma miatt a has primer zárása abdominális kompartmentszindrómához vezetne, nyitott hasi kezelés szükséges. Konvencionális terápiás protokoll szerint a beleken történő granulációt követően félvastag-bőr átültetésével zárjuk a hasfalat. A folyamat hosszadalmas volta mellett jelentős szövődmények alakulhatnak ki, mint a hasfali sérvképződés, vagy entero-atmoszférikus fisztulák (8). Újabb megoldásokat kínál az úgynevezett ideiglenes hasfali zárás, mint a „Bogota-bag”, „Wittmann-patch”, szintetikus háló, illetve a negatívnyomás-terápia (9).
A negatívnyomás-terápia, jelentős költségigénye mellett számos előnnyel rendelkezik. Nedves környezetet biztosít, összehúzza a sebszéleket, elősegíti a felesleges exsudátum eltávolítását, makro-, illetve mikrodeformálódást hoz létre. A seb környezetében növeli a véráramlást, segíti a granulációs szövet kialakulását, illetve lokális és szisztémás biokémiai változásokat idézi elő (10). Ezek mellett fontos megemlíteni, hogy megelőzi az intesztinális adhéziók kialakulását, és a faszciaszélekre gyakorolt húzás kifejtése révén gyorsítja a hasfal végleges zárását (8).
Esetünkben a többszörös reoperáció miatt létrejött intesztinális ödéma a hasfal primer zárását abdominális kompartmentszindróma veszélye miatt nem tette lehetővé. A negatívnyomás-terápia segítségével teljes sebzárás vált elérhetővé, megelőzve ezzel további – akár fatális – kimenetelű szövődmények kialakulását. Ezen technika bevált és széleskörben alkalmazott a hasi sebészeti gyakorlatban, azonban sebészeti társszakmák, mint pl. az urológia esetében kevéssé használjuk, illetve gondolunk alkalmazásának lehetőségére. Ugyanakkor, különösen a kiterjedt hasi műtéteket is végző urológiai osztályokon, a reoperációkat követő további szövődmények megelőzésében, illetve kezelésében elengedhetetlen ezen technika ismerete.
Következtetés
Esetismertetésünkkel szerettük volna felhívni a figyelmet erre a ritkán alkalmazott, de nagyon hasznos, súlyos komplikációkat megelőzni képes és az urológiai sebészetben is alkalmazható terápiás módszerre.
Irodalom
1. Pénzes E, Joós L, Szabó K, et al. Radikális cystectomiák korai perioperatív eredményeinek és szövődményeinek értékelése, az aneszteziológus és intenzív terapeuta szempontjából. Magyar Urológia 2009; 2.
2. Vetterlein MW, Klemm J, Gild P, et al. Improving Estimates of Perioperative Morbidity After Radical Cystectomy Using the European Association of Urology Quality Criteria for Standardized Reporting and Introducing the Comprehensive Complication Index. Eur Urol 2020; 77(1): 55–65.
https://doi.org/10.1016/j.eururo.2019.08.011 [published Online First: 20190829]
3. De Laet IE, Malbrain M, De Waele JJ. A Clinician’s Guide to Management of Intra-abdominal Hypertension and Abdominal Compartment Syndrome in Critically Ill Patients. Crit Care 2020; 24(1): 97.
https://doi.org/10.1186/s13054-020-2782-1 [published Online First: 20200324]
4. Papavramidis TS, Marinis AD, Pliakos I, et al. Abdominal compartment syndrome – Intra-abdominal hypertension: Defining, diagnosing, and managing. J Emerg Trauma Shock 2011; 4(2): 279–91.
https://doi.org/10.4103/0974-2700.82224
5. Pereira BM. Abdominal compartment syndrome and intra-abdominal hypertension. Curr Opin Crit Care 2019; 25(6): 688–96.
https://doi.org/10.1097/MCC.0000000000000665
6. Sugrue M, Buhkari Y. Intra-abdominal pressure and abdominal compartment syndrome in acute general surgery. World J Surg 2009; 33(6): 1123–7. https://doi.org/10.1007/s00268-009-0040-4
7. Horváth B, Pytel Á, Szántó Á. Korszerű sebkezelés az urológiában. Magyar Urológia 2021; 33(4).
8. Kaariainen M, Kuokkanen H. Primary closure of the abdominal wall after “open abdomen” situation. Scand J Surg 2013; 102(1): 20–4.
https://doi.org/10.1177/145749691310200105
9. Sugrue M. Abdominal compartment syndrome. Curr Opin Crit Care 2005; 11(4): 333–8. https://doi.org/10.1097/01.ccx.0000170505.53657.48
10. Orgill DP, Manders EK, Sumpio BE, et al. The mechanisms of action of vacuum assisted closure: more to learn. Surgery 2009; 146(1): 40–51. https://doi.org/10.1016/j.surg.2009.02.002 [published Online First: 20090419