Introduction and current results of testis sparing surgery in Pécs
DOI: 10.2259/magyurol.2024.3.czetanyp.139
Authors:
Czétány Péter dr., Balló András dr., Szántó Árpád dr.
Pécsi Tudományegyetem, Klinikai Központ, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
Summary
Introduction: The gold standard of primary treatment in testicular cancer is radical orchiectomy. Approximately 80% of small, non-palpable testicular lesions are of benign origin, in their case radical surgery means overtreatment, with serious consequences for this predominantly young patient population (e.g. reduced fertility, hypogonadism). Testis sparing surgery can offer an alternative, which can be performed even in the case of malignant tumors with imperative indications (synchronous tumor, solitary testis – metachronous tumor).
Patients and methods: Between 2018 and 2023, 13 patients underwent testis sparing surgery in our institute (Urology Clinic, University of Pécs Clinical Center). The indications – in accordance with the EAU and AUA recommendations – were the following: small, solitary lesion (
Results: In 8 cases the preliminary histological results (FSE) indicated benign lesion (e.g. sex cord-stromal tumors, adenomatoid tumors), thus we preserved the testis. In 5 cases, the FSE results suggested malignancy (seminoma, NSGCT): in 4 cases in the lack of imperative indication and in one further case based on the prior request of the patient orchiectomy was performed.
Discussion: The organ-preserving surgical approach brought a paradigm shift in the treatment of testicular tumors. In the case of benign tumors, unnecessary organ loss due to radical surgery and the associated complications can be avoided. For malignant tumors, it provides excellent, comparable oncological outcomes with superior functional results, emphasising the importance of careful patient selection, appropriate indication and surgical technique.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Bevezetés: A heredaganatok sebészetében a primer kezelés aranystandardja az ingvinális szemikasztráció. A kisméretű, nem tapintható heretérfoglalások kb. 80%-a benignus eredetű, esetükben a radikális műtét túlkezelést jelent, amely komoly következményekkel jár ezen zömében fiatal betegpopuláció számára (pl. csökkent fertilitás, hipogonadizmus). Alternatívát jelenthet a mikrosebészeti reszekció, amely imperatív indikáció (szinkron tumor, szoliter here – metakron tumor) esetén akár malignus tumorok esetében is elvégezhető.
Betegek és módszer: A PTE KK Urológiai Klinikán 2018 és 2023 között 13 beteg esett át heretumor-mikroreszekción, a műtéti indikáció szempontjait – az EAU és az AUA ajánlásokkal összhangban – kisméretű, szoliter elváltozás.
Eredmények: Az elvégzett műtétek során 8 esetben benignus térfoglalás diagnózisa mellett az érintett here megkímélhető volt, szövettani eredmények között sex cord-sztromális tumorok (Leydig-, illetve Sertoli-sejtes tumor), adenomatoid tumor, egyéb benignus szöveti reakciók szerepeltek. 5 beteg esetében az intraoperatív szövettan malignitást vetett fel (seminoma, NSGCT), 4 esetben imperatív indikáció hiányában, egyetlen esetben pedig a beteg kifejezett előzetes kérése alapján szemikasztrációt végeztünk.
Megbeszélés: A szervmegtartó sebészeti megközelítés paradigmaváltást hozott a heretumorok kezelésében. Benignus viselkedésű térfoglalások esetében a felesleges szervvesztés, annak szövődményei elkerülhetők, malignus tumor esetében gondos betegszelekció, megfelelő indikáció, illetve sebészi technika alkalmazása esetén kiváló – a szemikasztrációval összemérhető – onkológiai kontrollt biztosít jobb funkcionális eredmények mellett.
Bevezetés
Bár a teljes férfi populációt vizsgálva a heredaganatok ritka betegségnek számítanak (incidencia: 3-11/100 000, az összes daganatos megbetegedés kb. 1%-a), a fiatal férfiakat (15–40 éves kor között) nézve a leggyakoribb malignus kórképnek mondható, amely előfordulása a fejlett országokban továbbra is emelkedő tendenciát mutat (1).
Az 1970-es években bevezetett új platinaalapú kemoterápiás protokolloknak köszönhetően a túlélés jelentősen javult (kb. 95%, korábban 5-10%), jelenleg a heredaganat legjobban kezelhető felnőttkori malignitássá vált (2, 3). Ennek eredményeként a túlélő fiatal betegek várható élettartama több évtizedre nyúlt, amely során megjelentek az onkológiai kezelések szövődményei (pl. magas kardiovaszkuláris morbiditás, pulmonalis, nefro- és ototoxicitás, szekunder malignitások, hipogonadizmus, csökkent fertilitás, depresszió, stb.). A szövődmények előfordulásának csökkentése céljából szükségessé vált a betegek előzetes rizikóstratifikációja és az ennek megfelelő rizikóadaptált kezelés (4).
A primer ellátás aranystandardja az ingvinális szemikasztráció. Az ingvinális feltárás dogmatikusan a scrotalis behatolás által a nyirokelvezetésben potenciálisan előidézett átrendeződés, ezáltal a későbbiekben esetlegesen megjelenő atípusos (ingvinális) nyirokcsomó-áttétek elkerülése céljából szükséges. Ezen túl korábban a betegek nagyobb arányban estek át retroperitoneális lymphadenectomián (RLA) a kezelési algoritmus további lépcsőjeként, amikor szükség volt a funikulus komplett kiirtására, amely csak annak korábbi magas ingvinális ellátása esetén valósulhatott meg. A modern platinaalapú kemoterápiás protokollok mellett az RLA aránya visszaszorult, ezáltal ez utóbbi szempont jelentősége is csökkent.
A magas ingvinális szemikasztráció során lágyékcsatorna-megnyitásra kerül, magasabb szövődményrátát (pl. n. ilioinguinalis sérülés, következményes paresztézia, hiperesztézia, ingvinális hernia) eredményezve egy, az ingvinális csatorna megnyitása nélküli szubingvinális feltárással („low-cord” orchiectomy) vagy akár scrotalis behatolással szemben. Ennek fényében a friss irodalmat áttekintve a szakmában van törekvés a morbiditás csökkentésére ezen műtétek kapcsán, természetesen az onkológiai kimenetel rontása nélkül. Ashdown és munkatársai (5) 2004-ben közölt publikációjukban 120 hagyományos műtéten átesett és 102 alacsony funikulus ellátásban részesült beteg adatait hasonlították össze: I. stádiumú betegek esetében a relapszus rátában és a mortalitásban nem találtak szignifikáns különbséget. Patel és munkatársai (6) 2020-as metaanalízisükben scrotalis manipuláción átesett betegek adatait elemezték: a lokál recidíva aránya jelzetten magasabb volt az ingvinális behatoláshoz viszonyítva (2,5% vs. 0%), de ez 3-5 év távlatában a metasztázisok megjelenésének arányában vagy a túlélésben különbséget nem jelentett. Sarıkaya és munkatársai (7) által 2024-ben retrospektíve vizsgált 196 beteg adatainak összehasonlítása szerint az I. stádiumú betegek esetében a funikulus alacsony ellátása nem rontja az onkológiai eredményeket. Ezek alapján várhatóan alacsony stádiumú betegek esetén a műtét során okozott iatrogén ártalmak mérséklése érdekében a fenti szempontok mindenképpen megfontolandók.
Az ingvinális szemikasztráció alternatívája lehet bizonyos esetekben a mikrosebészeti reszekció („testis sparing surgery”, TSS), amely jól illeszkedik a rizikóadaptált terápiás szemléletbe: megfelelő indikáció és sebészi technika esetén összemérhető onkológiai kontroll biztosít jobb funkcionális kimenetel mellett (hipogonadizmus, szub-/infertilitás kialakulásának esélye kisebb, negatív testkép, pszichés distressz elkerülhető). Malignus térfoglalások esetében a jelenlegi ajánlások (European Association of Urology – EAU, American Association of Urology – AUA) szerint imperatív indikáció (szinkron tumor, szoliter here – metakron tumor) alapján végezhető el.
A kisméretű, nem tapintható heretérfoglalások kb. 80%-a benignus jellegű (8), a szemikasztráció esetükben túlkezelést jelent, így a nemzetközi irányvonalak alapján ezen esetekben, illetve bizonytalan dignitás esetén szintén választhatjuk a herekímélő sebészeti megoldást, amennyiben az elváltozás szoliter. Különleges jelentőségű a téma gyermekurológiai vonatkozása: prepubertális fiúgyermekek esetében kb. 60-75%-os a benignus hisztológia az összes heretumort tekintve, így az ajánlás szerint szervkímélő műtétet szükséges végezni, amikor lehetséges.
A térfoglalás méretét illetően csak az AUA szerinti irányvonalak jelölnek meg egy 2 cm-es határt, amely felett a beavatkozást nem ajánlják. Az indikáció során fontos szempont továbbá a tumormarkerek: alfa-fötoprotein (AFP), b-humán koriogonadotropin (b-hCG) normális szintje és megtartott preoperatív tesztoszteron (TT) és luteinizáló hormon- (LH) szintek (1. táblázat) (9, 10, 11).

Amennyiben a betegnél már műtét előtt definitív (TTi, LHh)/szubklinikus (TT norm., LHh) hipogonád értékeket látunk, a szervmegtartás ilyen szempontból való előnye kétséges, mivel nagy eséllyel amellett is hormonszubsztitúció válik szükségessé. Amennyiben a fertilitási szempont nem játszik szerepet, radikális műtét javasolt. A műtétet megelőzően a kontrasztanyagos ultrahang (UH; contrast-enhanced ultrasound – CEUS) fontos addícionális információkkal szolgálhat az elváltozás dignitását illetően, konvencionális B-módú UH-val kombinálva 93%-os diagnosztikus pontosság érhető el vele (sajnos hazánkban a finanszírozása ilyen indikációval még nem biztosított) (12).
A műtéti technika első leírója Seppelt volt 1982-ben (13), majd a következő mérföldkövet 2001-ben a German Testicular Cancer Study Group tanulmánya jelentette, amelyben lefektették az alapvető sebészi elveket, illetve először igazolták a technika onkológiai biztonságosságát (14). Hazánkban elsőként Kopa Zsolt és munkatársai által a Semmelweis Egyetem Urológiai Klinika Andrológiai Centrumában került bevezetésre az eljárás, a legnagyobb számban jelenleg is itt végzik, munkacsoportunk is itt szerezte a technika elsajátításához szükséges kezdeti ismereteket.
A beavatkozás elvégzéséhez operációs mikroszkóp, mikrosebészeti armamentárium használata javasolt. A herét ingvinális feltárásból emeljük elő. Fontos a funikulus leszorításának kérdése: az eredeti technika során ezt a tumorszóródás megelőzése céljából javasolták (meleg/hideg iszkémia), azonban mindezidáig ennek hiányában sem került leírásra magasabb recidívaarány az irodalomban (clampless technika), ellenben 30 perc elteltével már megfigyelhetőek morfológiai elváltozások, degeneráció a Sertoli-sejtekben, iszkémiás kárododásra utalva (15). A tumort tapintás, illetve szükség esetén intraoperatív UH alapján lokalizáljuk. Az elváltozás felett a tunica albugineat megnyitjuk, majd azt megfelelő ép sebészi széllel reszekáljuk, illetve pseudocapsula megléte esetén enukleálhatjuk is (1. ábra).
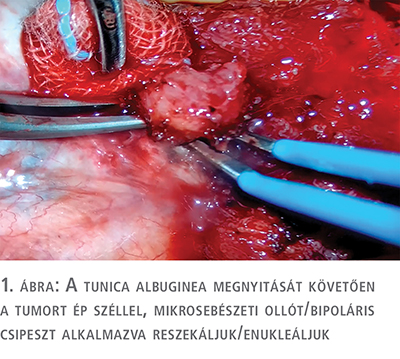
A tumorágyból további biopsziák (min. 2) vétele szükséges. Minden esetben szükséges intraoperatív friss fagyasztott szövettani metszet (frozen section examination – FSE) vizsgálata tapasztalt uropatológus közreműködésével. Amennyiben a reszekciós alapon in situ neoplasia (germ cell neoplasia in situ – GCNIS) marad vissza, lokálisan adjuváns irradiáció (18-20 Gy) adása szükséges csírasejtes tumor (germ cell tumor – GCT) kifejlődésének megelőzésére (kezelés nélkül 5 év alatt 50%-ban) (16), amely által a germinális hám elpusztul, azonban az ellenállóbb Leydig-sejtek túlélnek, az endokrin funkció nagyobb eséllyel megőrizhető, így az androgén szubsztitúció elkerülhető lehet. Le nem zárult gyermekvállalás esetén a kezelés szoros obszerváció mellett átmenetileg halasztható (10–17).
Betegek és módszer
A PTE KK Urológiai Klinikán 2018 augusztusa és 2023 májusa között 13 esetben végeztünk mikroreszekciót heretérfoglalás esetében.
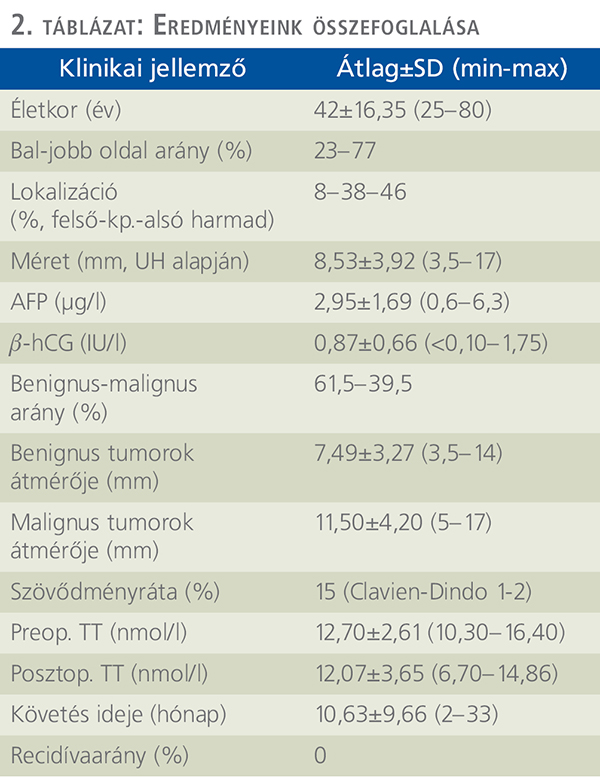
A betegek átlagos életkora 42±16,35 év (25–80) volt, az esetek több, mint ¾-ében a jobb oldali here volt érintett (bal-jobb oldal arány: 23–77%), ezen belül legtöbbször alsó, illetve középső harmadi lokalizációval találkoztunk (8% felső – 38% kp. – 46% alsó harmad).
Az átlagos tumorméret (UH alapján) 8,53±3,92 mm (3,5–17) volt, a tumormarkerek az ajánlásoknak megfelelően minden esetben normáltartományban voltak (AFP: 2,95±1,69 mg/l [0,6–6,3], b-hCG: 0,87±0,66 IU/l [<0,10–1,75]).
A műtéteket a korábbiakban ismertetett technika alapján végeztük, funikulus-leszorítást nem alkalmaztunk. Megelőzően minden esetben spermakonzerválás, illetve staging céljából hasi képalkotó vizsgálat (komputertomográfia – CT/mágneses rezonancia képalkotás – MRI) történt.
Eredmények
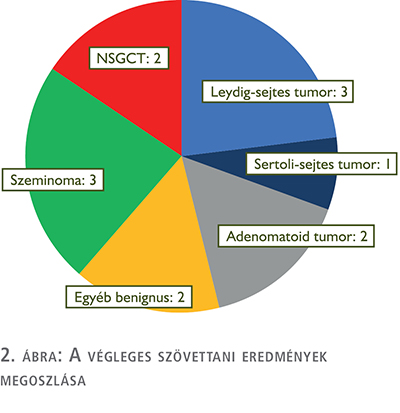
8 esetben véleményeztek az előzetes szövettani vizsgálat (FSE) alapján benignus folyamatot (61,5%), ezek végleges szövettani típusa egészen változatos volt: 4 esetben sex cord/stroma sejtes tumorok (Leydig-sejtes tumor 3, Sertoli-sejtes tumor: 1), 2 esetben adenomatoid tumor, 2 további esetben egyéb szöveti reakciók (reparálódó terület, granulomatózis) kerültek leírásra. Egy esetben a benignus elváltozás környezetében észlelt GCNIS miatt a betegnek adjuváns irradiációt javasoltunk, azonban tekintettel a még fennálló gyermekvállalási igényre, ennek halasztását kérte, jelenleg szoros követése zajlik.
5 esetben találkoztunk malignus folyamattal (39,5%, 2 non-seminomatosus csírasejtes tumor – NSGCT –, 1 tiszta teratoma-1 kevert, 3 seminoma), amelyből 4 esetben a here megtartására imperatív indikáció nem állt fenn, így együlésben szemikasztrációra való konverzió mellett döntöttünk. Egyetlen esetben szoliter herében észlelt malignus elváltozás miatt szintén szemikasztráció történt, mivel a beteg karcinofóbia miatt malignitás felmerülése esetén a here komplett eltávolítását kérte. A friss fagyasztott szövettan eredménye a végleges szövettani eredménnyel 100%-ban konvergált, így második ülésben szemikasztrációra nem volt szükséges (2. ábra).
A benignus vs. malignus tumorok átmérőit összehasonlítva statisztikailag szignifikáns eltérést nem találtunk (7,49±3,27 [3,5–14] vs. 11,50±4,20 [5–17]; Mann–Whitney-teszt, p<0,05). A posztoperatív időszakban csak minor szövődményeket észleltünk (lázas állapot, hematoma – Clavien-Dindo 1-2), amelyek konzervatív módon uralhatók voltak. A preoperatív vs. posztoperatív tesztoszteronszinteket összehasonlítva szintén nem látszott szignifikáns különbség (12,70±2,61 [10,30–16,40] vs. 12,07±3,65 [6,70–14,86]; Wilcoxon-teszt, p<0,05). A betegek eddigi követése (10,63±9,66 hó [2–33]) során recidíva nem fordult elő (2. táblázat).
Megbeszélés
A szervmegtartó sebészeti megközelítés paradigmaváltást hozott a heretumorok kezelésében. Benignus viselkedésű térfoglalások esetében a felesleges szervvesztés, annak szövődményei (szub-/infertilitás, hipogonadizmus, pszichés distressz) elkerülhetők ebben a zömében fiatal, fertilis korban lévő betegpopulációban. Malignus tumorok esetében gondos betegszelekció, megfelelő indikáció, illetve sebészi technika (tumorágyi biopszia, FSE, GCNIS esetén adjuváns irradiáció, stb.) alkalmazása esetén kiváló – a szemikasztrációval összemérhető – onkológiai kontrollt biztosít jobb funkcionális eredmények mellett. Az előbbieket támogatják saját eredményeink is, vizsgálatunk limitációját az eddigi alacsony esetszám adja.
.
Irodalom
1. Park JS, Kim J, Elghiaty A, et al. Recent global trends in testicular cancer incidence and mortality. Medicine (Baltimore) Sep. 2018; 97(37): e12390. https://doi.org/10.1097/MD.0000000000012390
2. Einhorn LH. Treatment of testicular cancer: a new and improved model. J Clin Oncol 1990 Nov; 8(11): 1777–1781.
https://doi.org/10.1200/JCO.1990.8.11.1777
3. Bosetti C, Bertuccio P, Chatenoud L, et al. Trends in mortality from urologic cancers in Europe, 1970-2008. Eur Urol 2011 Jul; 60(1): 1–15.
https://doi.org/10.1016/j.eururo.2011.03.047
4. Fung X, Dinh PJ, Ardeshir-Rouhani-Fard S, et al. Toxicities Associated with Cisplatin-Based Chemotherapy and Radiotherapy in Long-Term Testicular Cancer Survivors. Adv Urol 2018; 8671832.
https://doi.org/10.1155/2018/8671832
5. Ashdown DA, Bodiwala D, Liu S. Is high cord radical orchidectomy always necessary for testicular cancer? Ann R Coll Surg Engl 2004 Jul; 86(4): 289–291. https://doi.org/10.1308/147870804272
6. Patel HD, Gupta M, Cheaib JG, et al. Testis-sparing surgery and scrotal violation for testicular masses suspicious for malignancy: A systematic review and meta-analysis. Urol Oncol 2020 May; 38(5): 344–353.
https://doi.org/10.1016/j.urolonc.2020.02.023
7. Sarıkaya EA, S¸en V, Yörükog˘lu K, et al. Low-cord orchidectomy for testicular cancer: what would be different? World J Urol 2024 Jul; 42(1): 421. https://doi.org/10.1007/s00345-024-05118-7
8. Carmignani L, Gadda F, Gazzano G, et al. High incidence of benign testicular neoplasms diagnosed by ultrasound. J Urol 2003 Nov; 170(5): 1783–1786. https://doi.org/10.1097/01.ju.0000092066.01699.90
9. Nicol D, Berney D, Boormans JL, et al. EAU Guidelines on Testicular Cancer. EAU Guidelines Office, Arnhem, The Netherlands, 2023.
10. Stephenson A, Bass EB, Bixler BR, et al. Diagnosis and Treatment of Early-Stage Testicular Cancer: AUA Guideline Amendment 2023. J Urol 2023 Sep; 101097JU0000000000003694.
https://doi.org/10.1097/JU.0000000000003694
11. Radmayr C, Bogaert G, Burgu B, et al. EAU Guidelines on Pediatric Urology. EAU Guidelines Office, Arnhem, The Netherlands 2023.
12. Isid M, Pozza C, Gianfrilli D, et al. Differential diagnosis of nonpalpable testicular lesions: qualitative and quantitative contrast-enhanced US of benign and malignant testicular tumors. Radiology 2014 Nov; 273(2): 606–618. https://doi.org/10.1148/radiol.14132718
13. Seppelt U. Enukleation Eines Sukzessiven Zweittumors Im Resthoden. Therapiewoche 1982; 32(5): 560–563.
14. Heidenreich A, Weissbach L, Höltl W, et al. Organ sparing surgery for malignant germ cell tumor of the testis. J Urol 2001 Dec; 166(6): 2161–2165. https://doi.org/10.1016/s0022-5347(05)65526-7
15. Miller DC, Peron SE, Keck RW, et al. Effects of hypothermia on testicular ischemia. J Urol 1990 May; 143(5): 1046–1048.
https://doi.org/10.1016/s0022-5347(17)40180-7
16. von der Maase H, Rørth M, Walbom-Jørgensen R, et al. Carcinoma in situ of contralateral testis in patients with testicular germ cell cancer: study of 27 cases in 500 patients. Br Med J (Clin Res Ed). 1986 Nov; 293(6559): 1398–1401. https://doi.org/10.1136/bmj.293.6559.1398
17. Giannarini G, Dieckmann KP, Albers P, et al. Organ-sparing surgery for adult testicular tumours: a systematic review of the literature. Eur Urol 2010 May; 57(5): 780–790.
https://doi.org/10.1016/j.eururo.2010.01.014