A radioligand kezelési lehetőségek helye a prosztatadaganatok terápiájában – White Paper
DOI: 10.22591/magyurol.2024.4.maraza.203
Authors:
Maráz Anikó dr.1, Besenyi Zsuzsanna dr.2, Garai Ildikó dr.3, Géczi Lajos dr.4,
Györke Tamás dr.5, Mangel László dr.6, Murányi Mátyás10, Nyirády Péter dr.7,
Rózsa Péter dr.9,10, Tenke Péter dr.8
1Szegedi Tudományegyetem, Szent-Györgyi Albert Klinikai Központ, Onkoterápiás Klinika, Szeged
2Szegedi Tudományegyetem, Szent-Györgyi Albert Klinikai Központ, Nukleáris Medicina Intézet, Szeged
3Debreceni Egyetem, Klinikai Központ, Nukleáris Medicina Tanszék, Debrecen
4Országos Onkológiai Intézet, Urogenitális Tumorok és Klinikai Farmakológiai Osztály, Budapest
5Semmelweis Egyetem, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Budapest
6Pécsi Tudományegyetem, Klinikai Központ, Onkoterápiás Intézet, Pécs
7Semmelweis Egyetem, Általános Orvostudományi Kar, Urológiai Klinika, Budapest
8Jahn Ferenc Dél-pesti Kórház és Rendelőintézet, Urológiai Osztály, Budapest
9Pécsi Tudományegyetem, Gyógyszerésztudományi Kar, Egészségügyi Technológiaértékelési és Farmakoökonómiai Kutatóközpont, Pécs
10MediConcept Kft., Budapest
Összefoglalás
A White Paper célja, hogy részletesen bemutassa a prosztatarák-betegséget, különös tekintettel a radioligandok terápiás célú alkalmazására. Kiemelten foglalkozik a betegség társadalmi terheivel, a hazai és nemzetközi szűrési, diagnosztikai és kezelési gyakorlatokkal. Továbbá részletezi, hogy a prosztatarák diagnosztikájában és terápiájában jelenleg, valamint a jövőben milyen szerepet töltenek be az innovatív radioligandok. Mindezek mellett kritikus fontosságúnak tartja, hogy a jelenlegi állapotot és az esetleges hiányosságokat a döntéshozók számára is feltárja.
A White Paper elkészítése során elsőként szakértői mélyinterjúkat folytattunk, amelyek során átfogó felmérés készült a radioligand-terápiák általános ismertségéről, valamint a különböző érintettek szerepéről a területtel kapcsolatos kommunikációban, tudásátadásban. Az interjúalanyok segítségével azonosításra kerültek a terápiás terület jelenlegi jellegzetességei, erősségei, kihívásai, valamint jövőbeli fejlődési lehetőségei. Az interjúk alapján egy összesítés készült, amelyet egy kerekasztal-megbeszélés keretein belül vitattunk meg az érintett területek meghívott szakértőivel. Az interjúk alapján a jelenlegi rendszer legfőbb kihívásait hat fő kategória mentén csoportosítottuk, amelyek a következők: betegútmenedzsment, ellátásszervezés és kapacitáskérdések, edukáció, az elkészült leletek standard jó minőségének biztosítása, nukleáris medicina helye és szerepe, valamint a finanszírozás. A radiofarmakonokkal érintett szűkebb metasztatikus prosztatadaganat betegségterület megismerésével és a lefolytatott interjúk tapasztalatainak összesítésével a következő főbb javaslatokat tettük annak érdekében, hogy a radioligand-kezelések a jövőben a lehető legkisebb akadály mellett jussanak el az érintett betegkörhöz:
- Mind helyi, mind országos szinten elengedhetetlen a betegutak kidolgozása, valamint a kompetenciák tisztázása. A betegellátás során kiemelten fontos a multidiszciplináris onkoteam döntése az adott stádium alapján a legoptimálisabb kezelés javaslatához, valamint a beteg aktuális kezelésében közreműködő szakemberek meghatározásához.
- Az egyenlő hozzáférés elvén támogatni kell a radioligand-kezelések elérhetőségét a szükséges személyi és tárgyi feltételeknek megfelelő izotópterápiás intézményekben. A betegek és hozzátartozóik részére megfelelő támogató kézikönyv kidolgozása javasolt. Az orvosoknak pedig folyamatos továbbképzések biztosítása.
- Meg kell határozni a nukleáris medicina szakma helyét és szerepét a klinikai döntéshozatalban, a teranosztikai fekvőbeteg terápiás osztály működési feltételeinek kialakításában.
- Javasolt a teranosztikumokkal végzett terápiák diagnosztikáját – képalkotás, leletezés – a nukleáris medicina módszertana alapján standardizálni. Komplex finanszírozási ökoszisztémát indokolt kialakítani, ahol az ellátás a diagnosztikától kezdve a radioligand-terápiák adminisztrációján át, az utánkövetésig egységes rendben, méltányosan és arányosan finanszírozott. Ezt a komplexitást már az egyes technológiák befogadásakor is javasolt figyelembe venni.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 4. SZÁM
Bevezetés
A tanulmány célja
Jelen White Paper célja, hogy röviden bemutassa a prosztatarák-betegséget, azon belül különösen az innovatív radioligand-kezeléssel érintett területet, annak a társadalmi terheit, a szűrésének, kezelésének és diagnosztikájának hazai és nemzetközi környezetét, majd részleteiben feltárja, hogy a betegség diagnosztikájában és kezelésében milyen speciális helye, szerepe van, vagy kellene legyen a területen legújabbak között citálható radioligandoknak.
Ehhez az anyagban a vizsgálat tárgyát képezik a nemzetközi és hazai nukleáris medicina területén alkalmazott protokollok és szakmai iránymutatások, a legújabb szakirodalomban fellelhető tudományos bizonyítékok a radiofarmakonok diagnosztikai és kezelési lehetőségeiről és korlátairól, illetve egy a témában jelen tanulmány keretein belül készülő mélyinterjú-sorozat eredményei.
Bár évek óta elérhetőek a diagnosztikában és a kezelésben is radiofarmakon megoldások, ezek jelenleg csak a betegek egy jelentősen szűkített populációja számára elérhetőek, ami az aktuális új indikációknak köszönhetően bővülhet a közeljövőben.
A kutatások azt mutatják, hogy mind az ellátás területén tevékenyen közreműködő orvosszakmák, mind a tágabb értelemben vett társszakmák folyamatos képzése kiemelkedően fontos lenne a bővülő betegpopuláció kiszolgálása érdekében.
Bugani és szerzőtársai szisztematikus kérdőíves kutatásukban 156 európai onkológiai intézmény, orvostudományi egyetem és ápolói szervezet bevonásával kutatták azt, hogy a képviselt intézmények és szervezetek rálátása szerint mennyire megfelelőek a radioligand-terápiákkal kapcsolatos ismeretek, mennyire volna szükség a szakemberek és a különböző társszakmák ismereteit mélyíteni (1).
A válaszadók 78 százaléka szerint a radioligand-terápiákkal kapcsolatos képzés nagyon fontos a szakemberek számára. 88 százalék úgy nyilatkozott, hogy a képzések erre ki is térnek, ugyanakkor 94 százalék szerint a képzések túlnyomórészt elméletiek és hiányzik a gyakorlati tapasztalat elsajátítása, amely nagyban köszönhető a kevés szakembernek, a radioligand-terápiákat oktatni képes szakemberek alulreprezentáltságának az orvostudományi egyetemeken és gyakorlati tudás átadására alkalmas alacsony számú intézményi lehetőségnek (1).
Bugani és szerzőtársai munkásságára alapozva és az egyre növekvő radiofarmakon diagnosztikai és ellátási paletta alapján arra következtethetünk, hogy a nukleáris medicina, így a radiofarmakon megoldások súlya vélhetően tovább fog erősödni.
Amellett tehát, hogy a prosztatarák-betegségen belül a radiofarmakon diagnosztikai és terápiás terület magában hordozza az alapbetegség teljes ellátásának kihívásait és lehetőségeit (úgy mint a szűrések és a betegek folyamatos nyomon követésének kiemelt szerepe, a terület eszközellátottságának és az innovatív megoldásokhoz való hozzáférésének finanszírozási korlátai), rendelkezik saját, az ellátási területre vonatkozó megoldandó kérdésekkel, mint például a nukleáris medicinában jártas szakemberek képzése, képzettsége és helye a multidiszciplináris ellátásban vagy a kezelés után a kezelés sajátos körülményeinek gondos felügyelete, menedzsmentje. A tanulmányban a szerzők a terület általános leírásán és bemutatásán túl ezekre a kérdésekre igyekeznek iránymutatással szolgálni mind a közpolitika alkotók, mind a szélesebb szakma számára.
Módszertan
Ahhoz, hogy a prosztatarák-betegség ellátásán belül átfogó képet kaphassunk a radioligand terápiás kezelési lehetőségek helyzetéről, majd ennek alapján releváns és előremutató javaslatokat fogalmazzunk meg, olyan átfogó és transzparens tudományos módszertanra van szükség, amely alapján a levont következtetések koherensek, figyelembe veszik a jelenlegi hazai és nemzetközi terápiás gyakorlatot, iránymutatásokat, és beépíthetőek a hazai oktatási, finanszírozási és ellátási környezetbe, lehetőség szerint evidenciákkal alátámasztva a javaslatok létjogosultságát (1. ábra).
Tanulmány felépítése
Jelen tanulmány szerkezetét és módszertanát tekintve három pilléren nyugszik:

Betegségterület bemutatása
Tanulmányunk első pilléreként a prosztatarák-betegség rövid általános bemutatását jelöltük meg.
Ennek keretében ismereteink és a szükséges szakirodalom figyelembevételével röviden bemutatjuk magát a betegséget, azon belül a radioligand-terápiákkal érintett területet.
Bemutatjuk, hogy a betegség ezen területe mekkora populációt érint, évről évre hány új beteget tud az egészségügyi ellátórendszer felfedezni, a betegségnek milyen stádiumai vannak, és hogy hány beteget sorolnak az egyes stádiumokba, végül pedig kitérünk a betegséggel kapcsolatos túlélési esélyekre és a legfontosabb statisztikai mutatókra is.
Betegségteher feltárása
Bár a betegség bemutatásánál már sok olyan pontot feltárunk, ami a társadalmi terhekre enged következtetni, ezen terhek megbecsülésére szofisztikáltabb eszközök is rendelkezésünkre állnak.
Az elérhető adatbázisok alapján megvizsgáljuk, hogy a betegségben átlagosan mennyi évet töltenek a betegek, és hogyan alakul az életminőséggel korrigált életévnyereségük.
Szisztematikus irodalomkutatás segítségével elemezzük, hogy mik a prosztatarák-betegség radioligand-kezelésekkel érintett területének legjellemzőbb betegségterhei, ezek hogyan hatnak a betegek életminőségére, és milyen közvetlen és közvetett költségeket jelentenek számukra.
Ezt követően értékeljük azt is, hogy a finanszírozó számára milyen költségterhet jelent a terület ellátása, és ennek mik a tényezői.
Nemzetközi és hazai ellátási környezet
A tanulmány harmadik pillére a nemzetközi és hazai ellátási környezet rövid bemutatása, illetve annak részletes vizsgálata, hogy ebben a szerkezetben hol lehet helye a radioligand kezelési lehetőségeknek, és milyen kihívások és lehetőségek állnak a szakterület előtt, illetve milyen kihívásokat és lehetőségeket jelent a terület kibontakozása a teljes betegségterületre nézve.
Ehhez megvizsgáljuk a prosztatarák-betegség szűrését, az ezzel kapcsolatos lehetőségeket és gyakorlatot; a diagnosztikai lehetőségeket, tekintettel a nemzetközi és hazai iránymutatásokra; feltárjuk az elérhető, ajánlott és alkalmazott kezelési lehetőségeket, illetve kitérünk a betegség nyomon követesének fontosságára.
Ezzel együtt áttekintjük, hogy ebben az ellátási környezetben hol és milyen helye van a radioligand kezelési lehetőségeknek, amelyek a legfontosabb szakmai ajánlások, mik az elérhető alternatívák, hogyan hozható ez összhangba az ellátási gyakorlattal és a finanszírozással, milyen lehet ezen új ellátási alternatívák társadalmi megítélése és hogyan lehet maga a szakma felkészülve ezen új terület szélesebb körű alkalmazására.
Ez utóbbi terület feltárásához összesen 18 mélyinterjút készítettünk a lehető legtöbb érintett szereplő bevonásával úgy, mint érintett orvosszakmák (onkológia, urológia, radiológia, nukleáris medicina), betegszervezetek, betegek és finanszírozó.
Betegségterület bemutatása
A prosztatadaganatokról
A prosztatarák a prosztata rosszindulatú daganatos megbetegedése, amely jelenleg a fejlett országokban a leggyakoribb férfiakat érintő daganatos megbetegedési forma. Hazánkban még a teljes népességre nézve is a harmadik leggyakoribb daganattípus és férfiak körében a harmadik leggyakoribb daganatos halálozási ok (2, 3).
A jelenlegi szakmai konszenzus szerint radioligand-terápiákban azon betegek részesülhetnek, akiknek prosztatarákja már kasztrációrezisztens fázisban van (tehát betegségükre androgén deprivációs terápia, sebészeti kasztráció önmagában már nem fejt ki pozitív hatást), mi több, a betegségnek már más szervi érintettsége is van, tehát áttétes (2. ábra).
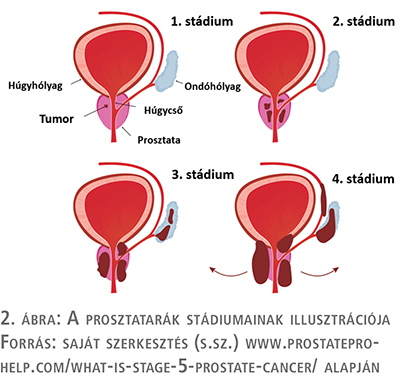
Ezt a betegségállapotot metasztatikus kasztrációrezisztens prosztataráknak (mCRPC) nevezzük. Az iránymutatások idővel változhatnak, de jelen tanulmány fókuszában az ezzel a betegségfázissal kapcsolatos információk feltárása és összegzése áll.
Incidencia
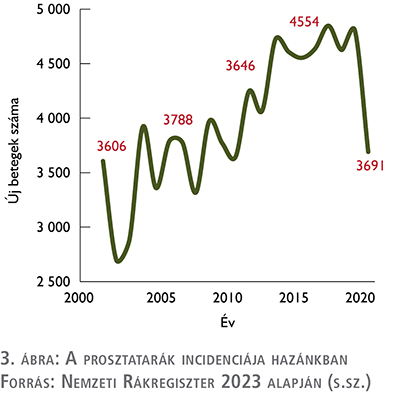
A Nemzeti Rákregiszter adatai alapján a Rákregiszter fennállása, azaz 2000 óta a prosztatarák éves incidenciája 2700 és 4900 beteg/év között mozgott (3), az új betegek leginkább az idősebb korosztályból kerülnek ki.
A COVID-19 által sújtott 2020-as évet figyelmen kívül hagyva összességében elmondható, hogy a felfedezett betegek éves száma növekvő tendenciát mutat. Ez betudható a szűrési hatékonyság emelkedésének és a társadalom idősödésének is, ami miatt várhatóan tovább növekszik majd a prosztatarák incidenciája (3. ábra).
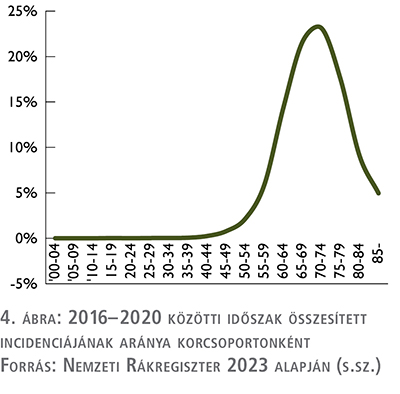
Az új betegek több mint 90 százaléka a 60 éves és annál idősebb korosztályból kerül ki: az utolsó vizsgált öt évben, tehát 2016 és 2020 között összesen 22 606 új beteget diagnosztizáltak, akiknek 14 százaléka 60–64, 22 százaléka 65–69, 23 százaléka 70–74, 18 százaléka 75–79, 9 százaléka 80–84 és 5 százaléka a 85+ éves korosztályból került ki. A társadalom elöregedésével egyre nagyobb lesz a jövőben a prosztatarák egészségügyi rendszerre gyakorolt terhe, ráadásul a munkaképes korú lakosság arányának csökkenése tetézi a várható problémát (4. ábra).
A radioligand-terápiákkal érintett betegségterületen, azaz az mCRPC-ben nem rendelkezünk olyan hazai publikus adatokkal, amelyek az mCRPC hazai incidenciájára vonatkoznának. Thurin és szerzőtársai 2020-ban készített tanulmányukban a Francia Országos Egészségügyi Adatbázis adatai alapján 2014-re vonatkozóan az mCRPC incidenciáját 21/100 000-re becsülték a felnőtt férfi lakosságban (4).
A KSH alapján vett 2014-es magyar felnőtt férfi lakosság adatai (3 756 276 fő) és a Rákregiszter 2014-re vonatkozó prosztatarák incidenciája alapján Magyarországon 2014-ben 123 új megbetegedés jutott 100 000 felnőtt férfi lakosra. Ez azt jelenti, hogy Thurin és munkatársai adatait alapul véve az új megbetegedések között az mCRPC aránya hazánkban 17 százalékra tehető, tehát 2014-ben 790 körül alakulhatott az új mCRPC betegek száma (2, 3).
Prevalencia
A prosztatarák hazai prevalenciájára vonatkozóan hazai publikus adatbázisból nem érhető el adat. A Global Health Data Exchange (GHDx) 2021-es adatai alapján 2014 és 2019 között 23 000 és 27 000 fő körül alakulhatott a prosztatarák prevalenciája (5).
Ezen belül az mCRPC-re vonatkozó specifikált adat szintén nem lelhető fel Magyarországra vonatkozóan, ezért ennek megbecsléséhez újfent Thurin és szerzőtársai 2020-ban készült munkájára hivatkozunk. A szerzők munkája alapján Franciaországban 2014-ben 100 000 betegre 62 mCRPC-beteg jutott, ez a hazai férfi lakosságra vetítve ~ 3000 beteget jelent (5. ábra).
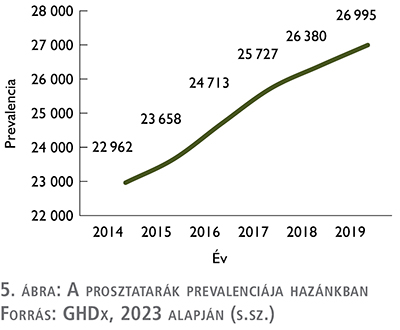
Ez az összes prosztatarákos beteg 13 százaléka (2, 4, 5).
Stádiumbesorolás
A prosztatarák diagnózisának felállítása után több tényezőt is figyelembe vesznek annak megítélésére, mennyire előrehaladott a betegség. A prosztatarák stádiumbesorolására jellemzően a TNM (Tumor, Node, Metastasis, azaz magyarul primer tumor, regionális nyirokcsomók és távoli áttét) rendszert alkalmazzák, a prosztatarák szövettani differenciáltsági fokának meghatározására az úgynevezett Gleason-pontértéket, vagy az ezek alapján továbbfejlesztett ISUP Grade besorolást használják, ahol a magasabb értékek agresszívabb viselkedésű daganatra utalnak.
A kezelés megtervezéséhez hasznos kockázati besorolási iránymutatást készített az ESMO (European Society for Medical Oncology) és az NCCN (National Comprehensive Cancer Network) is, ahol előbbi értékeken túlmenően figyelembe veszik a prosztataspecifikus antigén (PSA) vérben mért szintjét is (6, 7).
A TNM-rendszer szerint a radioligand-kezeléseknek jelenleg akkor van helye, ha a betegeknél távoli áttét van jelen (M1).
A tanulmány szempontjából a vizsgált szűk kategória a metasztatikus kasztrációrezisztens prosztatarák.
Ezen szűkebb betegségállapot metasztatikus jellegére a fenti besorolási lehetőségek tudnak segítséget nyújtani, ugyanakkor a hormonszenzitivitás csak a megelőző terápia ismeretében megállapítható, ugyanis a pontozások önmagukban csak a hormonrezisztencia kialakulásának, és ezzel a betegség későbbi előrehaladásának kockázatát képesek előrevetíteni.
A prosztatarák mindaddig hormonszenzitív (HSPC), míg androgén-deprivációs terápiával (ADT) előidézett szérumtesztoszteron-érték a kasztrációs szint alatt tartható (1,7 nmol/l) és ez idő alatt biokémiai, vagy radiológiai progresszió nem következik be. Amennyiben az ADT és kasztrációs tesztoszteronérték mellett a PSA értéke 2 ng/ml fölé emelkedik, vagy a képalkotókon progresszió alakul ki, úgy kasztrációrezisztens prosztatarákról kell beszélnünk (CRPC). Ebben a fázisban a bázis ADT-hormonterápia kiegészítése szükséges egyéb terápiákkal. Amennyiben a kasztrációrezisztens állapot valamilyen áttéttel (legjellemzőbben csontáttéttel) is társul, úgy a betegség metasztatikus kasztrációrezisztens prosztatarák fázisba lépett át (mCRPC).
Mortalitás
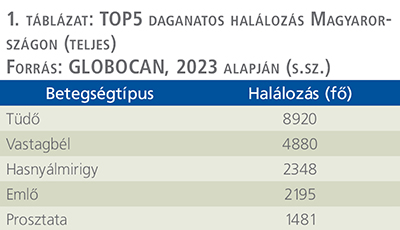
A GLOBOCAN 2020-as évi adatait vizsgálva Magyarországon 1481 fő hunyt el prosztatarákban, ezzel a teljes lakosságot tekintve a prosztatarák az ötödik, míg a férfiak körében a harmadik leggyakoribb daganatos eredetű halálozási ok volt (8) (1. táblázat).
A betegség mortalitása a betegség egyes fázisaiban nagyon eltérő: míg az öt- és tízéves teljes túlélése (OS) az újonnan, lokalizált betegséggel diagnosztizált betegeknél kezeléstől függően 70-92 százalék és 49-80 százalék (9–12), a lokálisan előrehaladott betegség esetén 64-91 százalék és 35-80 százalék (12–15); addig az 5 és 10 éves teljes túlélés a tünetekkel nem rendelkező mCRPC-betegeknél már csak 10,6 és 2,3 százalék (16), szimptómás mCRPC-nél 5,4 és 0,3 százalék (17), az első kemoterápiás kezelés ellenére is előrehaladó mCRPC esetén pedig csupán 1,6 és 0 százalék (18).
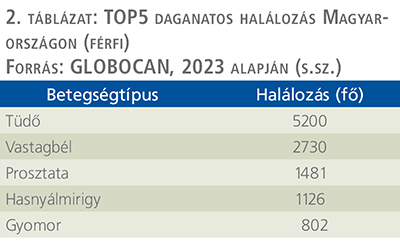
A betegek életkilátásai tehát mCRPC-ben jelentősen rosszabbak, mint a kevésbé előrehaladott stádiumokban, így arányaiban jelentősen nagyobb az mCRPC mortalitása, mint a teljes prosztataráké (2. táblázat).
Köszönhető ez részben annak is, hogy míg a betegség korábbi stádiumaiban még számos, a túlélést tekintve is hatásos terápiás lehetőség érhető el a betegek számára, ezek későbbi terápiás vonalakban történő újbóli alkalmazása, az esetlegesen kialakuló rezisztencia miatt már kevésbé hatékony, illetve a beteg általános állapota is befolyásolhatja egyes terápiák alkalmazhatóságát.
Betegségteher bemutatása
A betegségteher bemutatása szisztematikus irodalomkutatás alapján
Az előző fejezetek alapján belátható, hogy a radioligand-kezelésekkel érintett mCRPC-terület sajátosságai miatt igen eltérő terheket róhat a betegekre, illetve a korlátos kezelési alternatíva finanszírozási szempontból is eltérő az alapbetegséghez képest.
Az irodalomkutatásunk alátámasztja, hogy a vizsgált előrehaladott betegségstádiumban a jelenleg használt terápiák többsége hazánkban is elérhető és finanszírozott. Ugyanakkor ezek terápiás hatása mérsékelt, mindemellett mellékhatásprofiljuk tolerálható. Ennek okán, bár egyelőre nagyobb anyagi terhet róhatnak a finanszírozóra, az új, innovatív radioligand-terápiák hiányában szűkösek azok a terápiás alternatívák, amelyek jelentős életminőség-javulást hozhatnak.
A betegség kezdeti szakaszában a betegségteher és a gazdasági teher is viszonylag alacsonyabb, a betegek a kezdeti nyomonkövetés alatt tünetmentesek, az egészségügyi költségek minimálisak.
A betegség előrehaladtával megjelennek az első tünetek, amik a betegek életminőségét rontják és ezek a betegség előrehaladtával egyre nagyobb terhet rónak a betegre és az ellátórendszerre is.
Ilyen, a betegséggel összefüggő tünetek és szövődmények a betegek mindennapjait megnehezítő vagy akár ellehetetlenítő inkontinencia, a csontrendszer érintettsége miatti fájdalom és mozgási korlátozottság.
A tünetek miatti folyamatos és egyre növekvő pszichés és fizikális terhelés a betegek inaktivitását eredményezheti, ami elhízáshoz, az állóképesség és mobilitási képesség fokozatos elvesztéséhez vezethet. Idővel elvész a betegek munkaképessége is, ami már nemcsak az egészségügyre, de a teljes nemzetgazdaságra jelentős negatív hatásokat fejt ki.
Amennyiben áttétek jelennek meg, úgy a betegek állapota és életminősége is drasztikusan zuhan, a csont és szervi fájdalom pedig elviselhetetlen terhet jelenthet a betegek számára.
Az ellátórendszer szempontjából a betegség előrehaladtával egyre szűkül az ellátási paletta, a korábban már alkalmazott kezelések egyre kevésbé lesznek hatékonyak az előrehaladott stádiumú betegeken, miközben a költségek egyre magasabbak lehetnek.
Az imént bemutatott betegségteher költségszámítására a radioligand-kezelésekkel érintett prosztatarákos betegségterületen szisztematikus irodalomkutatást végeztünk, ahol a PubMed adatbázisában olyan tanulmányokat kerestünk, amelyek a prosztatarákon belül a radioligand-kezelésekkel érintett terület betegségterheit és költségeit vizsgálják meg.
Az angol nyelvű cikkeket vizsgáltuk és mivel ez a terápiás megoldás meglehetősen új keletű, ezért keresésünket az elmúlt 10 évre korlátoztuk, tehát a 2013–2023 időszakra.
Az első 2023-ban készült tanulmányban Mehrens és munkatársai költséghatékonysági elemzésben vetették össze a 177Lu-PSMA-617 radioligand-terápiát a standardterápiával 813 mCRPC-beteget bevonó randomizált III. fázis klinikai vizsgálat adatai alapján az Egyesült Államokban (19).
A standardterápiák között szerepelt a sugárterápia és különböző gyógyszeres kezelések, a SoC terápiás karon ez túlnyomórészt (83,9 százalék) az alacsony költségű, de a betegség ezen fázisában már alacsony hatásosságú hormonterápiákat jelentette. Időtávnak 5 éves időtávot vettek, amely időtáv végére a költséghatékonysági modell alapján a betegek több mint 99 százaléka már elhunyt. Az ötéves időtávon a 177Lu-PSMA-617 83 712 dollár többletköltséget jelentett a standardterápiához képest (összesen 169 110 dollár), miközben 0,42 többlet életminőséggel korrigált életévet hozott a betegek számára (összesen 0,53 QALY) Ez összességében azt jelenti, hogy az inkrementális költséghatékonysági ráta életminőséggel korrigált életévenként 200 708 dollár volt (19) (6. ábra).
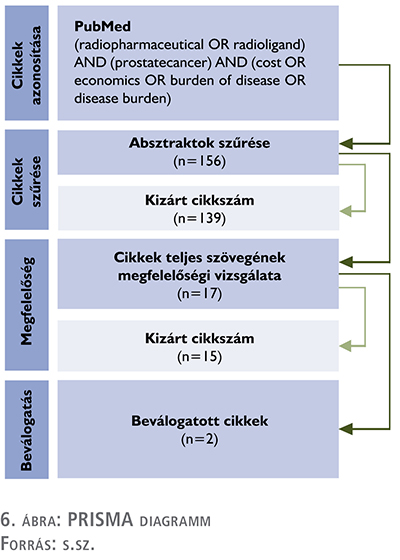
A PubMed kulcsszó algoritmusunk a következő volt: (radiopharmaceutical OR radioligand) AND (prostate cancer) AND (cost OR economics OR burden of disease OR disease burden).
A keresés összesen 156 találatot eredményezett, ezek mindegyikének megvizsgáltuk az absztraktját. Az összefoglalók vizsgálata után összesen 17 tanulmány teljes szöveges vizsgálatát végeztük el, ezek közül a témában való relevancia hiánya miatt 15 tanulmányt zártunk ki a kutatásból, elsősorban mert nem tartalmaztak költségekre vonatkozó adatokat. Ennek eredményeképp két cikket vontunk be a vizsgálatba, amelynek eredményeit foglaltuk össze.
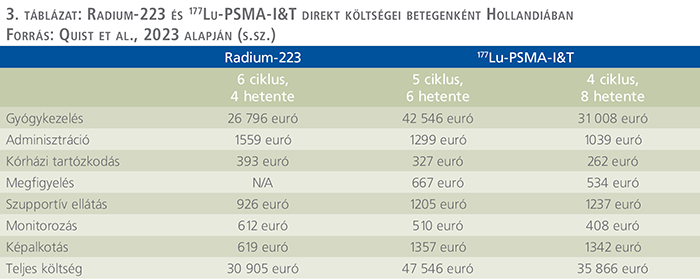
A második beválogatott, 2023-ban készült tanulmányban Quist és munkatársai a radium-223 és a 177Lu-PSMA-I&T (nem azonos a 177Lu-PSMA-617-tel) terápiák direkt egészségügyi költségeit vizsgálták meg holland kórházakban. A radium-223 esetén az adagolás összesen 6 injekció volt négyhetente, míg a 177Lu-PSMA-I&T esetén összesen 5 injekció négyhetente, vagy összesen 4 injekció nyolchetente. Minden direkt egészségügyi költséget figyelembe vettek, mint gyógykezelés, adminisztráció, kórházi tartózkodás költsége, megfigyelés, szupportív ellátás, monitorozás, képalkotás.
A kezelési ciklus alatt a radium-223 teljes direkt egészségügyi költsége 30 905 euró volt, míg a 177Lu-PSMA-I&T 5 injekció/négyhetes ciklusa 47 546 euró, 4 injekció/nyolchetes ciklusa
35 866 euró. Mindegyik esetben a gyógykezelés költségei jelentették a legmagasabb költséget (26 796 euró, 42 546 euró, 31 008 euró) (20).
Az első tanulmány alapján, a prosztatarák területén alkalmazott radioligand-terápiák költsége a betegek várható ötéves túlélésére alapozva 2021-ben 169 110 dollár volt, ez akkori árfolyamon számolva (MNB középárfolyam alapján 303,29 Ft/1 dollár) 51 289 372 Ft betegenként. A két ország vásárlóerő paritását is figyelembe véve (KSH alapján USA GDP/fő 2021: 70 160 USD; HU GDP/fő 2021: 37 433 USD) a kezelés költsége egy betegre 27 364 810 Ft (21). Eközben a jelenleg alkalmazott standardterápia költsége ugyanezen időtávon betegenként
85 398 dollár volt, ez forintra vetítve 25 900 359 Ft, ami vásárlóerő paritáson 13 818 816 Ft.
Ez azt jelenti, hogy 0,42 értékű többlet QALY a becslés szerint 13 545 994 Ft többletköltségért érhető el, ha a standardterápia helyett 177Lu-PSMA-617 kezelést alkalmaznak, ez tehát azt jelenti, hogy 1 életminőséggel korrigált életév 32 252 367 Ft. többletráfordítással érhető el.
A második tanulmány alapján a vizsgált 3 terápiás ciklus 1 betegre vetített átlagos teljes direkt egészségügyi költsége 2023-ban 38 106 euró a Radium-223 és a 177Lu-PSMA-I&T terápiákat figyelembe véve. Ez a 2023-as euró középárfolyamon számolva (MNB középárfolyam alapján 358,52 Ft/1 euró) 13 661 763 Ft.
A két ország vásárlóerő paritását is figyelembe véve (KSH alapján Hollandia GDP/fő 2022: 69 963 USD; HU GDP/fő 2022:
42 044 USD) a kezelés költsége egy betegre egy teljes ciklusra
8 209 985 Ft (3. táblázat).
Egyéb források
A szisztematikus irodalomkutatás alapján a radioligand-kezelések direkt költségeire vonatkozó adatokat tudtuk feltárni, azonban az irodalomkutatás során nem akadtunk olyan tanulmányra, amely számításba vette volna a betegségterülettel kapcsolatos indirekt egészségügyi költségeket, vagy a nem feltétlenül radioligand-kezelések alkalmazása során számított direkt egészségügyi költségeket. Emiatt kiegészítő kutatást végeztünk olyan evidencia azonosítása érdekében, amely segíthet ennek feltárásában.
Dragomir és munkatársai 2014-es vizsgálatukban két eltérő szcenárió alapján 193 604 000 és 416 284 000 kanadai dollár közé becsülték az mCRPC teljes költségét Kanadában (22).
Restelli és munkatársai maguk is elvégeztek egy szisztematikus irodalomkutatást 2017-ben, azzal a célzattal, hogy felmérjék az mCRPC költségeit (23). Kutatásukban csupán egy releváns tanulmányt találtak a témában.
Restelliék tanulmányukban maguk végeztek becslést az olasz ellátórendszer éves direkt egészségügyi költségeire prevalencia alapon azon betegek körében, akik első- vagy másodvonalbeli terápiában részesültek. A teljes mCRPC-ben érintett betegszámot 9700-ra becsülték 2016-ra.
Számításaik alapján a 9700 betegre vonatkozó éves direkt egészségügyi költség 2016-ban 195,5 millió euró és 228 millió euró között volt. Ez egy betegre vetítve éves szinten 20 155–
23 506 euró közé tehető.
Ez forintra vetítve (MNB középárfolyam alapján 311,46 Ft/1 euró) 6 277 476–7 321 178 Ft, vásárlóerő paritást is figyelembe véve (KSH alapján Olaszország GDP/fő 2016: 40 231 USD; HU GDP/fő 2016: 27 894 USD) 4 352 462–5 076 109 Ft/beteg/év.
Ezen egy betegre eső költség hazai extrapolációja alapján a korábban bemutatott prevalenciaadatokkal számolva (2016-ban becsült mCRPC betegszám 3213 fő) 2016-ban akár a 10 milliárd Ft-ot is meghaladhatta az mCRPC direkt egészségügyi költsége hazánkban.
Nemzetközi és hazai ellátási környezet
Prosztatarák szűrése
A prosztatarák korai felismerése minden prosztatarákkal kapcsolatos átfogó anyag marginális pontja, ugyanis a betegség kezdeti stádiumban nagyon jól kontrollálható. A prosztatarák szűrésével kapcsolatban azonban megoszlik a szakemberek véleménye, hogy mely életévtől lenne célszerű a férfitársadalom szűrése. A túl korai időpont kitűzése a betegség túl-, a túl kései időpont kitűzése a betegség aluldiagnosztizálását eredményezheti. Az első szűrés, a családi halmozódás függvényében, 40-50 éves kor felett javasolt.
A szűrés általában a világban mindenhol rektális digitális vizsgálat (RDV) útján történik, ahol a vizsgálatot végző szakember kitapintásos módszerrel igyekszik meggyőződni a prosztata állapotáról.
A kezdeti szűrési regimentet képezi ezen túlmenően a prosztataspecifikus antigén (PSA) vérben történő megállapítása, amelynek emelkedett szintje jól előrejelezheti a prosztatarák kialakulását, ugyanakkor önmagában nem bír teljes meggyőző erővel. Előrehaladott prosztatarák esetén a szakemberek számára mind az RDV, mind a PSA-szint vizsgálata gyanút keltő eredményre kell vezessen.
Prosztatarák diagnosztikája
A szűréseket követően a gyanús eseteket tűbiopszia útján lehet diagnosztizálni, jelenleg ez a prosztatarák diagnózis felállításának egyetlen elfogadott módja.
A diagnózis pontosításában nagy szerepe van a képalkotó vizsgálatoknak. Ennek hagyományos eszközei a transzrektális ultrahangvizsgálat, amely akár a biopszia elvégzésében is segítsége lehet a vizsgálatot végző szakembernek. Modernebb vizsgálati lehetőség a multiparametrikus mágneses rezonancia vizsgálat (mpMRI), amely a lokalizált prosztatarák diagnosztizálásában képes hathatós segítséget nyújtani, vagy az ultrahangos módszerhez hasonlóan segíthet a biopszia pontosabb elvégzésében is.
Előrehaladottabb betegségállapotban CT- és MR-vizsgálatokkal feltérképezhető a távoli áttét helye, jellege. Nukleáris medicina módszerek (SPECT/CT, PET/CT) megfelelő radiofarmakonok alkalmazásával tovább pontosíthatják az eredményt.
A radiofarmakonoknak nagyon fontos és egyre növekvő szerepe van a kezelések mellett a diagnosztikában is (Lásd később PSMA PET/CT).
Csontmetasztázis jelenlétét a 99mTc-mal jelzett bifoszfonát radiofarmakonokkal végzett csontszcintigráfia-vizsgálat igazolhatja. A prosztatarákban érintett sejtek sajátosságai miatt növekszik a PET/CT-módszer alkalmazhatósága, egyes radiofarmakonokat a ligandjuk jellemzői miatt a tumorsejtek általánosan nagy arányban felvesznek, míg más radiofarmakonok jobban használhatóak csontérintettség esetén.
Prosztatarák esetén a legtöbb daganatban kimutatható a prosztataspecifikus membrán antigén (PSMA) fokozott sejtfelszíni kifejeződése, ráadásul minél előrehaladottabb a betegség állapota, annál magasabb szinten.
Ennek köszönhetően a radioizótóppal jelölt PSMA ligand jobban koncentrálódik a prosztatarákkal érintett területeken. Fentebbiek okán a radioizotóppal jelölt PSMA PET/CT, vagy SPECT/CT hatékony vizsgálati módja a prosztataráknak. A PET/MR a jobb lágyszöveti kontraszttal rendelkezik, ami pontosabb anatómiai megítélést biztosít.
Prosztatarák kezelése
A prosztatarák kezelésében jelenlegi indikációjuk miatt a radioligand-terápiák a betegség lefolyását tekintve a metasztatikus kasztrációrezisztens prosztatarák későbbi fázisában jelennek meg, a törzskönyvező vizsgálatok alapján új generációs hormonterápia (más néven androgénreceptor target terápia – ARTA) és docetaxel kemoterápia után, amikor a betegek életkilátásai szerényebbek.
A prosztatarák kezelési algoritmusát részletesen és rendszeresen frissítve az Európai Urológiai Társaság (EAU) irányelve mutatja be. Ez röviden összefoglalva a következő:
Korai stádiumú, alacsony rizikójú prosztatarák esetén a radikális prostatectomia, a definitív sugárkezelés és az aktív követés azonos túlélést eredményez. A prosztatarák kezdetben tünetmentes lehet, aktív követés és rendszeres kontrollok mellett biztonsággal megfigyelhető. Amennyiben az ellenőrzések során a betegség romlása tapasztalható, és közepes rizikójúvá válik, definitív ellátás szükséges műtét vagy sugárkezelés formájában.
Ha a betegség felismerése közepes vagy magas rizikójú, de távoli áttétektől mentes stádiumban történik, szükséges a definitív ellátás megkezdése. A sugárkezelés mellett rizikótól függő időtartamban androgéndeprivációs kezelés (ADT) alkalmazása is szükséges.
Ha a hormonterápia alkalmazása mellett, vagy a leállítása után a prosztatarák stádiuma romlik, PSA-emelkedés vagy áttétek jelentkeznek, a hormonterápia újraindítása vagy folytatása mellett a betegségkontroll alatt tartásához kiegészítő kezelésként új generációs hormonterápia vagy kemoterápia alkalmazható.
Az áttétes prosztatarák esetén akár életvégig alkalmazható androgéndeprivációs terápia szükséges, amely a kezelés alapeleme. Ha a betegség áttétesen kerül felismerésre, az kedvezőtlenebb prognózist jelent, szükséges az ADT mellett ARTA vagy akár docetaxel együttes alkalmazása is.
Amennyiben a betegség hormonterápiára már nem reagál, tehát a tesztoszteronszint kasztrációs érték alatt tartása ellenére a betegség progrediál és áttétek is kimutathatóak, úgy a betegség kasztrációrezisztens metasztatikus prosztatarák (mCRPC) fázisba lép át. Ha csak csontmetasztázis detektálható, akkor választható radium-223 alfa izotóp terápia.
Ha megelőző taxánalapú kemoterápia történt, de új generációs hormonterápia nem, akkor annak alkalmazása javasolt.
Új terápiás lehetőséget jelentenek a PARP-inhibitorok az ARTA-kezeléssel kombinálva, amelyből számos beteg, de legjobban a BRCA-mutációval rendelkezők profitálnak.
Ha megelőző ARTA-hormonterápia történt, de taxánalapú kemoterápia nem, akkor a taxánalapú kemoterápia megfontolása mellett BRCA-mutáns esetekben a PARP-gátló olaparib-monoterápia, vagy csak csontmetasztázis esetén radium-223 alkalmazása választható.
2022 márciusában az FDA, majd decemberében az EMA is törzskönyvezte a lutécium(177Lu)-vipivotid-tetraxetán PSMA ligandalapú bétasugárzó izotópkezelést az mCRPC terápiájában, ami az USA-ban már alkalmazható, Európában pedig elindult az egyes országok hatóságai által a készítmény engedélyeztetése és ezután a használata a törzskönyvi iránymutatásnak megfelelően.
Amennyiben mind új generációs hormonterápia, mind taxánalapú kemoterápia képezte már a megelőző kezelések részét, úgy PSMA-pozitív betegség esetén a 177Lu-PSMA-617 radioligand-kezelés választható a betegeknek. 2. fázis vizsgálat alapján a tumorválasz aránya kedvezőbb, mint kabazitaxel kemoterápiával, hasonló túlélési eredmény mellett.
Egyéb kezelési alternatívák lehetnek taxánalapú kemoterápiák, vagy mitoxantron, valamint, ha korábban nem történt, BRCA-mutáns esetben PARP-gátlók, illetve csontmetasztázis esetén radium-223 (24).
Hazai radioligand kezelési lehetőségek
A teranosztikai gyógyszerfejlesztés új lehetőséget nyitott meg az onkológiai terápiák terén. A teranosztikum kifejezés a terapeutikum és diagnosztikum szavak kombinációjából alakult ki, olyan radioaktív gyógyszerekre alkalmazzák, amelyek gamma- vagy pozitronsugárzó radioizotóppal jelölve diagnosztikai és béta- vagy újabban alfasugárzó radioizotóppal jelölve terápiás célra használhatók (25).
Magyarországon a prosztatarák ellátásában radioligand kezelési lehetőségként a radium-223 kezelés érhető el, amely kezeléshez a betegek járóbeteg-ellátás keretében férhetnek hozzá, finanszírozása pedig tételes finanszírozási formában történik.
Mint az előbbi fejezetben olvasható, a hazai ellátásra is igaz az, hogy ehhez a kezeléshez, mint radioligand kezelési alternatívához a betegeknek csak a betegség igen késői mCRPC-fázisában van lehetőségük hozzáférni, ami a korábban bemutatott mCRPC hazai incidenciája alapján körülbelül 790 új beteget érinthet évente. Ezt a számot jelentősen szűkíti az egyes konkrét terápiák indikációja, amely jelen esetben csupán egy indikációt jelent hazánkban, csontmetasztázishoz köthetően. Eddigre a betegek már számos más kezelésben részesültek, állapotuk leromlott, életkilátásaik rosszak, a legtöbb beteg számára más, az életkilátásaikat érdemben javító terápia ekkor már nem elérhető, és esetleges csont- és más jellegű áttéteik miatt fokozott fájdalmat kell elviselniük, ráadásul nem csont-, hanem egyéb áttét esetén ez a terápia nem alkalmazható.
Ilyen esetekben a betegek számára csak a hagyományos kemoterápiák sokadik vonala nyújthat némi támogatást, mérsékelt hatékonyság és kedvezőtlen életkilátások mellett. Ezek a terápiák ebben a betegállapotban nem, vagy csak csekély életminőségbeli javulást eredményeznek, általánosan kedvezőtlen mellékhatásprofiljuk miatt megterhelőek a betegek számára.
Fentieken túl a betegek számára alternatívát jelenthetnek a radioligand kezelési lehetőségek. Magyarországon jelenleg indikációval a radium-223 kezelés rendelkezik, illetve várható a közeljövőben az FDA és az EMA által már jóváhagyott lutécium (177Lu)-vipivotid-tetraxetán indikációja.
A radium-223 kezelés metasztatikus kasztrációrezisztens prosztatarákban adható, amennyiben a beteg tünetekkel járó csontáttéttel rendelkezik, abszolút neutrofilszáma ≥1,5×109/l, thrombocytaszáma ≥ 100×109/l, hemoglobinszintje ≥10,0 g/dl valamint ECOG-státusza 2022 márciusában az FDA, majd decemberében az EMA is jóváhagyta a lutécium (177Lu)-vipivotid-tetraxetán kezelést, amely az EMA jóváhagyásának köszönhetően hamarosan akár a magyar betegek számára is elérhető lehet mCRPC-ben.
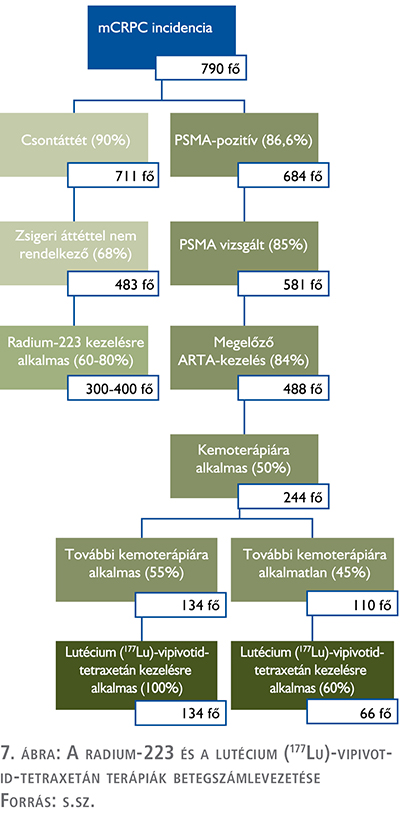
Alább a két készítmény potenciális hazai betegszámait vezetjük le. A korábban bemutatott mCRPC incidenciaadatokból kiindulva Magyarországon évi 790 mCRPC-ben szenvedő új beteg jelenik meg.
n Radium-223 kezelés esetén a csontáttétben szenvedő betegekre kell szűkíteni, amely populáció Hotte és szerzőtársai alapján az mCRPC-betegek 90 százalék, tehát esetünkben 711 beteg évente. Ezen betegek közül azonban indikáció szerint nem kaphatnak radium-223 kezelést a zsigeri áttéttel rendelkező betegek, akik Grobet-Jeandin és munkatársai alapján a csontáttétes betegek 32 százalékát teszi ki. Ezzel 483 főre szűkül a radium-223-mal kezelhető betegek éves száma. Emellett a betegeknek a kezeléshez kielégítő állapotúnak kell lennie, ami becsléseink alapján 300-400 betegre szűkíti a maximálisan kezelhető évi populációt (27, 28).
n Lutécium (177Lu)-vipivotid-tetraxetán esetén az mCRPC tényén túl első körben vizsgálni kell a betegek PSMA pozitivitását, ugyanis csak a PSMA-pozitív betegek esetén lehet alternatíva a kezelés. Sartor és munkatársai alapján ez a betegek 86,6 százalékáról mondható el, így a 790 fős évi betegszám 684 főre szűkül (29).
Ezt követően vizsgálni kell azt is, hogy a betegek hány százalékán végzik el ezt a vizsgálatot, amely becslésünk szerint 85 százalék, így tovább, 581 főre szűkül a betegszám. A terápia indikációja szerint azon betegeknél folytatható le, akiknek volt megelőző ARTA-kezelésben részük, ami becsléseink szerint a betegek 84 százaléka, tehát 488 főre csökken a betegszám. Korábbi technológiaértékelés alapján ezen betegek 50 százaléka részesül taxánkezelésben, míg 50 százalék erre orvosilag alkalmatlan, nem kezelhető, így 244-re szűkül a potenciális betegszám (30). A technológiaértékelés alapján a kezelt betegek 55 százaléka további kemoterápiára is alkalmas, így lutécium (177Lu)-vipivotid-tetraxetán terápiára is alkalmasak. A fennmaradó 45 százaléknak szakértői becslés alapján csak a 60 százaléka lesz alkalmas a terápiára, így a teljes becsült potenciális betegszám ~ 200 fő (7. ábra).
A szakértői interjúk eredménye
A szakértői panel összetétele (4. táblázat)
Az ajánlások megfogalmazásához a radioligand-kezelésekben érintett szereplőkkel összesen 18 mélyinterjút készítettünk.
Az interjúkban kitértünk a radioligand terápiák általános ismertségére a betegek és a szakemberek részéről, a különböző érintettek szerepére a területtel kapcsolatos kommunikációban, tudásátadásban, az interjúalanyok segítségével azonosítottuk a terület sajátosságait, erősségeit, kihívásait, fejlődési lehetőségeit, majd ezek értékelésével javaslatokat fogalmaztunk meg az ellátás ezen területének javítása céljából.
Szakemberek felkészültsége
A megkérdezettek összességében inkább jónak ítélték a magyar orvosok felkészültségét a témában azzal kiegészítve, hogy az ellátás csúcsát jelentő centrumokban, illetve azon orvosok (urológusok, onkológusok, nukleáris medicina szakorvosok) esetében a legmagasabb az ezzel kapcsolatos tudásanyag ismerete, akik rendszeres résztvevői a szakmai konferenciáknak.
Kevéssé biztos a területen azon szakemberek tudása, akik nem követik ilyen szinten az újításokat, az új szakmai iránymutatásokat. Emiatt a hazai orvosszakma radioligand-terápiákkal kapcsolatos ismereteit összességében 3,67 pontra értékelték egy 1–5 skálán, ahol a 0 az ismeretek teljes hiányára, 5 az ismeretek teljes meglétére utal (8. ábra).

Az egyes szakemberek hozzáértésén túl elengedhetetlen a terápiában érintett szakemberek közvetlen és tartós együttműködése. A prosztatarák kezelésében előbb az urológia és az onkológia együttműködésére volt szükség, amelyhez később csatlakozott a radiológia, ugyanakkor a radioligand-terápiás megoldások esetén elengedhetetlen a nukleáris medicina integrálása a multidiszciplináris betegellátásba. Minden új szereplő belépésével kérdések merülnek fel a betegutat érintően, amelyeket tisztázni kell: más osztályra utalással a betegek ideiglenesen kikerülnek az onkológusok látóköréből, emiatt tisztázni érdemes, hogy amennyiben a nukleáris medicina állapotromlást vagy szövődményeket tapasztal, kinek a feladata lesz ennek kezelése, hogyan értesül erről az onkológus, egyáltalán hogyan alakul a kapcsolattartás a beteggel, míg más szakma alá van utalva (9. ábra).
A radioligand kezelések ismertsége
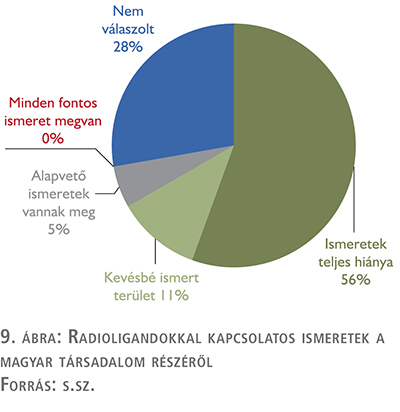
Az interjúalanyok többségében úgy ítélték meg, hogy a radioligand-terápiákkal kapcsolatban az ismeretek teljes hiánya tapasztalható a társadalomban.
Véleményük szerint a betegek a kemoterápia és a sugárterápia létezésével egyébként többségében tisztában vannak, de az egyéb kezelési alternatívákat döntően nem ismerik.
Az ismeretek hiánya miatt különösebben nem tekintenek máshogy a kezelésre, mint a soron következő gyógyszeres kezelésre. Emiatt örülnek is neki, sok betegnek ugyanis ezek a terápiák jelenthetik az utolsó lehetőséget.
Amint megkapják a betegek a terápiával kapcsolatos információkat, el tudják helyezni a kezelést az újabb terápiák közé, és lelkesek az ígért eredményei miatt.
Ezen ismeretek átadása az interjúalanyok többsége szerint az orvosok feladata, ugyanis a legfontosabb információkat csak a kezelésben jártas szakemberek tudják átadni, a betegeknek a szakemberektől kell megtudnia, hogy milyen előnyökben részesülhetnek, milyen különös óvintézkedésekre kell odafigyelni, és milyen mellékhatásokra kell számítani.
Ezen túlmenően fontos lehet a betegszervezetek szerepe is, amelyek betölthetik azt a szerepet, hogy a terápiával kapcsolatos általános tévhiteket, félinformációkat eloszlassák, megosszák a terápiával kapcsolatos általános betegtapasztalatokat, vagy az orvosokkal szoros együttműködésben olyan kiadványokat, tájékoztató anyagokat készítsenek, előadásokat szervezzenek, amivel segíthetik a betegek tájékozódását. Ha ugyanis a betegek magukra maradnak az információszerzésben, könnyen álhírekre és félinformációkra alapozhatják a terápiával kapcsolatos döntéseiket, amely csökkentheti az együttműködési hajlandóságukat.
Az orvosok és a betegszervezetek kapcsolata általánosságban jónak mondható, ugyanakkor a radioligand-terápiák specialistáinak számító nukleáris medicina szakemberekkel, akik a legjobban képesek lennének a területen releváns tudást átadni, jelenleg még szórványos a kapcsolat.
Egyes vélemények szerint ez arra is rámutat, hogy a betegszervezeteknek még van hová fejlődnie hazánkban, ugyanis a szakmával való jó kapcsolat kiépítésében a többség szerint az első lépést a betegszervezetnek kell megtennie, nem jellemző az, hogy egy előadás vagy kiadvány céljából az orvos keresse fel a szervezetet, fordítva volna természetes.
A megkérdezettek többsége szerint a betegszervezeteknek fontos szerepet kellene kapniuk, ugyanis nemcsak a betegek tudatosításában van szerepük, hanem a finanszírozó és a döntéshozók felé a betegek és azok hozzátartozóinak érdekének képviselői is lehetnének.
Ha a betegek eljutnak a radioligand-kezelésekig, örülnek az új lehetőségnek, de vannak olyan tényezők, ami miatt megriadhatnak tőle.
Az esetleges félelmek mögötti fő motiváció a sugárzással kapcsolatos kedvezőtlen asszociációk. Az ezzel kapcsolatos tévhitek eloszlatása után a betegek együttműködőek, mi több, a sugárveszély egyfajta nyomatékod tud adni a kezeléssel kapcsolatos, esetlegesen kényelmetlen óvintézkedések betartásának. Tovább támogatja a betegek együttműködését, hogy a radioligandok indikálhatósága miatt a kezelésre alkalmas betegek már túl vannak számos megelőző terápiás lehetőségen, azok minden negatívumával, esetleges mellékhatásaival együtt. Ezzel szemben a radioligand-kezelések a speciális óvintézkedésektől eltekintve nem különböznek más kezelésektől, mellékhatásprofiljuk sok esetben kedvezőbb is lehet, mint a hagyományos terápiáknak.
Az alanyok jelentős része szerint ahhoz, hogy a betegek eljussanak ezekig a terápiás lehetőségekig és hogy közben ne morzsolódjanak le a rendszer valamelyik részében elengedhetetlen, hogy a betegek megkapjanak minden szükséges információt, amihez szükség van a kezelésben érintett orvosok felkészültségére.
Az elérhető kapacitásokról
A megkérdezettek egy része szerint a radioligand-kezelésekkel kapcsolatban – ha most nem lépünk – akkor a jövőben hatalmas kapacitási gondok lehetnek, ugyanis a terület most van feltörőben. 2022 márciusában az FDA, majd decemberében az EMA is jóváhagyta a lutécium (177Lu)-vipivotid-tetraxetán PSMA ligandalapú kezelést mCRPC területén, így ez akár hamarosan itthon is elérhetővé válhat, és egyre több ilyen kezelési forma fog érkezni más daganatok esetén is. Ez előbb-utóbb a radioligand-kezelések egyre szélesebb körű állami finanszírozását is eredményezheti, amire fel kell készíteni az infrastruktúrát. Többek szerint már most el kell kezdeni a meglévő centrumok fejlesztését és új centrumok kialakítását.
Az alanyok egy része szerint az is kulcskérdés, hogy az új kezelések járó- vagy fekvőbeteg-ellátás keretében fognak megvalósulni.
Az alacsony felezési idejű izotópot (pl. 177Lu) alkalmazó kezeléseknél a szakemberek szerint a beteg állapotát is figyelembe véve kúraszerű ellátásban érdemes gondolkozni, míg a hosszabb felezési idejű izotópok alkalmazása során szükségessé válhat a speciális izotópterápiás osztályon történő fekvőbetegellátás (sugárvédelmi előírások szerint). Emellett a beteg állapota is szükségessé teheti a fekvőbeteg osztályra való felvételt is. Ezért tehát kellően rugalmas finanszírozási megoldás szükséges.
Diagnosztikai kihívások
Az ellátásokkal kapcsolatos kapacitáskérdések mellett ugyancsak kritikus az ellátásokhoz e területen a hagyományosnál is szorosabb kapcsolatban lévő diagnosztika kapacitáskérdések. Ezek a közeljövőben hasonló kihívásokkal, növekvő igénnyel néznek majd szembe. Számos radioligand-kezelés ugyanis szorosan kapcsolódik az adott (diagnosztikus izotóppal jelölt) ligand alkalmazásán alapuló diagnosztikai eljáráshoz. Ilyen a PSMA PET/CT esete is, amely lényegében eldönti a PSMA-alapú ligandok kezelési alternatívaként való alkalmazhatóságát. Ha tehát a jövőben megnő a radioligand-kezelések alkalmazása, az szükségszerűen magával hozza majd a kapcsolódó diagnosztikai kapacitások bővítésének igényét is.
Jelenleg a PSMA PET/CT hazai alkalmazására csak egyedi méltányossági kérelem útján van lehetőség.
Ez a jövőben megnövekedő alkalmazásnak jelentős adminisztratív gátat szabhat. A valós elbírálás jellemzően két hét, de az eljárásban jártas alanyaink szerint az optimális elbírálási idő nem lehetne több 3 napnál. Alternatív diagnosztikai megoldás lehet a PSMA SPECT/CT.
De nem csupán az adminisztráció okoz gondot a területen, nehézkes hozzájutni a vizsgálathoz szükséges radiofarmakonhoz is. Ha a jövőben elérhető lenne egy erre alkalmas radiofarmakon, akkor a jelenleginél több nukleáris medicina centrum is bevonható lenne a betegkiválasztásba. Továbbá a diagnosztika finanszírozása sem megoldott, a hozzárendelt finanszírozás nem fedezi a diagnosztika és az ahhoz szükséges izotóp együttes költségét.
Az ellátórendszerrel kapcsolatos észrevételek
A radioligand-kezelések finanszírozása kérdésében megosztó volt a megkérdezettek véleménye: van, aki kezdetben mindenképp egyedi méltányosság keretében gondolná a finanszírozást, később pedig tételes finanszírozás keretében. Ezzel szemben van, aki nem önmagában a készítményt finanszírozná, hanem a teljes ellátáshoz javasolna létrehozni egy dedikált HBCs kódot, amelyben már tartalmazza a beadás és a diagnosztika költségét is.
Ugyanakkor törekedni kell arra is, hogy azon PSMA PET/CT (esetleg SPECT/CT) vizsgálatok finanszírozása is megoldott legyen, amelyeknek nincs terápiás következménye.
Összegezve a következőképpen látták az alanyok az ellátást 9 szempont alapján:
Az alanyok a legkritikusabb területnek 4,6-es pontérték mellett a szervezetekkel való együttműködést jelölték meg.
Az alanyok a második legkritikusabb területnek 5,2-es pontértékkel az integrált, jól szervezett betegutak középszerűségét jelölték meg.
Az ellátáshoz való egyenlő hozzáférés (5,4) szintén problematikus, kiemelve, hogy a legmagasabb szintű ellátás általában jól elérhető a centrumokban, de a legjobb centrumokban sincs mindig integráltan jelen a nukleáris medicina (10. ábra).
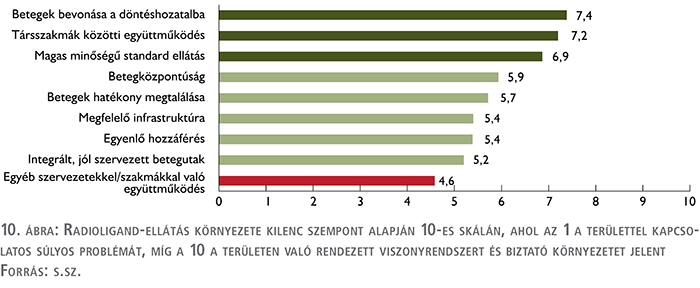
A negyedik legkritikusabb területnek a megfelelő infrastrukturális környezet bizonyult 5,4-es pontérték mellett, amelynek okait fentebb már kifejtettük, ötödik legkritikusabb területnek pedig az érintett betegkör megtalálása bizonyult 5,7-es pontértékkel.
Pontértékét tekintve a kevésbé problémás területek között szerepelt 5,9 ponttal negyedik helyen a betegközpontúság, mivel a megkérdezettek szerint ez az orvosok részéről alapvetően biztosított. 6,9 ponttal harmadik helyen az ellátás magas minősége végzett, itt a megkérdezettek a jól felszerelt központokat és a kiválóan képzett szakembereket emelték ki. 7,2 ponttal második helyen a társszakmák együttműködése végzett, amelyben bár a nukleáris medicina fokozottabb bevonásával van hova fejlődni, az urológus-onkológus szakmák együttműködését mára példaértékűnek ítélték. 7,4 ponttal első helyen a betegek döntéshozatalban betöltött szerepe végzett, itt látják az interjúalanyok a legkevesebb problémát, ugyanis azokba a döntési pontokba, ahol a betegnek tényleges elbírálási lehetősége van, ott ez teljesen meg is valósul, míg más területeken (például onkoteam döntések) nincs is szükség fokozottabb bevonásra.
Az interjúalanyok a hazai ellátás erősségei között említették a jól szervezett centrumok meglétét, a magas műtéti felkészültséget, a szakemberek jólképzettségét, az egyedi méltányosság keretében kapható széles körű termékpalettát, és az ellátás ingyenességét.
A hazai ellátás legnagyobb kihívásai között említették az ellátási egyenlőtlenségeket, ami miatt a betegek egy csoportja az ellátás földrajzi egyenlőtlenségei miatt nem részesülhet az ország más pontjain elérhető legmagasabb szintű ellátásban, emiatt akár olyan kezelési lehetőségektől esnek el, amik hónapokkal, akár évekkel meghosszabbíthatnák az életüket. Az egyenlőtlenségek mellett problémaként jelölték meg, hogy hazánkban igen alacsony számban érhetőek el közfinanszírozott radioligand-megoldások, így ha a földrajzi egyenlőtlenség nem is, a terápiás elérhetőség ismételten hónapokat, éveket vehet el a betegektől az optimálishoz képest.
Előbbi mellett hiányosság, hogy a nukleáris medicina reprezentáltsága a hazai szakemberképzésben igen alacsony, emiatt az orvosszakma is kevésbé lehet tájékozott a radioligand-megoldások terén, nem mindig a beteg számára legoptimálisabb döntés születhet meg, amennyiben a szakemberek nincsenek tisztában a terápiás terület adta lehetőségekkel. Szintén kardinális problémának jelölték meg a diagnosztika finanszírozási problémáit, amely miatt a betegek nem, vagy csak korlátozottan férnek hozzá a legmodernebb diagnosztikai megoldásokhoz, a radioligand terápiák kezelésben történő jövőbeli előretörése esetén pedig nem lesz meg a kezelések megkezdéséhez szükséges diagnosztikai háttér.
Szorosan idekapcsolódó problémaként jelölték meg a radioligand diagnosztikai lehetőségek esetén az egyedi méltányossági kérelmek túlbürokratizáltságát, ami miatt a betegek fontos heteket, hónapokat veszíthetnek el a terápia megkezdéséig. Nem feltétlen radioligand-specifikus problémaként kiemelték a szakemberek, hogy a betegutak szervezése sem ideális, sok esetben a betegek leragadhatnak egy-egy kezelésben, ami esetenként azt jelenti a betegek számára, hogy hosszú ideig kedvezőtlen mellékhatásprofilú és kevéssé hatékony, csekély terápiás előnyt nyújtó terápiában ragadhatnak, és el sem juthatnak az ellátás azon fázisába, amelyben részesülhetnének a radioligand-kezelések előnyeiben. Részben előbbihez kapcsolódik a nukleáris medicina szakemberek, és a prosztatarák kezelésében résztvevő többi szakember együttműködése, amely az alanyok szerint még messze nem optimális, hiányzik a nukleáris medicina szorosabb bevonása a terápiás döntésekbe.
Az interjúalanyok a területtel kapcsolatos legjelentősebb fejlesztési lehetőségek között említették, a meglévő Nukleáris Medicina Terápiás Központok kapacitásának bővítését, valamint az egyenlő hozzáférés elve mentén új központok kialakítását. Ezzel párhuzamosan az alanyok szerint szükséges lenne modernizálni a radioligand-területtel kapcsolatos diagnosztikai és kezelési eszközparkot.
Ezt követően pedig megfelelő és folyamatos finanszírozási hátteret kellene biztosítani annak érdekében, hogy a legmodernebb eszközök és terápiák az első modernizálási hullámot követően is folyamatosan elérhetőek legyenek, mind a betegek, mind a rendszerben dolgozó szakemberek számára.
Az alanyok kiemelték, hogy szükség van a nemzetközi irányelvek alapján megalkotott és folyamatosan frissített szakmai irányelvekre, amelyek ugyanakkor figyelembe veszik a hazai ellátás sajátosságait is.
Végezetül több helyen elhangzott, hogy szükséges volna egyszerűsíteni az egyedi méltányossági kérelmek rendszerét, amely a sok esetben hosszúra nyúló átfutási idők miatt késlelteti a terápiák megkezdését.
A legtöbb szaktekintély a következő 5-10 évben a fenti felsorolt aktív kutatások miatt a radioligand-kezelések további térnyerését várja, nemcsak a prosztatarák területén, de más terápiás területeken is. Amennyiben a terápiák hatásossága meggyőző lesz, úgy kombinációban, vagy monoterápiaként is egyre előrébb kerülhetnek az ellátási vonalakban. Amennyiben sikerül a jövőben a PSMA-hoz hasonló gyakori és specifikus biomarkereket más daganattípusok esetében is azonosítani (ahogy azt pl. a neuroendokrin daganatok esetében már sikerült) úgy a populáció igen jelentős része kaphat új, innovatív esélyt a radioligandok alkalmazásával, nemcsak egy szűk betegpopuláció élvezheti majd azokat.
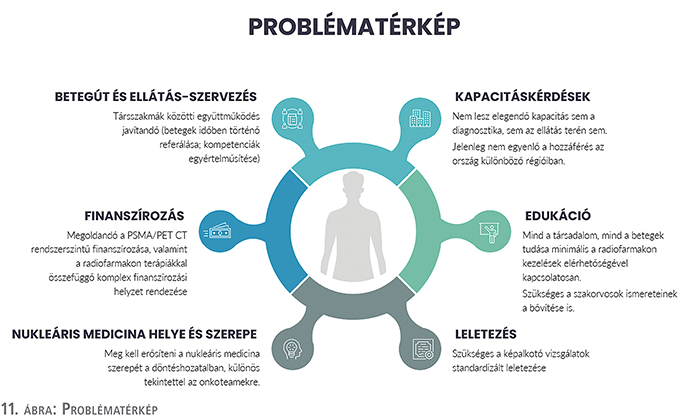
Problématérkép
Az interjúk alapján a jelenlegi rendszer legfőbb kihívásait hat fő kategória mentén csoportosítottuk: betegútmenedzsment, ellátásszervezés és kapacitáskérdések, edukáció, az elkészült leletek standard jó minőségének biztosítása, nukleáris medicina helye és szerepe, valamint a finanszírozás (11. ábra).
Javaslatok
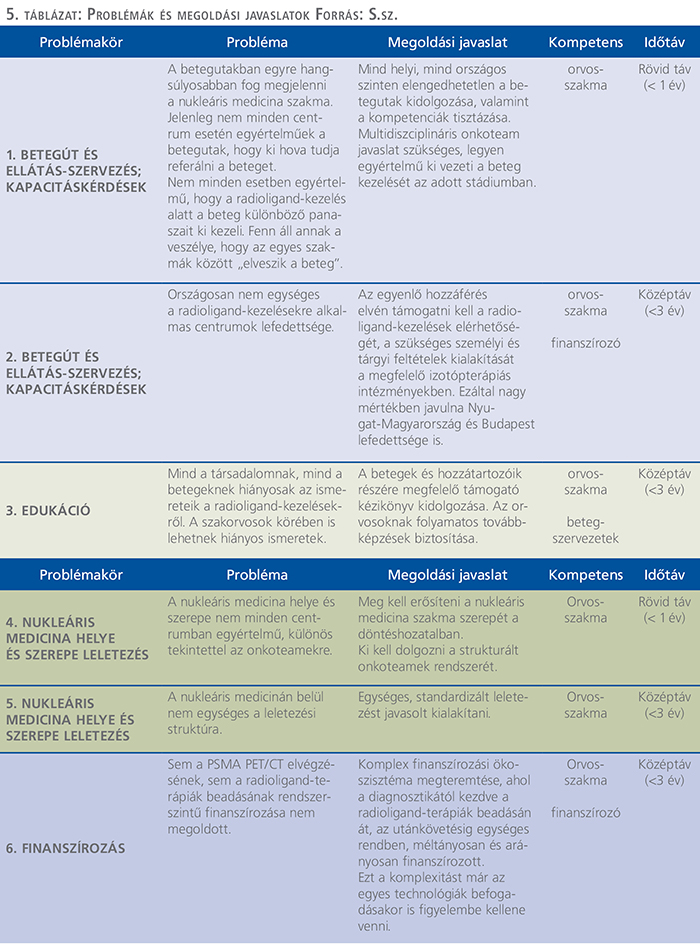
A radioligand-terápiákkal érintett szűkebb mCRPC-betegségterület megismerésével és a lefolytatott interjúk tapasztalatainak összesítésével a következő javaslatokat tesszük annak érdekében, hogy a radioligand-kezelések a jövőben a lehető legkevesebb akadály mellett jussanak el az érintett betegkörhöz:
A következőkben az egyes javaslatainkat fejtjük ki részletesebben (5. táblázat).
Első javaslat ELLÁTÁSSZERVEZÉS
Mind helyi, mind országos szinten elengedhetetlen a betegutak kidolgozása, valamint a kompetenciák tisztázása
Első javaslati pontunk a nukleáris medicina onkoteamekbe való beemelésének, illetve a radioligand diagnosztika és kezelés finanszírozásával kapcsolatos problémák megoldásának eredőjeként a megfelelő szakmai szempontok támasztása mellett olyan országos centrumok kialakítása, amelyekben a prosztatarák ellátásának teljes modern diagnosztikai és kezelési palettája kivitelezhető, ideértve a nukleáris medicinát és a radioligand terápiás lehetőségeket is.
Ennek érdekében mind helyi, mind országos szinten elengedhetetlen a betegutak kidolgozása, valamint a kompetenciák tisztázása.
Legnagyobb kihívást azon ellátóhelyek felkészítése jelenti majd, ahol a diagnosztika és a PSMA-terápia nem elérhető. Itt fontos a kezelőorvosok edukálása, hogy a beteget a megfelelő kompetenciával bíró centrumba referálják. Nekik jelentős segítséget jelenthet az online referálás lehetősége, de ehhez előzetesen az szükséges, hogy a helyi szakorvosok tisztában legyenek a lehetőségekkel.
Betegutak rendezése szakmai ajánlásban
Hasonlóan az onkológia és az urológia együttműködéséhez, ahol előbb az urológus döntése alapján a beteg az onkológushoz, majd később az onkológus döntése alapján akár vissza az urológushoz kerül, radioligand-kezelési alternatíva választásakor a beteg rendre az onkológustól a nukleáris medicina szakemberhez kerül.
Ebben a viszonyrendszerben a beteg szempontjait figyelembevéve olyan gyakorlatot kell kialakítani, amelyben nem állhat fenn olyan eshetőség, hogy a beteg bármilyen szempontból kezeletlen marad. Ennek hiányában a beteg kockázatnak van kitéve. Ennek érdekében az onkológia és a nukleáris medicina részvételével lokálisan tisztázni kell, hogy a betegállapot, a betegkövetés, a korábbi terápia vagy a radioligand-terápia eredményeképp jelentkező mellékhatások kezelése mikor és melyik szakembernek a feladata, milyen párhuzamosságok megengedhetőek.
Jó gyakorlat lehet, ha a beteg már a kezelések megkezdése előtt tisztában van azzal, hogy milyen jellegű panaszával hova fordulhat (akár egy tájékoztató füzet formájában).
Második javaslat KAPACITÁSKÉRDÉSEK
Radioligand-kezelésekre alkalmas országos lefedettséget biztosító centrumok fejlesztése, kialakítása
A betegutak egyszerűsítése és a betegközpontúság jegyében, a teljes területi ellátás biztosítása érdekében javasoljuk a személyi és tárgyi feltételeket jelenleg teljesítő 5 centrum fejlesztését, a kapacitások bővítését. Amennyiben a teljes diagnosztikai és ellátási palettát lefedni képes szakmákat és támogató eszközöket felvonultató centrumok jönnek létre, úgy a szakemberek és eszközök helyi elérhetősége okán egyszerűsödik a minden szakmát képviseltető onkoteamek létrejötte. Az osztályok szorosabb kapcsolata okán egyszerűsödik a betegút, és a betegek számára biztos elérhetőség valósul meg a teljes ellátási palettához, függetlenül attól, hogy az ország mely régiójában élnek.
Harmadik javaslat EDUKÁCIÓ
Közérthető „radioligand-kezelési kézikönyv” kidolgozása a betegszervezetek és a szakma együttműködésével
A betegek számára történő információátadásra a kezelést végző nukleáris medicina szakorvos a legalkalmasabb, ugyanakkor a széles körű, de mégis célzott információátadásért a betegszervezet nagyon sokat tehet.
A két szereplő ötvözheti előnyeit, amennyiben a szakma részvételével olyan informatív és közérthető tudatosítást célzó anyag készül, amely a betegszervezeten belül és a nukleáris medicina intézeteken belül terjeszthető.
Ezen kiadvány a radioligand-kezelésekre való indikálhatóság felfedezésekor ideális esetben a betegnek odaadható, így az nem fals és kétes forrásokból tájékozódik már a kezelés megkezdése előtt sem, hanem a szakemberek által megfelelőnek tartott irodalomból. A kiadvány segítségével csökkenthető az álhírek okozta esetleges pszichikai terhelés a betegeken, miközben részvételi hajlandóságuk fokozható.
A radioligand-kezelési ismeretek beemelése a prosztatarák kezelésében résztvevő szakemberek képzési, továbbképzési programjába
A megkérdezett alanyok szerint a nukleáris medicina reprezentáltsága az orvosképzésben alacsony, a tudományosan kevésbé aktív szakemberek pedig a későbbiekben sem találkoznak, nem ismerkednek meg a terület lehetőségeivel.
Amennyiben az érintett társszakmák jobban megismerik a radioligand-terápiákban rejlő lehetőségeket, úgy remélhető, hogy nagyobb belátással járnak el a kezelések során, jobban együtt tudnak működni a nukleáris medicina szakemberekkel, így növelve a multidiszciplináris együttműködések lehetőségét is. A tudatosításnak nyomatékot ad a kötelező jelleg, amely elengedhetetlen azon előfeltételezés mellett, miszerint a probléma magja az érintett orvosok alacsonyabb érdeklődése más szakmák szakterületének irányába. Az edukáció kapcsán fontos, hogy egykapussá kell tenni a rendszert. Azaz a beteg vezetését kiemelt centrumokban indokolt végezni, ahol minden szaktudás egy helyen rendelkezésre áll. A magas minőségű betegállátáshoz emocionálisan érdekelt, professzionálisan felkészült szakemberek kellenek. A prosztatarák-kezelés hasonlatos a vitorlázáshoz, amit valakinek hajóskapitányként irányítania kell. De ez nem elegendő, a sikerhez mindenkinek hozzá kell tenni a maga kis részét (legyen az a társszakma képviselője vagy maga a beteg).
Elengedhetetlen az is, hogy a társadalom tudjon erről a kezelési lehetőségről és a betegek jussanak el a centrumokba. Ehhez általános tájékoztatás, majd erre specializálódott célzott információátadás szükséges.
Negyedik javaslat
NUKLEÁRIS MEDICINA SZEREPE
Nukleáris medicina bevonásának erősítése a kezelést érintő döntésekbe
Interjúalanyaink többsége arról számolt be, hogy a nukleáris medicina szakorvosok nem minden esetben részei a multidiszciplináris döntéshozatalnak, azaz az onkoteamdöntésnek. Nemcsak a radioligand-kezelések kapcsán, de már a megelőző vonalak és tágabb betegségterület diagnosztizálásakor is kiemelkedő szerepe van a nukleáris medicina által felvonultatott diagnosztikai eszköztárnak. Számos kezelési döntést a nukleáris medicina által végzett modern diagnosztika előz meg, így a modern onkoteamek döntésében már csak emiatt is helye van a szakmának. Kiemelten igaz ez a radioligandokkal kapcsolatos kezelésre, ahol mind a diagnosztikát, mind a kezelést a nukleáris medicina szakember végzi.
A szakmaközi együttműködés mélyítheti is a szakemberek közötti kapcsolatot, az ellátás szempontjából hasznos organikusan fejlődő együttműködési formákat eredményezhet.
A strukturált onkoteamek biztosíthatják a nukleáris medicina megfelelő képviseletét a betegállátás során, minden olyan esetben, ahol a megfelelő képalkotó diagnosztika kiválasztása vagy radioligand terápia mérlegelése történik.
Az online működési forma azért is támogatandó, mert már ma is ez a mindennapi gyakorlat. Ugyanakkor kiemelten fontos a strukturáltság, hiszen arra jelenleg nincs kapacitás, és szakmailag sem feltétlen indokolt, hogy a nukleáris medicina szakemberek minden uro-onkoteamen megjelent beteget értékeljenek. Csak azok esetében indokolt a bevonásuk, ha a radioligand-kezelés mérlegelésre kerül. Ugyanakkor fontos felhívni a jogalkotó figyelmét arra is, hogy a 2003-as onkoteamrendelet, valamint a 2012-es minimum feltételrendszerről szóló szabályozás értelmében a nukleáris medicina szakember részvétele az onkoteamen nem kötelező. Ezt mindenképp rendezni javasolt.
Ötödik javaslat LELETEZÉS
Szükséges a képalkotó vizsgálatok leleteinek standardizálása, minőségének javítása
A nukleáris medicina bevonása az onkoteambe támogathatja a lelet kiértékelést is, a szakmák visszajelzése alapján standardizálható és javítható a nukleáris medicina által végzett leletezés, gyorsabb hozzáférés biztosítható a diagnosztikához.
Hatodik javaslatFINANSZÍROZÁS
Területet érintő diagnosztika elérési és finanszírozási kérdéseinek megoldása
Az interjúk kiértékelése során a radioligand-terápiára alkalmas betegek kiválasztásához szükséges diagnosztika alacsony elérhetőségét és finanszírozásbeli problémát azonosítottunk.
A modern diagnosztikai lehetőségek elérhetősége jelenleg többnyire helyhez kötött. Szórványosan elérhetőek az ország területén a PSMA SPECT/CT és a PSMA PET/CT megoldások. Ennek egyik szűk keresztmetszete a gépi infrastruktúra, de korlátozottan elérhetőek az egyes diagnosztikához szükséges radiofarmakonok is, amely szoros összefüggésben áll a nem minden esetben hatékony (lásd egyedi méltányosság), illetve nem elégséges finanszírozással.
A gépi infrastrukturális elégtelenség modernizálás útján orvosolható, azonban ezzel együtt a finanszírozás kérdését is meg kell oldani.
Olyan finanszírozási módozatok szükségesek, amelyek figyelembe veszik az adott diagnosztikai eljárás minden költségét, tekintettel kell lenni a radiofarmakonok árára, és a vizsgálat elvégzésének költségére is.
Megfelelő finanszírozás mellett a radiofarmakonok hiánya is organikusan megoldódhat, amennyiben ezek előállítása piaci alapon megtérülővé válik.
A radioligand kezelési ellátáshoz szükséges diagnosztikai háttér megteremtésével nemcsak a radioligand kezelések háttere rendeződik, hiszen ezek a vizsgálatok nem radioligand-kezelésekkel összefüggő egyéb kezelési utakat is képesek megalapozni.
Radioligand-kezelések fenntartható finanszírozási környezetének kialakítása
Radioligand-kezelési lehetőségek jelenleg ugyan korlátozottan elérhetőek, de a potenciális kezelési paletta folyamatos bővülésével egyre égetőbbé válik az új terápiák lehetséges finanszírozási alternatíváinak felvázolása, az egyes terápiák esetén az optimális finanszírozási utak kigondolása. Számos terápia esetén kezdetben megoldást jelenthet az egyedi méltányossági kérelmek keretében történő finanszírozás, de hosszabb távon a szélesebb elérhetőség és az adminisztrációs terhek csökkentése érdekében tartósabb megoldásokat kell eszközölni.
Egyes terápiák esetében, ahol a beteg intézményben tartását hosszabb időre érv nem támasztja alá, ott főként kúraszerű ellátás során indokolt végezni a kezelést, vagy akár járóbeteg-ellátás keretében is megoldható a terápia finanszírozása. Más terápiáknál indokolt lehet a beteg befektetése, ezért a fekvőbeteg-ellátásban is ki kell alakítani a finanszírozás rendjét.
A finanszírozás kialakításakor tekintettel kell lenni az alkalmazott készítmény költsége mellett a beadás költségterheire is, de az ellátás megkezdéséhez szükséges diagnosztika költségére is. Érdemes tehát a teljes felmerülő költséget vizsgálni, a finanszírozás alapjául szolgáló kódokat ennek megfelelően kialakítani.
Egy-egy terápia társadalombiztosítási támogatásba vételekor ajánlást kell tenni az ellátás finanszírozásának alapjául szolgáló kódokra is. Elengedhetetlen a komplex ökoszisztémaként történő technológiaértékelés.
A terápiás terület várható előretörésével folyamatosan frissíteni kell a szakmai iránymutatásokat, ezeknek megfelelően kell elvégezni a kódkarbantartásokat és felülvizsgálni a finanszírozási protokollokat. A folyamatnak organikusnak és folyamatosnak kell lennie, hogy az ellátások megtérülése az azt végző intézmények számára biztosított legyen, ne keletkezzenek az ellátást hátráltató finanszírozási anomáliák.
A tanulmány elkészítésében szerzőként és közreműködőként a feltüntetett szakemberek, szervezetek vettek részt, a MediConcept Kft. koordinálásával. A szerzők teljes szerkesztői ellenőrzéssel rendelkeztek a tartalom felett. A tanulmány elkészítését a Novartis Hungária Kft. kezdeményezte és támogatta. A tanulmány tartalma nem kezelési módszer vagy terápiaspecifikus.
Engedélyszám: FA-11322298. Lezárás dátuma: 2024. 12. 02.
Irodalom
1. Bugani V, Battistelli L, Sansovini M, et al. Radioligand therapies in cancer: mapping the educational landscape in Europe. Eur J Nucl Med Mol Imaging 2023; 50(9): 2692–2698. https://doi.org/10.1007/s00259-023-06217-0
2. Központi Statisztikai Hivatal. Egészségügyi helyzetkép, 2019. Központi Statisztikai Hivatal. 2021. https://www.ksh.hu/apps/shop.kiadvany?p_kiadvany_id=1063993&p_temakor_kod=KSH&p_lang=HU
3. Nemzeti Rákregiszter. Adatok és statisztikák a daganatos megbetegedésekről. 2023. https://stat.nrr.hu/
4. Thurin NH, Rouyer M, Gross-Goupil M, et al. Epidemiology of metastatic castration-resistant prostate cancer: A first estimate of incidence and prevalence using the French nationwide healthcare database. Cancer Epidemiol 2020; 69: 101833. https://doi.org/10.1016/j.canep.2020.101833
5. Global Health Data Exchange – GHDx. Explore results from the 2021 Global Burden of Disease (GBD) study. Institute For Health Metrics and Evaluation. 2021. https://vizhub.healthdata.org/gbd-results/
6. Parker C, Castro E, Fizazi K, et al. Prostate cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2020; 31(9): 1119–1134. https://doi.org/10.1016/j.annonc.2020.06.011.
7. National Comprehensive Cancer Network. Prostate Cancer Guideline. 2023. Version 4.2023. https://www.nccn.org/home
8. International Agency for Research on Cancer. Globocan (2023): Cancer Incidence, Mortality, and Prevalence Worldwide. Lyon, France: IARC; 2023. https://gco.iarc.fr/
9. Bill-Axelson A, Holmberg L, Filen F, et al. Radical prostatectomy versus watchful waiting in localized prostate cancer: the Scandinavian prostate cancer group-4 randomized trial. J Natl Cancer Inst 2008; 100(16): 1144–54. https://doi.org/10.1093/jnci/djn255
10. Moreira DM, Presti JC, Jr., Aronson WJ, et al. Natural history of persistently elevated prostate specific antigen after radical prostatectomy: results from the SEARCH database. J Urol 2009; 182(5): 2250–5.
https://doi.org/10.1016/j.juro.2009.07.022
11. D’Amico AV, Hui-Chen M, Renshaw AA, et al. Identifying men diagnosed with clinically localized prostate cancer who are at high risk for death from prostate cancer. J Urol 2006; 176(6 Pt 2): S11–5.
https://doi.org/10.1016/j.juro.2006.06.075
12. Antonarakis ES, Blackford AL, Garrett-Mayer E, Eisenberger MA. Survival in men with nonmetastatic prostate cancer treated with hormone therapy: a quantitative systematic review. J Clin Oncol 2007; 25(31): 4998–5008. https://doi.org/10.1200/JCO.2007.11.1559
13. Shappley WV. III, Kenfield SA, Kasperzyk JL, et al. Prospective study of determinants and outcomes of deferred treatment or watchful waiting among men with prostate cancer in a nationwide cohort. J Clin Oncol 2009; 27(30): 4980–5. https://doi.org/10.1200/JCO.2008.21.2613
14. Bolla M, van Poppel H, Collette L, et al. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet 2005; 366(9485): 572–8.
https://doi.org/10.1016/S0140-6736(05)67101-2
15. Bolla M, Collette L, Blank L, et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002; 360(9327): 103–6.
https://doi.org/10.1016/S0140-6736(02)09408-4
16. Small EJ, Schellhammer PF, Higano CS, et al. Placebo-controlled phase III trial of immunologic therapy with sipuleucel-T (APC8015) in patients with metastatic, asymptomatic hormone refractory prostate cancer. J Clin Oncol 2006; 24(19): 3089–94. https://doi.org/10.1200/JCO.2005.04.5252
17. Petrylak DP, Tangen CM, Hussain MH, et al. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. N Engl J Med 2004; 351(15): 1513–20.
https://doi.org/10.1056/NEJMoa041318
18. de Bono JS, Logothetis CJ, Molina A, et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011; 364(21): 1995–2005. https://doi.org/10.1056/NEJMoa1014618
19. Mehrens D, Kramer KKM, Unterrainer LM, et al. Cost-Effectiveness Analysis of 177Lu-PSMA-617 Radioligand Therapy in Metastatic Castration-Resistant Prostate Cancer. Journal of the National Comprehensive Cancer Network: JNCCN 2023; 21(1): 43–50.e2.
https://doi.org/10.6004/jnccn.2022.7070
20. Quist SW, Paulissen JHJ, Wyndaele DNJ, et al. Costs of radium-223 and the pharmacy preparation 177Lu-PSMA-I&T for metastatic castration-resistant prostate cancer in Dutch hospitals. J Med Econ 2023; 26(1): 366–375. https://doi.org/10.1080/13696998.2023.2183618
21. Központi Statisztikai Hivatal. 21.1.3.2. Egy főre jutó GDP, vásárlóerő-paritás alapján [USD]. 2023. https://www.ksh.hu
22. Dragomir A, Dinea D, Vanhuyse M, et al. Drug costs in the management of metastatic castration-resistant prostate cancer in Canada. BMC Health Serv Res 2014; 14: 252. https://doi.org/10.1186/1472-6963-14-252.
23. Restelli U, Ceresoli GL, Croce D, et al. Economic burden of the management of metastatic castrate-resistant prostate cancer in Italy: a cost of illness study. Cancer Manag Res 2017; 9: 789–800.
https://doi.org/10.2147/CMAR.S148323
24. Cornford P, Tilki D, van den Bergh RCN, et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG Guidelines on Prostate Cancer. ISBN 978-94-92671-23-3. EAU Guidelines Office, Arnhem, the Netherlands.
http://uroweb.org/guidelines/compilations-of-all-guidelines/
25. Garai I. Új diagnosztikus és terápiás lehetőségek a nukleáris medicinában a neuroendokrin daganatok terén. Magyar Tudomány 2023; 184(2023)8: 1005–1013. https://doi.org/10.1556/2065.184.2023.8.6
26. 31/2010. (V. 13.) EüM rendelet a finanszírozási eljárásrendekről
27. Hotte SJ, Saad F. Current management of castrate-resistant prostate cancer. Curr Oncol 2010; 17 Suppl 2(Suppl 2): S72–S79.
https://doi.org/10.3747/co.v17i0.718
28. Grobet-Jeandin E, Valerio M. Screening of visceral metastasis in castration-resistant prostate cancer: a cornerstone in personalized patient’s care. Prostate Cancer Prostatic Dis 2023; 26: 3–4.
https://doi.org/10.1038/s41391-022-00604-8
29. Sartor O, de Bono J, Chi KN, et al. Lutetium-177–PSMA-617 for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med 2021; 385(12): 1091–1103. https://doi.org/10.1056/NEJMoa2107322.
30. NICE 2016. Cabazitaxel for hormone-relapsed metastatic prostate cancer treated with docetaxel. Technology appraisal guidance [TA391]. Published: 25 May 2016. https://www.nice.org.uk/guidance/ta39