De novo Hormone-Sensitive Metastatic Prostate Cancer: A Rare Clinical Presentation, a Case Report
DOI: 10.22591/magyurol.2024.4.anikma.198
Authors:
Anik Mercédesz Amelita dr.1, Mangel László dr.2,
Szántó Árpád dr.1, Damásdi Miklós dr.1
1Pécsi Tudományegyetem, Klinikai Központ, Urológiai Klinika, Pécs (igazgató: Szántó Árpád)
2Pécsi Tudományegyetem, Klinikai Központ Onkoterápiás Intézet, Pécs (igazgató: Mangel László)
Summary
Introduction: In the therapy of prostate tumours, active surveillance may sseems to be a risky form of treatment to the patients as well as their attending doctors. The European Association of Urology (EAU) protocol states that the process should be follow of regular PSA and rectal digital examination, which sometimes needs to be supplemented with histological sampling, not forgetting the imaging assistance provided by prostate MR. Due to the coronavirus pandemic in recent years, the care of patients on active surveillance has become difficult, so a rare appearance of a co-morbidity could make the previously considered certain urological therapeutic choice completely uncertain.
Case report: Our 51-year-old asymptomatic patient was investigated during a control examination due to an elevated PSA value. A prostate biopsy gave the diagnosis of a low-risk prostate tumour, so we decided to start active surveillance, but due to the coronavirus pandemic, he was not monitored as often as he should have been. Next time, he appeared with locomotor pain, weight loss, night sweats and also felt enlarged tumours in the neck and armpit areas. Imaging tests confirmed tumour-suspicious lymph nodes. Sampling from axillary and abdominal lymph nodes showed the appearance of Non-Hodgkin lymphoma. A pelvic MR examination was performed, which evaluated space occupation with extraprostatic spread (PIRADS 5) in the right lobe of the prostate. Repeated prostate biopsy samples taken from the right lobe were described as infiltrative B-cell lymphoma and samples from the left lobe confirmed the prostate tumour known after our first sampling. The patient’s haematological treatment was started, and his complaints disappeared. Control pelvic MRI did not suggest the presence of a clinically significant tumour in the prostate (PIRADS 2).
Conclusion: The exact indication and implementation of active surveillance is vital in the case of low-risk prostate tumours. Progression on active surveillance may refer to the faults of risk assessment, or an appearance of a seconder disease. In these cases rebiopsy can clear the possible process and define the right therapeutic option. In our case, the chosen active surveillance proved to be a right decision which also offers the best quality of life to our patient.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 4. SZÁM
Összefoglalás
Bevezetés: A de novo, áttétes, hormonszenzitív prosztatarák (M1HSPC) a prosztatarákok (PC) mintegy 5-10%-át teszi ki, azonban a PC-hez kapcsolódó halálesetek közel 50%-áért felelős. Az áttétek elsősorban a csontrendszert érintik, azonban a csontvelő-érintettség igen ritka.
Anyag és módszer: Egy 71 éves férfi beteg néma, makroszkópos, alvadékos vérvizeléssel jelentkezett egyetemünk sürgősségi ambulanciáján. A vérvizsgálat thrombocytopeniát, emelkedett májfunkciós értékeket, veseelégtelenséget, enyhe elektrolitegyensúly-zavart, mérsékelt anémiát és enyhe gyulladásos érték eltérést mutatott. A konzervatív kezelés ellenére nem javuló vérvizelés hátterében disszeminált intravaszkuláris coagulopathia (DIC) igazolódott. Kivizsgálása során konvencionális CT-vizsgálat parailiacalis, supraclavicularis lymphadenopathiát igazolt, emellett fizikális vizsgálat során (rektális digitális vizsgálat, RDV) felmerült a prosztatarák lehetősége is. Kiegészítő tumormarker, PSA-vizsgálat (totál PSA) történt, amely jelentős eltérést, emelkedett értéket, 159 ng/ml igazolt, majd protokoll szerinti transrectalis ultrahang-vezérelte prosztatabiopszia történt, amely Gleason Grade 4+4, ISUP 4 adenokarcinomát igazolt. Androgén deprivációs terápia (ADT), majd később abirateron-acetát kezelés indult. A jelentős PSA-eltérés, illetve a konvecionális staging vizsgálati eredmények ismeretében kiegészítő PSMA PET CT-vizsgálat elvégzését kezdeményeztük. Hematológusokkal folytatott konzultációt követően csontvelő-biopszia történt, amelynek eredménye prosztata-adenocarcinoma metasztázisának felelt meg (PSA-, AR+ fenotípus). Az alkalmazott kombinált ADT- és ARTA-kezelések mellett kasztrációrezisztens állapot alakult ki, majd a diagnózis felállítását követően 5 hónappal a beteg alapbetegségének szövődményei következtében elhunyt.
Következtetés: A beteg klinikai tünetei, döntően a makroszkópos, alvadékos néma vérvizelés, illetve a negatív urológiai kórelőzmény, egyéb vizsgálati eredmények hiánya nehezítették a korai, pontos diagnózis felállítását. A fizikális vizsgálat (RDV), férfiaknál a PSA, mint szervspecifikus tumormarker, további képalkotó vizsgálatok, valamint esetünkben a PSMA PET CT, és a társszakmák bevonása segítették a beteg diagnózishoz történő jutását, illetve annak birtokában a viszonylag gyors szisztémás kezelés megkezdését. A DIC mögötti másodlagos folyamatok, mint például esetünkben a prosztatakarcinóma feltérképezése komplex feladat. A kezdeti tüneti terápia (a vérvizelés konzervatív módon történő uralása, vérkészítmények adása) átmeneti javulást ugyan eredményezett, de a beteg általános állapotában történő radikális javulást az új generációs ARTA (abirateron-acetát) és ADT-kezelések hoztak. Jelenleg nincs magas szintű evidenciával bíró és széles körben elfogadott kezelési terv csontvelő-érintettséggel együtt járó metasztatikus prosztatadaganat kezelésére. A rendelkezésre álló irodalmi adatok következetesen az ADT-, majd kemoterápia/ARTA-kezelést ajánlanak, triplet terápia (ADT + ARTA + kemoterápia) a betegek általános állapota miatt általában nem javasolt.
Bevezetés
A prosztatarák a második leggyakoribb daganatos megbetegedés férfiakban (9). A prosztatadaganatos betegeket kiterjedés alapján alábbi csoportokra osztjuk: lokalizált, lokálisan előrehaladott, és generalizált folyamatok. Szövettani eredmények alapján leggyakoribb hisztopatológiai kép az adenocarcinoma, ezt követik a tranzicionális, illetve a neuroendokrin tumorok. A betegség a korai fázisban legtöbbször tünetmentes, azonban előrehaladott esetekben a betegek nem specifikus tünetekről, mint csontfájdalom, hasi fájdalom, derékfájdalom, vérvizelés számolnak be. A PC leggyakrabban hematogén szóródással (csontváz, tüdő, máj), illetve nyirokkeringés útján terjedhet (regionális és extraregionális nyirokcsomók). A csontvázrendszer mellett csontvelő-érintettség jelenléte irodalmi ritkaság, és még ritkább esetben fordul elő szövődményként disszeminált intravaszkuláris coagulopathia (DIC) (1–3).
Esetismertetés
A Pécsi Tudományegyetem sürgősségi ambulanciáján egy 71 éves férfi beteg makroszkópos, alvadékos néma vérvizeléssel jelentkezett. Sürgősségi betegellátás keretében elvégezett laborvizsgálatok során thrombocytopenia, emelkedett májfunkciós értékek, veseelégtelenség, enyhe elektroliteltérés, mérsékelt anémia, enyhe gyulladásos paraméteremelkedés igazolódott. Kiegészítő laborvizsgálatok, döntően alvadológiai paraméterek vizsgálata (thrombin idő 20,8 sec, INR 1,4, fibrinogén 0,84 g/l, thrombocytaszám 54 g/l), illetve ClotPro® mérések történtek, amelyek DIC jelenlétét igazolták. Hematológiai konzultáció történt, amelynek alapján a beteg thrombocyta, friss fagyasztott plazma, krioprecipitátum és hemokomplettan szövődménymentes transzfúziójában részesült. A kiegészítő mellkas-has-kismedence CT képalkotó vizsgálatok parailiacalis, illetve supraclavicularis patológiás méretű nyirokcsomók jelenlétét igazolták. A rektális digitális fizikális vizsgálat alapján felmerülő a prosztata malignus eltérése miatt kiegészítő tumormarker, totál PSA-vizsgálatot végeztünk, amely jelentősen emelkedett korspecifikus (159 ng/ml), illetve PSA-denzitás (PSAD 3,18 ng/ml/cm3) értékeket mutatott. A beteg állapotromlása miatt intenzív osztályos elhelyezése, majd helyi érzéstelenítésben transrectalis ultrahang-vezérelte szextáns prosztatabiopszia történt (5). A szövettani eredmény adenocarcinoma, Gleason Grade 4+4, ISUP 4 folyamatot igazolt, perineurális, limfovaszkuláris invázió jeleivel, az összes core minta pozitivitása mellett. Hormonszenzitív, de novo, szinkron metasztatikus, és az első felmérés alapján low volume, low risk (csontmetasztázisok, illetve visceralis szerv érintettségének hiánya) áttétes prosztata-adenocarcinoma alapján ADT-kezelést indítottunk (LHRH-antagonista, degarelix) (8). A második lépésben elvégzett PSMA PET-vizsgálat alapján, a rizikóbecslés újraértékelésével, a beteg kezdeti emelkedett vesefunkciós, illetve májfunkciós eredményeit is figyelembe véve ARTA-kezelést, azon belül abirateron-acetát kezelést kezdtünk. Áttekintve az abirateron-acetát gyógyszeralkalmazási előiratát, illetve törzskönyvét Child–Pough-meghatározás (Child Class A) alapján a beteg teljes, napi 1000 mg dózisú abirateronkezelése mellé 5 mg prednisolon készítményadagolást is elkezdtük. A készítmények megindítása előtt a beteg kemoterápiás kezelésének lehetőségéről (docetaxel/cabazitaxel) mind hematológiai, mind pedig onkológiai egyeztetést követően arra az álláspontra helyezkedtünk, hogy a vélhető csontvelő-érintettség miatt a beteget a kemoterápiás kezeléssel igen komoly rizikónak tennénk ki és végül a haszon/kockázat elvét mérlegelve azt elvetettük. A kivizsgálás során konvencionális képalkotó CT-vizsgálat, illetve induló PSA-eredmény, és a klinikai kép alapján további diagnosztikai vizsgálat, PSMA PET (1. ábra) elvégzése mellett döntöttünk, amelynek eredménye megerősítette a beteg kiterjedt, multiplex csontvázrendszert érintő folyamatát, a regionális parailiacalis patológiás nyirokcsomók jelenléte mellett.
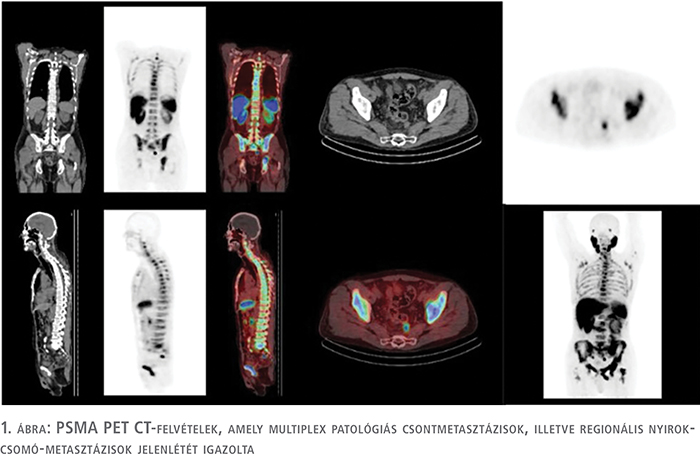
A csontvelő-elégtelenség jelei miatt esetleges egyéb, az alapbetegsége mellett megjelenő folyamat kizárása céljából csontvelő-biopsziát végeztünk, amelynek szövettani eredménye prosztataeredetű adenocarcinoma csontvelő-metasztázisát igazolta. A kórszövettani vizsgálat érdekessége, hogy a minta PSA-negatív, AR-pozitív fenotípust véleményezett (2. ábra).
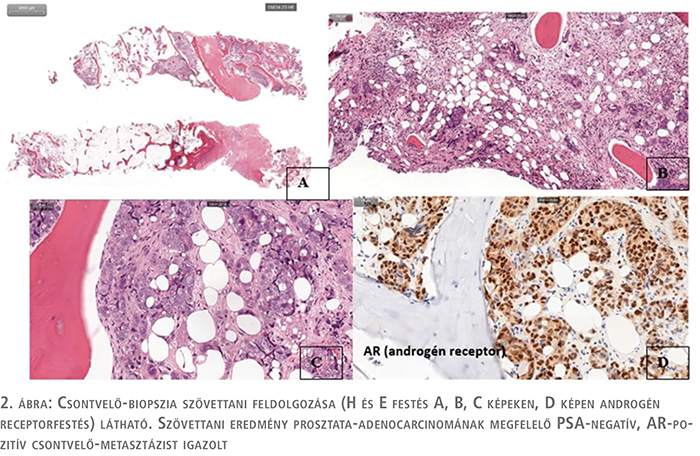
Összességében a beteg klinikai onkológiai állapotát ezt követően M1 HSPC high risk, high volume betegségként értékelve a megkezdett kombinált terápiát (ADT + Abi) dózisredukció mellett zoledronsav-kezeléssel egészítettük ki. Kiegészítő molekuláris genetikai vizsgálatokat (BRCA 1/2 meghatározás) is elvégeztük, de azok negatív eredménnyel zárultak.
A kombinált kezelésre adott korai PSA-választ kifejezetten kedvezőnek értékeltük (PSA 27,9 ng/ml, 1 hónapos kezelést követően), miközben a beteg általános állapota, illetve kisfokban a vérképzőszervi eredményei is javultak, további folyamatos szubsztitúciós terápiát nem igényelt. A 3 hónapos kontroll laborvizsgálat kedvezőtlen, biokémiai, PSA-relapszus jeleit mutatta (27–40–61 ng/ml), a beteg általános állapota azonban ismételten romlott, újra intézeti elhelyezést igényelt.
Az alkalmazott szubsztitúciós kezelések ellenére a továbbra is fennálló vérképzőszervi, máj-, illetve vesefunkciós értékek romlása miatt az abirateronkezelést felfüggesztettük, a beteg továbbra sem volt alkalmas kemoterápiás kezelés megkezdésére. A mindenre kiterjedő intézeti (urológiai, onkológiai, hematológiai) ellátás ellenére a beteg a kezelés megkezdését követő 5. hónapban többszervi elégtelenségben elhunyt.
Megbeszélés
Prosztatakarcinóma kivizsgálás részeként a fizikális vizsgálat (RDV), további képalkotó vizsgálatok, mint a PSMA PET CT, és az összefonódó szakmák bevonása továbbra is alapvető fontosságú a pontos diagnózis megállapításához és a megfelelő terápia megkezdéséhez. A korai, rendelkezésre álló konvencionális képalkotó, illetve szövettani eredmények alapján a jelen beteg onkológiai stádiumát de novo, szinkron, hormonszenzitív, metasztatikus low risk, low volume prosztata-adenocarcinomaként határoztuk meg. A beteg általános állapota, DIC-re utaló klinikai képe, a metasztázisok elhelyezkedése, száma (regionális, illetve extraregionális metasztázisok) viszont ellentmondtak az alacsony kockázatnak, így a jelenleg elérhető legmagasabb (mind szenzitivitásban, mind pedig specificitásban) radiológiai képalkotó vizsgálat elvégzése mellett döntöttünk. A beteg általános állapota ugyan nem tette lehetővé, hogy az igazolt high risk betegségben kemoterápiával kombinált, triplet kezelést kezdjünk, de az irodalmi adatokkal egyezően az abirateron-acetát kezelés folytatásának szükségességét megerősítette (4, 6, 10).
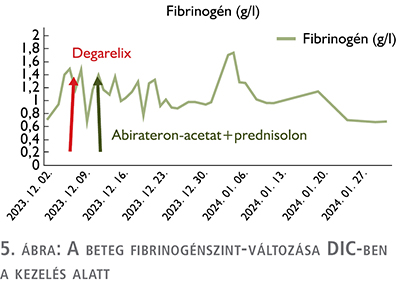
Az ADT-, ARTA-kezelés megkezdése a beteg látványos klinikai állapot javulását, illetve kedvező irányú labordiagnosztikai értékváltozást hozott – ahogy azt a grafikai ábrák mutatják (3–5. ábra) –, de az elért eredmények csak átmenetinek bizonyultak. A korai kasztrációrezisztens állapot elérése igazolta azt, hogy a de novo csontvelő-érintettség igen rossz prognosztikai hatással bír. A rapid – 6 hónapon belüli – PSA-duplikációs idő, biokémiai relapszus alapján a szóba jöhető kezelésekre – ARTA-váltás, kemoterápia – a beteg rossz általános állapota miatt nem került sor.
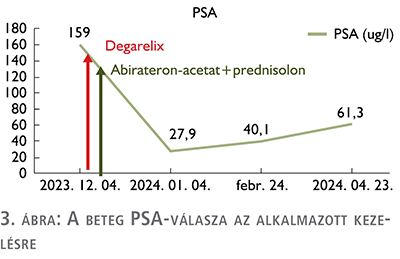
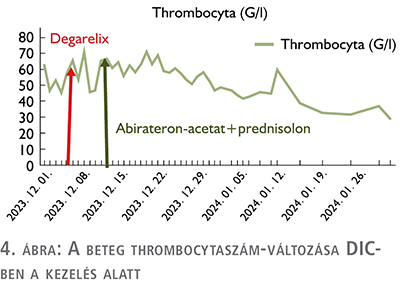
Következtetés
Végezetül a makroszkópos vérvizelés differenciáldiagnózisának elvégzése komplex gondolkodást igényel, figyelembe véve, hogy a vérzés egy része nem sebészi eredetű. Másodlagos folyamatok, mint például a prosztata malignus elváltozása ugyanúgy állhatnak a disszeminált intravaszkuláris coagulopathia mögött, mint egyéb onkológiai kórképek. Jelenleg nincs elfogadott, egységes irányelv a csontvelő-érintettséggel együtt járó prosztatakarcinóma kezelésére, de a betegünk gyógykezelése során szerzett tapasztalatok alapján az abirateron-acetát kezelés megfelelő alternatíva a kemoterápiás kezelésre nem alkalmas betegek számára.
A szakmai anyag megjelenését a Richter Gedeon Nyrt. támogatta. A szakmai cikkben közölt információk a szerző véleményét tükrözik. Minden említett termék alkalmazásakor az érvényes alkalmazási előírás az irányadó.
Irodalom
1. Adamson AS, Francis JL, Witherow RO, Snell ME. Coagulopathy in the prostate cancer patient: prevalence and clinical relevance. Ann R Coll Surg Engl 1993 Mar; 75(2): 100–4. PMID: 7682795; PMCID: PMC2497758.
2. Bick RL. Disseminated intravascular coagulation: a review of etiology, pathophysiology, diagnosis, and management: guidelines for care. Clin Appl Thromb Hemost 2002 Jan; 8(1): 1–31.
https://doi.org/10.1177/107602960200800103. PMID: 11991236.
3. Desai M, John B, Evans G, Eddy B. Prostate cancer: beware of disseminated intravascular coagulation. BMJ Case Rep 2015 Mar 27; 2015: bcr2014206814. https://doi.org/10.1136/bcr-2014-206814. PMID: 25819815; PMCID: PMC4386315.
4. Gauthier H, Serrate C, Pouessel D, leMaignan C, Teixeira L, Culine S. Very fast recovery of acute disseminated intravascular coagulation with abiraterone acetate in a patient with bone metastases from castrate-resistant prostate cancer. Case Rep Oncol 2014 Sep 5; 7(3): 625–7. https://doi.org/10.1159/000367781. PMID: 25408654; PMCID: PMC4209259.
5. Ghallab M, Ilyas U, Tran L, Amin T, Abdelmoteleb S. Disseminated Intravascular Coagulation With Excessive Fibrinolysis Following Diagnostic Prostatic Biopsy for Prostate Cancer. Cureus 2022 Oct 20; 14(10): e30502.
https://doi.org/10.7759/cureus.30502. PMID: 36415381; PMCID: PMC9675043.
6. Giszas B, Fritzenwanger M, Grimm MO, Stallmach A, Reuken PA. Recurrent Disseminated Intravascular Coagulation in Metastatic Castration-Resistant Prostate Cancer: A Case Report. Diagnostics (Basel) 2022 Sep 28; 12(10): 2342.
https://doi.org/10.3390/diagnostics12102342. PMID: 36292031; PMCID: PMC9600388.
7. Hiroshige T, Eguchi Y. Prostate cancer with disseminated carcinomatosis of the bone marrow: Two case reports. Mol Clin Oncol 2017 Aug; 7(2): 233–236.
https://doi.org/10.3892/mco.2017.1303. Epub 2017 Jun 28. PMID: 28781792; PMCID: PMC5532688.
8. Ong SY, Taverna J, Jokerst C, Enzler T, Hammode E, Rogowitz E, Green MR, Babiker HM. Prostate Cancer-Associated Disseminated Intravascular Coagulation with Excessive Fibrinolysis Treated with Degarelix. Case Rep Oncol Med 2015; 2015: 212543.
https://doi.org/10.1155/2015/212543. Epub 2015 Nov 3. PMID: 26613055; PMCID: PMC4646996.
9. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019 Jan; 69(1): 7–34. https://doi.org/10.3322/caac.21551. Epub 2019 Jan 8. PMID: 30620402.
10. Hiroshige T, Eguchi Y. Prostate cancer with disseminated carcinomatosis of the bone marrow: Two case reports. Molecular and clinical oncology, 2017; 7(2): 233–236. https://doi.org/10.3892/mco.2017.1303