New approaches in the therapy of prostate cancer: The role of genetic patterns in selecting targeted treatments
DOI: https://doi.org/10.22591/magyurol.2023.2.fazekast.75

Authors:
Fazekas Tamás dr.1, Dér Bálint dr.1, Csizmarik Anita dr.1, Soós Áron1, Fekete Bálint dr.1, Nyirády Péter dr.1, Szarvas Tibor dr.1,2
1 Semmelweis Egyetem ÁOK, Urológiai Klinika és Andrológiai Centrum, Budapest
2 Duisburg-Esseni Egyetem, Urológiai Klinika, Essen, Németország
Summary
The use of genetic testing for prostate cancer is becoming increasingly common in clinical practice, particularly because of the emergence of PARP inhibitors that target tumours with specific genetic abnormalities in their BRCA and other homologous recombination repair (HRR) genes. At the same time, the number of available therapies that target specific subgroups of prostate cancer based on their genetic makeup is continuously growing. Consequently, the selection of treatment for prostate cancer patients may involve testing multiple genes to allow for more tailored treatment plans that take into account the genetic features of the tumour. In this review we aim to provide an overview on the currently relevant genetic alterations in prostate cancer for therapeutic purposes.
LAPSZÁM: MAGYAR UROLÓGIA | 2023 | 35. ÉVFOLYAM, 2. SZÁM
Összefoglalás
A prosztatarák genetikai tesztelésének használata egyre elterjedtebb a klinikai gyakorlatban. Ez elsősorban a PARP-inhibitorok megjelenésének köszönhető, amelyek a prosztataráknak a BRCA és más homológ rekombinációs javító (HRR) gének patogén eltéréseit hordozó eseteiben alkalmazhatóak. Ebből kifolyólag a genetikai vizsgálatok elvégzése a prosztatarák előrehaladott eseteinek kezelése során bekerült a rutinvizsgálatok közé. Ezzel párhuzamosan folyamatosan nő az olyan gyógyszeres kezeléseknek a száma, amelyek alkalmazása célzottan egy bizonyos genetikai eltérés jelenléte esetén lehetséges. Ennek eredményeképpen egyre növekszik azon gének száma, amelyek vizsgálata fontos lehet a prosztatadaganatok kezelési stratégiáinak megválasztásánál. Jelen közleményünkkel szeretnénk áttekintést nyújtani a prosztatarák molekuláris alcsoportjairól, valamint azokról a génekről, amelyek a jelenleg és a közeljövőben potenciálisan alkalmazható kezelések kiválasztásához szükségesek.
A prosztatadaganat klinikai megjelenési formái igen nagy változatosságot mutatnak; magukba foglalják a lokális stádiumú, kezelést nem igénylő, indolens daganatokat, valamint lokális és tünetmentes, de kezelést igénylő formákat, a metasztatikus hormonérzékeny típusokat és az antiandrogén kezelés hatására kialakuló kasztrációrezisztens daganatokat is. Ezt a heterogenitást a prosztatadaganatok molekuláris háttere is tükrözi, amely szintén jelentős változatosságot mutat. Az elmúlt években elvégzett teljes genom-, transzkriptom-, epigenom- és proteomvizsgálatoknak köszönhetően lehetővé vált a tumorok molekuláris hátterének megértése (1–3). Ezeknek az átfogó vizsgálatoknak köszönhetően sikerült a prosztatarákot molekuláris alcsoportokba sorolni (1–3). Ezen túlmenően a PARP-inhibitorok megjelenése egy új korszak kezdete a prosztatarák terápiájában, amelyben a klinikai paramétereken túl a daganat molekuláris eltérései is meghatározó szereppel bírnak a terápiás döntéseinek meghozatalánál. Ez az új szemléletmód, amely a daganatok genetikai vizsgálatának elterjedését vonja maga után, elősegítheti néhány további olyan prosztatadaganatban még ritkán alkalmazott célzott gyógyszer használatát, amelyek már jelenleg is elérhetőek, vagy a közeljövőben kaphatnak használati engedélyt. Ebben az összefoglaló közleményben ezekről a lehetőségekről szeretnénk egy rövid áttekintést nyújtani.
A prosztatarák molekuláris alcsoportjai
A prosztatadaganatok öt nagy molekuláris alcsoportba oszthatók (1. ábra). A legnagyobb alcsoportot az ETS (Erythroblast Transformation Specific) géncsalád eltéréseit hordozó tumorok alkotják. Ehhez a családhoz tartozik az ERG (ETS Transcription Factor) gén, amely a leggyakrabban a TMPRSS2 (Transmemebrane Protease, Serine 2) génnel alkot fúziót, amely az összes prosztatadaganat 40–50%-ában van jelen (3, 4, 5). Továbbá ritkábban előfordulhat, hogy az ETS géncsalád további tagjai, így az ETV1 (ETS Translocation Variant 1), az ETV4 (ETS Translocation Variant 4 ) és az FLI1 (Friend Leukemia Integration 1 Transcription Factor) gének alkotnak fúziós mutánst a TMPRSS2 génnel. Az ETS-pozitív alcsoportra jellemző továbbá a PTEN (Phosphatase and Tensin Homologue) deléciója és a TP53 (Tumor Protein p53) gén mutációi, továbbá a PI3K (Phosphoinositide 3-kinases) jelátviteli útvonal érintettsége (1, 2, 3). Az ETS-génátrendeződés prognosztikus értéke és klinikai jelentősége jelenleg még vitatott.
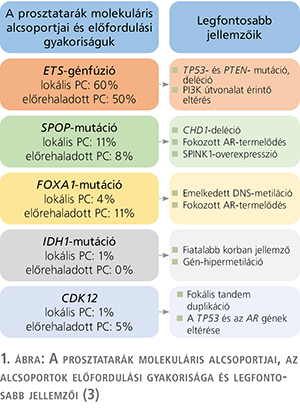
A további alcsoportokat a SPOP (Speckle-type Pox Virus and Zinc Finger Protein), a FOXA1 (Forkhead Box Protein A1), az IDH1 (Isocitrate Dehydrogenase 1) és a CDK12 (Cyclin Dependent Kinase 12) gének eltéréseivel jellemezhető tumorok alkotják (1, 2, 3, 6, 7). Mind primer, mind metasztatikus PC esetében körülbelül 6-15%-ban fordulnak elő a SPOP gén eltérései (1, 2, 3).
A SPOP-pontmutációt hordozó tumorok esetében nem fordul elő ETS-génátrendeződés, azonban jellemző a CHD1 (Chromodomain Helicase DNA Binding Protein 1) gén deléciója, a Wnt (Wingless-type jelátviteli út) útvonal érintettsége, valamint az androgénreceptor (AR) fokozott termelődése. Ez arra utal, hogy ezek a tumorok nagy valószínűséggel jól reagálnak az AR támadáspontú terápiákra (8).
A FOXA1 gént érintő eltérések a lokális prosztatarákok 4%-ában, míg az előrehaladott daganatok körülbelül 11%-ában fordulnak elő (1, 2, 3). A FOXA1-mutációt hordozó esetek hasonló génexpressziós mintázatot és DNS-hipermetilációt mutatnak, mint a SPOP-mutációval rendelkező tumorok, valamint fokozott az AR-transzkripciós aktivitásuk is (1, 3).
Az egyik legkisebb alcsoportot az IDH1 gént érintő eltéréseket hordozó esetek alkotják, amelyek a lokális prosztatarákok 1%-ában fordulnak elő. Az alcsoport jellegzetessége, hogy a mutáció többnyire fiatalabb férfiak esetében fordul elő (1, 3).
A legújabb molekuláris alcsoportot a CDK12 gén biallélikus elvesztésével rendelkező daganatok alkotják, amelyek a lokális esetek 1%-ában, míg a metasztatikus esetek 5%-ában fordulnak elő. A CDK12 gén funkcióvesztése esetén nem fordul elő az ETS-fúzió és a SPOP gén eltérése, azonban jellemzőek ezekre a tumorokra az AR és a TP53 gének eltérései (3, 6). A CDK12-eltéréssel rendelkező tumorok a prosztatadaganatok igen agresszív alcsoportját képviselik, amelyek rosszul reagálnak az antiandrogén-, a taxán- és PARP-inhibitor-terápiákra, azonban ezek a betegek kedvezően reagálhatnak az immunellenőrzőpont-gátló terápiákra (9).
A BRCA-mutációk terápiás relevanciája a prosztatarákban
A prosztatadaganatok genetikai eltérései közül kiemelt terápiás jelentőséggel bírnak a BRCA (Brest cancer gene) gének mutációi (10). Ezen gének – valamint további, hasonló funkciójú ún. homológ rekombináns hibajavító (HRR) gének – eltérései emelkedett mutációs terhelést és felgyorsult daganatképződést eredményeznek, ami korábbi életkorban kialakuló, rosszabb prognózisú és kedvezőtlenebb klinikopatológiai jellemzőkkel járó agresszív prosztatadaganatok kialakulásához vezet (11, 12, 13).
A BRCA-mutációk a metasztatikus prosztatadaganatok 10-12%-ban vannak jelen, az európai irányelvek alapján javasolt a vizsgálatuk, amelyhez daganatminta szükséges, amely származhat az elsődleges tumorból (biopszia, prosztatareszekátum, radikális prostatectomia), áttétből vagy vérből (keringő tumorsejtek, keringő tumor-DNS). Pozitív teszteredmény esetén javasolt klinikai genetikus bevonása genetikai tanácsadás és a további molekuláris vizsgálatok mérlegelésének céljából.
A metasztatikus kasztrációrezisztens prosztatadaganatokban az utóbbi évek kutatási eredményei bizonyították a PARP-gátló (Poly/ADP-ribose/Polymerase) kezelések hatékonyságát; a PROfound-vizsgálatban az olaparib javította a BRCA-pozitív betegek progressziómentes és teljes túlélését, ezért mind az Egysült Államokban (FDA) mind pedig Európában (EMA) engedélyezték a szer használatát új generációs androgénreceptorgátló-kezelést követően (14, 15). További PARP-inhibitorokat (niraparib, talazoparib) jelenleg klinikai vizsgálatokban tesztelnek, valamint a rucaparibot az FDA engedélyezte a TRITON2-vizsgálat eredményei alapján (16). A közelmúltban számos publikáció jelent meg az új generációs antiandrogének és PARP-gátlók kombinációjával kapcsolatban. A PROpel-vizsgálatban az abirateron és olaparib első vonalban alkalmazott kombinációja molekulárisan szelektálatlan betegcsoportban javította a progressziómentes túlélést, ezért az EMA engedélyezte a kombinációt biomarkerstátusztól függetlenül is.
Számos daganatféleség esetében ismert, hogy a BRCA-eltérések jelenléte a platinavegyületek iránt mutatott fokozott érzékenységgel jár együtt. Prosztatadaganatok esetében a platinakezelést neuroendokrin szövettan esetén, valamint az adenokarcinómák esetében ritkábban, a terápiás szekvencia végen alkalmazzák. Retrospektív vizsgálatok és esettanulmányok azonban gyakran kivételesen erős terápiás választ írtak le BRCA-pozitív esetekben (17, 18, 19). Bár erre vonatkozóan még nem állnak rendelkezésre prospektív adatok, azonban a jelenlegi EAU-irányelvek javasolják a platinakezelés megfontolását BRCA-eltéréseket hordozó metasztatikus prosztatarákokban akkor, ha a standard kezelési lehetőségek kimerültek (20).
Összeségében tehát elmondható, hogy a BRCA- (és HRR-) mutáció-pozitív daganatok a prosztatarák egy korábban kialakuló és agresszív formáját alkotják, amelynek hátterében felerészben örökletes mutációk állnak. A BRCA-eltérések jelenléte – a betegség prognózisán túl – annak terápiás érzékenységét is előrejelzi. Jelenleg célzott PARP-gátló-kezelések, a prosztatarák metasztatikus kasztrációrezisztens eseteiben első vonalban abirateronnal kombinálva, másodvonaltól pedig monoterápiában alkalmazva érhetők el.
További terápiás relevanciával bíró genetikai eltérések prosztatarákban
MMR-deficiencia
Az ún. mismatch hibajavító mechanizmus (mismatch repair, röviden MMR) hibái a prosztatarákok 3-5%-ában fordulnak elő (21, 22). Az MMR rendszer a kisebb génhibák kijavítására szolgáló apparátus, amelynek meghibásodása a mutációk felhalmozódásához vezet. Az MMR-hibát (MMR-d) kimutathatjuk az abban részt vevő fehérjék (MLH1, MSH2, MSH6, PMS2) immunhisztokémiai vizsgálatával. Ilyenkor a négy fehérje bármelyikének hiánya a tumorsejtekben MMR-d jelenlétére utal. Az MMR-d DNS-szinten is kimutatható mikroszatellita-instabilitás (MSI) vagy tumormutációs terhelés (TMB) formájában. Az előbbiben a DNS egyes (általában 5-10) mikroszatellita-régióiban PCR-technika segítségével mutatják ki az MSI jelenlétét, míg a másik esetben új generációs DNS-szekvenálással határozzák meg az egységnyi DNS-szakaszra eső eltérések mennyiségét, amelynek 10/Mb feletti értéke számít magasnak. A fenti vizsgálatokhoz szükséges módszertani tapasztalat a patológiai intézetekben többnyire rendelkezésre áll. A fent említett eltérések jelenléte esetén minden szolid tumorban – így metasztatikus prosztatarákban is – alkalmazható az immunellenőrzőpont-gátló (IEG) pembrolizumab, akkor, ha a betegség legalább egy korábbi szisztémás kezelésre progrediált (23). Prosztatarák esetében a jelenleg elérhető retrospektív vizsgálatok az MMR/MSI eltérést hordozó és IEG-kezelést kapó prosztatarákos betegek felében találtak PSA50-választ (a kezelés alatt legalább 50%-os PSA-csökkenés), és a válaszolók jelentős részénél hosszú távon (>20 hónap) is folytatni lehetett a kezelést, ami – figyelembe véve, hogy a szert többnyire késői vonalakban alkalmazták – igen jó eredménynek számít (21, 24, 25). Ezek alapján az MMR-d- vagy az MSI-eltérések prosztatarákban ugyan ritkán fordulnak elő, ugyanakkor IEG-kezeléssel ezen esetek mintegy felében igen jó eredményt lehet elérni.
NTRK-génfúzió
A neurotrofikus tropomiozinreceptor-kináz (NTRK) génfúzióit hordozó betegek számára szintén tumorentitástól függetlenül elérhetőek célzott kezelések (larotrectinib, entrectinib). Azonban ez az eltérés prosztatadaganatban nagyon ritkán (<0,5%) fordul elő, és jelenleg az irodalomban sem érhetők még el klinikai tapasztalatok NTRK-inhibitorokkal prosztatarákban, így a fenti szerek alkalmazása prosztatarákban gyakorlati szempontból nem jelentős (26).
A PTEN funkcióvesztő mutációi
A PTEN tumorszupresszor gén funkcióvesztést okozó mutációi a prosztatarák stádiumától függően az esetek 20-50%-ában fordulnak elő (27). A PTEN elvesztése esetén az AKT jelátviteli útvonal kórosan aktívvá válik, ezért az ipatasertib- (orális AKT-inhibitor) abirateron kezelés az abirateron-monoterápiával összehasonlítva kedvezőbb radiológiai progressziómentes túlélést eredményezett a PTEN-mutációt vagy fehérjevesztést hordozó betegeknél (27). A teljes túléléssel kapcsolatos eredményeket még nem publikálták, így az ipatasertib használatára jelen pillanatban még nincsenek ajánlások.
Következtetések
A prosztatadaganatok molekuláris eltéréseik alapján molekuláris alcsoportokba sorolhatók, amelyek klinikai relevanciája még nem tisztázott. Ezzel szemben egy-egy gén eltérései már ma is klinikai döntéshozatal részét képezik. A BRCA és más HRR gének mutációi mellett fontos kiemelni az MMR-d kimutatását, amely az IEG-terápia hatékonyságát vetíti előre. Ezzel szemben az NTRK-fúzióhoz kötött célzott kezelések az eltérés nagyon ritka előfordulása miatt továbbra sem játszanak majd jelentős szerepet a prosztatarák kezelésében. A PTEN gént érintő eltérések jóval gyakrabban fordulnak elő, ezért a még folyamatban levő klinikai vizsgálatok lezárultával a jövőben az AKT-gátló kezelése is bekerülhet a prosztatarákban alkalmazható célzott kezelések közé. A jelenleg folyamatban lévő klinikai vizsgálatok növekvő száma a célzott terápiás szerek prosztatadaganat kezelésében történő további elterjedését vetítik előre, amely egyre több gén vizsgálatát teszi majd szükségessé. A terápiás lehetőségek bővülésével az adott daganat molekuláris sajátságaihoz egyre inkább illeszkedő kezelés választható ki, ami minden bizonnyal a betegek életkilátásainak javulásával jár majd.
Támogatás
Ez a közlemény a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal NKFIH/ K139059 számú és az Emberi Erőforrások Minisztériuma ÚNKP-21-5-SE-3, ÚNKP-21-3-II-SE-13, ÚNKP-22-4-I-SE-25 és ÚNKP-22-3-1-SE-19 kódszámú Új Nemzeti Kiválóság Programjának támogatásával készült. Dr. Szarvas Tibor a Magyar Tudományos Akadémia Bolyai János-ösztöndíjában részesült (BO/00451/20/5).
Irodalom
1. Cancer Genome Atlas Research Network. The Molecular Taxonomy of Primary Prostate Cancer. Cell 2015; 163: 1011–1025.
https://doi.org/10.1016/j.cell.2015.10.025
2. Robinson D, Van Allen EM, Wu YM, et al. Integrative clinical genomics of advanced prostate cancer. Cell 2015; 161: 1215–1228.
https://doi.org/10.1016/j.cell.2015.05.001
3. Szarvas T, Csizmarik A, Szűcs M et al. A prosztatarák molekuláris altípusai és célzott terápiás kilátásai (Molecular subtypes and perspectives of targeted therapies in prostate cancer). Orv Hetil 2019; 160: 252–263. https://doi.org/10.1556/650.2019.31315
4. Tomlins SA, Bjartell A, Chinnaiyan AM, et al. ETS gene fusions in prostate cancer: from discovery to daily clinical practice. Eur Urol 2009; 56: 275–28. https://doi.org/10.1016/j.eururo.2009.04.036
5. Tomlins SA, Rhodes DR, Perner S, et al. Recurrent fusion of TMPRSS2 and ETS transcription factor genes in prostate cancer. Science 2005; 310: 644–64. https://doi.org/10.1126/science.1117679
6. Wu YM, Cies´lik M, Lonigro RJ, et al. Inactivation of CDK12 Delineates a Distinct Immunogenic Class of Advanced Prostate Cancer. Cell 2018; 173: 1770–1782.e14 https://doi.org/10.1016/j.cell.2018.04.034
7. Hjorth-Jensen K, Maya-Mendoza A, Dalgaard N, et al. SPOP promotes transcriptional expression of DNA repair and replication factors to prevent replication stress and genomic instability. Nucleic Acids Res 2018; 46: 9484–9495. https://doi.org/10.1093/nar/gky719
8. Nakazawa M, Fang M, H Marshall C, et al. Clinical and genomic features of SPOP-mutant prostate cancer. Prostate 2022; 82: 260–268.
https://doi.org/10.1002/pros.24269
9. Antonarakis ES, Isaacsson Velho P, Fu W, et al. CDK12-Altered Prostate Cancer: Clinical Features and Therapeutic Outcomes to Standard Systemic Therapies, Poly (ADP-Ribose) Polymerase Inhibitors, and PD-1 Inhibitors. JCO Precis Oncol 2020; 4: 370–381.
https://doi.org/10.1200/PO.19.00399
10. Sweeney C, Bracarda S, Sternberg CN, et al. Ipatasertib plus abiraterone
and prednisolone in metastatic castration-resistant prostate cancer (IPATential150): a multicentre, randomised, double-blind, phase 3 trial. Lancet 2021; 398: 131–142. https://doi.org/10.1016/S0140-6736(21)00580-8
11. Vietri MT, D’Elia G, Caliendo G, et al. Hereditary Prostate Cancer: Genes Related, Target Therapy and Prevention. Int J Mol Sci 2021; 22: 3753. https://doi.org/10.3390/ijms22073753
12. Sipeky C, Talala KM, Tammela TLJ, et al. Prostate cancer risk prediction using a polygenic risk score. Sci Rep 2020; 10: 17075.
https://doi.org/10.1038/s41598-020-74172-z
13. Jackson SP, Bartek J. The DNA-damage response in human biology and disease. Nature 2009; 461: 1071–1078. https://doi.org/10.1038/nature08467
14. De Bono J, Mateo J, Fizazi K, et al. Olaparib for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med 2020; 382: 2091–2102. https://doi.org/10.1056/NEJMoa1911440
15. Hussain M, Mateo J, Fizazi K, et al. Survival with Olaparib in Metastatic Castration-Resistant Prostate Cancer. N Engl J Med 2020; 383: 2345–2357.
https://doi.org/10.1056/NEJMoa2022485
16. Abida W, Patnaik A, Campbell D, et al. Rucaparib in Men With Metastatic Castration-Resistant Prostate Cancer Harboring a BRCA1 or BRCA2 Gene Alteration. J Clin Oncol 2020; 38: 3763–3772.
https://doi.org/10.1200/JCO.20.01035
17. Castro E, Goh C, Olmos D, et al. Germline BRCA mutations are associated with higher risk of nodal involvement, distant metastasis, and poor survival outcomes in prostate cancer. J Clin Oncol 2013; 31: 1748–1757. https://doi.org/10.1200/JCO.2012.43.1882
18. Nagy ND, Fazekas T, Baghy K, et al. Efficacy of carboplatin chemotherapy in a metastatic, castration-resistant BRCA2 mutation positive prostate cancer patient. Orv Hetil 2021 Jun 20; 162(25): 1004–1008.
https://doi.org/10.1556/650.2021.32112.
19. Rajwa P, Quhal F, Pradere B, et al. Prostate cancer risk, screening and management in patients with germline BRCA1/2 mutations. Nat Rev Urol 2023; 20: 205–216. https://doi.org/10.1038/s41585-022-00680-4
20. Cheng HH, Pritchard CC, Boyd T, et al. Biallelic Inactivation of BRCA2 in Platinum-sensitive Metastatic Castration-resistant Prostate Cancer. Eur Urol 2016; 69: 992–995. https://doi.org/10.1016/j.eururo.2015.11.022
21. Iannantuono GM, Torino F, Rosenfeld R, et al. The Role of Histology-Agnostic Drugs in the Treatment of Metastatic Castration-Resistant Prostate Cancer. Int J Mol Sci 2022; 23: 8535.
https://doi.org/10.3390/ijms23158535
22. Robinson D, Van Allen EM, Wu YM, et al. Integrative clinical genomics of advanced prostate cancer. Cell 2015; 161: 1215–1228.
https://doi.org/10.1016/j.cell.2015.05.001
23. Marcus L, Lemery SJ, Keegan P, et al. FDA Approval Summary: Pembrolizumab for the Treatment of Microsatellite Instability-High Solid Tumors. Clin Cancer Res 2019; 25: 3753–3758.
https://doi.org/10.1158/1078-0432.CCR-18-4070
24. Antonarakis ES, Shaukat F, Isaacsson Velho P, et al. Clinical Features and Therapeutic Outcomes in Men with Advanced Prostate Cancer and DNA Mismatch Repair Gene Mutations. Eur Urol 2019; 75: 378–382. https://doi.org/10.1016/j.eururo.2018.10.009
25. Sena LA, Fountain J, Isaacsson Velho P, et al. Tumor Frameshift Mutation Proportion Predicts Response to Immunotherapy in Mismatch Repair-Deficient Prostate Cancer. Oncologist 2021; 26: e270–e278.
https://doi.org/10.1002/onco.13601
26. Westphalen CB, Krebs MG, Le Tourneau C, et al. Genomic context of NTRK1/2/3 fusion-positive tumours from a large real-world population. NPJ Precis Oncol 2021; 5: 69. https://doi.org/10.1038/s41698-021-00206-y
27. De Bono JS, De Giorgi U, et al. Randomized Phase II Study Evaluating Akt Blockade with Ipatasertib, in Combination with Abiraterone, in Patients with Metastatic Prostate Cancer with and without PTEN Loss. Clin Cancer Res 2019; 25: 928–936.
https://doi.org/10.1158/1078-0432.CCR-18-0981