Active surveillance in practice – Review
DOI: https://doi.org/10.22591/magyurol.2023.2.beothet.79

Authors:
Beöthe Tamás Zsolt dr.
Déli-pesti Centrumkórház, Péterfy Sándor Utcai Kórház-Rendelőintézet, Urológiai Osztály (osztályvezető: Buzogány István dr.)
Summary
Active surveillance (AS) takes advantage of the prolonged natural course of prostate cancer. Active treatments are postponed and the patient is monitored according to a strict protocol. In case of progression, curative treatment is performed while the patient is still safely curable. The intention to treat is curative, aiming to minimize treatment-related toxicity without compromising survival.
The feasibility and safety of AS have been demonstrated in several studies, but the heterogeneity of studies means that guidelines are partly based on consensus.
For patients with low-risk disease and life expectancy over 10 years, AS should be considered as the standard first-line treatment of choice. AS can be recommended when ISUP 2 is associated with a tumour with PSA Rectal digital examination (at least annually) and PSA testing (at least every 6 months) are recommended during follow-up, as well as regular repeat biopsies. Histological sampling is necessary in case of PSA elevation or other suspicion (e.g. multiparametric MRI). The main indication for switching to active therapy is an increase in Gleason score or an increase in tumour area. The patient may decide to opt for active treatment at any time. If the life expectancy is less than 10 years, „watchful waiting” is recommended.
The importance of education should be stressed and the patient should be involved in the therapeutic decision together with the oncoteam.
LAPSZÁM: MAGYAR UROLÓGIA | 2023 | 35. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Az aktív surveillance (AS) kihasználja a prosztatarák elhúzódó természetes lefolyását. Az aktív kezeléseket halasztják, a beteg szigorú protokoll szerint ellenőrzés alatt áll. Progresszió esetén a kuratív kezelés még akkor történik meg, amikor a beteg biztonságosan meggyógyítható. A cél a kezeléssel kapcsolatos toxicitás minimalizálása a túlélés veszélyeztetése nélkül.
Az AS alkalmazhatóságát és biztonságát több vizsgálat igazolta, azonban a vizsgálatok heterogenitása miatt a szakmai irányelvek részben konszenzusra támaszkodnak.
Az alacsony kockázatú betegségben szenvedő és 10 év feletti várható élettartamú betegeknél az AS-t standard, elsőként választandó kezelésnek kell tekinteni. AS akkor ajánlható, ha ISUP 2 daganat mellett a prosztataspecifikus antigén (PSA) A követés során rektális digitális vizsgálat (legalább évente) és PSA-vizsgálat elvégzése (legalább 6 havonta), valamint a biopszia rendszeres ismétlése is javasolt. PSA-emelkedés vagy egyéb (pl. multiparametrikus MRI) gyanú esetén szövettani mintavétel szükséges. Aktív terápiára váltás indoka elsősorban a Gleason-érték emelkedése vagy a daganat területének növekedése. A beteg bármikor dönthet aktív kezelés mellett. Ha az életkilátások 10 évnél rövidebbek, „figyelmes várakozás” javasolt.
Kiemelendő a felvilágosítás fontossága, a terápiás döntésbe az onkoteammel együtt a beteget is be kell vonni.
A 90-es években – a PSA-vizsgálat egyre szélesebb elterjedésével – a prosztatarák lett a leggyakrabban diagnosztizált rosszindulatú daganat az Amerikai Egyesült Államokban (1). Az intenzív szűrési politika miatt sok ún. indolens daganatot is felismertek (2). Ezekben az esetekben a daganat a beteg élete során várhatóan nem okoz klinikai tünetet és rákkal összefüggő halálozást (3, 4). Az aktív kezelés, különösen a kezelés szövődményei ezeket a betegeket feleslegesen terhelik, ezért a United States Preventive Services Task Force (USPSTF) 2008-ban javaslatot tett a 75 év feletti, majd később a 70 év feletti férfiak szűrésének elhagyására. A túlkezelés elkerülésének másik lehetséges módja, hogy a kiszűrt, indolens daganatokat nem, vagy nem azonnal kezelik. Ezt a stratégiát alkalmazza az aktív surveillance (aktív megfigyelés, AS).
Történelmi áttekintés
Az aktív surveillance kifejezést Smith használta először 1990-ben (5). Azt javasolta, hogy a jól differenciált daganatokat – azonnali kezelés helyett – figyeljék meg, és csak progresszió esetén avatkozzanak be. 1994-ben Chodak 828, konzervatívan kezelt beteg adatai alapján igazolta, hogy a 10 éves tumorspecifikus túlélés klinikai T1a stádium és 2-4 Gleason-érték mellett 96%, illetve 5-7 Gleason-értéknél 94%, vagyis a betegség lefutása nagyon hosszú (6). Epstein, majd 1998-ban D’Amico egy másik osztályozási rendszert mutatott be, amely a PSA, klinikai T-stádium és Gleason-pontszám alapján sorolta rizikócsoportba a betegeket (7, 8).
A prospektív vizsgálatok eredményére még 2002-ig várni kellett. Ekkor közölte a Torontói Egyetem (9) és a Johns Hopkins Orvosi Intézet (10) a prospektív protokollal kezelt AS-kohorszok első eredményeit. A következő évtizedben három randomizált, kontrollált vizsgálat az azonnali kezelés hatékonyságát hasonlította össze a várakozással. A Scandinavian Prostate Cancer Group Study Number 4 (SPCG-4-) vizsgálatot 2011-ben (11), a The Prostate Cancer Intervention Versus Observation Trial (PIVOT) vizsgálatot 2012-ben (12) és a The Prostate Testing for Cancer and Treatment (ProtecT-) vizsgálat eredményeit 2016-ban (13) tették közzé. Bár a vizsgálatok részleteikben nem voltak egységesek, az alacsony kockázati csoportba tartozó betegek esetén egyik sem mutatott szignifikáns különbséget a 10 éves teljes túlélés és a daganatspecifikus halálozás tekintetében. (A ProtecT-vizsgálat legutóbbi frissítése 15 éves medián követési idő után sem mutatott ki jelentős különbséget.) Ebben a vizsgálatban a vizelet-, a bél- és a szexuális funkció életminőségre gyakorolt hatását is vizsgálták, amelyek természetesen kevésbé voltak érintettek a megfigyelési ágon. A Global Action Plan Prostate Cancer Active Surveillance (GAP3) 25 központban kezelt 15 101 férfi adatainak átfogó elemzésében Bruinsma a metasztázis kialakulását 0,3%-nak, míg a daganatos halálozást 0,2%-nak találta AS mellett (14). Az 5, 10 és 15 éves követés során a betegek 58, 39 és 23%-a állt AS alatt, míg 23, 30 és 36%-a progresszió miatt kezelésre került.
Ahogy nőtt a bizalom az AS hosszú távú biztonságossága iránt, úgy nőtt az AS alkalmazása is az alacsony kockázatú betegségben szenvedő férfiaknál. Az Egyesült Államokban a 2014-es 27%-ról 2021-re 60%-ra nőtt az AS alatt álló betegek aránya (15). Hollandiában 2015–2016-ban diagnosztizált, nagyon alacsony kockázatú prosztatarákos férfiak 85%-át, (16) míg egy svéd vizsgálatban 2014-re 91%-át AS-re sorolták (17). Magyarországi adatok az AS alkalmazásáról még nem állnak rendelkezésre.
Az aktív surveillance
Az aktív surveillance (aktív megfigyelés) tehát kihasználja a prosztatarák elhúzódó természetes lefolyását. A várhatóan indolens daganatok esetén nincs szükség azonnali kezelésre, hanem a beteg szigorú protokoll alapján történő megfigyelésre kerül. Ez biztosítja, hogy progresszió esetén a kuratív kezelés még biztonságos időben elvégezhető. Az AS célja a kezeléssel kapcsolatos toxicitás minimalizálása a túlélés veszélyeztetése nélkül. Hangsúlyozni kell, hogy AS esetén a kezelési szándék kuratív! Az AS az alacsony (vagy kedvező feltételek esetén a közepes) kockázati csoportba tartozó szervre lokalizált prosztatadaganat esetén választható, a 10 évnél hosszabb életkilátásokkal rendelkező betegek számára.
Gyakori, hogy az AS fogalmát összekeverik a watchful waiting (figyelmes várakozás) fogalmával. A figyelmes várakozás célja a palliáció az aktív kezelések toxicitásának elkerülése mellett. A betegség minden stádiumában alkalmazható, ha a beteg életkilátásai rövidek ( A felsorolt klinikai vizsgálatok hosszú időtartamot (akár 20 évet) öleltek fel. Sokféleségük miatt mégsem adtak a kezünkbe egy minden részletre kiterjedő, bizonyítékokon alapuló útmutatót. Az egységes álláspont kialakítására az Európai Urológus Társaság (EAU) klinikai vizsgálatot szervezett. A DETECTIVE-vizsgálat eredményeit Lam 2019-ben publikálta (18). A vizsgálat során – a bizonyítékokra alapuló eredmények mellett – konszenzuson alapuló véleményeket is figyelembe vettek. Az amerikai National Comprehensive Cancer Network (NCCN) útmutatója szintén részben konszenzus alapján készült. Mivel kifejezetten az orvosi gyakorlat támogatására állították össze, ennek javaslatait is érdemes figyelembe venni a mindennapi gyakorlat kialakításához.
A prosztatadaganat rizikóbesorolásához szükséges vizsgálatok
Az AS-re alkalmas betegek szövettani eredménye többnyire szűrés kapcsán elvégzett biopsziás mintákból származik, néhány esetben BPH-műtét során incidentálisan.
A kezelési terv szempontjából legfontosabb annak eldöntése, hogy szervre lokalizált, lokálisan előrehaladott vagy generalizált prosztatarákkal állunk szemben. Ha a daganat az alacsony (vagy igen alacsony) rizikócsoportba esik, azt szervre lokalizáltnak tekinthetjük, és további staging vizsgálatok nem szükségesek. Minden más esetben csontszcintigráfia és nagy hasi/kismedencei képalkotó vizsgálat elvégzése javasolt. Rendelkezésre állnak modern képalkotó vizsgálatok pl. PET-CT vagy teljestest-MR, ezek elvégzése azonban AS-re alkalmas, szervre lokalizált esetekben nem indokolt.
Rendelkezésre kell állnia a kiindulási (azaz a beavatkozás előtti) PSA-értéknek. Emellett javasolt a PSA-denzitás kiszámítása is: a kiindulási értéket elosztjuk a prosztata térfogatával. Ha ennek az értéke 0,09 ng/ml/cc alá esik, klinikailag szignifikáns prosztatadaganat előfordulása nem valószínű (4%) (19). Az NCCN rizikóbeosztása megengedőbb: 0,15 ng/ml/cc határértékig igen alacsony kockázatú prosztatarák véleményezhető. A klinikai T-stádium megítéléséhez szükséges a rektális digitális vizsgálat elvégzése.
A szövettani eredménynek tartalmaznia kell az elsődleges és másodlagos Gleason- és az ISUP- (International Society of Urological Pathology) értékeket, a pozitív minták számát, azokban a daganatos terület kiterjedését – különös tekintettel a Gleason 4 területekre ISUP 7 esetén. A véleménynek tartalmaznia kell, ha a mintában intraductalis karcinóma vagy invazív cribriform mintázat van jelen. A limfovaszkuláris invázió, az extraprosztatikus terjedés, illetve a ductus ejaculatorius vagy a vesicula seminalis érintettsége is fontos tényező (20). Incidentális daganat esetén – ha a beteg alkalmas AS-re – javasolt a biopsziát pótlólag elvégezni (21).
A multiparametrikus magnetic resonance imaging (mpMRI-) vizsgálat segít a lokális kiterjedés megítélésében, valamint a célzott mintavételben. A betegek rizikócsoportba sorolása mpMRI-vizsgálat nélkül, szisztematikus biopszia alapján is elvégezhető, és az AS megkezdhető. Ugyanakkor javasolt a multiparametrikus MR-vizsgálat és ennek alapján a célzott biopszia 6-12 hónap után, hogy a mintavételi hibát kizárjuk (22).
Igazolt, hogy a megerősítő biopszia javítja az ISUP 2 feletti daganatok kimutatását, illetve alkalmazásával 16%-kal csökkent az ún. surveillance-hiba, vagyis az AS-ből progresszió miatt kieső betegek száma (23). A szisztematikus biopsziára azért van szükség, mert segít kizárni a nagy területet elfoglaló daganatokat. A konszenzus szerint a kombinált szisztematikus és mpMRI-célzott biopsziák mindegyikének elvégzése szükséges. Ha bármelyik elmaradt, azt 6-12 hónap múlva pótolni kell, de a már elvégzett biopsziatípus ismétlésére nincs szükség. Fontos kiemelni, hogy a célzott biopszia során az egy gócból vett mintákat a beosztás során egyetlen mintaként kell figyelembe venni.
Életkilátások
A várható élettartamot betegcsoportok esetén ugyan jól meg tudjuk becsülni, de egyetlen beteg esetén ez nehéz feladat. Mivel a betegek életkilátásának szubjektív megítélése bizonytalan, javasolt – lehetőleg validált – kérdőív használata.
Az általánosan használt ECOG (Eastern Cooperative Oncology Group) Performance Status Scale és Karnofsky-index jól használhatóak a pillanatnyi fizikai állapot leírására, de a várható élettartamról kevés információt adnak.
A járássebesség egy egyszerű és jó módszer a várható élettartam megbecsülésére. 75 éves férfiaknál a 10 éves várható túlélés 87%-ra tehető 5 km/h-t meghaladó sétatempó esetén, míg csupán 19%, ha a járássebesség nem éri el a csoszogásnak megfelelő 1,5 km/h-t (24).
Idősebb betegek egészségi állapotának komplex megítélésére alkalmas a G8 (Geriatric 8) kérdőív (25). Bár validált magyar fordítás nem áll rendelkezésre, a kérdések angol nyelven is egyértelműek, és könnyen kitölthetőek. 14 vagy annál kisebb G8-as pontszám mellett magas a 3 éven belüli mortalitás, így aktív kezelés nem indokolt, viszont a betegek átfogó geriátriai kivizsgálása javasolt.
A Clinical Frailty Scale (CFS) egy másik szűrőeszköz a törékenység megítélésére. 1-től 9-ig terjedő skálán a magasabb pontszámok a növekvő törékenységet jelzik. Klinikai Esendőségi Skála néven magyar nyelven is elérhető (26).
A felvilágosításra jól használható a Memorial Sloan Kettering Cancer Center által kifejlesztett Male Life Expectancy (Férfiak várható élettartama) című, internetalapú kérdőív, bár csak angol nyelven elérhető. A kitöltést követően grafikus formában mutatja be a 10 és 15 éves várható túlélést, valamint a kezelés nélküli prosztatadaganat halálozási kockázatát.
Kinek ajánlott az aktív surveillance?
Az elvégzett vizsgálatok alapján elvégezhető a rizikócsoportba való besorolás (1. táblázat). Ha a várható életkilátások nem érik el a 10 évet, akkor nincs szükség kezelésre, figyelmes várakozás ajánlható.
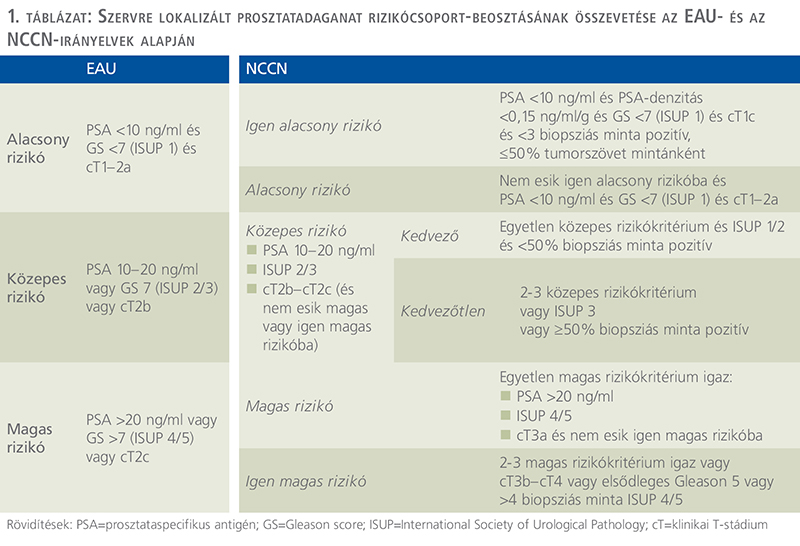
A beválasztásra alkalmazott kritériumok megfelelnek az alacsony kockázatú betegség kritériumainak: ISUP 1, klinikai T1c-T2a stádium és PSA ISUP 2 daganatok esetén egy kanadai konszenzus javasolta az AS-protokoll alkalmazását, ha a tumor kis kiterjedésű (szisztematikus biopszia során 10%-nál kevesebb Gleason 4 területet tartalmazó). Ezt a javaslatot az EAU is elfogadta, ha a PSA 3 pozitív minta, >50% érintettséggel a szisztematikus biopszia során) egyértelműen progressziót jelent, és terápiaváltást indikál (35).
Általánosságban terápiaváltás akkor javasolt, ha a Gleason-érték emelkedik, vagy ha a prosztatarák kiterjedése növekszik. A terápiaváltás határértékét már a terápiás terv felállításakor érdemes a beteggel megbeszélni. Progresszió esetén – a beteget gondosan felvilágosítva – a rizikót újra kell értékelni. A beteg állapotát, életkilátásit is ismét meg kell határozni. Az aktív kezelésről a beteggel együtt, és onkoteam bevonásával kell döntést hozni.
A progresszió megelőzése
5-alfa-reduktáz-gátlók
Vannak arra utaló adatok, hogy 5-alfa-reduktáz-gátlók alkalmazása csökkenti a progressziót (36). Ugyanakkor a REDEEM-vizsgálat alapján a citoredukció volt a dutasterid egyetlen előnye, és nem csökkentette a magasabb grádusú rák kialakulásának arányát. Csak a kockázat csökkentése céljából egyetlen irányelv sem ajánlja az alkalmazásukat.
Enzalutamid
Az enzalutamid előnyeit az AS-kezelés alatt álló betegeknél a II. fázisú ENACT-vizsgálatban vizsgálták (37). A vizsgálat eredménye ellentmondásos volt, ugyanis a prosztatarák progressziója egy év alatt alacsonyabb volt a kezelt csoportban, két év után a különbség nem volt megfigyelhető. Bár súlyos mellékhatások ritkán (2,7%) jelentkeztek, de a kezelés a szexuális és fizikai funkciók klinikailag jelentős csökkenésével járt. Az irányelvekben enzalutamidkezelés az AS alternatívájaként vagy részeként nem szerepel.
ADT-monoterápia
Az ADT-monoterápia alkalmazásával kapcsolatos adatok a Early Prostate Cancer (EPC-) vizsgálatból származnak, amely 2006-ban tette közzé eredményeit (38). A szerzők azt találták, hogy lokalizált betegségben szenvedő betegeknél az ADT-monoterápia egyik alcsoportban sem javította a progressziómentes és a teljes túlélést. Jelenleg nincs bizonyíték az ADT-monoterápia alkalmazására olyan alacsony kockázatú betegségben szenvedő, tünetmentes férfiaknál, akik (más okból) nem részesülhetnek semmilyen aktív kezelésben; ezeknek a férfiaknak a watchful waitinget (figyelmes várakozást) kell felajánlani.
Összefoglalás
Az AS a legalább 10 éves életkilátásokkal rendelkező, alacsony kockázatú, szervre lokalizált prosztatadaganatban szenvedő férfiak elsődleges kezelésévé vált. A közepes kockázati csoportban, kedvező feltételek teljesülése esetén alkalmazható. A klinikai vizsgálatok az AS eredményességét igazolták, azonban a beválasztási kritériumok, illetve a követési protokollok nem voltak egységesek. Emiatt a szakmai irányelvek konszenzuson alapuló útmutatókat tartalmaznak. Az AS során alapvető fontosságú a beteg megfelelő informálása és az onkoteammel közös döntés a terápiás terv mellett.
Irodalom
1. Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin 2017; 67(1): 7–30. https://doi.org/10.3322/caac.21387.
2. Neppl-Huber C, Zappa M, Coebergh JW, et al. Changes in Incidence, Survival and Mortality of Prostate Cancer in Europe and the United States in the PSA Era: Additional Diagnoses and Avoided Deaths. Annals of Oncology 2012; 23(5): 1325–1334.
https://doi.org/10.1093/annonc/mdr414.
3. Van der Kwast TH, Roobol MJ. Defining the Threshold for Significant versus Insignificant Prostate Cancer. Nat Rev Urol 2013; 10(8): 473–482. https://doi.org/10.1038/nrurol.2013.112.
4. Ahmed HU, Arya M, Freeman A, et al. Do Low-Grade and Low-Volume
Prostate Cancers Bear the Hallmarks of Malignancy? Lancet Oncol 2012; 13(11): e509–e517. https://doi.org/10.1016/S1470-2045(12)70388-1.
5. Smith PH. The Case for No Initial Treatment of Localized Prostate Cancer. Urologic Clinics of North America 1990; 17(4): 827–834.
https://doi.org/10.1016/S0094-0143(21)01377-X.
6. Chodak GW, Thisted RA, Gerber GS, et al. Results of Conservative
Management of Clinically Localized Prostate Cancer. New England Journal of Medicine 1994; 330(4): 242–248.
https://doi.org/10.1056/NEJM199401273300403.
7. Epstein JI. Pathologic and Clinical Findings to Predict Tumor Extent of Non-palpable (Stage T1c) Prostate Cancer. JAMA: The Journal of the American Medical Association 1994; 271(5): 368.
https://doi.org/10.1001/jama.1994.03510290050036.
8. D’Amico AV. Biochemical Outcome After Radical Prostatectomy, External Beam Radiation Therapy, or Interstitial Radiation Therapy for Clinically Localized Prostate Cancer. JAMA 1998; 280(11): 969.
https://doi.org/10.1001/jama.280.11.969.
9. Choo R, Klotz L, Danjoux C, et al. Feasibility Study: Watchful Waiting for Localized Low to Intermediate Grade Prostate Carcinoma with Selective Delayed Intervention Based on Prostate Specific Antigen, Histological and/or Clinical Progression. J Urol 2002; 167(4): 1664–1669.
10. Carter HB, Walsh PC, Landis P, et al. Expectant Management of Non-palpable Prostate Cancer with Curative Intent: Preliminary Results. J Urol 2002; 167(3): 1231–1234.
11. Bill-Axelson A, Holmberg L, Ruutu M, et al. Radical Prostatectomy versus Watchful Waiting in Early Prostate Cancer. New England Journal of Medicine 2011; 364(18): 1708–1717.
https://doi.org/10.1056/NEJMoa1011967.
12. Wilt TJ, Brawer MK, Jones KM, et al. Radical Prostatectomy versus Observation for Localized Prostate Cancer. New England Journal of Medicine 2012; 367(3): 203–213. https://doi.org/10.1056/NEJMoa1113162.
13. Hamdy FC, Donovan JL, Lane JA, et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. New England Journal of Medicine 2016; 375(15): 1415–1424.
https://doi.org/10.1056/NEJMoa1606220.
14. Bruinsma SM, Zhang L, Roobol MJ, et al. The Movember Foundation’s GAP3 Cohort: A Profile of the Largest Global Prostate Cancer Active Surveillance Database to Date. BJU Int 2018; 121(5): 737–744.
https://doi.org/10.1111/bju.14106.
15. Cooperberg MR, Meeks W, Fang R, et al. Time Trends and Variation in the Use of Active Surveillance for Management of Low-Risk Prostate Cancer in the US. JAMA Netw Open 2023; 6(3): e231439.
https://doi.org/10.1001/jamanetworkopen.2023.1439.
16. Jansen H, Van Oort IM, Van Andel G, et al. Immediate Treatment vs. Active-Surveillance in Very-Low-Risk Prostate Cancer: The Role of Patient-, Tumour-, and Hospital-Related Factors. Prostate Cancer Prostatic Dis 2019; 22(2): 337–343. https://doi.org/10.1038/s41391-018-0109-y.
17. Loeb S, Folkvaljon Y, Curnyn C, et al. Uptake of Active Surveillance for Very-Low-Risk Prostate Cancer in Sweden. JAMA Oncol 2017; 3(10): 1393.
https://doi.org/10.1001/jamaoncol.2016.3600.
18. Lam TBL, MacLennan S, Willemse P-PM, et al. EAU-EANM-ESTRO-ESUR-SIOG Prostate Cancer Guideline Panel Consensus Statements for Deferred Treatment with Curative Intent for Localised Prostate Cancer from an International Collaborative Study (DETECTIVE Study). Eur Urol 2019; 76(6): 790–813. https://doi.org/10.1016/j.eururo.2019.09.020.
19. Yusim I, Krenawi M, Mazor E, et al. The Use of Prostate Specific Antigen Density to Predict Clinically Significant Prostate Cancer. Sci Rep 2020; 10(1): 20015. https://doi.org/10.1038/s41598-020-76786-9.
20. Epstein JI, Amin MB, Fine SW, et al. The 2019 Genitourinary Pathology Society (GUPS) White Paper on Contemporary Grading of Prostate Cancer. Arch Pathol Lab Med 2021; 145(4): 461–493.
https://doi.org/10.5858/arpa.2020-0015-RA.
21. Abedi AR, Ghiasy S, Fallah-karkan M, et al. The Management of Patients Diagnosed with Incidental Prostate Cancer: Narrative Review. Res Rep Urol 2020; 12: 105–109. https://doi.org/10.2147/RRU.S245669.
22. Wegelin O, Van Melick HHE, Hooft L, et al. Comparing Three Different Techniques for Magnetic Resonance Imaging-Targeted Prostate Biopsies: A Systematic Review of In-Bore versus Magnetic Resonance Imaging-Transrectal Ultrasound Fusion versus Cognitive Registration. Is There a Preferred Technique? Eur Urol 2017; 71(4): 517–531.
https://doi.org/10.1016/j.eururo.2016.07.041.
23. Klotz L, Pond G, Loblaw A, et al. Randomized Study of Systematic Biopsy Versus Magnetic Resonance Imaging and Targeted and Systematic Biopsy in Men on Active Surveillance (ASIST): 2-Year Postbiopsy Follow-Up. Eur Urol 2020; 77(3): 311–317.
https://doi.org/10.1016/j.eururo.2019.10.007.
24. Studenski S. Gait Speed and Survival in Older Adults. JAMA 2011; 305(1): 50.
https://doi.org/10.1001/jama.2010.1923.
25. Soubeyran P, Bellera C, Goyard J, et al. Screening for Vulnerability in Older Cancer Patients: The ONCODAGE Prospective Multicenter Cohort Study. PLoS One 2014; 9(12): e115060.
https://doi.org/10.1371/journal.pone.0115060.
26. Kálmán S, Pákáski M, Kálmán J. Esendőségszindróma: egy régi új ismerős. Orvosi Hetilap 2014; 155(49): 1935–1951.
27. Petrelli F, Vavassori I, Cabiddu M, et al. Predictive Factors for Reclassification and Relapse in Prostate Cancer Eligible for Active Surveillance: A Systematic Review and Meta-Analysis. Urology 2016; 91: 136–142.
https://doi.org/10.1016/j.urology.2016.01.034.
28. Lamy P-J, Allory Y, Gauchez A-S, et al. Prognostic Biomarkers Used for Localised Prostate Cancer Management: A Systematic Review. Eur Urol Focus 2018; 4(6): 790–803. https://doi.org/10.1016/j.euf.2017.02.017.
29. Yerram NK, Long L, O’Connor LP, et al. Magnetic Resonance Imaging-Targeted and Systematic Biopsy for Detection of Grade Progression in Patients on Active Surveillance for Prostate Cancer. Journal of Urology 2021; 205(5): 1352–1360. https://doi.org/10.1097/JU.0000000000001547.
30. Hettiarachchi D, Geraghty R, Rice P, et al. Can the Use of Serial Multiparametric Magnetic Resonance Imaging During Active Surveillance of Prostate Cancer Avoid the Need for Prostate Biopsies? – A Systematic Diagnostic Test Accuracy Review. Eur Urol Oncol 2021; 4(3): 426–436.
https://doi.org/10.1016/j.euo.2020.09.002.
31. Rajwa P, Pradere B, Mori K, Ploussard G, Leapman MS, Shariat SF. Association of Negative Followup Biopsy and Reclassification during Active Surveillance of Prostate Cancer: A Systematic Review and Meta-Analysis. Journal of Urology 2021; 205(6): 1559–1568.
https://doi.org/10.1097/JU.0000000000001701.
32. Inoue LYT, Lin DW, Newcomb LF, et al. Comparative Analysis of Biopsy Upgrading in Four Prostate Cancer Active Surveillance Cohorts. Ann Intern Med 2018; 168(1): 1. https://doi.org/10.7326/M17-0548.
33. Klotz L. Active Surveillance for Prostate Cancer: Trials and Tribulations. World J Urol 2008; 26(5): 437–442.
https://doi.org/10.1007/s00345-008-0330-8.
34. Thomsen FB, Brasso K, Berg KD, et al. Association between PSA Kinetics and Cancer-Specific Mortality in Patients with Localised Prostate Cancer: Analysis of the Placebo Arm of the SPCG-6 Study. Annals of Oncology 2016; 27(3): 460–466.
https://doi.org/10.1093/annonc/mdv607.
35. Willemse P-PM, Davis NF, Grivas N, et al. Systematic Review of Active Surveillance for Clinically Localised Prostate Cancer to Develop Recommendations Regarding Inclusion of Intermediate-Risk Disease, Biopsy Characteristics at Inclusion and Monitoring, and Surveillance Repeat Biopsy Strategy. Eur Urol 2022; 81(4): 337–346.
https://doi.org/10.1016/j.eururo.2021.12.007.
36. Ashrafi AN, Shin T, Marien A, et al. Five-Alpha Reductase Inhibitors in Men Undergoing Active Surveillance for Prostate Cancer: Impact on Treatment and Reclassification after 6 Years Follow-Up. World J Urol 2021; 39(9): 3295–3307. https://doi.org/10.1007/s00345-021-03644-2.
37. Shore ND, Renzulli J, Fleshner NE, et al. Enzalutamide Monotherapy vs. Active Surveillance in Patients With Low-Risk or Intermediate-Risk Localized Prostate Cancer. JAMA Oncol 2022; 8(8): 1128.
https://doi.org/10.1001/jamaoncol.2022.1641.
38. Mcleod DG, Iversen P, See WA, et al. Bicalutamide 150 Mg plus Standard Care vs. Standard Care Alone for Early Prostate Cancer. BJU Int 2006; 97(2): 247–254. https://doi.org/10.1111/j.1464-410X.2005.06051.x.