Trimodal therapy for prostate cancer
DOI: 10.22591/magyurol.2023.2.szantoa.88
Authors:
Szántó Árpád dr., Damásdi Miklós dr.
Pécsi Tudományegyetem, Klinikai Központ, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
Summary
The use of trimodal therapy (multimodality treatments) in prostate cancer is a new therapeutic concept that involves the previously used treatment options (radical prostatectomy, EBRT, BT, ADT, ARTA) combination. The combined therapy’s benefit is to prevent the local spread of the disease and early biochemical relapse caused by loco-regional micrometastases. The trimodal treatments do not have a high level of evidence recommendation in the available international guidelines, but based on the increasing number of publications, combination treatments may be more beneficial in the evaluation of certain oncological outcomes. In this summary, the combined trimodal treatment options is analysed, focusing on their indications, and presenting their oncological effects and the patients’ quality of life.
LAPSZÁM: MAGYAR UROLÓGIA | 2023 | 35. ÉVFOLYAM, 2. SZÁM
Összefoglalás
A multimodalitás alkalmazása egy olyan terápiás koncepció, amely korábban már alkalmazott kezelési lehetőségek (radikális prostatectomia, EBRT, BT, ADT, ARTA) kombinációban történő használatát jelenti. A terápiás modalitásnak elsősorban abban van szerepe, hogy a betegség lokális kiterjedése, illetve a lokoregionális mikrometasztázisok okozta korai biokémiai relapszus megjelenése idő előtt ne következzen be. A trimodális kezeléseknek az elérhető nemzetközi ajánlásokban nincs magas evidenciaszintű ajánlása, de az egyre szaporodó közlemények alapján a hármas kombinációs kezelések előnyösebbek lehetnek bizonyos onkológiai végkimenetelek tekintetében. Az összefoglaló közleményben tételesen elemezzük az egyes indikációs körökben alkalmazható kombinált, trimodális kezelési lehetőségeket, illetve bemutatjuk azok onkológiai és a betegek életminőségére gyakorolt hatásait.
A nemzetközi ajánlások – EAU (European Association of Urology), NCCN (National Comprehensive Cancer Network) – a szervre lokalizált prosztata-adenokarcinóma (PC) esetén kockázati besorolás alapján megkezdett terápiát írnak elő (1). A kockázati csoportokba történő besorolás alapfeltétele az induló PSA, a szövettani mintavétel alapján meghatározott Gleason score, továbbá a képalkotó vizsgálatok, kifejezetten a lokális, klinikai T-stádium meghatározásában elengedhetetlen multiparametrikus prosztata-MRI-vizsgálat eredménye szükséges. A fentiek alapján rizikócsoportokat alakítottak ki, döntően a D’Amico és munkatársai által 1998-ban publikált közlemény alapján. Az NCCN Guideline legfrissebb, 2023-as verziójában nagyon alacsony (very low), alacsony (low), közepes kedvező (intermediate favorable), illetve kedveztőlen (intermediate unfavorable), magas (high, HR) és nagyon magas (very high, VHR) csoportok különíthetők el, míg az EAU Guideline az alacsony, illetve a magas rizikócsoportokat nem bontja tovább (1. ábra).
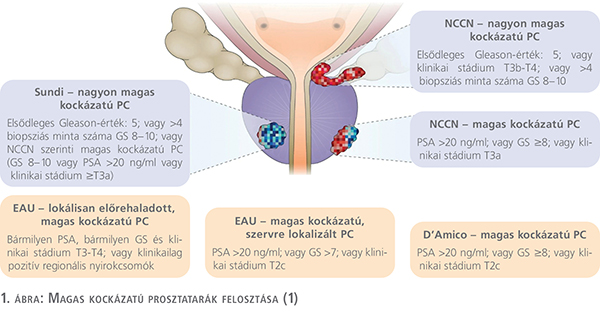
A felismert prosztatarákbetegek csak mintegy 15%-a sorolható a szervre lokalizált magas/igen magas kockázati csoportba. A magas kockázati csoport további, nagyon magas kockázati csoportra történő bontása azért lényeges, mert a kombinált terápiás lehetőségek előnyeit a szelektált, homogenizált betegcsoportok jobban mutathatják, és a velük együtt járó szövődmények arányát ennek megfelelően csökkenteni is lehet. A magas kockázatú, szervre lokalizált prosztatarák kezelésének irányelve, hogy nemcsak a primer daganat kezelése a fontos, hanem a diagnózis felállításakor a már nagy valószínűséggel mikrometasztázisokat adó lokális folyamatok preventív jelleggel történő, szisztémás kezelése is. A radikális prostatectomia, illetve az EBRT (external beam radiation therapy) alkalmazása a lokális folyamat kezelésére önmagában rosszabb klinikai eredményekkel járt, mint azok ADT-vel (androgen deprivation therapy) történő kombinációja (2, 3). A sebészeti határok kiterjesztése (regionális lymphadenectomiák elvégzése), illetve az EBRT elvégzésekor alkalmazott dóziseszkaláció klinikai vizsgálatok által bizonyítottan jobb lokális onkológiai kimenetelt biztosít, azonban az ADT megfelelő idejű alkalmazása legalább annyira fontos, döntően a mikrometasztázisok kezelése miatt (4).
A szervre lokalizált magas, nagyon magas kockázatú, illetve a lokálisan előrehaladott prosztata-adenokarcinóma „standard of care” (SC) ellátásának tárgykörében kétfajta, úgynevezett bimodális kezelési lehetőség áll rendelkezésre: a radikális prostatectomia és a külső sugárterápia (EBRT), illetve az EBRT és a hormondeprivációs terápia. A fent említett betegcsoportok kezelése után magas arányban kialakuló, döntően lokális kiújulás megelőzése céljából a nemzetközi ajánlások multimodális vagy trimodális kezelési eljárásokra tettek javaslatot. A trimodális kezeléseknek az elérhető nemzetközi ajánlásokban nincs magas evidenciaszintű ajánlásuk, de az egyre szaporodó közlemények alapján a hármas kombinációs kezelések előnyösebbek lehetnek bizonyos onkológiai végkimenetelek értékelésében (2. ábra). Az összefoglaló közleményben tételesen elemezzük az egyes indikációs körökben alkalmazható kombinált, trimodális kezelési lehetőségeket, illetve bemutatjuk azok onkológiai, valamint a betegek életminőségére gyakorolt hatásait.
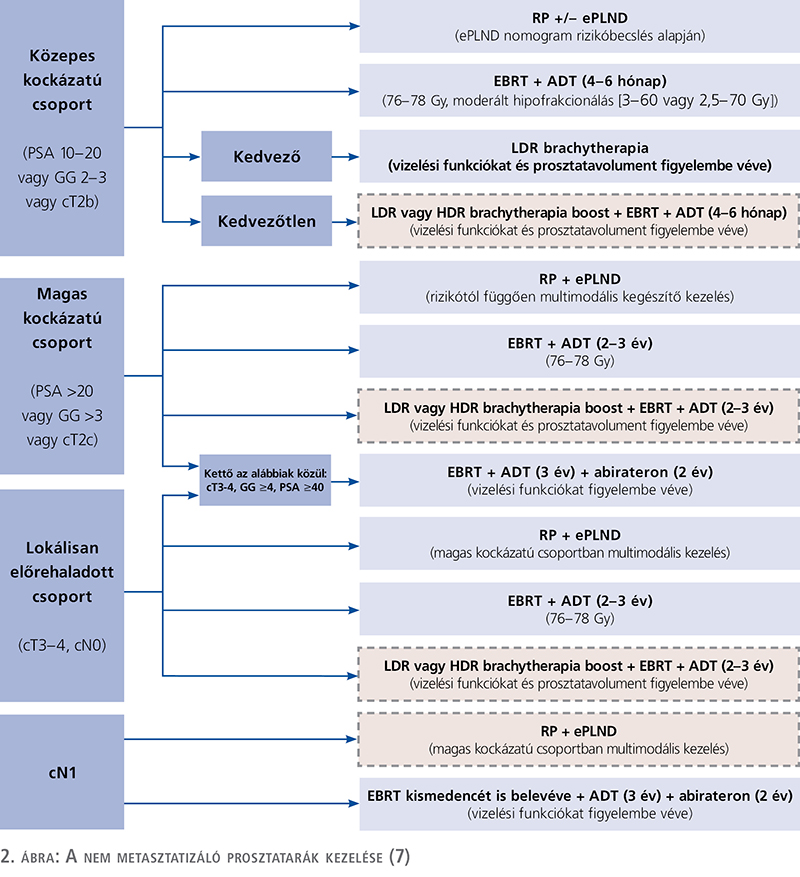
Szervre lokalizált közepes, kedvezőtlen kockázatú prosztata-adenokarcinóma
PSA 10–20 ng/ml vagy GS (Gleason score) 7, ISUP (International Society of Urological Pathology) grade 3 vagy cT2b
A trimodális terápia az NCCN által definiált közepes, de kedvezőtlen kockázatú betegcsoportban az EBRT + BT (brachytherapia) kezelések kombinációja mellé adott ADT-kezeléssel egészül ki, amelynek vizsgálati alapjául az ASCENDE-RT-tanulmány 2016-ban megjelent vizsgálati anyaga szolgált (5). A klinikai vizsgálat rámutatott arra, hogy a trimodális karon (EBRT + low dose rate-BT + ADT) a biokémiai (PSA) relapszustól mentes túlélés kétszerese volt a bimodális karon (EBRT + ADT) lévő betegekéhez képest, azonban a teljes túlélésben nem hozott szignifikáns különbséget. A trimodális kezelési karon észlelt biokémiairelapszus-mentes előny azonban megnövekedett (18 vs. 8%), késői, 3-as fokozatú urogenitális toxicitást eredményezett, amely főként húgycsőszűkületek és inkontinencia kialakulásának formájában jelentkezett (6). Az EAU-irányelvek gyenge ajánlásként javasolják a közepes, kedvezőtlen kockázatú, szervre lokalizált prosztata-adenokarcinómában az EBRT-kezelés BT LDR (low-dose-rate) vagy HDR (high-dose-rate) kiegészítését, illetve rövid idejű ADT (4-6 hónap) alkalmazását (7).
Szervre lokalizált magas (HR), illetve nagyon magas (VHR) kockázatú prosztata-adenokarcinóma
PSA >20 ng/ml vagy GS >7, ISUP grade 4/5 vagy cT2c
A szervre lokalizált, magas és igen magas kockázatú (HR, VHR) prosztataráknak két fontos jellemzője van: kifejezetten agresszív betegség, amelynek kezelés melletti lokális kiújulási aránya 10 éves utánkövetést figyelembe véve az 50%-ot meghaladhatja (8), illetve a betegség – mindezek mellett – az alkalmazott konvencionális képalkotó vizsgálatokkal szervre lokalizáltnak mondható, így a betegség az ismert lokális terápiá(ka)t alkalmazva meggyógyítható.
A szervre lokalizált magas és igen magas kockázatú prosztatadaganatban jelenleg számos kezelési lehetőség áll rendelkezésre. A hagyományos külső sugárterápia (EBRT) kiegészítéseként – például a 3D-konform sugárterápián és az intenzitásmodulált sugárterápián (intensity-modulated radiation therapy, IMRT) kívül – a tumorágy kezelését kiegészítő alacsony dózisú (LDR BT) vagy nagy dózisú (HDR-BT) boost brachytherapia is rendelkezésre áll az elhúzódó androgéndeprivációs terápia adása mellett. A radikális prostatectomiát kiegészítő korai, posztoperatív sugárterápia és adjuváns jelleggel alkalmazott ADT-kezelések is fellelhetők a napi klinikai gyakorlatban. A szakirodalomban ez idáig nem jelentek meg randomizált, kontrollált, multicentrikus klinikai vizsgálatok a trimodális terápia összehasonlítására. A trimodális terápiás lehetőségeket azonban számos munkacsoport próbálta különböző aspektusokból összehasonlítani az SC kezelési lehetőségekkel: RP + EBRT + ADT vs. EBRT + ADT, illetve EBRT + BT + ADT vs. EBRT + BT. Ezenkívül olyan összehasonlító vizsgálatok is rendelkezésre állnak, amelyek a HR, illetve VHR csoportok trimodális kezelésének vizsgálatait összegezik.
RP + EBRT + ADT
Az európai (EAU) és amerikai (NCCN) irányelvek elsősorban a multimodális kezelések alkalmazását szorgalmazzák ebben a betegcsoportban, így a sugárterápia és neoadjuváns, majd adjuváns ADT-kezelés (kiegészítő brachytherapiával vagy anélkül) az alkalmazott protokoll. A kiterjesztett kismedencei sebészeti beavatkozások két okból népszerűtlenek az urológus sebészek körében: a műtét során magas arányban visszamaradó pozitív margó (R1, R2), illetve a műtéttel együtt járó magas korai, illetve késői posztoperatív szövődmények miatt. A radikális prostatectomiát megelőző biopsziás, illetve a radikális prostatectomiás anyagban a minták ISUP-értékelése jelentősen eltérhet egymástól. A térképbiopszia alkalmával igazolt ISUP >4 fokozat esetén a szervre lokalizált prosztatadaganatok százalékos aránya 26–31%, azonban a radikális prostatectomia után feldolgozott minták nagy százalékban mutatnak magasabb, ISUP 5 fokozatot a megelőző biopsziás mintákhoz képest. A radikális sebészeti beavatkozást követő adjuváns vagy salvage ADT és/vagy irradiációs kezelés az ISUP 5 fokozat esetén – 15 éves utánkövetést figyelembe véve – mintegy 60% feletti rákspecifikus túlélést (CSS) eredményez a trimodálisan kezelt betegcsoportban (9).
Az EBRT + BT + ADT vs. EBRT + ADT összehasonlító elemzése
A sugárterápia kuratív céllal történő alkalmazásakor a dózisemelés előnyösebb a biokémiai kiújulásmentes túlélés (biochemical recurrence free survival, BCRFS) szempontjából, különösen a magasabb kockázatú (VHR) PC-ben (10). A HDR-BT széles körben alkalmazott kezelési metodika a kedvezőtlen kockázatú (HR, VHR) PC-k vagy lokálisan előrehaladott PC-k kezelésében, amely úgy teszi lehetővé a dózis emelését, hogy a kezeléssel együtt járó toxicitás minimális marad (11). A HDR-BT és az EBRT kombinációjával ennek megfelelően összességében magasabb sugárdózis (akár 115 Gy) leadása eredményezhető, amely csökkenteni fogja a lokális kiújulás kockázatát. Vargas és munkatársai nagy betegszámú klinikai vizsgálat (12) keretén belül olyan magas kockázatú betegek adatait dolgozták fel, akik egyenként 1-3 rizikófaktorral rendelkeztek, EBRT- és BT-terápiát kaptak neoadjuváns ADT-vel vagy anélkül (≤6 hónap vs. ADT nélkül) kezelve. A klinikai vizsgálat igazolta, hogy a biokémiai relapszusmentes túlélési arány (7-8 éves utánkövetési idő) 81–85% közé emelhető a trimodális terápiában részesülő karon.
Lokálisan előrehaladott prosztata-adenokarcinóma
cT3-4, cN0, cN1
Egy másik lehetőség a metasztatikus formában sikerrel alkalmazott kezelési lehetőségeket (ARTA, kemoterápia) még korábbi, szervre lokalizált, vagy lokálisan előrehaladott állapotokban alkalmazni. Egy II. fázisú klinikai vizsgálatban (NCT00924469) radikális prostatectomia előtt, neoadjuváns jelleggel abirateron-acetát- és ADT-kezelés mellett mintegy 30%-os komplett patológiai remisszió következett be, nagy valószínűséggel a potenciálisan korai kasztrációrezisztens klónok eliminálása miatt (13). Egy másik II. fázisú klinikai vizsgálatban ADT és ipilimumab (CTLA4-blokkoló) kombinációját alkalmazták lokálisan előrehaladott betegeknél radikális prostatectomia előtt, amelynek során szignifikáns korai PSA-választ értek el a beteg jelentős (54% vs. 38%) hányadánál (14). A CALGB 90203 elnevezésű, randomizált klinikai vizsgálatban (15) radikális prostatectomia előtt, szintén neoadjuváns jelleggel ADT- és docetaxelkezeléseket végeztek, illetve rendelkezésre állnak olyan klinikai vizsgálatok is, amelyek a sugárterápiát kombinálták enzalutamiddal (16), TAK700- (Orteronel-) (17) vagy taxánalapú kemoterápiával (18).
A fent említett klinikai vizsgálatok hosszú távú eredményei (overall survival, OS; metastatic free survival, MFS) még nem ismeretesek, de a jól definiált, homogenizált betegcsoportoknál (cN0, cN1) ezek a végpontok szignifikáns előnyt fognak mutatni a kontrollcsoportokkal szemben a lokalizált betegségterápia gerinceként szolgáló radikális műtétet vagy a sugárterápiát kiegészítve.
Összefoglalás
A multimodalitás alkalmazása egy olyan terápiás koncepció, amely korábban már alkalmazott kezelési lehetőségek (radikális prostatectomia, EBRT, BT, ADT, ARTA) kombinációban történő használatát jelenti, amelynek elsősorban abban van szerepe, hogy megakadályozza a betegség lokális kiterjedését, illetve hogy a lokoregionális mikrometasztázisok okozta korai biokémiai relapszus ne jelenjen meg idő előtt. A trimodális terápiában részt vevő betegek pontos definiálása elengedhetetlen ahhoz, hogy a kombinált kezelés előnyei (a lokális relapszus vagy a korai biokémiai progresszió megelőzése, a teljes túlélés növelése) a vele járó hátrányok, szövődmények mellett mérhetőek legyenek. Vitathatatlan siker az, ha olyan kezelési lehetőségeket alkalmazunk, amelyek után a beteg nem a kezelt betegségbe, hanem azzal együtt, „vele” hal meg. A „vele” és nem pedig az „abból” tekinthető ennek megfelelően terápiás sikernek. Egy kombinált terápia kockázat/nyereség aránya különösen fontos annak mérlegelésekor, hogy folytassuk-e az esetleg szerényebb haszonnal járó kezelést az életminőség romlásának rovására.
Rövidítések: EAU=European Association of Urology; NCCN=National Comprehensive Cancer Network; PSA=prostate specific antigen; PC=prostate cancer; EBRT=external beam radiation therapy; ADT=androgen deprivation therapy; ISUP=International Society of Urological Pathology; BT=brachytherapy; LDR= low-dose-rate; HDR=high-dose-rate; HR=high risk; VHR=very high risk; CSS=cancer specific survival; BCRF=biochemical recurrence free survival; MFS= metastatic free survival; OS=overall survival; PFS=progression free survival; IMRT=intensity-modulated radiation therapy; ARTA=androgen receptor targeted agents; P=radical prostatectomy; SC=standard of care
Irodalom
1. Wilkins LJ, Tosoian JJ, Sundi D, et al. Surgical management of high-risk, localized prostate cancer Nat Rev Urol 2020 Dec; 17(12): 679–690. https://doi.org/10.1038/s41585-020-00384-7
2. Bolla M, et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002; 360: 103–6. https://doi.org/10.1016/S0140-6736(02)09408-4
3. Pilepich MV, et al. Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma – Long-term results of phase III RTOG 85–31. Int J Radiat Oncol Biol Phys 2005; 61: 1285–90. https://doi.org/10.1016/j.ijrobp.2004.08.047
4. Roach M 3rd. Dose escalated external beam radiotherapy versus neoadjuvant androgen deprivation therapy and conventional dose external beam radiotherapy for clinically localized prostate cancer: do we need both? Strahlenther Onkol 2007; 183(Spec No 2): 26–8. https://doi.org/10.1007/s00066-007-2011-8
5. Rodda S, Tyldesley S, Morris WJ, et al. ASCENDE-RT: An Analysis of Treatment-Related Morbidity for a Randomized Trial Comparing a Low-Dose-Rate Brachytherapy Boost with a Dose-Escalated External Beam Boost for High- and Intermediate-Risk Prostate Cancer Int J Radiat Oncol Biol Phys 2017 Jun 1; 98(2): 286–295. https://doi.org/10.1016/j.ijrobp.2017.01.008
6. Morris WJ, et al. Androgen Suppression Combined with Elective Nodal and Dose
Escalated Radiation Therapy (the ASCENDE-RT Trial): An Analysis of Survival Endpoints for a Randomized Trial Comparing a Low-Dose-Rate Brachytherapy Boost to a Dose-Escalated External Beam Boost for High- and Intermediate-risk Prostate Cancer. Int J Radiat Oncol Biol Phys 2017; 98: 275. https://doi.org/10.1016/j.ijrobp.2016.11.026
7. Roach M 3rd. Dose escalated external beam radiotherapy versus neoadjuvant androgen deprivation therapy and conventional dose external beam radiotherapy for clinically localized prostate cancer:do we need both? Strahlenther Onkol 2007; 183 Spec No 2: 26–8. [PubMed: 18167004]
8. Mottet N, Bellmunt J, Bolla M, et al. EAU-ESTRO-SIOG Guidelines on Prostate Cancer. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent. European Urology 2017; 71(4): 618–629. https://doi.org/10.1016/j.eururo.2016.08.003
9. Walz J, et al. A nomogram predicting 10-year life expectancy in candidates for radical prostatectomy or radiotherapy for prostate cancer. J Clin Oncol 2007; 25: 3576. https://doi.org/10.1200/JCO.2006.10.3820
10. Morris WJ, Tyldesley S, Rodda S, et al. Androgen Suppression Combined With Elective Nodal and Dose Escalated Radiation Therapy (the ASCENDE-RT Trial): an analysis of survival endpoints for a randomized trial comparing a low-dose-rate brachytherapy boost to a dose-escalated external beam boost for high- and intermediate-risk prostate cancer. Int J Radiat Oncol Biol Phys 2017; 98(2): 275–285. https://doi.org/10.1016/j.ijrobp.2016.11.026
11. Boorjian SA, Karnes RJ, Viterbo R, et al. Long-term survival after radical prostatectomy versus external-beam radiotherapy for patients with high-risk prostate cancer. Cancer 2011; 117(13): 2883–2891. https://doi.org/10.1002/cncr.25900
12. Vargas C, et al. High-dose radiation employing external beam radiotherapy and high-dose rate brachytherapy with and without neoadjuvant androgen deprivation for prostate cancer patients with intermediate- and high-risk features. Prostate Cancer Prostatic Dis 2006; 9: 245–53.
https://doi.org/10.1038/sj.pcan.4500882
13. Taplin ME, et al. Effect of neoadjuvant abiraterone acetate (AA) plus leuprolide acetate (LHRHa) on PSA, pathological complete response (pCR), and near pCR in localized high-risk prostate cancer (LHRPC): Results of a randomized phase II study. J Clin Oncol; ASCO Annual Meeting; June 1-5, 2012; Chicago, Illinois. 2012. suppl; abstr 4521. Ther Adv Urol 2009; 1: 251–8. 123. https://doi.org/10.1200/jco.2012.30.15_suppl.4521
14. Tollefson MK, et al. A randomized phase II study of ipilimumab with androgen ablation compared with androgen ablation alone in patients with advanced prostate cancer. ASCO Genitourinary Cancers Symposium; March 5-7, 2010; San Francisco, CA. 2010. Abstract 168.
15. Eastham JA, Heller G, Halabi S, et al. Cancer and Leukemia Group B 90203 (Alliance): Radical Prostatectomy With or Without Neoadjuvant Chemohormonal Therapy in Localized, High-Risk Prostate Cancer J Clin Oncol 2020 Sep 10; 38(26): 3042–3050. https://doi.org/10.1200/JCO.20.00315
16. Kaplan I, Bubley GJ, Bhatt R, Taplin ME, et al. Enzalutamide With Radiation Therapy for Intermediate-Risk Prostate Cancer: A Phase 2 Study Int J Radiat Oncol Biol Phys 2021 Aug 1; 110(5): 1416–1422.
https://doi.org/10.1016/j.ijrobp.2021.02.027
17. Bruner DW, Pugh S, Michaelson D, Hamstra DA, Bachand F, et al. RTOG/NRG 1115 Quality of Life of Phase III Dose Escalated Radiation Therapy (RT) and Standard Androgen Deprivation Therapy (ADT) with GnRH Agonist vs. Dose Escalated RT and ADT with GnRH Agonist and Orteronel (TAK-700) for Men with High-Risk Prostate International Journal of Radiation Oncology Biology Physics November 2022; 114(3, Supplement, 1) e214. https://doi.org/10.1016/j.ijrobp.2022.07.1151
18. Rosenthal SA, Hu C, Sartor O, et al. Effect of Chemotherapy With Docetaxel With Androgen Suppression and Radiotherapy for Localized High-Risk Prostate Cancer: The Randomized Phase III NRG Oncology RTOG 0521 Trial J Clin Oncol. 2019 May 10; 37(14): 1159–1168.
https://doi.org/10.1200/JCO.18.02158