Targeted diagnosis, more precise therapy: results of MR fusion biopsy at the Budapest Péterfy Sándor Street Hospital and Outpatient Clinic
DOI: 10.22591/magyurol.2025.2.bartekv.46
Authors:
Bartek Virág dr.1, Berta Tibor dr.1, Altenni Mohammed dr.1,
Lajos Márton dr.1, Volford Gábor dr.2, Márványkövi Fanni Magdolna dr.1,
Beöthe Tamás dr.1, Buzogány István dr.1
1Budapesti Péterfy Sándor Utcai Kórház-Rendelőintézet, Budapest (osztályvezető: Buzogány István dr.)
2Affidea Magyarország Kft.
Summary
Introduction: Prostate cancer affects approximately one in eight men during their lifetime. The gold standard for diagnosis is a biopsy, which can be performed using either the transrectal or transperineal approach. With advances in radiology, in addition to traditional “mapping” biopsies, MRI-ultrasound fusion techniques are increasingly being used. Prostate lesions identified on MRI can be categorized from 1 to 5 based on the PI-RADS (Prostate Imaging-Reporting and Data System) criteria. These categories reflect the likelihood that a lesion is clinically significant (defined as ISUP grade ≥2 or Gleason score ≥3+4).
Material and methods: Between 2019 and 2024, a total of 478 MRI fusion-guided prostate biopsies were performed at the Urology Department of Péterfy Sándor Street Hospital and Clinic. Of these, 368 cases were included in the analysis; cases lacking baseline PSA data were excluded.
Results: Age 68.33±7.49, PSA 12.38±11.76. Prostate carcinoma was confirmed in 247 cases, negative results were obtained in 121 cases. In 47 cases, a positive sample was obtained after a previous negative biopsy. In 1 case, a positive sample was taken from a PI-RADS-3, in 17 cases, PI-RADS-4, and in 29 cases, PI-RADS-5 nodule.
Conclusion: MRI fusion-guided prostate biopsy enhances the early detection of clinically significant prostate tumours. This technique facilitates earlier and more accurate histological diagnosis, allowing timely initiation of appropriate therapy and ultimately improving patient outcomes and survival rates.
LAPSZÁM: MAGYAR UROLÓGIA | 2025 | 37. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Bevezetés: A prosztatadaganat nyolcból egy férfit érint élete során. Diagnosztikájának aranystandardja a biopsziás mintavétel, transrectalis vagy transperinealis technikával. A radiológia fejlődésével a hagyományos térképbiopszia mellett egyre elterjedtebb az MR-fúziós technikával végzett beavatkozás is. Prosztata MRI-felvételeken a látott gócot PI-RADS (Prostate Imaging-Reporting and Data System) szempontok alapján 1–5 kategóriákba oszthatjuk. Ezek a kategóriák korrelálnak azzal, hogy a látott eltérés milyen valószínűséggel klinikailag szignifikáns (ISUP grade ≥2, vagy Gleason score ≥3+4).
Betegek és módszerek: A Péterfy Sándor Utcai Kórház és Rendelőintézet Urológiai Osztályán 2019–2024 között 478 MR-fúziós technikával végzett biopszia történt. Ebből 368 adatot dolgoztunk fel (kizártuk a feldolgozásból, ahol nem állt rendelkezésre kiinduló PSA).
Eredmények: Életkor 68,33±7,49, PSA 12,38±11,76 adódott. 247 esetben igazoltuk a prosztatadaganatot, 121 esetben negatív eredményt kaptunk. 47 esetben korábbi negatív térképbiopszia után kaptunk pozitív eredményt. 1 esetben PI-RADS-3, 17 esetben PI-RADS-4, 29 esetben PI-RADS-5 gócból lett pozitív mintavétel.
Következtetés: Az MR-fúziós biopszia segítségével a prosztatadaganat korábban felismerhető, korábban tudunk megfelelő szövettani diagnózishoz jutni. Ezáltal a páciens korábban juthat adekvát terápiához, ezzel javítva a túlélést.
Bevezetés
A prosztatadaganat elsősorban a 45 év feletti férfiakat érinti, és világszerte a vezető daganatos halálokok közé tartozik (1). A WHO (World Health Organization) adatai szerint Magyarországon évente 4000 új esetet regisztrálnak. Régiónkban az összes haláleset közel 5%-áért felelős, és 2023-ban mintegy 1300 férfi halála hozható összefüggésbe prosztatadaganattal vagy annak közvetlen szövődményeivel (2).
Emelkedett PSA-szint vagy kóros rektális digitális vizsgálati (RDV) lelet esetén multiparametrikus prosztata-MRI elvégzése javasolt (3). Megjegyzendő, hogy a Society of Urologic Oncology (SUO) és a European Association of Urology (EAU) 2024-es állásfoglalása szerint szűrővizsgálat során az emelkedett PSA RDV nélkül is indikáció mpMRI elvégzésére és a biopsziás mintavételre (4). Az MRI-felvételek értékelése tapasztalt radiológus feladata, aki a látott elváltozásokat a PI-RADS (Prostate Imaging–Reporting and Data System) klasszifikáció alapján kategorizálja.
A PI-RADS-besorolás – European Society of Urogenital Radiology (ESUR) – többszöri megújítással 2012 óta van használatban. Alapja a multiparametrikus MRI, amely T2 súlyozott, diffúzió súlyozott (DWI) és dinamikus kontraszt súlyozott (DCE) képek kombinációjából áll (5). A beosztás 1–5-ig osztályozza, hogy mennyi az esélye a klinikailag szignifikáns (ISUP grade ≥2, vagy Gleason score ≥3+4) daganat jelenlétének (6, 7). A PI-RADS-1 és PI-RADS-2 elváltozások valószínűleg jóindulatúak, PI-RADS-3 beosztástól felfelé pedig egyre nő az esélye a rosszindulatú daganat valószínűségének (8).
Amennyiben a képalkotó vizsgálatok alapján daganatos megbetegedés gyanúja merül fel, a definitív diagnózis szövettani mintavétellel, azaz prosztatabiopsziával állítható fel. A mintavétel elvégezhető transrectalis (TRUS) vagy transperinealis úton.
A biopsziás mintavétel az évek során sokat fejlődött. Legrégebben alkalmazott módszer a random, „ujjvezérelt” mintavétel, amely nem igényel képalkotó asszisztenciát, ennek szenzitivitása különböző források szerint 48-60% (9, 10, 11). Legnagyobb hátránya az „undersampling”, azaz, hogy a prosztata bizonyos régióiból annak anatómiája miatt nehezebb a mintavétel.
Napjainkban a legelterjedtebb, különösen az alacsony eszközigény és gazdasági megfontolások miatt az ultrahangvezérelt random biopszia, amely során transrectalis vagy transperinealis ultrahangkészülékkel a prosztatából azt régiókra osztva „térképszerűen” veszünk szövettani mintát. Ennek szenzitivitása 55-65% között van (9, 10, 11).
Az MRI-technológia fejlődésével és szélesebb körű hozzáférhetőségével párhuzamosan az MR-alapú diagnosztikai módszerek alkalmazása is folyamatosan növekszik. Az USA-ban a prosztatabiopsziák kb. 60%-át végzik MRI-asszociált módszerekkel (12). Ennek „legegyszerűbb” fajtája a kognitív MR-fúziós biopszia, ahol az MRI-képeket áttekintve annak alapján végzünk térképbiopsziát ultrahangvezérelve. Hátránya, hogy szenzitivitása nagymértékben függ a beavatkozást végző orvos jártasságától, szenzitivitása 65-75% között van (9, 10, 11).
Az MR-fúziós biopszia a jelenleg rutinszerűen alkalmazott technikák közül a legmagasabb szenzitivitással rendelkezik, amely 85-95% között mozog. Az eljárás során speciálisan erre alkalmas ultrahangkészüléket használunk, amelyhez szoftveresen társítjuk az előzetesen készült MRI-felvételeket („fúzió”). Az MRI-képek kontúrozását radiológus végzi el – intraoperatív vagy preoperatív módon –, ezáltal segítve a célzott és pontos mintavételt.
A PRECISION-vizsgálat során, amely egy multicentrumos, randomizált, non-inferior vizsgálat volt, az MR-fúziós prosztatabiopsziát és az ultrahangvezérelt random biopsziát hasonlították össze. 500 férfi beteget randomizáltak, klinikailag szignifikáns daganat a randomizált férfiak 38%-ában volt kimutatható MR-fúziós, és 26%-ában standard térképbiopsziával (95% konfidenciaintervallum [CI], 4–20; p = 0,005), ezzel igazolva az MRI-asszociált módszer jobb szenzitivitását (11).
A PROMIS-vizsgálat során az Egyesült Királyságban 740, prosztatadaganat-gyanús pácienst vizsgáltak egy prospektív párosított kohort során. Az mpMRI (multiparametrikus MRI) a klinikailag szignifikáns daganatok 93%-át mutatta ki (magas szenzitivitás), ellenben az mpMRI nélkül végzett TRUS-biopszia csak a klinikailag szignifikáns daganatok 48%-át. A vizsgálat afelé mutat, hogy az mpMRI önmagában is jobb szenzitivitású, mint a random, ultrahangvezérelt prosztata-térképbiopszia. A PROMIS-vizsgálat javasolja az mpMRI használatát „triázs”-ként, elkerülve ezzel a felesleges mintavételeket, illetve a „túldiagnosztizálását” a klinikailag nem szignifikáns prosztatadaganatoknak (13).
Betegek és módszerek
Retrospektív elemzésünk során a Budapesti Péterfy Sándor Utcai Kórház-Rendelőintézet Urológiai Osztályán 2019 és 2024 között MR-fúziós TRUS-biopszián átesett páciensek adatait vizsgáltuk. Minden páciensnél előzetes szűrés történt és multiparametrikus MRI (mpMRI) készült legalább 1,5 T MRI-berendezéssel. A leletek értékelésénél a PI-RADSv2.1 rendszert használtuk. Elsősorban a PI-RADS-4 és PI-RADS-5 gócokból vettünk mintát, illetve újra leletezést és klinikai képet figyelembe véve egyes PI-RADS-3 léziókból.
A gyűjtött adatok között voltak a PI-RADS-besorolás, PSA, szövettani diagnózis (Gleason-score), korábbi biopszia esetén a korábbi biopszia szövettani eredménye (Gleason-score), illetve a kapott kezelés. Az adatgyűjtés Mac Microsoft® Excel 16.89.1 (24091630) segítségével történt. A gyűjtött adatokon egyszerű statisztikai próbákat végeztünk.
Eredmények
Osztályunkon 2019–2024 között 478 MR-fúziós TRUS-biopszia történt. Ebből 368 adatot dolgoztunk fel. Az adatfeldolgozásból kizártuk azokat az eseteket, ahol a kiindulási PSA nem állt rendelkezésre.
A vizsgált páciensek életkora 68,33±7,49 (n = 368) adódott, PSA 12,38±11,76 (n = 368). 247 esetben igazoltunk prosztatakarcinómát, míg 121 esetben negatív eredményt kaptunk.
Vizsgálatunk célja volt, hogy felmérjük, milyen detekciós arányt értünk el MR-fúziós TRUS-biopsziával azokban az esetekben, ahol a korábban végzett random, ultrahangvezérelt biopszia negatív eredményt adott.
89 esetben történt korábban random mintavétel. 47 esetben korábbi negatív biopszia után kaptunk pozitív eredményt (52,8%). A korábbi negatív biopszián átesett páciensek közül 1 esetben PI-RADS-3, 17 esetben PI-RADS-4, illetve 29 esetben PI-RADS-5 gócból igazoltuk a daganat jelenlétét. A szövettani megoszlást az 1. ábra ismerteti.
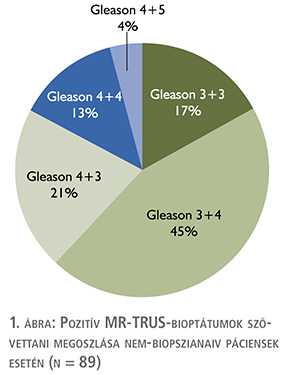
Megvizsgáltuk, hogy az MRI-felvételeken meghatározott PI-RADS-besorolás miként korrelált a szövettani diagnózisokkal.
20 alkalommal történt PI-RADS-3 gócból a mintavétel. PI-RADS-3 góc esetén a páciensek életkori átlaga 64,90±6,67 (n=20) évnek, PSA átlaga 10,49±5,46 (n=20)-nek adódott. A PSA alakulását PI-RADS-3 gócok esetében a 2. ábra mutatja.
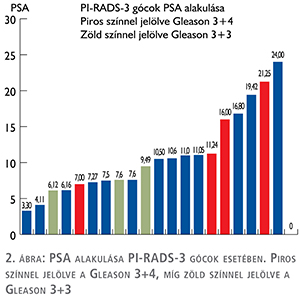
PI-RADS-3 páciensek esetében 11 alkalommal primer, míg 9 esetben rebiopszia történt. A vizsgált mintákban 8 esetben igazoltunk prosztatakarcinómát (3 esetben Gleason 3+3, 4 esetben Gleason 3+4, 1 esetben nincs pontos adat).
183 esetben PI-RADS-4 elváltozásból történt mintavétel, 111 pozitív lelettel. Az életkorok átlaga 68,11±7,67 (n=183), PSA átlaga 10,45±10,55 (n=183)-nek adódott. A szövettani eredmények megoszlását az 1. táblázat mutatja.
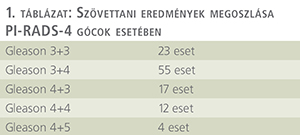
PI-RADS-4 kategóriájú elváltozás esetén a biopsziát 139 esetben olyan betegeknél végeztük el, akiknél korábban még nem történt mintavétel (biopszia-naiv), míg 44 esetben már korábbi szövettani eredménnyel rendelkező pácienseknél történt ismételt mintavétel.
165 esetben PI-RADS-5 gócból történt a mintavétel. Életkor átlaga 69,44±7,07 (n=165), PSA átlaga 14,53±12,53 (n=165)-nek adódott. Szövettani eredmények megoszlását a 2. táblázat mutatja.
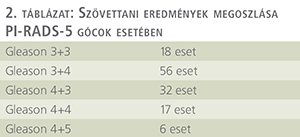
A vizsgált esetek közül 110 betegnél nem történt korábban biopszia, míg 55 esetben korábbi mintavétel szerepelt az anamnézisben. A biopszia 129 esetben igazolta a daganat jelenlétét, míg 36 esetben negatív eredményt adott, ami 78,2%-os pozitivitási aránynak felel meg.
Megvizsgáltuk, hogy van-e összefüggés a PSA-szint, a PI-RADS-beosztás és a pozitív szövettani diagnózis között, de a vizsgált mintákon nem kaptunk szignifikáns eredményt. Szenzitivitása az osztályunkon történt MR-fúziós TRUS-biopsziáknak 93% felett volt.
Megbeszélés
A prosztatadaganat világszinten és hazánkban is a vezető halálokok közé tartozik a 45 év feletti férfiak esetében. Az onkológiai és sebészi terápiák fejlődésével a korai, pontos diagnózis felállítása kritikus a prognózis szempontjából. Emellett azzal, hogy magasabb szenzitivitású módszert választunk, elkerüljük a rebiopsziák arányát, így a páciens és az egészségügyi rendszer terhelését is csökkentjük.
Vizsgálatunkban 368, MR-TRUS-módszerrel végzett prosztatabiopszia eredményét dolgoztuk fel. Eredményeink azt mutatják, hogy ezzel a módszerrel magas szenzitivitás érhető el. Korábban negatív szövettani mintavételen átesett páciensek esetén 247 esetben igazoltunk prosztatakarcinómát, ami alátámasztja az MR-fúziós biopszia magas szenzitivitását. Eredményeink korrelálnak az irodalmi adatokkal, amelyek az mpMRI- és az MR-TRUS-fúziós biopszia jobb szenzitivitását igazolják a hagyományos, random, ultrahangvezérelt térképbiopsziával szemben (PROMIS és PRECISION vizsgálat) (11, 13).
Pozitív szövettani leletek aránya összefüggésben van a PI-RADS-beosztással. PI-RADS-5 gócokból 78,2%-ban, míg PI-RADS-4 gócok esetén 60,65%-ban kaptunk pozitív eredményt. PI-RADS-3 góc esetén 4 esetben igazoltunk klinikailag szignifikáns (Gleason 3+4), míg 3 esetben Gleason 3+3 besorolású daganatot. Oerther és munkatársai 17 cikket vizsgáló metaanalízisükben azt találták, hogy a PI-RADS-3 gócoknál a klinikailag szignifikáns daganat aránya (cancer detection rate, CDR) 16% (7–27%), PI-RADS-4 gócoknál 59% (39–78%), míg PI-RADS-5 gócoknál 85% (73–94%) (p < 0,001) (14). Ez arányaiban korrelál a mi adatainkkal is.
A vizsgálatunkban a PSA aránya viszonylag magas átlagú volt (12,38±11,76), amely részben magyarázza a magas pozitív biopsziás arányt. Emellett az adatokból látszik, hogy a mintánk szórása is magas. Ezt magyarázhatja, hogy nagy területtel rendelkező osztályként a beteganyagunk igen heterogén.
Fontos kiemelni, hogy a módszer hatékonysága nagymértékben függ a leletező radiológustól. Multiparametrikus MRI-képek leletezésében jártas radiológus nagyban javítja a biopsziák eredményességét. Illetve tapasztalataink azt mutatják, hogy minél nagyobb gyakorlatra tesz szert mind a radiológus, mind a beavatkozást végző orvos, az eredmények annál jobbak és homogénebbek lesznek. Nagyobb esetszámmal az eredmények egyértelműen javulnak, ezért javasolt a beavatkozást elsősorban olyan osztályokon végezni, ahol lehetőség van a páciensek széles körű bevonására.
Vizsgálatunk korlátai közé tartozik a retrospektivitás torzítása, illetve az utánkövetés rövidsége. Mivel a beavatkozás után a páciensek gyakran visszatérnek az őket beutaló intézménybe, a kezelést és utánkövetést gyakran nem mi végezzük.
Következtetések
Az MR-fúziós TRUS-biopszia egy megbízható, magas szenzitivitású módszer a szignifikáns prosztatadaganat kimutatására. Ez egy klinikailag releváns és hatékony diagnosztikai eszköz, amely napjainkra egyre nagyobb teret nyer. Az ultrahangvezérelt „random” biopsziával ellentétben ez a módszer inkább támaszkodik a radiológusra, mint a beavatkozást végző urológusra, ezért fontos az ebben a módszerben jártas radiológus bevonása. Ezeket figyelembe véve egy komplex, modern, multidiszciplináris diagnosztikai módszert tudunk nyújtani a pácienseinknek.
Irodalom
2. WHO. WHO Mortality Database. 2023; Available from: https://platform.who.int/mortality/themes/theme-details/topics/indicator-groups/indicator-group-details/MDB/prostate-cancer.
3. Cornford P, van den Bergh RCN, Briers E, et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG Guidelines on Prostate Cancer-2024 Update. Part I: Screening, Diagnosis, and Local Treatment with Curative Intent. Eur Urol 2024; 86(2): 148–163.
https://doi.org/10.1016/j.eururo.2024.03.027
4. Ferraris FMD, Raman JDMDFF, Barreiro DMD. Is Era of the Digital Rectal Examination (DRE) for Prostate Cancer Detection and Management Over? JU Open Plus 2024; 2(10).
https://doi.org/10.1097/JU9.0000000000000197
5. Noujeim JP, Belahsen Y, Lefebvre Y, et al. Optimizing multiparametric magnetic resonance imaging-targeted biopsy and detection of clinically significant prostate cancer: the role of perilesional sampling. Prostate Cancer Prostatic Dis 2023; 26(3): 575–580.
https://doi.org/10.1038/s41391-022-00620-8
6. Turkbey B, Purysko AS. PI-RADS: Where Next? Radiology 2023; 307(5): e223128. https://doi.org/10.1148/radiol.223128
7. Urology, E.A.o., EAU Guidelines. Edn. presented at the EAU Annual Congress Madrid. 2025.
8. Pooli A, Johnson DC, Shirk J, et al. Predicting Pathological Tumor Size in Prostate Cancer Based on Multiparametric Prostate Magnetic Resonance Imaging and Preoperative Findings. J Urol 2021; 205(2): 444–451.
https://doi.org/10.1097/JU.0000000000001389
9. Valerio M, Donaldson I, Emberton M, et al. Detection of Clinically Significant Prostate Cancer Using Magnetic Resonance Imaging-Ultrasound Fusion Targeted Biopsy: A Systematic Review. European Urology 2015; 68(1): 8–19. https://doi.org/10.1016/j.eururo.2014.10.026
10. Klotz L, Chin J, Black PC, et al. Comparison of Multiparametric Magnetic Resonance Imaging-Targeted Biopsy With Systematic Transrectal Ultrasonography Biopsy for Biopsy-Naive Men at Risk for Prostate Cancer: A Phase 3 Randomized Clinical Trial. JAMA Oncology 2021; 7(4): 534–542. https://doi.org/10.1001/jamaoncol.2020.7589
11. Kasivisvanathan V, Rannikko AS, Borghi M, et al. MRI-Targeted or Standard Biopsy for Prostate-Cancer Diagnosis. N Engl J Med 2018; 378(19): 1767–1777. https://doi.org/10.1056/NEJMoa1801993
12. Novara G, Zattoni F, Zecchini G, et al. Role of targeted biopsy, perilesional biopsy, and random biopsy in prostate cancer diagnosis by mpMRI/transrectal ultrasonography fusion biopsy. World J Urol 2023; 41(11): 3239–3247. https://doi.org/10.1007/s00345-023-04382-3
13. Ahmed HU, El-Shater Bosaily A, Brown LC, et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. The Lancet 2017; 389(10071): 815–822. https://doi.org/10.1016/S0140-6736(16)32401-1
14. Oerther B, Engel H, Bamberg F, et al. Cancer detection rates of the PI-RADSv2.1 assessment categories: systematic review and meta-analysis on lesion level and patient level. Prostate Cancer and Prostatic Diseases 2022; 25(2): 256–263. https://doi.org/10.1038/s41391-021-00417-1