BRCA1/2 Mutation Testing in Prostate Cancer Patients during Routine Clinical Care
DOI: 10.22591/magyurol.2025.4.soosa.159
Authors:
Soós Áron dr.1, Csizmarik Anita dr.1, Tímár József dr.2, Barbai Tamás dr.2,
Riesz Péter dr.1, Horváth András dr.1, Szűcs Miklós dr.1, Nyirády Péter dr.1, Szarvas Tibor dr.1,3
1Urológiai Klinika, Semmelweis Egyetem, Budapest, Magyarország
2Patológiai, Igazságügyi és Biztosítási Orvostani Intézet, Semmelweis Egyetem, Budapest, Magyarország
3Urológiai Klinika, Esseni Egyetemi Klinika, Essen, Németország
Summary
BRCA1/2-mutations have significant clinical relevance in metastatic castration-resistant prostate cancer (mCRPC), with a relatively high prevalence (10–15%) and an established association with poorer prognosis as well as improved response to targeted PARP inhibitor therapies. The aim of our study was to summarize the clinical, technical, and therapeutic experience related to BRCA1/2 gene sequencing initiated at the Department of Urology, Semmelweis University, between 2019 and 2024. BRCA1/2 testing was performed in 143 prostate cancer patients, of whom 124 yielded successful sequencing results, with a 17% BRCA1/2 positivity rate. In 92% of cases, testing was initiated in the metastatic stage and most often used tissue samples from core needle biopsies, radical or transurethral surgeries, or peripheral blood. The highest failure rate was observed in needle biopsy samples (13%; p=0.016). The age of the samples did not significantly affect sequencing success. BRCA1/2-positive patients generally received a higher number of systemic therapies, and 38% underwent PARP-inhibitor or platinum-based treatment. Our findings confirm that the implementation of BRCA1/2 sequencing in prostate cancer diagnostics is effective and supports personalized decision-making in routine clinical practice.
LAPSZÁM: MAGYAR UROLÓGIA | 2025 | 37. ÉVFOLYAM, 4. SZÁM
Összefoglaló
A BRCA1/2-mutációk kiemelt klinikai jelentőséggel bírnak a metasztatikus, kasztrációrezisztens prosztatarákban (mCRPC), mivel előfordulási arányuk magas (10–15%), és jelenlétük összefüggést mutat a rosszabb prognózissal, valamint a célzott PARP-gátló terápiákra adott kedvezőbb válasszal. Vizsgálatunk célja a Semmelweis Egyetem Urológiai Klinikája által 2019 és 2024 között indított BRCA1/2-génszekvenálások klinikai, technikai és terápiás tapasztalatainak összegzése volt. Összesen 143 PC-beteg esetében történt vizsgálatkérés, amely csoportból 124 esetben készült sikeres vizsgálat, 17%-os BRCA1/2-pozitivitási arány mellett. A vizsgálatokat az esetek 92%-ában metasztatikus stádiumban indították, és leggyakrabban tűbiopsziás, illetve radikális vagy transurethralis műtétből származó szövetmintából, vagy pedig vérből történtek. A tűbiopszia esetében volt a legmagasabb a sikertelen vizsgálatok aránya (13%; p=0,016). A minták kora nem befolyásolta szignifikánsan a szekvenálás sikerességét. A BRCA1/2-pozitív betegek általánosságban több vonalbeli kezelést kaptak, és 38%-uk részesült PARP-gátló vagy platinaalapú terápiában. Eredményeink megerősítik, hogy a BRCA1/2-szekvenálás rutinszerű alkalmazása a prosztatarák diagnosztikájában és terápiatervezésében hatékony, és hozzájárul a személyre szabott onkológiai ellátás hazai elterjedéséhez.
Bevezetés
A prosztatarák (PC) a férfiak egyik leggyakoribb rosszindulatú daganata, amely jelentős egészségügyi terhet ró a társadalomra. A betegség incidenciája növekvő tendenciát mutat: 2022-ben világszerte több mint 1,5 millió új esetet diagnosztizáltak, és közel 396 000 férfi halt meg a betegség következtében (1).
A BRCA1/2-mutációk kiemelt klinikai jelentőséggel bírnak a metasztatikus, kasztrációrezisztens prosztatarákban (mCRPC), ahol előfordulási gyakoriságuk eléri a 10–15%-ot (2). Az örökletes BRCA2-mutációk jelenléte mintegy 4–5-szörösére növeli a betegség kockázatát, és összefügg a fiatalabb életkorban történő kialakulással, a diagnóziskori magasabb Gleason-pontszámmal és a rövidebb túléléssel (3–5). Ugyanakkor a BRCA1/2-mutációt hordozó betegek hatékonyan kezelhetők célzott PARP-gátló terápiával: ilyen kezelés az olaparib, amely az mCRPC elsővonalbeli terápiájában abirateronnal kombinálva, másodvonalban monoterápiaként is alkalmazható (6, 7).
Az NCCN (National Comprehensive Cancer Network) és az EAU (European Association of Urology) irányelvei 2019 óta javasolják a BRCA1/2-génszekvenálást lokális stádiumú, magas kockázatú, valamint metasztatikus prosztatarákban szenvedő betegek kezeléséhez (8, 9). A Semmelweis Egyetem (SE) Urológiai Klinikája hazánkban elsőként vezette be a PC-s betegek rutinszerű BRCA1/2-szekvenálását. Az alábbiakban az elmúlt öt év vizsgálatai kapcsán szerzett tapasztalatainkat összegezzük.
Anyagok és módszerek
Adatgyűjtés és statisztikai kiértékelés
A vizsgálatunkhoz az SE Urológiai Klinikája által kérvényezett és a Patológiai, Igazságügyi és Biztosítási Orvostani Intézetben elvégzett BRCA1/2-szekvenáláson átesett prosztatarákos betegek adatait használtuk. A betegazonosítást a 2019. 03. 04 – 2024. 11. 27. közötti vizsgálatkérések alapján végeztük. A klinikai adatgyűjtés az eMedsol rendszerből történt. Az anonimizált adatokat Microsoft Excelben rendszereztük, ahol leíró statisztikát és ábrákat készítettünk. A statisztikai elemzéshez az SPSS 22 programot (IBM, Armonk, NY, USA) használtuk p <0,050 szignifikanciaszinttel. A vizsgálatot az Egészségügyi Tudományos Tanács Tudományos és Kutatásetikai Bizottsága engedélyezte (BM/13011-3/2024/EKU).
A mintagyűjtés menete
A BRCA1/2-szekvenálások a Patológiai, Igazságügyi és Biztosítás Orvostani Intézetben történtek az onkológiai rutinból érkező kérések alapján. Elemzésünkbe minden BRCA1/2-vizsgálatot bevontunk, függetlenül a felhasznált minta típusától (tumorszövet vagy vér) és szintén függetlenül attól, hogy kizárólag
BRCA1/2-génvizsgálat vagy génpanelvizsgálat történt. Pozitívnak azokat az onkogén mutációkat tekintettük, amelyek allélfrekvenciája ≥10% volt. A vizsgálatok újgenerációs szekvenálással történtek, az esetek többségben az Oncomine Comprehensive Assay v3 panel felhasználásával, amely 161 onkológiai szempontból releváns gén egyidejű vizsgálatát teszi lehetővé.
Eredmények
A kohorsz általános bemutatása
Összesen 143 prosztatarákos beteg adatait gyűjtöttük össze, amelyből 124 esetben volt értékelhető szekvenálási eredmény, és 21 (17%) bizonyult BRCA1/2-pozitívnak.
A teljes populációban 62 beteg hunyt el; a medián teljes túlélés 53 hónap volt. A diagnóziskori medián életkor 66 év (43–86 év) volt. A 124 beteg közül 47 részesült lokális kezelésben, 123 kapott androgénmegvonásos terápiát (ADT), és 93 beteg progrediált mCRPC stádiumba. A medián követési idő 18 hónap (1–66 hónap) volt.
A vizsgálati számok és tendenciák áttekintése
A kezdeti évben (2019) 9 hónap alatt 15 vizsgálati kérés történt. Ezt követően összességében emelkedő tendencia volt megfigyelhető, bár 2020–2021-ben a COVID-19-járvány miatt megtorpanás következett be (1. ábra). 2022-ben ismét nőtt a vizsgálatok száma: 33 vizsgálatból 5 (15%) volt pozitív, 2023-ban pedig 39 vizsgálatból 5 (15%) bizonyult pozitívnak, és 2024. novemberéig 37 vizsgálatból 6 (16%) mutatott pozitív eredményt.
A betegek 92%-ánál metasztatikus stádiumban történt a vizsgálat: 56%-ban mCRPC, 36%-ban mHSPC esetén. Egy beteg esetén (1%) nem metasztatikus, kasztrációrezisztens stádiumban, míg az esetek 7%-ában lokális stádiumban történt a vizsgálat.
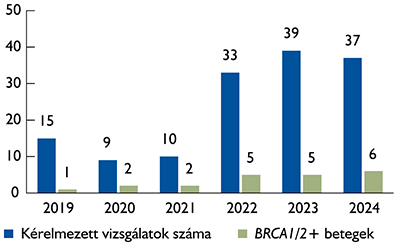
1. ábra: Az SE Urológiai Klinikáján PC-vel kapcsolatban kért BRCA1/2-vizsgálatok száma 2019/03 és 2024/11 között
A vizsgálat technikai vonatkozásai
Összesen 143 betegnél történt vizsgálatkérés, amelyből 124 (87%) esetben volt sikeresen elvégezhető a szekvenálás, 19 (13%) esetben pedig nem született értékelhető eredmény.
A szövetminták a mintavétel típusát tekintve a következők voltak: 75 (56%) tűbiopszia prosztatából, 20 (15%) vérminta, 27 (20%) radikális prostatectomia (RPE), 7 (5%) transurethralis reszekátum (TURP), 4 (3%) metasztázisbiopszia. A prosztatából vett tűbiopsziás minták gyakrabban adtak sikertelen eredményt (n=10; 13%) (p=0,016) az összes többi mintatípushoz viszonyítva. A 7 TURP mintából 1 vizsgálat lett sikertelen, míg az RPE-, a vér- és a metasztázisbioptátum-mintákból minden vizsgálat sikeresen elvégezhető volt (2. ábra).
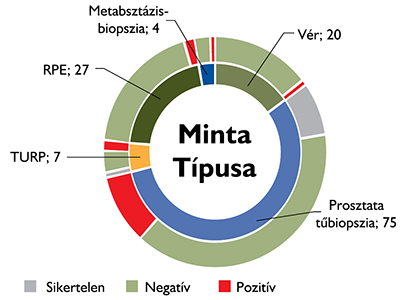
2. ábra: Az SE Urológiai Klinikáján PC-vel kapcsolatban kért BRCA1/2-vizsgálatok; a felhasznált minták típusai, és azon belül a pozitív/negatív eredmények és a sikertelen vizsgálatok megoszlása a mintavétel módjának függvényében
RPE = radikális prostatectomia, TURP = transurethralis prosztatareszekció
A mintavétel és a DNS-szekvenálás között eltelt idő és a vizsgálat sikeressége közötti kapcsolat elemzése során csak a szövetmintákra koncentráltunk. Így a szövetminta vétele és a szekvenálás között eltelt idő a sikeres esetekben 34, a sikerteleneknél 17 hónap volt (p=0,262), tehát a minta kora nem befolyásolta szignifikánsan a vizsgálat elvégezhetőségét.
A vizsgálat terápiás vonatkozásai
Ezután megvizsgáltuk, hogy van-e különbség az mCRPC-stádiumban alkalmazott terápiás mintázatokban a BRCA1/2-státusz szerint. A BRCA1/2-pozitív betegek nagyobb arányban kaptak másod- (62% vs. 27%), harmad- (29% vs. 17%) és negyedvonalbeli kezelést (24% vs. 5%), mint a mutációnegatívak (3. ábra).
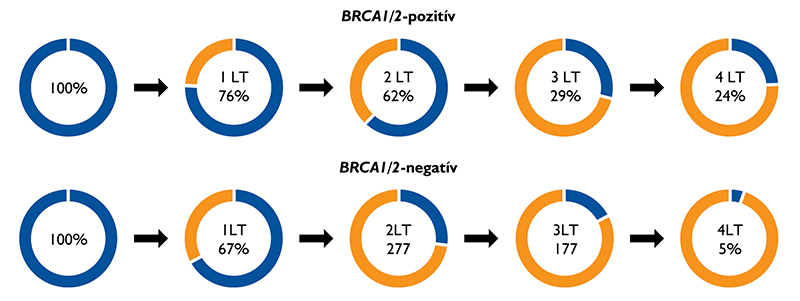
3. ábra: Gyógyszeres terápiák a BRCA1/2-mutációk függvényében. Az ábra a különböző vonalakban kezelet betegek arányát mutatja az BRCA1/2-pozitív (felül) és negatív (alul) betegekben
Ezt követően azt elemeztük, hogy a mutációt hordozó betegek milyen arányban részesültek státuszuknak megfelelő PARPi- vagy platinaalapú kezelésben. A vizsgálat idején érvényes irányelveknek megfelelően ezek a kezelések legkorábban az mCRPC-ben, másodvonalban indultak (8, 9). A 21 BRCA1/2-pozitív beteg közül eddig 16 jutott el az mCRPC elsővonalbeli kezelésig, közülük 8 kapott olaparib-monoterápiát, és közülük 3 fő carboplatin-monoterápiában részesült. Így a BRCA1/2-eredményt a terápiatervezésben a releváns esetek 38%-ában használták fel. Mivel azonban több beteg kezelése még folyamatban van, ezért várhatóan ez az arány a követési idővel tovább emelkedik majd.
Megbeszélés
Vizsgálatunkban az SE Urológiai Klinikáján 2019–2024 között BRCA1/2-szekvenáláson átesett, prosztatarákos betegek adatait elemeztük az esetszám, a technikai tényezők és a kezelési mintázatok szempontjából.
Az EAU- és az NCCN-irányelveknek megfelelően a BRCA1/2-szekvenálás Klinikánkon 2019 márciusa óta a mindennapi rutin része. A vizsgálatok száma folyamatosan emelkedett, csupán a COVID-19-járvány idején mutatkozott visszaesés.
A minták korának befolyása a vizsgálat sikerességére gyakori kérdés, mivel a DNS minősége idővel romolhat, és a progresszió során a tumor genetikai profilja is változhat. Az irodalmi adatok azonban arra utalnak, hogy a DNS-hibajavító gének eltérései, köztük a BRCA1/2, korán alakulnak ki, így többnyire a primer tumorból származó minták is megbízható eredményeket adhatnak (10). A korábbi tanulmányok azonban felhívták a figyelmet arra, hogy a DNS minősége a paraffinba ágyazott mintákban az idő előrehaladtával romlik, ami rontja a génszekvenálás technikai sikerességét (11). Saját adataink alapján azonban nem találtunk szignifikáns összefüggést a minta kora és a szekvenálás sikeressége között. Ennek ellenére az irányelvek ajánlásainak megfelelően továbbra is a legfrissebb tumorszövet vizsgálata részesítendő előnyben.
A különböző mintatípusok elemzése alapján a prosztatából vett tűbiopsziás minták vizsgálata gyakrabban bizonyult sikertelennek (13% vs. 2%; p=0,016); valószínűleg a minták kis mérete és alacsony DNS-tartalma miatt (12).
A vizsgálati kérések 92%-a metasztatikus stádiumban történt (8, 9), ugyanakkor az újabb irányelvek friss ajánlásait figyelembe véve (amely a PARPi-kezeléseket már az mCRPC-stádium elsővonalában is elérhetővé teszi) kiemelendő, hogy célszerű a vizsgálatot már a hormonszenzitív stádiumban elindítani, hogy a mutációs státusz az mCRPC elsővonalbeli kezelésének kezdetére rendelkezésre álljon.
A 124 értékelhető vizsgálatból 21 (17%) volt BRCA1/2-pozitív, ami megfelel a nemzetközi adatokban (Valsecchi et al.: 16,8%) (2) közölt gyakoriságnak. A BRCA1/2-pozitív betegek gyakrabban kaptak többvonalas kezelést, ami összefüggésben állhat a mutációpozitív betegekre jellemző gyorsabb progresszióval, illetve a PARPi-kezelésen keresztüli magasabb számú terápiás opcióval. Nyolc beteg részesült másod- vagy többedik vonalban alkalmazott PARPi-terápiában, három pedig carboplatinkezelésben.
A BRCA1/2-szekvenálás rutinszerű alkalmazása tapasztalataink alapján tehát hasznos diagnosztikai eszköz, amely támogatja a klinikai döntéshozatalt, és közelebb hozza a személyre szabott terápiatervezést a mindennapi gyakorlathoz.
Irodalom
4. Castro E, Goh C, Leongamornlert D, et al. Germline BRCA mutations are associated with higher risk of nodal involvement, distant metastasis, and poor survival outcomes in prostate cancer. J Clin Oncol 2013; 31(14): 1748–57.
5. Edwards SM, Kote-Jarai Z, Meitz J, et al. Two percent of men with early-onset prostate cancer harbor germline mutations in the BRCA2 gene. Am J Hum Genet 2003; 72(1): 1–12.
6. de Bono J, Mateo J, Fizazi K, et al. Olaparib for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med 2020; 382(22): 2091–102.
7. Saad F, Clarke NW, Oya M et al. Olaparib plus abiraterone versus placebo plus abiraterone in metastatic castration-resistant prostate cancer (PROpel): final prespecified overall survival results of a randomised, double-blind, phase 3 trial. Lancet Oncol 2023; 24(10): 1094–1108.
8. Cornford P, Tilki D, van den Bergh RCN, Briers E, Eberli D, De Meerleer G, et al. EAU – EANM – ESTRO – ESUR – ISUP – SIOG Guidelines on Prostate Cancer 2024; 86(2): 148–163.
9. Schaeffer EM, Srinivas S, Adra N, Yi A, Bitting R, Chapin B, et al. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Prostate Cancer. 4. 2024. 2024. május 17.
10. Schweizer MT, Sivakumar S, Tukachinsky H, Coleman I, De Sarkar N, Yu EY, et al. Concordance of DNA Repair Gene Mutations in Paired Primary Prostate Cancer Samples and Metastatic Tissue or Cell-Free DNA. JAMA Oncol 2021; 7(9): 1–5.
11. Tommasi S, Coppola CA, Caniglia A, et al. BRCA testing in metastatic castration-resistant prostate cancer: successes and troubles in a real world setting. An Italian Multicentric study. Pathologica 2024; 116(5): 303–309.
12. Gonzalez D, Mateo J, Stenzinger A, Rojo F, Shiller M, Wyatt AW, et al. Practical considerations for optimising homologous recombination repair mutation testing in patients with metastatic prostate cancer. J Pathol Clin Res 2021; 7(4): 311–25.