Male Fertility in the Context of Chronic Prostatitis: Mechanisms and Clinical Implications
DOI: magyurol.2025.4.keszthelyim.172
Authors:
Keszthelyi Márton dr.1, Lőczi Lotti Lúcia dr.1, Keszthelyi Attila dr.2
1Semmelweis Egyetem, Szülészeti és Nőgyógyászati Klinika, Budapest
2Semmelweis Egyetem, Urológiai Klinika, Budapest
Summary
Introduction: The chronic prostatitis/chronic pelvic pain syndrome (CP/CPPS) is one of the most prevalent urological disorders in men, affecting approximately one quarter of all male urology patients. Beyond pain and voiding dysfunction, CPPS may significantly impair fertility through inflammatory, hormonal, and oxidative mechanisms.
Results: Proinflammatory cytokines such as IL-6 and TNFa induce mitochondrial dysfunction and oxidative stress, resulting in reduced semen volume, sperm concentration, motility, and morphology, as well as increased DNA-fragmentation. Hormonal dysregulation and impaired prostatic secretion further compromise spermatogenesis. Plant-derived therapies, particularly rye pollen extracts, and combination regimens with L-carnitine, tadalafil, and micronutrients have demonstrated improvement in semen parameters and clinical outcomes.
Conclusion: CPPS adversely affects male fertility via complex, multifactorial mechanisms. Multimodal, phenotype-oriented therapy integrating anti-inflammatory, antioxidant, and reproductive-supportive interventions may break the cycle of pain, inflammation, and infertility.
LAPSZÁM: MAGYAR UROLÓGIA | 2025 | 37. ÉVFOLYAM, 4. SZÁM
Összefoglaló
Bevezetés: A krónikus prosztatagyulladás/krónikus kismedencei fájdalom szindróma (chronic prostatitis/chronic pelvic pain syndrome, CP/CPPS) a férfiak egyik leggyakoribb urológiai betegsége, amelynek hatásai a reproduktív funkciókra is kiterjednek. A gyulladásos folyamatok, az oxidatív stressz és a hormonális szabályozás zavara egyaránt hozzájárulhat a spermatogenezis károsodásához és a fertilitás csökkenéséhez.
Célkitűzés: A közlemény célja a CPPS patofiziológiai hátterének, a spermaparamétereket érintő elváltozásoknak és az evidenciákon alapuló terápiás lehetőségeknek az összefoglalása.
Eredmények: A CPPS során az ondó térfogata, a spermium-koncentráció, a motilitás és a morfológia aránya csökkenhet, miközben emelkedhet a DNS-fragmentációs index. A rozspollenkivonatok, az L-karnitin, a tadalafil és a különböző mikrotápanyagok kombinációi javították a spermaparamétereket és a klinikai tüneteket. A multimodális, fenotípusorientált terápia a leghatékonyabb megközelítés a fájdalom és a reproduktív károsodás egyidejű kezelésére.
Következtetés: A CPPS komplex, gyulladásos és hormonális folyamatokon keresztül negatívan befolyásolja a fertilitást. A fitoterápiás és a kombinált kezelések ígéretes alternatívát jelenthetnek a fertilitás megőrzése és a tünetek enyhítése szempontjából.
Bevezetés
A krónikus prosztatagyulladás/krónikus kismedencei fájdalom szindróma (CP/CPPS) a férfiak egyik leggyakoribb urológiai rendellenessége, amely az urológiai rendeléseket felkereső betegek mintegy negyedét érinti. Az NIH-osztályozás a prosztatagyulladások négy kategóriáját különíti el; ezek közül a III. kategória (a CP/CPPS) gyulladásos (IIIA) és nem gyulladásos (IIIB) formára oszlik. A tünetek közé tartoznak a következők: a tartós, az elmúlt 6 hónapban legalább három hónapon át fennálló kismedencei fájdalom, a diszkomfortérzet, az alsó húgyúti tünetek és a szexuális diszfunkció. A kórkép multifaktoriális eredetű, és jelentős életminőség-romlással, pszichoszociális terhekkel, valamint reproduktív zavarokkal is járhat. Ez utóbbi eddig nem tartozott a CP/CPPS jellemzően tárgyalt témái közé; jelen közleményünk hazánkban az első, amelyik elsősorban ezzel a kérdéssel foglalkozik.
A CPPS patofiziológiája és a fertilitásra gyakorolt hatása
A legújabb kutatások és az irodalmi összefoglalók alapján a CPPS patomechanizmusában több tényező játszik szerepet: a gyulladásos mediátorok fokozott jelenléte, a neuroendokrin diszfunkció, a metabolikus szindróma és a bélmikrobiom egyensúlyának felborulása egyaránt hozzájárul a tünetegyüttes kialakulásához. A prosztata lokális gyulladása következtében felszabaduló proinflammatorikus citokinek (pl. IL-6, TNFa) oxidatív stresszhelyzetet váltanak ki, amely előbb a spermiumok membránját rombolja, majd beljebb hatolva mitokondriális károsodást okoz, és ronthatja a spermiumok DNS-integritását. A mitofágia (az elpusztult mitokondriumok “eltakarítása”) elmarad, ami további károsodásokhoz vezet. A folyamat eredményeként az ondóváladék minősége jelentősen romolhat: általában csökken az ejakulátum volumene, a teljes spermiumszám és a spermiumkoncentráció; továbbá romlik a hímivarsejtek progresszív motilitása és normál morfológiája is. Ezzel párhuzamosan gyakoribb a spermiumok funkciójának károsodása, tehát növekszik a DNS-fragmentációs index (SDF), amely az utóbbi időben az egyetlen evidenciaszinttel bíró funkcionális paraméter: a fertilitási potenciál jelenleg egyik legfontosabb prediktora.
A gyulladásos folyamatok hormonális szinten is érvényesülnek. A hypothalamus–hipofízis–here tengely gátlása csökkenti a herékben a tesztoszterontermelést, ami úgyszintén negatívan befolyásolja a spermatogenezist, hiszen annak egyik alapfeltétele a Sertoli-sejtek körül kialakuló, igen magas endogén tesztoszteronkoncentráció. A klinikai vizsgálatokból származó adatok analízise alapján az ondóvolumen szignifikánsan csökken CPPS esetén. Ami a spermiumkoncentrációt illeti, a standardizált átlagkülönbség (standardized mean differene, SMD) értéke –14,12. (Az SMD azt mutatja meg, hogy két csoport átlagai mekkora távolságra vannak egymástól a csoportok átlagos szórásához képest.) A motilitás csökkenésére vonatkozóan az SMD értéke –5,94, míg a morfológiát illetően –8,26. A funkcionális károsodás mértéke is igen számottevő: a DNS-fragmentációs aránynál a különbség meghaladja a 30%-ot. Hozzá kell tennünk, hogy az SDF vonatkozásában jelenleg még nem egyértelmű, melyik vizsgáló módszer az arany standard és nincsenek abszolút érvényű határértékek sem. A jelenlegi konszenzus alapján a 25% alatti SDF-értékeket tekintjük optimálisnak.
Mindemellett a prosztata váladékának összetétele is módosul: csökken a cink- és az antioxidánskoncentráció, amelyek a spermiumok védelmében és mozgékonyságában alapvető szerepet töltenek be. Csökken a hímivarsejtek vitalitása is, ami szintén kiemelkedően fontos paraméter, hiszen fertilizációra csak élő spermium képes. Egyes esetekben autoimmun mechanizmusok is szerepet játszanak; ilyen például az ondóváladékban a spermiumellenes antitestek (ASA) megjelenése, ami a vér-here gát infekció által okozott sérülésének bizonyítéka.
Terápiás lehetőségek: multimodális stratégia
A CPPS legkorszerűbb kezelésének alapját a multimodális, fenotípuson alapuló megközelítés képezi, amely a beteg UPOINT-profilját veszi figyelembe (U = húgyúti, P = pszichoszociális, O = szervspecifikus, I = infekciós, N = neurológiai/szisztémás, T = izomfájdalom). A cél a fájdalom, a gyulladás és a reproduktív funkciózavarok együttes mérséklése.
A szakmai irányelvekben a gyógyszeres terápia klasszikus elemei közé tartoznak a szelektív alfa-receptor-blokkolók, az 5-alfa-reduktáz-gátlók, az antimuscarin szerek, az antibiotikumok, a neuromodulátorok, a gyulladáscsökkentő készítmények, amelyeket kismedencei fizioterápiával egészítenek ki. Ugyanakkor a fertilitás megőrzése érdekében a kezelés kiválasztása során kerülendők a spermatogenezist gátló hatóanyagok. A szelektív alfa-receptor-blokkolók csökkentik az ejakuláció intenzitását, és az ehhez szükséges izomösszehúzódásokat is. Az 5-alfa-reduktáz-gátlók esetében különösen fontos a körültekintés, mivel állatkísérletes modellekben teratogén hatásokat figyeltek meg. Nem véletlen az sem, hogy véradás előtt pl. dutasterid szedése mellett 6 hónapos, finasterid mellett 1 hónapos terápiamentes várakozási időt kell betartani.
Fitoterápia és kombinált kezelések
A növényi alapú készítmények közül a rozspollenkivonatok bizonyítottan hatékonyak a CPPS tüneteinek enyhítésében. Gyulladáscsökkentő és antioxidáns hatásuknak köszönhetően a fájdalom mérséklése és a tünetek javítása mellett (ezek világosan nyomon követhetők a NIH-CPSI-pontszám csökkenésében) az ondótermelést is támogathatják. A rozspollen-polifenolok (catechin, klorogénsav) kedvezően befolyásolják a spermatogenezis oxidatív egyensúlyát, javítják a spermiumok motilitását, vitalitását és morfológiáját, továbbá növelik az ondóvolument és a spermiumkoncentrációt is. Az EAU (Európai Urológus Társaság) jelenlegi szakmai irányelve ezt a kezelési módot magas, 1a szintű evidenciával ajánlja.
A kombinált kezelések közül a klinikai vizsgálatokban az L-karnitin-kiegészítés három hónap után mérhetően javította az ondóvolument és a spermiumok vitalitását. A tadalafil napi 5 mg-os adagban, három hónapon keresztül alkalmazva növelte az ondó térfogatát, a spermiumszámot és a motilitást. A tadalafil + L-karnitin + Serenoa repens kombinációs terápia minden vizsgált spermaparaméterre pozitívan hatott, továbbá szignifikánsan csökkentette a fájdalmat, és javította az NIH-CPSI-pontszámokat is. Az L-karnitin mikrotápanyagokkal (fruktóz, cink, koenzim-Q10, szelén, folsav) kombinálva tovább fokozza a terápiás hatást. Ez a kombináció nemcsak a spermiumok mozgékonyságát és életképességét növeli, hanem a DNS-integritást is javítja, amely kulcsfontosságú a fertilitás helyreállításában. Ezen terápiás stratégiák különösen alkalmasak olyan betegek számára, akiknél a fájdalom- és gyulladáscsökkentés mellett a reproduktív funkciók megőrzése is cél.
Összegzés
A CPPS a férfiak fertilitásának szempontjából komplex, multifaktoriális állapot, amely a gyulladás, az oxidatív stressz, a hormonális diszreguláció és az immunológiai mechanizmusok összjátékán keresztül rontja a férfiegészséget, a szexuális funkciót és a spermatogenezist (1. ábra). A hagyományos gyógyszeres kezelések mellett a fitoterápiás megoldások, a rozspollen és a kombinált, mikrotápanyagokon alapuló beavatkozások új, hatékony lehetőséget kínálnak a tünetek csökkentésére és a fertilitási potenciál megőrzésére. A fenotípusorientált, multidiszciplináris megközelítés a jövőben a CPPS kezelésének alapvető irányát jelentheti.
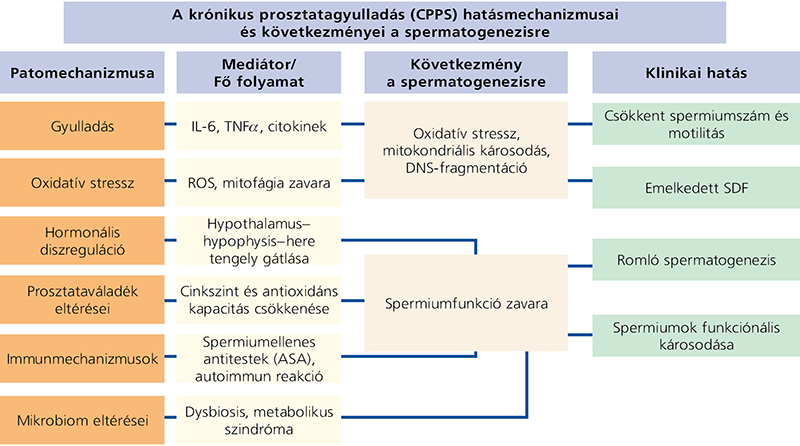
1. ábra: A krónikus prosztatagyulladás hatásmechanizmusai és következményei a fertilitásra nézve
Irodalom
3. Wagenlehner FME, Pilatz A, Bschleipfer T, Weidner W. Chronic prostatitis/chronic pelvic pain syndrome: which antibiotic for which patient? Curr Opin Urol 2020; 30(3): 338–344.
4. Magri V, Trinchieri A, Perletti G. The role of infection and inflammation in chronic prostatitis and its impact on sperm parameters: a systematic review. Andrology 2022; 10(4): 674–686.
5. Punab M, Kullisaar T, Mändar R, et al. Male infertility as a chronic inflammatory disease: impact of CP/CPPS on semen quality and sperm DNA integrity. Andrologia 2021; 53(5): e14026.
6. Motrich RD, Maccioni M, Riera CM, Rivero VE. Autoimmune prostatitis: experimental models and clinical relevance. Andrology 2020; 8(3): 734–746.
7. Ventimiglia E, Capogrosso P, Boeri L, et al. Semen parameters and fertility potential in men with chronic prostatitis/chronic pelvic pain syndrome: systematic review and meta-analysis. Andrology 2022; 10(1): 111–120.
8. Wagenlehner FME, Uçkay I, Nickel JC. Multimodal therapy in chronic prostatitis/chronic pelvic pain syndrome. Curr Opin Urol 2019; 29(3): 296–301.
9. Cai T, Verze P, Morgia G, et al. Phytotherapeutic approaches for the treatment of chronic prostatitis/chronic pelvic pain syndrome: evidence-based review. World J Mens Health 2021; 39(1): 72–87.
10. Vicari E, Calogero AE. Effects of carnitines and micronutrients on sperm parameters in chronic prostatitis patients. J Endocrinol Invest 2020; 43(6): 763–770.
11. Russo GI, Calogero AE, Condorelli RA, et al. The role of phosphodiesterase type 5 inhibitors in semen quality and fertility: from basic science to clinical practice. J Androl 2021; 42(3): 312–320.
12. Diemer T, Huwe P, Ludwig M, Weidner W. Influence of chronic inflammation on semen parameters in men with chronic prostatitis/chronic pelvic pain syndrome. Urology 2020; 138: 101–108.
13. EAU Guidelines on Chronic Pelvic Pain. European Association of Urology, 2024 Edition. https://uroweb.org/guidelines/chronic-pelvic-pain
14. Shoskes DA, Nickel JC. Phytotherapy and nutraceuticals for chronic prostatitis/chronic pelvic pain syndrome. Transl Androl Urol 2021; 10(1): 276–284.
15. Magri V, Boltri M, Cai T. Multidisciplinary and phenotype-directed therapy for CP/CPPS: breaking the circle of pain–inflammation–infertility. Ther Adv Urol 2023; 15: 1756287223111214.