2018-4 —- Full Articles
Investigation and treatment of non-infectious scrotal elefantiázis – case collection and literature review
DOI: 10.22591/magyurol.2018.4.romicsm.163
Authors:
Romics Miklós dr.1, Jósvay János dr.2, Regőczi Tamás dr.3, Nyirády Péter dr.1
1Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum, Budapest (igazgató: Nyirády Péter dr.)
2Szt. Imre Egyetemi Oktatókórház, Plasztikai Sebészeti Profil, Budapest (osztályvezető: Jósvay János dr.)
3Szt. Imre Egyetemi Oktatókórház, Általános Sebészeti Profil, Budapest (osztályvezető: Máté Miklós dr.)
Summary
Introduction: Scrotal elephantiasis is a rare, benign entity with radical impact on the quality of life. In the Third World chronic lymphedema and enlargement of the scrotum usually occurred due to filariasis or other infections, in more developed countries it mainly happens for other reasons like morbid obesity. Because of its rarity, investigation and treatment of the problem requires special care and coordinated cooperation between the urologist dermatologist and plastic surgeon team.
Patients and methods: In our work, written and visual documentation of 5 cases is presented with the proposed algorithm management of the condition. In addition, we summarize the available knowledge represented in domestic and international literature.
Results: After studying our well documented patients, it can be stated that proper preparation, surgical planning, pre- and postoperative antibiotic and wound management, the surgical solution of the problem can be achieved with good results and high safety.
Discussion: As the aftermath of the increasing incidence of morbid obesity in Hungary, scrotal elephantiasis is likely to become more common in the future, thus it is desired for all urologists to be familiar with the management algorithm of the condition.
LAPSZÁM: MAGYAR UROLÓGIA | 2018 | 30. ÉVFOLYAM, 4. SZÁM
Összefoglalás
Bevezetés: A nagyméretű scrotalis elefantiázis a nyugati világban ritkán előforduló, jóindulatú, ám az életminőséget radikálisan befolyásoló elváltozás. A harmadik világ területén a herezacskó krónikus lymphoedemás megnagyobbodása általában filariázis, vagy más infekció talaján alakul ki, a fejlettebb országokban azonban főleg más okokból fordul elő. A probléma kivizsgálása és kezelés, ritkaságára való tekintettel különleges körültekintést, és urológus-bőrgógyász-plasztikai sebész team összehangolt együttműködését igényli.
Betegek és módszer: Munkánkban 5 esetünk írásos és képi dokumentációjával ismertetjük a fenti kórállapot javasolt kivizsgálási és ellátási algoritmusát. Továbbá a hazai és nemzetközi irodalomban elérhető ismereteket is összegezzük összefoglalásunkban.
Eredmények: A dokumentált és éveken át követett betegeink vizsgálata után kijelenthető, hogy megfelelő előkészítés, műtéttervezés, valamint a pre- és posztoperatív antibiotikum és sebkezelési menedzsment mellett a probléma műtéti megoldása jó eredménnyel és nagy biztonsággal végezhető.
Megbeszélés: A hazánkban az egyre frekventáltabb morbid elhízás mellett a jövőben feltehetően a scrotalis elefantiázis is gyakoribbá válik, így nemcsak a filariázisra endémiás területeken, de Magyarországon is szükséges az efféle esetek kivizsgálásának és ellátásának ismerete.
Bevezetés
A herezacskó megnagyobbodásának számos oka és formája lehet (infekció, tumor, veleszületett nyirokér-malformáció stb.) ám ezek közül, a fejlett világban tapasztalt relatív ritkaságával és groteszk megjelenésével, kiemelkedik a scrotalis elefantiázis, azaz a nyirokpangás következtében megjelenő, jellemző bőrelváltozással (lásd: elefántbőr) tarkított, herezacskó egészére kiterjedő (sokszor a hímvesszőt is involváló) kórállapot. Ennek eredete lehet primer (a nyirokutak intrinszik hibájából eredően), vagy lehet (és sokkal gyakrabban az) szekunder, egy nyirokelfolyást akadályozó mechanizmus (1, 2). Ezen jóindulatú, ám krónikus, a beteg számára rendkívüli kényelmetlenséget okozó elváltozás Európában korábban ritkábban került látótérbe. Bővebb ismereteket inkább a fejlődő világból közölt tanulmányok által nyerhetünk, amelyek főleg infekciós eredetű eseteket ismertetnek. Ritkán fordul elő, hogy egy-egy Indiából vagy Afrikából közölt eset, vagy esetgyűjtemény ne például a filariázissal legyen összeköthető (3, 4). A világ fejlettebb országaiban általában más eredetűek és természetesen sokkal ritkábbak az efféle elváltozások: peritoneális dialízis, nyirokerek tumoros, traumás, kongenitális, vagy operációt/radioterápiát követő kompressziója-elzáródása következtében is kialakulhat az elváltozás, de a nagymértékű elhízás mellett megjelent elefantiázis az egyetlen, amely az idő előrehaladtával egyre nagyobb gyakoriságot mutat (5, 6)! És bár az entitás eredete eltérhet, kijelenthető, hogy a sebészi intervenció szükségessége és annak módja a probléma genezisétől függetlenül fenn áll és gyakorlatilag megegyezik, így bátran felhasználhatjuk az elmaradottabb területeken szerzett tapasztalatokat betegeink gyógyításában!
Munkánkban öt, az utóbbi hat évben klinikánk orvosaiból és plasztikai sebészekből összeállt sebészi team által operált beteg szigorúan dokumentált esetét mutatjuk be, és ismertetjük a hazai és nemzetközi irodalom témát tárgyaló munkáit is.
Betegek és módszer
Öt beteg esetét mutatjuk be. Többnyire fiatal, 23–49 éves (átlag: 39,4 éves) férfiak, jelentős alapbetegség, és – eltekintve a méretes scrotalis duzzanattól és a betegek majd mindegyikénél tapasztalt, morbid (BMI >40 kg/m2) obesitastól – számottevő egészségügyi probléma nélkül. Függetlenül attól, hogy a beteget klinikánk ambulanciáján láttuk először, vagy külső intézet referálta, bizonyos kivizsgálási protokollokon mindegyikük átesett: minden beteg anamnézise és előzetes dokumentációja átvizsgálásra és rögzítésre került, majd fotók készültek az elváltozásról.
A betegeket kikérdeztük a probléma fennállásának idejéről, testtömegük múltbeli változásáról, külföldi (főleg afrikai, indiai és ázsiai) tartózkodásukról, dermatológiai problémákról. Ezt követően tüzetes fizikális vizsgálatot végeztünk (az elhízáson és a krónikus scrotalis nyiroködémán kívül egyéb eltérést egyik esetben sem találtunk), majd labor- és képalkotó vizsgálatok következtek: hasi- és scrotalis ultrahangvizsgálat, majd komputertomográfia (CT) és/vagy mágneses rezonanciavizsgálat (MR) történt. Az MR-vizsgálat egy esetben felvetette a popliteális régió térfoglalását, azonban ez további vizsgálatokkal nem igazolódott. A többi esetben sem hasi, sem egyéb nyirokérpangáshoz vezető eltérés nem igazolódott, és szisztémás kórállapot jelenléte sem merült fel. A betegeket minden esetben dermatológus (az infekciós és onkológiai eredet kizárására) és plasztikai sebész is vizsgálta. Plasztikai sebész nem mindig vett részt az operációban, de a műtétek megtervezésében és az utókezelésben (illetve további korrekciós eljárásokban) is szükség volt szakértelmére. A hasonló esetek kivizsgálása során a fenti diagnosztikus algoritmus (lásd: anamnézis, fizikális vizsgálat, labor és hasi képalkotó, onkodermatológiai és plasztikai sebészeti vizsgálat) alkalmazása javasolt az esetleges malignitások kizárására!
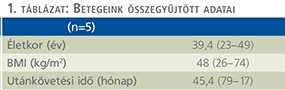
Minthogy egyik esetben sem igazolódott egyértelmű (infektológiai, onkológiai, endokrinológiai vagy egyéb) kórok, az elváltozást idiopátiásnak, vagy az elhízás következményének kezeltük, és elsősorban testtömegcsökkentést javasoltunk. Betegeink kivizsgálás idején mért testtömegindexe 74, 57, 42, 41, és 26 kg/m2 volt, tehát az öt betegből négy morbidan elhízottnak, egy pedig enyhén túlsúlyosnak számított (1. táblázat). Bár a testtömeg nagymértékű csökkenése és a nyiroködéma kialakulása között egyértelműen nem tisztázott a (egyesek szerint ráadásul reciprok) viszony, a fogyás mégis minden alkalommal javasolt a scrotalis nyirokpangással diagnosztizált betegeknek. Egyrészt a nyirokerek kompressziójának csökkentése az ödéma mérsékléséhez vezethet, másrészt a testtömeg normalizálásán keresztül csökken a perioperatív komplikációk és sebgyógyulási zavar előfordulásának lehetősége is (7). Habár a súlyosan obes betegek mindegyikének sikerült bizonyos testtömegcsökkenés elérése, panaszaik érdemben nem javultak, ezért – további alternatív kezelési módoktól eltekintve – az operatív megoldás mellett döntöttünk, amelyet a betegek a körültekintő felvilágosítást követően elfogadtak. Felhívtuk a betegek figyelmét a várható komplikációkra és sebgyógyulási zavarokra, és a transzfúzió adásának esetleges szükségességére is. Továbbá elengedhetetlen volt annak tisztázása, hogy a beteg elvárásai mennyire lesznek átfedésben a várható esztétikai eredményekkel.
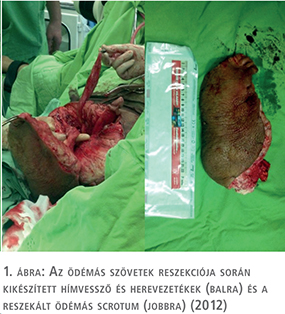
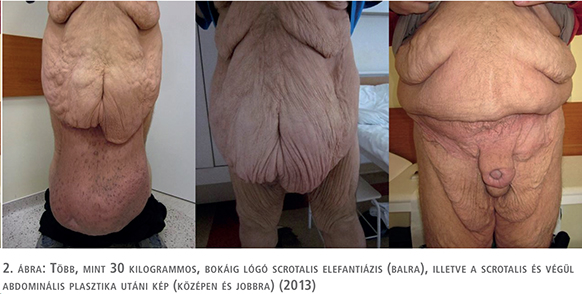
Az öt esetből négyben klinikánk adott helyet a primer beavatkozásnak, egy alkalommal pedig tapasztalt szakorvosunk külső intézetben segédkezett a műtét lebonyolításában. Az operációk során a raphe-n indított, az elefantiázisos területet megfelező, majd körülmetsző vágással – a scrotum és a hímvessző kiemelésével párhuzamosan – eltávolítottuk a megvastagodott bőrt és az ép (herezacskó és előbőr) szövetekből végeztük el a szövetpótlást (1–5. ábrák). Minden operációt antibiotikum adása mellett és körültekintő aneszteziológiai felkészítést követően végeztünk. A műtétek alatt jelentős események nem történtek, transzfúzió adására csak egy alkalommal volt szükség. A műtétet követően – a körültekintő sebellátásnak köszönhetően – jelentős sebgyógyulási zavar, illetve sebfertőzés egyik esetben sem volt. Az eltávolított szövetek (amelyek tömege 5 és 30 kg között változott) hisztológiai vizsgálata egyik esetben sem igazolt infekciót, vagy neopláziát. Az ötből három beteg szorult további műtétre, kettőnél a kötényhas plasztikája történt, egy esetben pedig ismételt ödéma megjelenése miatt laparoszkópos nyirokérlezárást végeztünk.
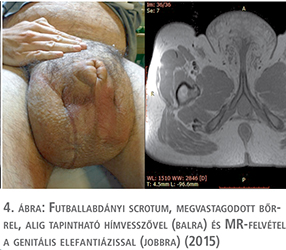
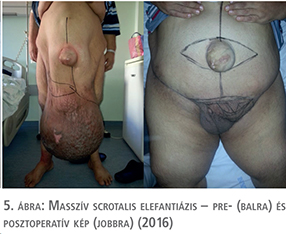
A fenti esetek mindegyikében külön kiemelt figyelmet kapott a műtét alatti tenziómenedzsment és volumenpótlás, az ezt követő, hosszú távú tromboprofilaxis, antibiotikum-kezelés és természetesen az életvezetési és további testtömegcsökkentést segítő tanácsok részletes ismertetése. Betegeink esetében egyik alkalommal sem fordult elő sebészeti beavatkozást igénylő (Clavien-Dindo >2) szövődmény. A primer műtéttől számított követési időben (79–17, átlagosan 45,4 hónap) scrotalis elefantiázis ismételten nem alakult ki. A betegek követését minden esetben az operáló orvospáros (urológus és plasztikai sebész) közösen végezte, lévén, hogy a fenti esetek közül több is további korrekciós beavatkozásra szorult a herezacskó plasztikáját követően.
Irodalmi áttekintés
A PubMed oldalon végzett keresés 177 találatot ad (az állati vizsgálatok kiszelektálása után) a „scrotal elephantiasis” kifejezésre: ezek közül 53 (30%) csak egy-egy eset bemutatására szorítkozik, 16 (9%) pedig kettő, vagy annál több esetet prezentál. Az utóbbiak közül azonban kiemelkedik az a két publikáció, amelyek több száz (pontosan 274 és 350) esetről is beszámolnak (3, 11). Az esetismertetések közül 46 (26%) infekciós témájú, 15 idiopátiás (8,5%) (vagy az elhízással kapcsolatos), 5 tumoros (2,8%), 1 (0,5%) terápiás szövődmény következtében kialakult elefantiázisról ír, 2 (1%) közlemény pedig kongenitális esetekről számol be. Ezek mellett 19 diagnosztikai (10,7%) és 42 (23,7%) terápiás összefoglaló, valamint egy irodalmi kutatás is van a felsoroltak közt (0,5%). Emellett 11 (6%) alap- és gyógyszerkutatási közlemény is szerepel, 5 klinikai szignifikanciával nem rendelkező leirat mellett.
31 közlemény (17,5%) hosszabb, epidemiológiai összefoglaló is olvasható, természetesen az endémiás területek országaiból, amelyek értelemszerűen igen csekély segítséget nyújtanak a nyugati világban tapasztalt előfordulás megbecsüléséhez. Összességében kijelenthetjük, hogy a fenti probléma az előfordulásához képest meglehetősen ritkán tárgyalt: az Egészségügyi Világszervezet weboldala (https://who.int) szerint 2000-ben 120 millió parazitás infekció és 40 millió testi torzulást elszenvedő beteg élt a világon. Az utóbbi 5 évben csupán 9, az utóbbi tízben pedig 29 új munka jelent meg (PubMed), 1950 és 2000 között az arány még ennél is alacsonyabb volt: 105 új publikáció jutott 50 évre. Tekintettel arra, hogy a fejlődő világban egyre nagyobb számban élnek túlsúlyos emberek és az ilyen értelemben vett fejlődő világ is egyre bővül, igen valószínű, hogy a scrotalis elefantiázis előfordulásának növekedését tapasztaljuk majd a jövőben hazánkban és Európában is.
A magyar szakirodalomban megjelent szűkös mennyiségű munkából elsősorban a Magyar Sebészetben megjelent 1951-es (12), majd a Magyar Urológiában megjelent 2018-as (13) esetbemutatás említendő. A jelenlegihez hasonló, betegutat hosszan és részletesen végig kísérő, a modern orvosi irodalmat áttekintő közlemény hiánycikk a magyar urológia irodalmában, így bátorkodunk támpontot nyújtani közleményünkkel minden hasonló problémával szemben álló kollégának.
Megbeszélés
Habár a herezacskó elefantiázisa több okból is előfordulhat, egyre gyakoribb – főként fejlett világban – hogy a nagyfokú elhízás áll a hátterében (8). Az abdominális adipozitás ugyanis gyakran nagymértékű kompressziót fejt ki a nyirokerekre, meggátolva ezzel a nyirok természetes áramlását. Az ödéma kialakulását krónikus gyulladásos állapot és a folyadék felhalmozódása előzi meg, amit fibrózis és a pangás feletti bőrterület hiperkeratózisa és kiszáradása követ (9). Konzervatív kezelési megoldástól jelentős változás nem várható, a nagyméretű scrotális nyirokpangás következtében kialakuló elefantiázis ellátása sebészi. Ez magába foglalja az ödémás szövet reszekcióját, és a scrotum, illetve a hímvessző bőrének rekonstrukcióját – valamint volumen – és infekciókontroll igen körültekintő pre-, intra- és posztoperatív menedzsmentjét (10). Az általunk bemutatott esetekben a megfelelő és alapos kivizsgálás, plasztikai sebész segítségével történő műtéttervezés és adekvát aneszteziológiai háttérrel történő együttműködés biztosította az operációk kiváló rövid- és hosszú távú eredményét.
References
1. Elephantiasis of the Scrotum and Labia Pudendi. The Medico-Chirurgical Review. 1830; 12(24): 505–509.
2. Shaitelman SF, Cromwell KD, Rasmussen JC, et al. Recent Progress in Cancer-Related Lymphedema Treatment and Prevention. CA: a cancer journal for clinicians 2015; 65(1): 55–81. https://doi.org/10.3322/caac.21253
3. Dandapat MC, Mohapatro SK, Patro SK. Elephantiasis of the penis and scrotum. A review of 350 cases. Am J Surg 1985 May; 149(5): 686–90. https://doi.org/10.1016/S0002-9610(85)80156-2
4. Geshere Oli G1, Tekola Ayele F, Petros B. Parasitological, serological and clinical evidence for high prevalence of podoconiosis (non-filarial elephantiasis) in Midakegn district, central Ethiopia. Trop Med Int Health 2012 Jun; 17(6): 722–6. https://doi.org/10.1111/j.1365-3156.2012.02978.x
5. Abraham G, Blake PG, Mathews R, et al. Genital swell- ing as a surgical complication of continuous ambulatory peri-toneal dialysis. Surg Gynecol Obstet 1990; 170: 306–308.
6. Porter W, and Bunker C. Chronic penile lymphedema: a report of 6 cases. Arch Dermatol 2001; 137: 1108–1110.
7. Mehrara BJ, Greene AK. Lymphedema and obesity: is there a link? Plast Reconstr Surg 2014; 134: 154e–60e. https://doi.org/10.1097/PRS.0000000000000268
8. Champaneria MC, Workman A, Kao H, Ray AO, Hill M. Reconstruction of massive localised lymphoedema of the scrotum with a novel fascio-cutaneous flap: A rare case presentation and a review of the literature. J Plast Reconstr Aesthet Surg 2013 Feb; 66(2): 281–6. https://doi.org/10.1016/j.bjps.2012.06.024
9. Kuepper D. Giant scrotal elephantiasis. Urology 2005 Feb; 65(2): 389. https://doi.org/10.1016/j.urology.2004.08.051
https://doi.org/10.1016/j.urology.2004.08.040
10. Zacharakis E, Dudderidge T, Zacharakis E, Ioannidis E. Surgical repair of idiopathic scrotal elephantiasis. South Med J 2008 Feb; 101(2): 208–10. https://doi.org/10.1097/SMJ.0b013e318161290a
11. Carme B, Laigret J. Filarian elephantiasis in French Polynesia (Wuchereria bancrofti var. pacifica). Health study on 274 subjects. I Epidemiological and Clinical aspects. Bull Soc Pathol Exot Filiales 1978 Nov-Dec; 71(6): 455–65.
12. Bard R. Sorotal and preputial elephantiasis complicated by lymphangiectasis. Magy Seb 1951; 4(4): 293–5.
13. Magyar A, Póth S, Köves B, Tenke P. Tíz kilogrammos scrotalis elephantiasis műtéti megoldása. Magyar Urológia 2018; 30(1): 17–20. https://doi.org/10.22591/magyurol.2018.1.magyara.17
Thromboprophylaxis in urological patients: to whom, how long, too much or too little?
DOI: 10.22591/magyurol.2018.4.molnara.156
Authors:
Molnár Ágnes dr., Villányi Kinga dr., Szántó Árpád dr.
Pécsi Tudományegyetem KK, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
Summary
Due to the hypercoagulable state induced by surgery, serious complications of urological surgery include deep vein thrombosis and pulmonary embolism – together referred to as venous thromboembolism (VTE) – and major bleeding. Decisions regarding thromboprophylaxis using perioperative and postoperative low molecular weight heparin (LMWH) administration in urologic surgery involve a trade‐off between decreased risk of venous thromboembolism and increased risk of bleeding. Currently, there exists substantial practice variation in the use of thromboprophylaxis in urology, both within and between countries. This variation is unsurprising when one considers that recommendations from national and international guidelines often conflict. Consideration of LMWV administration, timing, dosage and duration are also a matter of debate in international literature. However, the majority of existing guidelines typically suggest thromboprophylaxis for most patients. Both patient‐ and procedure‐specific factors are critical in making an informed decision on the use of thromboprophylaxis.
Our aim is to summarize Guidelines proposal and to provide procedure and patient risk-specific guidance weighing the benefit of reduced VTE with the harm of increased bleeding.
LAPSZÁM: MAGYAR UROLÓGIA | 2018 | 30. ÉVFOLYAM, 4. SZÁM
Összefoglalás
Közismert, hogy minden műtéti beavatkozás két legrettegettebb szövődménye a tromboembólia és a vérzés. Az előbbi kivédésére évtizedek óta különböző heparinszármazékokat alkalmazunk, amelyek hatásuk révén a második szövődmény, a vérzés kockázatát növelik. A sebésznek a peri- és posztoperatív alacsony molekulasúlyú heparin (LMWH) kezelés alkalmazásakor egy igen keskeny mezsgyén belül kell egyensúlyoznia a kívánt védelem elérése és a vérzéses szövődmények elkerülésének érdekében. Az, hogy kinek, mikor és mennyi véralvadásgátló szert adjunk, a nemzetközi irodalomban is vita tárgyát képzi. Különböző szakmák és országok irányelvei valamint a különböző készítmények gyártóinak alkalmazási előiratai gyakran ellentétes ajánlásokat tesznek. Abban azonban mindenki egyetért, hogy trombózis profilaxis kell. Minden eset más, egyedi mérlegelést igényel, de felmerül a kérdés, általában melyik betegcsoportnak, mikor és mennyit adjunk.
Célunk az, hogy összefoglaljuk a konzervatív és operatív szakmák által javasolt irányelveket bemutatva ezzel egy betegcsoportra adaptált mintát a szerek biztonságos alkalmazása és a szövődmények csökkentése céljából.
Bevezetés
Az urológiai sebészeti beavatkozás során alkalmazott trombózis profilaxis előnyös és hátrányos következményei több tényezőtől függnek, ezeket beteg- és beavatkozás-specifikus tényezők közé sorolhatjuk. Az orvosoknak egy szűk terápiás mezsgyén belül kell egyensúlyozniuk a vénás tromboembóliás szövődmény (VTE) kivédése és a vérzéses szövődmények elkerülése érdekében. Az irodalomban számos randomizált vizsgálat zajlott különböző alacsony molekulasúlyú heparinok (low molecular weight heparin – LMWH) hatásának összehasonlítására, amelyek alapján az LMWH-k alkalmazása esetén a hasi- és kismedencei műtéten átesett betegeknél 50%-kal csökkent a VTE előfordulása, azonban a jelentős posztoperatív vérzés előfordulása is 50%-kal növekedett (1).
Azoknál a betegeknél, akiknél VTE kockázata magas és a vérzés szövődményeké alacsony, jelentősen profitálnak a profilaxis alkalmazásából. Ennél a betegcsoportnál az 50%-os vérzéses szövődményráta minimális veszélyt jelent. Azon betegcsoportnál viszont, akiknél az antikoaguláció nélküli tromboembóliás rizikó alacsony és a vérzésveszély igen magas, az ellenkezője igaz.
Igen kevés vizsgálat történt viszont a trombózis kockázatának felmérésére, az egyes beavatkozások során profilaxis alkalmazása, így a VTE-profilaxis pontos alkalmazására nincs egyértelmű irányelv. Így nem meglepő, hogy a különböző országokban alkalmazott gyakorlat jelentősen eltér egymástól. Nemzetközi viszonylatban a nemzeti urológus társaságok honlapjain és kiadványaiban több mint 160 ajánlás található (2).
Összefoglalónk célja, hogy az elérhető szakmai irányelvek alapján egy beteg- és beavatkozás-specifikus mintát mutassunk be a profilaxis biztonságos alkalmazása és a szövődmények csökkentése céljából.
American Urological Association (AUA) ajánlás
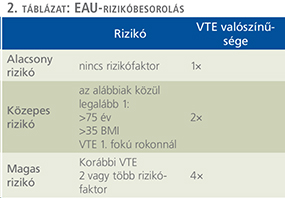
Az AUA Practice Guideline Comittee 2011-ben módosította 2009-ben kiadott ajánlásait (3). Ez a betegeket 4 rizikócsoportba sorolja (alacsony, közepes, magas és igen magas) az életkor, a rizikófaktorok jelenléte Greets és munkatársai által alkotott definíciók és a beavatkozás típusa („minor” és „major” beavatkozás) alapján (4). A minor beavatkozásokhoz a rövid műtéti idejű gyors felépülésű műtéteket sorolja, míg a major műtétekhez az összes minor csoportba nem sorolható. Ez a séma elsősorban a beteg rizikója alapján tesz javaslatot (1. táblázat).

Javaslatuk alapján az alábbi állapotok jelenléte esetén kell számolni magasabb vénás tromboembóliás rizikóval: nagyobb alsó végtagi trauma, immobilitás, malignitás, nem sebészi daganatterápia, korábbi mélyvénás trombózis, idősebb kor, terhesség, ösztrogéntartalmú antikoncipiens és hormonpótló kezelés, légzési- és keringési elégtelenség, gyulladásos bélbetegség, nephrosis szindróma, mieloproliferatív betegség, paroxizmális nocturnalis haemoglobinuria, obezitás, dohányzás, varicositás, centrál vénás kanül jelenléte, örökölt és szerzett trombofília. Arról, hogy ezen faktorok mennyire befolyásolják a VTE kialakulását, a társaság nem nyilatkozott. A profilaxis adásának időtartamára sem tesz pontos javaslatot, általánosságban a kórházi tartózkodás idejére terjed ki, és véleményük alapján az elbocsátás után csak az igen magas rizikójú betegeknél szükséges enoxaparin vagy warfarin alkalmazása.
Az AUA a fentiek mellett a beavatkozás módja szerint is megkülönbözteti az LMWH-profilaxis szükségességét. Ajánlásuk alapján általában a transzurethrális beavatkozások túlnyomó többségénél nincs szükség farmakológiai vagy mechanikai profilaxisra. A VTE és a vérzéses szövődmények igen változó mértékűek e betegek között, így a prosztata transzurethrális reszekciója után alkalmazott profilaxist személyre szabottan kell alkalmazni. Az anitiinkontinens beavatkozások és a kismedencei rekonstrukciós sebészeti műtétek is változó vérzéses és tromboembóliás rizikóval járnak, így ezeknél a beavatkozásoknál sem tesz egyértelmű ajánlásokat. Az igen korai mobilizációval járó periurethralis és sling műtéteknél nincs szükség profilaxisra. Ezzel ellentétben a vaginális, paravaginális rekonstrukciós, szuszpenziós műtétek és sacrocolpopexia magas VTE-rizikóval járnak, így ezeknél a beavatkozásoknál ajánlott a profilaxis alkalmazása.
A laparoszkópos és robottal végzett radikális műtétek tekintetében a társaság csak a prostatectomia, illetve nephrectomia tekintetében tesz ajánlásokat. Javasolják pneumatikus kompressziós készülék alkalmazását kiegészítve gyógyszeres profilaxissal a magas és igen magas rizikójú betegek esetében. A nyitott radikális műtétek esetében, különösen a prostatectomia és cystectomia esetében a társaság egyértelmű javaslata a mechanikai profilaxis alkalmazása, emellett mérlegelendő a farmakológiai profilaxissal való kiegészítés.
European Association of Urology (EAU) ajánlás
Az EAU a többi társasághoz hasonlóan 2016-ban közölte ajánlásait a tromboprofilaxis témakörében (5). Az ajánlások beavatkozás- és betegkockázat-specifikus rizikófaktorok figyelembevételével történtek. A szövődményeket nem halálos (szimptomatikus mélyvénás trombózis és pulmonalis embólia) és halálos tromboembóliás valamint nem halálos (reoperációt vagy intervenciót igénylő vérzés) és halálos vérzéses kategóriába sorolják, és felmérik ezek kockázatát. Az evidenciák alapján a súlyos vérzés kumulatív rizikója a beavatkozást követő reggelig 90%, míg az első 24 órában 50%. Ezzel szemben a vénás tromboembóliás szövődmények előfordulásának aránya az első 4 hétben konstans. Ez alapján a társaság a posztoperatív LMWH-kezelés indításának ideális időpontját a műtétet követő 24 óra múlva javasolja. Több randomizált vizsgálat metaanalízise azt igazolta, hogy a mechanikai profilaxis szintén 50%-kal csökkenti a VTE előfordulását, míg a posztoperatív vérzés lehetőségét nem növelik, azonban az ajánlás evidenciaszintje igen alacsony.
Az EAU által javasolt VTE betegadaptált rizikócsoportokat a 2. táblázat foglalja össze.
Az európai társaság a fent leírtakat figyelembe véve szigorú ajánlásokat tett a különböző műtéttípusok esetén alkalmazott profilaxist illetően. A kis, ambulánsan is elvégezhető beavatkozások esetében mind a gyógyszeres, mind a mechanikai profilaxis használata szükségtelen, mivel ezen betegek VTE kockázata az átlagpopulációéval azonos magas vérzéses rizikó mellett.
Radikális cystectomia esetében, függetlenül a végrehajtás módjától ajánlja mind a gyógyszeres, mind a mechanikai profilaxis alkalmazását.
A radikális prostatectomiák esetében ezzel szemben különbséget tesz a műtét módja és az elvégzett kismedencei lymphadenectomia mértékétől függően. A nyílt beavatkozások esetében mindig kell a betegnek gyógyszeres és mechanikai profilaxisban részesülnie. Robotasszisztált és laparoszkópos prostatectomia esetében a mechanikai profilaxis javasolt és csak lymphadenectomia elvégzése esetén ajánlott a gyógyszeres profilaxis alkalmazása.
Parciális nephrectomia esetében minden betegnél javasolt a mechanikai profilaxis. Nyílt beavatkozások esetén minden betegnél, míg laparoszkóppal végzett esetekben csak a magas tromboembóliás rizikójú betegeknél ajánlják LMWH alkalmazását. Radikális nephrectomia esetén hasonló ajánlásokat tettek. A trombectomiával járó esetekben viszont egyértelműen szükséges a mechanikai és farmakológiai profilaxis is, csakúgy, mint ureteronephrectomia, retroperitonealis lymphadenectomia esetén is.
A nem onkológiai indikációval végzett transzurethrális prosztatareszekció esetében egyértelműen a gyógyszeres profilaxis ellen foglalnak állást és mechanikai profilaxis alkalmazását is csak magas kockázatú betegeknél javasolják, hasonlóan a kismedencei rekonstrukciós, prolapsus és perkután kőműtétek esetében is.
National Insitute for Health and Care Excellence (NICE) – UK irányelv
Az angliai szervezet 2010-ben adta ki legfrissebb ajánlását a VTE megelőzésére mind a járóbeteg, mind az intézetben fekvő betegek számára (6). Az irányelveik a vérzés és a trombózisra való hajlam betegspecifikus és beavatkozás-specifikus rizikótényezőinek felderítésén alapulnak előre meghatározott „checklist” alapján. A NICE véleménye szerint a sebészeti beavatkozás előtt álló betegek mind magasabb rizikócsoportba tartoznak. A beavatkozás-specifikus rizikótényezőknek az alábbiakat találták:
- >90 perc teljes anesztéziai és műtéti idő,
- >60 perc műtéti idő a kismedencében vagy az alsó végtagokon, akut beavatkozás gyulladás vagy hasi történés esetén,
- immobilitást eredményező beavatkozások.
A betegspecifikus tényezőknek az alábbiakat határozták meg: aktív tumoros betegség, aktív tumorkezelés, >60 év, ITO-kezelés, dehidráció, ismert trombofília, BMI >30, egy vagy több szignifikáns komorbiditás, 1. fokú rokonnál VTE, hormonpótló kezelés, ösztrogéntartalmú antikoncopiens (OAC), varicositás phlebitisszel, terhesség, 6> posztpartum.
A NICE megállapít vérzésre hajalmosító tényezőket is, úgymint szerzett vérzészavarok (akut májelégtelenség), antikoaguláns kezelés (pl. warfarin), spinál anesztézia/lumbálpunkció/epidural anesztézia igény 4 órán belül vagy a következő 12 órában, akut stroke, thrombocytopenia, kontrollálatlan hipertónia (>230/120 Hgmm), kezeletlen örökölt vérzészavar.
A NICE javaslata alapján profilaxis szükséges minden olyan betegnek, aki magas kockázati csoportba sorolható. Az általuk javasolt profilaxis egyrészt mechanikai (kompressziós harisnya, intermittáló pneumatikus kompressziós készülék), a mobilizáció megkezdéséig kell folytatni, másrészt LMWH-profilaxis a teljes mobilizáció megkezdéséig, 5-7 napig. Onkológiai indikációval végzett hasi-kismedencei műtéten átesett betegek esetében ez 28 napra kiterjesztendő.
Magyar Thrombosis és Haemostasis Társaság, Transzfúziológiai és Hematológiai Szakmai Kollégium állásfoglalás
Az Egészségügyi Minisztérium 2011-ben publikálta a vénás tromboembóliák megelőzésére szóló irányelveit a belgyógyászati és sebészeti szakmák részére. Ennek alapja szintén a betegek és beavatkozások különböző kockázati csoportba való besorolása, amely a 3. táblázatban található (6, 7).

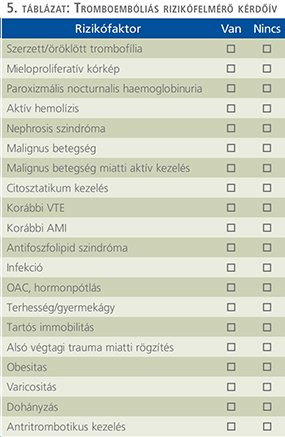
A betegspecifikus kockázati tényezők a nemzetközi irodalomnak megfelelően: trombofíliák, mieloproliferatív kórképek, paroxizmális nocturnalis haemoglobinuria, aktív hemolízis, nephrosis szindróma, malignus betegségek és azok kezelése során létrejött cytolisis, citosztatikus kezelés, korábbi VTE/AMI, antifoszfolipid szindróma, infekció, OAC, ösztrogénpótlás, terhesség és gyermekágy, tartós ágynyugalom, alsó végtag rögzítése és az ebből bekövetkező immobilitás, obesitas, varicositás, >6 h repülőút, dohányzás.
A javasolt profilaxis a kis kockázatú betegek esetében a korai mobilizálás, mechanikai profilaxis és a megfelelő folyadékpótlás. Ebben az ajánlásban a közepes, nagy és igen nagy kockázatú betegek profilaxisa között nincs különbség. Elektív műtétek esetén javasolt LMWH adása a műtét előtt 2 órával a gyógyszer alkalmazási előirat szerintit dózisban (ld. Függelék), amelyet igen nagy kockázatú betegek esetében a műtét befejezését követő 6 óra múlva ismételni kell, majd ezt követően naponta egy alkalommal szükséges folytatni. A kezelést a teljes mobilizációig, az igen nagy kockázatú betegek esetében 4 hétig folytatni kell. Emellett javasolja a megfelelő kompressziós grádienst biztosító elasztikus harisnya alkalmazását is. Ezen javaslatok azonban nem urológiai specifikusak, nem kerül többek között tárgyalásra az egyik leggyakrabban végzett műtéttípus, a prosztata transzurethrális reszekciója sem.
A preoperatív trombocitaaggregáció-gátló szerek és antikoaguláns kezelés menedzsmentje
Az elektív műtétek esetén a tromboembóliás és vérzéses szövődmények kivédése céljából szükséges a profilaxis helyes megválasztása. Számos beteg különböző kardiovaszkuláris és neurológiai állapot megelőzése céljából különféle antikoaguláns kezelésben részesül. Ezen gyógyszerek hatásának lecsengési ideje a gyógyszer elhagyása esetén is több nap. Azonban ezen betegek esetében alapvető fontosságú a véralvadásgátlás fenntartása, amely a beavatkozás során jelentős mértékben megemelné a vérzés kockázatát, így azok hatásának felfüggesztése szükséges. Az irodalomban is vitatott a különböző szakmák részéről, hogy melyik betegnek kell a korábbi per os antikoaguláns kezelését átállítani a sebészi beavatkozások előtt a gyógyszeresen könnyen felfüggeszthető, rövidebb hatásidővel rendelkező heparinokra vagy azok származékaira, mikor és milyen adagolásra. 2014-ben megjelent, kardiológusok és aneszteziológusok által publikált tanulmány alapján „áthidaló” („bridging”) kezelés csak magas trombózisrizikó és K-vitamin-antagonista kezelés együttes fennállása esetén szükséges (9). A különböző rizikócsoportokat a 4. táblázatban foglaljuk össze.
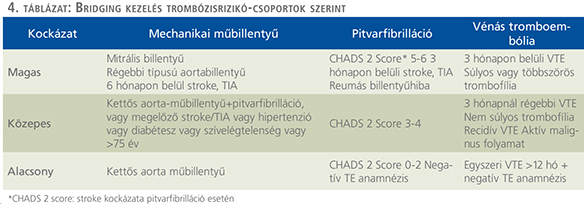
Az ajánlás alapján a K-vitamin-antagonista hatású gyógyszereket alacsony vérzéses rizikójú beavatkozások esetén nem szükséges elhagyni. Alacsony és közepes trombózisrizikó esetén elégséges a beavatkozás előtt 4-5 nappal ezen gyógyszerek szedését abbahagyni, áthidaló kezelést nem kell alkalmazni és a műtét előtt a véralvadási paramétereket ellenőrizni szükséges. Magas trombózisrizikójú betegek esetén korábbi warfarin terápiát a műtét előtti 5. napon kell felfüggeszteni és a 3. naptól kezdve terápiás dózisú LMWH-t indítani a műtétet megelőző 24 óráig. Acenokumarol (Syncumar) tartalmú készítmény szedése esetén azt a beavatkozás előtti 3. napon kell abbahagyni és a műtét előtt 48 órával kell terápiás dózisú LMWH-kezelést adni szintén a műtétet megelőző 24 óráig. Alacsony vérzéses rizikójú betegek esetében ezen szereket a posztoperatív első napon, míg magas rizikó esetén 48-72 órával később lehet legkorábban visszaállítani, addig a vérzés rizikójától függően profilaktikus vagy terápiás LMWH adása szükséges.
Az új típusú antikoaguláns szerek esetében az „áthidaló” LMWH-kezelés nem javasolt. A rivaroxaban, apixaban és edoxaban tartalmú készítmények esetén a beavatkozás előtt 3., míg a dabigatran tartalmú gyógyszerek esetén 4-5 nappal kell annak szedését felfüggeszteni. Alacsony vérzéses rizikójú műtét esetén ezen szerek a posztoperatív első nap visszaállíthatók, míg közepes és magas rizikó esetén 72 órás profilaktikus dózisú LMWH-kezelés szükséges az eredeti terápia visszaállítása esetén.
A trombocitaaggregáció-gátló szerek közül az aszpirin elhagyását csak magas vérzéses rizikó esetén ajánlják, ilyenkor javasolt azt a tervezett beavatkozás előtt 3 nappal felfüggeszteni. Gyógyszerkibocsátó koronáriastent esetén azonban még ilyen esetekben sem hagyható el.
A clopidogrel és ticagrelor tartalmú készítmények esetén 5 nap, míg plasugrel esetén 7 nap a műtét előtti javasolt gyógyszer-felfüggesztési időtartam. Ezen gyógyszereket javasolt minél hamarabb visszaállítani, ideálisan a bőrzárást követő 24 óra múlva.
Megbeszélés
Az irodalmat áttekintve az általunk trombózis profilaxis céljából alkalmazott terápiás elvek az alábbiak a beavatkozás specifikus tényezők figyelembe vételével:
- Scrotalis műtétek, kivéve tumoros szemikasztráció és absecdalt orhcidoepidimytis, varicocele, cirkumcízió, urethrotomia interna, hólyagnyaki sclerosis miatt végzett TURP, csak hólyagkőzúzás, meatotomia, húgycsőpolipus, szalagműtétek + fiatal életkor, rizikófaktorok nélkül: kompressziós harisnya, korai mobilizáció, hidráció.
- Tumoros szemikasztráció, TURB, trokár TURP, kismedencei rekonstrukciós műtétek, paravaginális műtétek, nem onkológiai nagyműtétek, vagy minor beavatkozások, de magas rizikóval: kompressziós harisnya a mobilizáció megkezdéséig + LMWH a teljes mobilizációig, de max. 7-10 napig.
- Infekció kezelése, illetve emiatt végzett műtét: LMWH az infekció zajlásának ideje alatt.
- Onkológiai műtétek, uroszepszis: kompressziós harisnya a mobilizáció megkezdéséig + LMWH 4 hétig.
A preoperatív profilaxis a kis kockázat kivételével a műtét előtt 12 órával történjen meg, igen magas rizikó esetén a műtét után 6 órával ismételve, 24 óra múlva napi 1×.
Emellett javasoljuk minden beteg felvételekor történő, a vénás tromboembóliás események betegspecifikus rizikófaktorainak felmérését minden betegnél (5. táblázat).
Az elmúlt években a trombózis profilaxis irányelveiben is jelentős változások jelentkeztek. Az új iránymutatások felállítása során a korábbi szakértők mellett a klinikai szakmák is bevonásra kerültek. Az új típusú antikoaguláns szerek megjelenésével háttérbe szorult a „bridging”, emellett a gyógyszerek eliminálásban fontos szerepet játszó vesefunkció adaptált dozírozás előtérbe került. Habár a heparinszármazékok a rövid hatástartam és a relatíve könnyű és olcsó felfüggeszthetőség miatt még mindig a perioperatív profilaxis elsőként választandó szerei, azonban az egyéb területeken történő alkalmazásuk háttérbe szorult. Ennek megfelelően az LMWH-gyártók piaci részesedése az elmúlt hat évben csaknem a felére csökkent. Ezek alapján felmerül az is, hogy kinek az érdeke a különböző heparinszármazékok nemritkán indokolatlanul hosszú ideig történő alkalmazása, a betegé esetlegesen a piacé?
FÜGGELÉK: kivonat az egyes készítmények alkalmazási előiratából
CLEXAN
Vénás tromboembóliás szövődmény megelőzésére közepes és magas kockázatú műtéti beavatkozás esetén
A tromboembóliás szövődmény kialakulásának kockázata egyénileg felbecsülhető validált, kockázatbesorolási modell alapján.
- A tromboembólia szempontjából közepes rizikójú betegeknek az enoxaparin-nátrium ajánlott adagja 2000 NE (20 mg) naponta egy alkalommal szubkután (sc.) injekció formájában. A sebészeti beavatkozás előtt (2 órával a műtétet megelőzően) beadott 2000 NE (20 mg) enoxaparin-nátrium hatásosnak és biztonságosnak bizonyult közepes kockázatú műtéti beavatkozás esetén.
A közepes kockázatú betegeknél az enoxaparin-nátrium-kezelés időtartama minimum 7-10 nap, függetlenült a klinikai állapot (pl. mobilitás) alakulásától. A profilaktikus kezelést mindaddig folytatni kell, amíg a beteg mobilitása jelentősen korlátozott.
- A tromboembólia szempontjából nagy rizikójú betegeknek az enoxaparin-nátrium ajánlott adagja 4000 NE (40 mg) naponta egy alkalommal szubkután (sc.) injekció formájában, amit lehetőleg a műtét előtt 12 órával kell elkezdeni. Amennyiben a műtét előtti 12 óránál korábban van szükség az enoxaparin-nátrium profilaktikus alkalmazására (pl. ortopéd sebészeti beavatkozásra váró magas rizikójú beteg esetében), az utolsó injekciót a műtét előtt legalább 12 órával kell beadni, és a kezelést a műtét után 12 órával kell folytatni.
- Nagyobb ortopéd sebészeti beavatkozáson áteső betegeknél kiterjesztett, legalább 5 hétig tartó tromboprofilaxis javasolt.
- Hasi vagy kismedencei daganat műtéti eltávolításán áteső, vénás tromboembólia (VTE) szempontjából nagy rizikójú betegeknek meghosszabbított, legalább 4 hétig tartó tromboprofilaxis javasolt.
Közepes és enyhe vesekárosodás
Túlsúlyos betegek esetében nagyobb a tromboembólia kialakulásának kockázata. A profilaktikus dózisok hatásosságát és biztonságosságát túlsúlyos betegek esetében (BMI >30 kg/m2) még nem határozták meg teljes mértékben, így a dózismódosításra vonatkozóan nincs megállapodás.
FRAXIPARIN
Tromboembóliás megbetegedések megelőzése
Naponta 1 alkalommal sc. injekcióban kell alkalmazni a készítményt.
Műtéti beavatkozások esetén
Általános érzéstelenítésben végzett sebészeti beavatkozások során alkalmazható az alábbiakban megadott adagolás.
Közepes kockázat (pl. általános sebészeti beavatkozás) esetén
Naponta 1-szer 0,3 ml (2850 anti-Xa NE) alkalmazandó sc. injekcióban.
2-4 órával a sebészeti beavatkozás előtt kell az első 0,3 ml-es (2850 anti-Xa NE) injekciót sc. beadni.
Ugyanezt a sc. adagot kell naponta 1-szer ismételni a kockázati időtartam alatt, a beteg mobilizációjának befejezéséig (de legalább 7 napon keresztül).
Magas kockázat (pl. ortopéd-sebészeti beavatkozás) esetén
Az adagot a beteg testtömege alapján kell meghatározni (38 anti-Xa NE/ttkg), és az így kiszámított dózist kell alkalmazni naponta 1-szer, sc. (lásd 1. táblázat):
- az első dózis beadása szubkután injekcióban 12 órával a műtét előtt,
- ezután ugyanennek a dózisnak a beadása 12 órával a műtét után történjen,
- majd naponta egyszer kell ismételni ugyanezt az adagot a 4. posztoperatív napig.
A 4. posztoperatív naptól nagyobb dózisokat (57 anti-Xa NE/ttkg) kell alkalmazni (lásd a táblázatot).
Súlyos vesekárosodásban szenvedő betegeknél (kreatinin-clearance <30 ml/perc) az adagot 25-33%-kal kell csökkenteni.
FRAGMIN
Pre-, peri- és posztoperatív vénás tromboembóliás szövődmények megelőzése
Szubkután injekció formájában általában naponta 1 alkalommal adandó.
Átlagos testsúly (50-100 ttkg) esetén:
- A tromboembólia mérsékelt kockázatával járó állapotokban: 2500 NE szubkután.
Például általános sebészetben: 2500 NE szubkután a műtét kezdetét megelőzően 1-2 órával.
A műtét után naponta egyszer – minden reggel – ugyancsak 2500 NE szubkután, amíg a beteg teljesen nem mobilizálható.
A tromboembólia fokozott kockázatával járó állapotaiban: 5000 NE szubkután
Például fokozott rizikóval járó általános sebészeti, onkológiai sebészeti, illetve ortopédiai műtéteknél:
- Preoperatívan 5000 NE szubkután a műtétet megelőző este, majd a műtétet követően naponta egyszer – minden este – ismételten 5000 NE szubkután adagolva, a beteg mobilizálhatóságának eléréséig – átlagosan 7-10 napig.
Alternatívaként adható az alábbi módon is: - Preoperatívan 2500 NE szubkután a műtétet megelőzően 1-2 órával, majd 8-12 órával, de a műtét végétől számítva legalább 4 órával később, ismételten 2500 NE szubkután. A műtét utáni napokon naponta egyszer – minden reggel – 5000 NE szubkután, a mobilizálhatóság eléréséig.
A profilaxis prolongációja megfontolandó fennálló rizikófaktorral rendelkező betegek esetében (pl. obesitas, alsó végtagi parézis, malignitás), vagy anamnézisben szereplő mélyvénás trombózis/tromboembólia mellett.
Klinikailag jelentős vesekárosodás esetén, (a szérum kreatininszint a normálérték háromszorosa fölé emelkedik) a dalteparin adagját aszerint kell módosítani, hogy fenntartható legyen az 1 NE/ml (0,5-1,5 NE/ml intervallumban) anti-Xa terápiás szint.
References
1. Gould MK, Garcia DA, Wren SM, et al. American college of chest physicians: prevention of VTE in nonorthopedic surgical patients: antithrombotic therapy and prevention of thrombosis, 9th ed: american college of chest physicians evidence‐ based clinical practice guidelines. Chest 2012; 141(Suppl 2): e227S–77S.
2. Violette PD, Cartwright R, Briel M, Tikkinen KA, Guyatt G. Guideline of guidelines: thromboprophylaxis for urological surgery. BJU Int 2016 Sep; 118(3): 351–8. doi: 10.1111/bju.13496. Epub 2016 Apr 29. https://doi.org/10.1111/bju.13496
3. Forrest JB, Clemens JQ, Finamore P, et al. American urological association: AUA best practice statement for the prevention of deep vein thrombosis in patients undergoing urologic surgery. J Urol 2009; 181: 1170–7. Reviewed and validity confirmed 2011
4. Geerts WH, Pineo GF, Heit JA, et al. Prevention of venous thromboembolism: the Seventh ACCP conference on antithrombotic and thrombolytic therapy. Chest 2004; 126(3 Suppl): 338S–400S. https://doi.org/10.1378/chest.126.3_suppl.338S
5. EAU Guidelines on Thromboprophylaxis in Urologycal Surgery 2018.
6. Treasure T, Hill J. NICE guidance on reducing the risk of venous thromboembolism in patients admitted to hospital. J R Soc Med 2010; 103: 210–2. https://doi.org/10.1258/jrsm.2010.100086
7. Az Egészségügyi Minisztérium szakmai irányelve, A thromboemboliák megelőzése és kezelése; A Magyar Thrombosis és Haemostasis Társaság, felkért szakértők, és a Transzfúziológiai és Hematológiai Szakmai Kollégium 2011.
8. Pfliegler Gy. A tromboemboliák kockázatának csökkentése és kezelése. Az Egészségügyi Minisztérium Szakmai Irányelve 2011.
9. Kristensen SD, Knuuti J, Saraste A, Anker S, Bøtker HE, De Hert S, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management European. J Anaesthesiology 2014; 31: 517–573. https://doi.org/10.1097/EJA.0000000000000150
A Klinikák finanszírozásának egyes kérdései
DOI: 10.22591/magyurol.2018.4.fabosz.155
Authors:
Fábos Zoltán dr.
Pécsi Tudományegyetem KK, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
LAPSZÁM: MAGYAR UROLÓGIA | 2018 | 30. ÉVFOLYAM, 4. SZÁM
Szepesváry Zsolt kitűnően rávilágított a hazai finanszírozás hiányosságaira egy megyei kórház szemszögéből.
Az urológiai fekvőbeteg-finanszírozás a klinikákon is hasonló problémákat okoz, de ezen felül még olyan speciális nehézségekkel is meg kell küzdeni, mint az oktatás és a kutatás.
A másik probléma a klinikák esetén a fenntartás és finanszírozás kettőssége. Az orvoskarok fenntartója az Oktatási Minisztérium és a finanszírozást is biztosítja, míg a Klinikai Központok fenntartója az Emberi Erőforrás Minisztériumon belül az Egészségügyi Államtitkárság, de a betegellátást a NEAK finanszírozza.
Minden ellátási szinten gondot okoz a szövődmények ellátása, igenis bele kell számolni a súlyszám kialakításánál a szövődmények lehetőségét. Korábbi HBCS-verziókban (HBCS1.0 – HBCS 4.1) szerepeltek olyan HBCS-k, amelyek kísérőbetegségekkel kiegészítve magasabb súlyszámot jelentettek. Ez nem pontosan a szövődményeket vette figyelembe, azonban közvetve mégis megjelent a finanszírozásban (pl.: egy cukorbetegség esetén fokozott kockázattal fellépő húgyúti fertőzés többlet antibiotikum-költségét fedezte). Sajnálatos módon ezen HBCS-k kikerültek a rendszerből.
A következő általános, mindenkit érintő probléma az eszközök amortizációja. Ebben a kérdésben a fenntartó szerepe óriási, és azért jelentős különbségek vannak egyes osztályok felszereltsége között. Amíg a megyei és városi kórházak az önkormányzatok tulajdonába tartoztak, sokkal heterogénebb volt az eszközpark. Voltak olyan városi kórházak, ahol az önkormányzat jelentős anyagi forrást biztosított eszközvásárlásra (jobban működött a lobbi), és voltak olyan megyei kórházak, ahol minimális összeget fordítottak az eszközbeszerzésre. Akkor a kórházak között létezett az a különbség, hogy egyes helyeken 4 dimenziós UH volt, máshol reziduális vizeletet nem lehetett megítélni az UH-val. Amióta az állam átvette az önkormányzati kórházakat, azóta kampányszerű beszerzések eredményezik a full HD-s videorendszert és a félvak TUR-os optikákat egy kórházon belül. A klinikákon jelenleg még rosszabb a helyzet, ugyanis azt, hogy az eszközvásárlásra fordítható kevés pénzből mi jut a klinikákra, az orvoskar dékánjának és a Klinikai Központ elnökének csatája dönti el.
A harmadik nagy kérdés egy osztály nyereséges vagy veszteséges működtetése. Ez ugyanis meghatározza egy osztály sorsát az adott kórházban. A kórházigazgatóknak az érdeke, hogy nyereséges legyen a kórház, ezért azokat a szakmákat helyezik előtérbe, amely szakmák nem „termelnek” veszteséget. Ebből a szempontból nagyon nagy eredmény, hogy a Győri Urológiai osztály nyereséges és ebben nyilvánvalóan jelentős szerepe van az osztályvezetőknek. Sajnos azt kell mondanom, hogy az urológiai szakma általában veszteségesen működtethető. 2014-ben tartott felmérés alapján mind a 4 egyetemi klinika és 8 megyei kórház veszteséges volt.
A nyereséges osztály kritériumai nincsenek lefektetve és nem egységesek. Például 1995-ben a Pécsi Klinikáról nyolcan elmentünk Götz professzor úr irányításával megnézni, hogy akkor az ország egyetlen nyereséges osztálya mitől nyereséges. Egyszerű volt a képlet. Ha teljesítették a havi 120 súlyszámot, akkor nullszaldósok voltak, az efeletti súlyszámbevétel volt a nyereség. A kiadási oldalt nem vették figyelembe.
Nézzük meg, milyen tényezők befolyásolják alapvetően az eredményességet. A központi elvonás alapvetően meghatározó egy osztály nyereséges vagy veszteséges megítélésében. A jelenleg is hatályban lévő 50 elemű HBCS alapján a központi elvonás kb. 10%. Volt olyan időszak a Pécsi Urológiai Klinikán, amikor ez megközelítette a 40%-ot. Nyilván lehetetlen ezt kitermelni az urológiai HBCS-ből.
A másik meghatározó kérdés a bérköltség, ezen belül a bennalvó ügyeletesek bérköltsége. Jelenleg Dunántúlon két helyen (Pécs, Szombathely) működik a bennalvós ügyeletes rendszer. Ez jelentős többletkiadás a működtetésben.
A harmadik meghatározó tényező az urológiai nagyműtétek száma egy osztály eredményében. Minél több radikális műtétet (cystectomia, radikális prostatectomia, posztkemoterápiás RLA, pénisztumorok radikális műtétei) végzünk, annál nagyobb lesz a veszteségünk. Ahol csak „kisműtéteket” végeznek, kisebb a veszteség mértéke.
Ezek után a megfelelő működés feltételeinek biztosítását nagyon jól összefoglalta a szerző, de biztos, hogy ez a „szerényebb” változat a szükséges költségeknek.
A korrekt HBCS-súlyszám megállapításához nagyon aktuális lenne egy országos költségfelmérés. Ezenfelül meg kell határozni a fenntartóknak, hogy mennyi forrást biztosítanak a biztonságos eszközpark működtetéséhez tekintettel arra, hogy nem akarják a HBCS-be beemelni az amortizáció költségét. Természetesen egyszerűbb és biztonságosabb lenne, ha el lehetne érni, hogy az amortizáció bekerüljön a HBCS-be.
Funding for urological inpatient care
DOI: 10.22591/magyurol.2018.4.szepesvaryzs.150
Authors:
Szepesváry Zsolt dr.
Petz Aladár Megyei Oktató Kórház, Urológiai osztály, Győr (főigazgató: Tamás László János dr.)
Summary
It is well known that many interventions were not reimbursed at a fair price in Hungarian health care at all levels. Although the HBCS-based funding settles the same cost per category, hospital spending is different for each patient. Most urological interventions are underfinanced nevertheless, the operations must be carried out, and interventions cannot be omitted by the nature of the illness.
In addition to steep financing, expectations are high. High quality and fast patient health care according to European norms, maintenance by the right professional work, patient complaints, litigation, profitable operation, and compliance with the rules are the expectation.
In a new approach, the author tries to demonstrate the minimum and ideal financial conditions of an average county department.
The author determines the minimum required and optimal funding standard of HBCS categories with that the healthcare provider can operate in compliance with professional, safety, law and ethical rules.
LAPSZÁM: MAGYAR UROLÓGIA | 2018 | 30. ÉVFOLYAM, 4. SZÁM
Összefoglalás
Minden szinten nagy probléma, és köztudott, hogy a magyar egészségügyi ellátásban nem értékén finanszírozott sok beavatkozás. Ennek ellenére el kell végezni őket, a beavatkozások nem elhagyhatók a betegségek jellegénél fogva. Többféle megközelítés van arról, hogyan mutatható ki egyes beavatkozások tényleges költsége. Bele kell-e számolni a szövődményarányt és ha igen, hogyan. Ugyanabban a betegségcsoportban más költségekkel találkozunk egy jó egészségkultúrával rendelkező területen és más költségekkel egy elhanyagolt, az ellátásra megkésve jelentkező, értelemszerűen sokkal nagyobb kockázatú betegcsoport esetén. Bár a beavatkozás megnevezése ugyanaz, de más az anyagi teher egy kis kockázatú, döntően egyszerűbb eseteket operáló városi kórház esetén, ahol a várhatóan szövődményes beteg továbbküldhető, és más egy erre szakosodott centrumban, ahol a bonyolult, nehezebben gyógyuló esetek aránya jóval magasabb és továbbküldési lehetőség nincs.
Általánosságban elmondható, hogy a körülményeink a magyar urológiában nem pompásak. A műszerek sok esetben használtak és elhasználtak, bár az utóbbi időben sok beszerzés történt, a műszerkészlet heterogén. Mivel nincs megfelelő terv a tervezett cserékre, kampányszerű beszerzésekből tudjuk az eszközöket pótolni, sokszor nem a célszerűség, hanem egyéb szempontok alapján. Így ugyanabban a műtőben parádézik a vadonatúj HD-4k-3D videorendszer, és a félvak TUR-os optika. Kiemelendő, hogy míg más, szintén veszélyes üzemű területen (pl. közlekedés) a műszaki megfelelősség ellenőrzése szigorú, az egészségügyben az eszközök a végtelenségig használhatók, alkalmatlanságukról semmilyen hatóság nem tud vagy akar állást foglalni. Nem vesszük figyelembe a tervezett élettartamot (pl. az elvégezhető beavatkozások száma), vagy a garanciaidőn túli kötelező karbantartásokat. Az eszközök pótlására, karbantartására pedig semmilyen tervezett keret nincs a finanszírozásban.
A bevételeket a HBCS alapján finanszírozott ellátás jelenti, ezen felül pályázatokon, nagy baj esetén a Vis maior alapból tudunk pénzt szerezni. Sokat tettek hozzá a működéshez a döntően osztályokhoz, kórházakhoz kötődő alapítványok, de az elmúlt években a cégek és magánszemélyek részéről csökkenő adakozási lehetőségek miatt ezen források szűkülése figyelhető meg.
A mostoha finanszírozás mellett az elvárások magasak. A páciensek részéről a minőségi, európai normáknak megfelelő, gyors betegellátás, a fenntartó részéről a megfelelő szakmai munka, a betegpanaszok, perek elkerülése, a nyereséges működés és a szabályok betartása az elvárás.
Megjegyzendő, hogy a nyereség és a veszteség is virtuális. Ha a finanszírozó úgy állapítja meg a beavatkozásért járó térítést, hogy az nem fedezi a költségeket, akkor az nem hozható ki pozitív egyenlegűre. Ugyanez fordítva, de vonatkozik a túlfinanszírozott ellátásokra is. Az ellátóhelynek egyetlen lehetősége, ha teheti, az alulfinanszírozott ellátásokat elkerüli, a betegeket továbbküldi, a jól fizetőket megtartja. Ez nagy valószínűséggel szakmai szabályokat is sért. Minél magasabb progresszivitási szinten van egy osztály, annál kevésbé teheti ezt meg, ezáltal a rendszerbe kódolt a gyengébb pénzügyi eredmény az alacsonyabb progresszivitási szintű osztályokhoz képest. A rosszabb pénzügyi eredmény mellett nem fordítható forrás az esetleges pluszjuttatásokra, keresetkiegészítésekre, ügyeleti többletfinanszírozásra. Ez konzerválja azt az országos szinten tapasztalható, nem (csak) az urológiára jellemző visszás helyzetet, hogy a magas felelősség és terhelés mellett dolgozó szakemberek munkáltató általi anyagi megbecsülése a legkisebb, míg az alacsonyabb terhelésű, kevesebb stresszel járó, kisebb progresszivitású helyeken sokkal több pénz jut a keresetkiegészítésekre és az ügyeleti díjak elfogadható szintre emelésére.
Mit tekinthetünk nyereségnek az egészségügyi ellátás során?
A finanszírozó oldaláról azt jelenti, hogy „kijövünk” a HBCS-ből. Az állami finanszírozáson túl nem kell újabb pénzt tenni a rendszerbe. Az osztály szemszögéből azt jelenti, hogy betartjuk a szakmai, etikai, betegbiztonsági szabályokat, fejlesztjük és megfelelően karbantartjuk az eszközparkunkat, karbantartjuk és fejlesztjük az épületeinket, és még ezen felül a továbbképzéseinket is tudjuk finanszírozni. És a felsorolásban még nem is szerepelt a megfelelő bérezés.
Jelen cikkünkben nem célunk általános következtetéseket levonni. A finanszírozás szükséges mértékéhez egy új megközelítést igyekszünk bemutatni. Nem bontjuk le a költségeket beavatkozásokra, nem számoljuk tételesen az eszközöket, nem jegyezzük tablettánként a gyógyszereket. Egy átlagos megyei osztály működésén keresztül próbáljuk bemutatni a minimális és az ideális működéshez szükséges anyagi feltételeket. Éppen ezért a következtetések és az eredmények közvetlenül nem összevethetők a magasabb szintű (pl. klinikai) ellátóhelyekkel. Ugyanakkor ez kiindulási pontként és vitaalapként megfelelő lehet, tekintettel arra, hogy a Petz Aladár Megyei Oktató Kórház Urológiai Osztályán minden urológiai alapműtét megfelelő számban és nemcsak szórványosan fordul elő, beteg továbbküldés csak nagyon ritka esetekben történik, szövődményeinket saját magunk látjuk el. Technikailag nehéz műtétek is megfelelő számban vannak ahhoz, hogy a szövődményekkel költségszinten is számolnunk kelljen.
Hogy reális képet kaphassunk, néhány axiómát le kell fektetnünk. Mint minden magyarországi és nemcsak urológiai osztályon, a szabályokat nem tudjuk maradéktalanul betartani. Minden munkatársunk azon dolgozik, hogy a hiányos feltételek ellenére a betegbiztonság magas szintű maradjon. Ha egy beavatkozás nem végezhető el biztonsággal, nem végezzük el. A gyógyszerelésben és a profilaxisban (különösen az antibiotikum-profilaxis esetén) az EAU Guideline-t követjük. Azokat az eszközöket, amiket a tapasztalat alapján a beteg és beavatkozás veszélyeztetése nélkül újra lehet sterilizálni, de gyárilag egyszerhasználatosak, újrasterilizáljuk, akár többször is. Sajnos nem tudjuk az eszközeinket a tervezett élettartam elérésekor lecserélni, addig használjuk őket, amíg teljesen tönkre nem mennek, ez vonatkozik a kéziműszerekre is. Különös gondot fordítunk a nozokomiális fertőzésekre, a halmozódó esteket mindig a Mikrobiológiai osztállyal együtt kivizsgáljuk, az origót azonosítjuk. Az elmúlt öt évben nem fordult elő olyan fertőzéses eset, amelyben újrasterilizált egyszerhasználatos eszköz lett volna a forrás. Amelyik eszköz nem medikai forrásból beszerezhető és jóval olcsóbb, onnan vesszük (pl. monitorok, képrögzítők).
Szervezési oldalról különös figyelmet fordítunk a megfelelő dokumentálásra, kódolásra, az egynapos sebészeti finanszírozásban rejlő lehetőségek maximális kihasználására. A kódolás nem befolyásolja a szakmai döntéseket. Köszönhetően kiváló és gondos orvosainknak, szakdolgozóinknak és adminisztrátorainknak a 2017-es évet az osztályunk nyereséggel tudta zárni. Ez nemcsak a gyógyító munkának volt köszönhető, hanem a fegyelmezett és pontos adminisztrációnak is. A 2017-es adatokat a Kontrolling osztály bocsájtotta rendelkezésre, a műtéti adatok a kódolás és az éves jelentés alapján lettek közölve. Nem tartalmazzák a munkatársaink által más osztályokon végzett beavatkozásokat (pl. kórházunk másik osztályán fekvő beteg műtétje).
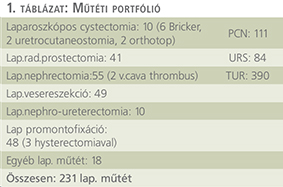
A műtéti adatok az 1. táblázatban láthatók. Nem tértünk ki a kisműtétekre, sok műtéti típust nem részleteztünk, a teljes műtéti paletta a Magyar Urológia folyóirat aktuális számaiban megismerhető. A kivonatos műtéti listát csupán a műtéti portfolió ismertetésére közöljük.
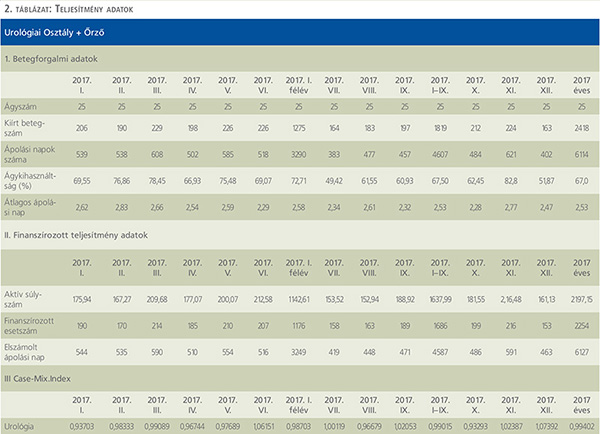
A 2017-es adatokat a 2–3. táblázat tartalmazza. Főbb vonalakban a 2017-es finanszírozott súlyszámunk: 2197. 15, a case mix index: 0,99, az átlagos ápolási nap: 2,53, az ágykihasználtság: 67,0% volt. Kórházunkban a minden arányos költség levonása utáni eredmény jelenti a III. költséghelyet (fedezet 3). Ez tartalmazza az igazgatási és üzemeltetési díjakat és minden levonást, ami az osztály működéséhez kell. Ez alapján eredményünk tavaly 41 814 500 Ft volt. A teljes bevétel
422 212 300 Ft-ra, a humán (bér) költség 111 364 800 Ft-ra adódott.
A további költségelemzéshez azt vesszük alapul, hogy osztályunk az elérhető optimumon működik, további racionalizálástól jelentős eredményjavulás a szakmai szempontok csorbulása nélkül már nem várható.
A valós költségszámításnál az előbbiekben részletezett adatok alapján számoltunk. Feltételezve, hogy az osztályunk így is az elérhető optimumon működik, a nemzetközi és hazai átlagnak megfelelő szövődmény- és infekciórátával, minden részletben meghatároztuk, hogy milyen valós költséggel kalkulálhatunk, ha egy minden szempontból megfelelő működést veszünk alapul. A megfelelő működés általunk javasolt feltételei:
- Az egyszerhasználatos eszközöket egyszer használjuk, utána kidobjuk.
- A nemzetközi gyakorlatban elfogadott eszközöket használunk, nem szükségmegoldásokat alkalmazunk. Például minden laparoszkópos veseműtéthez használunk kombinált vágóeszközt, nemcsak azokhoz, amelyekhez „nagyon kell”.
- A gépeket megfelelően szervizeltetjük betartva a gyártó által megadott beavatkozás szám utáni javasolt alkatrészcseréket.
- Minden eszközt az amortizációs idejét követően lecserélünk.
- A fontos területeken redundáns (tartalék) műszerparkot tartunk fent.
- Időszakosan új eszközöket szerzünk be és próbálunk ki.
- Az épület, helyiségek, betegágyak karbantartására és javítására megfelelő keretet biztosítunk.
- Anyagi lehetőséget kapunk a munkatársak motiválására, jutalmazására, nemcsak a bértábla alapján történik a bérezés. Lehetővé válik a terhelés, a felelősség és a munka anyagi differenciálására.
A havi költségeket több tényezőre bontottuk. A tárgyi feltételeknél először az egyszerhasználatos eszközöket vettük számba. Jelenleg átlagban havonta 840 000 Ft-ot költünk ezekre, a valós igény 4 400 000 Ft lenne az alábbi részletekben:
- Egyszerhasználatos nyílt/laparoszkópos kombinált vágóeszközök: 1 800 000 Ft.
- TUR kacsok, zúzó szondák, lézerszálak: 1 600 000 Ft.
- Drótok, csövek, szívók, Dormia-kosarak, fogók, egyéb eszközök: 1 000 000 Ft.
Az eszközamortizációra és a javításokra jelenleg az éves költséget visszaosztva havonta 150 000 Ft-ot költünk. A reális költség 1 084 000 Ft lenne a következő bontásban:
- Laparoszkópos kopó eszközök pótlása (kb. 50 műtétenként: betétek {tűfogó, olló, fogó, szívó}, fénykábel): 304 000 Ft.
- 200 műtétenként (komplett fogók, tűfogó, olló, markolatok, trokár nagyjavítás): 125 000 Ft.
- Optikák (minden műtéthez 100 sterilizálás után): 425 000 Ft.
- Endoszkópos eszközök (500 műtétenként): 200 000 Ft.
- Egyéb (ollók, csipeszek, fogók, feltárók stb.): 30 000 Ft.
Másik nagy csoportot a gyógyszerek, fertőtlenítőszerek beszerzése, tartós használati cikkek cseréje jelenti. Az átlagos gyógyszerkeretünk 834 000 Ft, ebből egy ilyen szintű működés tartósan nem finanszírozható megfelelően. Szinte minden esetben a beteg hozza a gyógyszerét (szabálytalan), sokszor nincs pénzünk a megfelelő antibiotikumra. Gyakran nem a megfelelő, hanem az olcsó, meglévő gyógyszert választjuk. Hozzávetőlegesen havi 2 000 000 Ft lenne a gyógyszerköltségigényünk. Külön kiemelendő a nozokomiális fertőzéseknél fontos információ, hogy az ágyak, ágybetétek, padlózat, festékek, bútorok védőrétege „elfárad” nem fertőtleníthető, időszakos cserére, javításra, festésre szorulnak. Jelenlegi keret:
0 Ft. A 25 ágyas osztályunkon ezek cseréje, az osztály évenkénti festése karbantartása hozzávetőlegesen évi 5 000 000 Ft-ba (havi 416 000 Ft-ba) kerülne.
A felsoroltak alapján, az osztályunkon rendelkezésre álló keret havi 1 824 000 Ft, az elvárásunk 7 900 000 Ft lenne. Ez csak a fogyóeszközök és műszerek karbantartását jelenti, nagy értékű eszközök esetén (8 éves amortizációval számolva), éves szinten 10 000 000 Ft pótlási összeg – havonta 833 000 Ft számolható. Az új eljárások bevezetésére és eszközök bevezetésére évente 5 000 000 Ft innovációs összeget (havonta 417 000 Ft) állapítottunk meg.
Így a fenntarthatósági forrásigény havonta 9 150 000 Ft-ra adódott.
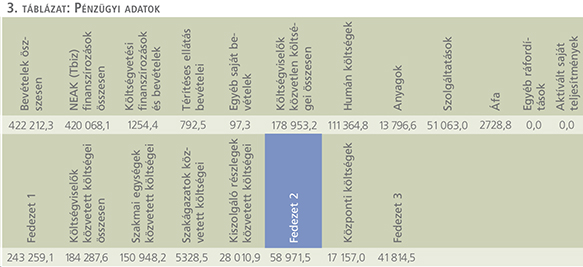
Mit jelent ez HBCS-ben? A 2017-es adatok alapján a teljes finanszírozásunk 2197,15 HBCS-re 420 068 100 Ft volt, ez pontonként 191 187 Ft-ot jelent. Ha hozzáadjuk a megelőzően felsorolt keretigény és a jelenlegi keret közötti különbséget az éves finanszírozási igény 507 980 100 Ft-ra jön ki. Ha feltételezzük, hogy a teljesítmény nem változik, ez pontonként 231 200 Ft. Az azt jelenti, hogy a pont/forintérték 21%-os emelésével vagy ezzel egyenértékű lépésként az urológiai HBCS-pontok egységes 21%-os emelésével egy megyei szintű urológiai osztály működésének tárgyi feltételei hosszútávon biztonságossá és európai szintűvé tehetők.
A fenti összeg számításánál a béreket nem vettük figyelembe. Hogy teljes legyen a kép, nem maradhat ki a bérrendezés kérdése sem, azonban ennek mértéke kevésbé objektivizálható a költségekhez hasonló módon. Ezért önkényesen, a béremelést egy nem túlzó, de érzékelhető 100%-ban határoztuk meg, ehhez 50% „mobil” keretet rendeltünk, amely a motivációk, a differenciált feladatok után járó kifizetések és a jutalmak alapja lehet. 2017-es évi humán költségünk 111 364 800 Ft volt, a 150%-os bővítés után ez 278 412 000 Ft-ra adódik. Ez alapján a HBCS forintértéke 307 229 Ft (675 027 300 Ft, 2197,15 HBCS) lesz. Ez kicsit több mint 60%-os emelést jelentene a HBCS forintértékében.
A száraz számadatok mögé nézve kijelenthetjük, ha a finanszírozás összege 231 200 Ft alatt van, biztosan valamilyen szakmai, biztonsági, jogi vagy etikai szabályt szegünk. Ez a minimum összeg, amiből a fenntartható, de biztonságos betegellátás biztosítható.
Sajnos azonban ez nem elég. Ha tisztességes (de nem túlzó) bérezést választunk a HBCS-t 307 229 Ft-ra kell emelni. Ebben az esetben differenciálhatunk anyagilag is a munkatársak között a feladatok nehézsége és a felelősségvállalás mértéke szerint, motiválhatók a kollégák a hatékony munkavégzésre és ez számon is kérhető rajtuk, valamint biztosítható és elvárható a szakmai szinten tartás és fejlődés.