Clinical application of the ERAS protocol during radical cystectomy
DOI: 10.22591/magyurol.2024.2.horvathb.64
Authors:
Horváth Bálint dr., Béres Bence dr., Molnár Ágnes dr., Villányi Kinga dr., Pytel Ákos dr., Szántó Árpád dr.
Pécsi Tudományegyetem KK, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
Summary
Enhanced Recovery After Surgery (ERAS) is a multimodal pathway that provides guidance for improving the perioperative care and outcomes of patients undergoing surgery. In 2013, the ERAS Society published its original guidelines for radical cystectomy, taking much of the data from the colorectal literature. Over the past decade, increasing interest in ERAS has fuelled radical cystectomy-specific ERAS research, including recent prospective randomized controlled trials (RCTs). The aggregated data indicate that ERAS contributes to the improvement of complications, the reduction of the length of hospital stay, and increases patient satisfaction. Several modified versions of the ERAS pathway exist, but there is still a lack of consensus on the efficacy of individual ERAS components and protocol standardization.
LAPSZÁM: MAGYAR UROLÓGIA | 2024 | 36. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Az Enhanced Recovery After Surgery (ERAS) egy multimodális út, amely útmutatást ad a sebészeti beavatkozáson átesett betegek perioperatív ellátásának és eredményeinek javításához. 2013-ban az ERAS-társaság kiadta a radikális cystectomiára vonatkozó eredeti irányelveit, átvéve a colorectalis irodalomból származó adatok nagy részét. Az elmúlt évtizedben az ERAS iránti növekvő érdeklődés fokozta az radikális cystectomia specifikus ERAS-kutatást, beleértve újabb prospektív, randomizált, kontrollált vizsgálatokat (RCT). Az összesített adatok arra utalnak, hogy az ERAS hozzájárul a szövődmények javulásához, a kórházi tartózkodás időtartamának csökkenéséhez, növeli a betegelégedettséget. Az ERAS-útvonal számos módosított változata létezik, de továbbra is hiányzik a konszenzus az egyes ERAS-elemek hatékonyságáról és a protokoll szabványosításáról.
Bevezetés
Évente 81 000 új hólyagrák (bladder cancer – BC) esetet diagnosztizálnak az Egyesült Államokban, és ebből több mint 17 000 halálesettel végződött (1). Magyarországon átlagosan évente 3300 új eset kerül felismerésre, és évente körülbelül 250-300 radikális cystectomia történik hazánkban (2).
A radikális cystectomia (RC) az aranystandard eljárás az izominvazív BC (muscle invasive bladder cancer – MIBC) és a nem izominvazív magas kockázatú BC (non muscle invasive bladder cancer – NMIBC) kezelésében (2). Bár potenciálisan kuratív beavatkozás, mégis a radikális cystectomia magas morbiditási és mortalitási kockázattal jár. A jelenlegi adatok szerint a 30 napos rehospitalizációs arány továbbra is magas, 25%, míg a posztoperatív időszakban az első 90 napban a szövődmények aránya pedig megközelíti a 65%-ot (3-5). A rosszindulatú hólyagrákot a betegek közel 40%-ánál 75 éves kor felett diagnosztizálják, és több mint 60%-ánál van legalább egy súlyos társbetegség, mindkettő rosszabb kimenetelt jelentő tényező (6).
Radikális cystectomia
A radikális hólyageltávolítás az aranystandard eljárás izominvazív hólyagtumorok gyógykezelésében. Sebészeti szempontból az egyik legtechnikásabb és az egyik legösszetettebb urológiai beavatkozás. A műtét során a teljes húgyhólyag és disztális uréterszakaszok, valamint férfiaknál a prosztata és az ondóhólyagok, a nőkben a méh, a petefészkek és a hüvelyfal egy része kerül eltávolításra. A következő lépésben a kismedencei nyirokcsomók disszekciója történik, majd végül a vizeletelterelés, amelynek során leggyakrabban egy vékonybélszakasz kirekesztésével hasfali stoma, vagy ortotopikus bélhólyag kerül kialakításra (7).
Indikációk
Radikális cystectomia leggyakoribb indikációja a T2–T4, N0M0 hólyagtumorok, a nagyon magas rizikócsoportba tartozó nem izominvazív daganat, valamint BCG-kezelésre refrakter, vagy nem reagáló nem izominvazív tumorok. Ezenkívül endoszkóposan nem uralható nagy kiterjedésű papilláris tumor esetén is a hólyag eltávolítása javasolt. „Salvage” cystectomia multimodális terápiát követő relapszus esetén jön szóba, valamint palliatív hólyageltávolítás visszatérő súlyos vérvizelés és fájdalomcsillapítás céljából végezhető.
Sebészeti technikák közül világszerte legelterjedtebb a nyílt, illetve robotasszisztált beavatkozás. Manapság előtérbe kerültek különböző idegkímélő megoldások a szexuális funkciók megőrzése céljából, azonban ezek csak igen válogatott esetekben jönnek szóba (7).
Kismedencei lymphadenectomia a radikális cystectomia standard részét képezi, amelynek a cranialis határa az arteria iliaca communis, oldalról a nervus genitofemorálisok, valamint disztálisan a vena iliaca circumflexa határolja, régiónként magába foglalja a preszakrális, fossa oburatoria, valamint parailiaclis nyirokcsomóláncokat. A kismedencei nyirokcsomók eltávolítása nemcsak prognosztikai jelentőséggel bír, hanem szignifikánsan hat a túlélésre is (7).
A vizeletdeviáció számos formája használatos. Legelterjedtebb és leggyakrabban használt módszer a terminális ileumszakaszból képzett hasfali vizeletes stoma, az ileumkonduit, vagy más néven Bricker-konduit. Korai szövődmények közül a húgyúti infekciók, vizeletes ázás, bélpasszás-zavar a leggyakoribb, míg hosszú távon vesefunkció-romlással, húgyúti kövességgel, és parastomális sérvképződéssel kell számolnunk.
A legegyszerűbb vizeletelterelési módszer az uréterek hasfalhoz történő szájaztatás, az ureterocutaneostomia. Ez a módszer kevesebb szövődmény és mellékhatásprofillal bír, így idős, komorbiditásokkal rendelkező beteg esetén preferált eljárási módszer.
Kontinens vizeletdeviáció felnőttekben az ortotop bélhólyagképzés, amely során hosszabb vékonybélszakaszból képzett rezevoárt a húgycsőhöz szájaztatunk. Számos anatómiai és onkológiai korlát mellett, vese és májfunkciós zavarokban ellenjavallt, irodalmi adatok alapján a beteg 10-20%-ában valósítható meg.
Radikális cystectomia önmagában, a folyamatosan fejlődő modern sebészeti eljárások és technikák ellenére, 50%-os 5 éves túlélést biztosít. Az elmúlt évtizedekben előtérbe kerülő cisplatinalapú neoadjuváns kemoterápia (NAC) további 6-8%-kal javítja a daganatos halálozási rátát (7).
ERAS-protokoll (Enchanced Recovery After Surgery)
Minden nagyobb operáció komolyan megterheli a szervezetet. A műtéti stressz válaszreakció (Surgical Stress Response) egy olyan szisztémás fiziológiai-immunológiai folyamat, ami a sebészi beavatkozás következtében alakul ki, és amelynek célja a homeosztázis fenntartása, a túlélés biztosítása a noxával szemben (8).
A colorectalis sebészetben megalkotott, majd más szakmák által átvett, multimodális, támogatott műtét utáni felépülési program, angolul „enhanced recovery after surgery” (ERAS) utak célja az volt, hogy minél inkább stresszmentesen valósulhasson meg egy műtéti beavatkozás, és hogy bizonyítékokon alapuló irányelvet nyújtson a perioperatív ellátáshoz és az eredmények javításához. Ennek érdekében ez a komplex program integráltan veszi végig az összes potenciális stressz-
tényezőt, és jól átgondoltan mindenre kínál választ a betegtájékoztatástól kezdve a tápláláson át a fájdalomcsökkentésig (1. ábra).
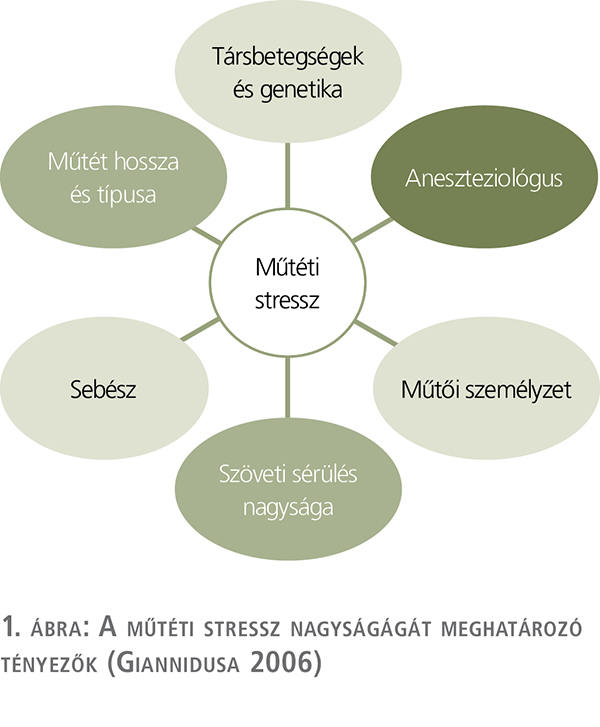
Az ERAS-program előnyei, hogy csökkenti a kórházi tartózkodási időt (35-40%-kal), csökkenti a szövődmények számát (sebészi szövődmények, nosocomiális infekciók stb.), csökkenti a szükséges analgetikum-mennyiséget, növeli a betegelégedettséget, a betegkomfortot, a műtét utáni életminőséget, csökkenti a kiadásokat (28-32%-kal), korábban visszatérnek a betegek a munkaerőpiacra, és több beteget lehet ellátni ugyanannyi ágyon (9).
Az ERAS-társaság által 2013-ban kiadott kezdeti iránymutatás 22 célzott elemet vázolt fel, amelyek közül csak hét tétel esetében volt elegendő bizonyíték. Ezek közé tartozott az orális mechanikus bélelőkészítés, a minimálisan invazív megközelítés, a perioperatív folyadékkezelés, a nazogasztrikus szonda alkalmazása, a vizelet elvezetése, a posztoperatív ileus megelőzése és a posztoperatív hányinger/hányás megelőzése. A colorectalis területen a metaanalízisek magas szintű bizonyítékot igazoltak az ERAS-útvonalakkal összefüggő csökkent szövődmények arányára és a posztoperatív kórházi tartózkodási időre. Mindazonáltal az ERAS bevezetése az urológiai szakterületen lassú volt, és sokan kritizálták a prospektív randomizált, kontrollált vizsgálatok bizonyítékainak hiányát ezen a területen (10, 11).
Az ERAS-módszer pontos kivitelezése igazi csapatmunkát igényel, a sebész, a műtői személyzet, az altatóorvos és a nővérek részvétele mellett szükség van a páciens és családjának aktív közreműködésére. Összetevőit időrendben összesen három nagy csoportba sorolhatjuk: megkülönböztetünk pre-, intra- és posztoperatív elemeket (2. ábra).
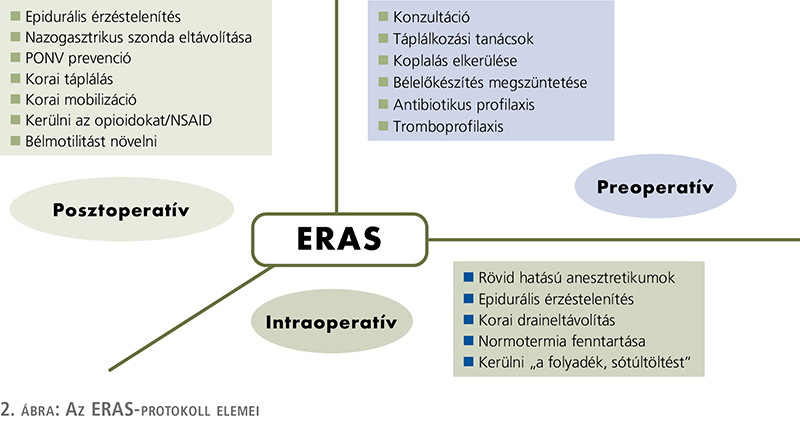
Preoperatív elemek
Konzultáció
A beteg és a hozzátartozók alapos felvilágosítása bizonyítottan mérsékeli a szorongást, kedvezően befolyásolja a gyógyulást. A beteget informálni kell a műtét és az ERAS-protokoll részleteiről, a várható komplikációkról, valamint tájékoztatni kell az életvitelében bekövetkező változásokkal kapcsolatban, nagy hangsúlyt fektetve a stomaedukációra (10).
Preoperatív optimalizáció
A preoperatív állapotfelmérés feladata a rizikófaktorok azonosítása, és amennyiben lehet, azok kiküszöbölése. A kezeletlen diabétesz, nem kontrollált hipertónia vagy jelentős anémia egyaránt hátrányos az operáció utáni felépülés szempontjából, így ezek korrekciója szükséges (10). A dohányzás elhagyása, az alkoholfogyasztás mérséklése, a napi rendszerességgel végzett fizikai aktivitás mind csökkenti a posztoperatív morbiditást (10, 11).
Bélelőkészítés elhagyása
A bakteriális kontaminációból eredő fertőzés a rekonstruktív bélsebészet egyik komoly problémája. Egyes kutatások szerint a radikális cystectomiát követő infekciós szövődmények hátterében 20%-ban a bélflóra hasüregi szóródása áll (12). Ennek tükrében érthető, hogy a preoperatív bélelőkészítés a legtöbb nagy sebészeti beavatkozás előtt gyakorlatilag kötelezővé vált. A hagyományos gyógyszeres és mechanikus bélelőkészítés célja a széklet teljes eliminálása, a kórokozók koncentrációjának csökkentése az alsó gasztrointesztinális traktusban. Az eljárás ugyanakkor igen komoly stressz a betegnek, súlyos elektrolitzavarhoz, dehidratációhoz, elesettséghez vezethet. Emiatt nem csoda, hogy a közelmúltban számos colorectalis műtétekkel foglalkozó kutatás (13) megkérdőjelezte a rendkívül megterhelő procedúra szükségességét, sőt, bizonyos szerzők (14) szerint annak kifejezetten hátrányos következményei is vannak, úgymint a gyakrabban előforduló posztoperatív ileus és anasztomózis-elégtelenség. Radikális cystectomiával kapcsolatban az eddigi tanulmányok hasonló következtetésre jutottak (26), ugyanakkor további prospektív vizsgálatokra van szükség. A kedvező eredmények miatt a klasszikus bélelőkészítés mellőzése az ERAS-protokoll egyik sarokkövévé vált.
Preoperatív szénhidrát „töltés”
Az alultápláltság a sebészi beavatkozások egyik független kockázati tényezője, amely radikális cystectomia esetén bizonyítottan növeli a mortalitást (17). A műtétet megelőző 3-5 napban folytatott szénhidrátdús táplálkozás, és az operáció előtt 2 órával elfogyasztott tiszta, édes folyadék kiküszöböli az éhezés okozta stresszt, stabilizálja az endogén inzulinszintet, fokozza az inzulinérzékenységet, valamint segít megelőzni az izomerőcsökkenést és testtömegvesztést, így kedvező hatással van a felépülésre (10, 16).
Preoperatív koplalás
Az éjféltől való koplaltatás kutatások alapján sem a gyomor pH-ját, sem annak tartalmát nem csökkenti jelentős mértékben, összehasonlítva azokkal a betegekével, akik az altatás kezdetét megelőzően 6 órával szilárd táplálékot, előtte 2 órával cukros, rostmentes innivalót fogyaszthattak. Utóbbi protokollt alkalmazva nem tapasztaltak több aneszteziológiai szövődményt (regurgitáció, aspiráció) sem (18).
Trombózisprofilaxis
A malignus alapbetegség, a drasztikus műtéti beavatkozás és az azt követő immobilizáció egyaránt emeli a tromboembóliás szövődmények kockázatát. Radikális cystectomia után 4-8%-ban fordul elő mélyvénás trombózis (MVT) vagy tüdőembólia (TE), ami az onkológiai sebészetben a korai mortalitás leg-
gyakoribb oka. Az alacsony molekulasúlyú heparin- (LMWH) kezelés csökkenti mind az MVT, mind a TE rizikóját (19). Az ERAS-protokoll részeként a betegek a perioperatív szakban kompressziós harisnyát viselnek, az operáció előtt 2-12 órával beállított LMWH-kezelést pedig a posztoperatív 4. hét végéig folytatják (19).
Premedikáció
A betegek altatás előtti fokozott szorongása felerősíti a posztoperatív fájdalomérzetet, így annak csökkentése bizonyítottan előnyös. Hosszú hatású benzodiazepinek (BZD) anxiolitikumként való adása a kognitív képességek meglassulását, több óráig tartó funkcionális zavarokat okozhat a műtét után, különösen az idősek körében. Emiatt nem tudnak időben táplálékot és folyadékot magukhoz venni, korai mobilizációjuk nehézkessé válik. Rövid hatású BZD-k alkalmazásával a nem kívánt tünetek megelőzhetők (10, 16).
Intraoperatív elemek
Standard aneszteziológiai protokoll
A szakmán belül 100%-os egyetértés van a standard aneszteziológiai protokoll szükségességét illetően. Habár az ezzel foglalkozó klinikai vizsgálatok száma meglehetősen limitált, a beteg állapotának folyamatos és alapos intraoperatív megfigyelése, valamint a sebész és az altatóorvos közötti jó kommunikáció kritikus pontja az ellátásnak. A későbbi eredmények szempontjából az altatás alatt a legfontosabb feladatok közé tartozik a hypotermia, hypoxaemia és a hypovolaemia megelőzése, a szoros vércukorkontroll, a felhasznált opiátok mennyiségének csökkentése (20).
Epidurális érzéstelenítés
A szisztémásan adott opioidok mellékhatásait kiküszöbölve az epidurális érzéstelenítés (EDA) az intra- és posztoperatív fájdalomcsillapítás hasznos eszköze. Alkalmazása különösen ajánlott a laparotomiából végzett radikális cystectomiák során (10). A kanül behelyezése a 10-es vagy 11-es háti csigolya magasságában történik, rajta fentanyl és helyi érzéstelenítő (pl. bupivakain) juttatható a peridurális térbe. Eltávolításának optimális ideje a posztoperatív 3. nap végére tehető (10). Colorectalis sebészeti kutatások kimutatták, hogy az EDA használata mérsékli a műtéti stresszválaszt, segíti a korai mobilizációt, csökkenti a kardiopulmonális komplikációk számát (16).
Antimikrobás profilaxis és bőrelőkészítés
A sebfertőzés megelőzése céljából adott intravénás antibiotikum és a bőr lemosására használt klórhexidin-tartalmú alkoholos fertőtlenítőszer használata kedvező hatású. Az Európai Urológus Társaság ajánlása szerint egy második vagy harmadik generációs cefalosporin, és gentamicin vagy metronidazol kombinációját javasolja, amelyet a bőrmetszés előtt 1 órával kell bólusban alkalmazni, valamint fenntartó kezelésként az első posztoperatív nap végéig folytatni (10, 16).
Minimál invazív megközelítés
A sebészi behatolás módja befolyásolhatja a morbiditást és a hosszabb távú felépülést. A robotasszisztált technikák a hagyományos sebészi feltárással ellentétben kisebb metszést igényelnek, emiatt kevesebb vérzéssel és traumával járnak. A szöveti sérülés nagyságának redukálása csökkenti a posztoperatív analgetikumigényt, mindamellett nyílt műtéthez hasonló onkológiai kimenetel érhető el (21), emiatt az ERAS-protokoll megalkotói radikális cystectomia kapcsán a minimál invazív megközelítést preferálják (10, 11).
Perioperatív folyadék-menedzsment
Intraoperatíve a vérnyomás, a normál perfúzió és a homeosztázis csak céltudatos folyadékterápiával tartható egyensúlyban. A hypovolaemia, illetve a páciens „túltöltéséből” eredő hypervolaemia egyaránt kerülendő. Mindkét állapot a hasi szervek keringési elégtelenségéhez vezethet, ami a posztoperatív időszakban gyakrabban előforduló ileusban, emelkedett morbiditásban és hosszabb kórházi tartózkodásban nyilvánul meg (22).
Intraoperatív hipotermia-prevenció
A fiziológiás testhőmérséklet szükséges feltétele a homeosztázis megőrzésének. A hipotermia (18).
Drenázs
A kismedencébe helyezett drének feladata a lokálisan képződő haematomák/seromák megelőzése, a felgyülemlő váladék elvezetése, annak elemzése révén az anasztomózis-elégtelenség korai igazolása. Ezen eredményeket fenntartással kell kezelnünk radikális cystectomiával kapcsolatban, mivel itt az operáció után nagyobb a vizeletszivárgás esélye (11). Az ERAS-protokoll szerint amennyiben a leszívott folyadék laboratóriumi vizsgálata ennek tényét nem igazolja, az első posztoperatív napon a drének eltávolíthatók (9, 10).
Posztoperatív elemek
Nazogasztrikus szonda
Erős evidencia áll rendelkezésünkre, hogy az általános anesztézia kezdetekor dekompressziós céllal a gyomorba levezetett szonda az altatás felfüggesztésekor káros következmények nélkül eltávolítható. A kontrollcsoporttal összehasonlítva így csökken a pulmonalis komplikációk (tüdőgyulladás, atelectasia) száma, a normál bélműködés is hamarabb helyreáll, a nazogasztrikus szonda csak az elhúzódó posztoperatív ileusos esetekben indokolt (23).
Hólyag/uréterkatéter Amennyiben a radikális cystectomia ortotopikus hólyagpótlással zárult, átlagosan 14 nap, míg Bricker-szerinti ileumkonduit esetén a szakemberek többsége 8-14 nap után távolítja el a hólyagkatétert vagy az uréter sztenteket (20).
Ileusprevenció
A posztoperatív ileus (POI) kialakulása a szervezet nem kívánt válasza a túlzott mértékű műtéti stresszre. Az okozott diszkomfort és egyéb káros következmények miatt a POI az elhúzódó kórházi ápolás leggyakoribb oka a sebészeti osztályokon, ezért nem véletlen, hogy elhárítása az összes ERAS-protokoll egyik kulcsfontosságú részévé vált (18). A POI diagnózisának felállítása a jellegzetes tünetek (hányinger, hányás, székrekedés, puffadás, evési képtelenség) alapján nem nehéz. Egy randomizált klinikai vizsgálat alapján az ERAS-módszer számos korábban felsorolt tényezője csökkenti a POI incidenciáját, úgymint az epidurális érzéstelenítés használata, a folyadék „túltöltés” elkerülése, valamint a rutinszerű nazogasztrikus intubálás mellőzése (24). Egyszerű és olcsó, mégis az ileusprevenció egyik fontos eleme a rágógumizás, ami bizonyítottan serkenti a bélmozgásokat, növeli az étvágyat. Súlyosabb esetben a műtéti feltárást megelőzendő további lehetőség az orálisan adott prokinetikus ágensek alkalmazása, mint a metoklopramid vagy a fizosztigmin (10, 16).
Az alvimopán egy orális készítmény, amely a perifériás μ-opioid-receptor antagonistája. Elsődleges hatása a gyomor-bél traktus helyreállításának, motilitásánák fokozása. Az Amerikai Urológus Társaság irányelvei alapján erősen ajánlott az alkalmazása radikális cystectomia során bélreszekción átesett betegek számára. Magyarországon a készítmény jelenleg nem elérhető (28).
PONV-prevenció
A posztoperatív hányinger, hányás (PONV – Postoperative Nause & Vomiting) gyakori szövődmény a radikális műtéteket követően, emellett a betegek elégedetlenségének egyik fő oka. Mivel a PONV a pácienst megterheli, továbbá az enterális táplálást nehezítve a felépülést késlelteti, csillapítására kell törekednünk. A nemdohányzók, nőbetegek, opioidalapú fájdalomcsillapításban, inhalációs anesztetikumok adásában részesülők különösen veszélyeztetettek a PONV szempontjából. Esetükben a komplex antiemetikus terápiának kiemelt szerepe van (9, 10). A profilaxisként kiváló ondanszetron és az ugyancsak hatékony és biztonságos dexametazon a leginkább preferált gyógyszerek közé tartoznak. Az altatás során adjuváns gázként belélegeztetett nitrogén-oxidult propofollal kombinálva káros interakciók nélkül figyeltek meg kedvező hányáscsillapító hatást. Az éhezést kiküszöbölő preoperatív szénhidrát „töltés”, és az operáció előtt két órával fogyasztott folyadék a megfelelő hidratáció biztosítása révén szintén előnyös a PONV-t tekintve (18).
Posztoperatív fájdalomcsillapítás
A sebészi beavatkozás után jelentkező fájdalom az egyik legnagyobb akadálya a kórházból történő mihamarabbi elbocsátásnak. Csillapítása a gyógyulás folyamatát felgyorsítja, segíti a betegmobilizálást (25). A multimodális analgetikus kezelés célja a hatékony fájdalom-menedzsment elérése az opioidok káros hatásainak (légzésdepresszió, POI, hiperalgézia, immunszuppresszió, tolerancia, dependencia) minimalizálása mellett (25). Az ERAS-protokoll alapja az intraoperatíve indított parenterális acetaminofen és ketorolak, posztoperatíve pedig az orálisan adott acetaminofen-tartalmú tabletta és szubfaszciálisan a metszés köré infiltrált lokálanesztetikum. A korábban tárgyalt EDA egészíti ki a palettát, amelynek kontraindikációja esetén hasonlóan jó alternatíva az infúzió formájában alkalmazott intravénás lidokain. Az opiátszármazékok csak, mint tartalék gyógyszerek vetendők be az egyéb módon nem mérsékelhető fájdalmak esetén (15).

Korai mobilizáció
Az elhúzódó immobilizációnak számos jól ismert nemkívánatos következménye van. A hosszan ágyhoz kötött személyekben gyakoribb a pneumónia előfordulása, emelkedik a tromboembóliás események kockázata, felgyorsul az izomtömegvesztés. Korábban részletezett fájdalomcsillapítás effektív kivitelezése a sikeres mobilizálás egyik fontos feltétele.
Korai táplálás
A radikális cystectomiát követő koplalás szükségességét jelenleg semmilyen bizonyíték nem támasztja alá (18). A korábbi felfogás szerint az első posztoperatív napon bevitt szilárd táplálék növeli a gasztrointesztinális szövődmények rizikóját. Sebészeti kutatások során ennek épp az ellenkezőjét igazolták, vizsgálatuk jelentős mértékben alacsonyabb mortalitást, kevesebb anasztomózis-elégtelenséget és ritkábban előforduló pneumóniát írt le a kontrollcsoporttal összehasonlítva, számos egyéb pozitív változás (az inzulinérzékenység fokozódása, javuló fizikai erő, gyorsabb sebgyógyulás) mellett (27). A korai perorális táplálás ugyanakkor fokozza a PONV kockázatát, ezért a preventív antiemetikus kezelés elindításával sem szabad késlekedni. A rendelkezésünkre álló adatok nem támogatják a parenterális tápszerek rutin alkalmazását, szerepük azokra az esetekre korlátozódik, amikor a beteg az enterális táplálékbevitelt várhatóan napokig nem tolerálja (9, 27).
Következtetés
Radikális cystectomia egy komplex nagy hasi műtét, amely megfelelő interdiszciplináris perioperatív ellátást igényel, a műtét indikációjától kezdődően és a teljes funkcionális helyreállításig tart. Az ERAS-mozgalom jelentős fejlődésen ment keresztül a kezdeti irányelvek óta. Sebészeti technikák fejlődése mellett, az aneszteziológus szerepe kulcsfontosságú a preoperatív kockázatértékelésben, és a perioperatív előkészítésben és a műtét utáni fájdalomcsillapításban a gyógyulás felgyorsítása érdekében. Azonban az ERAS-elemek hatékonyságának növelésében további prospektív vizsgálatokra van szükség a protokoll optimalizálása érdekében.
Irodalom
1. Siegel RL, Miller KD, Fuchs HE. Cancer statistics, 2022. CA Cancer J Clin 2022; 72: 720220112–720220133. https://doi.org/10.3322/caac.21708
2. http://www.onkol.hu/hu/nemzeti_rakregiszter
3. Hu M, Jacobs BL, Montgomery JS. Sharpening the focus on causes and timing of readmission after radical cystectomy for bladder cancer. Cancer 2014; 120: 1409–1416.
https://doi.org/10.1002/cncr.28586
4. Bochner BH, Dalbagni G, Sjoberg DD. Comparing open radical cystectomy and robot-assisted laparoscopic radical cystectomy: a randomized clinical trial. Euro Urol 2015; 67: 1042–1050.
https://doi.org/10.1016/j.eururo.2014.11.043
5. Krishnan N, Li B, Jacobs BL, et al. The fate of radical cystectomy patients after hospital discharge: understanding the black box of the pre-readmission interval. Eur Urol Focus 2018; 4: 711–717.
https://doi.org/10.1016/j.euf.2016.07.004
6. Goossens-Laan CA, Leliveld AM, Verhoeven RH. Effects of age and comorbidity on treatment and survival of patients with muscle-invasive bladder cancer. International Journal of Cancer 2014; 135: 905–912.
https://doi.org/10.1002/ijc.28716
7. https://uroweb.org/guidelines/muscle-invasive-and-metastatic-bladder-cancer
8. Giannoudisa PV, Dinopoulosa H, et al. Surgical stress response. Injury 2006; 37(Suppl 5): 83–9. https://doi.org/10.1016/S0020-1383(07)70005-0
9. Peerbocus M, Wang ZJ. Enhanced Recovery After Surgery and Radical Cystectomy: A Systematic Review and Meta-Analysis. Res Rep Urol 2021 Jul 29. https://doi.org/10.2147/RRU.S307385
10. Cerantola Y, Valerio M, et al. Guidelines for perioperative care after radical cystectomy for bladder cancer: Enhanced Recovery After Surgery (ERAS) Society recommendations. Clinical Nutrition 2013; 32: 879–87. https://doi.org/10.1016/j.clnu.2013.09.014
11. Patel HRH, Cerantola Y, et al. Enhanced Recovery After Surgery: Are We Ready, and Can We Afford Not to Implement These Pathways for Patients Undergoing Radical Cystectomy? European Urology 2014; 65(2): 263–6. https://doi.org/10.1016/j.eururo.2013.10.011
12. Bracken RB, McDonald MW, et al. Cystectomy for superficial bladder cancer. Urology 1981; 18: 459–63.
https://doi.org/10.1016/0090-4295(81)90289-2
13. Walsh PC, Retik AB, Vaughan ED Jr, et al. Use of intestinal segments and urinary diversion, in radical cystectomy. Campbell’s Urology 2002; 3: 3749–51.
14. Slim K, Flamein R, et al. Preoperative bowel preparation-is it useful? Journal de Chirurgie 2004; 141: 285–92.
https://doi.org/10.1016/S0021-7697(04)95335-5
15. Xu W, Daneshmand S, et al. Postoperative pain management after radical cystectomy: Compairing Traditional versus Enhanced Recovery Protocol Pathway. The Journal of Urology 2015; 194: 1209–13.
https://doi.org/10.1016/j.juro.2015.05.083
16. Nygren J, Thacker J, et al. Guidelines for perioperative care in elective rectal/pelvic surgery: Enhanced Recovery After Surgery (ERAS) Society recommendations. World Journal of Surgery 2013; 37: 285–305.
https://doi.org/10.1007/s00268-012-1787-6
17. Gregg JR, Cookson MS, et al. Effect of preoperative nutritional deficiency on mortality after radical cystectomy for bladder cancer. The Journal of Urology 2011; 185: 90–6. https://doi.org/10.1016/j.juro.2010.09.021
18. Gustafsson UO, Scott MJ, et al. Guidelines for perioperative care in elective colonic surgery: Enhanced Recovery After Surgery (ERAS) Society recommendations, Clinical Nutrition 2012; 31: 783–800.
https://doi.org/10.1016/j.clnu.2012.08.013
19. Kakkar AK, Haas S, et al. Evaluation of perioperative fatal pulmonary embolism and death in cancer surgical patients: the MC-4 cancer substudy. Thrombosis and Haemostasis 2005; 94: 867–71.
https://doi.org/10.1160/TH04-03-0189
20. Collins JW, Patel H, et al. Enhanced Recovery After Robot-assisted Radical Cystectomy: EAU Robotic Urology Section Scientific Working Group Consensus View. European Urology 2016.
https://doi.org/10.1016/S1569-9056(16)15183-8
21. Nix J, Smith A, et al. Prospective randomized controlled trial of robotic versus open radical cystectomy for bladder cancer: perioperative and pathologic results. European Urology 2010; 57: 196–201
https://doi.org/10.1016/j.eururo.2009.10.024
22. Giglio MT, Marucci M, et al. Goal-directed haemodynamic therapy and gastrointestinal complications in major surgery: a meta-analysis of randomized controlled trials. British Journal of Anaesthesiology 2009; 103: 637–46. https://doi.org/10.1093/bja/aep279
23. Rao W, Zhang X, et al. The role of nasogastric tube in decompression after elective colon and rectum surgery: a meta-analysis. International Journal of Colorectal Diseases 2011; 26: 423–9.
https://doi.org/10.1007/s00384-010-1093-4
24. Kehlet H, Wilmore D. Multimodal strategies to improve surgical outcome. American Journal of Surgery 2002; 183: 630–41.
https://doi.org/10.1016/S0002-9610(02)00866-8
25. Benyamin R, Trescot AM, Datta S, et al. Opioid complications and side effects. Techniques in Regional Anaesthesia and Pain Management 2008; 11: 105–20. https://doi.org/10.36076/ppj.2008/11/S105
26. Xu R, Zhao X, et al. No advantage is gained by preoperative bowel preparation in radical cystectomy and ileal conduit: a randomized controlled trial of 86 patients. International Urology and Nephrology 2010; 42: 947–50. https://doi.org/10.1007/s11255-010-9732-9
27. Lewis SJ, Andersen HK, et al. Early enteral nutrition within 24 h of intestinal surgery versus later commencement of feeding: a systematic review and meta-analysis. Journal of Gastrointestinal Surgery 2009; 13: 569–75.
https://doi.org/10.1007/s11605-008-0592-x
28. Lee CT, Chang SS, Kamat AM, et al. Alvimopan accelerates gastrointestinal recovery after radical cystectomy: a multicenter randomized placebo-controlled trial. Euro Urol 2014; 66: 265–272.
https://doi.org/10.1016/j.eururo.2014.02.036