Prostate cancer 2024–2025: New directions in screening, diagnosis and treatment
DOI: https://doi.org/10.22591/magyurol.2025.2.fazekasf.39

Authors:
Fazekas Fruzsina dr.1, Biró Krisztina dr.2, Kuthi Levente dr.3,
Buzogány István dr.1, Beöthe Tamás dr.1
1Dél-pesti Centrumkórház, Budapesti Péterfy Sándor Utcai Kórház-Rendelőintézet, Urológiai Osztály,
Budapest (osztályvezető: Buzogány István dr.)
2Országos Onkológiai Intézet, Urogenitális Tumorok és Klinikai Farmakológiai Osztály „Kemoterápia C”,
Budapest (osztályvezető: Géczi Lajos dr.)
3Országos Onkológiai Intézet, Sebészeti és Molekuláris Pathológiai Osztály,
Budapest (osztályvezető Tóth Erika dr.)
Summary
This publication reviews the latest developments in prostate cancer screening, diagnostics, and treatment from 2024 to 2025. Digital rectal examination showed limited added value compared to PSA blood tests. Therefore the 2024 national screening campaign was based on PSA measurement. Avoiding overtreatment in localized cancer, especially in patients with limited life expectancy, remains crucial. In non-metastatic castration-resistant prostate cancer, darolutamide demonstrated superior efficacy and tolerability compared to other androgen receptor inhibitors. In high volume metastatic hormone-sensitive disease, the addition of metformin improved overall survival, metabolic outcomes were favourable. In metastatic castration-resistant cases improved progression-free survival was found with the addition of radium-223 to enzalutamide. Theranostic approaches using PSMA-targeted radionuclide therapy emerged as a promising option in advanced disease based on the VISION and TheraP trials. Liquid biopsy with next-generation sequencing proved to be a reliable tool for identifying molecular targets, particularly when tissue-based testing was not feasible or conclusive.
LAPSZÁM: MAGYAR UROLÓGIA | 2025 | 37. ÉVFOLYAM, 2. SZÁM
Összefoglalás
A prosztatarák kezelése az elmúlt évtizedekben jelentős fejlődésen ment keresztül, amelyet a gyógyszeres terápiák, a műtéti technológia és a sugárkezelés innovációi egyaránt meghatároztak. Maga a kezelési stratégia paradigmaváltáson esett át; míg az alacsony rizikójú prosztatarákok esetében az aktív követés vált elfogadottá a túlkezelés elkerülése érdekében, addig a lokálisan előrehaladott stádiumú daganatoknál egyre gyakoribb a kuratív célú terápiák alkalmazása. A közelmúltban megjelent új hatásmechanizmusú gyógyszerek, mint például az androgénreceptor-targetáló terápiák, a PARP-inhibitorok és a radionuklid kezelések eredményeképpen javultak a túlélési eredmények metasztatikus prosztatadaganat esetében is. A prosztatarák sebészetében hazánkban is elterjedtté vált a robotasszisztált műtéti technika. A sugárterápia terén is jelentős előrelépések történtek, különös tekintettel a precíziós besugárzás és a kombinált terápiás protokollok alkalmazására. A 2024–2025-ös időszak a szűrés, a korai felismerés és a személyre szabott terápia terén hozott új eredményeket.
1. Újdonságok a prosztatadaganat szűrése és korai felismerése terén
1.1 A rektális digitális vizsgálat (RDV) korlátozott hozzáadott értéke a prosztatarák szűrésében – szisztematikus áttekintés és metaanalízis eredményei
A prosztatarák szűrésének hagyományos eszközei közé tartozik a prosztataspecifikus antigén (PSA)-szint mérése és a rektális digitális vizsgálat (RDV). Míg a PSA-alapú szűrés szerepe jól dokumentált, az RDV hasznossága, különösen a PSA-val kombinálva, egyre inkább megkérdőjeleződik. Shariat és munkatársai (1) nyolc közlemény adataiból készítettek metaanalízist ezen két alapvető vizsgálati módszer szűrési hatékonyságának összehasonlítása érdekében. Jelen szisztematikus áttekintés és metaanalízis célja a DRE szűrési értékének újraértékelése volt.
A metaanalízis nyolc prospektív kohorszvizsgálat adatait integrálta, összesen 85 798 páciens bevonásával; metaanalízis célja az RDV szűrési értékének újraértékelése volt a prosztatarák korai felismerésében.
Az elemzés elsődleges végpontja a prosztata manuális betapintásának pozitív prediktív értéke (positive predictive value, PPV) és rákdetekciós aránya (cancer detection rate, CDR) volt. Másodlagos célkitűzésként vizsgálták a PPV- és CDR-értékeket a PSA-teszt egyedüli alkalmazása, valamint a PSA és RDV kombinálása esetén.
Shariat és munkatársai eredményei szerint a manuális vizsgálat önálló alkalmazása alacsonyabb CDR-t eredményezett, mint a PSA-mérés. Az RDV és PSA kombinációja nem növelte érdemben a daganat felfedezési arányt a PSA önmagában történő ellenőrzéséhez képest. Az RDV, mint szűrési módszer hatékonyságát erősen szubjektív jellege is csökkenti. Amikor különböző tapasztalati szintű vizsgáló orvosok végezték a prosztata tapintását, az RDV diagnosztikai teljesítménye jelentős variabilitást mutatott.
A metaanalízis alapján az RDV önmagában, illetve PSA-val kombinálva sem növeli klinikailag releváns módon a prosztatarák szűrésének hatékonyságát. Az RDV rutinszerű alkalmazása – különösen alacsony kockázatú populációban – korlátozott hasznot hoz, miközben a betegeknek kellemetlenséget és akár a szűrés elfogadottságának csökkenését is okozhatja. A szerzők megfontolásra javasolják az RDV szerepének újraértékelését a jelenlegi szűrési protokollokban.
Az eredmények alátámasztják a PSA-alapú szűrés elsődlegességét, míg az RDV elvégzése inkább klinikai tünetek, panaszok esetén lehet indokolt, de nem mint általános szűrőeszköz. Az RDV elhagyása növelheti a szűrésen való részvétei hajlandóságot azon páciensek esetében, akik a prosztata kellemetlen manuális vizsgálatától ódzkodnak.
A klinikai gyakorlatban a metaanalízis alapján alacsonyabb PSA-értéknél azonosítjuk azokat a betegeket, akiknek prosztatadaganat irányában további vizsgálata szükséges. Ebben a kivizsgálásban központi szerepet kap a multiparametrikus MR-vizsgálat, valamint a gyanús esetekben az RDV elvégzése továbbra is kötelező ahhoz, hogy a betegeket rizikócsoportokba tudjuk sorolni.
1.2 Magyarországi szűrési kampányok
A prosztatarák hazánkban a harmadik leggyakoribb daganatos halálok a férfiak körében, évente több mint 1300 áldozatot követelve. A betegség sok esetben hosszú ideig tünetmentes marad, ezért a korai felismerés döntő jelentőségű a kezelhetőség és a túlélési esélyek szempontjából. Ennek elősegítése érdekében 2024 őszén országos szintű szűrési kampány indult „Egy szúrás, egy szűrés” (2) mottóval, amelynek célja az 50 év feletti férfiak – valamint családi halmozódás esetén a 45 év felettiek – ingyenes PSA-szint alapú szűrése volt.
A programot a Magyar Rákellenes Liga, a Magyar Szervátültetettek Szövetsége és a Magyar Urológusok Társasága szervezte, az Országos Kórházi Főigazgatóság, háziorvosok és számos szakmai és civil partner közreműködésével. A szűrések elvégzésére több mint 70 helyszínen, köztük kórházakban, szakrendelőkben, háziorvosi praxisokban és közösségi eseményeken (pl. Csabai Kolbászfesztivál, PontyShow) került sor. A szűrési módszer egyszerű, egyetlen vérvételen alapuló PSA-meghatározást jelentett, amelyre nem volt szükséges éhgyomorra érkezni. Ugyanakkor figyelmeztették a résztvevőket arra, hogy a vérvétel előtti néhány napban kerüljék a kerékpározást, fokozott fizikai aktivitást és a szexuális együttlétet, amelyek átmenetileg befolyásolhatják a PSA-értéket.
A kampány során 6022 férfi vett részt a szűrésen, közülük 568 esetben (kb. 10%) észleltek emelkedett PSA-szintet, amely további urológiai kivizsgálást tett indokolttá. A szűréseket összesen 350 időpontban szervezték meg országszerte, igazodva a helyi igényekhez és lehetőségekhez.
A kampány sikeresen hozzájárult a lakossági tudatosság növeléséhez, és lehetőséget teremtett a prosztatarák korai felismerésére olyan esetekben is, ahol a betegség addig tünetmentes volt. A résztvevő szervezetek szerint a program tapasztalatai megalapozhatják egy hosszú távú, rendszeres prosztataszűrési stratégia kialakítását Magyarországon.
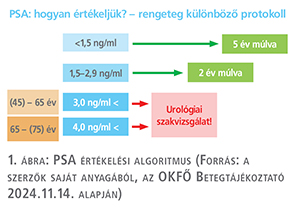
Az 1. ábra az OKFŐ által kiadott 2024. 11. 14-i utasításban található PSA értékelési algoritmust mutatja be. Az útmutató szerint 45 éves kor felett 3,0 ng/ml, 65 éves kor felett pedig 4,0 ng/ml PSA-határérték felett urológiai szakvizsgálatra kell irányítani a férfi beteget. 1,5–2,9 ng/ml közötti PSA-érték esetén 2 év múlva, <1,5 ng/ml esetén pedig 5 év múlva szükséges megismételni a szűrővizsgálatot.
2. Újdonságok a lokalizált prosztatarák kezelése terén
2.1 A prosztatarák túlkezelése korlátozott várható élettartamú férfiaknál az aktív megfigyelés korszakában: retrospektív kohorszvizsgálat a Veterans Affairs rendszerében
A prosztatarák kezelése során kiemelt jelentőséggel bír a betegek várható élettartamának figyelembevétele. 10 évnél alacsonyabb várható élettartam esetén a figyelmes várakozás (watchful waiting) alternatívát kínálhat a definitív kezelésekkel szemben. Az aktív megfigyelés (active surveillence) a 10 évnél hosszabb életkilátásokkal rendelkező, alacsony, vagy jól megválogatott esetekben közepes kockázatú páciensek számára lehet előnyös kezelési stratégia (3). Daskivich és munkatársai (4) vizsgálatának célja az volt, hogy felmérje a túlkezelés mértékét korlátozott várható élettartamú férfiaknál az Egyesült Államok Veterans Affairs (VA) egészségügyi rendszerében az aktív megfigyelés korszakában, valamint megvizsgálja, hogy a túlkezelés hogyan változik a daganat kockázati szintje és a kezelés típusa szerint.
A retrospektív kohorszvizsgálat 243 928 férfit foglalt magában, akiknél 2000. január 1. és 2019. december 31. között diagnosztizáltak lokalizált prosztatarákot a VA rendszerében. A várható élettartamot a validált, életkorral korrigált Prostate Cancer Comorbidity Index (PCCI) alapján becsülték meg.
Az eredmények szerint a kevesebb, mint 10 éves várható élettartamú férfiak aránya 20,5% (50 045 fő), míg a kevesebb, mint 5 éves várható élettartamúaké 4,7% (11 366 fő) volt. Az alacsony kockázatú daganatok esetében a definitív kezelés (műtét vagy sugárterápia) aránya csökkent 37,4%-ról 14,7%-ra 2000 és 2019 között. Ezzel szemben a közepes kockázatú daganatoknál ez az arány növekedett 37,6%-ról 59,8%-ra ugyanebben az időszakban. A definitív kezelést kapó betegek körében a sugárterápia volt a domináns kezelési forma, különösen a közepes kockázatú csoportban, ahol a sugárterápia alkalmazása 31,3%-ról 44,9%-ra emelkedett.
A kevesebb, mint 5 éves várható élettartamú férfiak esetében a magas kockázatú daganatok definitív kezelése 17,3%-ról 46,5%-ra nőtt a vizsgált időszakban. Ebben a csoportban is a sugárterápia volt a leggyakrabban alkalmazott kezelés.
A tanulmány megállapította, hogy az aktív megfigyelés korszakában is fennáll a túlkezelés problémája a korlátozott várható élettartamú férfiaknál, különösen a közepes és magas kockázatú prosztatarák esetében, ahol a sugárterápia alkalmazása jelentősen megnőtt. Ezek az eredmények hangsúlyozzák a kezelési döntések individualizálásának fontosságát, figyelembe véve a beteg várható élettartamát és a daganat kockázati profilját, hogy elkerüljük a potenciálisan felesleges kezeléseket és szövődményeiket.
3. Újdonságok a nem metasztatikus kasztrációrezisztens prosztatarákkezelése terén
3.1 Androgénreceptor-gátlók alkalmazása nem metasztatikus kasztrációrezisztens prosztatarákban: a darolutamid, enzalutamid és apalutamid összehasonlító elemzése
A nem metasztatikus kasztrációrezisztens prosztatarák (nmCRPC) kezelésében az androgénreceptor-gátlók (ARi-k) – darolutamid, enzalutamid és apalutamid – standard terápiás lehetőségek. Ugyanakkor a klinikai gyakorlatban történő alkalmazásukról és tolerálhatóságukról korlátozott mennyiségű összehasonlító adat áll rendelkezésre.
A DEAR (5) (Darolutamide, Enzalutamide, and Apalutamide in Nonmetastatic Castration-Resistant Prostate Cancer) retrospektív kohorszvizsgálat célja az volt, hogy összehasonlítsa e három ARi klinikai alkalmazását és eredményeit nmCRPC-ben szenvedő betegeknél. A vizsgálat során 870 beteg elektronikus egészségügyi adatait elemezték, akik 2019. augusztus 1. és 2022. március 31. között kezdték meg első ARi-kezelésüket az Egyesült Államokban működő Precision Point Specialty urológiai hálózatban. A betegek korábban nem részesültek új típusú hormonkezelésben.
Az elemzés során a fő végpont egy összetett mutató volt, amely magában foglalta a kezelés megszakítását és a metasztatikus CRPC-be történő progressziót. A darolutamiddal kezelt betegek esetében szignifikánsan alacsonyabb volt a vizsgált mutató előfordulása, mint az enzalutamiddal vagy apalutamiddal kezelt csoportokban. Ez a különbség a kezelés megszakításának és a betegség progressziójának külön-külön elemzésekor is fennmaradt. Kaplan–Meier-számítás alapján a darolutamid alkalmazásánál később következett be a kezelés megszakítása, illetve a hormonrezisztencia kialakulása, mint a többi vizsgált ARI esetén.
A vizsgálat eredményei arra utalnak, hogy a darolutamid kedvezőbb tolerálhatósági profillal rendelkezik, ami a klinikai gyakorlatban hatékonysági előnyt jelenthet az nmCRPC-ben szenvedő férfiak kezelésében.
A tanulmány korlátai közé tartozik a retrospektív kialakítás és a potenciális szelekciós torzítások, azonban a valós klinikai gyakorlatból származó adatok értékes kiegészítést nyújtanak a randomizált klinikai vizsgálatok eredményeihez.
Az APCCC konszenzuskonferencián (6) is több szempontból tárgyalták az előrehaladott prosztatarákban választható új hormonterápiákat. A paneltagok több kérdésben is a darolutamidot javasolták elsőként választandó szernek: ha a beteg korábban többször elesett, ha koronáriabetegség miatt antikoagulánst vagy statint szed, ha kognitív károsodást szenvedett, vagy ha csak fáradékony. Érdekes, hogy 75 évnél idősebb betegeknél mHSPC-ben és mCRPC-ben is legtöbben darolutamidot választanának először.
4. Újdonságok a metasztatikus hormonszenzitív prosztatarák kezelése terén
4.1 A metformin hozzáadása az androgén-deprivációs terápiához (ADT) metasztatikus hormonszenzitív prosztatarákban (mHSPC): a STAMPEDE-vizsgálat eredményei
A metformin, egy széles körben alkalmazott, szájon át szedhető antidiabetikus szer, preklinikai és epidemiológiai adatok alapján potenciális antitumorális hatással bírhat (7). Gillessen (8) és munkatársai a randomizált, többkarú, többfázisú STAMPEDE-vizsgálathoz kapcsolódóan kutatták, hogy a metformin hozzáadása az ADT-hez csökkentheti-e a hormondepriváció okozta anyagcsere-károsodást, ezzel javítva a teljes túlélést (OS) metasztatikus hormonszenzitív prosztatarákos, nem diabéteszes betegeknél. 1874 mHSPC-ben szenvedő, nem cukorbeteg pácienst osztottak két csoportba: standardkezelés (SOC) (n=938) és SOC + metformin (n=936). A SOC magában foglalta az ADT-t sugárkezeléssel, docetaxellel vagy androgénreceptor-targetáló terápiával (ARTA) kombinálva. A metformin adagja napi kétszer 850 mg volt. Az elsődleges végpont a teljes túlélés (OS) volt, míg a másodlagos végpontok közé tartoztak a progressziómentes túlélés (PFS), a daganatspecifikus-túlélés, a metabolikus paraméterek és a toxicitás.
A vizsgálat medián követési ideje 60 hónap volt. A medián OS 63,1 hónap volt a SOC-csoportban és 69,1 hónap a SOC + metformin csoportban (HR=0,91; 95% CI: 0,80–1,03; p=0,148), ami nem jelentett statisztikailag szignifikáns különbséget.
A betegeket a CHAARTED-kritériumok alapján alcsoportokba osztották. Alacsony volumenű betegség esetén nem mutatkozott különbség a SOC és a SOC + metformincsoport között. Magas volumenű daganatnál viszont a metformint is kapó csoport szignifikáns túlélési előnyt élvezett. A magas volumenű betegségben szenvedőknél az 5 éves PFS 22% volt a SOC-csoportban és 34% a metformincsoportban. A metformint kapó betegek körében szignifikáns javulást figyeltek meg a testsúlygyarapodás, éhomi glükóz, HbA1c, valamint az össz- és LDL-koleszterin-szintek tekintetében, függetlenül a betegség volumenétől. A súlyos (≥3. fokozatú) mellékhatások előfordulása hasonló volt mindkét kezelési csoportban (SOC: 52%, SOC + metformin: 57%). A metformincsoportban gyakoribbak voltak a gasztrointesztinális mellékhatások.
Gillessen és munkatársai következtetései szerint a metformin hozzáadása az ADT-hez nem javította szignifikánsan a teljes túlélést az összesített mHSPC-s populációban. Ugyanakkor bizonyos eredmények arra utalnak, hogy a magas volumenű betegségben szenvedő alcsoportban túlélési előnyt jelenthet a metformin alkalmazása. Emellett a metformin kedvező hatást gyakorolt több anyagcsere-paraméterre, amelyek hosszú távon csökkenthetik a kardiovaszkuláris kockázatot. További vizsgálatok szükségesek a metformin szerepének pontos meghatározásához a mHSPC kezelésében.
5. Újdonságok a metasztatikus kasztrációrezisztens prosztatarák kezelése terén
5.1 Radium-223 és enzalutamid kombinációja csontáttétes kasztráció-rezisztens prosztatarákban: a PEACE-3-vizsgálat első eredményei
A PEACE-3-vizsgálat (9) célja annak értékelése volt, hogy a radium-223 hozzáadása javítja-e az enzalutamid terápiás hatékonyságát olyan férfiak körében, akik csontáttétes, visceralisan nem érintett, kasztrációrezisztens prosztatarákban (mCRPC) szenvednek, és tünetmentesek, vagy csak enyhe tüneteket mutatnak. A nyílt, multicentrikus, III. fázis vizsgálatba összesen 446 beteget vontak be, akiket 1:1 arányban randomizáltak enzalutamid monoterápiára, illetve enzalutamid + radium-223 kombinációs terápiára. A radium-223 alkalmazása hat cikluson keresztül történt, négyhetes időközönként, az enzalutamid mellett. Fontos megjegyezni, hogy a vizsgálat protokollját 2019-ben módosították, és onnantól kezdve a csontvédő szerek – például denosumab vagy zoledronát – adása kötelezővé vált a fokozott csonttörési kockázat mérséklése érdekében.
A vizsgálat elsődleges végpontja a radiológiai progressziómentes túlélés (rPFS) volt, amely szignifikáns javulást mutatott a kombinációs terápiás karban: a medián rPFS 19,4 hónap volt, szemben a kontrollcsoport 16,4 hónapjával (HR=0,69; p=0,0009). Az interim elemzés során a teljes túlélés (OS) szintén kedvezőbbnek bizonyult a kombinációs karban (42,3 hónap vs. 35,0 hónap; HR=0,69; p=0,0031), bár a végleges OS-eredmények még nem állnak rendelkezésre. További előnyt mutatott a radium-223 kombináció a következő szisztémás kezelésig eltelt idő (TTNT) tekintetében is (HR=0,57; p<0,0001), míg a fájdalomprogresszió és a szimptómás csontesemények (SSE) előfordulása tekintetében nem volt statisztikailag szignifikáns különbség a két kar között.
A biztonságossági profil tekintetében a kombinációs terápia nagyobb arányban járt 3. fokozatú vagy súlyosabb mellékhatásokkal (66% vs. 56%), azonban ezek zöme kezelhető volt, és a csontvédő szerek alkalmazása számottevően csökkentette a csonttörések arányát. A leggyakoribb mellékhatások között szerepelt a hipertónia, fáradtság, anémia és a csonttörések.
Összefoglalva, a PEACE-3-vizsgálat eredményei alapján a radium-223 hozzáadása az enzalutamidhoz javítja a radiológiai progressziómentes túlélést és előnyös tendenciát mutat a teljes túlélés tekintetében is, miközben elfogadható biztonságossági profilt mutat, különösen megfelelő csontvédő kezelés mellett. Ezek az adatok új lehetőségeket nyithatnak a csontáttétes, tünetmentes vagy enyhe tünetekkel rendelkező mCRPC-s betegek személyre szabott terápiájában.
5.2 A PSMA célzott radionuklid-terápia alkalmazása prosztatarák esetén – a VISION- és a TheraP-vizsgálatok eredményei, hazai vonatkozások
A prosztatarák kezelésének egyik legígéretesebb innovációja a teranosztika, amely diagnosztikai vagy terápiás célú radionuklidokkal megjelölt célzott vegyületek alkalmazását jelenti. Alapelve, hogy a megjelölt vegyületek képalkotási és kezelési célokra egyaránt felhasználhatóak. A teranosztika két fő pillére a PSMA PET/CT-képalkotás, amely lehetővé teszi a daganatos gócok precíz lokalizálását, és a PSMA célzott radionuklid-terápia, mint például a lutécium-177-PSMA-617 (177Lu-PSMA-617), amely radioaktív izotópokat juttat a tumorsejtekhez, így helyi sugárzással pusztítva azokat. A prosztataspecifikus membránantigén (PSMA) a prosztatarákos sejtek felszínén jelentős mértékben expresszálódik.
Az ESMO 2024-es kongresszusán kiemelt figyelmet kapott a teranosztika klinikai alkalmazása és annak jövőbeni szerepe a metasztatizáló prosztatarák kezelésében. Dr. Silke Gillessen (10) bemutatta a nagy betegpopulációt érintő VISION és TheraP klinikai vizsgálatok eredményeit.
A VISION-vizsgálat (11) egy randomizált, kontrollált III. fázis tanulmány volt, amelyben a legalább harmadvonalban alkalmazott 177Lu-PSMA-617 plusz standardkezelés hatékonyságát és biztonságosságát hasonlították össze a standardkezeléssel önmagában, kasztrációrezisztens, metasztatikus prosztatarákos betegeknél. Az eredmények alapján a radionuklid-kezelés szignifikánsan javította a betegek általános túlélését: a medián túlélés több hónappal meghaladta a kontrollcsoportét. Ezen túlmenően a progressziómentes túlélés is lényegesen hosszabb volt, ami azt jelzi, hogy a daganat növekedését és terjedését hatékonyan fékezte a célzott radionuklid-terápia. A mellékhatások tekintetében a kezelés jól tolerálható volt, a leggyakoribb szövődmények közé a szájszárazság, fáradtság, anémia és thrombocytopenia tartozott.
A TheraP-vizsgálat (12) során, amely randomizált II. fázis vizsgálat, a 177Lu-PSMA-617 harmadvonalbeli hatását hasonlították össze a taxánalapú kemoterápiával. Ebben a tanulmányban a célzott célzott radionuklid-terápia alkalmazása javította a PSA-szint csökkenésének arányát, a teljes túlélés viszont nem különbözött jelentősen a két vizsgálati karon. Ezen felül a radionuklid-terápiával kezelt csoportban alacsonyabbnak bizonyult a grade 3/4 mellékhatások aránya. A vizsgálat következtetései alapján a 177Lu-PSMA-617 megfelelő alternatívát jelenthet cabazitaxel-használat helyett harmadvonalban, PSMA-PET pozitív, mCRPC-s betegek esetén.
Gillessen kiemelte, hogy a 177Lu-PSMA-617 harmadvonalban, docetaxel és ARTA alkalmazását követően a metasztatikus kasztrációrezisztens prosztatarák standardkezelésének számít a VISION-vizsgálat eredményei alapján. További kutatások szükségesek az optimális terápiás menetrend, a dózisok személyre szabása, valamint a legmegfelelőbb betegcsoportok pontos meghatározása érdekében. A terápiás stratégia finomítása érdekében fontos a radionuklid-terápia kombinálása más hatékony kezelésekkel.
A teranosztika sikeres klinikai alkalmazása a mindennapi gyakorlatban interdiszciplináris együttműködést igényel, különösen a nukleáris medicina, onkológia, radiológia és urológia szakterületei között. Ezen felül kiemelt szerepe van a betegek megfelelő tájékoztatásának és bevonásának a kezelési döntésekbe, hogy a terápiás lehetőségek optimálisan illeszkedjenek az egyéni igényekhez és állapothoz.
Összességében az ESMO 2024-ben bemutatott adatok és szakértői vélemények alapján a teranosztika a prosztatarák kezelésének egyik kulcsfontosságú új irányává válik, amely várhatóan a standard of care részévé alakul a következő években. Ez a megközelítés nemcsak a túlélési eredményeket javítja, hanem hozzájárul a betegek életminőségének fenntartásához is, különösen a nehezen kezelhető, előrehaladott stádiumú daganatok esetén.
Magyarországon 2025. március közepe óta elérhető a 177Lu-PSMA-617 terápia egyedi méltányossági kérelemmel, szigorú szempontok alapján kiválasztott betegek csoportjában. A radionuklid-kezelés elvégzésére a négy hazai orvostudományi egyetem mellett az Országos Onkológiai Intézet Nukleáris Medicina Osztálya jogosult. A kezelés ARTA és docetaxel terápiát követően, a további negyedvonalbanaz kezelési lehetőségek kimerülése, vagy az azokra való alkalmatlanság esetén ajánlható mCRPC-ben szenvedő, megfelelő általános állapotú (ECOG 0-1, megtartott máj-, vese- és vérképzőszervi funkciók), PSMA-pozitív betegek számára. A terápia megkezdése előtt kötelező a hagyományos képalkotók mellett a PSMA-ra irányuló képalkotó vizsgálat elvégzése.
6. Újdonságok a metasztatikus prosztatarák folyadékbiopszia-alapú molekuláris patológiai vizsgálata terén
6.1 A folyadékbiopszia új generációs szekvenálása prosztatarákban
Az mCRPC kezelésében előtérbe kerültek a közelmúltban EMA engedélyt kapott PARP-inhibitorok. Ismert, hogy a BRCA1/2, ATM, vagy egyéb homológ rekombináns gének (HRR) mutációival rendelkező páciensek esetében szignifikánsan hatékonyabbak a PARP-gátló gyógyszerek. HRR-mutáció az mCRPC-s betegek 15-30%-ában (13) van jelen, és ezek azonosítása kulcsfontosságú a terápiás döntések meghozatala előtt. Viszont az említett genetikai eltérések azonosítását kettő tényező gátolhatja. Egyrészt a betegek döntő többsége a hormonszenzitív fázisban kerül felismerésre és a szövettani mintavétel, jellemzően biopszia, is ekkor történik. PARP-gátló kezelés viszont csak a kasztrációrezisztens fázisban jön szóba. A paraffinos beágyazás megbízhatóan konzerválja a szöveteket, viszont 3-5 év után óhatatlanul elindul a minta lassú károsodása, ami sikertelen genetikai vizsgálatot eredményezhet (14). Természetesen a helytelen preanalitikai fázis, illetve a paraffinos blokkok helytelen tárolása ezt a folyamatot gyorsítja. A másik korlátozó tényező a daganatsejtek plaszticitásából fakad, ugyanis a HRR-mutációk a kasztrációrezisztens fázisban gyakoribbak. Prediktív markerek meghatározása esetén alapigazság, hogy azt a tumort kell vizsgálni, amire terápiát kívánunk azonosítani, viszont a természetéből fakadóan a prosztatarák elsősorban a csontokba adja az áttéteket, amelyek biopsziára és esetleges molekuláris patológiai feldolgozásra korlátozottan alkalmasak. Ezeket a korlátokat a folyadékbiopszia szakíthatja át, ami a hagyományos szöveti biopsziák mellett a folyadékbiopszia egyre nagyobb szerepet kap, mivel kevésbé invazív és képes lehet a daganat heterogenitásának jobb feltérképezésére is. Mandel és munkatársai (15) vizsgálatának célja a folyadékbiopsziás minták új generációs szekvenálásának (NGS) alkalmazhatóságának és megbízhatóságának értékelése volt prosztatarákos betegek esetében.
A vizsgálat során 50 áttétes prosztatarákos beteg folyadékbiopsziás mintáit elemezték. A mintákban a BRCA1/2, ATM, CHEK2, PALB2, AR és egyéb HRR gének mutációit keresték. A folyadékbiopsziás minták elemzéséből kapott eredményeket összehasonlították a szöveti biopsziákból származó adatokkal és a klinikai paraméterekkel, beleértve a PSA-szintet és a klinikai stádiumot is.
Elemzésükben a folyadékbiopsziás minták új generációs szekvenálása minden betegeknél sikeres volt, míg a szöveti minták vizsgálata csak 88%-ban járt sikerrel. LB NGS elemzésében 40%-ban azonosítottak patogén vagy valószínűleg patogén mutációkat, míg a szöveti biopsziákban ez az arány 45% volt. A leggyakoribb mutációk a BRCA2 és ATM génekben fordultak elő. Az LB és szöveti biopszia eredményei között 85%-os egyezés mutatkozott. A PSA-szint és a klinikai stádium nem mutatott szoros összefüggést a mutációk előfordulásával. Idehaza LB rutinszerűen tüdőrákos és emlőrákos beteg esetén történik, viszont egyszerűbb, ugyanis jóval kevesebb gént kell vizsgálni. Áttétes prosztatarákos beteg esetén nagyobb génpanelre van szüksége, ami miatt a vizsgálat technikailag összetettebb és költségesebb. Az Országos Onkológiai Intézet Sebészeti és Molekuláris Patológiai Osztályán lehetőség nyílt az Illumina TSO500 ctDNA paneljének tesztelésére, amelynek során 16 olyan mCRPC-s betegnél végeztünk LB NGS-t, akiknél a szöveti NGS sikertelen volt vagy nem tárt fel targetálható genetikai eltérést. A vizsgálatok során 3 betegnél HRR-mutációt, 4 betegnél magas tumormutációs terheltséget azonosítottunk, illetve egy betegnél mind a kettő jelenség fennállt (nem közölt adatok). Jól lehet, hogy egy kicsi, pilot-jellegű vizsgálatról van szó, viszont a betegek 50%-ánál azonosítottunk terápiás célpontot. Saját tapasztalataink és a nemzetközi adatok alapján az LB NGS megbízható módszer a prosztatarákos betegek szomatikus mutációinak azonosítására. Az LB NGS egyértelmű előnye, hogy nem igényel szövetmintát és az alkalmazott génpaneltől függően további molekuláris célpontokat tárhat fel, illetve megállapíthatja a tumor mutációs terheltségét vagy mikroszatellita státuszát is. Hátránya az összetettsége és a költségvonzata, amelyek miatt kiváltani teljesen nem tudja a szöveti NGS-t, viszont a megfelelően kiválasztott betegeknél egy hasznos kiegészítő módszer lehet. A szakmai egyeztetések jelenleg is zajlanak és a cél az, hogy az LB NGS az mCRPC-s betegek ellátása során a rutin részévé váljon.
Következtetés
Az elmúlt két évtizedben az uroonkológia, azon belül különösen a prosztatarák ellátásának lehetőségei robbanásszerűen fejlődtek. Ez a fejlődés egyre inkább gyorsul, és örömteli mind a betegek mind a klinikusok számára, hogy az új lehetőségekhez hazánkban is rövid időn belül hozzáférhetünk. Összefoglalónkban bemutattuk, hogy a prosztatarák kezelésének minden területén már ilyen rövid idő alatt is olyan változások következtek be, amelyek átformálták a klinikai gyakorlatot.
Rövidítések:
ADT=Androgén-deprivációs terápia; AR=Androgénreceptor; ARTA=Androgénreceptort célzó kezelés (Androgen Receptor-Targeted Agents); BRCA1/2=Mellrák 1 és 2 gén (Breast Cancer Gene 1/2); CDR=Rákdetekciós arány (Cancer Detection Rate); CHAARTED=(Clinical trial név; nem mozaikszóként értelmezendő, de a szövegben szerepel); ctDNA=Keringő daganat-DNS (Circulating Tumor DNA); DRE (RDV)=Rektális digitális vizsgálat (Digital Rectal Examination); ECOG=Eastern Cooperative Oncology Group (beteg általános állapotának skálája); HR=Kockázati hányados (Hazard Ratio); HRR=Homológ rekombinációs hibajavító gének (Homologous Recombination Repair genes); LB=Folyadékbiopszia (Liquid Biopsy); mCRPC=Metasztatikus kasztrációrezisztens prosztatarák (Metastatic Castration-Resistant Prostate Cancer); mHSPC=Metasztatikus hormonszenzitív prosztatarák (Metastatic Hormone-Sensitive Prostate Cancer); NGS=Új generációs szekvenálás (Next-Generation Sequencing); OS=Teljes túlélés (Overall Survival); PCCI=Prosztatarák komorbiditási index (Prostate Cancer Comorbidity Index); PET/CT=Pozitronemissziós tomográfia/Komputertomográfia; PFS=Progressziómentes túlélés (Progression-Free Survival); PPV=Pozitív prediktív érték (Positive Predictive Value); PSA=Prosztataspecifikus antigén; PSMA=Prosztataspecifikus membránantigén (Prostate-Specific Membrane Antigen); Ra-223=Rádium-223 (radioaktív izotóp); RDV (DRE)=Rektális digitális vizsgálat; rPFS=Radiológiai progressziómentes túlélés (Radiologic Progression-Free Survival); SOC=Standard kezelés (Standard of Care); SSE=Szimptómás csontesemény (Symptomatic Skeletal Event); TTNT=A következő kezelésig eltelt idő (Time To Next Treatment)
.
Irodalom
1. Matsukawa A, Yanagisawa T, Bekku K, et al. Comparing the Performance of Digital Rectal Examination and Prostate-specific Antigen as a Screening Test for Prostate Cancer: A Systematic Review and Meta-analysis. Eur Urol Oncol 2024 Aug; 7(4): 697–704.
https://doi.org/10.1016/j.euo.2023.12.005
2. Rákgyógyítás.hu. Prosztatarák: PSA-szűrések – minden tizedik férfinél emelkedett értéket találtak. 2025.
3. EAU Guidelines. Edn. presented at the EAU Annual Congress Paris 2024. EAU Guidelines Office, Arnhem, the Netherlands; 2024.
4. Daskivich TJ, Luu M, Heard J, et al. Overtreatment of Prostate Cancer Among Men With Limited Longevity in the Active Surveillance Era. JAMA Intern Med 2025 Jan 1; 185(1): 28.
https://doi.org/10.1001/jamainternmed.2024.5994
5. George DJ, Morgans AK, Constantinovici N, et al. Androgen Receptor Inhibitors in Patients With Nonmetastatic Castration-Resistant Prostate Cancer. JAMA Netw Open 2024 Aug 27; 7(8): e2429783.
https://doi.org/10.1001/jamanetworkopen.2024.29783
6. Gillessen S, Turco F, Davis ID, et al. Management of Patients with Advanced Prostate Cancer. Report from the 2024 Advanced Prostate Cancer Consensus Conference (APCCC). Eur Urol 2025 Feb; 87(2): 157–216.
7. Gillessen S, Gilson C, James N, et al. Repurposing Metformin as Therapy for Prostate Cancer within the STAMPEDE Trial Platform. Eur Urol 2016 Dec; 70(6): 906–8. https://doi.org/10.1016/j.eururo.2016.07.015
8. Gillessen S, Murphy LR, James ND, et al. LBA70 Adding metformin to androgen deprivation therapy (ADT) for patients (pts) with metastatic hormone sensitive prostate cancer (mHSPC): Overall survival (OS) results from the multi-arm, multi-stage randomised platform trial STAMPEDE. Annals of Oncology 2024 Sep; 35: S1258–9.
https://doi.org/10.1016/j.annonc.2024.08.2313
9. Gillessen S, Choudhury A, Saad F, et al. LBA1 A randomized multicenter open label phase III trial comparing enzalutamide vs a combination of Radium-223 (Ra223) and enzalutamide in asymptomatic or mildly
symptomatic patients with bone metastatic castration-resistant prostate cancer (mCRPC): First results of EORTC-GUCG 1333/PEACE-3. Annals of Oncology 2024 Sep; 35: S1254.
https://doi.org/10.1016/j.annonc.2024.08.2307
10. Julian Chavarriaga. UroToday. 2024 [cited 2025 May 15]. Will Theranostics Become Standard of Care? Results From VISION and PSMAfore and the Role of Lu-PSMA in 1st and 2nd Line mCRPC. Available from: https://www.urotoday.com/conference-highlights/esmo-2024/esmo-2024-prostate-cancer/154762-esmo-2024-will-theranostics-become-standard-of-care.html
11. Chi KN, Armstrong AJ, Krause BJ, et al. Safety Analyses of the Phase 3 VISION Trial of [177Lu]Lu-PSMA-617 in Patients with Metastatic Castration-resistant Prostate Cancer. Eur Urol 2024 Apr; 85(4): 382–91.
https://doi.org/10.1016/j.eururo.2023.12.004
12. Hofman MS, Emmett L, Sandhu S, et al. Overall survival with [177Lu]Lu-PSMA-617 versus cabazitaxel in metastatic castration-resistant prostate cancer (TheraP): secondary outcomes of a randomised, open-label, phase 2 trial. Lancet Oncol 2024 Jan; 25(1): 99–107.
13. Melegh Z, Németh K, Székely E, et al. [The pathological processing of prostate biopsy and resection specimens]. Magy Onkol 2024 Jul 16; 68(2): 143–53.
14. Melegh Z, Csernák E, Kohánka A, et al. [Mutation frequency of homologous recombination repair genes in prostate adenocarcinomas]. Magy Onkol 2024 Jul 16; 68(2): 137–41.
15. Mandel P, Hoeh B, Humke C, et al. Feasibility of Next-generation Sequencing of Liquid Biopsy (Circulating Tumor DNA) Samples and Tumor Tissue from Patients with Metastatic Prostate Cancer in a Real-world Clinical Setting in Germany. Eur Urol Focus 2024 Mar; 10(2): 339–45.
https://doi.org/10.1016/j.euf.2024.02.00