Promising imaging technique for diagnosing non-muscle invasive bladder tumour: NBI (narrow band imaging) in urology
DOI: 10.22591/magyurol.2017.2.kubika.52
Authors:
Mosonyi Péter dr., Szepesváry Zsolt dr., Kerényi Gábor dr., Lacó László dr. (Petz Aladár Megyei Oktató Kórház, Urológiai Osztály, Győr (osztályvezető: Szepesváry Zsolt dr.))
Summary
Objective: A high percentage of recurrent tumours can be obtained during the follow up of non-muscle invasive bladder tumours (NMIBT). In order to reduce this number, a lot of newly developed procedures have been introduced in the clinical practice. These are either biomarkers, and have a role in the follow up, or make the visualisation of bladder tumors more accurate. In the following article we discuss the most common methods and emphasize more importance to Narrow Band Imaging (NBI).
Patients and method: A total of 26 patients were retrospectively examined (female: 10 – male: 16). The light source of Olympus’s Visera Elite (C-190) type with special filters was used for endoscopic examinations. Conventional cystoscopy white light was performed, followed by NBI technique procedure.
Results: Atipical malformations were detected in two cases during NBI examination that was not detectable with white light cystoscopy.
Conclusion: The authors also highlight that the results can be improved by combining these new procedures.
LAPSZÁM: MAGYAR UROLÓGIA | 2017 | 29. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Célkitűzés: A nem izominvazív hólyagdaganatok (non-muscle invasive bladder tumor – NMIBT) utánkövetése során viszonylag magas számban észlelhető recidíva. Ennek csökkentése céljából az utóbbi években számos eljárás került kidolgozásra vagy bevezetésre a klinikai gyakorlatban. Ezek részben biomarkerek és az utánkövetésben van szerepük, részben pedig a tumor vizualizációját javítják. A közleményünkben az utóbbi technikák közül a legelterjedtebbeket tárgyaljuk, kiemelve a szűkített hullámhosszú képalkotás (narrow band imaging – NBI) jelentőségét.
Bevezetés
A hólyagdaganat a húgyutakban leggyakrabban előforduló rosszindulatú tumor. Az idősebb generáció betegsége, mivel diagnóziskor az átlagéletkor 70 év. Ugyanakkor a fiatalabb korban felfedezett tumorok általában jobban differenciáltak, alacsonyabb grádusúak és ezáltal jobb prognózissal bírnak. Férfiak esetében négyszer gyakrabban figyelhető meg, mint nőknél, afroamerikaiaknál feleannyira gyakori (1). Az újonnan diagnosztizált betegek 75%-ánál a daganat felszínes (non-muscle invasive bladder tumor, NMIBT), vagyis a mucosat és submucosus területeket érinti (Ta, T1 és CIS). Szövettani típus szerint 90%-ban tranziciocelluláris tumor (TCC) kerül diagnosztizálásra, 5%-ban laphám, 3%-ban adenokarcinóma, valamint 1%-ban neuroendokrin tumor (2).
A nem izominvazív hólyagtumoros esetek 15-61%-ában a tumor transurethralis reszekcióját (TUR) követően a daganat ismételten megjelenik a hólyagban egy éven belül (2, 22). A rekurrenciát és emellett a progressziót több tényező befolyásolja: a tumorok száma, mérete, megelőző kiújulási gyakoriság, jelen lévő karcinóma in situ (CIS), a daganat kiterjedése (Ta, T1) és a szövettani malignitás foka (grading). Mindezeket az EORTC – GUCG (European Organization for Research and Treatment of Cancer – Genito-Urinary Cancer Group) objektív pontrendszer formájában foglalta össze (2). Ugyanakkor a fentiek mellett egy további, szubjektív tényező befolyásolja a daganatok kiújulási gyakoriságát: a műtét (TUR) minősége. Ez utóbbi tényező javítása igencsak fontos és kívánatos (3). Az orvosi kezelés első és el nem hanyagolható lépcsőjének tökéletesítésére két lehetőségünk adódik: a vizualizáció javítása és a reszekciós technika fejlesztése. Ennek fényében a műtét során a lehető legnagyobb gondossággal és precizitással kell eljárni. Ebben lehet segítségünkre néhány, az utóbbi időben kifejlesztett, vagy újra felfedezett reszekciós technika („en block” reszekció, „HybridKnife” hidrodisszekció). Nem szabad elhanyagolni a beteg kezelése során elvégzett korai intravesicalis kemoinstillációt sem, mivel alkalmazásával 11,7%-13%-os csökkenést tudunk elérni a nem izominvazív hólyagtumorok kiújulási gyakoriságában (2).
A betegek utánkövetése szintén fontos lépés a gyógyuláshoz vezető úton. Kiemelt jelentőségű, hogy a daganat esetleges kiújulása minél előbb felfedezésre kerüljön. Korai recidíva alatt az első műtéttől számított három hónap múlva elvégzett első cisztoszkópia során felfedezett daganat értendő, amely az esetek 3-45%-ában figyelhető meg (5). Ezen esetek egy része valós tumorrecidíva, amely a daganat agresszív viselkedéséből származtatható, vagy a reszekciót követően implantálódott tumorsejtek hozzák létre. Ezeken túl el nem hanyagolható hányadot képeznek a műtét során észre nem vett apró daganatok is. Amellett, hogy újabb műtét szükséges ahhoz, hogy a beteg daganatmentessé váljon, nem kerülhető el az a tény sem, hogy a beavatkozások ismétlése jelentős terhet ró az amúgy is minimális tartalékokkal rendelkező egészségügyi rendszerünkre, nem beszélve a beteg szociális, pszichés és általános egészségi állapotáról (8, 9, 10).
Az utánkövetés során a képalkotó eljárások mellett alapvető fontosságú a vizeletcitológia (G3 tumor esetén) és a cisztoszkópia. A vizeletcitológia a G1, G2 esetekben erősen korlátozott értékű, hátránya, hogy vizsgálófüggő, low-grade tumorok esetén a szenzitivitás lecsökken, valamint zavarja az értékelést egyidejű gyulladás, húgyúti kövesség vagy intravesicalis instilláció is. Az eddig alkalmazott, fehér fénnyel (white light cystoscopy – WLC) történő cisztoszkópiának is megvannak a gyenge pontjai: az apró recidívát vagy CIS-t nehéz észrevenni, amelynek előfordulási gyakoriságát 10-20%-ra becsülik (3, 15). Mindezekre tekintettel az utóbbi időben jelentős erőfeszítések történtek annak érdekében, hogy a nem izominvazív hólyagtumorok detektálási hatékonyságát növelni lehessen mind az első műtét során, mind pedig az utánkövetés alatt. Erre szolgál több, az utóbbi években kifejlesztett eljárás: a biomarkerek és a vizualizációt javító technikák.
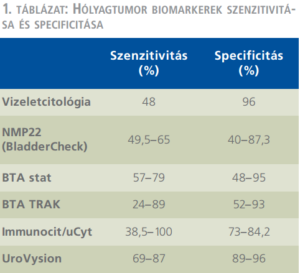
Továbbra sincs meg az ideális biomarker, azonban a jelenleg használatban lévők mindegyike igyekszik túlszárnyalni az ezidáig „gold standardnak” számító vizeletcitológiát. Az ImmunoCyt/uCyt immunohisztokémiai megoldást kínál a fenti problémára, míg az UroVysion fluoreszcens in situ hibridizációt alkalmaz. Az NMP22 (BladderCheck) a nuclear matrix protein 22 kimutatására szolgál vizeletből, könnyű a használata és 30 perc alatt eredményt ad. BTA stat (bladder tumor antigen) és BTA TRAK a hólyagtumor antigén jelenlétét igazolja vizeletből, ugyancsak fél óra alatt kész. Közös jellemzőjük, hogy nem helyettesíthetik a cisztoszkópiát és általában kiegészítésként használják citológia mellett. A továbbra sem tökéletes szenzitivitás miatt egyelőre csak az utánkövetés során van értelme a használatuknak (2, 23) (1. táblázat).
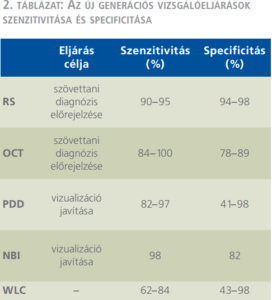
A nem izominvazív hólyagdaganatok felismerését elősegítő, jelenleg jóval nagyobb jelentőséggel bíró eljárások a vizualizációt segítik: a Raman-spektroszkópia (RS), az optikai koherencia-tomográfia (optical cocherence tomography, OCT), a fotodinámiás diagnózis (PDD), és a szűkített hullámhosszú képalkotás (narrow band imaging, NBI), továbbá néhány kezdeti stádiumban lévő módszer.
Új generációs vizsgálóeljárások
1. Raman-spektroszkópia (RS)
Az ún. Raman-effektusra alapozott eljárás lényege, hogy monokromatikus fénnyel megvilágított anyag részecskéinek vibrációs energiaállapota megváltozik és az ebből a helyzetből az alapenergia-állapotba történő visszatéréskor fotont sugároz ki, ami jól regisztrálható és az adott részecskékből álló anyagra jellemző. Minden anyagnak – így a normál mucosanak és tumoros szövetnek is – megvan a jellemző Raman-spektruma, amit fel lehet használni a normál és kóros szövetek elkülönítésére. Ezzel az RS alkalmas a patológiai diagnózis megelőlegezésére, hátránya, azonban hogy a hólyagnak csak kis területe vizsgálható és az eljárás kidolgozása még folyamatban van (3, 4, 6).
2. Optikai koherencia-tomográfia (optical coherence tomography, OCT
Ahogyan a neve is mutatja, ez is egy optikai eljárás, amelynek segítségével nagy felbontású, 2- vagy 3-dimenziós képeket tudunk előállítani szövetekről. A szemészetben már széles körben elterjedt eljárás, alapja az ultrahang analógiájára képzelhető el, annyi különbséggel, hogy fényt használnak hang helyett. Míg az ultrahang esetén a mélységi információt a hang visszaverődésének késleltetési idejéből származtatják, az OCT esetén interferometrikus módszert alkalmaznak. A szórt fény amplitúdója jellemző a szöveti típusra és szöveti mélységre, ami jól vizualizálható, penetrációja 2-3 mm. A hólyag három anatómiai rétege (urothelium, lamina propria, muscularis propria) így jól elkülöníthető, de tumoros invázió esetén ezek a rétegek eltűnnek. Előnye, hogy valós idejű eljárás, nem igényel speciális előkészítést és segítségével a tumor mélységi terjedésére lehet következtetni. Hátránya viszont az, hogy a hólyagnak csak kis területét lehet vizsgálni és az eredmények értékelése nagy gyakorlatot igényel (3, 4, 6).
3. Fotodinámiás diagnózis (photodynamic diagnosis, PDD
A fotodinámiás diagnózis, más néven fluoreszcens cisztoszkópia a fluoreszcencia jelenségét használja ki arra, hogy a patológiás és normális nyálkahártyafelszín között különbséget tegyen. Az eljárás során eltérő koncentrációban halmozódnak fel fluoreszcens molekulák normális és kóros szövetekben, majd a megfelelő hullámhosszú fény hatására más és más színben jelennek meg. A következő anyagokkal történtek beavatkozások: hypericin, 5-amino levulinsav (5-ALA) és észtere, hexa-amino levulinsav (HAL). Instillációt követően átlagosan két órával lehet a cisztoszkópiát elvégezni, speciális fényforrással és filterekkel felszerelt eszközökkel, amelyeken egyszerű gombnyomással lehet váltani a fehér fényű és a fluoreszcens mód között. A daganatos szövet intenzív rózsaszínes-vöröses fényben jelenik meg kékes (egészséges) háttér előtt. Számos klinikai tanulmány igazolta a detekciós ráta javulását PDD használata során a hagyományos fehér fényű cisztoszkópiával szemben. További előnye, hogy a tumoros szövet reszekciójának pontosságát is javítja. 5-ALA mellett jobb eredmények születtek, mint HAL alkalmazásával, mivel a vizsgálatok szerint az 5-ALA mélyebbre penetrál a szövetekbe és jobb dúsulást ér el neoplasztikus sejtekben (17, 18). A legnyomósabb ellenérv PDD-vel szemben a relatíve alacsony specificitása. Fals pozitív eseteket eredményezhet gyulladás, megelőző TUR vagy intravesicalis kemoterápia, valamint a nyálkahártya tangencionális megvilágítása. Mindezeken túl sajnos nem elhanyagolható tény az eljárás költséges volta, ami elterjedésének egyik fő akadályát képezi. A legújabb tanulmányok már az RS-sel és az OCT-vel történő kombinációját vizsgálják, amelynek köszönhetően a specificitás jelentősen javítható. További felhasználási lehetőség a fluoreszcens citológiai vizsgálat, amely mind a PDD, mind pedig a vizeletcitológiai vizsgálat előnyét egyesíti (19).
4. Szűkített hullámhosszú képalkotás (narrow band imaging, NBI
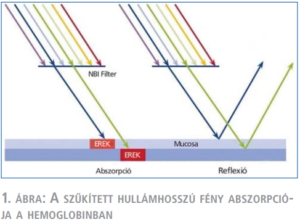
Az eljárásnak magyar elnevezése még nincs, leginkább „a látható fény spektrumát beszűkítő technikának”, vagy „szűkített hullámhosszú képalkotásnak” lehetne nevezni. A módszer maga egyszerű, ötletes és hatékony. Gasztrointesztinális endoszkópos vizsgálatokra fejlesztették ki, célja, hogy festék nélkül, optikai úton segítsen felerősíteni a kontrasztot ép és kóros mikrovaszkulatúrával rendelkező területek között (20). Azon a jelenségen alapul, hogy a fény szöveti penetrációjának mélysége az adott fény hullámhosszának függvénye. Ennek megfelelően, amikor a vizsgálófény hullámhosszát kék (415 nm) és zöld (540 nm) színekre szűkítjük, az a hemoglobin abszorpciós sávjába kerül és elnyelődik benne (1. ábra).
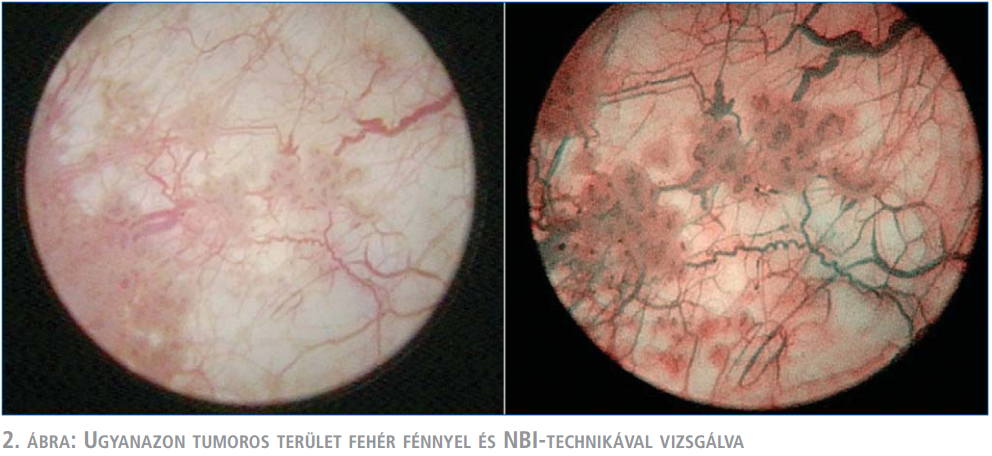
Következésképpen az érstruktúrák sötétzöld – fekete színben jelennek meg, míg a nyálkahártya rózsaszínes marad. A tumoros szövetekre jellemző dús érhálózat ezáltal könnyebben felismerhető, éles kontrasztot képez a normális vaszkulatúrával rendelkező nyálkahártya előtt (2. ábra) (9,10,12).
A vizsgálat során xenon fényforrást alkalmaznak, ami speciális színszűrővel van ellátva, 415 nm és 514 nm hullámhosszra optimalizálva. A készülék nem más, mint egy átlagos fényforrás, egyetlen plusz gombbal, ami a szűrőket aktiválja. Egyszerűségében rejlenek az előnyei: valós idejű, reprodukálható, jól dokumentálható (fénykép, videó), egyszeri beruházást igényel, amortizációja átlagos, speciális betegelőkészítés nincs, ambuláns formában is kivitelezhető (flexibilis cisztoszkópia), használatát könnyű elsajátítani, gyulladás vagy előzetes instillácó, kismértékű vérzés az értékelést nem zavarja. Fontos megemlíteni, hogy optikai eljárásról van szó, így nem hasonlítható egyéb valós idejű digitális képminőség – és kontrasztjavító technikához.
Hátránya a speciális szűrőkkel ellátott fényforrás viszonylag magas ára. További hátrányként szokták megemlíteni a fals pozitív minták számának emelkedését, ami azonban az eddigi vizsgálatok alapján nem jár a szövődmények gyakoriságának növekedésével (15, 16).
A gasztroenterológiában kiterjedten alkalmazzák azért, mert kolonoszkópia során hatékonyan segít a hiperplasztikus (nem neoplasztikus) és adenomatosus (neoplasztikus) polipusok in vivo elkülönítésében. Ugyancsak hasznos segítség gasztroszkópia során a nyelőcső Barrett-metaplázia kimutatásában. A bőrgyógyászatban is egyre szélesebb körben használják a fej-nyak régió laphámsejtes daganatainak diagnosztizálásában (2. táblázat) (7, 20).
A fentieken túl számos további vizsgálat indult a hólyagtumorok vizualizációjának elősegítésére. Ezek többsége még kísérleti stádiumban van. Kisebb részük ugyan már kipróbált és bevált eljárás, azonban nem terjedt el a mindennapi gyakorlatban, mivel egyes tulajdonságaikban a gyakorlati használhatóságuk korlátozott. A következőket lehet megemlíteni a teljesség igénye nélkül (hivatalos magyar elnevezés hiányában): confocal laser endomicroscopy, virtual cystoscopy, multimodal imaging, ultraviolet autofluorescence, multiphoton microscopy, scanning fiber endoscopy, telerobotic cystoscopy (4).
Betegek és módszer
Összesen 26 beteget vizsgáltunk retrospektíve (nő: 10 – férfi: 16), minden betegnél a beavatkozást megelőzően standard kivizsgálási protokollt alkalmaztunk. Ez magában foglalta az anamnézist, általános fizikális, laboratóriumi (vér és vizelet), és hasi ultrahangvizsgálatot. Az endoszkópos vizsgálatokat az Olympus cég Visera Elite (C-190) típusú speciális szűrőkkel ellátott fényforrásával végeztük.
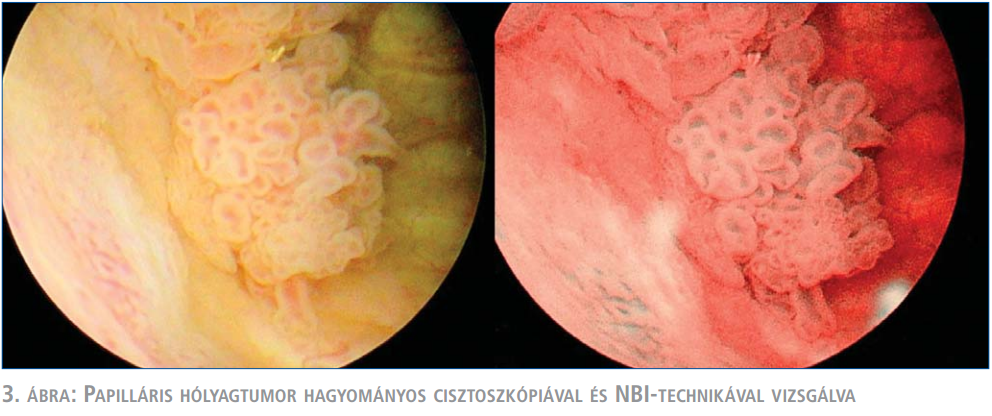
A műtét során minden betegnél először fehér fénnyel, hagyományos cisztoszkópiát végeztünk. Ezt követően a készülék átállítása után az NBI-technikát alkalmaztuk és az eredményeket a műtéti leírásban rögzítettük (3. ábra). Amennyiben a két diagnosztikus eljárás során különbséget észleltünk, az adott területről vett szövettani mintákat szeparáltan küldtük vizsgálatra.
A műtét után sem tértünk el az eddig megszokott protokolltól.
Eredmények
Gyógytartamot befolyásoló szövődmény nem volt, amiből a kis esetszám miatt nem vonhatunk le messzemenő következtetéseket, azonban joggal feltételezhetjük, hogy NBI használata nem növeli a szövődmények előfordulási gyakoriságát. NBI-vel történő vizsgálat során két betegnél észleltünk olyan eltérést, amely fehér fénnyel nem volt detektálható. Az e területekről vett minták szövettani vizsgálata az első esetben pozitívnak bizonyult (pTa, low grade urothelialis karcinóma). A második esetben a hisztológiai diagnózis krónikus urocistitist mutatott (ál-pozitív).
Utánkövetés kapcsán három hónap múlva elvégzett cisztoszkópia során két betegnél találtunk rekurráló tumort. Egy beteg nem jelent meg kontrollvizsgálaton.
Megbeszélés
Az Európai Unióban a hólyagtumorok előfordulási gyakorisága férfiak esetében 27/100 000 személy/év, míg nők esetében 4/100 000 személy/év. 2012-es adatok alapján férfiak esetében a prosztata, tüdő és colorectalis tumorokat követő a negyedik leggyakoribb daganat, míg nőknél a gyakorisági lista 15. helyén találjuk. Magyarországon a Nemzeti Rákregiszter adatai alapján a hólyagdaganat a hetedik leggyakoribb daganatféleség. 2013-ban 2262 férfi és 1049 női esetet regisztráltak, számuk 2009 óta 14%-kal nőtt. Érdekesség, hogy nők esetében az incidencia meglepően magas, az Európai Uniós országok közül csak Dániában magasabb (1).
Az újonnan diagnosztizált esetek 75%-a nem izominvazív hólyagtumor (Ta, T1 vagy CIS), amelyek 15-61%-a recidivál egy éven belül, 31-78%-a pedig öt éven belül a transurethralis reszekciót követően (2, 22). Ebből 3-45% a műtétet követő harmadik hónapban elvégzett cisztoszkópiás kontroll kapcsán kerül felfedezésre. A fentiekben ismertetett vizualizációt javító eljárások is elsősorban azért kerültek kifejlesztésre, hogy a kezdeti stádiumban lévő tumorszövet minél nagyobb arányban felfedezésre, és lehetőleg már az első műtét alkalmával eltávolításra kerüljön. Természetesen az utánkövetés során is jól kihasználhatóak az előnyei cisztoszkópia kapcsán. Míg az optikai koherencia-tomográfia (OCT) és a Raman-spektroszkópia (RS) a hólyagnyálkahártyának csak kis részét képes vizsgálni, addig a fotodinámiás diagnózis (PDD) és a szűkített hullámhosszú képalkotás (NBI) során a teljes nyálkahártya-felületet ellenőrizni lehet. A PDD-technika hasznosságára már az 1990-es évek elején felhívták a figyelmet, 2006 óta az Európai Urológus Társaság ajánlásában (EAU Guideline) is szerepel (21). Számos előnye ellenére a mindennapos gyakorlatban a mai napig nem terjedt el. Az NBI-technika első klinikai alkalmazását japán kutatók 2004-ben kolonoszkópia kapcsán végezték (7). Első urológiai alkalmazásáról Bryan és munkatársai számoltak be 2007-ben, majd a következő években a PDD konkurrensévé vált (12). Egy 2015-ben közreadott metaanalízis alapján nem találtak szignifikáns különbséget a hólyagdaganat kiújulási gyakoriságában PDD és NBI alkalmazásával elvégzett TUR-t követően. A vizsgálat egyértelműen az NBI alkalmazását javasolja, mert a PDD-vel ellentétben nem szükséges előzetes instilláció, és egyebek mellett egyidejű gyulladás sem rontja a specificitást (17).
Számos további vizsgálat igazolta az NBI előnyeit hagyományos cisztoszkópiával szemben, ezek közül kiemelendőek az alábbiak:
1. lényegesen jobb szenzitivitás (NBI: 98,8% – WLC: 75,4%) (11);
2. reziduális tumorok arányának csökkenése (NBI: 15% – WLC: 30,5%) (9, 13).
3. az egyéves kontroll kapcsán észlelt átlagos 10%-os csökkenés a kiújulási gyakoriságban (13).
Az NBI legnagyobb hátrányaként a fals pozitív esetek számának 8-13%-os emelkedését említik, azonban a vizsgálatok kimutatták, hogy ezen emelkedés nem jár sem a morbiditás, sem pedig a költségek szignifikáns növekedésével (9, 10, 15, 16).
Az előzetesen diagnosztizált felületes hólyagtumorok 4-25%-ban progresszió figyelhető meg (2). Arra még nem kaptunk választ, hogy a fenti vizsgálóeljárások alkalmazásával a progresszió gyakorisága milyen mértékben csökkenthető. A Nemzetközi Endourológiai Társaság koordinálásával 2013-ban indult egy nemzetközi, multicentrikus, randomizált, kontrollált vizsgálat, amelynek eredményei feltehetőleg választ adnak többek között a progressziós ráta alakulására is (14). A már említett 2015-ös metaanalízis következtetései alapján valószínűsíthető, hogy az NBI önmagában a progressziós rátát nem javítja (15). Mindezek miatt az egyes technikák kombinálásával lehetséges az eredményeken javítani. Már eddig is bíztató eredmények születtek (PDD+OCT, NBI+OCT), de további vizsgálatok szükségesek a megfelelő szintű evidencia felállításához.
A klinikus számára azonban a legfontosabb kérdés továbbra is az, hogy a mindennapi munkában hol jelent leginkább előnyt az NBI alkalmazása? Erre keres választ többek között egy, még le nem zárult dán vizsgálat (Da-Bla-Ca study), amelyben a PDD-vel és NBI-vel végzett hólyagtükrözés eredményeit hasonlítják össze a hagyományos cisztoszkópiával. A 2016-os EAU kongresszuson részeredményeket is közöltek, amelyben arra a következtetésre jutottak, hogy mindkét vizualizációt javító (PDD és NBI) vizsgálóeljárás a standard módszert mind specificitásban, mind szenzitivitásban megelőzi. Ezen túl úgy véleményezték, hogy egyszerűsége miatt az NBI a legalkalmasabb arra, hogy az ambuláns hólyagtükrözés során a szenzitivitást javítsa. Így a járóbeteg-ellátásban lehet számítani leginkább az elterjedésére, méghozzá a nem izominvazív hólyagtumoros betegek utánkövetése során végzett vizsgálatok esetében.
Következtetések
A fentiekben tárgyalt technikák közül – amennyiben rendelkezésre áll – a két, vizualizációt javító eljárás valamelyikét javasolt a mindennapi munkában is alkalmazni.
Az Európai Urológus Társaság legfrissebb ajánlása szerint amennyiben a vizeletcitológia pozitív és a hagyományos cisztoszkópia negatív eredményű – akár kivizsgálás, akár utánkövetés során – a felső húgyúti tumor kizárását követően PDD-, vagy pedig az NBI-technika alkalmazása előnyben részesítendő a random biopsziával szemben. Előzetes CIS szövettani eredmény mellett a három- és hathónapos kontrollvizsgálat során PDD vagy NBI által vezérelt biopszia elvégzése javasolt tumorrecidíva gyanúja esetén (2).
Tekintettel arra, hogy a PDD, de különösen az NBI a kiújulási gyakoriságot, ezáltal az ismételt transurethralis reszekciók számát lecsökkenti, költséghatékonynak tekinthető.
Annak ellenére, hogy a cikkben ismertetett NBI-technika számos előnnyel rendelkezik, hangsúlyozni szükséges, hogy ez az új képalkotó eljárás nem helyettesítheti, és nem nélkülözheti a tapasztalt urológus szakember jelenlétét és közreműködését.
Irodalomjegyzék:
1. Cancer incidence IARC, Ferlay J, Bray F, Forman D, et al. GLOBOCAN 2008 v1.2, Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 10 2010, International Agency for Research on Cancer: Lyon, France. https://doi.org/10.1002/ijc.29210
2. Babjuk M, Böhle A, Burger M, et al. EAU Guidelines on Non–Muscle-invasive Urothelial Carcinoma of the Bladder: Update 2016 http://doi.org/10.1016/j.eururo.2016.05.041
3. Cauberg ECC, de Bruin DM, Faber DJ, van Leeuwen TG, de la Rosette JJMCH, de Reijke TM. A new generation of optical diagnostics for bladder cancer: technology, diagnostic accuracy and future applications. Eur Urol 2009; 56: 287–97. https://doi.org/10.1016/j.eururo.2009.02.033
4. Lopez A, Liao JC. Emerging endoscopic imaging technologies for bladder cancer detection. Curr Urol Rep 2014; 15: 406. https://doi.org/10.1007/s11934–014–0406–5
5. Brausi M, Colette L, Kurt K, et al. Variability in the recurrence rate at firs follow-up cystoscopy after TUR in stage Ta T1 transitional cell carcinoma of the bladder: a combined analysis of seven EORTC studies. Eur Urol 2002; 41: 523–531. https://doi.org/10.1016/s0302-2838(02)00068–4
6. Patel P, Bryan RT, Wallace DM. Emerging endoscopic and photodynamic techniques for bladder cancer detection and surveillance. Scientific WorldJournal 2011; 11: 2550–2558. https://doi.org/10.1100/2011/412739
7. Muguruma N, Takayama T. Narrow band imaging as an efficient and economical tool in diagnosing colorectal polyps. Clin Endosc 2015; 48: 461–463. https://doi.org/10.5946/ce.2015.48.6.461
8. Naselli A, Introini C, Timossi L, et al. A Randomized Prospective Trial to Assess the Impact of Transurethral Resection in Narrow Band Imaging Modality on Non–Muscle-Invasive Bladder Cancer Recurrence. Eur Urol 2012; 61: 908–913. https://doi.org/10.1016/j.eururo.2012.01.018
9. Herr HW, Donat SM. A comparison of white-light cystoscopy and narrow-band imaging cystoscopy to detect bladder tumour recurrences. BJU Int 2008; 102: 1111–1114. https://doi.org/10.1111/j.1464–410x.2008.07846.x
10. Naselli A, Introini C, Bertolotto F. Narrow band imaging for detecting residual/recurrent cancerous tissue during second transurethral resection of newly diagnosed non-muscle-invasive high-grade bladder cancer. BJU Int 2009; 105: 208–211. https://doi.org/10.1111/j.1464–410x.2009.08701.x
11. Ye Z, Hu J, Song X, et al. A comparison of NBI and WLI cystoscopy in detecting non-muscle-invasive bladder cancer: a prospective, randomized and multi-center study. Sci Rep 2015; 5: 10905. https://doi.org/10.1038/srep10905
12. Bryan RT, Billingham LJ, Wallace DMA. Narrow-band imaging flexible cystoscopy in the detection of recurrent urothelial cancer of the bladder. BJU Int 2007; 101: 702–706. https://doi.org/10.1111/j.1464–410x.2007.07317.x
13. Cauberg ECC, Mamoulakis C, de la Rosette JJ. Narrow band imaging-assisted transurethral resection for non-muscle invasive bladder cancer significantly reduces residual tumour rate. World J Urol 2011; 29: 503–509. https://doi.org/10.1007/s00345–011–0659–2
14. Naito S, de la Rosette JJ, Algaba F, et al. The Global Randomized NBI Bladder Cancer study. 2010. http://www.croesoffice.org/ OngoingProjects/NBIStudy.aspx
15. Li K, Lin T, Fan X, et al. Diagnosis of narrow-band imaging in non-muscle-invasive bladder cancer: a systematic review and meta-analysis. Int J Urol 2013; 20: 602–609. https://doi.org/10.1111/j.1442–2042.2012.03211.x
16. Song PH, Cho S, Ko YH. Decision based on narrow band imaging cystoscopy without a referential normal standard rather increases unnecessary biopsy in detection of recurrent bladder urothelial carcinoma early after intravesical instillation. Cancer Res Treat 2016; 48: 273–280. https://doi.org/10.4143/crt.2014.190
17. Lee JY, Cho KS, Kang DH, et al. A network meta-analysis of therapeutic outcomes after new image technology-assisted transurethral resection for non-muscle invasive bladder cancer: 5-aminolaevulinic acid fluorescence vs hexylaminolevulinate fluorescence vs narrow band imaging. BMC Cancer 2015; 15: 566. https://doi.org/10.1186/s12885–015–1571–8
18. Járomi P, PintérZ, Lukács N, et al. A differenciált szövetmintavétel, illetve a fluorescens cystoscopia – mint prognózist befolyásoló tényező – szerepe a hólyagdaganat diagnosztikájában. Uroonkológia 2011; 8(2): 29–31.
19. Pytel A, Schmeller N. New aspect of photodynamic diagnosis of bladder tumors: fluorescence cytology. Urology 2002; 59: 216–219. https://doi.org/10.1016/s0090–4295(01)01528–x
20. Herszényi L, Mihály E, Tulassay Zs. Az NBI endoszkópos technika. Magy Belorv Arch 2014; 67: 5–10.
21. Pajor L, Bajory Z. A magyar urológia irányelvei. Útmutató. Klinikai Irányelvek Kézikönyve. 2009.dec. Urológia p. 75–82.
22. van der Heijden AG, Witjes JA. Recurrence, progression, and follow-up in non–muscle-invasive bladder cancer. Eur Urol Suppl 2009; 8: 556–562. https://doi.org/10.1016/j.eursup.2009.06.010
23. Vrooman OPJ, Witjes JA. Urinary Markers in Bladder Cancer. Eur Urol 2008; 53: 909–916. http://doi.org/10.1016/j.eururo.2007.12.006.
Leave a Reply
You must be logged in to post a comment.