Treatment modalities for renal angiomyolipomas associated with tuberous sclerosis
DOI: 10.22591/magyurol.2017.2.szendroia.69
Authors:
Szendrői Attila dr. (Semmelweis Egyetem, Urológiai Klinika, Budapest (igazgató: Nyirády Péter dr.))
Summary
Sclerosis Tuberosa (TSC) is an autosomal dominantly inherited, various organs such as kidney in 80%, brain in 75%, skin in 70%, and heart in 50% affecting disease. In the patient’s kidney next to multiple cysts angiomyolipomas (AML) also appear, both tend to ruin the renal function on long-term. In case of sclerosis tuberose the clinical appearance of the angiomyolipomas differ from the sporadic AML: they appear in younger age, show progressive growing, with several centre and both kidneys are involved. Treatment of AML in urology is performed due to the high risk of heavy bleeding or blood shock and means in most of the cases kidney resection or nephrectomy. On the other hand surgery is not ideal on TS based AML, because we have to count on further manifestations of the illness and repeated surgeries cause damage to the renal parenchyma and even without surgery complications this increases the development of renal insufficiency. This enhances the importance of the minimal invasive radiological interventions, such as the selective embolization and radiofrequency ablation the importance of the medical treatment. Per os applying the mTOR inhibitor everolimus on regular basis, the size of the AML’s decrease, preventing the shock of bleeding. On the systematic therapy the other organ’s lesions react also well, there will be less epileptic attacks; cognitive functions will be better, etc. The treatment of TS patients is a multidisciplinary task, where the patient’s quality of life and the expected lifetime can be supported by the efficient cooperation of the different professions.
LAPSZÁM: MAGYAR UROLÓGIA | 2017 | 29. ÉVFOLYAM, 2. SZÁM
Összefoglalás
A Sclerosis Tuberosa (TSC) autoszomális dominánsan öröklődő, sok szervet érintő megbetegedés, amelyben a vese 80%-ban, az agy 75%-ban, a bőr 70%-ban, a szív 50%-ban érintett. A betegek veséiben többszörös ciszták mellett angiomyolipomák (AML) is jelentkeznek, hosszú távon mindkettő hajlamosít a vesefunkció romlására. A sclerosis tuberosás betegek angiomyolipomái klinikai viselkedésükben eltérnek a sporadikus AML-től: fiatalabb korban jelentkeznek, progresszív növekedést mutatnak, többgócúak és mindkét vesét érintik. Az urológiában az AML kezelése elsősorban fenyegető vérzésveszély vagy ruptúra következtében kialakuló heveny vérzéses sokk miatt történik, és az esetek döntő többségében vesereszekciót vagy nephrectomiát végzünk. A sebészi beavatkozások azonban a TSC talaján kialakult AML kezelésére nem ideálisak, ezekben az esetekben számolnunk kell a betegség további manifesztációjával, és az ismételt sebészi feltárások a működő veseállomány károsítása révén még sebészi szövődmények nélkül is gyorsítják a veseelégtelenség kialakulását. Mindez kiemeli a minimálisan invazív intervenciós radiológiai eljárások, a szelektív embolizáció és a radiofrekvenciás abláció mellett a gyógyszeres kezelés jelentőségét. A per os alkalmazható mTOR-gátló everolimus tartós használatával az AML-k mérete csökken, megelőzve ezáltal a ruptúra következtében kialakuló vérzéses sokk kialakulását. A szisztémás terápia alkalmazására a többi szervrendszert érintő elváltozások is jótékonyan reagálnak, ritkulnak az epilepsziás rohamok, javulnak a kognitív funkciók stb. A TS-betegek élethosszig tartó kezelése multidiszciplináris feladat, amelyben a betegek életminőségét és várható élethosszát az egyes társszakmák hatékony együttműködése segítheti elő.
Az angiomyolipoma (AML) a vesében kialakuló, jóindulatú daganat, hamartoma, amely szövettanilag túlburjánzott atípusos erekből, simaizomból és zsírszövetből épül fel. Tünetet általában nem okoz, nagyra megnőve hasi fájdalom, vérvizelés hívhatja fel rá a figyelmet, hirtelen megrepedéskor pedig vérzéses sokk klinikai képét mutatja (1). Ultrahang-(UH) vizsgálat során jellemzően hiperdenz, hangárnyékot nem adó, jól körülírt, kerek képlet ábrázolódik a vese kéregállományában, és ez az esetek többségében elegendő a diagnózishoz (2). Az AML klinikai jelentőségét az adja, hogy bizonyos esetekben (pl. zsírszegény AML) képalkotó módszerekkel (UH, MR), nehéz lehet elkülöníteni egyéb, a vesén belül elhelyezkedő rosszindulatú daganatoktól (liposarcoma, vesesejtes rák stb.), illetve az, hogy spontán megrepedhet, ezzel életet veszélyeztető retroperitonealis vérzést okozva. Ruptúrára hajlamosít, ha a daganat eléri a 4 cm-es átmérőt, illetve ha a patológiás erek (ér aneurizmák) átmérője meghaladja az 5 mm-t. Az AML felismerését követően az esetek többségében további kezelést nem igényel, elegendő a beteg rendszeres követése UH-val. Az AML beavatkozást igényel, amennyiben a képalkotó vizsgálatok alapján (lásd előzőekben leírtak) a vérzés fokozott veszélye áll fenn, ha panaszokat okoz, ha a beteg életmódja, együttműködése stb. miatt az utánkövetés vagy az akut ellátás nem oldható meg, illetve ha a képalkotó vizsgálatok alapján a malignitás gyanúja nem zárható ki teljes biztonsággal (3). A terápia az urológiai gyakorlatban leginkább a sebészi kezelést, nyílt vagy laparoszkópos technikával történő vesereszekciót, esetleg veseeltávolítást jelent.
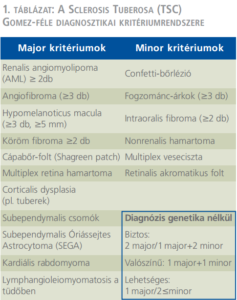
A Sclerosis Tuberosa (TSC) autoszomális dominánsan, inkomplett penetranciával öröklődő rendellenesség, amely sokszervi károsodás képében jelentkezik, incidenciája 1/10 000. A betegek genetikai vizsgálata során két gént, a TSC1-et és a TSC2-t írtak le, az első a hamartin, a második a tuberin nevű fehérje kialakulásáért felel. A két fehérje által alkotott komplex gátolja a sejteken belül az mTOR jelátviteli mechanizmust. A fenti gének károsodása tehát az mTOR kontrollálatlan túlműködésével jár, amely a sejtek kóros irányban történő differenciálódását és túlburjánzását okozza. Az mTOR-rendszer gyógyszeres gátlásán alapul a betegek szisztémás kezelése (4). A kórképet először Bourneville és Pringle írták le mentális retardációval, görcsökkel és a bőrön jelentkező angiofibromákkal jellemezték, azonban a kórképre jellemző hamartomák minden szervben, így a vesében is előfordulhatnak. TS esetén a vese 80%-ban, az agy 75%-ban, a bőr 70%-ban, a szív 50%-ban érintett (5). Kórisméjét a klinikumban leggyakrabban a Gomez-féle kritériumok alapján állapíthatjuk meg (1. táblázat), de bizonyos esetekben a képalkotó (koponya, szív és vese MR vagy UH) és a klinikai vizsgálatok (szemészet, bőrgyógyászat, neurológia) mellett genetikai és szövettani vizsgálat is szükségessé válhat (6).
Extrarenális manifesztációk közül a központi idegrendszer érintettsége epilepsziás görcsök és mentális retardáció képében jelentkezik (7). Szemfenéki vizsgálattal a retina idegrostjai mentén kialakuló burjánzások a látást nem befolyásoló sárga foltok képében mutathatók ki. A bőrön születéskor hipopigmentált foltok jelentkeznek, a későbbiekben alakul ki az adenoma sebaceum és a periungualis fibromatosis. A tüdőben lymphangio-leiomyomatosis alakul ki, amely spontán pneumothoraxhoz és fokozódó dyspnoehoz vezet. A szívben, csecsemőkorban kialakuló rhabdomyomák lehetnek tünetmentesek, de hajlamosíthatnak ritmuszavar, dekompenzáció és hirtelen szívhalál kialakulására, a későbbiekben spontán regressziót mutathatnak.
A renális manifesztációk közé tartoznak az AML-k és a ciszták. A ciszták jellemzően a kéregállományban szaporodnak fel, klinikai megjelenésük gyakran nem különbözik az autoszómális domináns öröklésmenetet mutató policisztás vesebetegségétől, és ahhoz hasonlóan szintén magas vérnyomást és a vesefunkció progresszív romlását okozhatják.
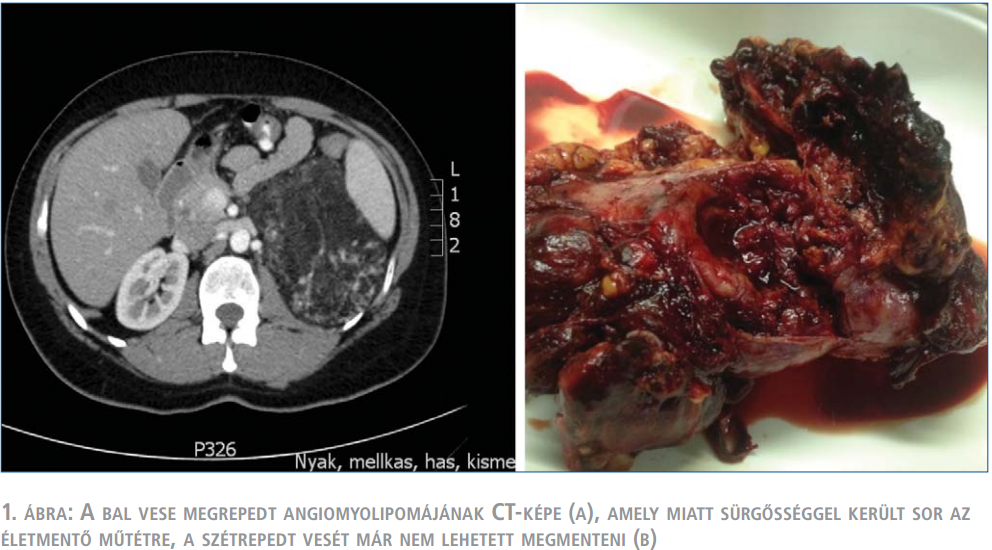
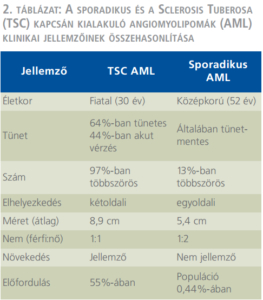
A TSC-vel szövődött AML klinikai viselkedésében eltér a gyakoribb, sporadikus betegségtől: fiatalabb korban jelentkezik, gyakran többszörös és mindkét vesét érinti, gyorsabban növekszik, és ezáltal nagyobb a spontán ruptúra következtében kialakuló vérzés veszélye is (2. táblázat). A vérzés az esetek negyedében keringési sokkot okoz. Az ekkor végzett azonnali műtét során gyakrabban kényszerülünk csonkolásra, nephrectomiára, ez a másik vese érintettségét is figyelembe véve sietteti a végstádiumú veseelégtelenség kialakulását (1. ábra). Ezért kívánatos a vérzés kialakulásának megelőzése. A hazai klinikai gyakorlatban a TSC részjelenségeként kialakult AML kezelése általában nem tér el a sporadikus esetekétől, elsősorban sebészi kezelést alkalmaznak (8) (2. ábra). Azonban a genetikai károsodás következtében ezekben a betegekben fiatalabb korban, gyakran többszörös, kétoldali műtétekre van szükség, amelyek a vesereszekció általános veszélyei mellett, a visszamaradó parenchyma-állomány hegesedésével, működésének csökkenésével is járnak. A fentiek kiemelik a minimál invazív intervenciós radiológiai módszer és a gyógyszeres kezelés jelentőségét, amelyek hozzájárulhatnak a parenchyma megőrzésével a jobb vesefunkció biztosításához, ezáltal a TSC-ben szenvedő betegek életminőségének és életkilátásainak javításához.
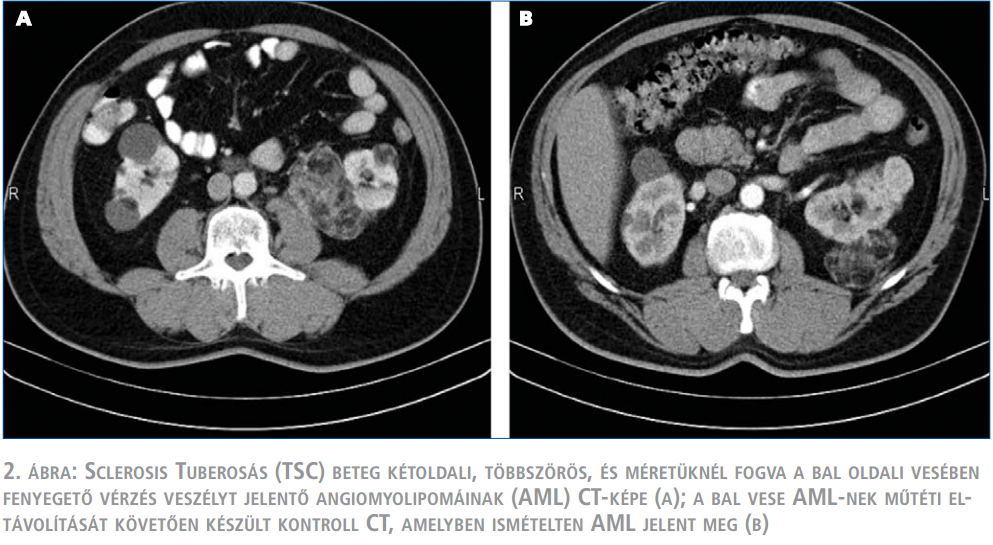
Az intervenciós radiológiai módszerek közül az embolizáció, mind a vérzésveszélyt jelentő AML-ek kezelésében, mind a ruptúra miatt bekövetkező heveny vérzést okozó AML sürgősségi ellátásában eredményesen alkalmazható. Megelőzésként a 4 cm-nél nagyobb, vagy 5 mm-nél vastagabb eret tartalmazó AML-t ellátó ér embolizációjával a daganat mérete megkisebbedik, későbbi növekedése lelassul, és kisebb lesz a spontán repedés valószínűsége is. Az embolizációt, a sebészi kezeléssel ellentétben, a későbbiekben gyakrabban kell ismételni. A radiofrekvenciás abláció (RFA) alkalmazásával a vesén belüli daganatok szövetei elpusztulnak, így AML esetében csökken a ruptúra és ezáltal a vérzés veszélye is. Mindkét fenti módszerre jellemző, hogy biztonsággal alkalmazható, kevesebb szövődménnyel jár és kisebb megterhelést jelentenek a betegnek, mint a „hagyományos” sebészeti eljárás. Ugyanakkor az AML gyakrabban recidivál intervenciós radiológiai eljárást követően, ezért a szoros, élethosszig tartó UH-kontroll elengedhetetlen.
A gyógyszeres kezelés során a TS hátterében lévő genetikai okok talaján kialakuló szövetburjánzást célzottan, a sejten belüli jelátvitel szintjén gátoljuk az urológiában a magas rizikójú, áttétet adó világossejtes vesedaganatok kezeléséből már ismert mTOR-gátló everolimus alkalmazásával. A szisztémás kezelés a TSC által érintett szervek mindegyikén kifejti hatását. Így eredményesen csökkenthető pl. az epilepsziás rohamok valószínűsége, javulnak a kognitív funkciók, csökken a kardiológiai eltérések kockázata stb. (9). A vesén belül az AML-ek megkisebbednek, és csökken az általuk jelentett vérzésveszély is (10). A gyógyszeres kezelést, amennyiben az eredményesnek bizonyul, hosszú távon, akár élethosszig kell alkalmazni a transzplantált betegek kezeléséhez hasonlóan. Mellékhatásai általában jól tolerálhatóak (11). Nemzetközi kettős vak placebokontrollált vizsgálatok (pl. EXIST2) több mint 3 éves utánkövetési idővel megállapították, hogy a naponta 1×10 mg per os alkalmazott everolimus kezelés a betegek 89,4%-ában gátolta az AML-ek progresszióját, sőt 64%-ában a tumorok több mint 50%-os méretcsökkenését tapasztalták (12). Ezen vizsgálatok alapján megfogalmazott nemzetközi ajánlások (FDA, EMA) szerint az everolimus kezelés első vonalban alkalmazandó:
- a 3 cm-nél nagyobb, tünetmentes, növekedést mutató AML-k;
- a növekvő, tünetmentes subependimális óriássejtes astrocytomák (SEGA) esetén.
A TSC-ben szenvedő betegek gyógyszeres kezelése kiemelt (általában transzplantált betegekkel foglalkozó) centrumokban, nefrológusok irányításával működő multidiszciplináris szakemberek összefogásával történik világszerte (13)
Következtetések
A fentiekben ismertettük az AML kezelési lehetőségeit, különös tekintettel a konzervatív (intervenciós radiológiai és gyógyszeres) gyógymódokra. Ezeket a kezeléseket Magyarországon ritkán alkalmazzák, és a hazai urológusok nem ismerik eléggé. A konzervatív terápiás lehetőségek bővülésével a társszakmák (nefrológus, intervenciós radiológus stb.) együttműködése kiemelt szerephez jut azon közös cél érdekében, hogy betegeink a számukra legkisebb megterhelést jelentő, legjobb eredménnyel, legkevesebb szövődménnyel járó gyógymódban részesülhessenek.
Támogatások
A közlemény a Novartis felkérésére készült, a cikkben leírtak a szerző saját véleményét tükrözik, amelyek eltérhetnek a cég álláspontjától.
Irodalomjegyzék:
1. Szendrői A, Hamvas A, Székely E, et al. Jóindulatú daganat-e a vese angiomyolipoma? Uroonkológia 2005; 2(3): 76–80.
2. Fittschen A, Wendlik I, Oeztuerk S, et al. Prevalence of sporadic renal angiomyolipoma: a retrospective analysis of 61,389 in- and out-patients. Abdom Imaging 2014; 39(5): 1009–1013. https://doi.org/10.1007/s00261-014-0129-6
3. Ljunberg B, Bensalah K, Bex A, et al. EAU Guidelines on renal cell carcinoma 2016. http://uroweb.org/guideline/renal-cell-carcinoma/
4. Reusz Gy, Deák-Pál Á, Remport Á. A sclerosis tuberosa terápiájának és gondozásának újabb aspektusai. Hypertonia és Nephrologia 2016; 20(3): 97–144.
5. Wataya-Taneda M, Tanaka M, Hamasaki T, et al. Trends in the Prevalence of Tuberous Sclerosis Complex Manifestations: An Epidemiological Study of 166 Japanese Patients. Plos One 2013; 8(5): e63910 https://doi.org/10.1371/journal.pone.0063910
6. Krueger DA, Northrup H, et al. Tuberous Sclerosis Complex Diagnostic Criteria Update: Recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference. Peadiatr Neurol 2013; 49: 243–254.
7. Franz DN, Agricola K, Mays M, et al. Everolimus for subependymal giant cell astrocytoma: 5-year final analysis. Ann Neurol 2015; 78(6): 929–38. https://doi.org/10.1002/ana.24523
8. Nelson CP, Sanda MG. Contemporary diagnosis and management of renal angiomyolipoma. J Urol 2002; 168(4): 1315–25. https://doi.org/10.1016/S0022-5347(05)64440-0
9. Krueger DA, Care MM, Agricola K, et al. Everolimus long-term safety and efficacy in subependymal giant cell astrocytoma. Neurology 2013; 80(6):574–80. https://doi.org/10.1212/WNL.0b013e3182815428
10. Bissler JJ, Kingswood JC, Radzikowska E, et al. Everolimus for renal angiomyolipoma in patients with tuberous sclerosis complex or sporadic lymphangioleiomyomatosis: extension of a randomized controlled trial. Nephrol Dilal Transplant 2016; 31(1): 111–119. https://doi.org/10.1093/ndt/gfv249
11. Eijkemans MJC, van der Wal W, Rejinders LJ, et al. Long term follow up assassing renal angiomyolipoma treatment patterns, morbidity and mortality: an observational study in tuberous sclerosis complex patients in the Netherlands. Am J Kidney Dis 2015; 66: 638–645. https://doi.org/10.1053/j.ajkd.2015.05.016
12. Bissler JJ, Kingswood JC, Radzikowska E, et al. Everolimus for angiomyolipoma associated with tuberous sclerosis complex or sporadic lymphangioleiomyomatosis (EXIST2): a multicentre, randomised, double blind, placebo-controlled trial. Lancet 2013; 381: 817–824. https://doi.org/10.1016/S0140-6736(12)61767-X
13. Coombs E. Role of mTOR inhibition in the treatment of patients with renal angiomyolipomas. J Am Assoc Nurse Pract 2013; 25(11): 588–596. https://doi.org/10.1002/2327-6924.1208
Leave a Reply
You must be logged in to post a comment.