The role of human papillomavirus in the penile cancer (summary of the PhD dissertation)
DOI: 10.22591/magyurol.2018.2.damasdim.69
Authors:
Damásdi Miklós dr., Pytel Ákos dr., Kovács Gyula dr., Szántó Árpád dr.
Pécsi Tudományegyetem Klinikai Központ Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
Summary
Objective: Based on our present knowledge and evidence, phimosis, chronic inflammation (balanoposthitis, balanitis xerotica obliterans), penile lesions, UVA radiation, smoking, promiscuity, prior condyloma and HPV infection are considered a clear risk factor. The question arises whether the HPV affected primary tumor, an advanced process, clinically positive or possibly the involvement of the lymph nodes of the lymph nodes affected by HPV involvement, or the presence of the same subtypes, oncogenic HPV types in both tissue environments.
Patients, methods: Between 2002 and 2012, during operations of malignant penile cancers in the Department of Urology, University of Pécs, tissue samples were taken from both the primer tumour and the regional lymph nodes. The collection and processing of tissue samples was carried out with the permission of the PTE ÁOK Ethics Committee (Ethical Approval Number: 4828).
In our clinical studies we studied the HPV expression is issue samples and biological markers that correlated with the progression of penile tumors, and we investigated the protective role of toll-like receptor 4 (TLR4) in the formation of penile tumors.
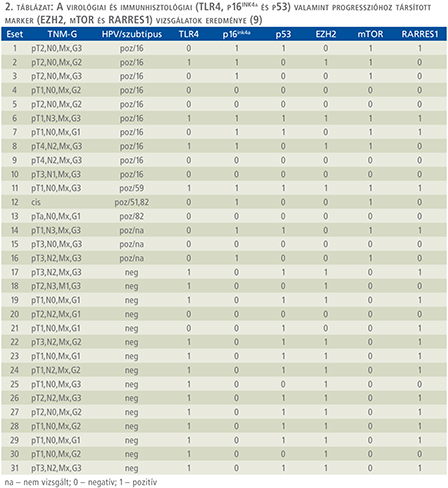
Results: In our clinical study 16/31(51.61%) patients were isolated high malignant HPV DNA from the primary tumor, and in 3/31 cases were detected HPV from its regional (inguinal) lymph nodes. In further molecular biological studies and typing processes, in 13 of the 16 high-malignant HPV positive primary tumors, the high sensitivity test method was used to characterize. Types of HPV 16 in all 10 patients (76.92%) and 3 (23.07%) HPV 51, 82, 59 types were confirmed. In the 3 patients with HPV analysis of both primary and lymph node positive HPV 16 types were positive. In the clinical and pathological studies associated with molecular biology, 47% pTa-pT1 and 53% pT2-pT4 localized HPV positive cases were confirmed. A reverse correlation between HPV infection / TLR4 expression in penile cancer can be observed (compared to cervical cancer). TLR4 expression can be used as a biological marker to detect Of the biological markers involved in the clinical trial, the mTOR, EZH2 and RARRES1 immunohistological expression have a significant correlation with the progression of the penile tumors.
Conclusions: Both HPV-associated and HPV-independent mechanisms can lead to malignant processes (different pathways). We first introduced the difference between HPV infection and TLR4 expression in the penile tumor. Increased TLR4 expression indicates HPV negative tumors, and p16INK4a expression increases in HPV positive penile cancer. Our data suggest that TLR4 receptor expression protects the long-term presence of viral infection. We identified three new prognostic markers. Patient vaccination in the light of this clinical study would be absolutely justified, as the incidence of HPV 16/18 types in our region is far more common with other non-HPV 16-18 types. In the case of mTOR positivity (66%) the possibility of therapeutic use of mTOR inhibitors may be included.
LAPSZÁM: MAGYAR UROLÓGIA | 2018 | 30. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Célkitűzés: A hímvessződaganatok kockázati tényezői a fitymaszűkület, a krónikus gyulladások (balanoposthitis, balanitis xerotica obliterans), a hímvesszőt ért sérülések, az UVA-sugárzás, a dohányzás, a promiszkuitás, a korábbi condyloma- és HPV-infekció. Felmerül a kérdés, hogy a HPV-érintett primer daganat esetén, illetve az eltávolított nyirokcsomó daganatos érintettsége esetén a csomók HPV-érintettsége vajon összefüggést mutat-e, illetve azonos szubtípusok, onkogén HPV-típusok jelenléte kimutatható-e mindkét szöveti környezetben.
Beteganyag, módszer: A Pécsi Tudományegyetem Urológiai Klinikáján 2002–2012 között malignus hímvessződaganat miatt elvégzett műtéti beavatkozások során mind a primer tumorból, mind pedig a regionális nyirokcsomókból vettünk szövetmintákat. A szövetminták gyűjtését és feldolgozását a PTE ÁOK Etikai Bizottság engedélyének birtokában végeztük (etikai engedély száma: 4828). Kutatásaink során a primer tumorban, valamint az inguinális nyirokrégióban vizsgáltuk a humán papillomavírus jelenlétét, kerestünk olyan biológiai markereket, amelyek a hímvessződaganatok progressziójával összefügghetnek, illetve vizsgáltuk a toll-like receptor-4 (TLR4) protektív szerepét a hímvessződaganatok kialakulásában.
Eredmények: A vizsgálatba bevont 31 betegnél 16 esetben tudtunk a primer daganatból magas malignitású HPV DNS-t izolálni (51,61%), és 3 esetben tudtunk a hozzá tartozó regionális (inguinalis) nyirokcsomókból HPV-t kimutatni. A 16 magas malignitású HPV-pozitív primer daganatos beteg közül 13 esetben tudtuk a magas szenzitivitású vizsgáló módszerrel a tipizálást elvégezni. 10 betegnél (76,92%) HPV 16 szubtípus, 3 esetben (23,07%) HPV 51, 82, 59 szubtípusok igazolódtak. Azon 3 betegnél, akiknél mind a primer, mind pedig a nyirokcsomó HPV-analízise pozitív eredménnyel zárult megegyező HPV 16 szubtípust tudtunk kimutatni. A magas malignitású HPV-pozitív esetek 47%-ában pTa-pT1, míg 53%-ában pT2-pT4 stádiumú lokális folyamatok igazolódtak. A HPV-fertőzés/TLR4 expressziója között fordított összefüggés volt kimutatható a hímvessződaganatok esetén (szemben a cervicalis daganatokénál). A klinikai vizsgálatba bevont biológiai markerek közül az mTOR EZH2 és RARRES1 immunhisztológiai kifejeződése szignifikáns korrelációt mutat a hímvessződaganatok progressziójával.
Következtetés: Hímvessződaganatok esetén mind a HPV-asszociálta, mind pedig a HPV független mechanizmus a malignus folyamat irányába vezethet (más utat bejárva). A HPV-pozitív hímvessző malignus daganatok kórlefolyása a HPV-negatív esetekhez képest rosszabb, illetve a nyirokcsomó-pozitivitás esetén különösképpen rapid lefolyású.
Először mutattuk be a HPV-fertőzés és a TLR4-expresszió közötti különbséget a hímvessződaganatban. A TLR4-expresszió biológiai markerként használható a HPV-negatív tumorok kimutatásában (non-virális eredet) ugyanúgy, mint a p16-expresszió a HPV-pozitív daganatokéban (virális eredet). Adataink arra utalnak, hogy a TLR4-receptor expressziója megvéd a vírusfertőzés tartós fennállásától. Három új prognosztikai markert azonosítottunk. A betegek védőoltása a fenti klinikai vizsgálat tükrében feltétlenül indokolt lenne, hiszen régiónkban a HPV 16/18-as típusok előfordulása messze gyakoribb az egyéb non-HPV 16-18-as típusokhoz képest. Az mTOR-pozitivitás esetén (66%) fel lehet vetni az mTOR-gátlók terápiás alkalmazásának lehetőségét.
Bevezetés
A pénisztumor rizikófaktorait először a Karolinska Intézet állította össze az 1966 és 2000 között megjelent irodalmi közlemények adatai alapján (1). Esetkontroll-tanulmányok jelentős rizikófaktorként azonosították a fitymaszűkületet, a krónikus gyulladásos állapotokat (balanoposthitis, lichen sclerosis, balanitis xerotica obliterans) és az UVA (ultra violet A) foto-kemoterápiás kezelést. Jelen tudásunk és bizonyítékaink alapján a fitymaszűkület, a krónikus gyulladások (balanoposthitis, balanitis xerotica obliterans), a hímvesszőt ért sérülések, az UVA-sugárzás, a dohányzás, a promiszkuitás, a korábbi condyloma- és HPV-infekció (Humán Papillomavírus) tekinthetők egyértelmű kockázati tényezőnek.
A méhnyakrákkal szemben a HPV-fertőzés önmagában nem oka a hímvessződaganat kialakulásának, a primer daganatban 15-71%-ban ugyan kimutatható (2), prognosztikai faktorként történő alkalmazása sem egyértelmű. Bizonyos hímvessződaganat típusok között sokkal gyakoribb a kapcsolat (pl. basaloid, condylomatosus megjelenés 76%), mint egyéb (pl. verrucosus karcinóma 24,5%) megjelenési típusok között.
A hímvessződaganatok klinikai lefolyását, illetve a túlélést egyértelműen a nyirokcsomóstátusz határozza meg. A klinikailag negatív nyirokcsomók 5 éves daganatmentes túlélése 75-93%, a klinikailag igazolt kismedencei nyirokcsomó-érintettség esetén az 5 éves daganatmentes túlélés 20-34% közé esik (3). Felmerül a kérdés, hogy a HPV-érintett primer daganat esetén, előrehaladott folyamat, klinikailag pozitív, illetve esetlegesen az eltávolított szentinel nyirokcsomó daganatos érintettsége esetén a csomók HPV-érintettsége vajon összefüggést mutat-e, illetve azonos szubtípusok, onkogén HPV-típusok jelenléte kimutatható-e mindkét szöveti környezetben. Ha igen, a daganatos betegség klinikai lefolyásában mutatnak-e ezen betegek különbséget a kontrollpopulációhoz képest.
Kiterjedt kutatás és adatgyűjtés csak szórványosan folyik a férfiak között, a világ urológus társaságainak irányelvei érdemben nagyon keveset foglalkoznak a humán papillomavírussal.
Kutatásaink során a primer tumorban, valamint az inguinális nyirokrégióban vizsgáltuk a humán papillomavírus jelenlétét, kerestünk olyan biológiai markereket, amelyek a hímvessződaganatok progressziójával összefüggenek, illetve vizsgáltuk a toll-like receptor-4 (TLR4) protektív szerepét a hímvessződaganatok kialakulásában. Ezen kívül szerettük volna összefoglalni a HPV és a hímvessződaganatokról megszerzett tudást. A HPV kóroki szerepe ugyan lényegesen kisebb, mint a nők esetében, az ezzel kapcsolatos kutatás sok hasznot vonhat maga után: a védőoltásoknak a hímvessződaganatos esetekben is preventív szerepe lehet, emellett a HPV prognosztikai szerepére is fény derülhet.
Betegek és módszer
A Pécsi Tudományegyetem Urológiai Klinikáján 2002–2012 között malignus hímvessződaganat miatt elvégzett műtéti beavatkozások során mind a primer tumorból, mind pedig a regionális nyirokcsomókból vettünk szövetmintákat (1. táblázat). A mintákat további kórszövettani feldolgozásra küldtük, ahol a szövetek paraffin beágyazása történt meg. A szövetminták gyűjtését és feldolgozását a PTE ÁOK Etikai Bizottság engedélyének birtokában végeztük (etikai engedély száma: 4828).
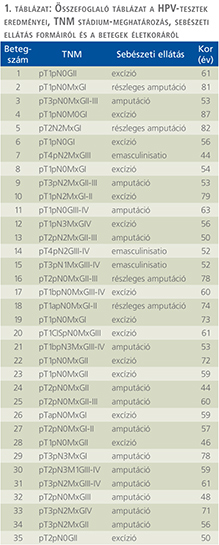
A HPV-státusz meghatározása
A továbbiakban a retrospektív molekuláris vizsgálatokhoz a paraffin blokkokból 10 µm-es szövetmetszetek készültek, amikből a deparaffinálás után totál DNS-kivonást végeztünk HPV-kimutatás céljából. A DNS kivonásához a sejteket QIAGEN sejtfeltáró készülékkel (TissueLyser, Qiagen, Biomarker Ltd. Hungary) tártuk fel, majd a finomabb struktúrák bontását enzimatikus emésztéssel (Proteinase-K) végeztük. A DNS preparálása QIAGEN-kittel (QIAmp DNA FFPE Tissue Kit) történt, a gyártó utasításainak megfelelően. A HPV örökítő anyagának kimutatását vírusspecifikus TaqMan próbával (DiaSTD HPV Screening Kit, DIAGON) polimeráz láncreakció (PCR) alkalmazásával erősítettük fel, amely alkalmas a HPV minden genotípusának egyidejű kimutatására. A méréseket LineGene 9600-as valós idejű PCR-készülékkel végeztük, ahol az 530 nm-en megjelenő fluoreszcens jel detektálásával igazoltuk a mintában a HPV virális nukleinsav jelenlétét.
Szöveti microarray (Tissue microarray, TMA)
A vizsgálat során a karcinómát tartalmazó paraffin-blokkokat használtunk fel tissue microarray (TMA) készítéséhez. A tumoros blokkokból készített hematoxilin-eozinnal festett metszetek áttekintése során kijelöltük a mintavétel helyét. Ezt követően a kijelölt területnek megfelelően a paraffinba ágyazott szövetblokkból Manual Tissue Arrayer (MTA1, Beecher Instruments, Inc. Sun Prairie, USA) készülék segítségével 0,6 mm átmérőjű szövethengereket emeltünk ki. Minden egyes tumorból, de különösen a különböző morfológiájú vagy grádusú területekkel rendelkező tumorokból több (3-5) mintát vettünk. Az így nyert szövethengereket az MTA1 készülék segítségével egy közös paraffin-blokkba ágyaztuk be, lehetővé téve az összes vizsgált tumor egy metszeten történő egyidejű vizsgálatát.
Immunhisztokémia
A TMA-ból készített 4 µm vastagságú metszetekből a paraffint xilol segítségével eltávolítottuk, majd a metszeteket leszálló etanol sorozatban rehidráltuk. Ezt követően az antigénfeltárás 10 mM nátrium-citrát pufferben (pH 6,0) vagy TE-pufferben (pH 9,0) történő kezeléssel értük el, amit a 2100-Retriever (Pick-Cell Laboratories, Amsterdam, Hollandia) készülékben végeztünk el.
Az endogén peroxidáz aktivitás és a nem specifikus kötőhelyek blokkolása 1% normál lószérumot tartalmazó 3%-os hidrogén-peroxidban történt szobahőmérsékleten 10 percig. Ezt követően a metszeteket a primer antitesttel nedves kamrában 4 °C-on inkubáltuk.
Harminc percig történő HRP konjugált anti-nyúl másodlagos antitest (MACH4 Universal HRP-Polymer, Biocare Medical, Concord, USA) alkalmazását követően az előhívás AEC szubsztrát és DAB (DAKO Glostrup, Danemark) segítségével történt, majd a metszeteket Mayer hematoxilinnel festettük. Végül a metszetek kétszeres kiértékelése történt a klinikai adatok ismerete nélkül. A kiértékelést Leica LaborluxS mikroszkóppal végeztük a fotókat Leitz DMRBE mikroszkópra helyezett ProgRes C14 kamerával készítettük.
Az immunhisztológiai reakciók kiértékelése
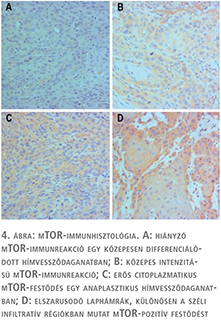
A TLR4, P16INK4a és p53 immunhisztológia eredményét két alkalommal értékeltük ki a HPV-státusz ismerete nélkül. Az EZH2 (Enhancer of Zeste Homolog), mTOR (mammaliam Target of Rapamycin), RARRES1 (Retinoic Acin Receprot Responder 1), MMP12 (Macrophage Metalloproteinase 12) kiértékelése a tumorok progressziójának ismerete nélkül történt. Mivel ezekkel az antitestekkel a pozitív sejtek aránya 80%-fölött volt, a százalékos arányt nem értékeltük ki paraméterként. Az értékelés kizárólag a reakció intenzitásán alapult: hiányzó, gyenge, közepes és erős festődés. Az E-cadherin valamint a vimentin immunhisztológia kizárólag egy-két esetben volt pozitív, így nem került kiértékelésre.
Statisztikai módszer
A HPV-pozitivitás, TLR4, p53 és p16-expresszió közötti összefüggést Pearson’s Chi square teszttel értékeltük. Az eredményt akkor tartottuk szignifikánsnak, ha a p-érték 0,05 alatt volt. A számításokat az SPSS (IBM Corporation, New York, USA, v24.0) programmal végeztük el (Fisher Extect Test).
Eredmények
A vizsgálati időszakban 47 beteg esetében távolítottuk el a primer tumort, illetve 35 esetben a regionális nyirokcsomókat, 24 esetben végeztünk dinamikus szentinel nyirokcsomó-eltávolítást. Az alkalmazott DNS-preparálási módszerrel megfelelő mennyiségű és minőségű nukleinsavat sikerült kinyernünk, amelyet a továbbiakban a virális nukleinsav kimutatásához használtunk fel. A végleges vizsgálatokban 35 beteg primer tumor és nyirokcsomó-mintáit teszteltük párhuzamosan. A feldolgozásba 31 beteg került bevonásra, 16 esetben tudtunk a primer daganatból magas malignitású HPV DNS-t izolálni, és 3 esetben tudtunk a hozzá tartozó regionális (inguinalis) nyirokcsomókból HPV-t kimutatni. A további molekulár biológiai vizsgálatok, illetve tipizálási folyamatok során a 16 magas malignitású HPV-pozitív primer daganatos beteg közül 13 esetben tudtuk a magas szenzitivitású vizsgáló módszerrel a tipizálást elvégezni. A tipizálás során 10 betegnél (76,92%) HPV 16 szubtípus, 3 esetben (23,07%) HPV 51, 82, 59-szubtípusok igazolódtak. Azon 3 betegnél, akiknél mind a primer, mind pedig a nyirokcsomó HPV-analízise pozitív eredménnyel zárult megegyező HPV 16-szubtípust tudtunk kimutatni.
A molekulár biológiai eredmények mellé rendelt klinikai, illetve patológiai vizsgálatok során a magas malignitású HPV-pozitív esetek 47%-ában pTa-pT1, míg 53%-ában pT2-pT4 stádiumú lokális folyamatok igazolódtak. A klinikai vizsgálat rámutatott arra, hogy azon 3 beteg, akiknél mind a primer, mind pedig a regionális nyirokcsomó pozitív volt, a primer daganat lokálisan előrehaladott (pT3-pT4), illetve kismedence nyirokcsomó-pozitivitást eredményezett. Mind a 3 betegnél kiterjesztett primer daganat eltávolítását (emasculinisatio) voltunk kénytelenek elvégezni, a rendelkezésre álló staging, illetve patológiai eredmények, a folyamat rapid előrehaladása miatt adjuváns kemoterápiás kezelés lett volna szükséges, azonban a betegek rossz compliance miatt a további onkológiai kezelés nem valósult meg.
A TLR4, P53 és P16ink4a immunhisztológiai vizsgálata hímvessződaganatokban
A TLR4 diffúz kifejeződést mutatott 17 hímvessződaganatban, míg 14 esetben nem találtunk immunreakciót. 16 HPV-pozitív hímvessződaganatból csak 4 mutatott TLR4-pozitivitást, ugyanakkor a 15 HPV-negatív daganatból 13 tumorban találtuk meg a TLR4-gén kifejeződését (1. ábra). A Pearson’s Chi square teszt szignifikans inverz korrelációt mutatott a HPV-pozitivitás és TLR4-immunreakció között (p=0,0006).
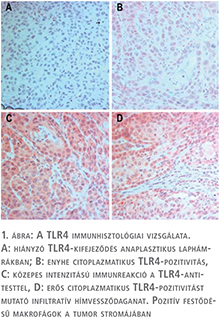

A p53 immunhisztológiai vizsgálata 16 hímvessző-karcinómában közepes vagy erős intenzitású magfestést mutatott. A 16 HPV-pozitív hímvessződaganat közül csak 5 tumor mutatott pozitív festődést a p53 antitesttel. A másik oldalon 15 HPV-negatív tumorból 11-ben (73%) tudtunk erős és diffúz sejtmag-pozitivitást kimutatni (2. ábra). A Pearson’s Chi square teszt szignifikáns korrelációt mutatott a hiányzó HPV-integráció és p53-immunreakció között (p=0,0191).
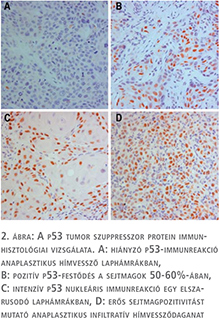

Kifejezett p16INK4a immunreakciót figyeltünk meg 10 hímvessződaganat citoplazmájában, illetve a tumor sejtmagban is. Mindegyik p16INK4a-pozitív malignoma HPV-pozitív volt. Ezzel ellentétben a HPV-negatív hímvessződaganatok nem mutattak p16INK4a-immunreakciót (3. ábra). Pearson’s Chi square teszt szignifikáns korrelációt mutatott a HPV-pozitivitás és a p16INK4a-fehérje kifejeződése között (p=0,0002).
A HPV-integráció és a TLR4, p16INK4a és p53-gének expressziójának összehasonlítása során két tumorcsoportot tudtunk elkülöníteni. A HPV-negatív tumor csoportban 10 hímvessződaganat volt mind TLR4-re mind p53-ra pozitív. A két marker koexpressziója szignifikáns volt (p=0,0198). A HPV-pozitív hímvessződaganatok pozitív immunreakciót mutattak a p16INK4a-antitesttel, míg a HPV-negatív esetekben nem tudtunk P16INK4a-pozitivitást kimutatni. Nemcsak a HPV kimutatása, hanem a három gén kombinált kifejeződése is egyértelműen meghatározta a hímvessződaganat különböző kialakulásának a valószínűségét. A HPV-szubtípus, TLR4, p16ink4a, p53-fehérjék összefüggése, valamint a progresszióval összefüggést mutató gének (EZH2, mTOR es RARRES1) kifejeződése a 2. táblázatban tekinthető meg.
Tumorprogresszióhoz társuló markerek immunhisztológiája
Számos tumorprogresszióhoz társított marker közül kiválasztottuk azokat, amelyeket még nem, vagy csak ritkán néztek meg hímvesszőtumorokban. Az EZH2 diffúz kifejeződést mutatott 17 hímvessződaganatban, míg 14 esetben nem találtunk immunreakciót. A 9 progressziót mutató hímvessződaganat közül 8 volt pozitív EZH2-re (90%), míg a 22 nem progrediáló hímvessződaganatból csak 8 esetben találtunk EZH2-pozitivitást. Érdemes megemlíteni, hogy a 14 EHZ2-negatív esetből csupán egyetlen hímvessződaganat progrediált. Az EZH2-immunreakció és a hímvessződaganat progressziója a Fisher’s Exact Teszt alapján szignifikáns összefüggést mutatott ki (p=0,021).
A humán makrofág metalloproteináz MMP12 a legtöbb hímvesszőtumorban kifejeződött, csak 7 tumor volt negatív. A jobban differenciált elszarusodó laphámrákok többnyire MMP12-negatívok voltak. A tumorsejtek pozitivitása az enyhe festődéstől az erősen pozitív citoplazmatikus immunreakcióig változott. A 24 MMP12-pozitív esetből 9 hímvessződaganat progrediált (38%), míg a 7 negatív tumor remisszióban maradt. A tumorok stromájában különböző számban fordultak elő makrofágok, amelyek MMP12-pozitivitást mutattak. A statisztika nem mutatott összefüggést az MMP12-pozitivitás és a hímvesszőtumorok progressziója között.
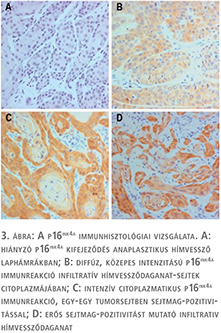
Diffúz mTOR-pozitivitást találtunk 21 hímvessződaganatban. A pozitív festődés nem függött össze a tumorok szövettani típusával, a pozitív esetek közt mind anaplasztikus vagy jól differenciált elszarusodó laphámrák is előfordult. A 16 HPV-pozitív tumorból 10 mTOR-pozitív volt, ami ugyan nem szignifikáns, de valamilyen összefüggést sejtet (4. ábra). A 21 mTOR-pozitív tumorból 9 progrediált 12 pedig remissziót mutatott. Nem találtunk szignifikáns összefüggést az mTOR-pozitivitás és p53-pozitivitás között. Ellenben az mTOR expressziója és a tumorok progressziója közt szignifikáns összefüggést tudtunk kimutatni (p=0,012).
A mi anyagunkban a mindennapi rutinban használt és megbízhatóan működő E-cadherin és vimentin antitestet is megvizsgáltuk. A 31 hímvessző-karcinómából csak 5 esetben figyeltünk meg E-cadherin pozitivitást.
RARRES1-pozitivitást találtunk 16 hímvessződaganatban, 7 esetben erős immunreakciót figyeltünk meg a stromát infiltráló immunsejtekben. A RARRES1-pozitivitás nem függött össze a tumorok szövettani típusával, a pozitív esetek közt mind anaplasztikus vagy jól differenciált elszarusodó laphámrák is előfordult. A 16 HPV-pozitív tumorból mindössze 5 mutatott pozitív immunreakciót, míg a 15 HPV-negatív tumorból 11-ben találtunk RARRES1-pozitivitást Szignifikáns összefüggés volt a hímvessződaganatok progressziója és a RARRES1-gén kifejeződése között (p=0,045) (2. táblázat).
Megbeszélés
Mind a HPV-asszociálta, mind pedig a HPV-független mechanizmus a malignus hímvessző-elváltozás folyamat irányába vezethet, különbözve abban, hogyan aktiválja a már jól ismert vírus onkogéneket (E6 és E7), vagy direkt módon aktivál tumor szuppresszor gén inaktiváló mechanizmusokat. Néhány tanulmány összefüggést vélt felfedezni a primer tumor HPV-fertőzés státusza és a daganatos betegség progressziója között. A HPV-pozitív és -negatív tumorok túlélési adatai között egyes tanulmányok szignifikáns különbséget tudtak kimutatni a HPV-pozitív tumorok javára, azonban ezzel ellentétes tanulmányok is megjelentek, amelyek nem tudtak kimutatni szignifikáns különbséget a HPV-pozitív és -negatív tumorok túlélési adatai között. Az első sikeres klinikai eredmények – az európai adatokkal hasonló módon – egyértelműen igazolták a HPV jelenlétét (55,4%) a hímvessződaganatokban, valamint a daganatokkal egy időben eltávolított regionális nyirokcsomókban (4). Az általunk elvégzett klinikai vizsgálatok az európai eredményekkel korrelálnak, a vizsgálati anyagban a HPV 16-szubtípus 76,92%-ban volt jelen, amely a méhnyakrákban a közép és kelet európai régióban vizsgált nő populációban előforduló HPV 16-os szubtípus arányának megfelelő. A HPV-pozitív esetek 53%-ában magas malignitású lokális patológiai stádiumba sorolhatók, ezen felül azon 3 beteg, akiknél mind a primer tumor, mind pedig az eltávolított nyirokcsomóblokk is pozitívnak bizonyult pT3-pT4 besorolást kapott. Következtetésként levonható, hogy a HPV-asszociálta hímvessző malignus daganatok kórlefolyása a HPV-negatív esetekhez képest rosszabb, illetve a nyirokcsomó-pozitivitás esetén különösképpen rapid lefolyású.
Vizsgálataink során először mutattuk ki a HPV genomikus integrációja és a toll like receptor 4 (TLR4) közötti szignifikáns inverz korrelációt (p=0,003). Eredményünk felveti a TLR4 protektív szerepet a HPV-infekcióval szemben. A szervezet immunrendszerének jelentős szerepe van a vírusinfekciók kivédésében. Erre utal az a tény is, hogy a HPV-pozitív méhnyakrák előfordulása sokkal gyakoribb immunszuppresszált egyénekben. A toll like receptoroknak jelentős szerepük van a természetes immunreakciók kiváltásában vírusinfekciók, köztük HPV-infekció esetében (5). Összesen 11 hasonló szerkezetű transzmembrán jelátvivő receptor TLR ismert. Amennyiben a TLR felismer egy idegen antigént, mint pl. egy vírus, aktiválja az NF-kB szignálrendszert és a gyulladásos citokinek valamint a természetes immunrendszer-fehérjék kifejeződéséhez vezet (6). Elmondhatjuk, hogy ellentétben az E6 és E7 vírus onkogénekkel a TLR4 szignál átvivő rendszer az immunreakciók megerősítéséhez vezet. Talán a TLR4 szerepét a HPV-infekcióval szemben akkor értjük meg a legjobban, ha figyelembe vesszük azt a tényt, hogy az esetek igen nagy többségében a HPV csak átmenetileg fertőzi meg a hámsejteket és csak kevés személyben alakul ki krónikus infekció (7). A HPV-infekció esetén a TLR4 aktiválása az azonnali, nem specifikus természetes immunreakcióhoz vezet, az adaptív immunreakció csak később és lassan alakul ki (8). Az azonnali természetes immunreakció attól függ, hogy a sejt azonosítani tudja a patogén vírust, mint idegen ágenst. A TLR-k jelfelismerő receptorok, amelyek felismerik a patogén mikrobák konzervált komponenseit és elindítják az természetes immunreakciót. A TLR4 felismeri a Gram-negatív baktériumok endotoxinját, a vírusokat, heat shock proteint, extracellular matrix komponenseket (9). A HPV felismerése esetén a TLR4 közvetített szignál az NFkB-n keresztül a gyulladásos citokinek és természetes immunrendszer fehérjék kifejeződéséhez vezet (10). Érdekes megemlíteni a TLR4 védő szerepével kapcsolatban a HPV16 gyakori előfordulását magas kockázatú vírusok közül. HPV-pozitív eseteink közül a HPV16 a tumorok 76,92%-ában fordult elő, míg a HPV51, HPV52 es HPV82 csak egy-egy esetben volt megfigyelhető. Ezt a különbséget azzal lehet megmagyarázni, hogy a HPV16 képes bizonyos esetekben a természetes immunreakciót kikapcsolni a TLR4 kifejeződés manipulálásával, és így a fertőzött sejtben tartósan megmarad, ami a genomikus beépülés egyik feltétele (11). Erre utal az a megfigyelés is, hogy a HPV16 mintegy 50-szer gyakrabban fertőzi meg krónikusan a cervix hámsejteket, mint az egyéb magas rizikójú HPV-típusok (12). A fej-nyaki laphámrákokban, hasonlóan a mi eseteinkhez, a TLR4 csökkent kifejeződését figyelték meg azokban a tumorokban, amelyekben a HPV-integrációt ki tudták mutatni (13). Vizsgálataink hasonló eredményhez vezettek a hímvessződaganatban, a TLR4 kifejeződése egy szignifikáns inverz asszociációt mutatott a HPV-pozitivitás tekintetében (p=0,0006). Összefoglalva elmondhatjuk, hogy a TLR4 expressziójának jelentős szerepe van a HPV-vírusinfekció leküzdésében.
Következtetés
Összefoglalva, először mutattuk be a HPV-fertőzés és a TLR4-expresszió közötti különbséget a hímvessződaganatban. A megnövekedett TLR4-expresszió HPV-negatív tumorokat jelöl, a p16INK4a-expresszió fokozódása pedig HPV-pozitív hímvessződaganatos betegekben jelentkezik. Adataink arra utalnak, hogy a TLR4-receptor expressziója megvédi a vírusfertőzés tartós fennállását. A HPV-fertőzés és annak a p53-expresszióval való inverz kapcsolata a HPV-hez nem kapcsolódó patogenézisre utal. Vizsgálataink alapján az alábbi következtetésre jutottunk:
n A hímvessződaganatokban mintegy 76,92%-ban a HPV 16-os szubtípus integrációnak van kóroki szerepe. A 2008-ban FED-engedélyt kapott férfi populáció bivalens és quadrivalens oltóanyagainak alkalmazása a fenti klinikai vizsgálat tükrében feltétlenül indokolt lenne, hiszen régiónkban a HPV 16/18-as típusok előfordulása messze gyakoribb az egyéb non-HPV 16/18-as típusokhoz képest.
- A rutin patológiai vizsgálatok során fel lehet használni a p16-pozitivitást a HPV-integráció gyanújának felvetésére.
- Elsőként mutattuk ki, hogy a TLR4-receptort kifejező hámsejtek sokkal ellenállóbbak a krónikus HPV-infekcióval és így a HPV integrációjával szemben. A HPV- és p16-pozitivitás egy virális patomechanizmust, míg a TLR4 valamint a p53 kifejeződése egy non-virális tumor keletkezést támaszt alá.
- Az mTOR, EZH2 és RARRES1 immunhisztológiai kifejeződése szignifikáns korrelációt mutat a hímvessződaganatok progressziójával.
- Az mTOR a hímvessződaganatok két harmadában (66%) kifejeződik, így az mTOR-pozitivitás esetén fel lehet vetni az mTOR-gátlók terápiás alkalmazásának lehetőségét.
References
1. Dillner J, et al. Etiology of squamous cell carcinoma of the penis. Scand J Urol Nephrol 2000; (Suppl): 189. https://doi.org/10.1080/00365590050509913
2. Rubin MA, Kleter B, Zhou M, Ayala G, Cubilla AL, Quint WGV, Pirog EC. Detection and Typing Human Papillomavirus DNA in Penile Carcinoma (Evidence for multiple independent pathqays of penile carcinogenesis). American Journal of Pathology 2001; 159(4): 1211–1218. ISSN 0002-9440. https://doi.org/10.1016/S0002-9440(10)62506-0
3. EAU Guidlines 2017.
4. Heidman DA, Waterboer T, Pawlita M. Human papillomavirus 16 is the predominant type etiologically involvedin penile squamous cell carcinoma. Journal of clinical Oncology 2007; 25(29): 4550–4556. ISSN 2218–333. https://doi.org/10.1200/JCO.2007.12.3182
5. Daud 11, Scott ME, Ma Y, Shiboski S, Farhat S, Moscicki AB. Association between toll-like receptors expression and human papillomavirus type 16 persistence. Int J Cancer 2011; 128: 879–886. https://doi.org/10.1002/ijc.25400
6. Carpenter S, O Neill LAJ. How important are Toll-like receptors for antimicrobial responses? Cellular Microbiology 2007; 9: 1891–1901. https://doi.org/10.1111/j.1462-5822.2007.00965.x
7. Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, Snijders PJ, Peto J, Meijer CJ and Munoz N. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 1999; 189: 12–19. https://doi.org/10.1002/(SICI)1096-9896(199909)189:1<12::AID-PATH431>3.0.CO;2-F
8. Frazer IH. Interaction of human papillomaviruses with the host immune system: a well evolved relationship. Virology 2009; 384: 410–414. https://doi.org/10.1016/j.virol.2008.10.004
9. Damasdi M, Kovacs K, Farkas N, Jakab F, Kovacs G Down-regulation of Toll-like Receptor TLR4 Is Associated with HPV DNA Integration in Penile Carcinoma. Anticancer Res. 2017 Oct; 37 (10): 5515-5519
Leave a Reply
You must be logged in to post a comment.