Efficacy of neoadjuvant hormonal treatment before radical prostatectomy for locally advanced high-risk prostate carcinomas
DOI: 10.22591/magyurol.2019.1.berczics.3
Authors:
Berczi Csaba dr., Kiss Zoltán dr., Flaskó Tibor dr.
Debreceni Egyetem Általános Orvostudományi Kar, Urológiai Tanszék, Debrecen (igazgató: Flaskó Tibor dr.)
Summary
Aims: To measure the efficacy of neoadjuvant hormonal treatment before radical prostatectomy in patients with locally advanced high-risk prostate carcinomas.
Methods: From January 1996 to January 2018, 105 patients underwent radical prostatectomy for locally advanced high-risk prostate cancer. In Group 1 the patients received neoadjuvant hormonal therapy (n: 37), while in Group 2 the patients didn’t receive neoadjuvant hormonal treatment (n:68). In Group 1, the mean age of the patients was 64.1±6.8 years and the mean PSA level was 31.5 ng/ml. In Group 2, the mean age of the patients was 63.7±6.3 years, and the mean PSA concentration was 20.5 ng/ml. In all cases the preoperative radiological examinations showed locally advanced tumor.
Results: Histology showed locally advanced tumor (pT3) in 8 cases (21.6%) in Group 1, and in 41 patients (60.2%) in Group 2 (p=0.073). Margin positivity was detected in 8 occasions (21.6%) in Group 1, while it was present in 28 cases (41.7%) in Group 2 (p=0.043).
The median follow-up period was 58 month. In Group 1, biochemical progression developed in 8 patients (21.6%), local recurrence in 1case (2.7%) and distant metastasis in 3 occasions (8.1%) during this period. In Group 2, biochemical progression was diagnosed in 12 cases (17.6%), local recurrence in 3 patients (4.4%) and distant metastasis in 1 occasion (1.4%).
There were no significant deviations in these parameters in the two groups. Tumor specific mortality didn’t occur during the follow-up period.
Conclusions: The results showed that the neoadjuvant hormonal therapy provides better – but not significantly better – local tumor control in locally advanced high-risk prostate carcinomas. However, the neoadjuvant hormonal therapy didn’t prove any advantage according to tumor progression.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 1. SZÁM
Összefoglalás
Cékitűzés: A neoadjuváns hormonkezelés hatékonyságának vizsgálata a lokálisan előrehaladott magas rizikójú prosztatatumorok esetében végzett radikális prostatectomiák során.
Módszer: A tanulmányban a 1996.01.01 és 2018.01.01. között, a klinikailag lokálisan előrehaladott magas rizikójú prosztatadaganat miatt radikális prostatectomián átesett 105 beteg adatai kerültek feldolgozásra. Az 1. csoportba (n: 37) tartozó betegek a műtét előtt neoadjuváns hormonkezelést kaptak. A 2. csoportba sorolt betegek (n: 68) nem részesültek hormonkezelésben. Az 1. csoportban az átlagos életkor 64,1±6,8 év, míg az átlagos PSA-szint 31,5 ng/ml. A 2. csoportban az átlagos életkor 63,7±6,3 év, míg az átlagos PSA-szint 20,5 ng/ml volt. Valamennyi esetben a műtét előtt elvégzett képalkotó-vizsgálat lokálisan előrehaladott tumort mutatott.
Eredmények: A szövettani vizsgálat az 1. csoportban, 8 esetben (21,6%), míg a 2. csoportban, 41 alkalommal (60,2%) igazolt lokálisan előrehaladott (pT3) daganatot (p=0,073). Margin-pozitivitás az 1. csoportban, 8 esetben (21,6%), míg a 2. csoportban, 28 betegben (41,7%) fordult elő (p=0,043).
A medián 58 hónapos utánkövetés alatt az 1. csoportban biokémiai progressziót 8 (21,6%), lokális recidívát 1 (2,7%), míg távoli metasztázist 3 (8,1%) betegben diagnosztizáltak.
A 2. csoportban biokémiai progresszió 12 (17,6%), lokális recidíva 3 (4,4%), míg távoli metasztázis 1 (1,4%) esetben fordult elő. Ezen vizsgált mutatókban a két csoport között nem volt szignifikáns eltérés. Tumorspecifikus mortalitás egyik csoportban sem fordult elő.
Következtetések: Az eredmények alapján a klinikailag lokálisan előrehaladott magas rizikójú prosztatadaganatok esetében a neoadjuváns hormonkezelés jobb, de nem szignifikánsan jobb lokális tumorkontrollt biztosított. A későbbi tumorprogresszió szempontjából a neoadjuváns hormonkezelés nem nyújtott lényeges előnyt.
Bevezetés
A prosztatakarcinóma a férfiakban leggyakrabban előforduló rosszindulatú daganatos megbetegedés. Míg az alacsony és a közepes rizikójú prosztatatumorok jól kezelhetőek, addig a magas rizikójú daganatok terápiája még nem teljesen megoldott. Jelenleg a magas rizikójú prosztatadaganatok kezelése során mind a hormonkezeléssel kombinált sugárkezelés, mind pedig a multimodális kezelés eredményesen alkalmazható (1–6). A multimodális terápia során a radikális prostatectomiát követően a szövettani eredménytől és a műtét utáni PSA-szinttől függően adjuváns vagy salvage sugárkezelést alkalmazhatunk. A definitív sugárkezeléssel kapcsolatban a randomizált klinikai vizsgálatok eredményei azt mutatták, hogy az irradiáció mellett adott hormonkezelés – különösen a hosszan tartó hormonkezelés – javítja az onkológiai eredményességet (7–11). A radikális prostatectomia előtt alkalmazható neoadjuváns hormonkezeléssel kapcsolatos álláspontok jelenleg nem egyértelműek. Az Európai Urológus Társaság módszertani levele alapján a neoadjuváns hormonkezelés alkalmazása nem javasolt a magas rizikójú prosztatadaganatok miatt végzett radikális műtét előtt. Ugyanakkor több vizsgálat eredménye azt mutatta, hogy a neoadjuváns hormonkezelés mellett jobb a lokális tumorkontroll. A neoadjuváns hormonkezelés eredményessége a tumorprogresszió gyakoriságának csökkentése és a tumorspecifikus túlélés javításának szempontjából egyelőre nem igazolt a multimodális kezelés során (3).
Jelen tanulmányunkban vizsgáltuk a magas rizikójú, lokálisan előrehaladott prosztatadaganatos betegekben végzett radikális prostatectomiák előtt adott neoadjuváns hormonkezelés eredményességét. Vizsgáltuk a neoadjuváns hormonkezelés utáni radikális prostatectomiák szövettani feldolgozása során a lokálisan előrehaladott daganat és a sebészi szél tumoros infiltrációjának gyakoriságát. Elemeztük az utánkövetés során a biokémiai progresszió, valamint a lokális tumorrecidíva és távoli áttét kialakulásának gyakoriságát a neoadjuváns hormonkezelést kapott és nem kapott csoportban.
Betegek és módszerek
A DE Urológiai Klinikáján 1996.01.01. és 2018.01.01. között 105 betegben végeztünk radikális prostatectomiát klinikailag lokálisan előrehaladott magas rizikójú prosztatadaganat miatt. A prosztatadaganatok magas rizikócsoportba való besorolása az Európai Urológus Társaság (EAU) erre vonatkozó beosztása szerinti történt.
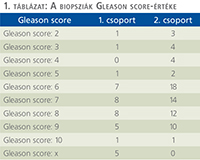
A prosztata-biopsziák szövettani vizsgálata során a Gleason grade rendszert alkalmaztuk (1. táblázat).
A magas rizikójú daganatos betegekben, valamennyi esetben képalkotó-vizsgálatot végeztünk a tumor helyi kiterjedtségének meghatározása céljából. Korábban CT, majd a későbbiekben, amikor már volt lehetőségünk MRI-vizsgálatok elvégzésére, MRI-vizsgálatokat végeztünk. Az eltelt időtartam alatt különböző típusú és érzékenységű CT- és MRI-készüléket használtunk klinikánkon. Több alkalommal azonban a beteg más kórházból hozta magával a CT vagy MRI eredményét. A klinikánkon végzett MRI-vizsgálatok 2015.09.01-ig 1 Teslás érzékenységű készülékkel, míg azt követően 3 Teslás készülékkel végezték. Az endorectalis MR-vizsgálatok 1 Teslás készülékkel történtek.
A klinikailag lokálisan előrehaladott magas rizikójú tumoros betegeket két csoportba soroltuk.
- Az 1. csoportba (n: 37) tartozó betegek a műtét előtt neoadjuváns hormonkezelést kaptak.
- A 2. csoportba sorolt betegek (n:68) nem részesültek hormonkezelésben az operáció előtt.
Az 1. csoportban az átlagos életkor 64,1±6,8 év, míg az átlagos PSA-szint 31,5 ng/ml. A 2. csoportban az átlagos életkor 63,7±6,3 év, míg az átlagos PSA-szint 20,5 ng/ml volt. A neoadjuváns hormonkezelés időtartama 3 és 6 hónap között változott.
Valamennyi esetben a műtét előtt végzett képalkotó-vizsgálat lokálisan előrehaladott tumort mutatott. A műtét előtti kivizsgálás során az 1. csoportban a CT-vizsgálat 6 betegben, kismedencei MRI 25 esetben, míg az endorectalis MRI 7 alkalommal mutatott cT3 stádiumú daganatot. A preoperatív kivizsgálás alkalmával a 2. csoportban a CT-vizsgálat 11 betegben, kismedencei MRI 46 esetben, s az endorectalis MRI 12 alkalommal mutatott lokálisan előrehaladott tumort. Mindkét csoportban volt egy-egy olyan beteg, akinek előbb CT-, majd MRI-vizsgálatot is végeztek, és ezt követően utalták klinikánkra.
Az elvégzett képalkotó-vizsgálatok távoli áttétet egyik betegben sem mutattak.
A radikális prostatectomiát az 1. csoportban, 28 esetben laparoszkópos és 9 betegben nyílt műtéti feltárással végeztük. A 2. csoportban a beavatkozás 53 alkalommal laparoszkópos, míg 15 esetben nyílt műtéti feltárással történt.
A szövettani stádium meghatározása a 2009. UICC TNM-rendszer szerint történt retrospektíve.
A műtétet követően az aktuális kezelési protokoll szerint obszervációt, adjuváns irradiációt, salvage irradiációt és hormonkezelést alkalmaztunk.
A betegek utánkövetése során PSA-vizsgálat az első 3 évben 3 havonta, azt követően az 5. évig 6 havonta, majd ezután évente történt. Képalkotó-vizsgálatot (CT, MRI, csontizotóp- vizsgálat) PSA-emelkedés vagy a beteg panaszai végeztünk. A biokémiai progressziót úgy definiáltuk, hogy olyan PSA-emelkedés, amely 0,2 ng/ml fölé történt (legalább 2 alkalommal).
Az átlagadatok mellett ± standard deviációt adtuk meg. A statisztikai analízist Student-féle t-próbával végeztük. A 0,05-nél kisebb p-értékeket tekintettük szignifikánsnak.
Eredmények
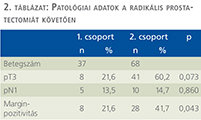
Az 1. csoportban a szövettani vizsgálat 8 esetben (21,6%) igazolt lokálisan előrehaladott (pT3) daganatot, 5 alkalommal (13,5%) a nyirokcsomók tumoros infiltrációját (pN1) és 8 betegben (21,6%) margin-pozitivitást mutatott (2. táblázat). A 2. csoportban pT3 stádiumú tumort 41 alkalommal (60,2%), nyirokcsomó-pozitivitást 10 (14,7%), míg a sebészi szél tumoros beszűrtségét 28 betegben (41,7%) észlelte a hisztológiai vizsgálat. A lokálisan előrehaladott prosztatakarcinóma lényegesebben gyakrabban fordult elő a neoadjuváns hormonkezelést nem kapott csoportban, de az eltérés nem volt szignifikáns (p=0,073). A nyirokcsomó-pozitivitás hasonló mértékben volt jelen mindkét csoportban (p=0,86). A margin-pozitivitás szignifikánsan ritkábban fordult elő a neoadjuváns hormonkezelést kapott betegekben (p=0,043).
A betegek átlagos utánkövetése 58±48 hónap volt.
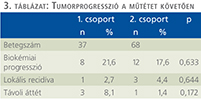
Az átlagosan csaknem 5 éves utánkövetési idő alatt az 1. csoportban biokémiai progressziót 8 (21,6%), lokális recidívát 1 (2,7%), míg távoli metasztázist 3 (8,1%) betegben diagnosztizáltunk (3. táblázat). A 2. csoportban biokémiai progresszió 12 (17,6%), lokális recidíva 3 (4,4%), míg távoli metasztázis 1 (1,4%) esetben fordult elő. Ezen vizsgált mutatókban a két csoport között nem volt szignifikáns eltérés.
A betegek utánkövetése alatt tumorspecifikus mortalitás egyik csoportban sem fordult elő.
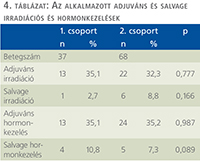
A magas rizikójú prosztatadaganatos betegek esetében az aktuális protokollnak megfelelően a beteg-compliance és preferencia figyelembevételével obszervációt, adjuváns irradiációt, salvage irradiációt és hormonkezelést alkalmaztunk (4. táblázat). Az 1. csoportban adjuváns és salvage sugárkezelés az esetek 35,1 és 2,7%-ában, míg a 2. csoportban a betegek 32,3%-ában és 8,8%-ában történt. A radikális prostatectomia után adjuváns és salvage hormonkezelést az 1. csoportban az esetek 35,1% és 10,8%-ában, míg a 2. csoportban a betegek 35,2 és 7,3%-ában alkalmaztunk.
Megbeszélés
Az irodalmi adatok alapján az újonnan felfedezett prosztatadaganatos betegek 5-15%-ában fordul elő lokálisan előrehaladott tumor (12, 13).
A lokálisan előrehaladott, magas rizikójú prosztatadaganatos betegek kuratív ellátására a hagyományos kezelési lehetőség a sugárkezelés és emellett hormonterápia.
Jelenleg nincs olyan randomizált klinikai tanulmány, amely a lokálisan előrehaladott prosztatadaganatok kezelése során összehasonlítaná a radikális prostatectomia és a sugárkezeléssel kombinált hormonterápia eredményességét. Boorjian és munkatársai több retrospektív vizsgálat analízise során azt találták, hogy a radikális prostatectomia után (ha az a multimodális kezelés részeként volt alkalmazva) a 10 éves általános túlélés jobb, mintha a beteg irradiációt és hormonkezelést kapott (14–17). Az utóbbi időben a lokálisan előrehaladott prosztatadaganatoknál – különösen a fiatal, egészséges, kis volumenű tumorral rendelkező betegekben – egyre jobban előtérbe kerül a multimodális kezelés, amely a radikális prostatectomia és a sugárkezelés kombinációját foglalja magába (13, 18).
Célszerű azonban figyelembe venni, hogy a klinikailag lokálisan előrehaladott tumor diagnózisa a képalkotó-vizsgálatokon alapszik, amelyek érzékenysége még nem teljesen megbízható. Így a kivizsgálás alkalmával végzett képalkotó-vizsgálatok során nemcsak „down staging”, hanem „overstaging” is előfordulhat. Az EORTC 30001 vizsgálat során azt tapasztalták, hogy az eredetileg lokálisan előrehaladott daganat miatt végzett műtét után a szövettan az esetek 43,8%-ában szervre lokalizált tumort mutatott (19). Ward és munkatársai a cT3 stádiumú prosztatakarcinómák miatt végzett radikális prostatectomiák után 27%-ban közöltek pT2 stádiumú daganatot (20). Saját anyagunkban a neoadjuváns hormonkezelést nem kapott csoportban a végleges szövettan szerint szervre lokalizált tumor az esetek 39,8%-ában fordult elő. Így betegeink jelentős részében is a képalkotó-vizsgálatok szempontjából „overstaging” volt észlelhető.
A lokálisan előrehaladott tumor miatt végzett radikális prostatectomiák során alkalmazott neoadjuváns hormonkezeléssel kapcsolatos vélemények megoszlanak. A legtöbb ezzel kapcsolatos publikáció eredményei szerint bár a lokális tumorkontroll javul, de a neoadjuváns hormonkezelés a progressziómentes túlélés és az általános túlélés szempontjából nem nyújt előnyt (21–23). Ugyanakkor a Cochrane-adabázisban megjelent metaanalízis szerint a tumorkiújulás szignifikánsan csökkent a neoadjuváns hormonkezelés mellett (24).
A lokálisan előrehaladott prosztatadaganatokban a neoadjuváns hormonkezelés segíthet a daganat operábilissá válásában, hogy a lokális tumorkontroll javuljon. McKay és munkatársai 10 klinikai vizsgálatot áttekintő metaanalízisükben arról számoltak be, hogy a neoadjuváns hormonkezelés után szignifikánsan csökken a daganat patológiai T-stádiuma, növekszik a szervre lokalizált tumorok aránya, csökken a margin-pozitív esetek száma és csökken a nyirokcsomó-áttétek száma (25).
A Southwest Oncology Group Study 9109 során a neoadjuváns hormonkezelés hatását vizsgálták klinikailag T3- és T4-stádiumú betegekben. Úgy találták, hogy a műtétet követően 56%-ban volt szervre lokalizált daganat, míg a sebészi szél pozitivitása az esetek 26%-ában volt kimutatható. A 10 éve progressziómentes túlélés 40%, míg a 10 éves általános túlélés 68% volt (26).
Hsu és munkatársai több vizsgálatuk során arról számoltak be, hogy a cT3-stádiumú prosztatadaganatos betegekben végzett radikális prostatectomiát követően a 10 éves biokémiai progressziómentes túlélés, a klinikai progressziómentes túlélés, a tumorspecifikus túlélés, valamint az általános túlélés szempontjából a daganat differenciáltsága, a margin-pozitivitás, valamint a nyirokcsomóstátusz volt szignifikáns prognosztikai tényező (27–29).
Saját anyagunkban a neoadjuváns hormonkezelés mellett szignifikánsan csökkent a margin-pozitív esetek száma, de a tumorprogresszió szempontjából szignifikáns eltérést nem tapasztaltunk a másik csoporthoz viszonyítva.
Figyelembe véve, hogy több tanulmányban úgy találták, hogy a lokálisan előrehaladott daganatokban a neoadjuváns hormonkezelés mellett javul a lokális tumorkontroll, így ez elméletileg hathat a prognosztikai faktorokra is. Ugyanakkor ilyen esetekben a neoadjuváns hormonkezelés eredményessége a tumorprogresszió szempontjából jelenleg nem bizonyított.
Következtetések
Összegzésül megállapíthatjuk, hogy az eredmények alapján a klinikailag lokálisan előrehaladott magas rizikójú prosztatadaganatok miatt végzett radikális prostatectomiák esetében a neoadjuváns hormonkezelés jobb, de nem szignifikánsan jobb lokális tumorkontrollt biztosított. A későbbi tumorprogresszió szempontjából a neoadjuváns hormonkezelés nem nyújtott lényeges előnyt. A neoadjuváns hormonkezelést követően nem csökkent az alkalmazott adjuváns és salvage kezelések száma sem.
References
1. Berczi Cs, Kiss Z, Flaskó T. A radikális prostatectomia hatékonysága a magas rizikójú prosztata daganatok kezelésére. Magyar Urológia 2018; 2: 55–59. https://doi.org/10.22591/magyurol.2018.2.berczics.55
2. Feldman AS, Meyer CP, Sanchez A, Krasnova A, Reznor G, Menon M, Kibel AS, Choueiri TK, Lipsitz SR, Sun M, Trinh QD. Morbidity and Mortality of Locally Advanced Prostate Cancer: Population Based Analysis Comparing Radical Prostatectomy versus External Beam Radiation. J Urol 2017 Nov; 198(5): 1061–1068. https://doi.org/10.1016/j.juro.2017.05.073
3. Froehner M, Wirth MP. Locally advanced prostate cancer: optimal therapy in older patients. Drugs Aging 2013 Dec; 30(12): 959–67. https://doi.org/10.1007/s40266-013-0123-7
4. Jani AB. Management strategies for locally advanced prostate cancer. Drugs Aging. 2006; 23: 119–29. https://doi.org/10.2165/00002512-200623020-00003
5. Joniau SG, Van Baelen AA, Hsu CY, Van Poppel HP. Complications and functional results of surgery for locally advanced prostate cancer. Adv Urol 2012; 2012: 706309. https://doi.org/10.1155/2012/706309
6. Wirth MP, Hakenberg OW, Froehner M. Optimal treatment of locally advanced prostate cancer. World J Urol 2007; 25: 169–76. https://doi.org/10.1007/s00345-007-0158-7
7. Denham JW, Steigler A, Lamb DS , Joseph D, Turner S, Matthews J, Atkinson C, North J, Christie D, Spry NA, Tai KH, Wynne C, D’Este C. Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 2011; 12(5): 451–9. https://doi.org/10.1016/S1470-2045(11)70063-8
8. Fossa SD, Wiklund F, Klepp O, Angelsen A, Solberg A, Damber JE, Hoyer M, Widmark A, The Scandinavian Prostate Cancer Group-7 Investigators. Ten- and 15-yr Prostate Cancer-specific Mortality in Patients with Nonmetastatic LocallyAdvanced or Aggressive Intermediate Prostate Cancer, Randomized to Lifelong EndocrineTreatment Alone or Combined with Radiotherapy: Final Results of The Scandinavian Prostate Cancer Group-7. Eur Urol 2016 Oct; 70(4): 684–691. https://doi.org/10.1016/j.eururo.2016.03.021
9. Horwitz EM, Bae K, Hanks GE Porter A, Grignon DJ, Brereton HD, Venkatesan V, Lawton CA, Rosenthal SA, Sandler HM, Shipley WU. Ten-year follow-up of radiation therapy oncology group protocol 92-02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J Clin Oncol 2008; 26(15): 2497–504. https://doi.org/10.1200/JCO.2007.14.9021
10. Mottet N, Peneau M, Mazeron JJ, Molinie V, Richaud P. Addition of radiotherapy to long-term androgen deprivation in locally advanced prostate cancer: an open randomised phase 3 trial. Eur Urol 2012;62:213–9. https://doi.org/10.1016/j.eururo.2012.03.053
11. Sridharan S, Dal Pra A, Catton C, Bristow RG, Warde P. Locally advanced prostate cancer: current controversies and optimisation opportunities. Clin Oncol (R Coll Radiol). 2013 Aug; 25(8): 499–505. https://doi.org/10.1016/j.clon.2013.04.004
12. Center MM, Jemal A, Lortet-Tieulent J, Ward E, Ferlay J, Brawley O, Bray F. International variation in prostate cancer incidence and mortality rates. Eur Urol 2012 Jun; 61(6): 1079–92. https://doi.org/10.1016/j.eururo.2012.02.054
13. Faria EF, Carvalhal GF, Vieira RA, Silva TB, Mauad EC, Tobias-Machado M, Carvalho AL. Comparison of clinical and pathologic findings of prostate cancers detected through screening versus conventional referral in Brazil. Cooperative Brazilian Uro-oncology Group (CBUG). Clin Genitourin Cancer 2011 Dec; 9(2): 104–8. https://doi.org/10.1016/j.clgc.2011.06.004
14. Bolla M, Van Poppel H, Collette L, van Cangh P, Vekemans K, Da Pozzo L de Reijke TM, Verbaeys A, Bosset JF, van Velthoven R, Colombel M, van de Beek C, Verhagen P, van den Bergh A, Sternberg C, Gasser T, van Tienhoven G, Scalliet P, Haustermans K, Collette L; European Organisation for Research and Treatment of Cancer, Radiation Oncology and Genito-Urinary Groups. Department of Radiation Oncology, Centre Hospitalier Universitaire A Michallon, Grenoble, France. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet 2012; 380: 2018–2027. https://doi.org/10.1016/S0140-6736(12)61253-7
15. Boorjian SA, Karnes RJ, Viterbo R, Rangel LJ, Bergstralh EJ, Horwitz EM, Blute ML, Buyyounouski MK. Long-term survival after radical prostatectomy versus external-beam radiotherapy for patients with high-risk prostate cancer. Cancer. 2011 Jul 1; 117(13): 2883–91. https://doi.org/10.1002/cncr.25900
16. Lange PH. Is surgery good for advanced localised prostate cancer? It’s time to find out! Eur Urol 2007; 51: 873–875. https://doi.org/10.1016/j.eururo.2006.09.044
17. Thompson IM Jr, Tangen CM, Paradelo J, Lucia MS, Miller G, Troyer D, Messing E, Forman J, Chin J, Swanson G, Canby-Hagino E, Crawford ED. Adjuvant radiotherapy for pathologicallyadvanced prostate cancer: a randomised clinical trial. J Am Med Assoc 2006; 296: 2329–2335. https://doi.org/10.1001/jama.296.19.2329
18. Lowrance WT, Elkin EB, Yee DS, Feifer A, Ehdaie B, Jacks LM, Atoria CL, Zelefsky MJ, Scher HI, Scardino PT, Eastham JA. Locally advanced prostate cancer: a population-based study of treatment patterns. BJU Int. 2012 May; 109(9): 1309–14. https://doi.org/10.1111/j.1464-410X.2011.10760.x
19. Van Poppel H, Vekemans K, Da Pozzo L, Bono A, Kliment J, Montironi R, Debois M, Collette L. Radical prostatectomy for locally advanced prostate cancer: results of a feasibility study (EORTC30001). Eur J Cancer 2006 May; 42(8): 1062–7. https://doi.org/10.1016/j.ejca.2005.11.030
20. Ward JF, Slezak JM, Blute ML, Bergstralh EJ, Zincke H. Radical prostatectomy for clinically advanced (cT3) prostate cancer since the advent of prostate-specific antigen testing: 15-year outcome. BJU Int 2005 Apr; 95(6): 751–6. https://doi.org/10.1111/j.1464-410X.2005.05394.x
21. Gleave ME, Goldenberg SL, Chin JL, Warner J, Saad F, Klotz LH, et al. Randomized comparative study of 3 versus 8-month neoadjuvant hormonal therapy before radical prostatectomy: biochemical and pathological effects. J Urol 2001; 166: 500–506. https://doi.org/10.1097/00005392-200108000-00021. https://doi.org/10.1016/S0022-5347(05)65971-X
22. Klotz LH, Goldenberg SL, Jewett MA, Fradet Y, Nam R, Barkin J, Chin J, Chatterjee S; Canadian Uro-Oncology Group. Long-term followup of a randomized trial of 0 versus 3 months of neoadjuvant androgen ablation before radical prostatectomy. J Urol 2003; 170: 791–794. https://doi.org/10.1097/01.ju.0000081404.98273.fd
23. Labrie F, Cusan L, Gomez JL, Diamond P, Suburu R, Lemay M, Tetu B, Fradet Y, Bélanger A, Candas B. Neoadjuvant hormonal therapy: the Canadian experience. Urology 1997; 49: 56–64. https://doi.org/10.1016/S0090-4295(97)00170-2
24. Kumar S, Shelley M, Harrison C, Coles B, Wilt TJ, Mason MD. Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. Cochrane Database Syst Rev 2006 Oct 18; (4): CD006019. Review https://doi.org/10.1002/14651858.CD006019.pub2
25. McKay RR, Choueiri TK, Taplin ME. Rationale for and review of neoadjuvant therapy prior to radical prostatectomy for patients with high-risk prostate cancer. Drugs 2013 Sep; 73(13): 1417–30. https://doi.org/10.1007/s40265-013-0107-2
26. Berglund RK, Tangen CM, Powell IJ, Lowe BA, Haas GP, Carroll PR, Canby-Hagino ED, deVere White R, Hemstreet GP 3rd, Crawford ED, Thompson IM Jr, Klein EA. Ten-year follow-up of neoadjuvant therapy with goserelin acetate and flutamide before radical prostatectomy for clinical T3 and T4 prostate cancer: update on Southwest Oncology Group Study 9109. Urology 2012; 79: 633–7.
27. Hsu CY, Joniau S, Roskams T, Oyen R, van Poppel H. Comparing reults after surgery in patients with clinical unilateral T3a, prostate cancer treated with or without neoadjuvant androgen deprivation therapy. BJU Int 2006; 99: 311–4.
28. Hsu CY, Joniau S, Oyen R, Roskams T, van Poppel H. Outcome of surgery for clinical clinical unilateral T3a: a single institution experience. Eur Urol 2007; 51: 121–9.
29. Srivatsa N, Nagaraja H, Shweta S, Raghunath SK. Radical Prostatectomy for Locally Advanced Prostate Cancers-Review of Literature. Indian J Surg Oncol 2017; 8(2): 175–180.
Leave a Reply
You must be logged in to post a comment.